Фиброз легких: как лечить, что такое фиброзные изменения в легких, продолжительность жизни
Закрыть- Болезни
- Инфекционные и паразитарные болезни
- Новообразования
- Болезни крови и кроветворных органов
- Болезни эндокринной системы
- Психические расстройства
- Болезни нервной системы
- Болезни глаза
- Болезни уха
- Болезни системы кровообращения
- Болезни органов дыхания
- Болезни органов пищеварения
- Болезни кожи
- Болезни костно-мышечной системы
- Болезни мочеполовой системы
- Беременность и роды
- Болезни плода и новорожденного
- Врожденные аномалии (пороки развития)
- Травмы и отравления
- Симптомы
- Системы кровообращения и дыхания
- Система пищеварения и брюшная полость
- Кожа и подкожная клетчатка
- Нервная и костно-мышечная системы
- Мочевая система
- Восприятие и поведение
- Речь и голос
- Общие симптомы и признаки
- Отклонения от нормы
- Диеты
- Снижение веса
- Лечебные
- Быстрые
- Для красоты и здоровья
- Разгрузочные дни
- От профессионалов
- Монодиеты
- Звездные
- На кашах
- Овощные
- Детокс-диеты
- Фруктовые
- Модные
- Для мужчин
- Набор веса
- Вегетарианство
- Национальные
- Лекарства
- Пищеварительный тракт и обмен веществ
- Кровь и система кроветворения
- Сердечно-сосудистая система
- Дерматологические препараты
- Mочеполовая система и половые гормоны
- Гормональные препараты
- Противомикробные препараты
- Противоопухолевые препараты и иммуномодуляторы
- Костно-мышечная система
- Нервная система
- Противопаразитарные препараты, инсектициды и репелленты
- Дыхательная система
- Органы чувств
- Прочие препараты
- Врачи
- Клиники
- Справочник
что это такое, продолжительность жизни
Фиброз легких представляет собой заболевание, при котором легочная ткань замещается на соединительную. При фиброзе легких вырабатывается большое количество коллагена. Соединительная ткань со временем разрастается и образует рубцовые изменения. Такой патологический процесс необратим, поэтому основное лечение направлено на полное выздоровление и улучшение качества жизни больного.
При фиброзе легких вырабатывается большое количество коллагена. Соединительная ткань со временем разрастается и образует рубцовые изменения. Такой патологический процесс необратим, поэтому основное лечение направлено на полное выздоровление и улучшение качества жизни больного.
Причины болезни
Фиброзные изменения в легких возникают на фоне:
- инфекционного заболеваниях;
- аллергической реакции;
- воздействия лучевой терапии;
- гранулематозного типа патологии;
- длительном вдыхании пыли.
Причины фиброза легких не зависят от возраста человека. Данное заболевание диагностируется как у взрослых, так и у детей. В группе особого риска находятся лица, работа которых предусматривает контакт с органической и неорганической пылью. Например, со стружкой, мукой, плесенью, цементом, асбестом и песком. В этом случае пыль выступает источником заболевания легких, которые способны привести к развитию фиброза.
Причинным фактором развития патологии может послужить прием некоторых лекарственных препаратов. В некоторых случаях линейный фиброз легких развивается на фоне пневмонии, туберкулеза, ревматоидного артрита, волчанки или васкулита.
В некоторых случаях линейный фиброз легких развивается на фоне пневмонии, туберкулеза, ревматоидного артрита, волчанки или васкулита.
Провоцирующие факторы развития фиброза могут быть вызваны как внутренними, так и внешними раздражителями. Процент заболевания напрямую зависит от экологии. Чем выше загрязненность воздуха и окружающей среды, тем выше вероятность развития фиброза легких.
Доказано, что вредные привычки, в том числе и курение, приводят к разрушению легочной ткани и нарушению нормального функционирования альвеол. В 80% случаев у злостных курильщиков фиброз легких диагностируется чаще, чем у не курящих.
Виды патологии
Фиброзные изменения в легких могут быть локальными (очаговыми) и диффузными.
Локальный фиброз легких представляет собой разрастание соединительное ткани в результате воспалительного или дистрофического процесса. В группе особого риска находятся пожилые лица, иммунологическая реактивность которых значительно ослаблена. В этом случае очаговый воспалительный процесс поражает лишь небольшой участок легких. Легочная ткань при этом уплотняется, и объем легкого уменьшается. Пораженный участок имбибирован угольным пигментом в результате нарушения лимфооттока.
Легочная ткань при этом уплотняется, и объем легкого уменьшается. Пораженный участок имбибирован угольным пигментом в результате нарушения лимфооттока.
Ограниченные фиброзные изменения не влияют на газообменные функции и механические способности легких. Поэтому клиническая картина может быть скрытой. В некоторых случаях пациенты могут и не подозревать о наличие заболевания.
Пневмосклероз легких развивается на фоне хронических обструктивных патологий, инфекционных и инвазивных заболеваний или наследственных легочных болезней.
Диффузный фиброз протекает тяжелее за счет того, что воспалительный процесс затрагивает большую часть легкого. Органы дыхания при этом уплотняются и уменьшаются. Газообменные функции и механические свойства легких нарушаются. В пораженном участке наблюдаются обширные поля коллагеновых волокон. В субплевральных отделах наблюдаются микроцисты, которые способны распространяться и поражать достаточно крупные участки. В некоторых случаях патологический процесс затрагивает и сосудистую сеть легких.
Фиброз легких может быть односторонним или двусторонним. Фиброз классифицируют на интерстициальный и прикорневой.
Идиопатическая форма
В клинической практике чаще всего диагностируются идиопатические фиброзные изменения. Данная форма преобладает у курящих мужчин в возрасте 50-60 лет. Идиопатический легочный фиброз может развиваться от нескольких месяцев до нескольких лет. В медицинской практике такую форму фиброза называют пневмонией.
Причинные факторы, провоцирующие развитие идиопатического фиброза, на сегодняшний день до конца не изучены. Однако доказано, что такая форма фиброза может развиваться на фоне генетических и экологических факторов.
Клиническая картина идиопатических изменений в легких выглядит следующим образом: у больного появляется одышка и кашель. Как правило, симптомы обостряются после физической нагрузки. Характерной особенностью идиопатического фиброза являются сухие мелкопузырчатые хрипы.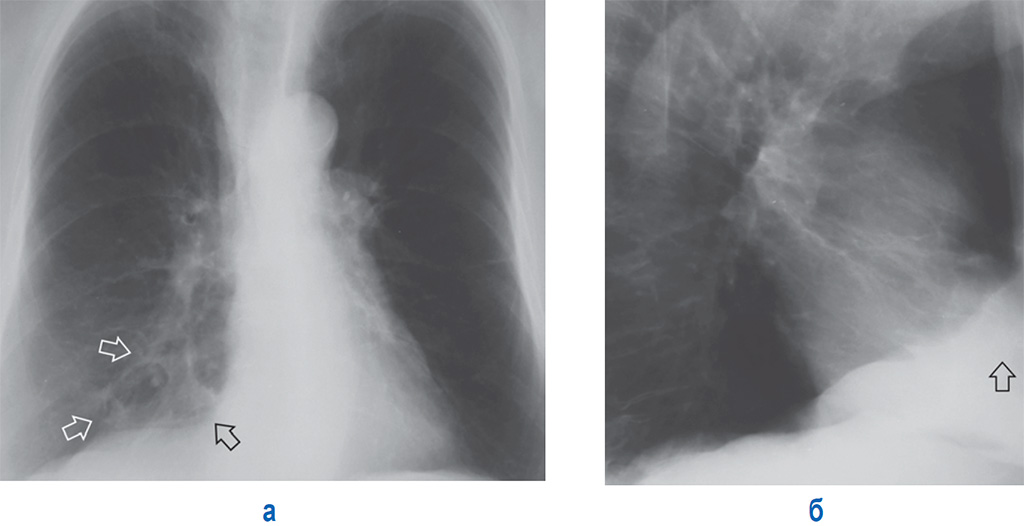 Температура тела находится в норме, однако, в некоторых случаях ее показатели могут достигать 38 °С.
Температура тела находится в норме, однако, в некоторых случаях ее показатели могут достигать 38 °С.
Оставлять без лечения фиброз легкого ни в коем случае нельзя. Это может привести к легочной недостаточности и к летальному исходу.
Характерные симптомы
Диагностировать фиброз легких на ранней стадии развития достаточно трудно, потому как симптомы заболевания остаются срытыми. Патологические изменения могут длительное время активно развиваться и при этом ни как себя не проявлять. Согласно статистике, выявить фиброз легкого на начальной стадии удается лишь у 2-х пациентов из 10-ти.
Признаки заболевания проявляются в виде сильной одышки и приступов кашля. Как правило, многие пациенты игнорируют первые проявления фиброза и не обращаются к врачу. Такое поведение может привести к развитию серьезных осложнений.
В связи с активным развитием патологических изменений у больного поднимается температура тела, и нарушается ритм дыхания. Дыхание становится частым и не глубоким. В некоторых случаях возможны проявления сердечной недостаточности и развитие бронхита.
В некоторых случаях возможны проявления сердечной недостаточности и развитие бронхита.
На поздних этапах развития патологии слизистая ротовой полости и пальцы приобретают синюшный оттенок.
Сухой кашель со временем становится мокрым. Больной может испытывать болевые ощущения в области груди. Фиброз легких сопровождается повышенной потливостью и наличием хрипов в легких.
При тяжелых формах течения недуга клиническая картина распространяется за пределы дыхательной системы. Изменения могут наблюдаться в утолщении пальцев и выпуклости ногтевой пластины. Кроме этого, у больного набухают вены на шее и появляется оттек в нижних конечностях.
Общее состояние пациента постепенно ухудшается. Трудоспособность уменьшается, появляется слабость и вялость. Если своевременно не оказать больному медицинскую помощь, то велика вероятность развития инфекционных патологий.
Что будет если не лечить фиброз легких? Это может привести к развитию эмфиземы легкого, нарушению кровообращения, сердечной недостаточности, легочной гипертонии и раку.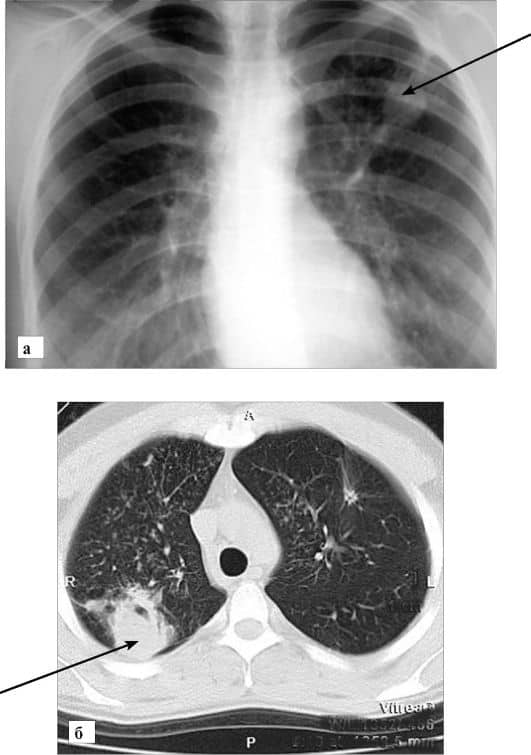
Диагностические мероприятия
Чтобы оценить состояние больного, учитываются не только его жалобы, но и проводится осмотр. Врач прослушивает и простукивает грудную клетку, проверяет дыхательную функцию и легочный объем.
Определение функции легких проводят при помощи специального теста. По силе выдоха определяется функция внешнего дыхания. С помощью оксигемометрии измеряется уровень содержания кислорода в крови.
Для получения полной клинической картины проводится инструментальная диагностика, которая включает рентгенографию, магнитно-резонансную, компьютерную томографию и биопсию.
На флюорограмме определяется диффузное или очаговое усиление легочного рисунка в периферической или нижней зоне легкого. В некоторых случаях на снимках можно обнаружить небольшие кистозные просветления. Компьютерная томография позволяет определить очаговые, сетевидные, субплевральные или периферийные затемненности легких. В случае развития осложнений проводят эхокардиограмму, которая позволяет выявить легочную гипертензию.
В случае необходимости проводится бронхоскопия при помощи специального эндоскопического оборудования. Данный способ диагностики позволяет тщательно изучить внутреннюю поверхность бронхов и определить масштаб пораженного участка.
В качестве диагностики проводится и биопсия легкого. Во время проведения процедуры врач берет небольшой кусочек легочной ткани и отправляет его на дальнейшее исследование. Биопсия проводится различными способами. Наиболее безопасным считается малоинвазивный хирургический метод, но в медицинской практике используется и бронхоскопия и бронхоальвеолярный лаваж.
Медикаментозное лечение
Фиброзные изменения в легких являются необратимыми, поэтому полного выздоровления не происходит. Медикаментозная терапия направлена на устранение симптомов и улучшения качества жизни пациента. Консервативное лечение считается эффективным лишь на начальных стадиях развития недуга.
Лечение фиброза на начальных этапах проводится комплексное, поэтому в сочетании с приемом лекарственных препаратов врачи назначают кислородную терапию, дыхательную гимнастику и диету.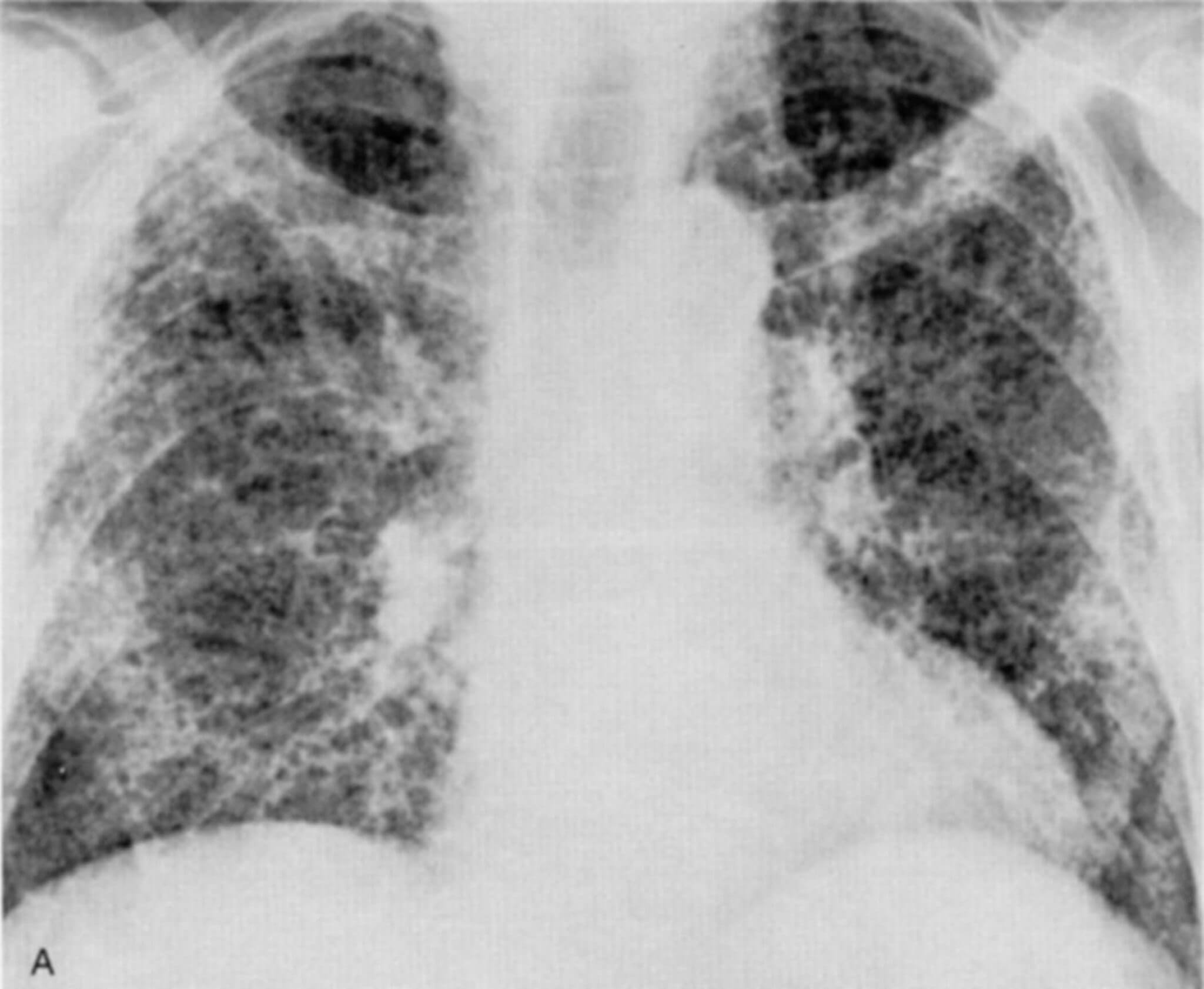 Только такой подход способен предотвратить развитие серьезных осложнений.
Только такой подход способен предотвратить развитие серьезных осложнений.
В зависимости от состояния больного и выраженности симптомов врачи могут проводить вакцину от пневмонии.
Медикаментозное лечение включает прием стероидных лекарственных препаратов. Эти средства за короткий промежуток времени избавляют больного от неприятных симптомов заболевания. Курс лечения назначает лечащий врач, поскольку стероидные препараты могут вызывать побочные эффекты. Если вероятность ожидаемого результата лечения не оправдывает возможные риски, то лечение стероидными препаратами не проводится.
Консервативное лечение подразумевает прием бронхолитиков, муколитиков и глюкокортикостероидов. К группе этих лекарственных препаратов входит Эуфиллин, Сальбутамол, Амброксол, Дексаметазон и Преднизолон. Если такое лечение не приносит желаемого результата, то врачи назначают Преднизолон в комбинации с Азатиоприном или Циклофосфамидом. Но такое лечение может вызвать побочные эффекты, например, остеопороз, расстройство нервной системы, артериальную гипертензию.
Для предотвращения развития сердечной недостаточности больному назначают сердечные гликозиды, а именно, Строфантин и Метотрексат.
Если фиброзные изменения в легких сопровождаются бронхитом или пневмонией, то медикаментозное лечение проводится с помощью антибактериальных и противомикробных препаратов, например, Стрептомицином, Изониазидом и Рифампицином. Противопаразитарное действие оказывает Метронидазол и Мебендазол.
Для укрепления иммунной системы и восстановления защитных сил организма врачи проводят курс лечения витаминами и назначают общеукрепляющие мероприятия.
Хирургическое вмешательство
В случае неэффективности консервативного лечения врачи прибегают к радикальному способу лечения – трансплантации органа. Данная хирургическая процедура также проводится на тяжелых стадиях болезни, когда легкие уже не способны самостоятельно осуществлять передачу кислорода и углекислого газа в клетки. Трансплантация может проводится для замены одного или обоих легких.
Операция по пересадке здорового органа противопоказана при наличии у больного гепатита, ВИЧ-инфекции, почечной недостаточности, заболеваний сердца и печени. Для оценки состояния больного перед операцией врачи проводят соответствующие анализы и исследования.
Операция по пересадке одного легкого занимает около 4-7 часов. Пациентам, после операции, назначают пожизненное лечение иммуносупрессорными препаратами. Эти лекарства помогают снизить риск отторжения донорского органа.
Лечебный массаж
С целью физиотерапии при фиброзе легких врачи рекомендуют проводить лечебный массаж грудной клетки, с помощью которого можно избавиться от приступов кашля и уменьшить проявление других симптомов недуга.
Массаж позволяет укрепить дыхательные мышцы, нормализовать приток крови и лимфы и улучшить дренажную функцию. На поздних этапах фиброза массаж противопоказан, так как он может спровоцировать активное развитие патологического процесса в легких. Массаж как вспомогательное мероприятие укрепляет мышечный каркас и восстанавливает физиологические свойства легких, что крайне важно в пожилом или детском возрасте.
Принцип проведения лечебного массажа включает такие виды движений, как растирание, поглаживание, разминание и постукивание. Сперва массируют грудную клетку, а затем массажные движения проводят на спине и шее.
Массирование выполняется руками или с помощью специальных приборов. Лечебный массаж бывает баночным, вибрационным, дренажным или медовым. Перед процедурой врачи рекомендуют теплое питье или муколитики. Это поможет отхождению мокроты. Длительность одной процедуры составляет не больше 20-30 минут.
Баночный массаж проводится с помощью специальных банок. Лечебное действие достигается за счет вакуума. В результате этого нормализуется приток крови. Перед проведением процедуры на тело наносится специальный крем, который способствует скольжению банок. После массажа следует избегать сквозняков.
Дренажный и вибрационный вид массажа предотвращает эмфизематозные изменения. При сопутствующих заболеваний сердца или гнойных процессов лечебная процедура не проводится. При выполнении процедуры массируется боковая поверхность грудной клетки.
При выполнении процедуры массируется боковая поверхность грудной клетки.
Медовый массаж оказывает разогревающий эффект и тем самым нормализует кровообращение в тканях. При наличии аллергической реакции на компоненты меда массаж противопоказан. После массажа могут оставаться небольшие синяки и кровоподтеки.
Кислородная терапия
При фиброзе легких назначают кислородную терапию. Она способствует увеличению эффективности медикаментозного лечения и улучшению самочувствия больного. Основная задача терапии заключается в увеличении концентрации кислорода во вдыхаемом воздухе и в крови. При своевременно назначенной кислородной терапии активность и трудоспособность больного значительно продлевается.
Данное лечение позволяет уменьшить одышку, количество обострений болезни и улучшить качество жизни. Кислородная терапия благоприятно воздействует на физическое и психоэмоциональное состояние.
При своевременном лечении продолжительность жизни больного увеличивается на 4-7 лет. В связи с развитием медицинской технологии проводить кислородную терапию можно в домашних условиях. Источником кислорода выступают портативные баллоны со сжатым газом или жидким кислородом. Однако, проводить самолечение без назначения врача может быть опасно для здоровья. Курс лечения назначает только терапевт и пульмонолог после проведения соответствующей диагностики.
В связи с развитием медицинской технологии проводить кислородную терапию можно в домашних условиях. Источником кислорода выступают портативные баллоны со сжатым газом или жидким кислородом. Однако, проводить самолечение без назначения врача может быть опасно для здоровья. Курс лечения назначает только терапевт и пульмонолог после проведения соответствующей диагностики.
Кислородная терапия эффективна при лечении фиброза легких у детей. При появлении неприятных ощущений или прочих осложнений передозировки кислородом необходимо незамедлительно обратиться к врачу.
Дыхательная гимнастика
При фиброзе легких в качестве вспомогательной терапии можно проводить лечебную физкультуру. Врачи рекомендуют регулярно заниматься спортом, например, бегать по утрам или кататься на велосипеде. Полезной считается спортивная ходьба на свежем воздухе. Не менее эффективной является дыхательная гимнастика, которая помогает улучшить работу дыхательного аппарата и обогатить кровь кислородом.
При фиброзе легких на дыхательные мышцы приходится двойная нагрузка, что приводит к их утомлению. В процессе дыхания активное участие принимает тонкая мышечная перегородка, которая разделяет брюшную и грудную полость. Основная задача дыхательной гимнастики состоит в лечении утомления и напряжения дыхательных мышц.
Комплекс дыхательных упражнений способствует отхождению мокроты. Дыхательная гимнастика включает упражнения на брюшное, грудное и полное дыхание. Для выполнения первого упражнения необходимо занять исходное положение – стоя. Сделайте медленный и глубокий вдох. На вдохе грудная клетка должна оставаться в покое, выпячиваться должен только живот. На выдохе втягивайте живот как можно глубже.
При грудном дыхании живот должен оставаться не подвижным. На вдохе должна подниматься грудная клетка, а на выдохе – опускаться. Дыхание должно быть плавным и глубоким.
Завершить дыхательную гимнастику следует упражнением на полное дыхание. В этом случае начинайте упражнение с брюшного вдоха.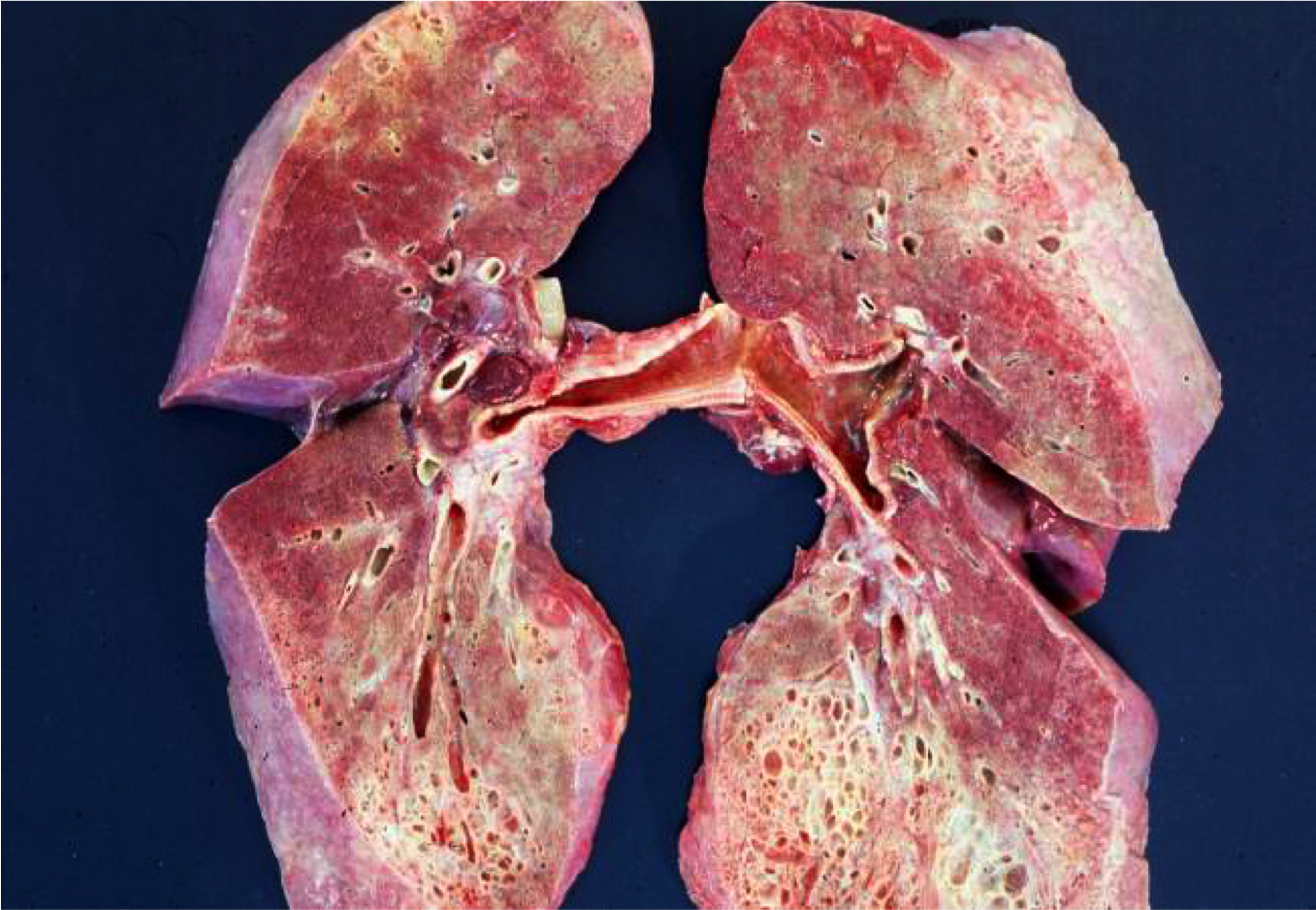 Когда максимально выпучится живот, продолжите вдох до отказа за счет грудного отдела. Переход должен быть плавным и без рывков. Вторая часть упражнения начинается с выдоха брюшного отдела и заканчивается сужением грудной клетки.
Когда максимально выпучится живот, продолжите вдох до отказа за счет грудного отдела. Переход должен быть плавным и без рывков. Вторая часть упражнения начинается с выдоха брюшного отдела и заканчивается сужением грудной клетки.
Повторять такой комплекс упражнений следует каждый день по 4-6 раз на каждое упражнение. При регулярном выполнение дыхательной гимнастики улучшается крово- и лимфоток, нормализуется легочная вентиляция и предотвращаются застойные явления в легких.
Нормализовать газообмен поможет выдох с сопротивлением. Для этого необходимо подготовить стакан с водой, трубочку или соломинку для коктейля. Сделайте глубокий вдох через нос, а затем плавно сделайте выдох через соломинку. Повторите такое упражнение 7-10 раз.
Вывести мокроту из легких поможет выжимание лежа. Для этого займите исходное положение и прижмите колени к груди. Обхватите ноги руками и сделайте глубокий выдох. На вдохе опустите ноги на пол. Закончить упражнение можно кашлем.
Рекомендованные правила питания
Сбалансированное и правильное питание помогает улучшить общее состояние лицам, страдающим от легочных заболеваний.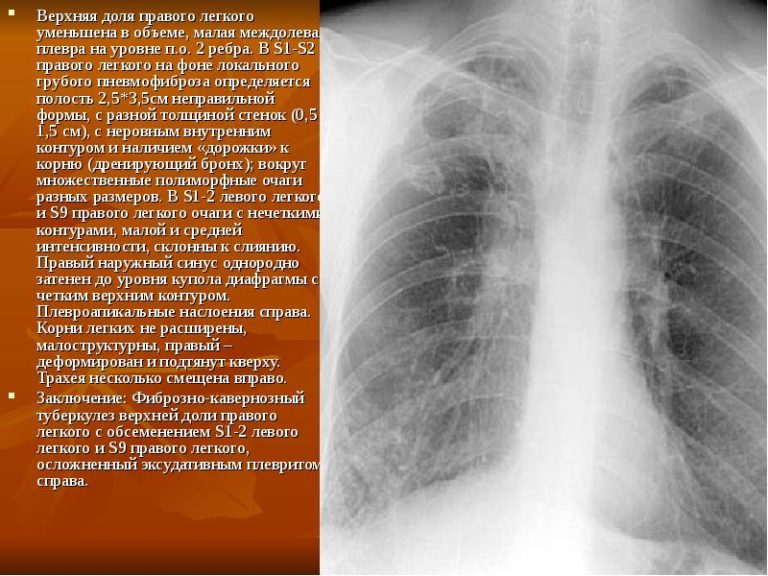 Неправильный рацион может ус
Неправильный рацион может ус
что это такое фиброзные изменения корней на флюорограмме, продолжительность жизни, как лечить, дыхательная гимнастика и лечение народными средствами
Фиброз легких — это не слишком распространенный диагноз, который часто выявляют совершенно случайно — при ежегодной и обязательной флюорографии. Но развитие такого недуга точно не получится оставить без внимания.
Что такое фиброзные изменения?
Если фиброз поражает легкие, эти основные органы дыхательной системы подвергаются фиброзным изменениям — в них формируется рубцовая ткань (ее также часто называют соединительной). Она может разрастаться и нарушать выполнение основных функций легких. В результате наличия фиброзных изменений легочная ткань не может полноценно растягиваться, становится неэластичной. Патологические процессы затрудняют проникновение углекислого газа, а также кислорода через стенки альвеол.
Патологические процессы затрудняют проникновение углекислого газа, а также кислорода через стенки альвеол.
Фиброз легких становится причиной гипоксии — кислородной недостаточности. Это состояние считается достаточно тяжелым и на сегодняшний день не поддается излечению на все 100%.
Является ли это раком?
Фиброз легких считается серьезнейшей патологией, но не имеет ничего общего с раковыми опухолями. Такой недуг не сопровождается возникновением новообразования, а вызывает замещение здоровых тканей соединительными, что, в свою очередь, является результатом чрезмерной выработки коллагена. При прогрессировании недуга в легком формируется грубый рубец — фиброзный тяж.
При фиброзе легких соединительные ткани распространяются лишь до определенных пределов, они не способны давать отсевов и провоцировать проблемы (очаги) в прочих органах. Таким образом, данное заболевание никак не может считаться раком и рассматриваться с ним на одном уровне.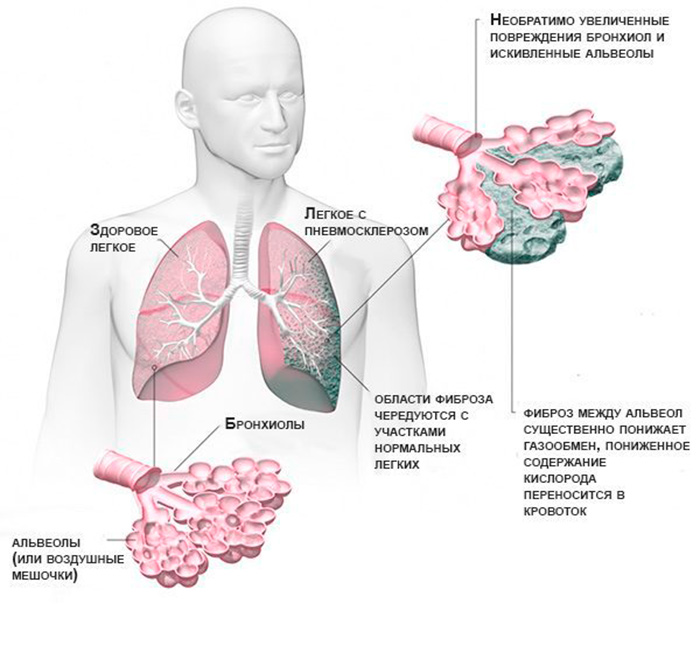
Причины
Чаще всего возникновение фиброза легких связано с длительным течением инфекционных либо простудных болезней и рассматривается, как осложнение таких недугов. Так, патологическое разрастание соединительных тканей может быть следствием:
- Инфицирования палочкой Коха (туберкулеза легких).
- Различных ОРВИ (и гриппа в том числе).
- Воспаления легких (пневмонии).
Воспалительные процессы чаще всего приводят к формированию так называемого линейного фиброза.
Иногда провоцирующими факторами возникновения фиброзных изменений становятся внешние обстоятельства и прочие заболевания. Среди возможных причин можно выделить:
- Некоторые аутоиммунные недуги, связанные с патологиями соединительных тканей, в частности, ревматоидный артрит либо волчанку.
- Негативное влияние различных факторов на дыхательную систему. Чаще всего виновниками становятся профессиональные вредности, к примеру, органическая либо неорганическая пыль.

- Продолжительный прием некоторых медикаментов, в частности, химиотерапевтических, а также антиаритмических.
- Влияние облучения (лучевой терапии). Такой фиброз также получил отдельное наименование — постлучевой.
- Аллергические заболевания, которые протекают в течение длительного времени и не лечатся либо не поддаются направленной коррекции.
В ряде случаев врачи так и не могут определить причин развития фиброза легких. При этом речь идет об идиопатических фиброзных изменениях.
Виды заболевания
Существует несколько вариантов классификации фиброза легких. В частности, болезнь может быть:
- Односторонней. Как понятно из названия, в таком случае речь идет о поражении лишь одного легкого.
- Двухсторонней. В такой ситуации, фиброзные изменения обнаруживаются в обоих легких.
Кроме того, достаточно популярной считается классификация заболевания в зависимости от степени тяжести.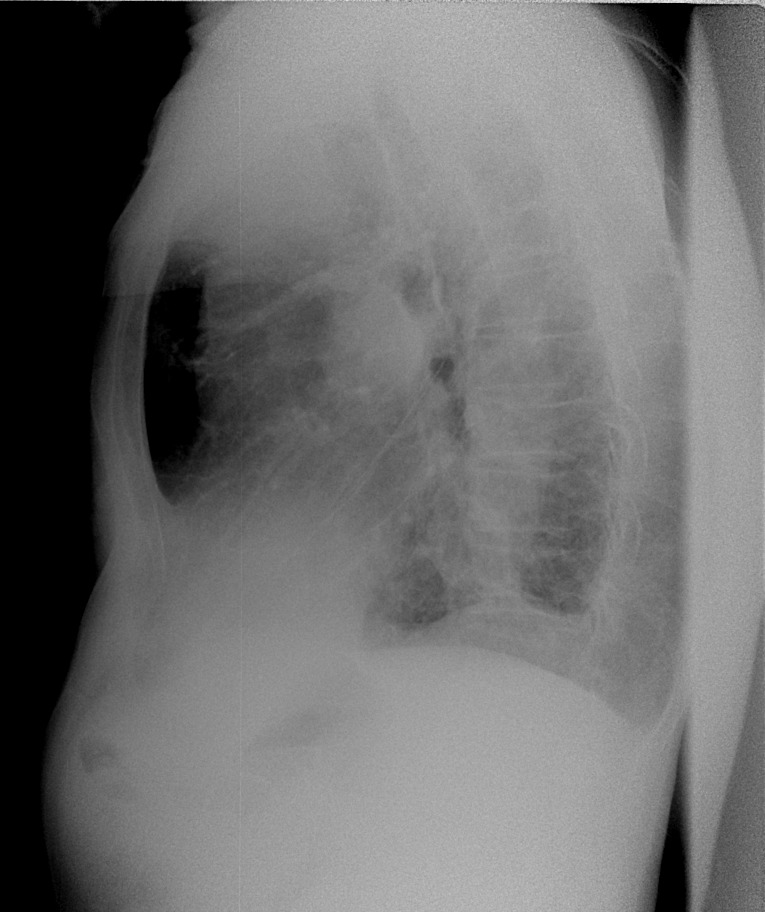 Медики выделяют:
Медики выделяют:
- Пневмофиброз. При такой патологии у пациента обнаруживаются лишь ограниченные участки изменений в легких, которые проявляются несущественным разрастанием тяжистых соединительных тканей.
- Пневмосклероз. В результате развития такого поражения участки легких замещаются грубыми соединительными тканями, что приводит к формированию фиброза бронхов и легких.
- Цирроз легких. При подобном варианте болезни полностью все легкое замещается соединительной тканью. Это наиболее тяжелая разновидность недуга.
Важная часть классификации заболевания — деление на виды в зависимости от локализации фиброзных изменений. Возможно развитие:
- Интерстициального фиброза. В этом случае у больного соединительная ткань приводит к утолщению межальвеолярных перегородок легких.
- Перилобулярного фиброза. При этом соединительные ткани образуются против дольных перемычек.
- Периваскулярного фиброза. Такой недуг тесно связан с воспаленными сосудами — соединительная ткань формируется именно вокруг них.

- Альвеолярного фиброза. В результате таких изменений утолщается альвеолярная мембрана.
- Перибронхиального фиброза. При таком недуге соединительная ткань образовывается на тканях около бронхов.
Локальная форма (очаговый)
Локальный фиброз легкого — это довольно коварное заболевание, при котором фиброзные изменения захватывают лишь ограниченную часть легкого. Подобное развитие событий может никак не отражаться на самочувствии больного в течение достаточно длительного времени — нескольких месяцев, а то и лет. Однако болезнь склонна к прогрессированию, очаги могут разрастаться, объединяться между собой и формировать целые комплексы соединительных тканей. В этом случае недуг проявляется достаточно яркой симптоматикой. Но при своевременной диагностике патологические процессы иногда удается приостановить.
Очаговый фиброз опасен тем, что в результате долгого игнорирования болезни есть риск развития цирроза — полного замещения органа соединительными тканями. В этом случае легкое, конечно же, не сможет работать, обеспечивая циркуляцию кислорода.
В этом случае легкое, конечно же, не сможет работать, обеспечивая циркуляцию кислорода.
Диффузные изменения
Диффузная форма фиброза также довольно коварна. При такой болезни все легкое (одно или оба) равномерно затрагивает патологический фиброзный процесс. Стоит учитывать, что прогрессирование недуга может быть очень стремительным, поэтому крайне важно действовать быстро.
Симптомы
Как мы уже говорили выше, поначалу фиброзные изменения в легких могут совершенно не нарушать самочувствия пациента. Но в дальнейшем недуг может привести к довольно явному нарушению самочувствия, проявляясь:
- Одышкой. Когда болезнь находится на ранней стадии развития, одышка случается лишь в ответ на физическую активность. Но прогрессирование болезни заставляет человека испытывать трудности с полноценным дыханием даже в покое.
- Кашлем. Чаще всего он является сухим, однако может сопровождаться возникновением несущественного количества мокроты.
- Бледностью и синюшностью кожи.
 Такие симптомы объясняются нарастающей гипоксией (дефицитом кислорода, от которого страдают все органы, системы и ткани).
Такие симптомы объясняются нарастающей гипоксией (дефицитом кислорода, от которого страдают все органы, системы и ткани).
Если фиброз прогрессирует, он приводит к появлению нарастающих нарушений самочувствия. Признаки болезни в этом случае распространяются за пределы бронхолегочной системы. Больного беспокоит:
- Заметное изменение формы пальцев. Они становятся утолщенными, а ногтевая пластина — выпуклой.
- Нарастающая сердечная недостаточность в сочетании с так называемым легочным сердцем. Подобное недомогание дает о себе знать постоянной одышкой, активным сердцебиением, отечностью на нижних конечностях, пульсацией шейных вен, а также загрудинными болями.
- Чрезмерная усталость, выраженная слабость и утомляемость. Человек с фиброзом легких становится совершенно не способен к тяжелым физическим нагрузкам.
Нарушение полноценной структуры легких увеличивает риск развития всевозможных инфекционных недугов. Болезни при такой патологии могут протекать более ярко и длительно.
Диагностика
При появлении нарушений в работе бронхолегочной системы необходимо для начала обратиться за помощью к терапевту. После осмотра и сбора анамнеза такой специалист, скорее всего, отправит пациента к пульмонологу. Дальнейшая диагностика будет включать в себя:
- Банальное прослушивание.
- Исследование объема легких, а также анализ дыхательной функции в целом.
- Рентгенографию грудины (на рентген-снимке можно рассмотреть наличие настораживающих изменений в легких).
- Компьютерную томографию (КТ) либо магнитно-резонансную томографию (МРТ). Это более современные методы диагностики, благодаря которым можно точно увидеть изменения в легких, определить их характер и локализацию.
- Биопсию легкого. Такое исследование позволяет визуально под микроскопом увидеть патологически измененные рубцовые ткани и убедиться в отсутствии раковых изменений. Кусочек органа для биопсии забирают при помощи малотравматичного исследования — бронхоскопии, при этом в дыхательные пути помещают специальные небольшие инструменты.

Обычно поставить точный диагноз пациентам с фиброзом легких удается после выполнения обзорного рентгенологического исследования. КТ или МРТ на сегодняшний день применяют не всегда, ввиду их малодоступности и дороговизны.
Изменения на флюорограмме
Флюорография считается разновидностью рентгенологического исследования, которое выполняется для массового обследования и обнаружения предположительных патологий легких на ранних стадиях развития. Данный метод является далеким от совершенства, тем не менее ежегодно он позволяет спасти множество жизней.
В частности, фиброз легких часто диагностируют именно при помощи флюорографии (ведь болезнь поначалу протекает практически бессимптомно).
Врач при исследовании снимка может обратить внимание на плеврофиброзное изменение, которое имеет вид затемнения. Далеко не всегда такой симптом указывает на развитие болезни, но в любом случае является поводом для дальнейшего проведения диагностических манипуляций.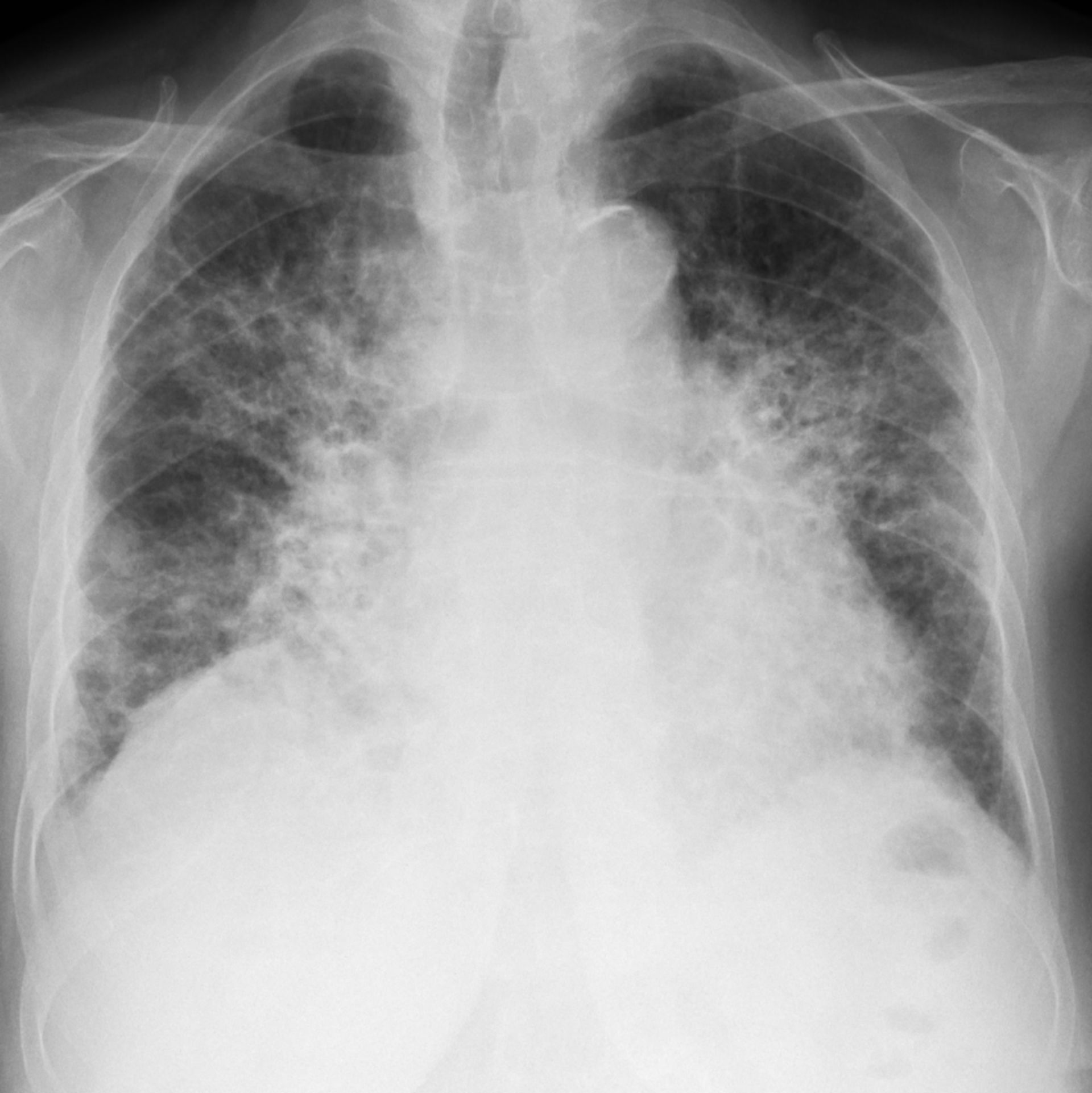
Как лечить?
Те соединительные ткани, которые уже сформировались в легком, не могут трансформироваться обратно. Современные методы терапии мало способны остановить появление новых фиброзных тяжей в легких. Прогрессирование болезни приводит к развитию дыхательной недостаточности, что становится серьезной угрозой для жизни.
Лечение фиброза легких на сегодняшний день может включать в себя:
- Консервативную терапию.
- Реабилитационные нелекарственные методики (в частности, дыхательную гимнастику).
- Оперативные методы воздействия — трансплантацию легких.
Всем пациентам необходимо отказаться от физических нагрузок, регулярно наблюдаться у пульмонолога и не заниматься самолечением. Само собой, крайне важную роль играет отказ от вредных привычек, особенно, от курения.
Терапия направлена в первую очередь на облегчение качества жизни пациента и профилактику дальнейшего прогрессирования нарушений в работе бронхолегочной системы.
Консервативная терапия
В основном все лекарства, используемые для терапии фиброза легких, можно разделить на три группы:
- Гормоны-кортикостероиды. Одним из наиболее известных медикаментов такой группы можно назвать Преднизолон. При хорошей переносимости такого препарата пациентом, он может использоваться до 3 месяцев подряд (курсово). Однако стоит учитывать, что медикаменты этой группы очень часто вызывают побочные эффекты, например, остеопороз, гипертонию, миопатии и пр.
- Цитостатики, подавляющие активность иммунитета (эффективны при аутоиммунных процессах и подавляют формирование соединительных тканей). Такие медикаменты используют при неэффективности кортикостероидов. Большинство из них имеют массу побочных эффектов, в частности, подавляют защитные силы организма и процессы кроветворения, могут нарушить работу ЖКТ и стать причиной облысения.
- Антифиброзные средства. Одним из наиболее известных препаратов такого типа является Колхицин, способный подавлять синтез фибронектина.
 Также неплохого результата можно добиться при помощи лекарства Верошпирон, предупреждающего формирование фиброзных тканей во всех уголках организма.
Также неплохого результата можно добиться при помощи лекарства Верошпирон, предупреждающего формирование фиброзных тканей во всех уголках организма.
Консервативная терапия фиброза легких может включать также применение прочих медикаментов. К примеру, для купирования одышки часто используют бронхорасширяющие средства, а при присоединении инфекции — антибиотики. При развитии проблем с сердцем не обойтись без медикаментов, влияющих на его функции (например, сердечных гликозидов).
Стоит отметить, что лекарственная терапия иногда кажется совершенно неэффективной. Но медикаменты все-таки замедляют прогрессирование патологии и помогают поддержать нормальную работу дыхательной системы.
Дыхательная гимнастика
Врачи подчеркивают, что нелекарственная коррекция фиброза легких играет очень важную роль для поддержания нормальной жизнедеятельности. Выполнение дыхательной гимнастики позволяет наладить максимально нормальный газообмен и поддерживать его в дальнейшем (по возможности), что облегчает жизнь больного и помогает избежать осложнений от гипоксии. Пациентам рекомендуется развивать три вида дыхания:
Пациентам рекомендуется развивать три вида дыхания:
- Брюшное. В этом случае больной должен выполнять дыхательные действия диафрагмой — дышать животом.
- Грудинное. Тут дыхательные движения совершаются исключительно грудной клеткой, живот остается неподвижным.
- Полное. Тут вдох осуществляется мышцами живота, а выдох — грудной клеткой.
Для тренировки легочного объема врачи советуют надувать воздушные шарики с использованием коктейльной трубочки. Если такое занятие дается слишком сложно, можно просто выдувать воздух в стакан с водой через трубку.
Чтобы облегчить одышку и прочие неприятные ощущения, вызванные болезнью, нужно:
- Вдохнуть как можно глубже и замереть в таком положении на 5 сек. После половину воздуха нужно выдохнуть резко с максимальным усилием, а остаток — выдохнуть плавно.
- Свободно дышать во время облегченных физических нагрузок (например, во время прогулки).
- Плавно дышать во время кислородотерапии либо во время проведения специальных дыхательных массажей.

Есть отдельная группа упражнений, которые увеличивают работоспособность легких. Их стоит выполнять ежедневно в соответствии с рекомендациями врача:
- Лягте. Вдыхая, подтяните коленки к грудной клетке. Выдыхая, вернитесь к исходному положению.
- Дышите диафрагмой. Лягте и вдохните, раздувая живот, после выдохните, сжимая его.
- Станьте ровно. На вдохе разводите руки в разные стороны, а на выдохе — складывайте их на груди так, чтобы ладони пытались достать до лопаток.
- Сложите руки в замок. Вдыхая, заведите их замахом за голову, а выдыхая — опустите вниз между ног, наклоняясь при этом.
- Стоя выполняйте вдохи и выдохи с разведением рук в диагональной плоскости (вверх и в стороны). При выдохе складывайте руки на груди, стараясь коснуться спины.
- Станьте, расположите ноги на ширине плеч. При вдохе вытягивайте руки вперед и несколько приподнимайтесь на носки, а при выдохе — наклоняйтесь, как лыжник.
Опытные врачи рекомендуют обучаться дыхательной гимнастике у инструктора по физиотерапии.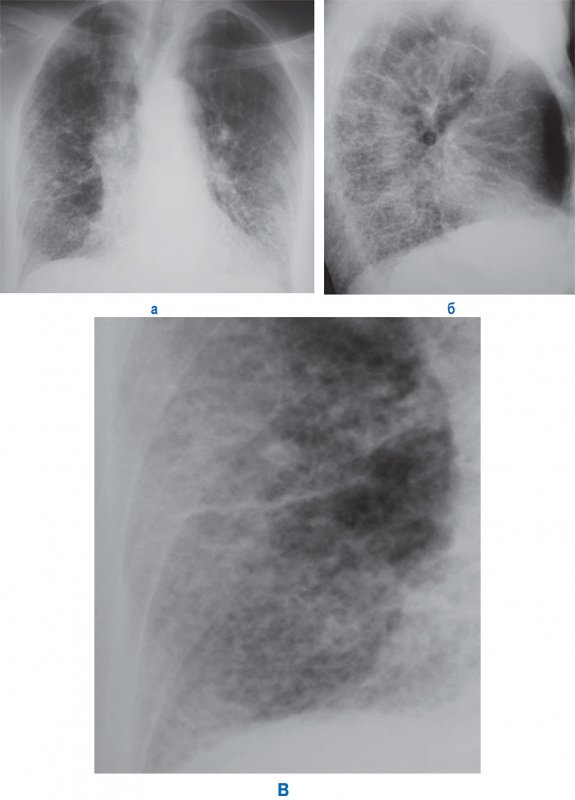 Специалист подскажет оптимальный перечень упражнений и поможет подобрать индивидуальную программу для успешного восстановления.
Специалист подскажет оптимальный перечень упражнений и поможет подобрать индивидуальную программу для успешного восстановления.
Лечение народными средствами
Методики народной медицины при фиброзе легких неспособны дать стойкого терапевтического эффекта. Между тем подобные методы воздействия несколько снижают негативную симптоматику болезни и укрепляют иммунитет, что делает жизнь больного более удовлетворительной. Пациентам с фиброзом может пойти на пользу использование:
- Розмарина. Измельчите веточки такого растения, заварите кипятком в пропорции 1:1 и оставьте в термосе на 2 часа. Процедите готовое лекарство, а сырье отожмите. Подсластите медом и принимайте по 1 ст. л. 2 р. на день.
- Сбора трав. Соедините равные доли горицвета весеннего, полевого хвоща, фенхеля и тмина. 1 ст. л. такого сбора заварите 1 ст. кипятка, поставьте на огонь и доведите до кипения. После снимите лекарство с плиты, остудите в течение 30 мин. и процедите. Пейте по 0,5 ст.
 дважды на день.
дважды на день. - Семян аниса. 1 ст. л. такого сырья залейте 1 ст. холодной кипяченой воды. Отправьте смесь на огонь, доведите до кипения, после чего сразу уберите с плиты. Оставьте под крышкой до остывания, после процедите. Пейте по 0,5 ст. раз в сутки.
- Семян льна. 1 ст. л. льняных семян заварите 1 ст. кипятка и оставьте на 20 мин. под крышкой. После процедите и выпейте за 1 прием вечером. Принимайте 1 раз в сутки.
- Фиалки и орегано. Соедините по 1 ч. л. таких растений, заварите 0,5 л кипящей воды. Настаивайте под крышкой в течение 1 часа, после процедите и выпейте за три приема (утром, в обед и вечером).
Целесообразность применения средств народной медицины при фиброзе легких необходимо обязательно согласовывать с лечащим врачом. Рецепты альтернативного лечения могут не слишком хорошо сочетаться с применяемыми медикаментами, а также вызывать нежелательные побочные эффекты (в том числе аллергию).
Операция
Иногда пациентам с фиброзом легких врачи рекомендуют удалить функционально неполноценный ограниченный очаг в легких. Но такие вмешательства не слишком популярны. В основном об операции говорят в случаях тотального фиброза, который несет угрозу для жизни больного. Если консервативное лечение не позволяет достичь положительного результата, врачи задумываются о возможности трансплантации легких. Пересадку выполняют при наличии ряда соответствующих показаний:
Но такие вмешательства не слишком популярны. В основном об операции говорят в случаях тотального фиброза, который несет угрозу для жизни больного. Если консервативное лечение не позволяет достичь положительного результата, врачи задумываются о возможности трансплантации легких. Пересадку выполняют при наличии ряда соответствующих показаний:
- При развитии сильной гипоксии (кислородного голодания).
- При существенном уменьшении жизненной емкости легких.
- При снижении диффузной способности пораженных органов в два раза.
- При развитии тяжелой формы дыхательной недостаточности.
Иногда трансплантация становится единственной возможностью продлить жизнь пациентам с диффузным фиброзом, у которых продолжительность жизни по прогнозам будет не более двух лет.
Но к сожалению, у нас в стране трансплантационные возможности пока не слишком развиты и малодоступны.
Прогноз при легочной патологии
Фиброз легких отличается довольно неблагоприятным прогнозом для пациента, так как является совершенно необратимым и склонным к неуклонному прогрессу.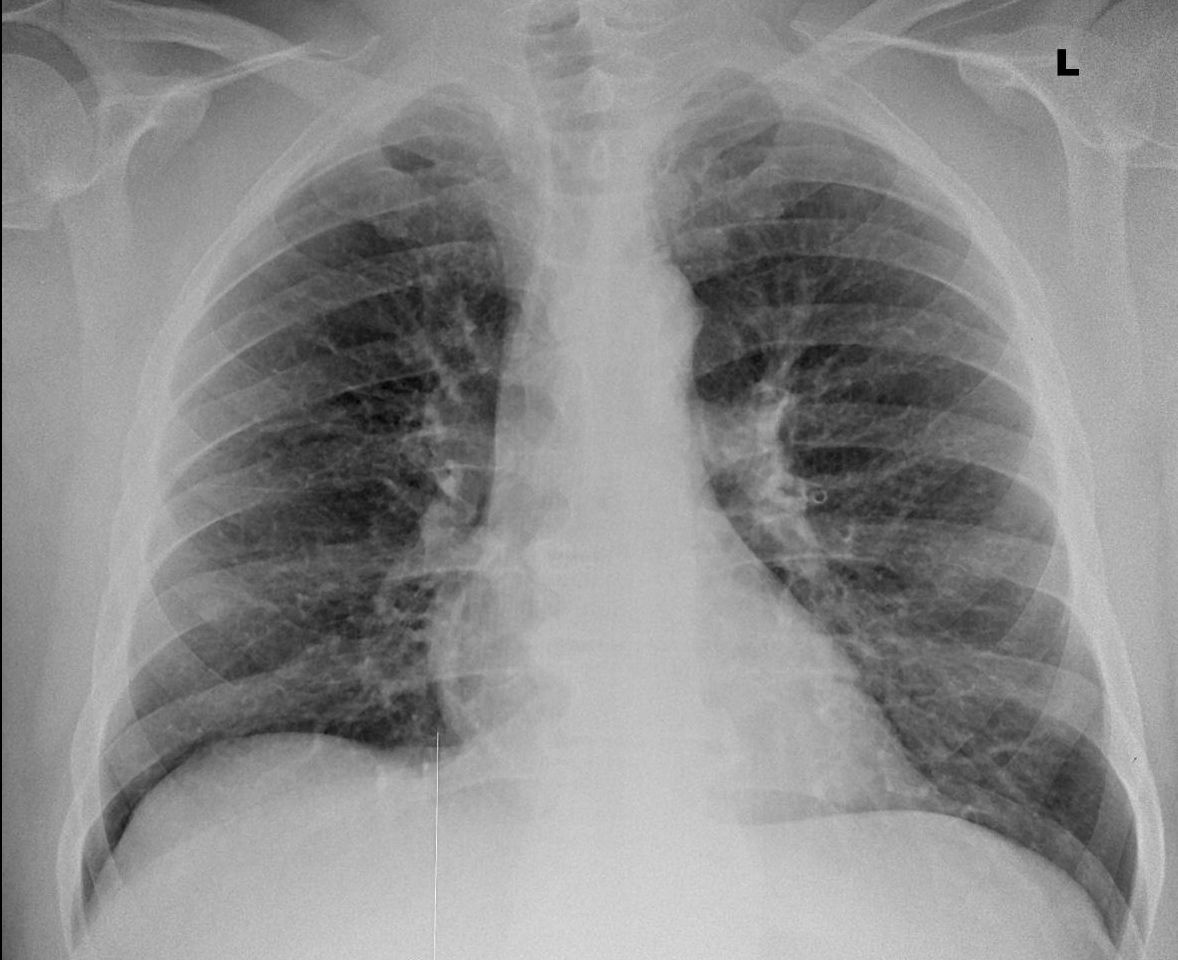 Даже незначительные изменения в легких нарушают дыхательную функцию. И чем больше соединительной ткани в легких, тем больше риск развития необратимых патологических изменений, способных ухудшать качество жизни и сокращать ее продолжительность.
Даже незначительные изменения в легких нарушают дыхательную функцию. И чем больше соединительной ткани в легких, тем больше риск развития необратимых патологических изменений, способных ухудшать качество жизни и сокращать ее продолжительность.
Наиболее негативный прогноз типичен для пациентов с острой формой заболевания, так как при ее развитии фиброзные изменения постоянно усугубляются. В то же время больные хроническим фиброзом с медленным течением имеют куда больше шансов на более-менее стабильную жизнь.
Осложнения и последствия
Наиболее распространенными негативными последствиями фиброза считаются следующие состояния:
- Хроническая дыхательная недостаточность (дефицит кислорода в организме). Отмечено, что наступление такого осложнения быстрее наступает, если обнаружены фиброзные тяжи корней легких.
- Легочная гипертензия.
- Хроническое легочное сердце.
- Осложнение вторичной инфекцией (присоединение воспалительного процесса в легких).

Именно осложнения фиброза приводят к летальному исходу. Но направленное комплексное лечение снижает риск их возникновения.
Сколько живут?
Средняя продолжительность жизни у пациентов с фиброзом превышает отметку в десять лет. Примерно 35% больным с таким диагнозом удается прожить более 20 лет. Однако такие данные актуальны лишь для пациентов с хронической формой заболевания. Острый и быстропрогрессирующий фиброз может унести жизнь человека всего за 2—3 года.
Вконтакте
Google+
Муковисцидоз: причины, диагностика и лечение
Что такое кистозный фиброз?
Муковисцидоз – серьезное генетическое заболевание, вызывающее серьезные повреждения дыхательной и пищеварительной систем. Это повреждение часто возникает в результате скопления в органах густой липкой слизи. Наиболее часто поражаются следующие органы:
- легкие
- поджелудочная железа
- печень
- кишечник
Муковисцидоз поражает клетки, вырабатывающие пот, слизь и пищеварительные ферменты. Обычно эти секретируемые жидкости жидкие и гладкие, как оливковое масло. Они смазывают различные органы и ткани, предотвращая их пересыхание или заражение. Однако у людей с муковисцидозом из-за дефектного гена жидкости становятся густыми и липкими. Вместо того, чтобы действовать как смазка, жидкости закупоривают каналы, трубки и проходы в теле. Это может привести к опасным для жизни проблемам, включая инфекции, дыхательную недостаточность и недоедание. Крайне важно сразу же начать лечение муковисцидоза.Ранняя диагностика и лечение имеют решающее значение для улучшения качества жизни и увеличения ожидаемой продолжительности жизни.
Обычно эти секретируемые жидкости жидкие и гладкие, как оливковое масло. Они смазывают различные органы и ткани, предотвращая их пересыхание или заражение. Однако у людей с муковисцидозом из-за дефектного гена жидкости становятся густыми и липкими. Вместо того, чтобы действовать как смазка, жидкости закупоривают каналы, трубки и проходы в теле. Это может привести к опасным для жизни проблемам, включая инфекции, дыхательную недостаточность и недоедание. Крайне важно сразу же начать лечение муковисцидоза.Ранняя диагностика и лечение имеют решающее значение для улучшения качества жизни и увеличения ожидаемой продолжительности жизни.
Приблизительно 1000 человек ежегодно заболевают кистозным фиброзом в Соединенных Штатах. Хотя люди с этим заболеванием нуждаются в ежедневном уходе, они по-прежнему могут вести относительно нормальный образ жизни, работать или посещать школу. В последние годы улучшились скрининговые тесты и методы лечения, поэтому многие люди с муковисцидозом теперь могут дожить до 40-50 лет.
Симптомы муковисцидоза могут различаться в зависимости от человека и степени тяжести состояния.Возраст, в котором развиваются симптомы, также может различаться. Симптомы могут появиться в младенчестве, но у других детей симптомы могут появиться только после полового созревания или даже в более позднем возрасте. Со временем симптомы, связанные с заболеванием, могут улучшаться или ухудшаться.
Один из первых признаков муковисцидоза – сильный соленый привкус на коже. Родители детей с муковисцидозом упоминали, что целовали своих детей, когда они ощущали эту соленость.
Другие симптомы муковисцидоза возникают в результате осложнений, которые влияют на:
- легкие
- поджелудочную железу
- печень
- другие железистые органы
Респираторные проблемы
Густая липкая слизь, связанная с муковисцидозом, часто блокирует проходы, по которым воздух попадает в легкие и выходит из них.Это может вызвать следующие симптомы:
- свистящее дыхание
- постоянный кашель с образованием густой слизи или мокроты
- одышка, особенно при физических нагрузках
- рецидивирующие легочные инфекции
- заложенный нос
- заложенность носовых пазух
Проблемы с пищеварением
Аномальная слизь может также закупорить каналы, по которым ферменты, вырабатываемые поджелудочной железой, попадают в тонкий кишечник. Без этих пищеварительных ферментов кишечник не может усваивать необходимые питательные вещества из пищи.Это может привести к:
Без этих пищеварительных ферментов кишечник не может усваивать необходимые питательные вещества из пищи.Это может привести к:
- жирному стулу с неприятным запахом
- запорам
- тошноте
- вздутию живота
- потере аппетита
- плохой прибавке в весе у детей
- задержке роста у детей
- кишечник
- поджелудочную железу
- печень
- легкие
Она также увеличивает количество соли в поте.
На ген CFTR может влиять множество различных дефектов. Тип дефекта связан с тяжестью муковисцидоза.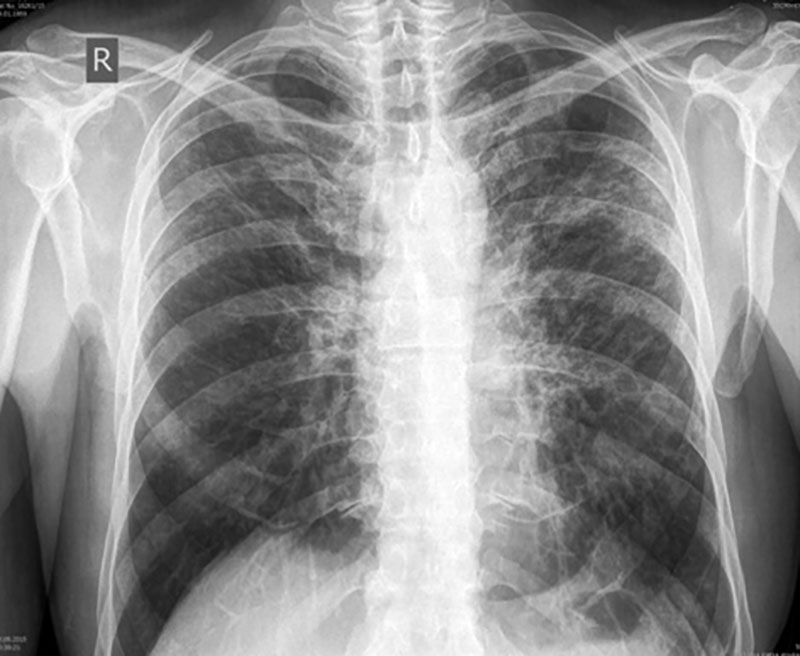 Поврежденный ген передается ребенку от родителей. Чтобы иметь муковисцидоз, ребенок должен унаследовать по одной копии гена от каждого родителя. Если они унаследуют только одну копию гена, у них не разовьется болезнь. Однако они будут носителями дефектного гена, а это значит, что они могут передать ген своим детям.
Поврежденный ген передается ребенку от родителей. Чтобы иметь муковисцидоз, ребенок должен унаследовать по одной копии гена от каждого родителя. Если они унаследуют только одну копию гена, у них не разовьется болезнь. Однако они будут носителями дефектного гена, а это значит, что они могут передать ген своим детям.
Муковисцидоз наиболее распространен среди кавказцев североевропейского происхождения. Однако известно, что он встречается у всех этнических групп.
Люди, у которых в семейном анамнезе был муковисцидоз, также находятся в группе повышенного риска, поскольку это наследственное заболевание.
В Соединенных Штатах все новорожденные проходят скрининг на муковисцидоз. Врачи используют генетический тест или анализ крови, чтобы проверить признаки заболевания. Генетический тест определяет, есть ли у вашего ребенка дефектный ген CFTR. Анализ крови определяет, правильно ли работают поджелудочная железа и печень ребенка. Другие диагностические тесты, которые могут быть выполнены, включают:
Тест на иммунореактивный трипсиноген (IRT)
Тест на иммунореактивный трипсиноген (IRT) – это стандартный скрининговый тест новорожденных, который проверяет аномальные уровни белка IRT в крови.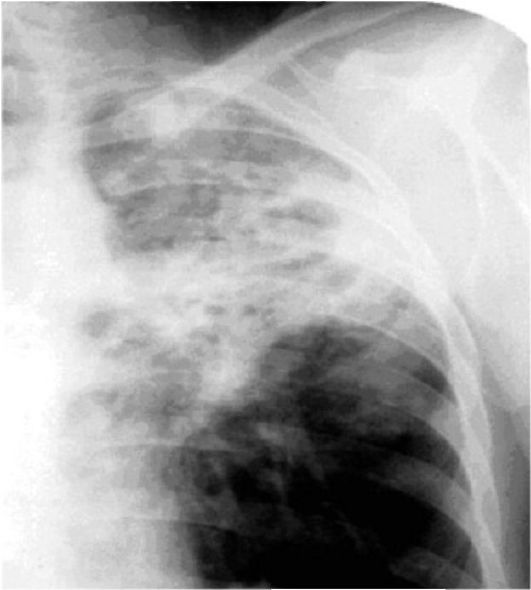 Высокий уровень IRT может быть признаком муковисцидоза. Однако для подтверждения диагноза требуется дальнейшее обследование.
Высокий уровень IRT может быть признаком муковисцидоза. Однако для подтверждения диагноза требуется дальнейшее обследование.
Тест хлорида пота
Тест хлорида пота является наиболее часто используемым тестом для диагностики муковисцидоза. Он проверяет повышенный уровень соли в поте. Тест проводится с использованием химического вещества, которое вызывает потливость кожи при срабатывании слабого электрического тока. Пот собирают на блокноте или бумаге и затем анализируют. Диагноз муковисцидоза ставится, если пот более соленый, чем обычно.
Анализ мокроты
Во время анализа мокроты врач берет образец слизи. Образец может подтвердить наличие инфекции легких. Он также может показать типы присутствующих микробов и определить, какие антибиотики лучше всего подходят для их лечения.
Рентген грудной клетки
Рентген грудной клетки полезен для выявления отека в легких из-за закупорки дыхательных путей.
КТ-сканирование
КТ-сканирование создает подробные изображения тела с помощью комбинации рентгеновских лучей, полученных с разных направлений.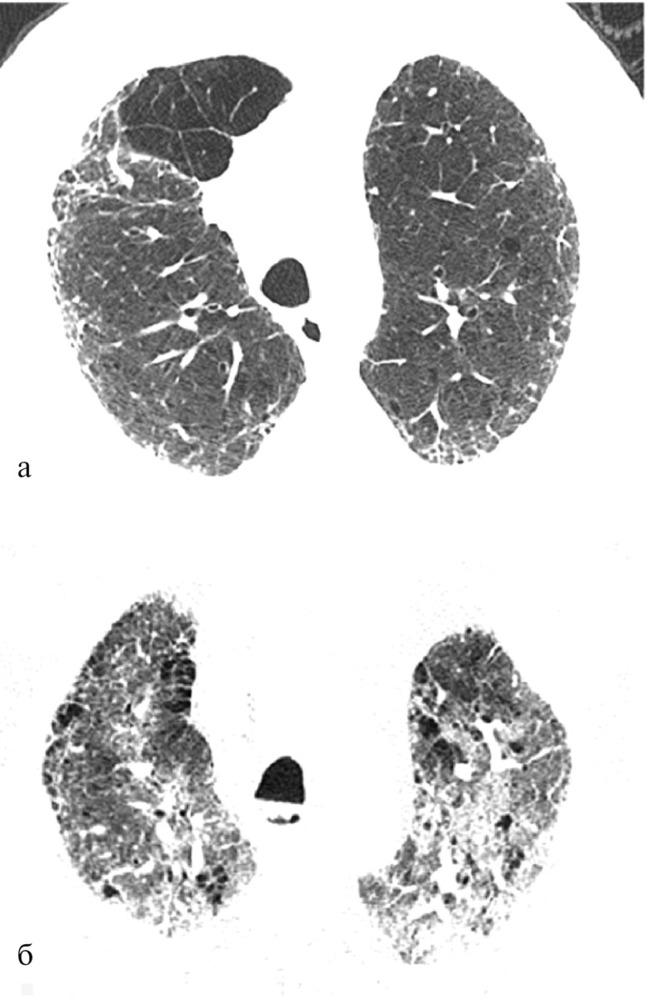 Эти изображения позволяют врачу просматривать внутренние структуры, такие как печень и поджелудочная железа, что упрощает оценку степени повреждения органов, вызванного муковисцидозом.
Эти изображения позволяют врачу просматривать внутренние структуры, такие как печень и поджелудочная железа, что упрощает оценку степени повреждения органов, вызванного муковисцидозом.
Тесты функции легких (PFT)
Тесты функции легких (PFT) определяют, правильно ли работают ваши легкие. Тесты могут помочь определить, сколько воздуха можно вдохнуть или выдохнуть и насколько хорошо легкие транспортируют кислород к остальному телу. Любые отклонения в этих функциях могут указывать на муковисцидоз.
Хотя муковисцидоз неизлечим, существуют различные методы лечения, которые могут помочь облегчить симптомы и снизить риск осложнений.
Лекарства
- Антибиотики могут быть назначены для избавления от инфекции легких и предотвращения повторной инфекции в будущем. Обычно их принимают в виде жидкости, таблеток или капсул. В более тяжелых случаях инъекции или инфузии антибиотиков можно вводить внутривенно или через вену.
- Разжижающие слизь лекарства делают слизь более жидкой и менее липкой.
 Они также помогают откашливать слизь, чтобы она покинула легкие. Это значительно улучшает функцию легких.
Они также помогают откашливать слизь, чтобы она покинула легкие. Это значительно улучшает функцию легких. - Нестероидные противовоспалительные препараты (НПВП), такие как ибупрофен и индометацин, могут помочь уменьшить любую боль и жар, связанные с кистозным фиброзом.
- Бронходилататоры расслабляют мышцы вокруг трубок, по которым воздух поступает в легкие, что помогает увеличить поток воздуха. Вы можете принимать это лекарство через ингалятор или небулайзер.
- Операция на кишечнике – это экстренная операция, при которой удаляется часть кишечника. Это может быть выполнено для облегчения кишечной непроходимости.
- Муковисцидоз может нарушать пищеварение и препятствовать усвоению питательных веществ из пищи. Зонд для кормления для подачи питания может быть введен через нос или хирургическим путем введен непосредственно в желудок.
- Трансплантация легкого включает удаление поврежденного легкого и замену его здоровым, как правило, от умершего донора.
 Операция может потребоваться, если у человека с муковисцидозом серьезные проблемы с дыханием. В некоторых случаях может потребоваться замена обоих легких. Это потенциально может привести к серьезным осложнениям после операции, включая пневмонию.
Операция может потребоваться, если у человека с муковисцидозом серьезные проблемы с дыханием. В некоторых случаях может потребоваться замена обоих легких. Это потенциально может привести к серьезным осложнениям после операции, включая пневмонию.
Хирургические процедуры
Физиотерапия грудной клетки
Грудная терапия помогает разжижить густую слизь в легких, облегчая ее откашливание. Обычно это выполняется от одного до четырех раз в день. Распространенная техника заключается в том, чтобы положить голову на край кровати и хлопать сложенными ладонями по бокам груди.Для очистки от слизи можно также использовать механические устройства. К ним относятся:
- хлопушка, которая имитирует хлопки сложенными ладонями по бокам груди
- надувной жилет, который вибрирует с высокой частотой, чтобы помочь удалить слизь из грудной клетки
Уход на дому
Кистоз фиброз может помешать кишечнику всасывать необходимые питательные вещества из пищи. Если у вас муковисцидоз, вам может потребоваться на 50 процентов больше калорий в день, чем людям, которые не страдают этим заболеванием.Вам также может потребоваться принимать капсулы ферментов поджелудочной железы с каждым приемом пищи. Ваш врач может также порекомендовать антациды, поливитамины и диету с высоким содержанием клетчатки и соли.
Если у вас муковисцидоз, вам следует сделать следующее:
- Пейте много жидкости, потому что они помогают разжижать слизь в легких.
- Регулярно делайте физические упражнения, чтобы разжижить слизь в дыхательных путях. Прогулка, езда на велосипеде и плавание – отличные варианты.
- По возможности избегайте дыма, пыльцы и плесени.Эти раздражители могут усугубить симптомы.
- Регулярно делайте прививки от гриппа и пневмонии.
Перспективы людей с муковисцидозом в последние годы значительно улучшились, в основном благодаря достижениям в лечении. Сегодня многие люди с этим заболеванием доживают до 40-50 лет, а в некоторых случаях даже дольше. Однако от муковисцидоза нет лекарства, поэтому функция легких со временем неуклонно ухудшается. В результате повреждения легких могут возникнуть серьезные проблемы с дыханием и другие осложнения.
Муковисцидоз невозможно предотвратить. Однако генетическое тестирование следует проводить парам, страдающим муковисцидозом или имеющим родственников с этим заболеванием. Генетическое тестирование может определить риск муковисцидоза у ребенка путем анализа образцов крови или слюны от каждого родителя. Тесты также могут быть выполнены вам, если вы беременны и беспокоитесь о риске для своего ребенка.
Препарат от диабета, потенциально способный лечить идиопатический фиброз легких, предполагает исследование фибробластов легких человека на мышиной модели фиброза легких – ScienceDaily
Исследователи из Университета Алабамы в Бирмингеме впервые показали, что легкое фиброз можно обратить вспять с помощью медикаментозного лечения, направленного на клеточный метаболизм.
Это новое открытие, опубликованное в журнале Nature Medicine , важно, потому что, несмотря на значительные достижения в выявлении патологических механизмов стойкого фиброза, эффективных лечебных вмешательств нет.
Легочный фиброз может развиться после травм легких, таких как инфекции, лучевая терапия или химиотерапия, или он может иметь неизвестную причину, например, идиопатический легочный фиброз или IPF. IPF – это прогрессирующее и, в конечном итоге, смертельное заболевание легких, которое поражает более 150 000 пациентов в год в США и более 5 миллионов пациентов во всем мире.
В экспериментах с использованием тканей легких пациентов с IPF, фибробластов легкого мыши и мышиной модели фиброза легких группа ученых под руководством доктора философии Ярослава Змиевского и доктора медицины Виктора Танникала показала обратное развитие фиброза легких и лежащих в его основе клеточных механизмов. пострадавшие от медикаментозного лечения.
Змиевски и Танникал – доцент и профессор кафедры медицины UAB соответственно. Змиевски является директором по исследованиям переводческой программы ARDS.Танникал возглавляет кафедру медицины респираторных заболеваний имени Бен Вона Бранскомба и является директором отделения легочной медицины, аллергии и реанимации UAB.
Интересно, что лекарство, которое ускорило разрешение фиброза легких, – это метформин, который является безопасным и широко используемым средством при инсулиннезависимом диабете.
Исследование было сфокусировано на AMP-активированной протеинкиназе (AMPK), ферменте, который определяет энергетическое состояние клетки и регулирует метаболизм. Zmijewski, Thannickal и его коллеги обнаружили, что активность AMPK была ниже в клетках миофибробластов в фиброзных областях легочной ткани человека от пациентов с IPF.Миофибробласты откладывают внеклеточные коллагеновые волокна как часть процесса фиброза. Эти миофибробласты были метаболически активными и устойчивыми к запрограммированной гибели клеток, называемой апоптозом, естественным процессом, который ежедневно удаляет более 50 миллиардов поврежденных или старых клеток у взрослых.
Активация AMPK в миофибробластах легких людей с IPF с использованием препарата метформин или другого активатора, называемого AICAR, привела к снижению фиброзной активности. Активация AMPK также усилила производство новых митохондрий, органелл в клетках, которые производят энергию, в миофибробластах, и нормализовала чувствительность клеток к апоптозу.
Используя мышиную модель фиброза легких, вызванного противораковым препаратом блеомицином, исследовательская группа обнаружила, что лечение метформином, начинающееся через три недели после повреждения легкого и продолжающееся в течение пяти недель, ускоряет исчезновение хорошо известного фиброза. Такое разрешение не было очевидным у мышей с AMPK-нокаутом, что показывает, что эффект метформина был AMPK-зависимым.
«В совокупности наши исследования подтверждают концепцию, что AMPK может функционировать как важный метаболический переключатель, способствующий разрешению сформировавшегося фиброза за счет смещения баланса с анаболического на катаболический метаболизм», – пишут исследователи.«Кроме того, мы обеспечиваем доказательство концепции, что активация AMPK метформином или другими фармакологическими агентами, которые активируют эти пути разрешения, может быть полезной терапевтической стратегией для прогрессирующих фиброзных расстройств».
История Источник:
Материалы предоставлены Университетом Алабамы в Бирмингеме . Примечание. Содержимое можно редактировать по стилю и длине.
Новые биотехнологии могут сократить время и стоимость разработки лекарств от смертельных заболеваний легких – ScienceDaily
Разработка новых лекарств для лечения фиброза легких, одной из наиболее распространенных и серьезных форм заболевания легких, непростая.
Одна причина: сложно имитировать то, как болезнь повреждает и рубит легочную ткань с течением времени, что часто вынуждает ученых использовать мешанину трудоемких и дорогостоящих методов для оценки эффективности потенциальных методов лечения.
Теперь новая биотехнология, о которой сообщается в журнале Nature Communications , может упростить процесс тестирования на наркотики.
Нововведение основано на той же технологии, которая используется для печати электронных чипов – фотолитографии. Только вместо полупроводниковых материалов исследователи поместили в матрицу микросхем тонкие, гибкие, выращенные в лаборатории легкие ткани – другими словами, технологию «легкое на чипе».
«Очевидно, что это не целое легкое, но технология может имитировать повреждающие эффекты фиброза легких. В конечном итоге это может изменить то, как мы тестируем новые лекарства, делая процесс более быстрым и менее дорогостоящим», – говорит ведущий автор Руоган Чжао, доктор философии, ассистент профессор кафедры биомедицинской инженерии Университета Буффало.
Кафедра является многопрофильным подразделением, образованным Школой инженерных и прикладных наук UB и Школой медицины и биомедицинских наук Джейкобса при UB.
Имея ограниченные инструменты для изучения фиброза, ученые изо всех сил пытались разработать лекарство для лечения этого заболевания. На сегодняшний день есть только два препарата – пирфенидон и нинтеданиб – одобренные Управлением по контролю за продуктами и лекарствами США, которые помогают замедлить его прогресс.
Однако оба препарата лечат только один тип фиброза легких: идиопатический фиброз легких. По данным Американской ассоциации легких, существует более 200 типов фиброза легких, и фиброз также может поражать другие жизненно важные органы, такие как сердце, печень и почки.
Кроме того, существующие инструменты не моделируют прогрессирование фиброза легких с течением времени – недостаток, который сделал разработку медицины сложной и относительно дорогой. Исследовательская группа Чжао, в которую входили бывшие и нынешние студенты, а также университет
Сотрудникв Торонто создал технологию «легкое на кристалле», чтобы помочь в решении этих проблем.
С помощью микролитографии исследователи напечатали крошечные гибкие столбики из органического полимера на основе кремния.Затем они поместили ткань, которая действует как альвеолы (крошечные воздушные мешочки в легких, которые позволяют нам потреблять кислород), поверх столбов.
Исследователи индуцировали фиброз путем введения белка, который вызывает заболевание здоровых клеток легких, что приводит к сокращению и укреплению сконструированной легочной ткани. Это имитирует рубцевание альвеолярной ткани легких у людей, страдающих этим заболеванием.
Сокращение ткани приводит к изгибу гибких столбов, что позволяет исследователям рассчитать силу сжатия ткани на основе простых механических принципов.
Исследователи проверили эффективность системы с пирфенидоном и нинтеданибом. Хотя каждый препарат действует по-разному, система показала положительные результаты для обоих, предполагая, что технология «легкое на чипе» может быть использована для тестирования множества потенциальных методов лечения фиброза легких.
Исследование было поддержано Национальными институтами здравоохранения; Школа инженерии и прикладных наук UB; Школа медицины и биомедицинских наук Джейкобса в UB; и Институт клинических и трансляционных наук при УБ.
История Источник:
Материалы предоставлены Университетом в Буффало . Оригинал написан Кори Нилоном. Примечание. Содержимое можно редактировать по стилю и длине.
Лунгенфиброза – Википедия
| Классификация нач МКБ-10 | |
|---|---|
| J62 | Pneumokoniose durch Quarzstaub |
| J63 | Pneumokoniose durch sonstige anorganische Stäube |
| J68.4 | Chronische Krankheiten der Atmungsorgane durch chemische Substanzen, Gase, Rauch und Dämpfe Lungenfibrose (chronisch) |
| J70.1 | Chronische und sonstige Lungenbeteiligung bei Strahleneinwirkung |
| J84.1 | Sonstige interstitielle Lungenkrankheiten mit Fibrose |
| Интернет-версия МКБ-10 (версия ВОЗ 2019 г.) | |
Lungenfibrose (синоним früher teils mit «Lungencirrhose» и «Lungensklerose» [1] ) ist eine Veränderung des Lungengewebes, bei der verstärkt Bindegewebe zwischen dendengeren Diesel und vernarbt ( fibrosiert ).Durch die verringerte Dehnbarkeit verringert sich das Lungenvolumen und die Atmung wird behindert.
Es gibt zahlreiche Krankheitsbilder, die zu einer Lungenfibrose führen können. Sie gehören zur Gruppe der interstitiellen Lungenerkrankungen. Pneumokoniosen (Staublungen) wie die Silikose (Quarzstaublunge) sind dabei vertreten. Ist die Ursache unbekannt, bezeichnet man die Form als idiopathische interstitielle Pneumonien, deren häufigster Vertreter die idiopathische pulmonale Fibrose (IPF, idiopathische Lungenfibrose) ist.Die idiopathische Lungenfibrose ist im Verlauf wesentlich aggressiver, d. час die Lebenserwartung ist geringer als bei exogen-аллерgischer Lungenfibrose.
Die exogen-Allergische Lungenfibrose wird durch Allergene verursacht. Die Entzündung der Lungenbläschen ist ein fortschreitender Prozess, der zum Tode führen kann. Bei der Lungenfibrose versteift die Lunge, ihre Compliance sinkt, und es wird mehr kraft benötigt, um die Lungenflügel ausreichend zu belüften, damit ein Gasaustausch stattfinden kann.Dieser ist bei einer Gewebevernarbung ohnehin gestört und der Sauerstoffanteil im Blut nimmt ab (Hypoxämie).
- Fibrose mit bekannter Ursache (Medikamente, Kollagenosen). So stehen Bleomycin, Busulfan und Amiodaron im Verdacht, als Nebenwirkung eine Lungenfibrose zu verursachen. Weitere bekannte Ursachen (etwa 50% der Fälle) [2] :
- Гранулематозный диффузный паренхиматоз Lungenerkrankung
- Lungenentzündungen: Idiopathische interstitielle Pneumonie (oder инфекция Vorerkrankungen der Lunge [2] )
- Ингаляционное или ингаляционное Ноксен [2]
- Systemerkrankungen wie z.B. Sarkoidose, Rheumatoide Arthritis, Kollagenosen [2]
- Kreislaufbedingte Lungenschäden, u. а. Chronische Stauungslunge bei Linksherzinsuffizienz [2]
- andere Formen (z. B. Histiozytosis)
Auslöser kann das Einatmen bestimmter Fasern wie Asbest, von Staubteilchen wie Quarzfeinstaub и т. Д. Или eine exogen-Allergische Reaktion auf bestimmestus. Auch Strahlentherapie von Lungenkrebs kann zur Lungenfibrose führen.
Beschwerden sind häufig Luftnot, geringe körperliche Belastbarkeit, stetiger Husten, Anstieg der Atemfrequenz sowie Kraftlosigkeit.
Eine Behandlung erfolgt manchmal mit kortisolhaltigen Präparaten und der Verabreichung von Sauerstoff (beispielsweise als Langzeittherapie) в качестве unzureichender Atemfunktion. Auch besteht die Möglichkeit, mit Immunsuppressiva zu therapieren – in geringerer Dosis als in der Chemotherapie. Dazu gehören z. Б. Циклофосфамид и азатиоприн.
Nintedanib wirkt positiv auf die Lungenfunktion von Patienten mit Systemischer Sklerose. Über 52 Wochen verzögerte die Einnahme zweimal täglich den Abbau der Lungenfunktion gegenüber Vergleichspatienten deutlich. [3]
Es ist auch eine Behandlung mit Pirfenidon zu erwägen. [4] [5] [6] Die zuvor verwendete Substanz Acetylcystein wird seltener eingesetzt. [7] In schweren Fällen wird eine Lungentransplantation erwogen.Nach der Lungentransplantation wegen einer ILD beträgt die mittlere Überlebenszeit etwa fünf Jahre. [8]
- Юрген Бер: Lungenfibrose. Aktuelle Aspekte in Diagnostik und Therapie. Uni-Med Verlag, 2003.
- Джозеф П. Линч III: Идиопатический фиброз легких. CRC Press, 2003.
- ↑ Иоахим Фрей: Krankheiten der Atmungsorgane. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Берлин / Геттинген / Гейдельберг 1955; 2. Auflage ebenda 1961, S. 599–746, hier: S. 690–693 ( Lungencirrhose bzw. -fibrose ) и 699–708 ( Lungenfibrosen (-sklerosen) ).
- ↑ a b c d e Gerd Herold und Mitarbeiter: Innere Medizin . Hrsg .: Доктор мед. Герд Герольд. 2016. Auflage. Докчек, Кельн, ISBN 978-3-9814660-5-8, S. 396.
- ↑ Оливер Дистлер, Сюзанна Стоуассер и др.: Нинтеданиб при системном склерозе-ассоциированном интерстициальном заболевании легких. Медицинский журнал Новой Англии. DOI: 10.1056 / NEJMoa1
- 6
- ↑ Андреас Гюнтер; Даниэль фон дер Бек; Филипп Маркарт: IPF – eine seltene Erkrankung mit schlechter Prognose. В: Андреас Гюнтер; Даниэль фон дер Бек; Филипп Маркарт: Zertifizierte Fortbildung Idiopathische Lungenfibrose, CME, Diagnostik und Therapie. Интернет-обучение (PDF-Datei) Springer Verlag
- ↑ EMA принимает заявки на получение разрешения на продажу нинтеданиба в составе IPF. Pressemitteilung Boehringer Ingelheim vom 5. июня 2014 г.
- ↑ Geschäftsbericht Roche, 2014 г.
- ↑ Martinez FJ: Рандомизированное испытание ацетилцистеина при идиопатическом фиброзе легких. In: N Engl J Med. 2014 29 мая; 370 (22): 2093–2101. DOI: 10.1056 / NEJMoa1401739.
- ↑ Brown AW, Трансплантация легких в IIP, Обзор, в Respirology (2016) 21, 1173–1184
Как диагностируется фиброз легких?
Обратитесь к терапевту, если у вас есть симптомы, которые могут быть связаны с фиброзом легких.
Если у вас IPF, врачи, прислушиваясь к вашей груди, часто могут слышать в ваших легких потрескивание, похожее на открывающуюся липучку.
Ваш врач осмотрит вас в поисках других причин одышки. Они выслушают хрипы в легких и сделают рентген грудной клетки, если услышат их.
Если есть подозрения, что у вас фиброз легких, ваш врач направит вас к специалисту по грудной клетке в вашей местной больнице. Вас могут снова направить для дальнейшего обследования или специализированного лечения к специалисту по международным заболеваниям, если его нет в вашей местной больнице.
Врач больницы задаст вопросы о вашем медицинском, семейном и профессиональном анамнезе, а также о ваших симптомах. Они осмотрят вас, послушают вашу грудь и оценят необходимость анализов.
Вам могут понадобиться такие тесты, как:
При некоторых типах фиброза легких результаты компьютерной томографии могут быть очень четкими и позволяют поставить диагноз.
На КТ-сканировании IPF часто проявляется в виде характерного рисунка на легких. Вы могли слышать, как ваш врач называет это легкое сота . На изображении видно много пустых карманов или пузырьков, появляющихся там, где обычно появляется более прочная легочная ткань.
Заглянуть в легкие
Чтобы получить дополнительную информацию, которая поможет поставить конкретный диагноз, вашему врачу может потребоваться заглянуть внутрь ваших легких и, возможно, удалить некоторые клетки или ткани для анализа.Для получения легочной ткани можно использовать разные процедуры:
- гибкая бронхоскопия включает введение узкой трубки через нос или рот в легкие. Вам будут распылять местный анестетик в нос и горло и часто вводить успокаивающее средство в вену для вашего комфорта. На конце трубки есть камера, чтобы врач мог видеть ваши легкие.
Врач может промыть трубку водой, чтобы удалить и собрать клетки для анализа.Ваш врач может также взять образцы ткани. Такие биопсии безболезненны. Обычно это амбулаторная или дневная процедура. - видео – вспомогательная торакоскопия (VATS) включает в себя операцию под общим наркозом с целью получения большего фрагмента легочной ткани. Хирург делает замочную скважину в вашей груди, чтобы в нее мог войти хирургический телескоп с видеоусилителем и взять образцы ткани из ваших легких.
Он имеет более высокий риск, чем бронхоскопия. Это делается только в том случае, если вашему специалисту требуется больше тканей для постановки диагноза и плана лечения.Ваш врач обсудит с вами риски. Для этого теста вы останетесь в больнице на несколько дней.
Диагностика фиброза легких – это совместная работа вашей группы специалистов. В него войдут врачи-специалисты по заболеваниям легких
Frontiers | Адаптация протеостаза и аутофагии для контроля патогенеза кистозного фиброза легких
Введение
Муковисцидоз (МВ) – одно из наиболее распространенных аутосомно-рецессивных заболеваний со смертельным исходом (Zhang et al., 2018), с новыми вариантами лечения, которые увеличивают выживаемость, но ограничивают успех в снижении общей смертности. В частности, субъекты с гомозиготной мутацией F508-del (фенилаланин-508), которые страдают наиболее серьезной формой недуга, не имеют эффективных вариантов лечения, которые могут гарантировать излечение или нормальное выживание. Вкратце, хроническое заболевание дыхательных путей является основным фактором заболеваемости и смертности у пациентов с МВ (Cantin et al., 2015; Mall, 2016), а доступность нескольких новых и более эффективных терапевтических возможностей позволила существенно улучшить выживаемость.Большинство этих терапевтических стратегий нацелены на борьбу с симптоматическим CF-заболеванием легких, в то время как некоторые из более новых стратегий разработаны для воздействия на первичную или «первопричину» заболевания, которой являются мутации в регуляторе трансмембранной проводимости муковисцидоза ( Cftr ) (Esposito et al., 2016; Hudock, Clancy, 2017; Maiuri et al., 2017; Zhang et al., 2018). Известно около 1700 мутаций, влияющих на генерацию (Класс I), структуру (Класс II) или функцию канала (Класс III – V) белка CFTR, и около 88% из них состоят из мутаций, вызывающих дефекты неправильной упаковки белка (Класс II) (С.F. Foundation, 2018). Люди с этими мутациями на обеих копиях гена Cftr демонстрируют классические проявления заболевания легких при МВ, такие как густая и липкая слизь, гиперсекреция муцина, повышенный воспалительно-окислительный стресс и / или стойкие бактериальные инфекции, которые в совокупности приводят к тяжелая обструкция дыхательных путей (Bodas and Vij, 2010; Bodas et al., 2018a). Данные, полученные на новых моделях МВ на животных, и некоторые клинические данные указывают на то, что симптомы заболевания легких присутствуют в очень раннем возрасте или даже при рождении, что позволяет предположить концепцию врожденного происхождения заболевания легких при МВ (Stoltz et al., 2015). С возрастом стойкие обострения, в первую очередь вызываемые Pseudomonas aeruginosa ( Pa ), и последующее стойкое нейтрофильное воспаление, опосредованное IL-8, являются отличительным признаком клинического заболевания легких при МВ и основным фактором необратимого поражения легких, а также связанного с МВ со смертельным исходом (Bodas, Vij, 2010; Ferrari et al., 2017; Bodas et al., 2018a).
В общем, все клеточные процессы, которые работают для поддержания устойчивого белкового репертуара в клетке, в совокупности называются сетью протеостаза (PN) (Klaips et al., 2018). Эта сложная молекулярная система жестко регулирует судьбу белка внутри клетки, начиная с его синтеза, сворачивания и поддержания свернутого функционального состояния до транспорта (транспортировки) и возможной деградации. Огромное количество клеточной энергии используется для поддержания механизма деградации белков, чтобы избавиться от неправильно свернутых, поврежденных, нефункциональных или даже функциональных белков, которые больше не требуются клеткам. Основные механизмы деградации белка или клеточного клиренса включают убиквитин-протеасомную систему (UPS) и «путь аутофагии-лизосомы» (Korovila et al., 2017). Основное различие между механизмами протеасомы и аутофагии – это тип груза, который они могут обрабатывать в качестве исходного материала. Протеасома может обрабатывать только белки, в то время как крупные белковые агрегаты, липиды и даже поврежденные органеллы могут обрабатываться и разрушаться путем аутофагии. Недавние данные свидетельствуют о тесной взаимосвязи между протеасомными путями и путями аутофагии (Bustamante et al., 2018), и поэтому неудивительно, что любое нарушение любого из этих механизмов может лежать в основе накопления аберрантных белков, что в конечном итоге приводит к серьезным патологическим изменениям. состояния, подобные тем, которые наблюдаются при нейродегенеративных заболеваниях, связанных со старением (Daniele et al., 2018; Klaips et al., 2018), протеинопатии (Chaudhuri and Paul, 2006; Hidvegi et al., 2015; Hartl, 2017), а также генетические или вызванные окружающей средой хронические респираторные заболевания, такие как CF (Lukacs and Verkman, 2012; Fraser-Pitt and O’Neil, 2015) и ХОБЛ (Tran et al., 2015; Bodas, Vij, 2017; Bodas et al., 2017; Vij, 2017) соответственно. Делеция фенилаланина-508 (F508-del) является наиболее распространенной (около 80%) мутацией гена Cftr , связанной с CF, что приводит к неправильно свернутому белку CFTR, который не может достичь плазматической мембраны (PM) (Lukacs et al. al., 1993; Де Стефано и др., 2014). Это приводит к отсутствию зрелого ионного канала CFTR на PM, что ведет к дисфункции CFTR, классически описываемой как дефект транспорта хлорид-ионов (Welsh et al., 1993). Кроме того, есть существенные доказательства, подтверждающие критическую роль мембранрезидентного CFTR в регуляции врожденных и адаптивных иммунных ответов при МВ (Teichgraber et al., 2008; Vij et al., 2009; Bodas and Vij, 2010; Grassme et al. , 2017; Сведин и др., 2017). Более того, растущее число исследований в настоящее время подтверждает решающую роль зрелого CFTR в регуляции важных клеточных гомеостатических процессов, таких как протеостаз и аутофагия, с общим консенсусом, что аутофагия потенциально изначально дефектна при CF (Gomes-Alves et al., 2010; Лучани и др., 2010, 2011; Бодас и др., 2012; Валле и Видж, 2012; Villella et al., 2013a). Генез дефектной аутофагии при CF, по-видимому, является врожденным дефектом, поскольку первичные клетки CF снижают уровни некоторых белков аутофагии (Abdulrahman et al., 2011, 2013), хотя точный механизм (ы) все еще неясен. Некоторые интересные исследования указывают на возможный вклад микроРНК (Tazi et al., 2016) и метилирования ДНК (Tazi and Amer, 2015), так как оба могут регулировать экспрессию белков аутофагии в клетках CF.Тем не менее, хорошо документировано, что отсутствие мембранного CFTR приводит к ROS-опосредованному SUMOилированию трансглютаминазы 2 (TG2), что предотвращает ее убиквитинирование и последующую деградацию протеасомой, что приводит к ее внутриклеточному накоплению. Это приводит к сшиванию Beclin-1 (BECN1), важного белка, необходимого для образования аутофагосом, что приводит к нарушению аутофагии и накоплению SQSTM1 (p62) (Luciani et al., 2010; Bodas et al., 2017), что способствует агрегации BECN1 и других белков, связанных с аутофагией, в агресомные тельца p62 + HDAC6 + (Рисунок 1).Неправильно свернутый F508del-CFTR также секвестрируется в агресомные тельца, поскольку накопление p62 приводит к ингибированию как белка (протеасомы), так и клиренса агресом. Этот агресомный захват F508del-CFTR предотвращает его надлежащий перенос в PM, что способствует инициации и прогрессированию воспалительно-окислительного стресса в легких при МВ (Luciani et al., 2010).
Рисунок 1. Механизм опосредованной цистеамином индукции аутофагии и спасения F508del-CFTR.(Левая панель) Отсутствие функционального CFTR на плазматической мембране (PM) приводит к повышенным уровням активных форм кислорода (ROS), которые вызывают активацию трансглутаминазы-2 (TG2). Активный TG2 опосредует перекрестное связывание важнейших белков аутофагии, таких как Beclin1 (BECN1), ATG14 и AMBRA1, в агресомные тельца Ub + / p62 + / HDAC6 +, делает BECN1 и другие белки аутофагии недоступными для образования аутофагосомы и, таким образом, блокируя последующий поток аутофагии. процесс. Более того, накопление p62 может приводить к секвестрации агресомами вновь синтезированного F508-delCFTR, тем самым предотвращая его транслокацию PM.Кроме того, накопление поврежденных митохондрий приводит к большему производству АФК, дополнительно способствуя TG2-опосредованному сшиванию BECN1 и ингибированию аутофагии. Кроме того, опосредованная ROS транслокация кислой сфингомиелиназы (ASM) из цитоплазмы в PM приводит к повышенному превращению сфингомиелина в церамид, который является вредоносным сфинголипидом, участвующим в патогенезе CF. (Правая панель) Обработка клеток CF или мышей антиоксидантным препаратом, индуцирующим аутофагию, цистеамином, который также является ингибитором TG2, приводит к предотвращению сшивания BECN1.Это приводит к удалению компонентов агресомы, что приводит к доступности BECN1 и других ключевых белков аутофагии для формирования аутофагосомы, тем самым позволяя процессу аутофагии функционировать и приводя к удалению аутофагического груза. Более того, пониженные уровни p62 из-за функционального потока аутофагии, возможно, позволят вновь синтезированному F508-delCFTR достичь PM и восстановить частичную функцию CFTR, даже несмотря на то, что некоторые из ранее секвестрированных агресомами F508-delCFTR могут деградировать в результате активного процесса аутофагии.В дополнение к цистеамину, обработка эпигаллокатехин-галлатом (EGCG) во время удаления цистеамина усиливает долгосрочную стабильность спасенного PM F508-delCFTR из-за его ингибирующего действия на протеинкиназу CK2, что в противном случае способствовало бы периферическому развитию. / PM деградация F508-delCFTR. Кроме того, функциональный процесс аутофагии означает, что агрегированные токсичные белки и другие поврежденные органеллы, такие как митохондрии, гомеостатически разлагаются, что снижает общие уровни АФК.Наконец, цистеамин блокирует транслокацию ASM из цитоплазмы в PM, тем самым уменьшая превращение сфингозина в церамид и предотвращая опосредованную церамидами воспалительно-апоптотическую передачу сигналов в клетках CF и / или легких.
Это говорит о том, что будущие стратегии управления и лечения CF должны быть сосредоточены на коррекции основного нарушения протеостаза / аутофагии, в основном через , спасая F508del-CFTR к PM, что одновременно будет контролировать воспалительно-окислительный стрессовый ответ в дыхательных путях. субъектов МВ.В последнее время модуляторы протеостаза и индукторы аутофагии показали обнадеживающие результаты в доклинических исследованиях по коррекции как переноса F508del-CFTR в PM (CFTR-корректор)) (De Stefano et al., 2014; Tosco et al., 2016; Vu et al., 2017; Hutt et al., 2018; Stincardini et al., 2018; Zhang et al., 2018), а также подавление реакции на воспалительно-окислительный стресс (антиоксидантный / противовоспалительный) (Romani et al., 2017; Stincardini et al., 2018), хотя эти стратегии были не очень эффективны при восстановлении других редких мутаций CFTR класса II (Awatade et al., 2018). Более того, неизвестно, приводят ли редкие мутации CFTR также к дефекту аутофагии, поэтому многие другие модуляторы CFTR были клинически протестированы для оценки их эффективности в восстановлении стабильности и функции PM различных мутантов CFTR (Lopes-Pacheco, 2016). Эта стратегия в настоящее время разрабатывается как индивидуальный план ведения пациентов с МВ и потенциально может применяться у пациентов с МВ со всеми классами мутаций МВТР (Lopes-Pacheco, 2016; Paranjape and Mogayzel, 2018). Например, для людей с мутацией G551D пероральный биодоступный усиливающий препарат VX770 является весьма перспективным в качестве индуктора активности мутантного канала CFTR и, таким образом, одобрен FDA для клинического применения у пациентов с МВ (Accurso et al., 2010). Однако, поскольку около 80% пациентов с МВ во всем мире обладают дефектом F508del-CFTR (Lopes-Pacheco, 2016), препараты, которые корректируют его перенос PM, стабильность и функцию, стали многообещающим терапевтическим каналом для клинической проверки пациентов с МВ. Поскольку одиночные корректирующие препараты продемонстрировали минимальную клиническую эффективность, были предприняты успешные усилия по разработке комбинаторной терапии МВ. Фактически, несколько соединений, корректирующих CFTR, прошли клиническую оценку, и лишь немногие из них были доступны пациентам с МВ в комбинации с препаратами, усиливающими CFTR, Orkambi ® , Symdeko ® (Birault et al., 2013; Wainwright et al., 2015; Mayer, 2016), хотя в настоящее время их стоимость огромна (Mayer, 2016; Bulloch et al., 2017). Кроме того, недавнее исследование проверило тройную комбинацию фармакологических шаперонов (VX809 + MCG1516A + RDR1) и продемонстрировало лучшую функциональную коррекцию CFTR, чем только VX809 (Carlile et al., 2018), что обеспечило потенциально многообещающие будущие терапевтические средства для пациентов с МВ. Аналогичным образом была протестирована еще одна тройная комбинированная терапия с использованием VX-659-тезакафтор-ивакафтор (Davies et al., 2018), и в настоящее время проходит III фазу клинических испытаний (Sala and Jain, 2018).
Еще одним важным аспектом современных препаратов от МВ является проблема доставки лекарств и / или in vivo биодоступности из-за заведомо толстого и липкого слоя слизи (Brockman et al., 2017; Vij, 2017). В настоящее время ведутся обширные доклинические исследования для решения этих важных проблем, и был достигнут определенный успех в разработке новых систем доставки лекарств, которые обеспечивают адресную доставку лекарств и долгосрочную биодоступность в легких при МВ (Vij et al., 2010; Vij, 2011, 2017; van Rijt et al., 2014). Хотя ученые и клиницисты прошли долгий путь к значительному увеличению среднего возраста выживаемости пациентов с МВ для достижения зрелого возраста (примерно 40–50 лет) (West and Flume, 2018), болезнь все еще неизлечима, и многие драгоценные жизни утеряны очень ранний возраст. Таким образом, продолжающиеся фундаментальные и трансляционные исследования необходимы для разработки лучшего вооружения профилактических / терапевтических стратегий для дальнейшего улучшения выживаемости пациентов и, возможно, поиска лекарства от этого ограничивающего жизнь и уносящего жизнь генетического заболевания.В текущем обзоре собраны некоторые недавние исследования, которые могут быть использованы в новых терапевтических стратегиях для пациентов с МВ, с акцентом на лекарственные средства / соединения, которые корректируют основной вызывающий заболевание дефект протеостаза и аутофагии, включая дефект процессинга белка в F508del- Белок CFTR.
Индукторы аутофагии как новые терапевтические средства от CF
Одним из важнейших клеточных протеостатических механизмов, регулирующих процессинг белка, является процесс катаболической аутофагии.В недавних исследованиях имеется множество доказательств того, что частичная (при хронической обструктивной болезни легких, ХОБЛ) (Cantin, 2016; Bodas et al., 2017; Vij, 2017; Shi et al., 2018) или полная потеря (при CF ) (Luciani et al., 2010; Cantin, 2016) функционального белка CFTR из PM приводит к нарушению аутофагии, опосредованному реактивными формами кислорода (ROS). Это приводит к накоплению неправильно свернутых CFTR в околоядерных агресомных телах, что в конечном итоге способствует развитию заболевания легких. При МВ накопление неправильно свернутого F508del-CFTR приводит к нарушению аутофагии, опосредованному ROS, что приводит к усилению воспалительно-окислительного стресса (Luciani et al., 2010) на воздушных трассах CF. Более того, нефункциональный CFTR также способствует дефектному поглощению, уничтожению и удалению бактерий (Brockman et al., 2017; Ferrari et al., 2017; Pehote et al., 2017; Shrestha et al., 2017), что способствует к стойким обострениям и воспалениям, что в конечном итоге приводит к необратимому повреждению легочной архитектуры. В последнее время некоторые доклинические и клинические испытания демонстрируют полезность терапевтических соединений, вызывающих аутофагию, в контроле патогенеза и прогрессирования заболевания легких при МВ (Villella et al., 2013b; Джанкинс и др., 2014; Эспозито и др., 2016; Романи и др., 2017; Stincardini et al., 2018), которые показали себя многообещающими в исследованиях фазы I / II, но до сих пор ни одно из них не достигло уровня постели больного (De Stefano et al., 2014; Devereux et al., 2015, 2016). Как обсуждалось ранее (Yang et al., 2013; Vu et al., 2017), некоторые другие препараты, вызывающие аутофагию, также тестируются как потенциальные кандидаты на лечение МВ, но они могут не достигать пациентов из-за высоких доз, необходимых для лечения. в качестве доказательства многих побочных эффектов, не направленных на цель (Yang et al., 2013; Ву и др., 2017). Таким образом, мы выделяем здесь ведущие соединения / препараты, модулирующие протеостаз / аутофагию, которые могут допускать трансляцию у постели больного в качестве новых кандидатов в лекарства от МВ.
Цистеамин: многоцелевое лекарство от CF
Цистеамин – это одобренный FDA препарат для лечения нефропатического цистиноза, который очень эффективно используется более 25 лет (Besouw et al., 2013; Fraser-Pitt et al., 2018). В химическом отношении цистеамин представляет собой эндогенно присутствующий водорастворимый аминотиол, образующийся в результате метаболизма кофермента А (Fraser-Pitt et al., 2018). Он коммерчески доступен как Cystagon ® и Procysbi ® и может вводиться перорально, хотя с хорошо задокументированными побочными эффектами (Cherqui, 2012; Veys et al., 2016). За прошедшие годы цистеамин был представлен как потенциальное лекарство от МВ, и с тех пор было проведено несколько исследований для оценки его эффективности в борьбе с заболеванием легких при МВ (Besouw et al., 2013; Charrier et al., 2014; Devereux et al., 2015, 2016; Brockman et al., 2017; Shrestha et al., 2017). С механической точки зрения цистеамин является ингибитором TG2, который разрушает сборку агресом, которая секвестрирует ключевые белки аутофагии и F508del-CFTR, тем самым восстанавливая аутофагию и снижая уровни p62 (Рисунок 1).Это позволяет направлять неправильно свернутый F508del-CFTR к Golgi и PM, таким образом восстанавливая его функцию хлоридного канала. Более того, пониженные уровни p62 могут также предотвращать секвестрацию вновь синтезированного склонного к агрегации белка F508del-CFTR (Luciani et al., 2010) в агресомные тельца, тем самым позволяя его транспортировку к PM. Кроме того, нокдаун p62 также имитирует спасающий эффект цистеамина F508del-CFTR, тем самым подтверждая решающую роль p62 в регуляции уровней F508del-CFTR на PM.Недавно мы продемонстрировали, что цистеамин блокирует транслокацию фермента кислой сфингомиелиназы (ASM) в PM, тем самым блокируя превращение сфингомиелина в церамид, патогенный биоактивный липид, участвующий в заболевании легких при CF (Рисунок 1; Bodas et al., 2018b). Это исследование добавляет еще один новый механизм действия цистеамина в контроле воспалительно-апоптотической передачи сигналов при заболевании легких при МВ, хотя необходимы дальнейшие доклинические и клинические исследования для проверки этих механизмов. Тем не менее обнадеживает тот факт, что цистеамин разрабатывается в форме капсул с отсроченным высвобождением (Lynovex ® ) (Charrier et al., 2014) и прошел предварительные клинические исследования у пациентов с МВ. Для оценки переносимости и фармакокинетики цистеамина у пациентов с МВ было проведено относительно недавнее небольшое открытое исследование фазы 1/2а в одной группе (Devereux et al., 2016). Результаты показали, что, хотя некоторые побочные реакции наблюдались у пациентов с МВ, получавших пероральный цистеамин, они были аналогичны побочным эффектам, наблюдаемым у пациентов с цистинозом (Devereux et al., 2016). В целом цистеамин хорошо переносился и попадал в бронхиальный секрет в концентрациях выше, чем в плазме (Devereux et al., 2016). Кроме того, недавнее многообещающее исследование на мышах и людях с CF было проведено с использованием цистеамина и эпигаллокатехин-галлата (EGCG) в качестве комбинаторной лекарственной стратегии (Tosco et al., 2016). Благоприятные эффекты этого подхода были приписаны опосредованному индукцией аутофагии восстановлению F508del-CFTR в PM с помощью цистеамина с последующим повышением стабильности PM-резидентного белка CFTR посредством ингибирования протеинкиназы CK2 с помощью EGCG. Интересно, что мы и другие недавно описали, что цистеамин можно использовать в качестве многоцелевого кандидата в лекарство от CF, поскольку его возможности не ограничиваются только исправлением CFTR-зависимого дефекта транспорта хлорид-ионов.Фактически, цистеамин обладает разнообразным набором полезных свойств, таких как антиоксидант (Bodas et al., 2016, 2018b; Govindaraju et al., 2017; Vij et al., 2018), противовоспалительный (Ferrari et al., 2017), индуктор аутофагии (Esposito et al., 2016; Tosco et al., 2016; Ferrari et al., 2017), бактерицидный (Charrier et al., 2014; Ferrari et al., 2017; Shrestha et al., 2017), муколитические и антибиопленочные (Charrier et al., 2014; Brockman et al., 2017), которые необходимы для контроля острых или повторяющихся обострений и прогрессирования заболевания легких при МВ.Несмотря на то, что цистеамин является сильным кандидатом в лекарство от CF, его полезность, возможно, ограничена только пациентами с мутацией F508del-CFTR, поскольку он не был очень эффективен при других типах мутаций CFTR, таких как R560S-CFTR (Awatade et al., 2018 ), что требует дальнейшей оценки. Более того, несмотря на все полезные свойства, основными недостатками при использовании цистеамина являются его низкая биодоступность и необходимость в высокой дозе, которой трудно достичь in vivo (Vu et al., 2017).Таким образом, были предприняты новые попытки улучшить биодоступность цистеамина, а также снизить эффективную дозу, например, путем конъюгирования его с [3-жирной кислотой (докозагексаеновой кислотой, DHA)], которая также обладает собственной индуцирующей аутофагию properties через путь AMPK (Vu et al., 2017). Этот конъюгат может эффективно возвращать F508del-CFTR в PM при существенно более низкой концентрации, что требует его дальнейшей оценки в клинических условиях. В другом отчете девять «пролекарств» -глутамил-цистеамина были протестированы на культивируемых клетках почек, чтобы преодолеть его основные недостатки (Frost et al., 2016). Эти пролекарства могут обеспечить успешную доставку цистеамина в эпителиальные клетки почек с улучшенной биодоступностью и низкой токсичностью (Frost et al., 2016). Этот подход кажется многообещающим и нуждается в дальнейшей оценке на доклинических моделях МВ.
Ранее мы продемонстрировали полезность нанотехнологий в разработке новых систем доставки лекарств, направленных на устойчивую и целенаправленную доставку в дыхательные пути при МВ (Vij et al., 2010; Vij, 2011, 2017; Brockman et al., 2017).Используя аналогичный подход, мы недавно предложили применение дендримерной технологии при разработке новой системы доставки лекарств для улучшения биодоступности и специфичности цистеамина. Мы разработали состав конъюгата дендример-цистеамин (PAMAM-DEN CYS ) и проверили его способность индуцировать перенос F508del-CFTR в PM в клетках CF (Brockman et al., 2017). Хотя это было доклиническое исследование на ранней стадии, мы смогли продемонстрировать ключевые терапевтические признаки, такие как спасение F508del-CFTR от агресомных тел и его доставка в PM, а также контроль инфекции и роста Pa и муколитический потенциал (Brockman et al., 2017). Таким образом, этот новый конъюгат PAMAM-DEN CYS имеет потенциал для дальнейшего развития в качестве новой терапевтической стратегии при МВ, поскольку он корректирует протеостаз и нарушение аутофагии, что является центральным механизмом, способствующим развитию заболевания в патогенезе хронического заболевания легких при МВ.
Ингибиторы GSNO и GSNOR
Другой интересной стратегией коррекции протеостаза и дефекта аутофагии при CF является аугментация оксидом азота (NO), которая способствует спасению неправильно свернутого белка F508del-CFTR в PM.В некоторых предыдущих отчетах предлагается использовать доноры NO (такие как S-нитрозоглутатион, GSNO) или ингибиторы GSNO-редуктазы (GSNOR) для контроля воспаления дыхательных путей при экспериментальной аллергической астме (Blonder et al., 2014) и моделях CF ( Zaman et al., 2006, 2014, 2016; Rafeeq, Murad, 2017). В легких NO и его резервуар, GSNO, играют очень важную роль в поддержании тонуса гладких мышц дыхательных путей и контроле воспаления (Que et al., 2009; Sun et al., 2011). Уровни GSNO строго регулируются GSNOR, ферментом, который разрушает GSNO (Sun et al., 2011). Фактически, уровни GSNO снижаются с сопутствующим увеличением уровней GSNOR как в легких, страдающих астмой, так и в легких (Que et al., 2009; Sun et al., 2011; Zaman et al., 2016), что указывает на изменение передачи сигналов NO. способствует патогенезу астмы и МВ. Механически GSNO-опосредованное нитрозилирование S и последующая деградация Hsp70 / Hsp90 организующего белка (HOP) способствует прямому переносу CFTR в PM (Рисунок 2; Odunuga et al., 2004; Marozkina et al., 2010) . Открытие того, что GSNO может увеличивать экспрессию, созревание и функцию как WT, так и F508del-CFTR в эпителиальных клетках бронхов человека, привело к клиническим испытаниям ингибитора GSNOR, N91115 (Cavosonstat, Nivalis Therapeutics) (C.F. Фонд, 2015; Donaldson et al., 2017). В исследовании сообщалось, что N91115 хорошо переносился в течение 28 дней, без лимитирующей дозы токсичности и без проблем с безопасностью (Donaldson et al., 2017), хотя исследование было прекращено на стадии 2 фазы, поскольку улучшения функции легких не наблюдалось. наблюдается у пациентов с МВ. Недавно мы сообщили, что помимо его свойства спасения CFTR, увеличение GSNO с помощью GSNO или ингибитора GSNOR (N6022) эффективно снижает вызванный CS воспалительно-оксидативный стресс, а также корректирует нарушение аутофагии (Bodas et al., 2017), таким образом воздействуя на основную причину дисфункции CFTR и, как следствие, патогенез и прогрессирование заболевания легких при МВ. Фактически, N6022 был протестирован в клинических испытаниях на пациентах с МВ с несколько обнадеживающими результатами (C.F. Foundation, 2014; Rafeeq and Murad, 2017). Способность GSNO или N6022 индуцировать аутофагию может быть связана с его спасением CFTR от PM (Zaman et al., 2016; Bodas et al., 2017) или другими механизмами, такими как его ингибирующее действие на mTOR (Montagna et al. , 2016) или его антиоксидантной функцией (Rauhala et al., 1998; Хан и др., 2011; Bodas et al., 2017). Применение in vivo N6022 может быть ограничено из-за его низкой биодоступности из-за присутствия высокополярной имидазольной группы (Sun et al., 2011). Таким образом, GSNO-увеличение имеет потенциал для дальнейшего тестирования при МВ, когда модификации в дозировке и одновременная разработка методологии доставки через дыхательные пути могут обеспечить успешные клинические результаты.
Рисунок 2. Механизмы, опосредованные ингибиторами GSNOR, «спасение» F508del-CFTR в PM.Молекулярные шапероны, такие как организующий белок Hsp70Hsp90 (HOP), регулируют биогенез CFTR и надлежащую доставку к PM. В ER ассоциация HOP с F508del-CFTR приводит к его деградации через связанный с ER протеасомный путь. S-нитрозоглутатион (GSNO), клеточный донор оксида азота (NO), модулирует функцию HOP посредством его S-нитрозирования. В отсутствие функционального CFTR клеточные уровни GSNO низкие, что приводит к снижению S-нитрозирования HOP, что способствует опосредованной протеасомами деградации F508del-CFTR.Клеточные уровни GSNO строго регулируются ферментом GSNO-редуктазой (GSNOR), который опосредует катаболизм GSNO. Фармакологическое ингибирование GSNOR с использованием N6022 или N91115 увеличивает уровни GSNO, что приводит к усилению S-нитрозирования HOP. Считается, что усиление S-нитрозирования HOP препятствует его ассоциации с F508del-CFTR, тем самым позволяя прямую транспортировку и созревание F508del-CFTR. Более того, недавние исследования нашей группы также показывают, что увеличение GSNO с помощью N6022 может контролировать повышенные уровни ROS и, таким образом, корректировать опосредованное ROS нарушение потока аутофагии при МВ.
Возможное применение физетина в качестве нутрицевтика для CF
Нутрицевтик растительного происхождения, физетин (3,3 ‘, 4’, 7-тетрагидроксифлавон), демонстрирует потенциал в качестве будущего кандидата в лекарство от CF (Pal et al., 2016). В ходе текущих экспериментальных и клинических исследований изучаются профилактические и терапевтические свойства физетина при хронических воспалительных состояниях (Pal et al., 2016), неврологических заболеваниях и различных типах рака (Pal et al., 2016). Предыдущие исследования описали физетин как мощный антиоксидант (Khan et al., 2013; Pal et al., 2016; Govindaraju et al., 2017), противовоспалительное (Khan et al., 2013; Pal et al., 2016), бактерицидное (Pehote et al., 2017), а также ингибитор пути передачи сигналов PI3K / AKT / mTOR (Adhami et al., 2012), который регулирует ключевые клеточные процессы, включая аутофагию, и обсуждается ниже в этой статье. В контексте воспалительных заболеваний легких физетин продемонстрировал свой терапевтический потенциал на мышиных моделях аллергического воспаления дыхательных путей (Goh et al., 2012; Brown et al., 2016), а липополисахарид (ЛПС) вызывал острое повреждение легких у крыс за счет противовоспалительного механизма действия, направленного на NFκB (Feng et al., 2016). Более того, наш недавний отчет с использованием экстракта сигаретного дыма (CS) и модели Pa на мышиных макрофагах демонстрирует эффективность физетина в коррекции вызванного CS дефекта бактериального клиренса посредством индукции аутофагии, опосредованной транскрипционным фактором EB (TFEB), и / или восстановлением экспрессии зрелого (WT) -CFTR (Pehote et al., 2017). Кроме того, подобно цистеамину, физетин также проявляет прямую бактерицидную активность против Pa-бактерий, преобладающего возбудителя МВ, с помощью до сих пор неизвестного механизма (ов) (Pehote et al., 2017). В другом параллельном исследовании с использованием CS-воздействия на пигментные эпителиальные клетки сетчатки (RPE) в качестве модели in vitro возрастной дегенерации желтого пятна (AMD), Fisetin успешно скорректировал вызванное CS нарушение потока аутофагии и уменьшил перинуклеарное накопление агресомных тел, вероятно, контролируя CS-индуцированную активацию ROS (Govindaraju et al., 2017). Поскольку заболевание легких при МВ также характеризуется хроническим воспалительно-окислительным стрессом, стойкими бактериальными инфекциями и нарушением аутофагии, доказательство концепции in vitro данные требует оценки эффективности физетина на доклинических моделях заболевания легких при МВ.Хотя следует отметить, что, как и в случае с другими многообещающими лекарствами-кандидатами, индуцирующими аутофагию, полезность фисетина ограничивается его низкой растворимостью в воде (Bothiraja et al., 2014) и низкой биодоступностью при пероральном приеме (Seguin et al., 2013) и таким образом, предпринимаются попытки улучшить его эффективность in vivo за счет использования основанных на нанотехнологиях подходов к доставке через дыхательные пути (Ragelle et al., 2012; Kadari et al., 2017; Mehta et al., 2018).
Пептид тимуса для коррекции основного дефекта CF
Недавние исследования выявили потенциал тимозина α-1 (Tα1), пептида тимуса с широкими иммуномодулирующими свойствами, в коррекции основного дефекта CF, т.е.е., восстановление неправильно свернутого F508del-CFTR в ПМ (Romani et al., 2017; Garaci, 2018; Rubin, 2018; Stincardini et al., 2018). Механически активация индоламин-2, 3-диоксигеназы (IDO1) и, как следствие, уменьшение воспаления, наряду с индукцией аутофагии, предлагаются в качестве ключевых средств Tα1-опосредованного спасения F508del-CFTR (Romani et al., 2017) (рис. 3). Было показано, что Tα1 спасает F508del-CFTR в PM в клинически достижимой дозе, и это было связано с его активностью в качестве модулятора протеостаза.Tα1 действует на нескольких этапах рециклинга F508del-CFTR, таких как Rab GTPase, деубиквитинирующий фермент USP36 и убиквитин-связывающий белок, p62, который участвует в секвестрации F508del-CFTR агресомами (Romani et al., 2017). В клетках, обработанных Tα1, F508del-CFTR локализуется совместно с Rab9, который является маркером рециклирования эндосомы. Более того, совместная локализация F508del-CFTR с Rab5 (маркер ранней эндосомы) и Rab7 (маркер поздней эндосомы) уменьшалась обработкой Tα1. Таким образом, Tα1 снижает эндоцитарную рециркуляцию F508del-CFTR в ранние эндосомы, а также предотвращает его транспорт в поздние эндосомы и / или лизосомы, тем самым способствуя его прямой рециркуляции в PM (Romani et al., 2017). Хотя Tα1 имеет хороший профиль клинической безопасности и уже коммерчески доступен как ZADAXIN ® для лечения нескольких воспалительных и / или инфекционных заболеваний, таких как вирусные инфекции, иммунодефицитные заболевания, ВИЧ / СПИД и рак (Romani et al., 2017 ), еще предстоит выяснить, обладает ли он другими важными анти-CF свойствами, такими как бактерицидный и муколитический. Более того, в некоторых недавних исследованиях сообщается, что Tα1 не смог спасти CFTR в эпителиальных клетках и первичных бронхиальных эпителиальных клетках пациентов с МВ (Matthes et al., 2018; Tomati et al., 2018), хотя эти эффекты могут быть связаны с неправильным растворителем, использованным этими исследователями (Garaci, 2018). Таким образом, недавние заявления о том, что Tα1 может быть потенциальным «одномолекулярным» лекарством для профилактики / лечения хронического заболевания CF-легких, кажется далекой перспективой, требующей дальнейших углубленных исследований в доклинических и клинических условиях CF.
Рисунок 3. Тимозин-α-1 действует на несколько целей, спасая F508del-CFTR. Тимозин α-1 (Tα1) представляет собой пептид тимуса, который действует на множественные клеточные пути в процессе рециклинга и созревания CFTR, чтобы восстановить неправильно свернутый F508del-CFTR в плазматическую мембрану (PM).Во-первых, Tα1 может вызывать аутофагию посредством активации индоламин-2, 3-диоксигеназы (IDO-1) и снижения уровня p62, что приводит к спасению F508del-CFTR в PM. Кроме того, Tα1 активирует деубиквитинирующий фермент USP36, который, в свою очередь, предотвращает убиквитинирование и последующую деградацию F508del-CFTR, тем самым улучшая его стабильность к PM. Более того, в клетках, обработанных Tα1, обнаружено, что F508del-CFTR связан с Rab9 GTPase (маркером рециклинга эндосом), который способствует рециклированию F508del-CFTR в PM.Это происходит параллельно с уменьшением совместной локализации F508del-CFTR с Rab 5 (маркер ранней эндосомы) и Rab7 (маркер поздней эндосомы) GTPases в клетках, обработанных Tα1.
Ингибиторы PI3K / AKT / mTOR как новые препараты от МВ
Мишень рапамицина у млекопитающих (mTOR) является членом семейства белков киназ, связанных с фосфатидилинозитол-3-киназой (PI3K), которые уже давно участвуют в регуляции ключевых клеточных процессов, таких как рост клеток (Yu and Cui, 2016), выживание (Yu and Cui, 2016), моторика (Holroyd and Michie, 2018), метаболические пути (Yu and Cui, 2016) и аутофагия (Kim and Guan, 2015; Rabanal-Ruiz et al., 2017). Путь передачи сигналов PI3K / AKT / mTOR изменяется при нескольких болезненных состояниях, таких как рак (Conciatori et al., 2018; Guri et al., 2018), заболевания, связанные с иммунной системой (Guri et al., 2018; Jung et al. , 2018), идиопатический фиброз легких (IPF) (Lawrence and Nho, 2018), ХОБЛ (Houssaini et al., 2018; Wang et al., 2018) и лимфангиолейомиоматоз (LAM) (Gao et al., 2018). Поскольку mTOR считается главным регулятором пути аутофагии, его ингибиторы были исследованы на предмет их терапевтического потенциала при различных типах рака, и индукция аутофагии является одним из предложенных механизмов действия (Saxton and Sabatini, 2017; Paquette et al. al., 2018). Более того, в фибробластах более высокая, чем обычно, активность mTOR и возникающий в результате дефект аутофагии были связаны с патогенезом IPF (Lawrence and Nho, 2018), фатального хронического рестриктивного заболевания легких. Кроме того, нарушение аутофагии, опосредованное повышенной передачей сигналов mTOR, недавно наблюдалось в клетках и тканях легких, выделенных от субъектов с ХОБЛ, в то время как те же концептуальные доказательства были получены и от трансгенных мышей с конститутивной или условной избыточной активацией mTOR (Houssaini et al., 2018). Интересно, что старение клеток легких и развитие эмфиземы были связаны с повышенной активностью mTOR у этих мышей, поскольку эффекты могут быть улучшены рапамицином (ингибитором mTOR) (Houssaini et al., 2018). Также стоит отметить, что ингибирование mTOR было полезным для очистки белковых агрегатов (агресом) при нейрогенеративных заболеваниях (Heras-Sandoval et al., 2014), тем самым еще раз подтверждая решающую роль mTOR в регуляции процесса аутофагии. Было показано, что опосредованное рапамицином ингибирование mTOR снижает воспалительные реакции легких на мышиной модели CF (Abdulrahman et al., 2011), наряду с улучшенной функцией CFTR (Luciani et al., 2011; Tazi and Amer, 2015). Эти исследования подтвердили, что восстановление аутофагии с помощью рапамицина, который коммерчески доступен как сиролимус, может принести пользу пациентам с МВ, хотя у него есть несколько ограничений в клинической практике (Emoto et al., 2013; Li et al., 2014). Сиролимус имеет низкую биодоступность при пероральном приеме (Brasttström C. et al., 2000), плохую растворимость в воде (Kim et al., 2011), огромную фармакокинетическую вариабельность среди пациентов (Emoto et al., 2013), побочные эффекты (Bee et al., 2018) и побочные эффекты (Arriola et al., 2016; Lamming, 2016; Haeri et al., 2017), которые связаны с ингибированием как mTORC1 и mTORC2 (Arriola et al., 2016). Основные побочные эффекты сиролимуса включают гипергликемию, гиперлипидемию, инсулинорезистентность и учащение новых случаев диабета 2 типа (Emoto et al., 2013; Bee et al., 2018). В национальном когортном исследовании изучался ответ функции легких на лечение рапамицином и связанные с ним побочные эффекты у женщин с прогрессирующим заболеванием легких, вызванным LAM (Bee et al., 2018). Было замечено, что, хотя побочные эффекты были обычным явлением, они были управляемыми в течение нескольких лет, и улучшение функции легких было очевидным. В целом, низкие дозы рапамицина были связаны с меньшим количеством побочных эффектов без разницы в положительных эффектах (Bee et al., 2018), что требует его дальнейшей клинической оценки при МВ. Более того, было проведено несколько исследований для разработки способов повышения биодоступности и улучшения доставки сиролимуса in vivo (Kim et al., 2011; Haeri et al., 2017). Принимая во внимание центральную роль нарушения аутофагии и, как следствие, патологии агресом при МВ, кажется целесообразным проверить эффективность ингибиторов mTOR на моделях МВ. В соответствии с этой идеей, клетки CFBE41o демонстрируют повышенную активность mTOR, и возникающее в результате нарушение аутофагии, как было установлено, связано с накоплением F508del-CFTR в околоядерных агресомных телах (Reilly et al., 2017). Более того, ингибирование пути PI3K / AKT / mTOR шестью различными соединениями повышает стабильность и экспрессию CFTR-мембраны (Reilly et al., 2017). В исследовании было определено, что MK-2206 является наиболее мощным соединением, спасающим CFTR, которое действует посредством нацеливания на Bcl-2-связанный атаноген 3 (BAG3), регулятор аутофагии и клиренса агресом (Reilly et al., 2017). Таким образом, эффективность фармакологических ингибиторов PI3K / AKT / mTOR требует дальнейшей оценки в качестве потенциальных терапевтических кандидатов для лечения хронического заболевания легких, вызванного МВ, на основании их способности исправлять вызывающий заболевание протеостаз и дефект аутофагии, включая коррекцию основной дисфункции CFTR.
Ингибиторы HDAC как модуляторы протеостаза в CF
Ингибирование гистондеацетилаз (HDAC) было оценено как потенциальная терапевтическая стратегия для нескольких сворачиваний белков и других хронических воспалительных заболеваний, таких как нейродегенеративные заболевания (Benito et al., 2015; Rabal et al., 2016), хроническое заболевание почек (Liu и Zhuang, 2015), воспалительное заболевание кишечника (Felice et al., 2015), рак (Falkenberg and Johnstone, 2014; West and Johnstone, 2014; De Souza and Chatterji, 2015), болезнь трансплантат против хозяина (Choi et al. ., 2014, 2017), ревматоидный артрит (Oh et al., 2017) и CF (Hutt et al., 2010, 2011; Bodas et al., 2018a). Фармакологические исследования суберанилогидроксамовой кислоты (SAHA, Vorinostat), широкого ингибитора ферментов HDAC класса I и II (Bubna, 2015), при различных типах рака показывают, что SAHA хорошо переносится и демонстрирует хорошую биодоступность при приеме внутрь (43%) (Kelly et al. др., 2005). Более того, основные побочные эффекты введения SAHA, такие как усталость, диарея, обезвоживание и т. Д., Которые были более заметными при внутривенном пути лечения, а не при пероральном режиме лечения, и более серьезные показания, такие как тромбоцитопения, были устранены после прекращения приема. лечение (O’Connor et al., 2006; Бубна, 2015). Кроме того, SAHA также одобрен FDA для лечения кожной Т-клеточной лимфомы (Bubna, 2015). Таким образом, по крайней мере, в исследованиях с участием пациентов, направленных на рак, SAHA безопасно вводили в течение длительного периода с минимальной токсичностью и постоянной анти-HDAC активностью, что указывает на его потенциальную переносимость в качестве кандидата в лекарство от CF. При CF фармакологическое ингибирование HDAC, особенно с использованием SAHA, кажется обнадеживающим, поскольку это дает двойную пользу в контроле воспаления (Hull et al., 2016; Xu et al., 2017), а также функционируют как регулятор протеостаза (Bouchecareilh et al., 2012; Han et al., 2015) для облегчения спасения и доставки F508del-CFTR в PM (CFTR-корректор) (Bodas et al. ., 2018а). Действительно, мы недавно проверили потенциальную полезность SAHA в спасении F508del-CFTR для PM, задерживая его деградацию, тем самым подтверждая его потенциал в качестве корректора CFTR (Bodas et al., 2018a). Кроме того, лечение SAHA также было эффективным для контроля Pa -LPS-индуцированного воспаления и активации нейтрофилов в доклинической модели CF на мышах, которая, возможно, составляла через индукцию регуляторных Т-клеток (Bodas et al., 2018а). Интересно, что это наблюдение не зависело от CFTR, поскольку функция SAHA по подавлению воспаления была очевидна даже у мышей C ftr – / – . Это указывает на то, что SAHA может обеспечить потенциальную терапевтическую пользу при CF независимо от его способности спасать мутантный CFTR. Якобы контрастирующее исследование демонстрирует неспособность SAHA восстановить F508del-CFTR, хотя клетки и доза SAHA, использованные в этих отчетах, отличаются от наших исследований, что, возможно, объясняет несоответствие в результатах (Bergougnoux et al., 2017). Более того, в двух других исследованиях SAHA был способен увеличивать индуцированную форсколином секрецию хлорида в клеточных линиях, экспрессирующих CFTR, но не смог продемонстрировать такой же эффект в первичных эпителиальных клетках пациентов с МВ (Sondo et al., 2011; Van Goor et al., 2011 ). Тем не менее, регуляторы протеостаза, такие как SAHA и специфические ингибиторы HDAC 6/7, такие как тубацин (Cebotaru et al., 2008), были оценены в спасении неправильно свернутого F508del-CFTR от протеасомной деградации и накопления агресом. Необходимы дальнейшие доклинические исследования для оценки терапевтической эффективности конкретных ингибиторов HDAC, которые могут сочетаться с новыми системами доставки лекарств (Mohamed et al., 2012; Tran et al., 2014) для дальнейшего повышения их эффективности in vivo и биодоступности в легких при МВ.
Вкратце, в качестве доказательства концепции в поддержку предлагаемой стратегии адаптации протеостаза и аутофагии для спасения болезни легких при МВ недавнее исследование демонстрирует, что спасение МВТР, опосредованное VX-809, зависит от протеостаза, но не зависит от аутофагии (Pesce et al., 2018) , где мощное усиление аутофагии обеспечит синергетический эффект как на спасение мутантного CFTR, так и на другие компоненты (Romani et al., 2017; Stincardini et al., 2018) патогенеза заболевания легких при МВ, как подробно описано выше (De Stefano et al., 2014; Tosco et al., 2016; Vu et al., 2017; Hutt et al., 2018; Stincardini et al. ., 2018; Zhang et al., 2018). В этом исследовании исследователи пытались усилить аутофагию с помощью торина-1 (Pesce et al., 2018), но его эффекты были упущены из-за отсутствия сывороточного голодания и соответствующих экспериментальных условий. Тем не менее, обширные экспериментальные данные нашей и других групп позволяют предположить, что адаптация протеостаза и аутофагии имеет значительный потенциал в коррекции основных причин патогенеза заболевания легких при МВ и позволит разработать новое поколение эффективных терапевтических средств, как показано ниже.
Перспектива
Отсутствие функциональной мембраны CFTR является основной этиологией развития хронического заболевания легких у пациентов с МВ, которое прогрессирует из-за многочисленных патологических осложнений, таких как гиперпродукция слизи, повышенный окислительный стресс, хронические инфекции и устойчивое воспаление, опосредованное NFκB, что в конечном итоге приводит к смертельный исход в раннем возрасте, если его не лечить. Хотя были достигнуты огромные успехи в разработке новых «прорывных» комбинаций лекарств, таких как Orkambi ® , Symdeko ® и т. Д.Для исправления основного дефекта CF их широкое терапевтическое преимущество было ограничено из-за несколько низкой эффективности в поддержании устойчивой активации CFTR, а также в контроле других компонентов заболевания легких при CF, таких как реакции на хронический воспалительно-окислительный стресс и обострения. Следовательно, необходимо одновременно разрабатывать альтернативные терапевтические методологии с использованием новых лекарств и / или систем доставки лекарств, которые могут заполнить пробел в доступной, но действенной и эффективной стратегии лечения МВ, способной спасти общее заболевание легких при МВ.Поскольку значительные экспериментальные и доклинические данные предполагают ключевую центральную роль протеостаза и процессов аутофагии в регулировании большинства патогенных патогенов, вызывающих МВ в дыхательных путях, это требует дальнейшей клинической оценки и разработки препаратов, модулирующих протеостаз и аутофагию, как новый терапевтический подход к заболеванию легких при МВ. Наконец, поскольку субъекты CF обладают многочисленными типами мутаций CFTR, генотипирование пациента до принятия решения о препарате (препаратах), модулирующем протеостаз и аутофагию, позволит оценить терапевтическое преимущество для пациента в рамках развивающейся инициативы Precision Medicine Initiative.
Авторские взносы
Оба автора внесли свой вклад в концепцию, структуру и написание рукописи для публикации.
Заявление о конфликте интересов
NV является ведущим изобретателем патентованных механизмов протеостаза для устранения дефекта процессинга белка CFTR и заболевания легких, а также основателем компании VIJ Biotech, которая занимается лабораторной трансляцией новых терапевтических средств для лечения МВ и ХОБЛ.
Оставшийся автор заявляет, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
NV был поддержан грантами Национальных институтов здравоохранения (NIH, R03HL09631 и CTSA UL RR025005ATIP), Медицинского исследовательского института бортпроводников (FAMRI, YCSA082131) и Фонда кистозного фиброза (CFF, R025-CR07 и VIJ07IO) для предотвращения модуляции / модуляции протеостаза. терапевтическая стратегия и системы доставки лекарств обсуждаются в этой публикации.
Список литературы
Абдулрахман, Б.А., Хвик, А.А., Ахтер, А., Осторожно, К., Котранж, С., Абдельазиз, Д. Х. и др. (2011). Стимуляция аутофагии рапамицином подавляет воспаление легких и инфекцию, вызванную Burkholderia cenocepacia , в модели муковисцидоза. Аутофагия 7, 1359–1370. DOI: 10.4161 / auto.7.11.17660
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Абдулрахман, Б.А., Хвик, А.А., Ахтер, А., Осторожно, К., Тази, М., Хассан, Х., и др. (2013). Истощение убиквитин-связывающей адаптерной молекулы SQSTM1 / p62 из макрофагов, несущих мутацию cftr ΔF508, улучшает доставку Burkholderia cenocepacia в аутофагический аппарат. J. Biol. Chem. 288, 2049–2058. DOI: 10.1074 / jbc.M112.411728
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аккурсо, Ф. Дж., Роу, С. М., Клэнси, Дж. П., Бойл, М. П., Дуниц, Дж. М., Дьюри, П. Р. и др. (2010). Влияние VX-770 на людей с муковисцидозом и мутацией G551D-CFTR.

 Такие симптомы объясняются нарастающей гипоксией (дефицитом кислорода, от которого страдают все органы, системы и ткани).
Такие симптомы объясняются нарастающей гипоксией (дефицитом кислорода, от которого страдают все органы, системы и ткани).

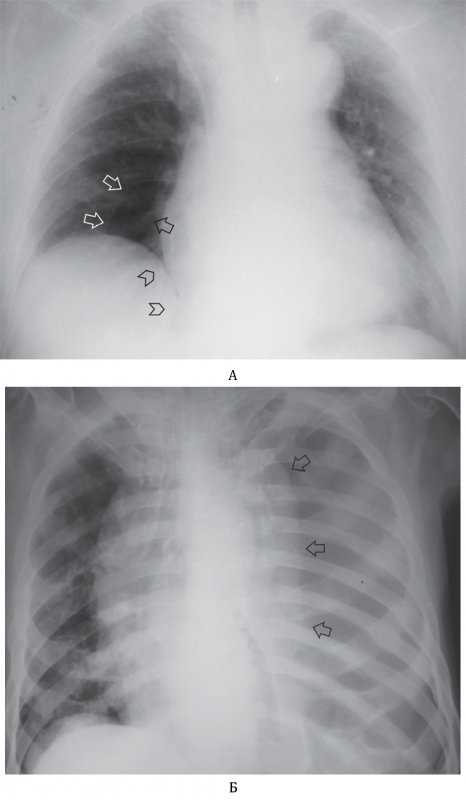 Также неплохого результата можно добиться при помощи лекарства Верошпирон, предупреждающего формирование фиброзных тканей во всех уголках организма.
Также неплохого результата можно добиться при помощи лекарства Верошпирон, предупреждающего формирование фиброзных тканей во всех уголках организма.
 дважды на день.
дважды на день.
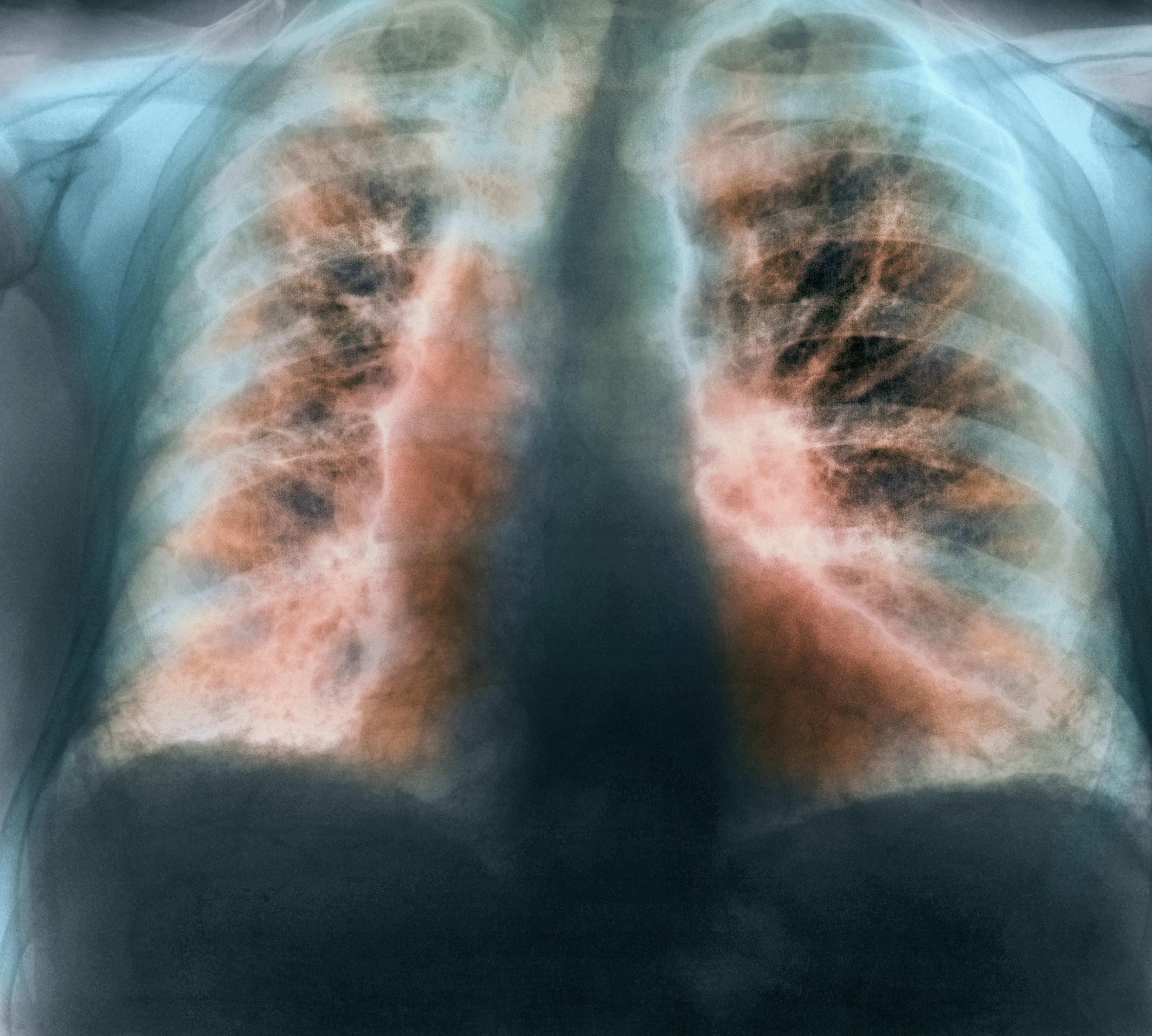 Они также помогают откашливать слизь, чтобы она покинула легкие. Это значительно улучшает функцию легких.
Они также помогают откашливать слизь, чтобы она покинула легкие. Это значительно улучшает функцию легких. Операция может потребоваться, если у человека с муковисцидозом серьезные проблемы с дыханием. В некоторых случаях может потребоваться замена обоих легких. Это потенциально может привести к серьезным осложнениям после операции, включая пневмонию.
Операция может потребоваться, если у человека с муковисцидозом серьезные проблемы с дыханием. В некоторых случаях может потребоваться замена обоих легких. Это потенциально может привести к серьезным осложнениям после операции, включая пневмонию.