Как различаются санитайзеры и чем их можно заменить
провизор, кандидат фармацевтических наук, преподаватель Уральского государственного медицинского университета
В первую очередь, мойте руки с мылом, если есть такая возможность. Это даже эффективнее в борьбе с вирусом, чем любой санитайзер. Мыть надо тщательно. Если вы вы сомневаетесь в том, правильно ли это делаете, еще раз пересмотрите обучающие видео.
Санитайзер лучше использовать после мытья рук. Размазывать гель по грязным рукам неэффективно. Если такой возможности нет, хотя бы протрите кожу влажной салфеткой. После этого смело наносите гелевый санитайзер, антисептический раствор или спиртосодержащий спрей. Также можно использовать спиртовые салфетки, но они, как и все спиртовые растворы, сильно сушат кожу.
Кожные антисептики бывают в форме спиртосодержащего геля, раствора, спрея или спиртовых салфеток. Также есть антисептики в виде крема, но они малоэффективны. Есть много рецептов, как приготовить антисептик в домашних условиях, но я не рекомендую это делать. Эффект от таких средств будет непредсказуем.
Для обработки рук подойдет любое спиртосодержащее средство, содержащее не менее 60 % спирта. Для этих целей используется этиловый или изопропиловый спирт (этанол или изопропанол, н-пропанол). Поэтому при покупке любого санитайзера обращайте внимание на состав. В нем должен быть этанол или изопропанол в процентном содержании не менее 60 %.
Можно приобрести в аптеке любой спиртовый раствор — салициловой, муравьиной или борной кислоты. Он подойдет для обработки кожи и поверхностей. Помните, что при их частом использовании может возникнуть сухость кожи, вплоть до микротрещинок. В этом случае используйте увлажняющие гели и крема на основе глицерина или пантенола. Применяйте их хотя бы вечером, перед сном. То же относится и к спиртовым салфеткам.
Применяйте их хотя бы вечером, перед сном. То же относится и к спиртовым салфеткам.
Если выбираете антисептический гель, обратите внимание на состав. В нем опять же должен присутствовать этанол или изопропанол (не менее 60 %). Только такой санитайзер будет эффективным. Если спирта в нем меньше или вовсе нет — это не эффективный продукт.
Гели могут содержать антибактериальные вещества на основе четвертичных аммониевых соединений (бензалкония хлорид), но они нужны для борьбы с бактериями, а не вирусами. Хорошо, если в составе есть глицерин, потому что он увлажняет кожу рук. Остальные компоненты геля значительной роли не играют.
Технические спирты, особенно на основе метилового спирта (метанол), опасны. Достаточно вспомнить случай в Иране, где улицы обработали метанолом. После этого несколько человек решили выпить его «для защиты от коронавируса», и отравились. Если просто протереть им руки, ничего опасного с вами, конечно, не случится, но он может впитаться через кожу.
Сейчас купить любое антисептическое средство в аптеках и в магазинах сложно. Особенно это касается городов, где были выявлены первые случаи инфицирования. Это не значит, что санитайзеры закончились и их больше не будет. Просто из-за ажиотажа раскупают их быстрее, чем успевают завозить новые. В аптеках можно купить спиртовые растворы (растворы салициловой, борной, муравьиной кислоты), они довольно дешевые. Если рост цен и будет, то покупатели вряд ли его почувствуют.
Помните, что есть ограничения по количеству флаконов, которые фармацевты могут отпускать в одни руки. Также в аптеках можно купить спиртовые салфетки. Гелевых санитайзеров сейчас практически не найти. Обратите внимание на крупные продуктовые магазины. Скорее всего, поставки там увеличат, и товара будет больше. Кстати, они там и стоят дешевле, потому что их закупают крупными партиями.
Борная кислота, 3%, раствор для местного применения (спиртовой), 25 мл, 1 шт.

Цены в аптеках на Борная кислота
3%, раствор для местного применения (спиртовой), 25 мл, 1 шт.
Аптека.ру
30₽
КупитьАСНА
от 8₽
КупитьДиалог
от 8₽
КупитьПроАптека
от 10₽
КупитьНадежда Фарм
11₽
КупитьАптечество
от 9₽
КупитьВаша №1
8₽
КупитьМонастырев
15₽
КупитьИстория стоимости Борная кислота
3%, раствор для местного применения (спиртовой), 25 мл, 1 шт.
15.02-21.02
15₽ (+1₽)
22.02-28.02
16₽ (+1₽)
01.03-07.03
15₽ (-1₽)
08.03-14.03
16₽ (+1₽)
Указана средняя стоимость товара в аптеках Москвы за период и разница по сравнению с предыдущим периодом
Инструкция на Борная кислота
3%, раствор для местного применения (спиртовой), 25 мл, 1 шт.
Состав
Борная кислота – 3 г;
Вспомогательные вещества:
Этиловый спирт 95% (этанол) – 73,7 г;
Воды очищенной – до 100 мл.
Описание
Прозрачная бесцветная жидкость со спиртовым запахом.
Фармакологическое действие
Антисептическое средство; коагулирует белки (в т.ч. ферментные) микробной клетки, нарушает проницаемость клеточной оболочки.
Фармакокинетика
Хорошо проникает через кожу и слизистые оболочки; медленно выводится и может накапливаться в органах и тканях. Выводится почками – 50% (в течение 12 ч), остальное количество – в течение 5-7 дней.
Борная кислота: Показания
Отит (острый наружный и хронический) без повреждения барабанной перепонки.
Способ применения и дозы
Местно. При остром и хроническом отите по 3-5 кап наносят на турунду и вводят в наружный слуховой проход 2-3 раза в день. Курс лечения не должен превышать 3-5 дней.
При остром и хроническом отите по 3-5 кап наносят на турунду и вводят в наружный слуховой проход 2-3 раза в день. Курс лечения не должен превышать 3-5 дней.
Борная кислота: Противопоказания
Гиперчувствительность, хроническая почечная недостаточность, перфорация барабанной перепонки; беременность, детский возраст, период лактации.
Борная кислота: Побочные действия
Местные реакции: зуд, жжение, гиперемия кожи наружного слухового прохода.
Аллергические реакции.
Передозировка
Симптомы острой интоксикации (при случайном приеме внутрь): тошнота, рвота, диарея, гастралгия, нарушение функций ССС, стимуляция или угнетение ЦНС, гиперпирексия, эритематозные высыпания с последующей десквамацией (возможен летальный исход в течение 5-7 дней), нарушение функции почек и печени (в т.ч. желтуха), циркуляторный коллапс, шок, в т.ч. с летальным исходом.
Лечение: симптоматическое. Переливание крови, гемо- и перитонеальный диализ.
Особые указания
Избегать попадания на слизистые оболочки.
Форма выпуска
Раствор для местного применения спиртовой 3%.
По 25, 40, 100 мл во флаконы из оранжевого стекла с винтовой горловиной, укупоренные пробками полиэтиленовыми и навинчиваемыми крышками или крышками унифицированными укупорочно-навинчиваемыми.
По 15, 25 мл во флаконы-капельницы из оранжевого стекла с винтовой горловиной, укупоренные полиэтиленовыми пробками и навинчиваемыми крышками или пробками-капельницами с крышками.
По 100 мл в банки из оранжевого стекла, укупоренные колпачками алюминиевыми или крышками навинчиваемыми полиэтиленовыми с уплотнительными элементами.
Каждый флакон, флакон-капельницу или банку вместе с инструкцией по применению помещают в пачку из картона коробочного.
Допускается укладка флаконов, флаконов-капельниц или банок без индивидуальных пачек в групповую упаковку (коробку картонную) с равным количеством инструкций по применению.
Условия отпуска
Производитель
ООО “Гиппократ”,
443012 Самара, ул. Охтинская, 10-13.
(846) 955-27-77
Претензии потребителей направлять в адрес производителя:
ООО “Гиппократ”,
443022 Самара, пр. Кирова, 10.
(846) 955-27-77
Основные сведения
Торговое название
Борная кислота
Действующее вещество (МНН)
Борная кислота
Дозировка или размер
3%
Форма выпуска
раствор для местного применения (спиртовой)
Первичная упаковка
флакон-капельница темного стекла
Объём упаковки
25 мл
Количество в упаковке
1
Производитель
Гиппократ
Страна
Россия
Срок годности
3 года
Условия хранения
В защищенном от света месте, при температуре не выше 25 °C
Борный спирт или Отипакс? — 19 ответов на Babyblog
ТаняНасчет что лучше это к врачу… а про борный спирт могу сказать, что он прогревает хорошо.
АллаЭто она вам противовирусное назначила, интерферон с антиоксидантами и витаминами, заместительное, которое разрешено для маленьких. А лечение отита заключается в правильном лечении насморка – туалет носа солевым раствором, сосудосуживающие по показаниям, капли с антибиотиком. В ушко капли только снимают боль , но не лечат.
АннаСлушайте, ну по моему борный спирт — это вообще древность, его уже даже когда я маленькая была не назначали. Сейчас полно препаратов от отита. Тот же отипакс куда безопаснее и эффективнее. Вообще, при вирусе я бы не отказывалась от противовирусного лечения, сейчас все чаще стали говорить о необходимости защиты от вируса, видимо, волна ненависти к таким препаратам проходит, а появление новых вирусов пугает.
при слове “спирт” аж глаза округлились, не надо его))))почитайте про вот это, на счет отита не знаю, но воспаления отлично снимает
ИринаБорный спирт — это каменный век. То, что его назначила ЛОР, — просто нонсенс!
То, что его назначила ЛОР, — просто нонсенс!
Ну как не понимаете действие спирта?..СПИРТ обеззараживает,он антисептик..Спирт убивает бактерии отипакс снимает боль и наверное тоже как антисептик действует..и то и другое вполне применимо..решайте сами..
ЕкатеринаСейчас есть хорошие ушные капли) отипакс можно деткам, хорошо снимает боль, обладает обезбол.и противоспал. эффектом,правда содержит лидокаин и нет антибиотика. Отофа — антибакт.капли,тоже можно деткам.
МаринаУ меня беременность 26 недель и вот я тоже приболела. 😭 Мой врач помимо других препаратов посоветовала борную кислоту. 3 дня я закладывала ватки с ней в уши и сегодня решила почитать про нее в интернете. Я В ШОКЕ!!!! И В УЖАСЕ!!! Практически везде пишут, что она токсична! А эта статья меня убедила окончательно: https://m.nkj.ru/archive/articles/3604/. Девочки, лучше не рискуйте! Даже маленький процент навредить малышу, уже процент. 😢 Буду надеяться, что на малышку это не повлияло! 😭
egsuteЗапись если назначена, это не значит что раньше нельзя придти. Если талонов нет, просто вместе с кем-то заходите в кабинет и вопрос свой задавайте. Вам спросить нужно о лекарстве. А вы в интернете людям херпойми с каким образованием доверить здоровье ребенка хотите.
Читать все 19 комментариевАнтисептики – новости медицины
В России зарегистрировано около 250 торговых названий антисептиков. Некоторые из таких препаратов применяются только в больницах, некоторые необходимо иметь в каждой домашней аптечке, некоторые из этой самой аптечки лучше выбросить, так как в цивилизованном мире от них давно отказались.
Что это и как работает
Антисептики — это вещества, которые уничтожают бактерии, грибы, вирусы и даже прионы (инфекционные агенты белковой природы, вызывающие поражения головного мозга). Эти препараты применяются преимущественно для обработки кожи, слизистых оболочек, ран и т. п. Антисептики нужны, чтобы не развивались различные инфекции и не возникало нагноения. В отличие от дезинфектантов они могут применяться на живых тканях, не повреждая их.
Эти препараты применяются преимущественно для обработки кожи, слизистых оболочек, ран и т. п. Антисептики нужны, чтобы не развивались различные инфекции и не возникало нагноения. В отличие от дезинфектантов они могут применяться на живых тканях, не повреждая их.
Механизм действия антисептиков очень и очень разный — все зависит от того, на основе чего они созданы: этилового спирта, йода, хлора и т. д. Антисептики продаются в виде мазей, растворов, спреев, присыпок и не только. Очевидно, что самостоятельно сделать выбор во всем этом многообразии достаточно трудно, но все же есть некоторые ориентиры: это, в частности, цель применения и доказанная эффективность препарата.
Какие выбрать
При выборе антисептика, безусловно, нужно ориентироваться на инструкцию, где будет указано, не вызовет ли препарат побочных эффектов у детей, в каких состояниях и дозировках его рекомендовано использовать и т. д. Самые популярные антисептики на Западе — это повидон-йод, хлоргексидин, этиловый спирт, ацетат, перекись водорода, борная кислота, нитрат серебра, сульфадиазин серебра и гипохлорит натрия.
По разным причинам рейтинг эффективности антисептиков составить непросто, однако, если рассматривать ограниченное число препаратов, по некоторым данным он может выглядеть так: полигексанид = октенидин > хлоргексидин > триклозан > повидон-йод. Полигексанид предпочтительнее при хронических ранах. Немедленного эффекта лучше всех добиваются октенидин и повидон-йод.
Октенидин хорош и тем, что он не проникает в системный кровоток даже при обработке ран, то есть обеспечивает удивительно низкую токсичность. Обработка ран — это довольно сложная тема, на которую было проведено немало исследований с противоречивыми выводами. С одной стороны, использование антисептиков необходимо для того, чтобы не произошло заражение с последующими осложнениями. Кроме того, бактерии мешают зажить ране. С другой стороны — антисептики также могут замедлить этот процесс. Обобщив результаты проведенных исследований, можно с уверенностью сказать, что повидон-йод не влияет негативно на заживление ран и при этом сокращает количество бактерий. 3%-ный раствор перекиси водорода также не тормозит процесс заживления, останавливает кровь, но с бактериями в ранах не справляется. Тем не менее Министерство здравоохранения и социальных служб США настоятельно не рекомендует использовать антисептики при пролежнях — эти поражения необходимо промывать с помощью физраствора.
Обобщив результаты проведенных исследований, можно с уверенностью сказать, что повидон-йод не влияет негативно на заживление ран и при этом сокращает количество бактерий. 3%-ный раствор перекиси водорода также не тормозит процесс заживления, останавливает кровь, но с бактериями в ранах не справляется. Тем не менее Министерство здравоохранения и социальных служб США настоятельно не рекомендует использовать антисептики при пролежнях — эти поражения необходимо промывать с помощью физраствора.
При ожогах чаще всего используются соединения серебра (сульфадиазин серебра, нитрат серебра). В проведенных исследованиях не было достоверно показано, имеют ли эти препараты антимикробное действие, однако отсутствие негативного эффекта на заживление ран установить удалось. Более того, возможно, соединения серебра ускоряют этот процесс.
При угрозе развития инфекционных заболеваний в полости рта рекомендуется проводить полоскания растворами, содержащими такие антисептики, как хлоргексидин, повидон-йод и 0,1%-ный раствор гипохлорита натрия.
Чтобы продезинфицировать руки, лучше всего использовать антисептики на основе этилового спирта. Однако какими бы хорошими они ни были, их эффект сопоставим с обычным мытьем рук с применением мыла. Кроме того, антисептики на основе этилового спирта бессмысленно применять, если руки загрязнены так, что это видно невооруженным глазом.
5%-ный спиртовой раствор йода рекомендуется использовать для обработки краев раны, а также небольших порезов, уколов, когда раневая поверхность практически отсутствует. С раствором йода необходимо быть очень осторожным, потому что молекулярный йод может частично всасываться с поверхности кожи и достигать системного кровотока. А это в свою очередь чревато угнетением функции щитовидной железы. (К слову, именно поэтому при простуде делать йодовые сетки, а также использовать раствор Люголя — отнюдь не лучшая идея.) Те же риски есть при применении йодинола и йодоната.
Что выкинуть из аптечки
Чтобы в аптечке были только действенные антисептики, безусловно, нужно избавиться от препаратов протаргол (протеинат серебра), колларгол (коллоидное серебро), ихтиол (ихтаммол — во всем мире это не очень популярное противовоспалительное средство, иногда используемое исключительно в ветеринарии), метилленовый синий, так как они имеют крайне малую эффективность и в России применяется исключительно по инерции.
Кроме того, препараты борной кислоты могут быть токсичны, они вызывают различные побочные эффекты (рвоту, диарею, сыпь, головную боль), поэтому применять их надо с осторожностью, а лучше заменить на более безопасные антисептики.
ФС.2.2.0002.15 Борная кислота | Фармакопея.рф
Содержимое (Table of Contents)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Борная кислота ФС.2.2.0002.15
Борная кислота
Acidum boricum Взамен ФС 42-3683-98
Ортоборная кислота
Содержит не менее 99,0 % борной кислоты H3BO3.
ОписаниеБелый или почти белый кристаллический порошок, бесцветные блестящие жирные на ощупь пластинки или белые или почти белые кристаллы.
РастворимостьЛегко растворим в кипящей воде и глицерине 85 %, растворим в воде и спирте 96 %.
Подлинность1. Качественная реакция. К 10 мл раствора, приготовленного в испытании на «Прозрачность» водного раствора, прибавляют 0,1 мл 0,05 % раствора метилового красного; должно появиться красно-оранжевое окрашивание.
- Качественная реакция. 1,0 г субстанции растворяют в 10 мл кипящего спирта 96 %. К 3 мл полученного раствора прибавляют 1 мл серной кислоты концентрированной и перемешивают. При зажигании смесь должна гореть пламенем, окаймленным зеленым цветом.
От 3,8 до 4,8 (3,3 % раствор, ОФС «Ионометрия», метод 3).
Не более 0,045 % (ОФС «Сульфаты», метод 1). Определение проводят с использованием эталонного раствора, содержащего 9 мл стандартного раствора сульфат-иона (10 мкг/мл) и 1 мл воды. 5,0 г субстанции растворяют в 20 мл кипящей воды. Раствор охлаждают, доводят объем раствора водой до 25 мл и фильтруют. 1 мл фильтрата разбавляют водой до 10 мл.
Тяжелые металлыНе более 0,0015 % (ОФС «Тяжёлые металлы»). Определение проводят с эталонным раствором, содержащим 3 мл стандартного раствора свинец-иона (5 мкг/мл) и 7 мл воды. 5 мл фильтрата, полученного в испытании на «Сульфаты», разбавляют водой до 10 мл.
Субстанция не должна темнеть при прокаливании при красном калении.
Микробиологическая чистотаВ соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определениеК около 1 г (точная навеска) субстанции прибавляют 100 мл 20 % раствора маннита, предварительно нейтрализованного по фенолфталеину 0,1 М раствором натрия гидроксида, нагревают до полного растворения, охлаждают и титруют 1 М раствором натрия гидроксида с тем же индикатором до появления неисчезающего розового окрашивания.
Параллельно проводят контрольный опыт.
1 мл 1 М раствора натрия гидроксида соответствует 61,83 мг борной кислоты H3BO3 .
ХранениеВ хорошо укупоренной упаковке.
Скачать в PDF ФС.2.2.0002.15 Борная кислота
Поделиться ссылкой:
Борная кислота, реакция со спиртам
Реакция борной кислоты со спиртами. Реакцию осуществляют в фарфоровом тигле или чашке. Для реакции берут сухое вещество, а если для анализа дан раствор, то его предварительно выпаривают досуха. К сухому испытуемому веществу прилейте немного спирта и концентрированной серной кислоты, смесь перемешайте стеклянной палочкой и подожгите. При наличии ВО3 -ионов пламя окрашивается в зеленый цвет. Бораты и борная кислота в сернокислой среде со спиртами образуют эфиры борной кислоты [c.377]
При наличии ВО3 -ионов пламя окрашивается в зеленый цвет. Бораты и борная кислота в сернокислой среде со спиртами образуют эфиры борной кислоты [c.377]Практический интерес представляют два последних способа получения триалкилборатов. Однако следует учесть, что при промышленном осуществлении реакции борного ангидрида со спиртами встречается ряд трудностей. В частности, при введении порошкообразного борного ангидрида в спирт необходимо устранять комкование борного ангидрида, так как это приводит к затуханию реакции. Если же борный ангидрид применяют в виде кусков, приходится проводить реакцию при повышенном давлении, а спирт необходимо предварительно обезвоживать. Поэтому наиболее технологичным является способ получения триалкил(арил)боратов при взаимодействии борной кислоты со спиртами. [c.313]
Синтез триалкилборатов из борной кислоты и спирта методом азеотроп-ного удаления воды проводят следующим образом [19] в реакционной колбе нагревают смесь борной кислоты и спирта по окончании реакции отгоняют (непосредственно из реакционной колбы) водно-спиртовую азеотропную смесь. Борат освобождают от избытка спирта дистилляцией, затем очищают фракционированной разгонкой. [c.242]
В Институте нефтехимического синтеза АН СССР под руководством Л. Н. Башкирова разработан процесс производства высших жирных спиртов методом окисления парафинов в присутствии борной кислоты [79—81 ]. Наличие в зоне реакции борной кислоты позволяет фиксировать процесс на стадии образования спиртов, несмотря на сравнительно высокую глубину окисления. [c.160]
Процесс совместного производства синтетических жирных кислот и натрийалкилсульфатов методом непрерывного окисления жидких парафинов. Сущность данного метода заключается в непрерывном окислении жидких парафинов в присутствии катализатора — нафтената марганца. Для обеспечения максимального выхода спиртов процесс ведется при относительно низкой температуре и ограниченном времени пребывания (а вместе с тем и глубины окисления) исходных парафинов в зоне реакции. Для понижения скорости окисления спиртов в качестве окисляющего агента используется азотокислородная смесь с содержанием кислорода 4—5%. В выбранном режиме окисления получаемые высшие жирные спирты представлены смесью первичных и вторичных спиртов. Однако в отличие от процесса прямого окисления парафиновых углеводородов в присутствии борной кислоты менее жесткие условия окисления рассматриваемого варианта обеспечивают более благоприятный состав смеси спиртов, в которой содержание первичных спиртов составляет 45—50%. [c.172]
Для понижения скорости окисления спиртов в качестве окисляющего агента используется азотокислородная смесь с содержанием кислорода 4—5%. В выбранном режиме окисления получаемые высшие жирные спирты представлены смесью первичных и вторичных спиртов. Однако в отличие от процесса прямого окисления парафиновых углеводородов в присутствии борной кислоты менее жесткие условия окисления рассматриваемого варианта обеспечивают более благоприятный состав смеси спиртов, в которой содержание первичных спиртов составляет 45—50%. [c.172]
В реакцию взаимодействия с борной кислотой вступают также и первичные спирты, получающиеся в небольших количествах из первичных гидроперекисей. [c.179]
Для интенсификации и придания большей селективности процессу получения спиртов необходимо было предельно ограничить протекание глубоких окислительных превращений — накопление смол,-являющихся ингибиторами окисления (особенно нейтральных смол), ускорить связывание спиртов борной кислотой в эфиры и затем исключить из зоны реакции спирты, не связанные в борные эфиры. Все это удалось впервые осуществить при окислении нормальных алканов в небольшом вакууме (остаточное давление в зоне реакции 300—400 мм рт. ст.) [13]. [c.294]
Под действием щелочного пероксида водорода триалкилбораны можно окислить до эфиров борной кислоты [237]. Реакция не затрагивает двойные или тройные связи, альдегиды, кетоны, галогениды или нитрилы. Группа К не подвергается перегруппировке. Эта реакция служит одной из стадий метода гидро-борирования, используемого для превращения олефинов в спирты (т. 3, реакция 15-11). Предлагаемый механизм реакции включает перемещение группы К от бора к кислороду [237] [c.454]
При определенных условиях борная кислота может проявлять и более высокую основность. Так, в присутствии серной кислоты она реагирует с метиловым спиртом по реакции [c.141]
Эту реакцию можно выполнять и следующим образом. Приготовленную смесь борной кислоты и тетрабората натрия с серной кислотой осторожно выпарьте до кашицеобразного состояния, охладите, смочите спиртом или глицерином, а затем немного полученной массы в ушке платиновой проволоки внесите в пламя горелки. При этом пламя окрашивается в ярко-зеленый цвет. [c.409]
Приготовленную смесь борной кислоты и тетрабората натрия с серной кислотой осторожно выпарьте до кашицеобразного состояния, охладите, смочите спиртом или глицерином, а затем немного полученной массы в ушке платиновой проволоки внесите в пламя горелки. При этом пламя окрашивается в ярко-зеленый цвет. [c.409]
Приведенная реакция, пригодная для открытия малых количеств борной кислоты и ее солей, обладает некоторыми преимуществами по сравнению с другими качественными реакциями на ВО. -ионы, например не требуется прибавления концентрированной серной кислоты и спирта реакция применима и присутствии фторидов, затрудняющих открытие ВО -ионов другими методами не требуется сложной аппаратуры реакция проста в выполнении. [c.410]
Несколько кристаллов борной кислоты поместите в маленькую фарфоровую чашку, добавьте 2—3 капли концентрированной серной кислоты и 10—15 капель спирта. Смесь тщательно перемешайте палочкой, перенесите чашку в вытяжной шкаф и подожгите содержимое. Обратите внимание на ярко-зеленую кайму горящего эфира. Составьте уравнение реакции образования эфира и его горения. [c.173]
Окисление проводили в колонне, внутри которой помещали водяной змеевик для снятия тенла экзотермической реакции (без охлаждения удержать температуру реакционной массы на заданном уровне не удавалось). Над колонной был установлен флорентийский сосуд, котором собиралась вода, выделявшаяся в реакциях окисления и этерификации борной кислоты образующихся спиртов. Сначала окисляли нормальшле алканы в спирты (режим окисления описан в работе [И]). Наряду со спиртами в оксидате образовывались в значительных количествах кислоты, сложные эфиры и смолы. Оксидат имел темно-желтый цвет. [c.293]
Опыт 3. Обнаружение борат-ионов. Чувствительная реакция на бор основана на способности его соединений окрашивать пламя в зеленый цвет. Одну-две крупинки буры поместите в тигель, добавьте несколько капель концентрированной серной кислоты и несколько капель метилового или этилового спирта, смесь перемешайте стеклянной палочкой и зажгите. Заметьте зеленую окраску пламени. Пламя окрашивается образующимся при реакции летучим эфиром борной кислоты со спиртом—В(ОСгИ5)з. [c.200]
Заметьте зеленую окраску пламени. Пламя окрашивается образующимся при реакции летучим эфиром борной кислоты со спиртом—В(ОСгИ5)з. [c.200]
Фракция исходных парафиновых углеводородов и возвратные углеводороды из емкости 19 в соотношении 1 1,2 поступают в подогреватель 1, где доводятся до 165° С и подаются в окислительную колонну 3, в которой подогреваются до 170° С теплоносителем. При 170° С в колонну из смесителя 2 загружается суспензия борной кислоты, носле чего начинается окисление при непрерывной подаче в нижнюю часть колонны воздуха. Окисление продолжается 2—3 часа по достижении гидроксильного числа ок-сидата 70—80. Отработанный газ по выходе из окислительной колонны проходит систему очистки 4—10). Газ после очистки смешивается с необходимым количеством воздуха и возвращается в окислительную колонну. Масляный конденсат из аппаратов 5 и б направляется в емкость 11. Окси дат из окислительной колонны подается в емкость 12, из которой направляется в промежуточную емкость 13 и на центрифугу 14 для отделения борной кислоты. Борная кислота собирается в сборнике 15, растворяется в воде и направляется на регенерацию через 16 (суперцентрифуга). Оксидат проходит емкость 17, подогреватель 18 и поступает в дистилля-ционную колонну 19, где от борных эфиров отгоняются парафиновые углеводороды, не вступившие в реакцию, которые поступают в сборник 20. Углеводороды после промывки 10%-ным раствором КаОН в аппарате 21 насосом 22 через промежуточную емкость 23 направляются на промывку водой в колонну 24, а затем в емкость 25, из которой часть их возвращается на окисление, а другая часть подвергается дистилляции. Борнокислые эфиры из куба 26 через емкость 27 поступают через подогреватель 28 в реактор 29, где при 98°С происходит их гидролиз водой. Сырые спирты отмываются в колоннах 29а от борной кислоты. Сырые спирты собираются в емкости 30, промываются 45%-ным раствором КаОН при 110°С в реакторах 31 для удаления примеси жирных кислот, а затем из емкосш 33 поступают на дистилляцию в ректификационные колонны 32 и собираются в емкостях готовой продукции 33. Водный раствор борной кислоты собирается в емкость 34, затем поступает в выпарной аппарат 35 и далее — в кристаллизатор 36, после чего кристаллы отделяются на центрифуге 37. Аппараты 38—40 играют роль промежуточных емкостей. 41 — подогреватель, 42 — транспортер борной кислоты ж 43 — бункер. [c.295]
Водный раствор борной кислоты собирается в емкость 34, затем поступает в выпарной аппарат 35 и далее — в кристаллизатор 36, после чего кристаллы отделяются на центрифуге 37. Аппараты 38—40 играют роль промежуточных емкостей. 41 — подогреватель, 42 — транспортер борной кислоты ж 43 — бункер. [c.295]
Полный эфир борной кислоты В(ОС2Н5)з образуется при нагревании борной кислоты со спиртом и серной кислотой, необходимой для каталитического ускорения реакции этерифи- [c.232]
Сырьем для получения высших спиртов яо А. Н. Башкирову может служить углеводородная фракция 275—320 °С, выделенная из газойля карбамидной депарафинизацией (так называемый мягкий парафин). Содержание в мягком парафине ароматических углеводородов, тормозящих окисление, не должно превышать 0,5%. Окисление проводится периодическим методом в барботажной колонне, куда загружают исходную фракцию н-парафинов с добавкой 4—5% борной кислоты. Реакция идет в отсутствие катализаторов при 165—170 °С и барботировании азото-кислородной смеси, содержащей 3—4,6 объемн. % Ог- Продолжительность окис- [c.529]
Средний эфир борной кислоты В(ОС2Нб)з образуется при нагревании борной кислоты со спиртом и серной кислотой, необходимой для каталитического ускорения реакции этерификации. Это — жидкость, кипящая при 123°. Она горит красивым зеленым пламенем, чем пользуются в качественном анализе для открытия борной кислоты. [c.222]
Триалкилбораты и силоксаны преимущественно образуются при взаимодействии диметилдиметоксисилана с борной кислотой [2008] и а, ш-(диэтокси)олигодиалкилсилоксанов с комплексами борной кислоты со спиртами [2048]. Смесь тетраэтоксисилана с борной кислотой дает качественную реакцию на эфиры борной кислоты, в связи с чем предложена следующая схема их взаимодействия [2049, 2050] [c.206]
Описаны реакции алкилборатов с рядом кислородных кислот (S hiff, 1867 herbuliez et al., 1953). Так, при нагревании триэтилбората с серной кислотой до 140—150° С, как и можно было ожидать, образуются этилсерная кислота, этилен, метаборная кислота и вода с азотной кислотой получаются этилнитрат и борная кислота. При нагревании этилбората с карбоновыми кислотами (уксусной, бензойной, янтарной, щавелевой) образуются соответствующие этиловые эфиры. Описан способ получения ацетатов, основанный на этой реакции (Hirao et al., 1953) из борной кислоты и спирта получают алкилборат, который нагревают с ледяной уксусной кислотой, не выделяя его из реакционной смеси [c.31]
Так, при нагревании триэтилбората с серной кислотой до 140—150° С, как и можно было ожидать, образуются этилсерная кислота, этилен, метаборная кислота и вода с азотной кислотой получаются этилнитрат и борная кислота. При нагревании этилбората с карбоновыми кислотами (уксусной, бензойной, янтарной, щавелевой) образуются соответствующие этиловые эфиры. Описан способ получения ацетатов, основанный на этой реакции (Hirao et al., 1953) из борной кислоты и спирта получают алкилборат, который нагревают с ледяной уксусной кислотой, не выделяя его из реакционной смеси [c.31]
Диэтиловый эфир энергично реагирует с трехиодистым бором, образуя жидкий продукт, из которого после обработки водой получаются йодистый этил, борная кислота и спирт. Реакция идет по уравнен1 11г [c.257]
Оксосинтезу подвергались также богатые олефинами углеводородные газы и бензины крекинга немецкой, венгерской и румынской нефтей масла, полученные при сухой перегонке эстонских и шведских сланцев полукоксо-вые буроугольные смолы и масла жидкофазной гидрогенизации угля. В большинстве случаев оксореакцию удавалось осуществить без предварительной очистки масел. Для буроугольной смолы желательна предварительная обработка едким натром и разбавленными кислотами. В случае гидроформилирования олефинов, полученных из нефтяных продуктов, были необходимы несколько более высокие температуры, в остальном же реакция протекала гладко. В присутствии сернистых соединений гидрирование несколько замедлялось. Полученные спирты разделяли частично с помощью дестилляции и частично путем перевода их в сложные эфиры борной кислоты [131. Спирты обычно представляли собой бесцветные или светложелтые жидкости со слабым ароматическим запахом. Они плавились при низких температурах и имели поразительно высокую плотность, что, вероятно, обусловлено присутствием циклических компонентов. Сульфаты, изготовленные из этих спиртов и хлор-сульфоновой кислоты, являлись хорошими моющими средствами. [c.386]
[c.386]
Найдено [9], что смеси борных кислот с гликолем или глицерином становятся со временем более вязкими но мере удаления воды дистилляцией. Реакция борной кислоты со спиртами характеризуется большой скоростью и обратимостью. Поэтому высокие молекулярные веса могут получиться с полиспиртами при непрерывном удалении воды, образующейся в процессе этерификации. Определения структуры получающихся при этом продуктов не производили, но, без сомнения, эти структуры очень сложны. Вследствие трехвалентности бора неизбежно образование поперечных связей между цепями. Вероятны также кольца неполимерной структуры. Кроме того, ввиду предельной лабильности реакций обмена для связи бор — кислород типы структур зависят не только от метода получения, но и от всей предыстории материала. Например, включение небольших количеств воды резко уменьшает молекулярные веса смол. Стаут и Чемберлен [91], а также Гоулд [40] попытались получить упорядоченные полимеры из гликоля и борной кислоты, но потерпели неудачу. [c.145]
Высшие жирные спирты получают аналогично ВЖК окислением парафина в жидкой фазе, но в иных условиях. Сырье окисляется при температуре 165—170 С азотокислородной смесью, содержапцей 3—5% кислорода, без катализатора. Чтобы избежать дальнейшего окисления образуюш ихся спиртов, процесс ведется в присутствии борной кислоты, дающ,ей со спиртами триалкилбораты (ЕО)зВ. Они легко выводятся из сферы реакции. В результате цепь окислительных превращений прерывается, обеспечивая селективность процесса. Борную кислоту в количестве 5% от массы парафина вводят в виде суспензии в парафине. Так как в этом случае процесс окисления протекает без разрыва углеродной цепи, то для получения спиртов с достаточно высокой молярной массой используют так называемые мягкие парафины Сю—Сго- Оксидат имеет состав ВЖС — 67%, ВЖК — 11,5%, низкомолекулярные продукты окисления — 12%, кубовый остаток 11,5%. [c.291]
По наблюдению Кохенхаузена [7], холестерин пе этерифи-цируется серной кислотой, а превращается в нерастворимый холестерон. Позднее запатентован способ [21] получения алкил-серной кислоты из спирта этого типа, заключающийся в предварительной этерификации спирта борной кислотой с последующим прибавлением реакционной смеси к 90%-ной серной кислоте. Возможно применение и более концентрированной серной кислоты. Наиболее благоприятной температурой превращения олеилового спирта в эфир действием серной кислоты является 30″” [22]. При более низкой температуре увеличивается значение реакции присоединения по двойной связи. [c.10]
Позднее запатентован способ [21] получения алкил-серной кислоты из спирта этого типа, заключающийся в предварительной этерификации спирта борной кислотой с последующим прибавлением реакционной смеси к 90%-ной серной кислоте. Возможно применение и более концентрированной серной кислоты. Наиболее благоприятной температурой превращения олеилового спирта в эфир действием серной кислоты является 30″” [22]. При более низкой температуре увеличивается значение реакции присоединения по двойной связи. [c.10]
Однако образование комплекса катализатор – сокатализатор возможно для трехфтористого бора, но маловероятно в случае применения боралкилов или эфиров борной кислоты. Спирты не являются сокатализаторами этой реакции и, кроме того, катион типа СНдМ./ + будет терять азот вследствие неустойчивости и тогда рост цепи должен протекать через ион карбония. [c.198]
Эту реакцию можно выполнить, заменив метиловый спирт трехатомным спиртом — глицерином —, СзН5(ОН)з. В ушко платиновой проволочки взять несколько кристалликов борной кислоты, смочить ее каплей концентрированной серной кислоты и каплей глицерина. Внести в пламя горелки. Наблюдать интенсивно зеленое окрашивание пламени. [c.184]
Качественной реакцией на борную кислоту и ее соли служит реакция горения борноэтилового зфира с характерной 10леной окраской пламени. Борноэтиловый )фир обра уется при смешении борной кислоты или боратов с конце.прированной серной кислотой и этиловым спиртом [c.137]
Со спиртами борная кислота образует летучие эфиры В(ОН)з, пары которых горят зеленым пламенем (качественная реакция на бор). Для кислоты НзВОз НзО известна гетерополикислота состава Hэ[E (WзOlo)4]. Н2В4О7 можно рассматривать как продукт конденсации борной кислоты [c.478]
Аналогичные продукты реакции борная кислота и борат1.1 дают с глицерином, метанолом и другими спиртами. [c.437]
Фталоилглицилглицин [386]. Раствор 1,09 г (2,34 миллимолей) дибензилфталоилглицилфосфата в 10 мл диоксана прибавляют к раствору 0,353 г (4,7 миллимоля) глицина в 10 лл буферного раствора борная кислота — бура (полученного прибавлением 0,05 М буры к 0,2 М борной кислоты до pH 7,4). Для полного растворения прибавляют около 5 мл диоксана. Смесь выдерживают 16 час, затем выпаривают в вакууме и остаток кристаллизуют из этилового спирта получают 0,51 г (83%) Неочищенного продукта реакции, т. пл. 180—190 . После перекристаллизации из этилового спирта получают 0,478 г (78%) фталоилглицилглицина, т. пл. 229—23Г. Из маточного раствора выделяют дополнительное количество препарата, выход которого после перекристаллизации составляет 0,08 г (13%), т. пл. 227—230 [c.292]
Раствор 1,09 г (2,34 миллимолей) дибензилфталоилглицилфосфата в 10 мл диоксана прибавляют к раствору 0,353 г (4,7 миллимоля) глицина в 10 лл буферного раствора борная кислота — бура (полученного прибавлением 0,05 М буры к 0,2 М борной кислоты до pH 7,4). Для полного растворения прибавляют около 5 мл диоксана. Смесь выдерживают 16 час, затем выпаривают в вакууме и остаток кристаллизуют из этилового спирта получают 0,51 г (83%) Неочищенного продукта реакции, т. пл. 180—190 . После перекристаллизации из этилового спирта получают 0,478 г (78%) фталоилглицилглицина, т. пл. 229—23Г. Из маточного раствора выделяют дополнительное количество препарата, выход которого после перекристаллизации составляет 0,08 г (13%), т. пл. 227—230 [c.292]
По этому же методу может быть получен и н,-амиловый эфир борной кислоты, Из 792 г (9 мол.) н.-амилового спирта и 124 г(2 мол.) борной кислоты получается 510—525 г (93— 96% теоретич.) н.-амилового эфира борной кислоты с т. кип. 146—148°/16лiлi. При реакции получается обратно 210—215 г н.-амилового спирта. Во время реакции температура отгоняемых паров держится первые 2 часа отгонки при 95°, и дестиллат содержит сравнительно много воды (100 мл дестиллата содержат 56 мл воды и 44 мл н.-амилового спирта). [c.134]
Как избавиться от тараканов — Новости компаний сферы здравоохранения Екатеринбурга
Самое эффективное средство от тараканов
Есть несколько рецептов борьбы с данным видом насекомых, но самое эффективное средство от тараканов — это, несомненно, борная кислота и инсектициды. Для полноты картины можно использовать и другие препараты, и уловки, ниже будут описаны самые действенные из них.
- Борная кислота
Это сильнодействующий яд для насекомых. Как только вещество оказывается в пищеварительной системе таракана, оно незамедлительно влияет на его нервную систему и выводит ее из строя. Таракан просто гибнет от удушья, так как его легкие уже не могут контролироваться рефлекторной системой. Чаще всего борная кислота продается в аптеках.
Чаще всего борная кислота продается в аптеках.
Покупать ее следует именно в порошке. Порошок борной кислоты нужно рассыпать по местам, где чаще всего появляются тараканы, это: пространство рядом с плинтусами, унитаз, душ, рукомойники и другие места где насекомые пьют воду. Таракан пройдет по порошку и тот прилипнет к его лапкам, позже, когда он начнет их облизывать, средство попадет в пищеварительный тракт.
Также можно приготовить смесь, которая очень нравится тараканам. Для этого потребуются:
1. Картофельное пюре.
2. Яичный желток.
3. Сахар.
4. Борная кислота.
5. Мука.
Смешайте все компоненты в равных пропорциях и разложите там, где тараканы могут питаться. В отличие от метода с чистой борной кислотой, это средство они должны съесть сразу.
- Нашатырный спирт от тараканов
Спирт обладает отпугивающим эффектом для насекомых, в особенности тараканов. При его наличии они стремятся покинуть помещение. Применять нашатырный спирт лучше всего в разбавленном виде. Просто добавьте его в воду, которой будете мыть стены, пол и другие предметы кухонного или ванного интерьера. Произведите уборку и следите как вредители начнут стремительно покидать ваш дом.
Важно: использовать метод нужно несколько раз, пока тараканы не исчезнут полностью.
- Вымораживание как способ борьбы с тараканами
Так как данные насекомые не являются теплокровными, при снижении температуры они замедляют свою жизнедеятельность. Уже при +7 °C их активность практически останавливается. Естественно, использовать такой подход можно только зимой, причем в хороший мороз. Просто закройте дверь в помещение и откройте в нем окна, необходимо чтобы температура тут на протяжении одного, а лучше двух дней держалась на уровне в –10 — 15 °C.
- Ловушка для тараканов
Отличный вариант борьбы с тараканами, который помогает при их не слишком большом количестве. Тем более что ловушку можно легко сделать самому в домашних условиях.
Инструкция по изготовлению ловушки от тараканов:
— Возьмите банку с широким горлышком или глубокую миску, можно эмалированную.
— Смажьте стенки сосуда жиром или вазелиновой мазью.
— Установите на дно посудины приманку (кусочек сахара, хлеб и т. д.).
Тараканы учуют запах «вкусняшки» и потянутся за нею, но назад вернуться уже не смогут. Они элементарно прилипнут к жиру. В качестве ловушки хорошо подойдет и доработанная пластиковая бутылка. Для этого отрежьте от нее горлышко и перевернув, установите назад, но уже другой стороной. Установите сооружение на кухне или в ванной на ночь и посмотрите на его содержимое утром. Естественно, пойманных вредителей нужно истребить, для этого залейте их кипятком или обработайте инсектицидом.
- Борная кислота от тараканов
Борная кислота является лучшим народным средством для борьбы с тараканами. Существует огромное количество рецептов для ее «подачи» усатым гурманам. Достоинством данного средства является его не токсичность, применяться борная кислота от тараканов может почти в любом помещении. Но при всей своей универсальности и у этого средства есть недостатки. Главное, при использовании кислоты соблюдать правила ее применения. Возможно, иногда лучше подобрать другое средство.
Борная кислота вызывает у насекомого паралич и как следствие удушье. Смертельной дозой для одного таракана является 2 — 3 мг борной кислоты. Получается, что пакетика весом в 10 грамм хватит чтобы истребить многотысячное полчище насекомых. Но на практике дела обстоят совсем по-другому. Ведь большая часть порошка остается неиспользованной и расходуется попусту.
- Правила использования борной кислоты
Чаще всего достаточно будет насыпать кислоту тонким слоем вокруг рукомойника и в других местах ванной, например, унитаза. Именно тут вредители проводят время за водопоем, если на их пути окажется «белая смерть» гибели не миновать. Препарат нужно насыпать дорожками и в других местах, где тараканы были замечены не один раз. Перед тем как начать использование борной кислоты узнайте куда прячутся насекомые. Для этого ночью неожиданно посетите кухню и включите свет. Вы увидите убегающих тараканов, то место куда они побегут и является их домом.
Перед тем как начать использование борной кислоты узнайте куда прячутся насекомые. Для этого ночью неожиданно посетите кухню и включите свет. Вы увидите убегающих тараканов, то место куда они побегут и является их домом.
- Уничтожение тараканов при помощи инсектицидов
Некоторые инсектициды способны разделаться с надоедливыми вредителями очень быстро. Иногда это происходит за один день, а порой всего за пару часов. Но для использования такого метода нужно провести тщательную подготовку. Давайте рассмотрим вопрос подробнее. В первую очередь подберите средство (сегодня их существует очень много). Большинство современных препаратов быстро убивают тараканов.
Список наиболее эффективных средств для борьбы с тараканами:
— форсайт;
— get;
— чистый дом;
— раптор;
— хлорофос;
— raid;
— микрофос;
— дохлокс;
— комбат.
Существует также действенные средство для уничтожения клопов, это — Палач, Тетрикс, Карбофос и Фуфанон. Но так как эти насекомые относятся к химии легче, средства для борьбы с ними помогают и в войне с тараканами. Это дает возможность совместить уничтожение тараканов и клопов. В итоге вы расправитесь со всеми насекомыми за раз.
Перед тем как начать уничтожение тараканов важно убрать из квартиры всех ее жителей, включая домашних животных. Расставьте мебель таким образом, чтобы освободить доступ ко всем уголкам квартиры или дома, в которых могут прятаться тараканы. Если средство изготовлено в виде аэрозоля, то наилучшим его применением будет распыление на как можно большую поверхность пола, столов и других деталей интерьера. Обрабатывайте любые щели, это могут быть отслоившиеся участки обоев и других настенных и напольных покрытий, вентиляторные отверстия, места под коврами и, конечно же, плинтусами.
- Как избавиться от тараканов в квартире
Лучше всего посыпать порошком борной кислоты все участки где тараканы могут пить воду. Насекомые нуждаются в жидкости и обязательно пройдут по насыпанному вами порошку, а значит унесут часть его с собой. В итоге большая половина вредителей будет уничтожена. Мало того, погибнут и другие насекомые, которые будут контактировать с особью, «хлебнувшей» порошка. Если средство не помогает нужно переходить к более действенным методам, способным ответить на вопрос — как избавиться от тараканов в квартире? Это, например, инсектициды. Дело в том, что тараканы быстро обучаются и могут обойти расставленные вами ловушки.
В итоге большая половина вредителей будет уничтожена. Мало того, погибнут и другие насекомые, которые будут контактировать с особью, «хлебнувшей» порошка. Если средство не помогает нужно переходить к более действенным методам, способным ответить на вопрос — как избавиться от тараканов в квартире? Это, например, инсектициды. Дело в том, что тараканы быстро обучаются и могут обойти расставленные вами ловушки.
Бора и борная кислота для борьбы с насекомыми
Дэвид Мур
Менеджер технических служб и сертифицированный энтомолог
при участии Эрика Смита, доктора философии, Британская Колумбия
В поисках способов борьбы с вредителями в доме многие люди обращаются к буре или борной кислоте. Эти вещества, как известно, вредны для определенных видов насекомых, поэтому может показаться, что проще просто попытаться контролировать вредителей самостоятельно, чем вызвать профессионала.Однако существует много дезинформации о том, что такое бура и борная кислота и на что они способны, информация, которая также может оказаться опасной для здоровья тех, кто находится в вашем доме.
Бура и борная кислота
Бура и борная кислота – это два разных состава одного и того же соединения. Бура – это минерал, который добывается прямо из земли (форма элемента бора) и используется в чистящих средствах. Борная кислота – это извлеченная, переработанная и очищенная форма, содержащаяся в различных химических продуктах.
Некоторые распространенные применения буры:
- Стиральный порошок
- Мыло для рук
- Удобрение
Некоторые распространенные применения борной кислоты включают:
- Глазные капли
- Пестицид / инсектицид
Бура и борная кислота токсичны только при проглатывании. Продукты, содержащие их, будут маркированы только для наружного использования, но могут быть опасны для детей и домашних животных.
Продукты, содержащие их, будут маркированы только для наружного использования, но могут быть опасны для детей и домашних животных.
Как действует борная кислота
Борная кислота чаще всего используется в пестицидах, ее можно найти в форме таблеток, жидкости, порошка и в различных типах ловушек.Он убивает насекомых, всасываясь в них, отравляя их желудки, влияя на их метаболизм и истирая их экзоскелеты. У него гораздо больше шансов убить вредителей, чем у буры, из-за более мелкого зерна, которое труднее обнаружить и легче проглотить. Когда вредители контактируют с ним, будь то через ловушку или проходя по нему тонким слоем, он прилипает к ним, и они проглатывают его, очищая себя.
Большинство приманок, содержащих это соединение, обычно содержат только 5% борной кислоты, так как большое ее количество может отпугивать насекомых.Однако мелкие порошки или пыль, которые можно разложить тонким слоем, содержат 98-99 процентов борной кислоты.
Что борная кислота убивает и не убивает
Домовладельцы покупают борную кислоту для уничтожения многих видов насекомых-вредителей. Однако есть только некоторые из них, на которые он действительно повлияет, а именно насекомые, которые ухаживают за собой и поэтому проглатывают его, например, муравьи и тараканы. Вредителей, которые он не убьет, включают:
Борьба с вредителями в доме
Если вы хотите приобрести борную кислоту для использования в пестицидах и ловушках, обратите внимание, что ее необходимо тщательно контролировать, поскольку это также опасное вещество для потребления людьми.Если в доме есть дети или домашние животные, лучше всего хранить эти продукты на возвышенности и в укромных местах или вообще не хранить их.
Кроме того, борьба с вредителями своими руками может работать какое-то время, но это не поможет найти корень проблемы с вредителями. Если у вас дома есть вредители, лучше всего обратиться к профессионалам. Специалисты по борьбе с вредителями имеют доступ к передовым методам и обучению, что делает процесс намного безопаснее и проще. Компания Dodson Pest Control обладает более чем 75-летним опытом работы в отрасли, поэтому вы можете доверять нам в выполнении работы правильно.Свяжитесь с нами сегодня для бесплатного осмотра!
Компания Dodson Pest Control обладает более чем 75-летним опытом работы в отрасли, поэтому вы можете доверять нам в выполнении работы правильно.Свяжитесь с нами сегодня для бесплатного осмотра!
Re: бура и спирт – ACS Community
Hi Ethan,
Если вы просто хотите увидеть зеленый цвет, который появляется, когда вы помещаете борную кислоту в огонь, вам вообще не нужен растворитель. Просто возьмите немного порошка борной кислоты на шпатель или на петлю из стальной проволоки и поместите его в голубое пламя от природного газа (горелка Бунзена или газовая плита дает синее пламя). Вы увидите красивый зеленый цвет от борной кислоты. . Причина использования голубого пламени в том, что оно не раздражает глаза.Если вы используете желтое пламя, например, от свечи, желтый цвет будет довольно ярким, и в борной кислоте будет сложнее увидеть зеленый от бора. Но используйте борную кислоту, а не бура (тетраборат натрия). Натрий в буре дает ярко-желтое пламя, а затем вы ищете зеленый цвет из бора против ярко-желтого из натрия. Вы можете увидеть желтый цвет натрия, нанеся на шпатель поваренную соль NaCl.
Это правда, что вы можете растворить обычные химические вещества в спиртах, поместить спиртовой раствор в небольшую лампу и увидеть цвета металла в пламени, когда вы зажжете фитиль.Но, пожалуйста, Итан, сделайте это «сухим» способом, который я покажу вам ниже, и не сжигайте спиртовые растворители! Существует реальный риск получить ожог, потому что спирты (особенно метанол, который раньше использовался в школах) очень летучие. Вы идете, чтобы зажечь фитиль на сольвентной (“спиртовой”) лампе, и оказывается, что вокруг фитиля есть облако паров спирта, и вы кладете в него не только свою спичку, но и всю руку, а затем опускаете лампу. когда вы отводите руку назад. Раньше учителя проводили эту демонстрацию цвета, потому что это было слишком опасно для их учеников, но есть несколько случаев, когда ученики на расстоянии 10 футов получали ожоги, а учитель сильно обжигался, поэтому теперь мы делаем это, не поджигая алкоголь.
Вот “сухой” или безалкогольный способ увидеть цвета. Возьмите палочки для мороженого или ватные палочки и смочите их в дистиллированной или деионизированной воде, чтобы удалить натрий, который дает ярко-желтое пламя (вы можете купить деионизированную воду в супермаркетах и аптеках; это для паровых утюгов). Просушите их и поместите сухую палочку в голубое пламя, чтобы пламя не стало слишком желтым; В дереве и хлопке всегда есть натриевая соль. Затем приготовьте водные растворы борной кислоты и других солей, смочите в этих растворах палочки для мороженого или ватные палочки и высушите их.Все ваши водные растворы были бесцветными, верно? Поместите сушеную и соленую палочку эскимо в огонь и посмотрите на цвета!
B в борной кислоте зеленый.
Поваренная соль NaCl ярко-желтого цвета.
Li в LiCl имеет красный цвет, а K в хлористом или йодиде калия – лилово-розовый. Вероятно, в аптеке вы найдете и то, и другое.
Кальций оранжево-красный; Если вы живете в заснеженной стране, найдите плавильный шкаф с хлоридом кальция или купите в аптеке таблетки с добавками кальция.
Стронций в пламени ярко-красный цвет, а барий – бледно-зеленый цвет.Если вы не можете найти этих солей рядом с собой (и, возможно, вам следует держаться подальше от солей бария; они могут быть вредными для здоровья), у Анны Мари Хелменстайн есть хороший блог «Цветной огонь – Где найти соли металлов для красителей» по адресу www.oughttco.com.
Ототоксичность порошка борной кислоты на модели крысы на животных
Реферат
Введение
Борная кислота, обладающая антисептическими и кислотными свойствами, используется для лечения инфекций наружного и среднего уха.Однако мы не нашли никакой литературы о влиянии порошка борной кислоты на слизистую оболочку среднего и внутреннего уха.
Цель
Целью данного исследования является изучение возможных ототоксических эффектов порошка борной кислоты на функцию наружных волосковых клеток улитки и гистологические изменения слизистой оболочки среднего уха на модели крыс на животных.
Методы
В этом исследовании использовали двадцать здоровых половозрелых крыс-альбиносов линии Wistar. Крысы были разделены на две группы, группу A и группу B, каждая из которых состояла из 10 крыс.Первоначально животные в каждой группе подвергались тестированию отоакустической эмиссии продуктов искажения их правого и левого уха. После первого испытания отоакустической эмиссии продукта искажения использовали хирургический микроскоп для создания небольшой перфорации в обоих ушах крыс в каждой группе, а второй тест отоакустической эмиссии продукта искажения использовали для измерения обоих ушей у всех крыс. Порошок борной кислоты наносили на правое среднее ухо крыс, используя перфорацию барабанной перепонки, и измеряли отоакустическую эмиссию продукта искажения сразу после нанесения порошка борной кислоты.Гистологические изменения и отоакустическая эмиссия продуктов искажения оценивались через три дня в группе A и через 40 дней в группе B.
Результаты
Не было обнаружено значительных различий на всех частотах отоакустической эмиссии продуктов искажения. В группе А легкое воспаление слизистой среднего уха было обнаружено на третьи сутки после нанесения порошка борной кислоты. В группе B порошок борной кислоты вызывал легкие воспалительные изменения на 40-й день, которые со временем уменьшились.Эти изменения не привели к значительному фиброзу слизистой оболочки.
Заключение
У крыс порошок борной кислоты вызывает легкое воспаление слизистой оболочки среднего уха и не оказывает ототоксического действия на функцию наружных волосковых клеток улитки во внутреннем ухе крыс.
Resumo
Introdução
O ácido bórico, que tem propriedades antissépticas e ácidas, é usado para tratar infcções de orelha externa e média. Нет entanto, não encontramos nenhuma literatura sobre o efeito do ácido bórico em pó sobre a mucosa da orelha interna e da mucosa da orelha média.
Objetivo
Investigar Possíveis efeitos ototóxicos do ácido bórico em pó sobre a função das células ciliadas externas cocleares e alterações histológicas na mucosa da orelha média em um modelo animal.
Método
Vinte ratos Wistar albinos maduros e saudáveis foram utilizados neste estudo. Os ratos foram divididos em dois grupos, Grupo A e Grupo B, cada um dos quais com 10 ratos. Inicialmente, os animais de cada grupo foram submetidos a testes de emissões otoacústicas – produto de distorção, nas orelhas direita e esquerda.Após o primeiro teste de emissões otoacústicas – produto de distorção, utilizou-se um microscópio cirúrgico para fazer uma pequena perfuração em ambas as orelhas dos ratos em cada grupo, e um segundo teste de foto de emissõçali produo de medúnía de medión как orelhas em todos os ratos. O ácido bórico em pó foi aplicado orelha média direita dos ratos utilizando perfuração dambrana timpânica e as emissões otoacústicas – produto de distorção foram medidas imediatamente após a aplicação de ácido póbó.Как alterações histológicas e emissões otoacústicas – produto de distorção foram avaliadas três dias depois no Grupo A e 40 dias depois no Grupo B.
Resultados
Não foram encontradas differençõesçasçastivas de emactivas de es de es de es de es de es. No Grupo A, foi observada uma ligeira excão da mucosa da orelha média no terceiro dia após a aplicação de ácido bórico em pó. Нет Grupo B, o ácido bórico em pó causou leves alterações excalatórias após 40 dias, que diminuíram ao longo do tempo.Essas alterações não levaram à фиброза, значимая для слизистой оболочки.
Заключение
Em ratos, o ácido bórico em pó causa influenação leve na mucosa da orelha média e não tem efeitos ototóxicos na função das células ciliadas externas da cóclea na orelha interna.
Ключевые слова
Борная кислота
Ухо
Отоакустическая эмиссия
Крысы
Palavras-chave
Ácido bórico
Ouvido
Emissões otoacústicas 0
Реферативные статьи Associação Brasileira de Otorrinolaringologia e Cirurgia Cérvico-Facial.Опубликовано Elsevier Editora Ltda.
Рекомендуемые товары
Ссылки на статьи
Борная кислота | Encyclopedia.
 com
comОБЗОР
Борная кислота (BORE-ik ASS-id) представляет собой бесцветный, белый или бесцветный порошок или кристаллическое вещество без запаха или запаха со слегка маслянистым ощущением, которое медленно разлагается при нагревании, превращаясь сначала в метаборную кислоту (HBO 2 ), затем к пироборной кислоте (H 2 B 4 O 7 ) и, в конечном итоге, к оксиду бора (B 2 O 3 ).Растворимость соединения во многом зависит от температуры. В холодной воде около 5 граммов (0,2 унции) борной кислоты растворяется в 100 мл (3,4 унции) воды, а при 100 ° C (212 ° F) ее растворимость увеличивается до 25 граммов (0,9 унции) в 100 мл ( 3,4 унции) воды.
ОСНОВНЫЕ ФАКТЫ
ДРУГИЕ НАИМЕНОВАНИЯ:
Ортоборная кислота; ортоборат водорода; борная кислота
ФОРМУЛА:
H 3 BO 3
ЭЛЕМЕНТЫ:
Водород, бор, кислород
ТИП СОЕДИНЕНИЯ:
Неорганическая кислота
СОСТОЯНИЕ:
ВЕС:
9002 МОЛЕКУЛЯРНЫЙ 61.83 г / мольТОЧКА ПЛАВЛЕНИЯ:
170,9 ° C (339,6 ° F)
ТОЧКА КИПЕНИЯ:
Разлагается выше точки плавления
РАСТВОРИМОСТЬ:
Слабо растворим в воде, этиловом спирте и глицерине
Борная кислота встречается в естественных условиях в ряде мест, где она выпала из горячих источников. Это может происходить тогда в форме минерала сассолита. Учитывая его изобилие в природе, неудивительно, что это соединение было известно и использовалось людьми на протяжении многих веков.Например, известно, что греки использовали борную кислоту в качестве антисептика, для консервирования продуктов и в качестве чистящего средства. Считается, что первым, кто приготовил борную кислоту в Европе, был немецкий химик Вильгельм Хомберг (1652–1715), который в 1702 году обработал натуральную буру (Na 2 B 4 O 7 · 10H 2 O). с кислотой, чтобы получить продукт, который он назвал седативной солью, вероятно, формой борной кислоты. Химическая структура соединения была определена в 1808 году французскими исследователями Луи-Жозефом Гей-Люссаком (1778–1850) и Луи-Жаком Тенаром (1777–1857).
Химическая структура соединения была определена в 1808 году французскими исследователями Луи-Жозефом Гей-Люссаком (1778–1850) и Луи-Жаком Тенаром (1777–1857).
КАК ЭТО ПРОИЗВОДИТСЯ
Наиболее распространенный метод получения борной кислоты – обработка относительно большого количества буры соляной или серной кислотой и кристаллизация борной кислоты, которая образуется в реакции. Менее распространенный метод приготовления включает обработку солевых растворов буры хелатирующим агентом, который связывается с боратами, присутствующими в рассоле, которые затем могут быть преобразованы в борную кислоту.
ОБЫЧНОЕ ИСПОЛЬЗОВАНИЕ И ПОТЕНЦИАЛЬНАЯ ОПАСНОСТЬ
Наибольшее количество борной кислоты используется в производстве термостойкого (боросиликатного) стекла, стекловолокна, фарфоровых эмалей, посуды, лабораторной посуды и других специализированных видов стекла и керамики. материалы.В 2004 году на эти цели было направлено около 80 процентов всей борной кислоты, используемой в США. Хотя на его долю приходится гораздо меньшее количество борной кислоты, еще одно хорошо известное применение этого соединения – это антисептик в жидких средах для промывания глаз, мазях и жидкостях для полоскания рта. Он также используется в качестве консерванта в пищевых продуктах и как фунгицид для цитрусовых культур. В США на фруктах, обработанных борной кислотой, допускается содержание не более 8 частей на миллион.
Интересные факты
- Наиболее распространенными источниками борной кислоты являются горячие источники и вулканические объекты, такие как минеральные источники в Виши и Экс-ла-Шапель во Франции и Висбадене в Германии, вокруг вулканических регионов Тосканы в Италии и в сухих озерах Калифорнии и Невады, таких как Калифорнийское озеро Боракс.
- Борная кислота когда-то использовалась в качестве ингредиента в тальке и порошках для подгузников, а также в мазях от опрелостей из-за ее антисептических свойств. Однако в конечном итоге это соединение было запрещено для такого использования, когда регулирующие органы решили, что он слишком токсичен, если случайно попал в организм через открытую рану или при проглатывании.

Некоторые другие важные области применения борной кислоты включают следующее:
- При производстве огнестойких материалов;
- В качестве пестицида для лечения тараканов, куропаток, термитов, блох, огненных муравьев, многоножек, кузнечиков и слизней;
- В качестве флюса при сварке и пайке;
- При синтезе многих соединений бора;
- Завершить производство кожаных и меховых изделий;
- При производстве латексных красок; и
- При никелировании металлических изделий.
Борная кислота токсична при проглатывании. Это вызывает тошноту, рвоту, диарею и спазмы желудка. В крайних случаях это может вызвать коллапс системы кровообращения, делирий, судороги, кому и смерть. Проглатывание не более 5 граммов (0,2 унции) борной кислоты может вызвать смерть младенца. Проглатывание от 15 до 20 граммов (от 0,5 до 0,7 унции) взрослым также может быть смертельным. Борная кислота также может вызывать раздражение кожи, что в крайних случаях может привести к состоянию, известному как боризм.Боризм характеризуется сухостью кожи, высыпаниями на коже и слизистых оболочках и желудочными расстройствами.
Слова, которые нужно знать
- РАСТВОР ДЛЯ РАСТВОРА
- Раствор, насыщенный или почти насыщенный хлоридом натрия или другими неорганическими солями.
- Хелатирующий агент
- Органическое соединение, которое связывает (“захватывает”) какое-то конкретное соединение или соединения, присутствующие в смеси.
- FLUX
- Материал, понижающий температуру плавления другого вещества или смеси веществ или используемый для очистки металла.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
«Бура, борная кислота и бораты». ИПМ Аляски. http://www.ipmofalaska.com/files/Borates.html (по состоянию на 12 октября 2005 г.).
«Борная кислота: техническое описание». Manufacturas Los Andes. http://www.mandes.com.ar/technic-boric-acid. php (по состоянию на 12 октября 2005 г.).
php (по состоянию на 12 октября 2005 г.).
Поттер, Майк. «Устранение тараканов». Энтомологический университет Кентукки. http://www.uky.edu/Agriculture/Entomology/entfacts/struct/ef614.htm (по состоянию на 12 октября 2005 г.).
Ортоборная кислота, бура, тетраборат натрия, сухага
Ортоборная кислота и бора
Источник: web elements.com
Ортоборная кислота (H 3 BO 3 )
Формы приготовления:1) Из нитрида бора:
При проточном гидролизе нитрида бора (BN) получается борная борная кислота:
BN + 3H 2 O ——-> H 3 BO 3 + NH 3
2) Из буры:
Na 2 B 4 O 7 + H 2 SO 4 ——–> H 2 B 4 O 7 + Na 2 SO 4
H 2 B 4 O 7 + 5H 2 O ———> 4H 3 BO 3
Недвижимость:i) Это слабая одноосновная кислота.
ii) Трудно растворим в воде при комнатной температуре.
iii) Эффект тепла:
При нагревании разлагается с образованием борного ангидрида.
4) Реакция с этиловым спиртом:
При реакции борной кислоты с этиловым спиртом образуется этилборат, который горит зеленым пламенем.
3C 2 H 5 OH + H 3 BO 3 ———-> (C 2 H 5 ) 3 BO 3 + 3H 2 O
5) sp
2 гибридизация присутствует в БОРОНе H 3 BO 3 . Использование ортоборной кислоты: i) Как антисептик в кремах для лица, пудре и других косметических средствах.
ii) При изготовлении лекарств для глаз.
Бура (тетраборат натрия) Na 2 B 4 O 7 . 10H 2 OОбщее название: Сухага
Формы приготовления:По реакции колеманита и Na 2 CO 3 раствор:
Ca 2 B 6 O 11 + Na 2 CO 3 ———> Na 2 B 4 O 7 + CaCO 3 + NaBO 2
Недвижимость:i) Бесцветное кристаллическое твердое вещество, растворимое в воде.
ii) Гидролиз: его водный раствор является щелочным из-за гидролиза. При гидролизе получают сильное основание NaOH.
Na 2 B 4 O 7 +7 H 2 0 ———> 4 H 3 BO 3 +2 NaOH
iii) Эффект тепла:
Na 2 B 4 O 7 . 10H 2 O ——–> Na 2 B 4 O 7 + 10H 2 O
Na 2 B 4 O 7 ———-> 2NaBO 2 + B 2 O 3
(метаборат натрия) (борный ангидрид)
Образуется прозрачный шарик из метабората натрия и борного ангидрида.
Использует:
1) Используется для изготовления стекла, мыла и свечей.
2) Испытание шариком буры
Боракс нагревается на петле из платиновой проволоки, после чего формируется прозрачный шарик из B 2 O 3 и NaBO 2 . Эта бусина называется бура из буры . Этот тест используется для определения цветных основных радикалов, присутствующих в смеси, таких как Cu ++ , Fe ++ , Fe 3+
Na 2 B 4 O 7 . 10 H 2 O ———-> Na 2 B 4 O 7 + 10H 2 O
10 H 2 O ———-> Na 2 B 4 O 7 + 10H 2 O
Na 2 B 4 O 7 ———> 2NaBO 2 + B 2 O 3
CuSO 4 + B 2 O 3 ———> Cu (BO 2 ) 2 + SO 3
Поли (виниловый спирт борная кислота) -Диклофенак Натриевая соль Системы доставки лекарств: экспериментальные и теоретические исследования
Основная цель статьи состояла в моделировании высвобождения лекарства с помощью мультифрактальной теоретической модели в качестве ценного метода оценки механизма высвобождения лекарства .Для этого были приготовлены пленки для доставки лекарств путем смешивания лекарственного средства натриевой соли поливинилового спирта, борной кислоты (PVAB) и диклофенака (DCF) в различных массовых соотношениях от 90/10 до 70/30, чтобы получить системы доставки лекарств с разные скорости выпуска. Различное содержание лекарства в трех системах было подтверждено анализом энергодисперсионной спектроскопии (EDAX), а особенности инкапсуляции были исследованы методами сканирующей электронной микроскопии (SEM), атомно-силовой микроскопии (AFM) и поляризованной оптической микроскопии (POM).Способность матрицы PVAB закреплять DCF оценивали с помощью инфракрасной спектроскопии с преобразованием Фурье (FTIR). Высвобождение in vitro натриевой соли диклофенака из составов исследовали в биомиметических условиях (и 37 ° C) с помощью УФ-видимой спектроскопии, измерения оптической плотности лекарственного средства при 275 нм и аппроксимации результатов на ранее построенной калибровочной кривой. . Оценка кинетики высвобождения лекарственного средства была выполнена путем подбора трех традиционных математических моделей на экспериментальных данных высвобождения.Кроме того, доставка лекарства моделировалась фрактальной теорией движения, в которой динамика высвобождения комплексной системы полимер-лекарство описывалась различными «режимами» типа Риккати. Для объяснения такой динамики задействована мультифрактальная самомодуляция в виде удвоения периода, квазипериодичности, перемежаемости и т. Д., А также мультифрактальная самомодуляция сетевого типа. Стандартная динамика высвобождения объяснялась мультифрактальным поведением типа временного кинка. Хорошая корреляция между традиционными математическими моделями и новой предложенной теоретической моделью продемонстрировала применимость мультифрактальной модели для исследования высвобождения лекарства.
Для объяснения такой динамики задействована мультифрактальная самомодуляция в виде удвоения периода, квазипериодичности, перемежаемости и т. Д., А также мультифрактальная самомодуляция сетевого типа. Стандартная динамика высвобождения объяснялась мультифрактальным поведением типа временного кинка. Хорошая корреляция между традиционными математическими моделями и новой предложенной теоретической моделью продемонстрировала применимость мультифрактальной модели для исследования высвобождения лекарства.
1. Введение
Доставка лекарств – одна из важнейших областей медицины и здравоохранения, в которой инновационные материалы играют решающую роль [1, 2]. Сочетая различные подходы и разные системы, доставка лекарств направлена на транспортировку фармацевтически активных соединений в пределах живого организма, создавая основу для его терапевтического эффекта. Универсальность и множество систем, используемых для доставки лекарств, обусловлены широким спектром как лекарств, так и носителей лекарств [3–8], учитывая, что одна и та же активная молекула, инкапсулированная в другом носителе, получает новую жизнь благодаря внутренним свойствам. носителей, но также из-за взаимодействий, установленных между матрицей и лекарственным средством.Более того, существование множества путей введения, таких как пероральный, назальный, глазной и внутривенный, делает область доставки лекарств сложной, требующей постоянного развития и инноваций [9, 10].
Диклофенак (DCF) – нестероидный противовоспалительный препарат (НПВП), часто используемый для облегчения острых или хронических болезненных состояний. Он эффективен при лечении острой послеоперационной боли [11], остеоартроза, ревматоидного артрита, анкилозирующего спондилита, внесуставного ревматизма [12], панкреатита [13], урологических заболеваний [14] и т. Д.Более того, недавние данные показали, что DCF также может ингибировать опухолевый ангиогенез некоторых линий раковых клеток [15]. Похоже, что общая причина его противовоспалительной и противоопухолевой эффективности заключается в его способности ингибировать фермент циклооксигеназу [14]. DCF, который является мощным ингибитором синтеза ЦОГ-2 и простагландина E2, проявляет ряд эффектов на иммунную систему, ангиогенный каскад, химио- и радиочувствительность и метаболизм опухоли. Тем не менее, ингибирование этого фермента также было связано с побочными эффектами, такими как желудочно-кишечные расстройства, реакция гиперчувствительности печени, иммунная гемолитическая анемия и иммунная тромбоцитопения.Систематические исследования показали, что эти побочные эффекты вызваны взаимодействием метаболических и иммунологических факторов, и их частота выше у пациентов, принимающих DCF в дозе более 150 мг / сут [16]. Более того, низкая биодоступность DCF, достигаемая при пероральном введении, вызывает серьезную озабоченность, поскольку его присутствие в окружающей среде создает проблемы для здоровья водных организмов, растений и млекопитающих и привело к развитию штаммов, устойчивых к лекарствам [17]. В этом контексте существует постоянная озабоченность по поводу поиска новых путей для эффективного введения DCF, которые должны минимизировать побочные эффекты.С этой целью дизайн составов для пролонгированного высвобождения DCF сохраняет обещание потенциального решения. Многие системы были разработаны и исследованы на основе инкапсуляции DCF в обширную область полимерных матриц на основе карбоксиметилцеллюлозы [18], мембран из фиброина шелка [19], хитозана [6], поливинилового спирта [20–23], поли (D, L-молочная кислота-гликолевая кислота) [24], поли (D, L-лактид-со-гликолид) [25–28], поли (эпсилон-капро / D, L-лактид) [29] , поли (малеиновый ангидрид-альт-2-метоксиэтилвиниловый эфир) [30, 31], пектин [32] и так далее.Эти данные показали, что пролонгированного высвобождения диклофенака можно достичь с помощью полимерных матриц, способных развивать межмолекулярные силы с молекулами диклофенака [6, 33]. Учитывая все это, мы разработали новые рецептуры на основе диклофенака и поливинилового спирта борной кислоты [4]. Рациональный дизайн был основан на идее сильных межмолекулярных сил между электронодефицитным атомом бора PVAB и сложноэфирными группами диклофенака, которые должны гарантировать хорошее закрепление лекарства в матрице [34–37] и, следовательно, медленное высвобождение.
DCF, который является мощным ингибитором синтеза ЦОГ-2 и простагландина E2, проявляет ряд эффектов на иммунную систему, ангиогенный каскад, химио- и радиочувствительность и метаболизм опухоли. Тем не менее, ингибирование этого фермента также было связано с побочными эффектами, такими как желудочно-кишечные расстройства, реакция гиперчувствительности печени, иммунная гемолитическая анемия и иммунная тромбоцитопения.Систематические исследования показали, что эти побочные эффекты вызваны взаимодействием метаболических и иммунологических факторов, и их частота выше у пациентов, принимающих DCF в дозе более 150 мг / сут [16]. Более того, низкая биодоступность DCF, достигаемая при пероральном введении, вызывает серьезную озабоченность, поскольку его присутствие в окружающей среде создает проблемы для здоровья водных организмов, растений и млекопитающих и привело к развитию штаммов, устойчивых к лекарствам [17]. В этом контексте существует постоянная озабоченность по поводу поиска новых путей для эффективного введения DCF, которые должны минимизировать побочные эффекты.С этой целью дизайн составов для пролонгированного высвобождения DCF сохраняет обещание потенциального решения. Многие системы были разработаны и исследованы на основе инкапсуляции DCF в обширную область полимерных матриц на основе карбоксиметилцеллюлозы [18], мембран из фиброина шелка [19], хитозана [6], поливинилового спирта [20–23], поли (D, L-молочная кислота-гликолевая кислота) [24], поли (D, L-лактид-со-гликолид) [25–28], поли (эпсилон-капро / D, L-лактид) [29] , поли (малеиновый ангидрид-альт-2-метоксиэтилвиниловый эфир) [30, 31], пектин [32] и так далее.Эти данные показали, что пролонгированного высвобождения диклофенака можно достичь с помощью полимерных матриц, способных развивать межмолекулярные силы с молекулами диклофенака [6, 33]. Учитывая все это, мы разработали новые рецептуры на основе диклофенака и поливинилового спирта борной кислоты [4]. Рациональный дизайн был основан на идее сильных межмолекулярных сил между электронодефицитным атомом бора PVAB и сложноэфирными группами диклофенака, которые должны гарантировать хорошее закрепление лекарства в матрице [34–37] и, следовательно, медленное высвобождение. Высвобождение in vitro было исследовано в среде, имитирующей жидкости организма, и кинетика высвобождения лекарственного средства была оценена путем сопоставления данных с тремя традиционными математическими моделями. Следующим шагом в исследовании таких новых систем было математическое моделирование высвобождения диклофенака с помощью фрактальной теории движения, нового подхода, который предлагает различные преимущества по сравнению с другими хорошо известными эмпирическими и полуэмпирическими моделями.
Высвобождение in vitro было исследовано в среде, имитирующей жидкости организма, и кинетика высвобождения лекарственного средства была оценена путем сопоставления данных с тремя традиционными математическими моделями. Следующим шагом в исследовании таких новых систем было математическое моделирование высвобождения диклофенака с помощью фрактальной теории движения, нового подхода, который предлагает различные преимущества по сравнению с другими хорошо известными эмпирическими и полуэмпирическими моделями.
2. Материалы и методы
Натриевая соль диклофенака (DCF), борная кислота поливинилового спирта (PVAB) и этанол (> 99.8%) были приобретены у Sigma Aldrich и использовались без какой-либо предварительной очистки, а бидистиллированная вода была получена в лаборатории.
2.1. Приготовление систем доставки лекарств
Системы доставки лекарств были получены методом разделения фаз, индуцированным растворителем, с помощью трех последовательных циклов 30-минутного перемешивания / 5-минутного вихря, примененного к смеси растворов PVAB и DCF в различных массовых отношениях [38, 39]. Точнее, к 10 мл раствора ПВАБ 7,5% в воде добавляли 1.666, 3,75 и 6,42 мл раствора DCF в этаноле (5%), что приводит к трем различным составам, D1, D2 и D3, содержащим разное количество лекарств. После третьего цикла растворы разливали в чашки Петри и сушили при комнатной температуре, что приводило к образованию самостоятельных гибких пленок (рис. 1).
2.2. Оценка кинетики высвобождения DCF
Способность полученных препаратов высвобождать инкапсулированное лекарственное средство контролировали in vitro в соответствии с ранее описанной процедурой [4].Кусочки пленок из составов D1-D3, содержащих такое же количество лекарственного средства (14 мг), использовали при определении высвобождения in vitro . Образцы имели размер от ~ 1 см 2 до ~ 3 см 2 в зависимости от содержания лекарства. Их погружали в 10 мл PBS,. Чтобы имитировать условия in vivo , температуру поддерживали постоянной на уровне 37 ° C на протяжении всего эксперимента. Время от времени 2 мл супернатанта удаляли и заменяли свежим PBS. Поглощение лекарственного средства DCF в супернатанте оценивали с помощью спектроскопии UV-Vis и коррелировали с концентрацией с помощью предварительно построенной калибровочной кривой на максимуме поглощения DCF от 275 нм [6].Все измерения были выполнены в трех экземплярах.
Чтобы имитировать условия in vivo , температуру поддерживали постоянной на уровне 37 ° C на протяжении всего эксперимента. Время от времени 2 мл супернатанта удаляли и заменяли свежим PBS. Поглощение лекарственного средства DCF в супернатанте оценивали с помощью спектроскопии UV-Vis и коррелировали с концентрацией с помощью предварительно построенной калибровочной кривой на максимуме поглощения DCF от 275 нм [6].Все измерения были выполнены в трех экземплярах.
Поглощение лекарственного средства измеряли на спектрофотометре PerkinElmer Lambda 35 UV-Vis.
Кинетические данные были подогнаны к трем математическим моделям, которые описаны ниже: (a) Zero – Модель заказа . , где – количество лекарственного средства, растворенного за время, и – константа высвобождения нулевого порядка (b) Higuchi Model . , где – количество лекарственного средства, высвобождающееся за время, и – константа растворения Хигучи (c) Модель Корсмейера-Пеппаса ., где – доля лекарства, высвобождаемая во времени, – константа скорости высвобождения, – показатель степени высвобождения
2.3. Математическая модель
2.3.1. Динамика высвобождения через мультифрактальные функции
Классические, обычно используемые модели обычно основаны на неоправданном в противном случае предположении, что переменные, описывающие динамику любой комплексной системы полимер-лекарство, дифференцируемы [40, 41] (подробнее см. Модели нулевого порядка , Хигучи, Корсмейер-Пеппас и др.[6]). Таким образом, успех вышеупомянутых моделей следует понимать как последовательный в областях, в которых дифференцируемость и интегрируемость все еще действительны. В противном случае дифференцируемые и интегрируемые математические процедуры неадекватны, когда динамика любой сложной системы полимер-лекарство включает в себя как нелинейность, так и хаотичность. Однако, чтобы описать такую динамику, но по-прежнему использовать дифференциальные математические процедуры, необходимо явно ввести масштабное разрешение в выражение физических переменных и неявно в выражение фундаментальных уравнений, которые управляют этой динамикой. Это означает, что любая переменная, зависящая от пространственных и временных координат в классическом смысле, будет зависеть как от пространственных и временных координат, так и от масштабного разрешения в новом математическом смысле (недифференцируемость и неинтегрируемость). Другими словами, вместо того, чтобы работать с переменной, описанной с помощью недифференцируемой функции, мы будем работать с приближениями этой математической функции, полученными при ее посредничестве при различных разрешениях масштаба. В результате любая переменная, предназначенная для описания динамики любой комплексной системы полимер-лекарство, будет функционировать как предел семейства математических функций, которые недифференцируемы для разрешения нулевой шкалы и дифференцируемы для разрешений ненулевой шкалы [42, 43].
Это означает, что любая переменная, зависящая от пространственных и временных координат в классическом смысле, будет зависеть как от пространственных и временных координат, так и от масштабного разрешения в новом математическом смысле (недифференцируемость и неинтегрируемость). Другими словами, вместо того, чтобы работать с переменной, описанной с помощью недифференцируемой функции, мы будем работать с приближениями этой математической функции, полученными при ее посредничестве при различных разрешениях масштаба. В результате любая переменная, предназначенная для описания динамики любой комплексной системы полимер-лекарство, будет функционировать как предел семейства математических функций, которые недифференцируемы для разрешения нулевой шкалы и дифференцируемы для разрешений ненулевой шкалы [42, 43].
Этот метод описания динамики любой комплексной системы полимер-лекарство явно подразумевает разработку новых геометрических структур, а также новых математических моделей, для которых законы движения, инвариантные к пространственным и временным преобразованиям, объединены с масштабными законами, инвариантными к пространственные и временные масштабные преобразования. На наш взгляд, такая геометрическая структура может быть основана на понятии «мультифрактал», а соответствующая математическая модель может быть основана на фрактальной теории движения в произвольной и постоянной фрактальной размерности.Приложения модели к анализу динамики сложных систем приведены в [44–53]. Для сложных систем с выпуском анализ динамики приведен в [54–58].
Основное предположение нашей модели состоит в том, что динамика структурных единиц любой комплексной системы полимер-лекарство будет описываться непрерывными, но недифференцируемыми кривыми движения (мультифрактальными кривыми движения). Эти мультифрактальные кривые движения демонстрируют свойство самоподобия в каждой точке, что может быть преобразовано в свойство голографии (каждая часть отражает отверстие).По сути, мы обсуждаем «голографические реализации динамики структурных единиц любой комплексной системы полимер-лекарство» через мультифрактальные «режимы» уравнений типа Риккати (описывающих динамику структурных единиц любой комплексной системы полимер-лекарство с помощью Риккати- уравнения типа при разном разрешении масштаба).
Очевидно, что для описания динамики структурных единиц любой сложной системы полимер-лекарство использовались уравнения логистического типа (которые являются частным случаем уравнений типа Риккати) [59].Однако их применимость ограничена из-за отсутствия масштабного разрешения в описании такой динамики. Первый результат в понимании вышеизложенного был дан нами в [60]. Далее мы проанализируем динамику сложных систем полимер-лекарство, используя уравнения типа Риккати с различным масштабным разрешением (мультифрактальные уравнения типа Риккати).
Рассмотрим теперь мультифрактальное уравнение типа Риккати: где – мультифрактальная масса лекарственного средства, высвобождаемого за время, – немультифрактальное время, играющее роль аффинного параметра кривых высвобождения, и, и – мультифрактальные параметры, характерные для динамики высвобождения.
Эти параметры зависят от внутренней структуры полимерной матрицы и лекарственного средства, от взаимодействий полимер-лекарственная матрица, от взаимодействий комплексной системы высвобождения с биоструктурой (которые подразумевают систему иммунитета биоструктуры) и от разрешения шкалы. .
2.3.2. Мультифрактальные переходные явления в доставке лекарств
Что касается решения мультифрактального уравнения типа Риккати (1), мы должны сначала заметить, что корни многочлена можно записать как
Выполнение гомографического преобразования это результат прямого исчисления, который является решением линейного и однородного уравнения первого порядка что позволяет решение
Следовательно, если начальное условие удобно выразить, общее решение (1) можно найти, записав (4) как
где – действительная мультифрактальная постоянная, характеризующая решение.Используя (3), мы можем записать это решение в реальном выражении:
что подчеркивает самомодуляцию характеристики типа пульсации, известную как преобразование типа Столера [61, 62], подразумевая сложную форму для этого параметра. На рисунке 2 мы представляем это явление самомодуляции через временные зависимости для различных значений и.
Получается, что динамика выброса объясняется мультифрактальной самомодуляцией (при разном масштабном разрешении, заданном максимальными значениями) в виде удвоения периода, квазипериодичности, затухающих колебаний, перемежаемости и т. Д.(особенности, продиктованные преобразованиями Фурье анализируемых величин).
С физической точки зрения фрактальное представление механизма высвобождения лекарства демонстрирует различные сценарии высвобождения. Эти сценарии описывают поведение в недифференцируемом (мезоскопическом) масштабе с локальной точки зрения, охватывая все типы взаимодействий между лекарственным средством-полимером-средой. Наша модель предсказывает сценарии высвобождения лекарства в переходном режиме до того, как взаимодействия достигнут равновесного режима высвобождения лекарства.На рисунках 2 (а) и 2 (б) можно увидеть периодическое высвобождение определенных количеств лекарства в течение контролируемого периода времени. Значимость удвоения периода важна, поскольку за каждой высокой концентрацией лекарства следует более низкая доза. На рисунках 2 (c) и 2 (d) можно увидеть, что альтернативы превращают эту динамику в более сложное поведение. Было замечено, что полезный периодический сценарий с затуханием действительно контролирует высокие дозы конкретного лекарственного средства. Прерывистое высвобождение лекарств основывалось на контролируемой модулирующей частоте (выбранной в качестве контрольного параметра).Наконец, мы достигли модулированного ответа систем высвобождения лекарства, который можно контролировать как по концентрации, так и по частоте высвобождения. В рамках фрактальной парадигмы мы можем получить различные сценарии механизма высвобождения лекарственного средства, которые помогают нам понять поведение лекарств, которым могут быть полезны такие сложные сценарии.
3D и 2D (контурный график) зависимости от и, для постоянного значения, показаны на рисунке 3. В такой ситуации динамика выброса включает мультифрактальную самомодуляцию (при различных недифференцируемых масштабных разрешениях, заданных максимальным значением значения) сетевой динамики. Общая эволюция нашей системы четко представлена на рисунке 3. Здесь мы можем видеть сценарий затухающего высвобождения лекарства, наблюдаемый для различных концентраций конкретного лекарства (контролируемый в нашей модели с помощью). Для различных недифференцируемых масштабных разрешений мы получили разные сценарии, такие как модулированное высвобождение, показанное на рисунке 3 (b), в то время как прерывистое высвобождение можно увидеть на рисунке 3 (c). Последние сценарии относятся к сложному сценарию высвобождения и сильно зависят от физических свойств полимерной матрицы и условий биологического высвобождения.Наконец, наша модель предсказывает наличие нежелательных режимов с квазихаотическим высвобождением. Стоит отметить, что полная хаотическая динамика никогда не достигается, вместо этого настройки, сделанные с помощью параметра управления, заставят систему перейти в состояние удвоения периода. Следовательно, даже когда динамика может казаться хаотичной, ее можно легко исправить в направлении более контролируемого состояния.
Общая эволюция нашей системы четко представлена на рисунке 3. Здесь мы можем видеть сценарий затухающего высвобождения лекарства, наблюдаемый для различных концентраций конкретного лекарства (контролируемый в нашей модели с помощью). Для различных недифференцируемых масштабных разрешений мы получили разные сценарии, такие как модулированное высвобождение, показанное на рисунке 3 (b), в то время как прерывистое высвобождение можно увидеть на рисунке 3 (c). Последние сценарии относятся к сложному сценарию высвобождения и сильно зависят от физических свойств полимерной матрицы и условий биологического высвобождения.Наконец, наша модель предсказывает наличие нежелательных режимов с квазихаотическим высвобождением. Стоит отметить, что полная хаотическая динамика никогда не достигается, вместо этого настройки, сделанные с помощью параметра управления, заставят систему перейти в состояние удвоения периода. Следовательно, даже когда динамика может казаться хаотичной, ее можно легко исправить в направлении более контролируемого состояния.
3. Результаты и обсуждения
Три различных препарата были получены путем комбинирования противовоспалительного препарата на основе полимерной матрицы, поли (винилового спирта, борной кислоты) и натриевой соли диклофенака в различных массовых соотношениях от 70/30% до 90/10%. .Путем заливки растворов в чашки Петри и медленного испарения воды были получены автономные гибкие пленки, которые дополнительно характеризовались с точки зрения морфологии, силы сцепления и скорости высвобождения лекарственного средства.
3.1. Морфологическая характеристика
Анализ EDAX подтвердил получение трех систем доставки лекарств с различными количествами лекарственного средства путем увеличения процентного содержания натрия и хлора, начиная с D1 до D3 (Рисунки 4 (a) –4 (c)). Соответствующие SEM-изображения показали, что DCF был гомогенно инкапсулирован в полимерную матрицу в виде микрометрических кристаллов, плотность которых зависит от массового соотношения между полимером PVAB и лекарственным средством DCF [39]. Следовательно, в случае D1, который содержит только 10% DCF, меньше микрометрических геометрических форм наблюдалось по сравнению со случаем D3, в котором плотность была намного выше (Рисунки 4 (d) –4 (f)).
Следовательно, в случае D1, который содержит только 10% DCF, меньше микрометрических геометрических форм наблюдалось по сравнению со случаем D3, в котором плотность была намного выше (Рисунки 4 (d) –4 (f)).
Чтобы получить представление о морфологии в наномасштабе, образцы были дополнительно проанализированы с помощью АСМ, который показал присутствие нанозерен во всех образцах (рис. 5).
Чтобы подтвердить кристаллическую природу инкапсулированного лекарственного средства, образцы D1-D3 были проанализированы с помощью микроскопии в поляризованном свете (рис. 6).Как видно на рисунке 7, образец имел двулучепреломляющую прямоугольную форму, характерную для кристаллов с низким молекулярным весом [63], приписываемых кристаллам лекарственного средства, в то время как полимерная матрица не имела никакого двулучепреломления из-за своей аморфной природы. Можно наблюдать, что по мере увеличения содержания лекарства размер кристаллов уменьшался, а их плотность увеличивалась, что также наблюдается для других систем на основе матрицы PVAB [34–36]. Объяснение связано с повышенной вязкостью системы, содержащей большее количество лекарственного средства, из-за более высокой плотности физических сил, возникающих между электронно-дефицитной матрицей PVAB и DCF, содержащим гетероатомы с высоким содержанием электронов.Более высокая плотность препятствовала диффузии молекул DCF и, следовательно, росту кристаллов.
3.2. Закрепление DCF в матрице PVAB
Полимер PVAB был выбран в качестве полимерной матрицы для DCF, предполагая сильные взаимодействия, которые должны закрепить лекарство, вызывая, таким образом, пролонгированное высвобождение. Чтобы исследовать их, FTIR-спектры были записаны для составов и для их компонентов (Рисунок 6). В спектрах как DCF, так и PVAB появляются множественные полосы в соответствии с их структурой следующим образом: как лекарство DCF, так и полимер PVAB представлены между 3750 и 2750 см 904 · 10 -1 две полосы при 3386 и 3262 см 904 · 10 -1 в случай DCF и полоса с двумя максимумами при 3277 и 3177 см -1 в случае полимера, которые соответствуют валентным колебаниям NH и OH соответственно [64]. В области отпечатков пальцев в спектре DCF наблюдались полосы, соответствующие валентным колебаниям связи C-Cl при 743 см -1 и колебаниям карбоксильных единиц при 1572 см -1 . Полимер PVAB также имел несколько пиков, наиболее значимые из которых приходились на 1330 и 1375 см -1 из-за колебания растяжения связи B-O и на ~ 1188 см 904 · 10 -1 из-за деформации B-OH. В спектрах композиций произошли важные изменения как в положении пика, так и в его количестве.Следовательно, в спектральной области 3750–2750 см, 904 · 10–1 , два максимума из спектра полимера смещены в сторону более высоких волновых чисел, что указывает на значительные изменения водородных связей, указывая на новые взаимодействия с молекулами DCF. Полосы, соответствующие деформации B-OH и колебаниям C-Cl, исчезли из спектра композиции, указывая на их участие в новых сильных взаимодействиях, наиболее вероятных координационных связях электронодефицитного атома бора с электронно-богатыми атомами диклофенака (например,грамм. азот, хлорид). Эти спектральные модификации ясно указывают на то, что из-за структурных особенностей как ПВАБ, так и лекарственного средства DCF, сильные взаимодействия между ними произошли в составах, причем молекулы DCF были «закреплены» в матрице PVAB сильными физическими взаимодействиями, подобно жидким кристаллам, о которых ранее сообщал нас [34–36].
В области отпечатков пальцев в спектре DCF наблюдались полосы, соответствующие валентным колебаниям связи C-Cl при 743 см -1 и колебаниям карбоксильных единиц при 1572 см -1 . Полимер PVAB также имел несколько пиков, наиболее значимые из которых приходились на 1330 и 1375 см -1 из-за колебания растяжения связи B-O и на ~ 1188 см 904 · 10 -1 из-за деформации B-OH. В спектрах композиций произошли важные изменения как в положении пика, так и в его количестве.Следовательно, в спектральной области 3750–2750 см, 904 · 10–1 , два максимума из спектра полимера смещены в сторону более высоких волновых чисел, что указывает на значительные изменения водородных связей, указывая на новые взаимодействия с молекулами DCF. Полосы, соответствующие деформации B-OH и колебаниям C-Cl, исчезли из спектра композиции, указывая на их участие в новых сильных взаимодействиях, наиболее вероятных координационных связях электронодефицитного атома бора с электронно-богатыми атомами диклофенака (например,грамм. азот, хлорид). Эти спектральные модификации ясно указывают на то, что из-за структурных особенностей как ПВАБ, так и лекарственного средства DCF, сильные взаимодействия между ними произошли в составах, причем молекулы DCF были «закреплены» в матрице PVAB сильными физическими взаимодействиями, подобно жидким кристаллам, о которых ранее сообщал нас [34–36].
3.3. Кинетика высвобождения
Кинетику высвобождения лекарственного средства DCF из составов исследовали в биомиметических условиях в PBS при pH 7.4 и 37 ° C, в соответствии с процедурой, ранее описанной в литературе (Рисунок 8) [6].
Как можно было наблюдать, образцы высвобождали инкапсулированное лекарственное средство с разными скоростями, которые зависят от количества DCF, использованного при их приготовлении. Следовательно, образец D1 высвобождает лекарство с более медленной скоростью из-за того, что он содержит только 10% лекарственного средства в 90% полимере PVAB. Это массовое соотношение между компонентами, весьма вероятно, привело к лучшему диспергированию и закреплению молекул лекарства в полимерной матрице, положительно влияя на скорость высвобождения лекарства.Когда количество препарата увеличивалось до 30%, скорость высвобождения увеличивалась, что приводило к усилению взрывного эффекта. Во всех трех случаях, независимо от количества инкапсулированного лекарственного средства, профиль высвобождения происходил в два этапа: в первые 4 часа наблюдался взрывной эффект, а в последующие часы (8-144 часа) скорость высвобождения лекарства снижалась. , что приводит к замедленному высвобождению (рис. 8, таблица 1).
Это массовое соотношение между компонентами, весьма вероятно, привело к лучшему диспергированию и закреплению молекул лекарства в полимерной матрице, положительно влияя на скорость высвобождения лекарства.Когда количество препарата увеличивалось до 30%, скорость высвобождения увеличивалась, что приводило к усилению взрывного эффекта. Во всех трех случаях, независимо от количества инкапсулированного лекарственного средства, профиль высвобождения происходил в два этапа: в первые 4 часа наблюдался взрывной эффект, а в последующие часы (8-144 часа) скорость высвобождения лекарства снижалась. , что приводит к замедленному высвобождению (рис. 8, таблица 1).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

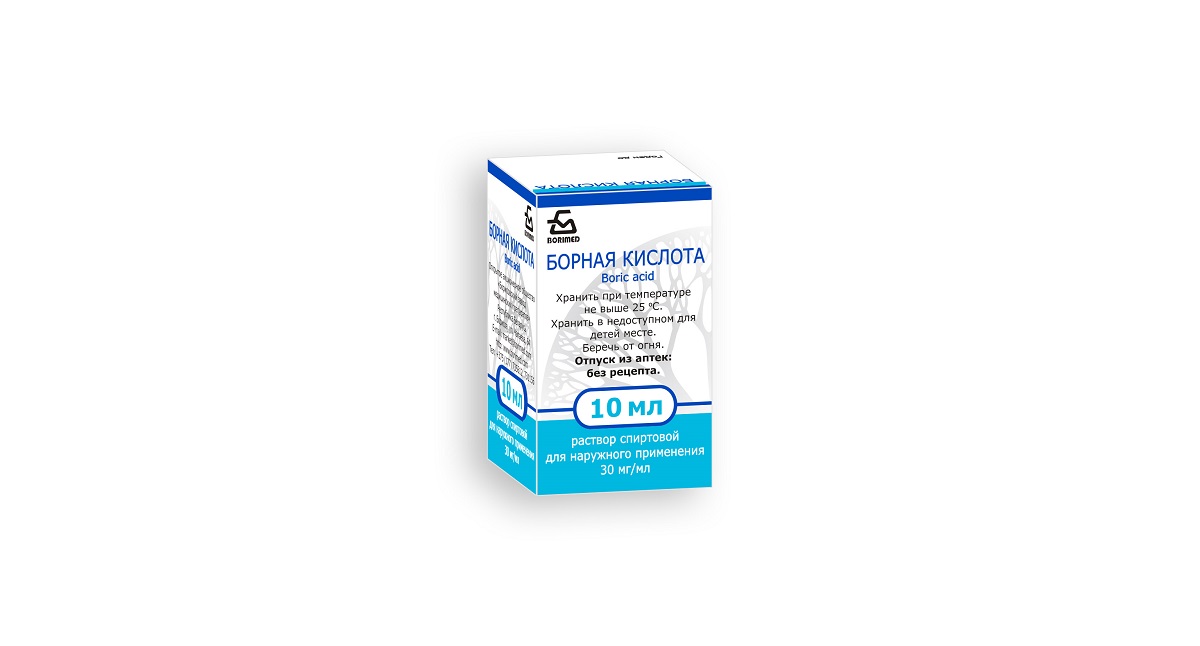
 На втором этапе кинетические модели неплохо подошли только для образца D1. Это указывает на то, что высвобождение лекарственного средства в основном регулируется эрозией матрикса на второй стадии процесса, что также подтверждается невооруженным глазом.
На втором этапе кинетические модели неплохо подошли только для образца D1. Это указывает на то, что высвобождение лекарственного средства в основном регулируется эрозией матрикса на второй стадии процесса, что также подтверждается невооруженным глазом. Точнее, различные взаимодействия полимер-лекарственное средство-среда как сложная система описываются различными «режимами» типа Риккати (мультифрактальными уравнениями типа Риккати). Мы получили несколько кинетических сценариев выброса в недифференцируемом (мезоскопическом) масштабе. Эти сценарии имитируют обычные сценарии перехода к хаосу: удвоение периода, квазипериодичность, затухающие колебания, перемежаемость и квазихаотичность. Более того, мы можем найти определенные режимы колебаний сложных сетей полимер-лекарство, где раствор типа излома соответствует устойчивому макроскопическому поведению.Решение излома будет использовано для проверки экспериментальных данных, представленных выше.
Точнее, различные взаимодействия полимер-лекарственное средство-среда как сложная система описываются различными «режимами» типа Риккати (мультифрактальными уравнениями типа Риккати). Мы получили несколько кинетических сценариев выброса в недифференцируемом (мезоскопическом) масштабе. Эти сценарии имитируют обычные сценарии перехода к хаосу: удвоение периода, квазипериодичность, затухающие колебания, перемежаемость и квазихаотичность. Более того, мы можем найти определенные режимы колебаний сложных сетей полимер-лекарство, где раствор типа излома соответствует устойчивому макроскопическому поведению.Решение излома будет использовано для проверки экспериментальных данных, представленных выше. Подгонка трех традиционных математических моделей к экспериментальным данным о высвобождении показала, что высвобождение лекарственного средства регулируется растворением и диффузией DCF на первой стадии (четыре часа) и эрозией матрицы на второй стадии (пять дней).Моделирование высвобождения лекарства с помощью фрактальной теории движения продемонстрировало несколько переходных сценариев для недифференцируемого (мезоскопического) масштаба в виде удвоения периода, квазипериодичности, затухающих колебаний, перемежаемости и квазихаотичности. Обычно такое поведение ассоциировалось со сценариями перехода к хаосу сложной системной динамики. Эти сценарии представляют собой особые режимы колебаний сложных сетей полимер-лекарство, где раствор типа излома соответствует устойчивому макроскопическому поведению.В такой ситуации, благодаря удобному выбору переменных и параметров выброса, теоретическая модель была подтверждена на основе экспериментальных данных.
Подгонка трех традиционных математических моделей к экспериментальным данным о высвобождении показала, что высвобождение лекарственного средства регулируется растворением и диффузией DCF на первой стадии (четыре часа) и эрозией матрицы на второй стадии (пять дней).Моделирование высвобождения лекарства с помощью фрактальной теории движения продемонстрировало несколько переходных сценариев для недифференцируемого (мезоскопического) масштаба в виде удвоения периода, квазипериодичности, затухающих колебаний, перемежаемости и квазихаотичности. Обычно такое поведение ассоциировалось со сценариями перехода к хаосу сложной системной динамики. Эти сценарии представляют собой особые режимы колебаний сложных сетей полимер-лекарство, где раствор типа излома соответствует устойчивому макроскопическому поведению.В такой ситуации, благодаря удобному выбору переменных и параметров выброса, теоретическая модель была подтверждена на основе экспериментальных данных. Это вещество представляет собой эффективный метод уничтожения муравьев и других вредителей, таких как термиты, жуки, блохи и тараканы. Борная кислота может сделать больше, чем просто убить насекомых, и ее можно использовать по-разному внутри и вне дома.
Это вещество представляет собой эффективный метод уничтожения муравьев и других вредителей, таких как термиты, жуки, блохи и тараканы. Борная кислота может сделать больше, чем просто убить насекомых, и ее можно использовать по-разному внутри и вне дома.