Роль хинолонов в антибактериальной терапии.Механизм действия, устойчивость микроорганизмов, фармакокинетика и переносимость | Сидоренко С.В.
Государственный научный центр по антибиотикам, Москва
Антибактериальные препараты группы хинолонов известны в медицинской практике достаточно давно. «Родословное дерево» хинолонов приведено на рисунке 1. Прототипным соединением всей группы является хлорохин. Первым представителем этой группы, внедренным в медицинскую практику в качестве антибактериального препарата в 1962 г., была налидиксовая кислота. Спектр действия налидиксовой кислоты ограничивается некоторыми грамотрицательными микроорганизмами, а область клинического применения – инфекциями мочевыводящих путей.
Рис.1. Родословное дерево хинолонов. Черным цветом выделены препараты, отозванные из медицинской практики.
Толчком к интенсивному развитию всей группы послужило введение атома фтора в 6–е положение молекулы хинолонов.
Несмотря на то, что в течение многих лет наличие атома фтора считалось обязательным условием проявления высокой антибактериальной активности, в последние годы появились активные соединения, не содержащие фтор в 6 положении (десфторхинолоны). Один из представителей этой группы гареноксацин находится на завершающих стадиях клинических испытаний.
Изложение основных свойств фторхинолонов несколько затрудняется отсутствием их общепринятой классификации.
Зарегистрированные в Российской Федерации хинолоновые препараты приведены в таблице 1. Имеются определенные перспективы регистрации в обозримом будущем в РФ гатифлоксацина и гемифлоксацина.
Механизм действия хинолонов и резистентности микроорганизмов. Мишенью действия хинолонов являются бактериальные топоизомеразы – топоизомераза IV и ДНК–гираза, ферменты, осуществляющие изменение пространственной конфигурации молекулы ДНК на различных этапах ее репликации. Каждый из ферментов состоит из четырех субъединиц. Так ДНК–гираза состоит из двух субъедииц
 Гены обоих ферментов локализованы на бактериальной хромосоме. Топоизомераза IV осуществляет разрезание на отдельные хромосомы формирующуюся в ходе репликации линейную молекулу ДНК. Одна из основных функций ДНК–гиразы заключается в снятии напряжения, возникающего впереди репликационной вилки в результате расплетения двойной спирали ДНК в ходе репликации. Ключевую роль в связывании ДНК с активным центром ДНК–гиразы играет молекула тирозина в 122 положении субъединицы А фермента. В присутствии АТФ ДНК–гираза осуществляет разрыв двухцепочечной молекулы ДНК, пропускает через образовавшийся промежуток двойную спираль и вновь сшивает разделенные нити. Таким образом, в молекулу ДНК вводится виток отрицательной суперспирализации и снимается топологическое напряжение, возникающее впереди движущейся репликационной вилки.
Модель действия хинолонов на примере связывания ципрофлоксацина с комплексом ДНК–гираза – ДНК приведена на рисунке 2 [1]. Хинолоны, обладая низкой аффинностью к свободным молекулам топоизомеразы или ДНК, проявляют высокое сродство к комплексу ДНК–фермент.
Гены обоих ферментов локализованы на бактериальной хромосоме. Топоизомераза IV осуществляет разрезание на отдельные хромосомы формирующуюся в ходе репликации линейную молекулу ДНК. Одна из основных функций ДНК–гиразы заключается в снятии напряжения, возникающего впереди репликационной вилки в результате расплетения двойной спирали ДНК в ходе репликации. Ключевую роль в связывании ДНК с активным центром ДНК–гиразы играет молекула тирозина в 122 положении субъединицы А фермента. В присутствии АТФ ДНК–гираза осуществляет разрыв двухцепочечной молекулы ДНК, пропускает через образовавшийся промежуток двойную спираль и вновь сшивает разделенные нити. Таким образом, в молекулу ДНК вводится виток отрицательной суперспирализации и снимается топологическое напряжение, возникающее впереди движущейся репликационной вилки.
Модель действия хинолонов на примере связывания ципрофлоксацина с комплексом ДНК–гираза – ДНК приведена на рисунке 2 [1]. Хинолоны, обладая низкой аффинностью к свободным молекулам топоизомеразы или ДНК, проявляют высокое сродство к комплексу ДНК–фермент.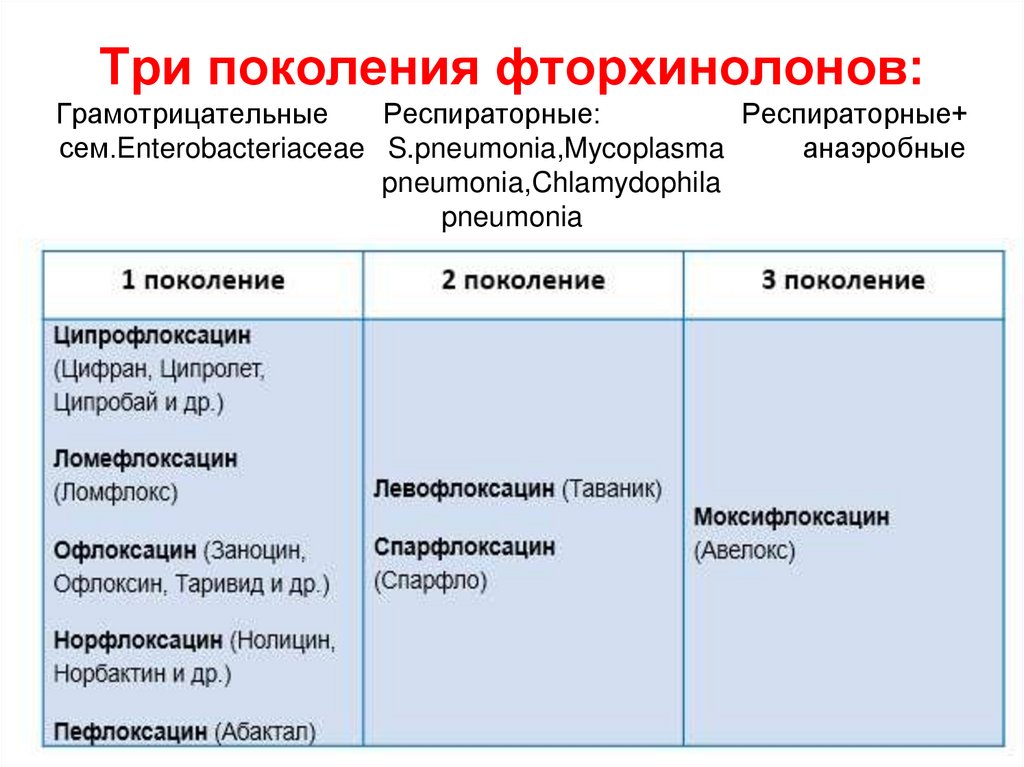 Участок связывания хинолонов с комплексом ДНК – фермент получил название «хинолоновый кармана». Необходимо вновь подчеркнуть, что в формировании «хинолонового кармана» принимают участие все субъединицы фермента молекула ДНК. После попадания хинолона в карман продвижение ДНК–гиразы вдоль молекулы останавливается, а затем останавливается и продвижение репликационной вилки. В результате происходит остановка всего процесса репликации. Кроме остановки процесса репликации в силу не совсем ясного механизма происходит образование разрывов двухцепочечной молекулы ДНК, с образованием разрывов связывают летальный эффект хинолонов.
Участок связывания хинолонов с комплексом ДНК – фермент получил название «хинолоновый кармана». Необходимо вновь подчеркнуть, что в формировании «хинолонового кармана» принимают участие все субъединицы фермента молекула ДНК. После попадания хинолона в карман продвижение ДНК–гиразы вдоль молекулы останавливается, а затем останавливается и продвижение репликационной вилки. В результате происходит остановка всего процесса репликации. Кроме остановки процесса репликации в силу не совсем ясного механизма происходит образование разрывов двухцепочечной молекулы ДНК, с образованием разрывов связывают летальный эффект хинолонов.
Рис. 2. Модель хинолонового кармана [1].
А) Взаимодействие хинолонов с молекулой ДНК, находящейся в активном центре фермента. Участки разрыва двойной спирали отмечены стрелками. Препарат представлен в виде серых прямоугольников. Предполагаемые варианты: А(i) – встраивание молекулы хинолона между нуклеотидами; А(ii) – вытеснение цитозина.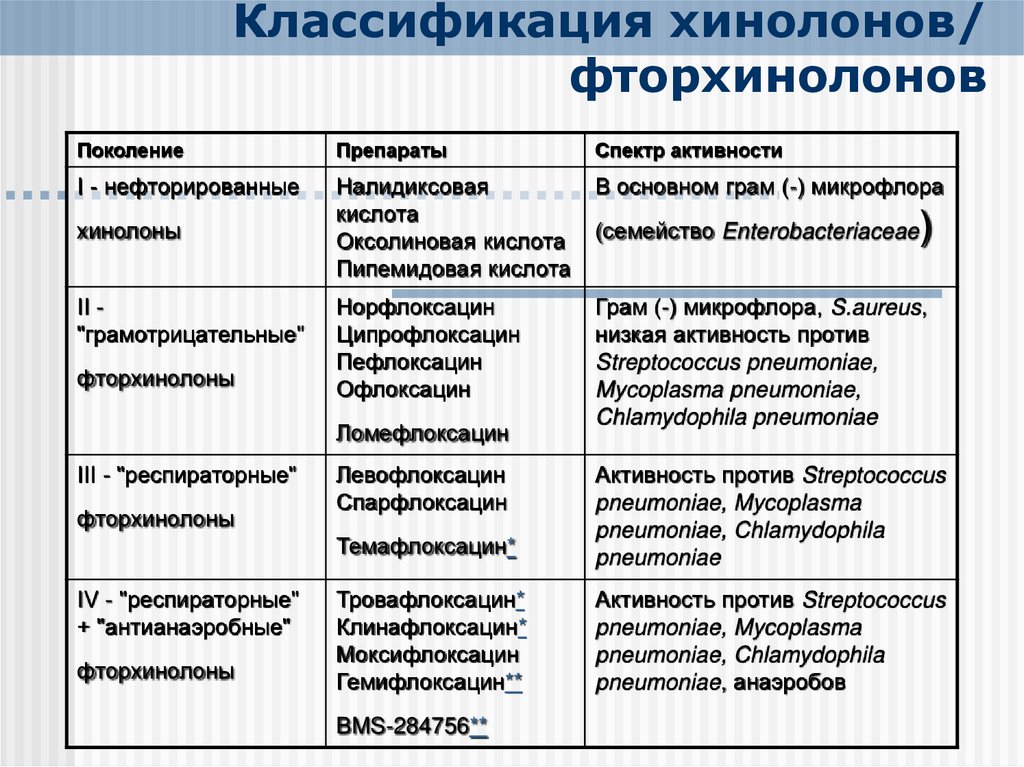
В) Хинолоновый карман в молекуле ДНК-гиразы. Нити ДНК отмечены Ось ДНК перпендикулярна к плану рисунка. Выделены аминокислотные остатки в субъединицах А и В, критичные для взаимодействия с молекулой хинолона
Частота мутаций, скорее всего не зависит от воздействия фторхинолонов и составляет 10
Поскольку топоизомеразы выполняют различные функции, то для подавления жизнедеятельности микробной клетки достаточно ингибировать активность только одного фермента, активность второго может сохраняться.
У грамотрицательных бактерий наибольшее сродство хинолоны проявляют к ДНК–гиразе, благодаря чему именно этот фермент является первичной мишенью их действия. У грамположительных ситуация менее однозначная из–за существенных противоречий между результатами, получаемыми биохимическими и генетическими методами. При использовании биохимических методов оказывается, что у S.pneumoniae для большинства хинолонов первичной мишенью действия является топоизомераза IV, ситафлоксацин и клинафлоксацин обладают приблизительно одинаковой аффинностью к обоим ферментам. По данным, полученным с помощью генетических методов, у спарфлоксацина моксифлоксацина и гатифлоксацина первичной мишенью является ДНК гираза. Гемифлоксацин, ситафлоксацин и клинафлоксацин вероятно, обладают приблизительно одинаковым сродством к обоим ферментам [2–11].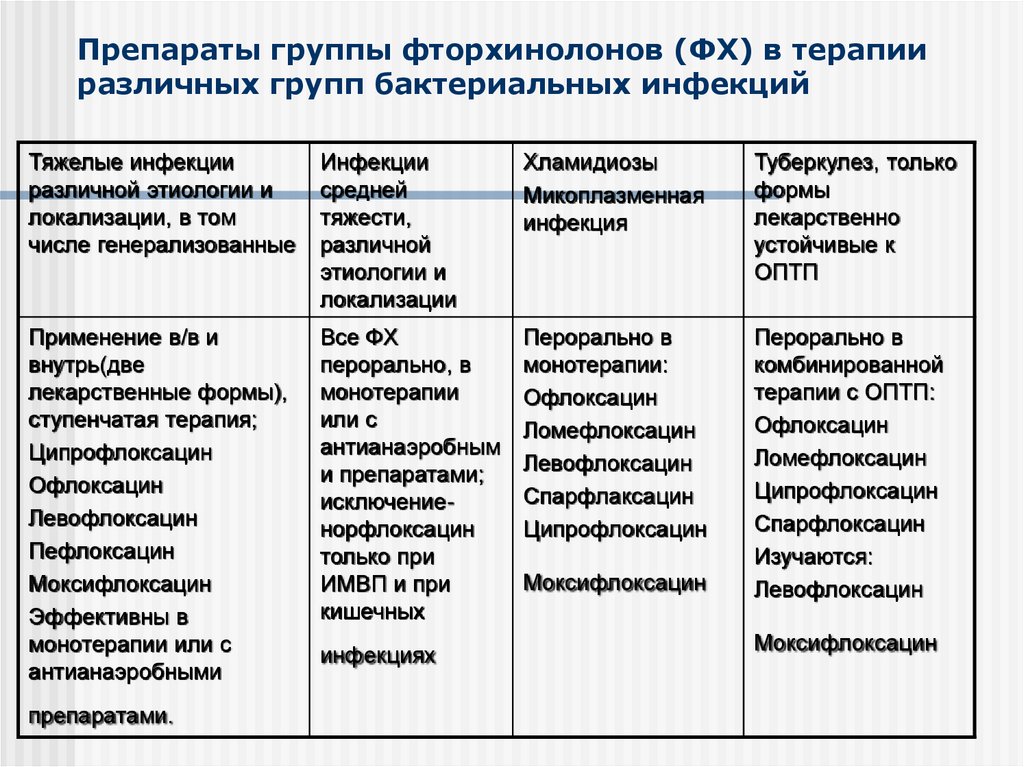
В связи с наличием у хинолонов двух мишеней действия устойчивость к ним формируется ступенеобразно. После возникновения и селекции мутаций в генах фермента, являющегося первичной мишенью антибактериальный эффект проявляется за счет подавления активности фермента, являющегося вторичной мишенью. Если воздействие хинолонов на микроорганизм продолжается, то возможно возникновение и селекция мутаций во вторичной мишени и, как следствие, дальнейшее повышение МПК. У штаммов микроорганизмов с высоким уровнем устойчивости обычно обнаруживают несколько мутаций в генах обеих топоизомераз.
Считается, что фторхинолоны, обладающие приблизительно одинаковым сродством к обеим топоизомеразам, в наименьшей степени способствуют селекции устойчивости. Это связано с тем, что для формирования устойчивого штамма мутации должны произойти одновременно в генах обоих ферментов, вероятность же двойных мутаций существенно ниже, чем одиночных.
Устойчивость к фторхинолонам может быть также связанная с активным выведением этих препаратов. Активное выведение антибактериальных препаратов (в том числе фторхинолонов) из внутренней среды бактерий осуществляют сложные белковые структуры (транспортные системы, эффлюксные насосы – efflux pumps), локализованные в цитоплазматической и внешней мембранах микробной клетки. Устойчивость, связанная с активным выведением наиболее широко распространена среди грамотрицательных бактерий. У грамположительных она встречается реже и, как правило, не достигает высокого уровня. Активному выведению в наибольшей степени подвержен норфлоксацин, в меньшей степени – ципрофлоксацин и офлоксацин. Левофлоксацин, спарфлоксацин и другие новые фторхинолоны практически не выводятся.
Активное выведение антибактериальных препаратов (в том числе фторхинолонов) из внутренней среды бактерий осуществляют сложные белковые структуры (транспортные системы, эффлюксные насосы – efflux pumps), локализованные в цитоплазматической и внешней мембранах микробной клетки. Устойчивость, связанная с активным выведением наиболее широко распространена среди грамотрицательных бактерий. У грамположительных она встречается реже и, как правило, не достигает высокого уровня. Активному выведению в наибольшей степени подвержен норфлоксацин, в меньшей степени – ципрофлоксацин и офлоксацин. Левофлоксацин, спарфлоксацин и другие новые фторхинолоны практически не выводятся.
Спектр антимикробной активности хинолонов. Данные о спектре и уровне активности хинолонов суммированы из ряда работ [12–28]. Первый хинолон – налидиксовая кислота, проявляет активность в отношении некоторых представителей семейства Enterobacteriaceae, прежде всего кишечной палочки, протея, клебсиелл. Спектр и уровень активности норфлоксацина существенно выше.
Спектр и уровень активности норфлоксацина существенно выше.
Пефлоксацин, ципрофлоксацин, офлоксацин и ломефлоксацин характеризуются значительной общностью микробиологических свойств, прежде всего сходной активностью в отношении грамотрицательных микроорганизмов. К препаратам высоко чувствительны все представители семейства Enterobacteriaceae, Haemophilus spp., Moraxella spp., Legionella spp., Neisseria spp. (МПК колеблется в пределах 0,03–0,5 мкг/мл). Менее чувствительны псевдомонады и другие неферментирующие микроорганизмы (МПК в пределах 2,0–8,0 мкг/мл). При этом необходимо отметить, что по уровню антиграмнегативной активности ципрофлоксацин несколько превосходит другие, даже наиболее новые фторхинолоны. Активность рассматриваемой группы хинолонов в отношении грамположительных микроорганизмов существенно меньше, так, в отношении стафилококков МПК колеблется в пределах 0,5–1,0 мкг/мл, а в отношении стрептококков (прежде всего пневмококков) и энтерококков в пределах 1,0–2,0 мкг/мл. Как будет указано ниже, такой уровень активности имеет ограниченное клиническое значение. Атипичные патогены (хламидии и микоплазмы) и анаэробы мало чувствительны. Некоторое клиническое значение имеет активность офлоксацина в отношении Chlamydia trachomatis.
Как будет указано ниже, такой уровень активности имеет ограниченное клиническое значение. Атипичные патогены (хламидии и микоплазмы) и анаэробы мало чувствительны. Некоторое клиническое значение имеет активность офлоксацина в отношении Chlamydia trachomatis.
Наиболее интересной и перспективной группой фторхинолонов являются так называемые «антипневмококковые» препараты. Препараты этой группы в целом отличаются повышенным сродством к топоизомеразам грамположительных бактерий и, как следствие существенно большей активностью. Причем в ряду левофлоксацин – спарфлоксацин – моксифлоксацин отмечается выраженное повышение активности. Если МПК левофлоксацина в отношении пневмококков только в 2 раза меньше, чем МПК ципрофлоксацина и офлоксацина и колеблется в пределах 0,5–1,0 мкг/мл, то для спарфлоксацина и моксифлоксацина этот показатель составляет 0,25 мкг/мл и меньше, а для клинафлоксацина (препарата, не вошедшего в медицинскую практику) и гемифлоксацина 0,06 мкг/мл. Важным свойством «антипневмококковых» хинолонов является их высокая активность в отношении атипичных патогенов (хламидий и микоплазм), для этих препаратов также характерно появление некоторой активности в отношении анаэробов, однако клиническое значение этого свойства не установлено. В отношении грамотрицательных микроорганизмов «антипневмококковые» препараты проявляют приблизительно такую же активность, как и другие фторхинолоны.
Важным свойством «антипневмококковых» хинолонов является их высокая активность в отношении атипичных патогенов (хламидий и микоплазм), для этих препаратов также характерно появление некоторой активности в отношении анаэробов, однако клиническое значение этого свойства не установлено. В отношении грамотрицательных микроорганизмов «антипневмококковые» препараты проявляют приблизительно такую же активность, как и другие фторхинолоны.
Распространение приобретенной устойчивости. Формирование приобретенной устойчивости к хинолонам описано практически у всех микроорганизмов, обладающих природной чувствительностью к этим препаратам. Однако распространение устойчивости среди некоторых микроорганизмов приобретает особое значение.
Устойчивость среди грамотрицательных бактерий. У грамотрицательных бактерий основной мишенью действия всех фторхинолонов является ДНК–гираза; топоизомераза IV менее чувствительна. Соответственно, при селекции устойчивости как in vitro, так и in vivo вначале формируются штаммы с мутациями в генах ДНК–гиразы, а затем и в генах топоизомеразы IV. Среди клинических штаммов грамотрицательных бактерий (Enterobacteriaceae, Pseudomonas, Acinetobacter, Haemophilus, Neisseria и Moraxella), проявляющих сниженную чувствительность к фторхинолонам, чаще всего выявляют замену серина, находящегося в 83–м положении ДНК–гиразы, на какую–либо другую аминокислоту (тирозин, фенилаланин, или изолейцин).
Среди клинических штаммов грамотрицательных бактерий (Enterobacteriaceae, Pseudomonas, Acinetobacter, Haemophilus, Neisseria и Moraxella), проявляющих сниженную чувствительность к фторхинолонам, чаще всего выявляют замену серина, находящегося в 83–м положении ДНК–гиразы, на какую–либо другую аминокислоту (тирозин, фенилаланин, или изолейцин).
У грамотрицательных бактерий, в подавляющем большинстве случаев, выявляют полную перекрестную резистентность между пефлоксацином, офлоксацином, ципрофлоксацином, ломефлоксацином, левофлоксацином, спарфлоксацином, гатифлоксацином и моксифлоксацином. В отношении небольшого количества штаммов грамотрицательных бактерий, устойчивых к перечисленным препаратам, активность могут сохранять клинафлоксацин, ситафлоксацин и гемифлоксацин [29]. Некоторые уропатогенные энтеробактерии могут быть устойчивыми к норфлоксацину, но сохранять чувствительность ко всем другим фторхинолонам.
Перечисленные закономерности в формировании перекрестной устойчивости к фторхинолонам среди грамотрицательных микроорганизмов важны для планирования рациональной антибактериальной терапии и интерпретации результатов микробиологических исследований.
Среди грамотрицательных возбудителей инфекций дыхательных путей (H.influenzae, M.catarrhalis) устойчивость к фторхинолонам до настоящего времени является казуистикой и не имеет практического значения.
Для грамотрицательных микроорганизмов – возбудителей внебольничных инфекций мочевыводящих путей устойчивость к фторхинолонам также не характерна. Так, среди уропатогенных E.coli в России частота устойчивости к налидиксовой кислоте не превышает 5,5%, а к ципрофлоксацину – 2,2%.
Устойчивость к хинолонам описана среди возбудителей кишечных инфекций – сальмонелл, шигелл и кампилобактерий, однако частота значительно варьирует в различных географических регионах.
Важной проблемой в Юго–Восточной Азии является устойчивость к фторхинолонам N.gonorrhoeae, достигающая 30–70% [32–36]. На территории России устойчивость гонококков к фторхинолонам до последнего времени не являлась значимой проблемой, однако недавно в Москве начали регистрировать штаммы гонококков со значительно сниженной чувствительностью к фторхинолонам (собственные неопубликованные данные). Эти наблюдения требуют пересмотра существующей практики лечения гонореи.
Эти наблюдения требуют пересмотра существующей практики лечения гонореи.
В отличие от возбудителей внебольничных инфекций, среди некоторых госпитальных патогенов частота устойчивости к фторхинолонам достигает значимого уровня, существенно сказывающегося на клинической эффективности этих препаратов. В первую очередь, речь идет о P.aeruginosa. Так, по данным Национальной системы по контролю за нозокомиальными инфекциями (США) в отделениях интенсивной терапии устойчивость к фторхинолонам среди этих микроорганизмов в среднем составляет 23% [30]. Высокий уровень устойчивости к фторхинолонам характерен и для других неферментирующих микроорганизмов. На территории России в отделениях реанимации частота устойчивости к ципрофлоксацину среди P.aeruginosa и Acinetobacter spp. варьирует от 13 до 53% [31].
Рост устойчивости к фторхинолонам в последние годы наблюдают и среди других грамотрицательных нозокомиальных патогенов. Достаточно часто устойчивость к фторхинолонам ассоциируется с устойчивостью к другим антибиотикам (аминогликозидам и b–лактамам).
Устойчивость среди грамположительных микроорганизмов. Наибольшее значение грамположительных микроорганизмов имеет устойчивость к фторхинолонам S.pneumoniae, связана практически только с мутациями в генах gyrA и parC. Мутации в генах gyrB и parE существенного значения не имеют. Причем, чем больше мутаций присутствует в генах ДНК–гиразы и топоизомеразы IV, тем выше значения МПК всех фторхинолонов.
Однако клиническое значение повышения МПК определяется не только микробиологическими параметрами, но и фармакокинетикой и фармакодинамикой препаратов (проблемы фармакодинамики будут рассмотрены в соответствующем разделе). При низких исходных значениях МПК конкретного фторхинолона даже после нескольких мутаций в мишенях действия и значительном повышении величины МПК препарат может сохранять клинически значимую активность. Таким образом, в результате нескольких мутаций штамм пневмококков может приобрести клинически значимую устойчивость к офлоксацину, но сохранить чувствительность к спарфлоксацину и моксифлоксацину, несмотря на повышение МПК этих препаратов.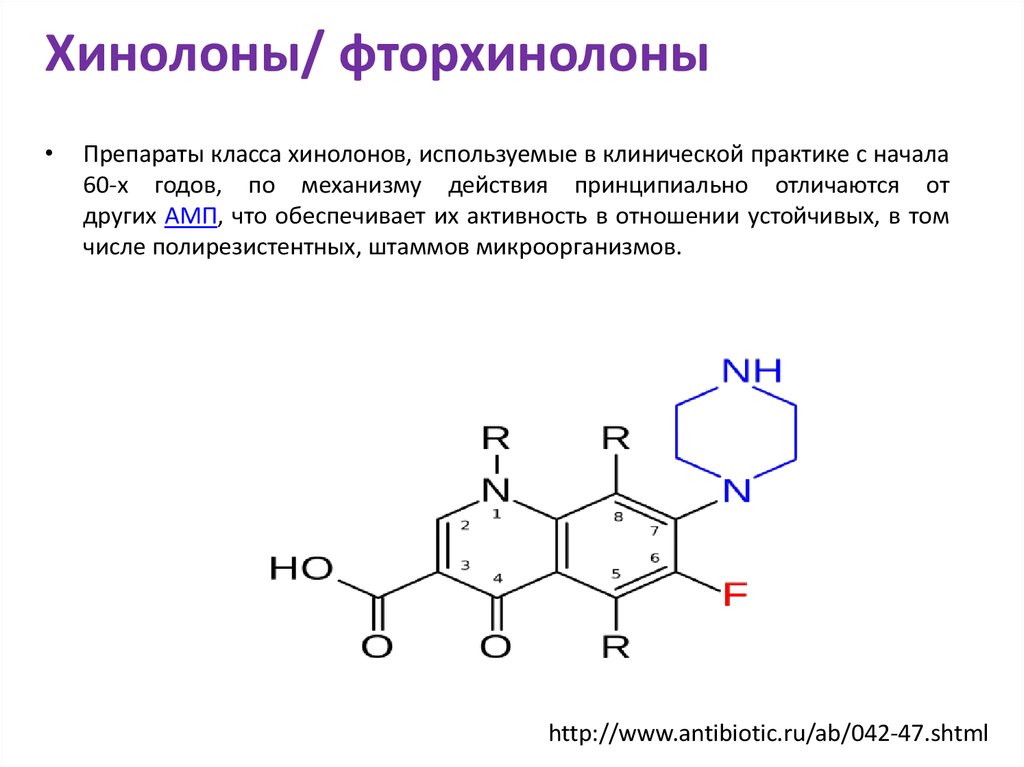 Величины МПК указанных препаратов в отношении S.pneumoniae, устойчивых к ципрофлоксацину и офлоксацину, как правило, менее 1 мкг/мл.
Величины МПК указанных препаратов в отношении S.pneumoniae, устойчивых к ципрофлоксацину и офлоксацину, как правило, менее 1 мкг/мл.
До недавнего времени проблема устойчивости пневмококков к фторхинолонам не рассматривалась как достаточно актуальная, несмотря на сообщения из отдельных географических регионов о выделении устойчивых штаммов. Так в Гонконге в 1998 г 5,5% штаммов проявляли сниженную чувствительность к левофлоксацину, а 2,2% – к тровафлоксацину [37]. Однако наибольший резонанс вызвала публикация из Канады о росте резистентности к ципрофлоксацину от 0 в 1993 г до 1,7% в 1997–1998 гг. Среди пациентов старше 65 лет частота выделения устойчивых штаммов достигает 2,6%. Авторы связывают этот рост с общим увеличением потребления фторхинолонов в стране от 0,8 до 5,5 назначений на 100 человек населения в год [38].
Данных об устойчивости пневмококков к фторхинолонам на территории России ограничены, однако снижение чувствительности к офлоксацину не является редкостью. Так в Москве в 1999–2000 гг. снижение чувствительности к офлоксацину было обнаружено у 8%, единичные штаммы проявляют устойчивость к левофлоксацину, спарфлоксацину и моксифлоксацину [39].
Так в Москве в 1999–2000 гг. снижение чувствительности к офлоксацину было обнаружено у 8%, единичные штаммы проявляют устойчивость к левофлоксацину, спарфлоксацину и моксифлоксацину [39].
Анализируя складывающуюся ситуацию, прежде всего, следует напомнить, что устойчивость пневмококков к левофлоксацину нельзя рассматривать изолированно от устойчивости к другим фторхинолонам. Селекция устойчивости, скорее всего, происходит на фоне применения фторхинолонов с низкой антипневмококковой активностью. Причем применяться они могут по показаниям, не связанным с инфекциями дыхательных путей. Основной причиной, вероятно, является широкое применение фторхинолонов при инфекциях мочевыводящих путей и другой локализации.
Учитывая изложенные факты, весьма обоснованными представляются рекомендации о замене при инфекциях дыхательных путей «старых» фторхинолонов на препараты, обладающие повышенной антипневмококковой активностью и низким потенциалом к селекции устойчивости, такие как левофлоксацин, спарфлоксацин и моксифлоксацин.
Фармакокинетика хинолонов. Фармакокинетические характеристики являются вторыми по важности после антимикробной активности параметрами, определяющими клиническую эффективность антибактериальных препаратов. Фторхинолоны, как группа антибактериальных препаратов, характеризуются высокой биодоступностью, большим объемом распределения, хорошим проникновением в ткани и низким связыванием с белками плазмы. Основные фармакокинетические константы наиболее распространенных фторхинолонов приведены в таблице 2.
Как следует из данных таблицы, биодоступность всех фторхинолонов превосходит 70%. Максимальная концентрация в сыворотке крови формируется через 1–2 ч, лишь у спарфлоксацина этот показатель достигает 4–5 ч, что, скорее всего, связано с низкой водорастворимостью препарата. Значения максимальной концентрации в сыворотке крови и площади под фармакокинетической кривой прямо пропорционально зависят от дозы препаратов. Высокие показатели объема распределения свидетельствуют о хорошем проникновении препаратов во внеклеточные пространства и внутрь клеток хозяина.
 Концентрации фторхинолонов внутри клеток, как правило, в несколько раз выше, чем в плазме крови. Сравнительно невысокие показатели связывания с белками плазмы не оказывают существенного влияния на эффективность препаратов.
Концентрации фторхинолонов внутри клеток, как правило, в несколько раз выше, чем в плазме крови. Сравнительно невысокие показатели связывания с белками плазмы не оказывают существенного влияния на эффективность препаратов.Все фторхинолоны в той или иной степени подвергаются метаболизму в организме человека. В наибольшей степени метаболизму подвергается пефлоксацин (до 80%), однако его основной метаболит – норфлоксацин в значительной степени сохраняет антибактериальную активность. Другие фторхинолоны метаболизируются в меньшей степени, но их метаболиты мало активны. Моксифлоксацин метаболизируется путем конъюгации.
Фторхинолоны различаются по механизмам экскреции – почечный и внепочечный. В корректировке доз при почечной недостаточности нуждаются ципрофлоксацин, спарфлоксацин, офлоксацин и левофлоксацин.
Переносимость фторхинолонов. Фторхинолоны, в целом, относятся к хорошо переносимым антибактериальным препаратам. Прекращение лечения, связанное с развитием нежелательных реакций, отмечают не более чем у 1–3% пациентов [40]. Препараты отличаются высокой специфичностью к прокариотическим топоизомеразам, данных о связи отмечаемых при приеме фторхинолонов побочных эффектов с ингибицией эукариотических топоизомераз нет.
Препараты отличаются высокой специфичностью к прокариотическим топоизомеразам, данных о связи отмечаемых при приеме фторхинолонов побочных эффектов с ингибицией эукариотических топоизомераз нет.
Среди побочных реакций чаще всего отмечают непереносимость со стороны желудочно–кишечного тракта (3–5%), в 1–3% влияние на центральную нервную систему, проявляющееся в широком диапазоне нарушений (от снижения внимания до судорожных припадков) и связанное с ингибицией взаимодействия g–аминомасляной кислоты с ее рецептором [41–43]. Редко наблюдают аллергические реакции, проявляющиеся в развитии сыпи, лихорадки, анафилаксии, интерстициального нефрита [40]. В редких случаях на фоне приема фторхинолонов наблюдают развитие фотодерматитов, обычно это осложнение связано с воздействием солнечного света или искусственным ультрафиолетовым облучением, в наибольшей степени характерно для ломефлоксацина и спарфлоксацина.
К крайне редким нежелательным реакциям относят тендениты и разрывы сухожилий (ахилловых). В эксперименте, у неполовозрелых животных наблюдают нарушения формирования хрящевой ткани. Однако анализ случаев применения фторхинолонов у детей по жизненным показаниям и при муковисцидозе не выявил ни в одном случае подобного эффекта [44–48]. Некоторые фторхинолоны (спарфлоксацин до 3%) вызывают аритмии и незначительное удлинение интервала QT на электрокардиограмме [49,50]. Этот эффект и, возможно, связанные с ним случаи внезапной смерти, послужили основанием для отзыва из медицинской практики грепафлоксацина.
Крайне редко отмечают случаи гепатотоксичности и лейкопении. Хотя данных о тератогенности фторхинолонов нет, их назначения у беременных следует избегать.
Заключение. По комплексу основных свойств (уровню и спектру антимикробной активности, фармакокинетике и переносимости) фторхинолоны следует рассматривать как препараты, пригодные для лечения широкого круга внебольничных и госпитальных инфекций. Результаты применения фармакодинамических методов для сравнительной оценки антибактериальных препаратов различных классов, а также опыт клинического использования фторхинолонов будут рассмотрены в следующей публикации.
Литература:
1. Quinolone–Binding Pocket of DNA Gyrase: Role of GyrB. Antimicrob. Agents Chemother. 2002, 46, 1805–1815.
2. Pan, X. & Fisher, L. M. (1999). Streptococcus pneumoniae DNA gyrase and topoisomerase IV: overexpression, purification, and differential inhibition by fluoroquinolones. Antimicrobial Agents and Chemotherapy 43, 1129–36.
3. Morrissey, I. & George, J. T. (2000). Purification of pneumococcal type II topoisomerases and inhibition by gemifloxacin and other quinolones. Journal of Antimicrobial Chemotherapy 45, Suppl. S1, 101–6.
4. Onodera, Y., Uchida, Y., Tanaka, M. & Sato, K. (1999). Dual inhibitory activity of sitafloxacin (DU–6859a) against DNA gyrase and topoisomerase IV of Streptococcus pneumoniae. Journal of Antimicrobial Chemotherapy 44, 533–6.
5. Yamada, H., Hisada, H., Mitsuyama, M., Takahata, M., Todo, Y., Minami, S. et al. (2000). BMS–284756 (T–3811ME), a des–F(6)–quinolone: selectivity between bacterial and human type II DNA toposiomerases. In Program and Abstracts of the Fortieth Interscience Conference on Antimicrobial Agents and Chemotherapy, Toronto, Canada, 2000. Abstract 753, p. 82. American Society for Microbiology, Washington, DC.
6. Morrissey, I. & George, J. (1999). Activities of fluoroquinolones against Streptococcus pneumoniae type II topoisomerases purified as recombinant proteins. Antimicrobial Agents and Chemotherapy 43, 2579–85 9. Morrissey, I. & George, J. (1999). Activities of fluoroquinolones against Streptococcus pneumoniae type II topoisomerases purified as recombinant proteins. Antimicrobial Agents and Chemotherapy 43, 2579–85.
7. Heaton, V. J., Ambler, J. E. & Fisher, L. M. (2000). Potent antipneumococcal activity of gemifloxacin is associated with dual targeting of gyrase and topoisomerase IV, and in vivo target preference for gyrase, and enhanced stabilization of cleavable complexes in vitro. Antimicrobial Agents and Chemotherapy 44, 3112–7
8. Fukuda, H., Kishii, R., Takei, M. & Hosaka, M. (2001). Contributions of the 8–methoxy group of gatifloxacin to resistance selectivity, target preference, and antibacterial activity against Streptococcus pneumoniae. Antimicrobial Agents and Chemotherapy 45, 1649–53
9. Pestova, E., Millichap, J. J., Noskin, G. A. & Peterson, L. R. Intracellular targets of moxifloxacin: a comparison with other fluoroquinolones. J. Antimicrob. Chemother. 2000, 45, 583–90
10. Bush, K. & Goldschmidt, R. Effectiveness of fluoroquinolones against Gram–positive bacteria. Current Opinion in Investigational Drugs. 2000, 1, 22–30
11. Alovero, F. L., Pan, X., Morris, J. E., Manzo, R. H. & Fisher, L. M. Engineering the specificity of antibacterial fluoroquinolones: benzenesulfonamide modifications at C–7 of ciprofloxacin change its primary target in Streptococcus pneumoniae from topoisomerase IV to gyrase. Antimicrob. Agents Chemother. 2000. 44, 320–5.
12. Rolstore KVI, Ho DH, LeBlanc B, Streeter H, Dvorak T. In vitro activity of trovafloxacin against clinical bacterial isolates from patients with cancer. J Antimicrob Chemother 1997;39:S15–22.
13. Bauernfeind A. Comparison of the antimicrobial activities of the quinolones Bay 12–8039, gatifloxacin (AM–1155), trovafloxacin, clinafloxacin, levofloxacin, and ciprofloxacin. J Antimicrob Chemother 1997;40:639–51.
14. Canton E, Peman J, Jimenez MT, Ramon MS, Gobernado M. In vitro activity of sparfloxacin compared with those of five other quinolones. Antimicrob Agents Chemother 1992;36:558–65.
15. Fu KP, Lafredo SC, Foleno B, et al. In vitro and in vivo antibacterial activities of levofloxacin, an optically active ofloxacin. Antimicrob Agents Chemother 1992;36:860–6.
16. Neu HC, Chin NX. In vitro activity of the new fluoroquinolone CP 99–219. Antimicrob Agents Chemother 1994;38:2615–22.
17. Woodcock JM, Andrews JM, Boswell FJ, Brenwald NP, Wise R. In vitro activity of Bay 12–8039, a new fluoroquinolone. Antimicrob Agents Chemother 1997;41:101–6.
18. Fuchs PC, Barry AL, Pfaller MA, Allen SD, Gerlach EH. Multicenter evaluation of the in vitro activities of 3 new quinolones, sparfloxacin, CI–960, and PD 131–628, compared with the activity of ciprofloxacin against 5,252 clinical bacterial isolates. Antimicrob Agents Chemother 1991;35:764–6.
19. Neu HC, Fang W, Gu JW, Chin NX. In vitro activity of OPC–17116. Antimicrob Agents Chemother 1992;36:1310–15.
20. Imada T, Miyazaki S, Nishida M, Yamaguchi K, Goto S. In vitro and in vivo antibacterial activities of a new quinolone, OPC–17116. Antimicrob Agents Chemother 1992;36:573–9.
21. Fuchs PC, Barry AL, Brown SD. In vitro activities of clinafloxacin against contemporary clinical bacterial isolates from 10 North American centers. Antimicrob Agents Chemother 1998;42:1274–7.
22. Wakabayashi E, Mitsuhashi S. In vitro antibacterial activity of AM–1155, a novel 6–fluoro–8–methoxy quinolone. Antimicrob Agents Chemother 1994;38:594–601.
23. Hosaka M, Yasue T, Fukuda H, Tomizawa H, Aoyama H, Hirai K. In vitro and in vivo antibacterial activities of AM–1155, a new 6–fluoro–8–methoxy quinolone. Antimicrob Agents Chemother 1992;36:2108–17.
24. Ednie LM, Jacobs MR, Appelbaum PC. Comparative activities of ciprofloxacin against gram–positive and –negative bacteria. Antimicrob Agents Chemother 1998;42:1269–73.
25. Felmingham D, Robbins MJ, Ingley K, et al. In vitro activity of trovafloxacin, a new fluoroquinolone, against recent clinical isolates. J Antimicrob Chemother 1997;39(suppl B):43–9.
26. Cunha BA, Hussain Qadri SM, Ueno Y, Walters EA, Domenico P. Antibacterial activity of trovafloxacin against nosocomial gram–positive and gram–negative isolates. J Antimicrob Chemother 1997;39(suppl B):29–34.
27. Brueggemann AB, Kugler KC, Doern GV. In vitro activity of Bay 12–8039, a novel 8–methoxyquinolone, compared to activities of six fluoroquinolones against S. pneumoniae, H. influenzae, and Moraxella catarrhalis. Antimicrob Agents Chemother 1997;41:1594–7.
28. Barry AL, Fuchs PC. Antibacterial activities of grepafloxacin, ciprofloxacin, ofloxacin, and fleroxacin. J Chemother 1997;9:9–16.
29. Brisse, S., D. Milatovic, A.C. Fluit, J. Verhoef, N. Martin, S. Scheuring, K. Kohrer, F.J. Schmitz //. Comparative in vitro activities of ciprofloxacin, clinafloxacin, gatifloxacin, levofloxacin, moxifloxacin, and trovafloxacin against Klebsiella pneumoniae, Klebsiella oxytoca, Enterobacter cloacae, and Enterobacter aerogenes clinical isolates with alterations in GyrA and ParC proteins. – Antimicrob.Ag. Chemother.,1999; 43:2051–2055.
30. SEMIANNUAL REPORT. Aggregated Data from the National Nosocomial Infections Surveillance (NNIS) System June 2000. (www.cdc.gov/ncidod/hip/SURVEILL/NNIS.HTM.)
31. Сидоренко С.В., Страчунский Л.С., Ахмедова Л.И., Белобородов В.Б., Богомолова Н.С., Большаков Л.В., Дехнич А.В., Карабак В.И., Маликов В.Е., Поликарпова С.В., Руднов В.А., Яковлев В.П., Павлова М.В. Результаты многоцентрового исследования сравнительной активности цефепима и других антибиотиков в отношении возбудителей тяжелых госпитальных инфекций (программа «Micromax»). – Антибиотики и химиотерапия. 1999. N.11, 7 –13.
32. Knapp JS, Wongba C, Limpakarnjanarat K et al. Antimicrobial susceptibilities of strains of Neisseria gonorrhoeae in Bangkok, Thailand: 1994–1995. Sex Transm.Dis 1997; 24: 142–8.
33. Knapp JS, Mesola VP, Neal SW et al. Molecular epidemiology, in 1994, of Neisseria gonorrhoeae in Manila and Cebu City, Republic of the Philippines. Sex Transm.Dis 1997; 24: 2–7.
34. Kam KM, Wong PW, Cheung MM, Ho NK, Lo KK. Quinolone–resistant Neisseria gonorrhoeae in Hong Kong. Sex Transm.Dis 1996; 23: 103–8.
35. Zenilman JM. Update on Quinolone Resistance in Neisseria gonorrhoeae. Curr.Infect Dis Rep. 2002; 4: 144–7.
36. Tapsall JW. Surveillance of antibiotic resistance in Neisseria gonorrhoeae in the WHO Western Pacific Region, 1998. The WHO Western Pacific Gonococcal Antimicrobial Surveillance Programme. Commun.Dis Intell. 2000; 24: 1–4.
37. Ho P–L, Que T–L, Tsang D.N–C, Ng T–K, Chow K–H, Seto W–H. //Emergence of fluoroquinolone resistance among multiply resistant strains of Streptococcus pneumoniae in Hong Kong. – Antimicrob. Ag. Chemother.,. 1999; 43:5: 1310–1313.
38. Chen DK, McGeer A, de Azavedo JC, Low DE. Decreased susceptibility of Streptococcus pneumoniae to fluoroquinolones in Canada. Canadian Bacterial Surveillance Network. – N Engl J Med, 1999; 341:4: 233–239.
39. Sidorenko S.V., Grudinina S.A., Kotosova L.K..// Antimicrobial resistance of Streptococcus pneumoniae recovered from respiratory tract infections (RTI) of inpatients in Moscow. – 40th Intersci. Conf. Antimicrob. Ag. Chemother., Toronto, 2000; Abstracts:
40. D.C. Hooper, J.S. Wolfson, Adverse effects, in: D.C. Hooper, J.S. Wolfson (Eds.), Quinolone Antimicrobial Agents, American Society for Microbiology, Washington, DC, 1993, pp. 489–512.
41. S. Hori, J. Shimada, Effects of quinolones on the central nervous system, in: D.C. Hooper, J.S. Wolfson (Eds.), Quinolone Antimicrobial Agents, American Society for Microbiology, Washington, DC, 1993, pp. 513–526.
42. Hori S., Shimada J., Saito A., Matsuda M. and Miyahara T. (1989) Comparison of the inhibitory effect of new quinolones on gamma–aminobutyric acid receptor binding in the presence of antiinflammatory drugs. Rev. Infect. Dis., 11:S1397–S1398.
43. Halliwell R.F., Davey P.G. and Lambert J.J. (1993) Antagonism of GABAA receptors by 4–quinolones. J. Antimicrob. Chemother., 31:457–462
44. Zabraniecki L., Negrier I., Vergne P., Arnaud M., Bonnet C., Bertin P. and Treves R. (1996) Fluoroquinolone induced tendinopathy: report of 6 cases. J. Rheumatol., 23:516–520.
45. Ribard P., Audisio F., Kahn M.F., De Bandt M., Jorgensen C., Hayem G., Meyer O. and Palazzo E. (1992) Seven Achilles tendinitis including 3 complicated by rupture during fluoroquinolone therapy. J. Rheumatol., 19:1479–1481.
46. Machida M., Kusajima H., Aijima H., Maeda A., Ishida R. and Uchida H. (1990) Toxicokinetic study of norfloxacin–induced arthropathy in juvenile animals.
Toxicol. Appl. Pharmacol., 105:403–412.
47. Schaad U.B. and Wedgwood J. (1992) Lack of quinolone–induced arthropathy in children. J. Antimicrob. Chemother., 30:414–416.
48. Schaad U.B., Stoupis C., Wedgwood J., Tschaeppeler H. and Vock P. (1991) Clinical, radiologic and magnetic resonance monitoring for skeletal toxicity in pediatric patients with cystic fibrosis receiving a three–month course of ciprofloxacin. Pediatr. Infect. Dis. J., 10:723–729
49. Dupont H., Timsit J.F., Souweine B., Gachot B., Wolff M. and Regnier B. (1996) Torsades de pointe probably related to sparfloxacin.
Eur. J. Clin. Microbiol. Infect. Dis., 15:350–351.
50. Jaillon P., Morganroth J., Brumpt I. and Talbot G. (1996) Overview of electrocardiographic and cardiovascular safety data for sparfloxacin. J. Antimicrob. Chemother., 37:161–167.
.
Антибиотики ряда фторхинолонов. Группа фторхинолонов. Объясняем, предупреждаем, советуем. Инфекции кожи и мягких тканей
Фторхинолоны являются одной из самых распространенных и используемых групп антимикробных препаратов благодаря высокой активности в отношении широкого спектра грамотрицательных и части грамположительных возбудителей . По количеству входящих препаратов в эту группу они уступают разве что бета-лактамным
антибиотикам. Фторхинолоны-результат «чистого» химического синтеза.
Первые фторхинолоны начали использоваться в клинической
практике в начале 80-х годов прошлого столетия. Понадобилось всего четверть века, чтобы они заняли одно из ведущих мест в химиотерапии инфекций самого различного генеза и локализации.
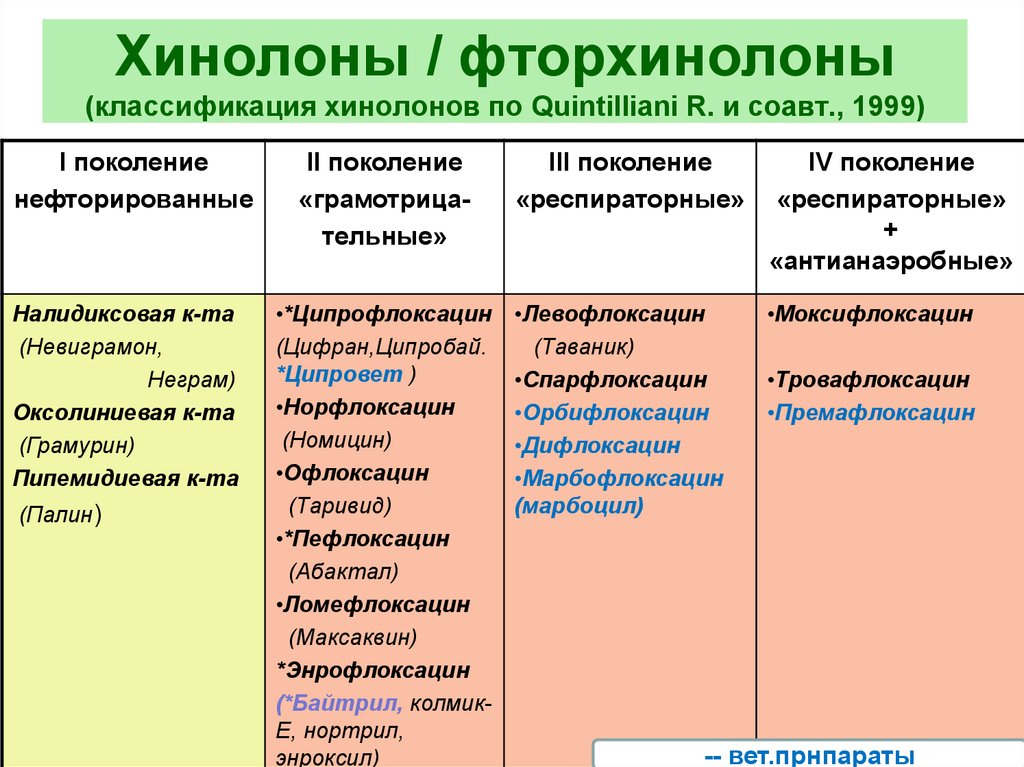
Существует ряд классификаций, в подавляющее большинство которых включены и хинолоны. Одна из распространенных классификаций, предложеная Quintilliani R. с соавт. в 1999 году, представлена в табл. 1.
Классификация отражает, с одной стороны, генерацию, а с другой – расширение спектра антимикробного действия фторхинолонов с акцентами на менее подверженных или не склонных микробов к действию фторхинолонов предшествующих генераций.
Таблица 1
Поколение | Препарат |
I – нефторированные хинолоны | Налидиксовая кислота Оксолиновая кислота Пипемидовая кислота |
II – «грамотрицательные» фторхинолоны | Норфлоксацин (F=35-40%) создает высокие концентрации в ЖКТ и МВП. Ципрофлоксацин (F=80%) Пефлоксацин Офлоксацин (F=90-95%)хуже действует на Ps.aeruginosa. Ломефлоксацин |
III – «респираторные» фторхинолоны | Левофлоксацин С парфлоксацин |
IV – респираторные» + «антианаеробные» фторхинолоны | Моксифлоксацин Гемифлоксацин Гатифлоксацин |
Фармакокинетика
Фторхинолоны хорошо всасываются в ЖКТ с достижением максимума концентрации в средах организма в первые 3 ч. и циркуляцией в них в терапевтических концентрациях 5–10 ч., что позволяет их назначать 2 раза в сутки. Прием пищи замедляет всасывание, но не влияет на его полноту. Биодоступность фторхинолонов при приеме внутрь достигает 80–100 % . Исключением является только норфлоксацин с биодоступностью 35–40 %. Фторхинолоны хорошо проникают в различные ткани организма, создавая концентрации близкие к сывороточным или превышающие их. Это обусловлено их физико-химическими свойствами: высокой липофильностью и низким связыванием с белками. В тканях ЖКТ, мочеполовых и дыхательных путей, почек, синовиальной жидкости их концентрация составляет более 150 % по отношению к сывороточной, показатель проникновения фторхинолонов в мокроту, кожу, мышцы, матку, воспалительную жидкость и слюну составляет 50–150 %, а в спинно-мозговую жидкость, жир и ткани глаза – менее 50 %.
Фторхинолоны хорошо проник
Остерегайтесь серьезных побочных эффектов фторхинолонов.
Фторхинолоны являются одними из самых опасных лекарственных препаратов на фармакологическом рынке и их следует назначать только в крайних случаях. Но несмотря на свою опасность, это наиболее часто назначаемый класс антибиотиков в США. В 2010 году фармкомпании “BAYER” получила от продаж Ципрофлоксацина и Моксифлоксацина (CIPRO И AVALOX) около 1 млрд $.
В том ж году, компания JOHNSON & JOHNSON заработала около 1,3 млрд $ от продаж препарата Левофлоксацин (LEVAQUIN).
У всех антибиотиков есть побочные эффекты, но класс фторхинолонов может оказать потенциальный вред здоровью.
Ни один другой антибиотик не вызывает такие тяжелые побочные эффекты или даже летальный исход, как фторхинолоны. Но несмотря на кучу побочных эффектов, врачи постоянно их назначают в качестве первой линии терапии даже при не тяжелых инфекциях, и не хотят заменить на более безопасную альтернативу.
Фторхинолоны содержат молекулу фтора с высокой антибактериальной активностью и широким спектром действия. Однако фтор известен также как нейротоксин, способный проникать в различные ткани, в том числе в головной мозг. «Фтор» означает «разрушение» (с греческого). Ни у какого другого элемента норма потребления не находится в такой опасной близости от дозы, оказывающей токсическое действие. Фтор может повредить иммунную систему за счет истощения энергетических запасов; также он препятствует образованию антител в организме.
В прошлом году, FDA – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, наконец выпустили предупреждение, что прием фторхинолонов через рот или инъекционно может вызвать периферическую нейропатию.
Периферическая нейропатия – повреждение периферических нервов, соединяющих спинной мозг и остальные части тела, боль может возникать в верхних или нижних конечностях и продвигаться в сторону позвоночника, например, от ступней к икрам.
Побочные эффекты фторхинолонов были зарегестрированы еще с 1980 года. К ним относят:
– поражение нервной системы: у 91 % пациентов, принимающих фторхинолоны (боли, покалывание, онемение, головокружение, слабость, недомогание, головные боли, тревоги, психоз)
– поражение опорно-двигательного аппарата: выявлено в 73% случаев (разрыв сухожилий, тендинит, припухлость суставов)
– сенсорные нарушения: у 42 % пациентов (шум в ушах, зрительные, обонятельные и слуховые нарушения)
– сердечно-сосудистые изменения в 36 % случаев (тахикардия, одышка, боли в груди)
– кожные реакции: в 29 % (сыпь, выпадение волос, потливость, непереносимость жары или холода)
– желудочно-кишечные расстройства: в 18% случаев (тошнота, рвота, диарея, боли в животе)
– отслойка сетчатки, которая может привести к слепоте
– острая почечная недостаточность
Согласно полученным данным, выявлено более 50 тыс случаев с побочными реакциями и 3000 летального исхода.
Фторхинолоны должны быть резервными препаратами и назначаться только при серьезных бактериальных инфекциях. Хотя несколько препаратов из данного класса запрещены FDA, 6 из них остаются одобреными в США – ципрофлоксацин, левофлоксацин, моксифлоксацин, гемифлоксацин, норфлоксацин.
15 Vital Reasons Why You Should Avoid These Common Antibiotics. Last updated 28 December 2014.
Фторхинолоны — Википедия. Что такое Фторхинолоны
Фторхинолоны (англ. fluoroquinolones) — группа лекарственных веществ, обладающих выраженной противомикробной активностью, широко применяющихся в медицине в качестве антибактериальных лекарственных средств широкого спектра действия. По широте спектра противомикробного действия, активности, и показаниям к применению они близки к антибиотикам, но отличаются от них по химической структуре и происхождению. (Антибиотики являются продуктами природного происхождения либо близкими синтетическими аналогами таковых, в то время, как фторхинолоны не имеют природного аналога).
История
В 1960-х годах была обнаружена высокая антимикробная активность налидиксовой кислоты. Затем была синтезирована оксолиновая кислота, с тем же спектром действия, но более активная (в 2—4 раза in vitro). В продолжение этих работ был синтезирован ряд производных 4-хинолона, среди которых особенно активными оказались соединения, содержащие в положении 6 атом фтора (отмечен на рисунке красным), а в положении 7 (помечено синим) — пиперазиновое кольцо, с дополнительными замещениями, либо без них. Эти соединения были названы фторхинолонами; их можно также назвать хинолонами второго поколения.
Классификация
- По количеству атомов фтора в молекуле: монофторхинолоны, дифторхинолоны и трифторхинолоны;
- Классификация по поколениям — включает хинолоны с атомом фтора и без него (первое поколение):[1][2]
- Первое поколение: налидиксовая кислота, оксолиновая кислота, пипемидовая кислота (не содержат атома фтора, не относятся к фторхинолонам в строгом смысле).
- Второе поколение: ципрофлоксацин, норфлоксацин, офлоксацин, пефлоксацин, ломефлоксацин.
- Третье поколение: спарфлоксацин, левофлоксацин.
- Четвертое поколение: моксифлоксацин, гемифлоксацин, гатифлоксацин, ситафлоксацин, тровафлоксацин, делафлоксацин.
Из препаратов группы фторхинолонов ломефлоксацин, офлоксацин, ципрофлоксацин, левофлоксацин, спарфлоксацин и моксифлоксацин входят в Перечень жизненно необходимых и важнейших лекарственных препаратов.
Механизм действия
Ингибируя два жизненно важных фермента микробной клетки – ДНК-гиразу и топоизомеразу-4, фторхинолоны нарушают синтез ДНК, что приводит к гибели бактерий (бактерицидный эффект)[3][4]. Кроме того, антибактериальная активность обусловлена влиянием на РНК бактерий, на стабильность их мембран, и влиянием на другие жизненно важные процессы бактериальных клеток[4].
Спектр противомикробной активности
По сравнению с налидиксовой и оксолиновой кислотой фторхинолоны имеют более широкий спектр действия. Препараты первого поколения активны в отношении большинства грамотрицательных бактерий: синегнойной, гемофильной и кишечной палочке, холерных вибрионов, шигелл, сальмонелл, менингококков, гонококков) Они также активны по отношению к кампилобактеру, легионелле, микоплазмам и хламидиям, и к некоторым грамположительным бактериям: некоторым разновидностям пневмококков и многим штаммам стафилококков. Они не действуют на анаэробные бактерии.
Многие фторхинолоны (офлоксацин[5], ципрофлоксацин и более поздние[6]) эффективны в отношении микобактерий туберкулёза.
Высокая бактерицидная активность фторхинолонов позволила разработать для многих из них лекарственные формы для местного применения в виде глазных и ушных капель.
Фармакокинетика
Фторхинолоны быстро и хорошо всасываются в ЖКТ. Максимальные концентрации в крови достигаются в среднем через 1—3 ч после приема внутрь. Они мало связываются с белками плазмы крови и сравнительно легко проникают во все органы и ткани, создавая в них высокие концентрации[3]; проникают внутрь клеток организма, воздействуя на внутриклеточные бактерии (хламидии, микобактерии, и т.п.)[4]
Пища может замедлять всасывание хинолонов, но не оказывает существенного влияния на биодоступность. Фторхинолоны проходят гематоплацентарный барьер, а также в небольших количествах проникают в грудное молоко, поэтому их не назначают беременным и кормящим женщинам. Выводятся они из организма почками, преимущественно в неизменном виде, и создают высокие концентрации в моче.[4]
При нарушении функции почек выведение хинолонов значительно замедляется.
Побочное действие
- Со стороны желудочно-кишечного тракта — изжога, боль в эпигастральной области, нарушение аппетита, тошнота, рвота, диарея.
- Со стороны центральной нервной системы — ототоксичность (отрицательное влияние на слух и работу вестибулярного аппарата), сонливость, бессонница, головная боль, головокружение, нарушения зрения, парестезии, тремор, судороги.
- Со стороны иммунной системы — транзиторный (временный, быстро проходящий) иммунодефицит.
- Аллергические реакции — сыпь, зуд, ангионевротический отек; фотосенсибилизация (наиболее характерна для ломефлоксацина и спарфлоксацина).
- Редкие и очень редкие
- Со стороны опорно-двигательного аппарата — артропатия, артралгия, миалгия, тендинит, тендовагинит, разрыв сухожилий.
- Со стороны почек — кристаллурия, транзиторный нефрит.
- Со стороны сердца — удлинение интервала QT на электрокардиограмме, в очень редких случиях: тахикардия, быстро появляющиеся и быстро проходящие боли в области сердца, артериальный тромбоз конечностей (в целом проходит сам или же лечится принятием рутина).
- Другие — кандидоз слизистой оболочки полости рта и/или вагинальный кандидоз, псевдомембранозный
Фторхинолоны для местного применения для глаз и ушей
НЭНСИ Э. МОРДЕН, доктор медицины, и ЭТАН М. БЕРК, доктор медицины, Медицинская школа Массачусетского университета, Вустер, Массачусетс
Am Famician. , 15 октября 2000 г .; 62 (8): 1870-1876.
Фторхинолоны для местного применения теперь доступны для лечения глаз и ушей. Их широкий спектр действия включает обычные глазные и ушные патогены Staphylococcus aureus и Pseudomonas aeruginosa. Для лечения острого наружного отита эти средства столь же эффективны, как и доступные ранее отические препараты.Для лечения среднего отита с перфорацией барабанной перепонки эффективны и безопасны фторхинолоны местного применения. Эти препараты одобрены для применения у детей, а отсутствие ототоксичности позволяет при необходимости их длительное применение. Местные фторхинолоны не подходят для лечения неосложненного конъюнктивита, когда достаточно средств более узкого спектра действия; они представляют собой упрощенную схему лечения бактериального кератита (язв роговицы). При местном применении фторхинолоны хорошо переносятся и предлагают удобные схемы дозирования.В настоящее время резистентность бактерий ограничена.
С тех пор, как фторхинолоновые антибиотики были введены для системного применения в 1980-х годах, их показания и использование быстро расширились. В последнее время появились составы для местного применения для глаз и ушей, расширяющие возможности лечения некоторых бактериальных инфекций.
Фторхинолоны получают путем добавления фтора и других групп к налидиксовой кислоте. Их бактерицидные и бактериостатические свойства являются результатом ингибирования фермента ДНК-гиразы.1 Широкий спектр активности фторхинолонов (таблица 1), особенно активность против Staphylococcus aureus и Pseudomonas aeruginosa, вызвал интерес к использованию этого класса агентов для местного лечения глаз и ушей.
Просмотр / печать таблицы
ТАБЛИЦА 1Антибактериальный спектр фторхинолонов
Восприимчивый * | ||
Escherichia coli | ||
Klebsiella 02 | ||
Виды Citrobacter | ||
Serratia marcescens | ||
Виды Shigella | ||
Виды Salmonella | ||
Виды Aeromonas | ||
Providencia виды | ||
Pseudomonas aeruginosa † ‡ | ||
Staphylococcus aureus † ‡ | ||
Staphylococcus Epidermidis ‡ | ||
Виды Haemophilus † ‡ | ||
Виды Neisseria | ||
Moraxella aeromonas vibrius | ||
Streptococcus pyogenes | ||
Гемолитические стрептококки Группы B, C, F, G | ||
Streptococcus pneumoniae † ‡ | ||
Streptocochibit | Виды Mycoplasma | |
Виды Chlamydia | ||
Виды Legionella | ||
Устойчивые * | ||
Анаэробные кокки | ||
Виды Bacteroides |
Антибактериальный спектр фторхинолонов
Восприимчивый * | |
Escherichia coli 03 | |
Виды Citrobacter | |
Serratia marcescens | |
Виды Shigella | |
Виды Salmonella | |
03 Виды Aeromonas | |
Виды Proteus | |
Виды Providencia | |
Pseudomonas aeruginosa † ‡ | |
Staphylococcus aureus † ‡ 900 25 | |
Staphylococcus epidermidis ‡ | |
Виды Haemophilus † ‡ | |
Neisseria виды | |
Moraxella aeromonas vibrius 0Moraxella aeromonas vibrius 0 | |
Streptococcus pyogenes | |
Гемолитические стрептококки Группы B, C, F, G | |
Streptococcus pneumoniae † ‡ | |
Виды микоплазм | |
Виды Chlamydia | |
Виды Legionella | |
Устойчивые * | |
Анаэробные анаэробные 0025 | |
Виды Clostridia | |
Виды Bacteroides |
Ухо
Бактериальные инфекции уха, такие как некротический (злокачественный) наружный отит и средний отит в ушах с интактной барабанной перепонкой, требуют системного лечения.Однако другие формы инфекции хорошо реагируют на местные антибиотики. Были внедрены два отических препарата фторхинолонов для местного применения: офлоксацин 0,3 процента (Floxin otic) и ципрофлоксацин 0,2 процента с гидрокортизоном 1,0 процента (Cipro HC otic). Отический раствор офлоксацина одобрен для лечения наружного и среднего отита с перфорированной или вентилируемой барабанной перепонкой. Отическая суспензия ципрофлоксацина одобрена для лечения наружного отита. Оба препарата можно применять у пациентов от года и старше.2 Рекомендуемые схемы лечения приведены в таблице 2.
Просмотр / печать таблицы
ТАБЛИЦА 2Рекомендуемые схемы лечения ушных инфекций
| Состояние | Лекарство | Дозировка | Продолжительность | Стоимость † | 90
|---|---|---|---|---|
Острый наружный отит | Ципрофлоксацин-гидрокортизон (Cipro HC) | Взрослые: 3 капли два раза в день | 7-10 дней | $ 59.00 ‡ / 10 мл |
Детский: 3 капли дважды в день | ||||
Офлоксацин (флоксин) | Взрослый: 10 капель два раза в день | 7-10 дней | 34,00 ‡ / 5 мл | |
Дети: 5 капель два раза в день | ||||
Полимиксин B-неомицин-гидрокортизон§ (кортиспорин) | Взрослые: 5 капель, три-четыре раза в день | 7-10 дней | Бренд: 42.00 (раствор или суспензия) / 10 мл | |
Детский: 4 капли три-четыре раза в день | Общий: от 10,00 до 28,00 / 10 мл | |||
Острый средний отит с тимпаностомическими трубками | Офлоксацин | Взрослый: 5 капель два раза в день | От 10 до 14 дней | То же, что и выше |
Детский: 5 капель два раза в день | ||||
Polymy B-неомицин-гидрокортизон§ | Взрослые: 5 капель три-четыре раза в день | 10-14 дней | То же, что и выше | |
Дети: 4 капли три-четыре раза ежедневно | ||||
Хронический гнойный средний отит [ исправлено] | Офлоксацин | Взрослый: 10 капель дважды в день | От 14 до 21 дня | То же, что и выше |
Детский: 5 капель два раза в день | ||||
Полимиксин В-неомицин-гидрокортизон§ | Не рекомендуется | То же, что и выше |
Рекомендуемые схемы лечения ушных инфекций
| Состояние | Дозировка | Дозировка препарата | Стоимость † | |
|---|---|---|---|---|
Острый наружный отит | Ципрофлоксацин-гидрокортизон (Cipro HC) | Взрослые: 3 капли дважды в день | 9002 5940 5940 дней | 9002 594000 ‡ / 10 мл |
Детский: 3 капли дважды в день | ||||
Офлоксацин (флоксин) | Взрослый: 10 капель два раза в день | 7-10 дней | 34,00 ‡ / 5 мл | |
Дети: 5 капель два раза в день | ||||
Полимиксин B-неомицин-гидрокортизон§ (кортиспорин) | Взрослые: 5 капель, три-четыре раза в день | 7-10 дней | Бренд: 42.00 (раствор или суспензия) / 10 мл | |
Детский: 4 капли три-четыре раза в день | Общий: от 10,00 до 28,00 / 10 мл | |||
Острый средний отит с тимпаностомическими трубками | Офлоксацин | Взрослый: 5 капель два раза в день | От 10 до 14 дней | То же, что и выше |
Детский: 5 капель два раза в день | ||||
Polymy B-неомицин-гидрокортизон§ | Взрослые: 5 капель три-четыре раза в день | 10-14 дней | То же, что и выше | |
Дети: 4 капли три-четыре раза ежедневно | ||||
Хронический гнойный средний отит [ исправлено] | Офлоксацин | Взрослый: 10 капель дважды в день | От 14 до 21 дня | То же, что и выше |
Детский: 5 капель два раза в день | ||||
Полимиксин В-неомицин-гидрокортизон§ | Не рекомендуется | То же, что указано выше |
Внешний отит
Острый диффузный наружный отит (ухо пловца) – воспалительная инфекция наружного слухового прохода.Клинические проявления обычно включают боль, болезненность, зуд и оторею. Разрушение эпителия в результате травмы и многократного воздействия влаги может предрасполагать пациентов к этому заболеванию.3 Осложнения острого наружного отита включают стеноз слухового прохода, перфорацию барабанной перепонки, ушной флегмона и прогрессирование до некротического наружного отита.4 P. aeruginosa является патогеном, ответственным за 40 человек. до 60 процентов случаев наружного отита, а S. aureus вызывает от 15 до 30 процентов случаев. На грибы приходится 10 процентов этих инфекций в большинстве мест, но заболеваемость увеличивается в районах с высокой влажностью.3–5
Недавнее крупное исследование4 схем лечения острого наружного отита среди узких специалистов и врачей широкого профиля показало, что наиболее часто назначаемым средством лечения этого заболевания является комбинированный продукт для местного применения, содержащий полимиксин B, неомицин (аминогликозид) и 1% гидрокортизона (кортиспорин). состояние. Результаты также показали, что значительное число врачей неправильно назначают пероральные антибиотики, которые не активны против P. aeruginosa и S. aureus, двух наиболее распространенных возбудителей острого наружного отита.
Многие врачи ошибочно полагают, что местные агенты нельзя использовать в ухе, когда отмечается или подозревается перфорация барабанной перепонки.6,7 Это убеждение сохраняется, несмотря на доказательства того, что местные антибиотики являются наиболее эффективным средством лечения неосложненной отореи с известной перфорацией барабанной перепонки. .7–10 Это беспокойство, однако, усиливается вкладышами в упаковку, которые советуют «осторожно» использовать местные аминогликозиды при перфорации барабанной перепонки. Рекомендуется соблюдать осторожность из-за потенциальной ототоксичности аминогликозидов.1,11 Ни одного случая ототоксичности не было связано с использованием местных аминогликозидов в ушах с неповрежденными барабанными перепонками. В ушах с перфорированной барабанной перепонкой токсичность встречается редко и возникает почти исключительно после длительного (более 14 дней) или повторного лечения.7,12 Риск контактной сенсибилизации к неомицину для местного применения также может усилить опасения по поводу лечения острого наружного отита. хотя сенсибилизация происходит редко.13
В прошлом некоторые врачи обходили опасения по поводу токсичности и сенсибилизации, используя растворы офтальмологических антибиотиков в ухе.Фторхинолоны часто выбирались из-за их широкой активности и отсутствия ототоксичности.3,4 Фторхинолоновые отические препараты представляют собой новый вариант лечения острого наружного отита в соответствии с рекомендациями по маркировке. Рандомизированное сравнение 5 местного применения офлоксацина и полимиксина B-неомицин-гидрокортизона для лечения острого наружного отита у детей и взрослых продемонстрировало одинаковую эффективность.
Аналогичное трехстороннее исследование6, в котором сравнивали отический раствор ципрофлоксацина 0,2% и отический раствор ципрофлоксацина 0.2 процента с гидрокортизоном 1,0 процента и полимиксином B-неомицином-гидрокортизоном для лечения острого наружного отита также показали, что лекарства одинаково эффективны. Время до исчезновения боли было значительно короче у пациентов, получавших комбинацию ципрофлоксацин-гидрокортизон или полимиксин B-неомицин-гидрокортизон (3,8 дня), чем у пациентов, получавших только ципрофлоксацин (4,8 дня). В остальном результат был одинаковым во всех группах. Это исследование было единственным, которое продемонстрировало преимущество стероидсодержащих антибиотиков по сравнению с тем же агентом без добавления стероидов.
Средний отит с перфорированной барабанной перепонкой
Развитие среднего отита после установки тимпаностомической трубки является обычным явлением. Обычно жалобы вызывают оторея. Боль и жар возникают нечасто. Острый средний отит с перфорацией возникает не реже одного раза в 21-50% ушей с проходимыми трубками.14–16 Хроническая форма этого состояния, хронический гнойный средний отит без холестеатомы, определяется как оторея, продолжающаяся три месяца и более в ухе с разрыв барабанной перепонки; он развивается в 3.6% пациентов с открытой тимпаностомической трубкой8,15 Эти состояния также возникают в ушах с нехирургической перфорацией барабанной перепонки. Лечение направлено на устранение симптомов и предотвращение потери слуха.9
Микробиология среднего отита с отореей варьируется в зависимости от продолжительности, возраста пациента и сезона. Наиболее частыми возбудителями, выделенными из ушей с острым средним отитом и перфорированной барабанной перепонкой у пациентов моложе трех лет, являются те же патогены, которые вызывают средний отит в ушах с неповрежденной оболочкой: Streptococcus pneumoniae, Haemophilus influenzae и Moraxella catarrhalis.Это особенно актуально, если инфекция развивается в зимние месяцы. Острый средний отит с перфорацией, возникающий в летние месяцы и у детей старше шести лет, чаще всего вызывается P. aeruginosa или S. aureus.16,17 Наиболее распространенными патогенами, выделяемыми из ушей с хроническим гнойным средним отитом, являются P. aeruginosa и S. aureus.8,15–18
Хотя хронический гнойный средний отит и острый средний отит с перфорацией представляют собой формы инфекции среднего уха, местное лечение этих состояний оказалось более эффективным, чем системная терапия.7–9,17,18 Превосходная эффективность местного лечения может быть результатом улучшенной доставки концентрированного раствора к месту инфекции.6,15,18 Высокая концентрация лекарственного средства была зарегистрирована в среднем ухе пациентов, получавших местный антибиотик. 19 Кроме того, считается, что S. aureus и P. aeruginosa вызывают достаточное разрушение тканей, чтобы препятствовать доставке системно вводимых агентов.8,9 Местная терапия обычно вызывает меньше побочных эффектов, чем системное лечение; кроме того, нет перорального средства, активного против P.aeruginosa в настоящее время доступен в Соединенных Штатах для использования у детей14,15
Ципрофлоксацин и офлоксацин изучались при лечении острого среднего отита с перфорацией и хронического гнойного среднего отита. В одном исследовании 14 местный офлоксацин сравнивался с пероральным амоксициллин-клавуланатом (Аугментин) при лечении детей с тимпаностомическими трубками и острым средним отитом с перфорацией. Офлоксацин и амоксициллин-клавуланат были одинаково эффективны у пациентов, у которых были культивированы типичные патогены среднего отита (S.pneumoniae, H. influenzae и M. catarrhalis). Офлоксацин оказался более эффективным, чем амоксициллин-клавуланат, в искоренении инфекции P. aeruginosa и S. aureus (96 и 67 процентов случаев соответственно). Побочные эффекты чаще встречались в группе амоксициллина-клавуланата. В другом исследовании8 сравнивали местный ципрофлоксацин с местным тобрамицином (Тобрекс) и плацебо при лечении хронического гнойного среднего отита; темпы эрадикации были одинаковыми (66 процентов) в двух группах антибиотиков. Плацебо не было эффективным.
ВЫБОР ЛЕЧЕНИЯ
Поскольку P. aeruginosa и S. aureus являются обычными возбудителями отореи, их необходимо учитывать при выборе лечения. В настоящее время не существует агента узкого спектра для защиты от этих двух микробов. Для лечения острого диффузного наружного отита комбинации полимиксин B-неомицин-гидрокортизон и фторхинолоны одинаково эффективны, и ни одно из методов лечения не несет известного риска. Схема приема фторхинолонов для местного применения два раза в день может улучшить комплаентность.При выборе лечения острого среднего отита с перфорацией местные фторхинолоны представляют собой хороший вариант первой линии, хотя не явно лучше, чем традиционная местная терапия. При хроническом гнойном среднем отите фторхинолоны для местного применения, вероятно, являются лучшим выбором, поскольку лечение длительное и часто проводится повторная терапия18.
ПОБОЧНЫЕ ЭФФЕКТЫ ФТОРОХИНОЛОНОВ ДЛЯ ТОЧНЫХ ОТИТОВ
Побочные эффекты фторхинолонов для местного применения возникают редко. Многие исследования не сообщили о побочных реакциях.15,17,19 В одном исследовании 6 головная боль, боль в ушах и зуд вызвали преждевременное прекращение лечения менее чем у 1 процента субъектов. В другом исследовании8 сообщалось о 35% случаев избыточного роста кандидозов у пациентов, получавших ципрофлоксацин. Другие исследования искали чрезмерный рост грибков и не обнаружили их. На сегодняшний день не было доказано, что местное применение фторхинолонов приводит к ототоксичности. 8,10,15
The Eye
Бактериальные инфекции глаз встречаются во многих формах. Сверхострый бактериальный конъюнктивит у взрослых (обычно вызываемый Neisseria gonorrhoeae) и неонатальный конъюнктивит необходимо лечить системно.20 Однако другие глазные инфекции лучше всего поддаются местной терапии. Офтальмологические растворы ципрофлоксацина 0,3% (Цилоксан) и офлоксацина 0,3% (Окуфлокс) одобрены для лечения бактериального кератита и бактериального конъюнктивита2.
Бактериальный конъюнктивит
Острый бактериальный конъюнктивит часто проходит самостоятельно. Во всем мире S. aureus и H. influenzae являются наиболее часто культивируемыми патогенами из глаз с этим заболеванием, но существуют значительные региональные различия.Несмотря на в целом доброкачественное течение, эту инфекцию обычно лечат антибиотиками местного действия для ускорения выздоровления и минимизации риска развития перфорации роговицы.20,21 Лечение эритромицином (илотицином), аминогликозидами для местного применения, такими как гентамицин (гарамицин) или тобрамицин, или бацитрацина обычно достаточно для этого состояния.21,22
Недавнее исследование23 оценило использование местного ципрофлоксацина для лечения бактериального конъюнктивита, подтвержденного посевом. Уровень искоренения 93.6 процентов было достигнуто в группах, получавших трехдневный курс местного ципрофлоксацина или тобрамицина. В группе плацебо показатель искоренения составил 59,5%. Автор отчета пришел к выводу, что ципрофлоксацин предлагает эффективное лечение бактериального конъюнктивита. Другие авторы подчеркивают, что использование фторхинолонов следует использовать для лечения тяжелых или рефрактерных конъюнктивитов и более серьезных глазных инфекций.21,22
Бактериальный кератит
Бактериальный кератит, или бактериальная язва роговицы, вызвал большой интерес в офтальмологии. использование местных фторхинолонов.Эта угрожающая зрению инфекция, которую обычно лечат офтальмологи, требует микробиологического обследования (окраска по Граму и посев) и немедленного агрессивного лечения. Даже незначительные случаи бактериального кератита могут вызвать значительные нарушения при поражении оси зрения, и прогрессирование может быть быстрым.
Бактериальный кератит возникает в результате условно-патогенной инфекции поврежденного глазного эпителия (травма, контактные линзы, заболевания век и слезы) .20 Возбудители болезни различаются в зависимости от региона и степени индустриализации.В Соединенных Штатах наиболее распространенными патогенами являются S. aureus и Staphylococcus epidermidis. Дети предрасположены к заражению H. influenzae и S. pneumoniae. Язвы роговицы у лиц, которые носят контактные линзы (особенно контактные линзы длительного ношения), часто вызваны инфекцией P. aeruginosa21.
Последствия неадекватного лечения бактериального кератита серьезны. По этой причине стандартным лечением в США была двойная антибактериальная терапия до получения результатов посева.21,24 Антибиотики доставляются местно, чтобы максимизировать концентрацию лекарства в месте инфекции и минимизировать токсичность.22 Офтальмологи и фармацевты обычно смешивают и разбавляют внутривенные препараты антибиотиков для создания для этой цели «обогащенных» растворов для местного применения.21,22,25 –27 В прошлом стандартное лечение требовало местного применения цефазолина (Ancef) или ванкомицина (Vancocin) для грамположительного покрытия и гентамицина или тобрамицина для лечения грамотрицательных организмов.21,25–27
Фторхинолоны для местного применения представляют собой новый вариант лечения бактериального кератита. Фторхинолоны активны в отношении организмов, наиболее часто встречающихся при бактериальном кератите. Исследования, сравнивающие местные фторхинолоны с двойными обогащенными растворами для лечения кератита, показали, что эти схемы одинаково эффективны.21,24–27 Использование одного агента упрощает лечение и повышает вероятность соблюдения режима лечения. Кроме того, использование коммерческого препарата исключает риск заражения
хинолонов: всесторонний обзор – American Family Physician
CATHERINE M.ОЛИФАНТ, PHARM.D., Школа фармацевтики Университета Вайоминга, Каспер, Вайоминг
ГЭРИ М. ГРИН, доктор медицины, Кайзер Перманенте, Медицинский центр Санта-Роза, Санта-Роза, Калифорния
Am Fam. 2002, 1 февраля; 65 (3): 455-465.
С недавним введением таких агентов, как гатифлоксацин и моксифлоксацин, традиционный грамотрицательный охват фторхинолонов был расширен за счет включения определенных грамположительных организмов. Клинические применения помимо инфекций мочеполовых путей включают инфекции верхних и нижних дыхательных путей, желудочно-кишечные инфекции, гинекологические инфекции, заболевания, передаваемые половым путем, а также некоторые инфекции кожи и мягких тканей.Большинство хинолонов обладают превосходной биодоступностью при пероральном приеме, при этом концентрация лекарственного средства в сыворотке крови эквивалентна внутривенному введению. У хинолонов мало побочных эффектов, в первую очередь тошнота, головная боль, головокружение и спутанность сознания. Менее распространенные, но более серьезные нежелательные явления включают удлинение скорректированного интервала QT, фототоксичность, аномалии ферментов печени, артропатию, а также аномалии хрящей и сухожилий. Новые фторхинолоны редко являются препаратами первого ряда, и их следует применять с осторожностью.Неправильное использование агентов из этого важного класса антибиотиков, вероятно, усугубит существующие проблемы с устойчивостью к антибиотикам. Также обсуждаются применения фторхинолонов в биологической войне.
Первый хинолон, налидиксовая кислота (NegGram), был представлен в 1962 году. С тех пор структурные модификации привели к фторхинолонам второго, третьего и четвертого поколений, которые улучшили охват грамположительных организмов.
Механизм действия
Хинолоны быстро подавляют синтез ДНК, способствуя расщеплению бактериальной ДНК в комплексах ДНК-фермент ДНК-гиразы и топоизомеразы типа IV, что приводит к быстрой гибели бактерий.1–3 Как правило, активность грамотрицательных бактерий коррелирует с ингибированием ДНК-гиразы, а активность грамположительных бактерий соответствует ингибированию топоизомеразы ДНК типа IV.1
Фармакокинетика
Как и аминогликозиды, хинолоны проявляют концентрационно-зависимые бактериальное убийство. Бактерицидная активность становится более выраженной, когда концентрация лекарственного средства в сыворотке увеличивается примерно до 30 раз минимальной ингибирующей концентрации (МПК) .1,4 Более высокие концентрации лекарственного средства парадоксальным образом подавляют синтез РНК и белка, тем самым снижая бактерицидную активность.1 Хинолоны обладают постантибиотическим эффектом от одного до двух часов.1
При использовании в комбинации с агентами из других классов антибиотиков, такими как бета-лактамы и аминогликозиды, хинолоны не обладают предсказуемым синергическим действием1. Хотя эффекты большинства комбинаций являются индифферентные или аддитивные, ципрофлоксацин (Cipro) и рифампицин (Rifadin), по-видимому, являются антагонистами по отношению к Staphylococcus aureus.5
Хинолоны хорошо всасываются после перорального приема, с биологической доступностью от умеренной до отличной.1,4 Уровни лекарств в сыворотке, достигаемые после перорального приема, сравнимы с таковыми при внутривенном введении, что позволяет быстро перейти от внутривенной к пероральной терапии и потенциально снизить затраты на лечение.6
Пища не ухудшает абсорбцию большинства хинолонов. Однако хинолоны образуют хелат с такими катионами, как алюминий, магний, кальций, железо и цинк. Это взаимодействие значительно снижает абсорбцию и биодоступность, что приводит к более низким концентрациям лекарственного средства в сыворотке и меньшему проникновению в ткань-мишень.1,4
Период полувыведения хинолонов варьируется от 1,5 до 16 часов. Поэтому большинство этих препаратов вводят каждые 12-24 часа. Хинолоны выводятся почечным и непочечным путями. Чтобы избежать токсичности, у пациентов с почечной или печеночной недостаточностью часто необходимо корректировать дозировку. Большинство хинолонов выводится через почки; однако спарфлоксацин (Загам), моксифлоксацин (Авелокс) и тровафлоксацин (Трован) выводятся через печень.
Хинолоны широко распространены в организме.Проникновение в ткани выше, чем концентрация, достигаемая в плазме, стуле, желчи, ткани предстательной железы и ткани легких. Внутриклеточная концентрация нейтрофилов и макрофагов исключительно высока. Хинолоны также хорошо проникают в мочу и почки, когда почечный клиренс является путем выведения препарата. Проникновение в простатическую жидкость, слюну, кости и спинномозговую жидкость не превышает сывороточных уровней препарата. Поскольку уровни хинолонов в спинномозговой жидкости предсказуемо низки, эти агенты не подходят для лечения менингита первой линии.1,4,7
Антимикробная активность
Хинолоны можно разделить на четыре поколения в зависимости от антимикробной активности (Таблица 1) .8 Агенты первого поколения, которые сегодня используются реже, обладают умеренной грамотрицательной активностью и минимальным системным действием. распространение. Хинолоны второго поколения обладают повышенной грамотрицательной активностью и охватом атипичных патогенов, но ограничивают грамположительную активность. Эти агенты наиболее активны в отношении аэробных грамотрицательных бактерий. Ципрофлоксацин остается наиболее активным хинолоном против синегнойной палочки.1,9,10 Хинолоны третьего поколения сохраняют повышенную грамотрицательную и атипичную внутриклеточную активность, но имеют улучшенное покрытие грамположительных. Наконец, препараты четвертого поколения улучшают грамположительный охват, поддерживают грамотрицательный охват и получают анаэробный охват.10
Просмотр / печать таблицы
ТАБЛИЦА 1Сравнение поколений хинолонов
| Поколения хинолонов | Микробиологические активность | Применение и характеристики | Показания | ||
|---|---|---|---|---|---|
Первое поколение | |||||
Налидиксовая кислота (NegGram) Циноксацин (Cinobac) | 9002Неосложненные инфекции мочевыводящих путей Не используется при системных инфекциях | ||||
Второе поколение | |||||
Класс I Ломефлоксацин (максакин) Норфлоксацин (нороксин) trex) | Enterobacteriaceae | Пероральное введение Низкие концентрации лекарств в сыворотке и тканях Улучшенный охват грамотрицательных веществ по сравнению с хинолонами первого поколения Ограниченный охват грамположительных | Неосложненные инфекции мочевыводящих путей Не используется при системных инфекциях | ||
Класс II | |||||
Офлоксацин (флоксацин) Ципрофлоксацин (Cipro) | Enterobacteriaceae, атипичные патогены; Pseudomonas aeruginosa (только ципрофлоксацин) | Пероральное и внутривенное введение Более высокие концентрации лекарственных средств в сыворотке, тканях и внутриклеточных препаратах по сравнению с препаратами класса I Охват атипичных патогенов | Осложненные инфекции мочевыводящих путей и катетер-ассоциированные инфекции Гастроэнтерит с тяжелой формой диареи. Инфекции, передаваемые половым путем.Не для использования при внебольничной пневмонии из-за ассоциации с пневмококковой бактериемией и менингеальным посевом из-за низкой восприимчивости к пневмококкам) | ||
Третье поколение | |||||
Левофлоксацин (левафаглоцин) Спар ) * Гатифлоксацин (текин) Моксифлоксацин (Авелокс) | Enterobacteriaceae, атипичные патогены, стрептококки | Пероральное и внутривенное введение Аналогично хинолонам второго поколения класса II, но с умеренным уровнем стептококка С. избыточный метаболизм в печени (спарфлоксацин и моксифлоксацин) | Показания, аналогичные показаниям для хинолонов второго поколения Внебольничная пневмония у госпитализированных пациентов или при наличии сильного подозрения на наличие атипичных патогенов Внебольничная пневмония у негоспитализированных пациентов с факторами риска устойчивой пневмококковой инфекции † | ||
Четвертое поколение | |||||
Тровафлоксацин (Trovan) * | Enterobacteriaceae, P.aeruginosa (снижено или отсутствует), атипичные патогены, чувствительный к метициллину Staphylococcus aureus, стрептококки, анаэробы | Пероральное и внутривенное введение Аналогично хинолонам третьего поколения, но с улучшенным охватом грамположительных и дополнительным анаэробным покрытием22 | r лечение интраабдоминальных инфекций.|||
Сравнение поколений хинолонов
| Поколения хинолонов | Микробиологическая активность | Назначение и характеристики | Показания | ||
|---|---|---|---|---|---|
Enterobacteriaceae | Пероральное введение Низкие концентрации лекарств в сыворотке и тканях Узкий грамотрицательный охват | Неосложненные инфекции мочевыводящих путей Не для использования при системных инфекциях | |||
Второе поколение | |||||
Класс I Ломефлоксацин (Максакин) Норфлоксацин (Нороксин) Эноксацин (Пенетрекс) | Enterobacteriaceae | Пероральное введение Низкие концентрации препарата в сыворотке и тканях Улучшенный грамм -отрицательный охват по сравнению с хинолонами первого поколения Ограниченный грамположительный охват | Неосложненные инфекции мочевыводящих путей Не используется при системных инфекциях | ||
Класс II | |||||
Офлоксацин (Флоксацин) Ципрофлокс Cipro) | Enterobacteriaceae, атипичные патогены; Pseudomonas aeruginosa (только ципрофлоксацин) | Пероральное и внутривенное введение Более высокие концентрации лекарственных средств в сыворотке, тканях и внутриклеточных препаратах по сравнению с препаратами класса I Охват атипичных патогенов | Осложненные инфекции мочевыводящих путей и катетер-ассоциированные инфекции Гастроэнтерит с тяжелой формой диареи. Инфекции, передаваемые половым путем.Не для использования при внебольничной пневмонии из-за ассоциации с пневмококковой бактериемией и менингеальным посевом из-за низкой восприимчивости к пневмококкам) | ||
Третье поколение | |||||
Левофлоксацин (левафаглоцин) Спар ) * Гатифлоксацин (текин) Моксифлоксацин (Авелокс) | Enterobacteriaceae, атипичные патогены, стрептококки | Пероральное и внутривенное введение Аналогично хинолонам второго поколения класса II, но с умеренным уровнем стептококка С. избыточный метаболизм в печени (спарфлоксацин и моксифлоксацин) | Показания, аналогичные показаниям для хинолонов второго поколения Внебольничная пневмония у госпитализированных пациентов или при наличии сильного подозрения на наличие атипичных патогенов Внебольничная пневмония у негоспитализированных пациентов с факторами риска устойчивой пневмококковой инфекции † | ||
Четвертое поколение | |||||
Тровафлоксацин (Trovan) * | Enterobacteriaceae, P.aeruginosa (снижено или отсутствует), атипичные патогены, чувствительный к метициллину Staphylococcus aureus, стрептококки, анаэробы | Пероральное и внутривенное введение Аналогично хинолонам третьего поколения, но с улучшенным охватом грамположительных и дополнительным анаэробным покрытием22 | r лечение интраабдоминальных инфекций.|||
Предельная восприимчивость и приобретенная устойчивость ограничивают эффективность хинолонов второго поколения при лечении стафилококковых, стрептококковых и энтерококковых инфекций.9 Доступными в настоящее время фторхинолонами с активностью in vitro против Streptococcus pneumoniae (включая существующие штаммы, устойчивые к пенициллину) являются левофлоксацин (Levaquin), спарфлоксацин, гатифлоксацин (Tequin), моксифлоксацин и тровафлоксацин. Левофлоксацин и спарфлоксацин проявляют более низкую стрептококковую активность in vitro по сравнению с гатифлоксацином, моксифлоксацином и тровафлоксацином. Гатифлоксацин в два-четыре раза активнее левофлоксацина против S. pneumoniae in vitro, а моксифлоксацин в четыре-восемь раз активнее.11 По сравнению с ципрофлоксацином и левофлоксацином, фторхинолоны, гатифлоксацин, моксифлоксацин и тровафлоксацин обладают большей активностью in vitro против S. aureus и некоторых штаммов энтерококка. 11,12
Хотя гатифлоксацин и моксифлоксацин, меченный анальгетиком, являются только трофлоксацином, активным в отношении трофлоксацина является только трофлоксацин. лечение анаэробных инфекций. Клинафлоксацин, исследуемый фторхинолон, обладает наиболее сильной анаэробной активностью in vitro.13
Ципрофлоксацин, офлоксацин (флоксин) и новые фторхинолоны обладают исключительной внутриклеточной концентрацией.Моксифлоксацин, гатифлоксацин, левофлоксацин и исследуемый лекарственный препарат гемифлоксацин обладают исключительной активностью в отношении видов Legionella, Chlamydia, Mycoplasma и Ureaplasma.9 Внутриклеточные респираторные патогены, такие как Chlamydia pneumoniae, Mycoplasbleasma pneumoniae, 9, предсказуемо чувствительны к ним. антибиотики считаются противотуберкулезными средствами второго ряда и должны применяться для лечения резистентного туберкулеза.
Устойчивость к хинолонам
Устойчивость к хинолонам имеет несколько механизмов и имеет значительное клиническое влияние.Мутации могут происходить быстро во время терапии фторхинолоном и могут быть наиболее значительным фактором, ограничивающим использование этих противомикробных препаратов.
Чувствительность in vitro к устойчивым к метициллину S. aureus, устойчивым к метициллину Staphylococcus epidermidis и устойчивым к ванкомицину энтерококкам непостоянна и непредсказуема. Хотя новые фторхинолоны показали многообещающую активность in vitro против грамположительных бактерий на основании данных по МПК, врачи должны проявлять осторожность при использовании хинолоновых антибиотиков для лечения опасных для жизни грамположительных инфекций.Продолжающееся чрезмерное использование этих противомикробных препаратов в клинической медицине и сельскохозяйственных кормах будет способствовать развитию грамположительной и грамотрицательной устойчивости и, вероятно, ограничит эффективность хинолонов в ближайшем будущем. Чрезмерное использование одного агента в конечном итоге приведет к резистентности ко всему классу.1
Терапевтическое применение хинолонов
ГЕНИТОРИНАРНЫЕ ИНФЕКЦИИ
Из-за их широкого охвата грамотрицательными антибиотиками хинолоновые антибиотики первоначально использовались для лечения инфекций мочевыводящих путей.Более высокие концентрации мочеполовых препаратов, которые возникают с очищенными почками хинолонами, способствуют их эффективности при лечении инфекций мочеполовой системы. Большинство хинолонов, вводимых курсами от 3 до 10 дней, так же эффективны, как и триметоприм-сульфаметоксазол (Bactrim, Septra), при лечении неосложненных инфекций мочевыводящих путей, вызванных чувствительной Escherichia coli14,15
Осложненные инфекции мочевыводящих путей включают инфекции у пациентов с камни или обструктивные уропатии, а также у пациентов с катетерными инфекциями.Эти инфекции часто связаны с внутрибольничными, устойчивыми к антибиотикам грамотрицательными патогенами и грамположительными бактериями, а также с видами Candida. Поскольку ципрофлоксацин, офлоксацин, ломефлоксацин (максакин), эноксацин (пенетрекс), левофлоксацин и гатифлоксацин обладают более высоким почечным клиренсом и большей концентрацией в почках, они являются оптимальным выбором для лечения осложненных инфекций мочевыводящих путей.1
Ципрофлоксацин был показан более эффективен, чем триметоприм-сульфаметоксазол и аминогликозиды, при 7-10-дневных курсах лечения осложненных инфекций мочевыводящих путей.Однако немногие пациенты сохраняют стерильную мочу через шесть недель после любой антибактериальной терапии.1,9 Бактериальная резистентность и суперинфекция Candida часто ограничивают лечение осложненных инфекций мочевыводящих путей, с оценочной частотой неудач не менее 2 процентов.15,16 Частота неудач достигает 20 процентов могут встречаться с инфекциями, вызванными патогенами, такими как P. aeruginosa.1
Семь-10-дневный курс перорального введения норфлоксацина (нороксина) или офлоксацина оказался успешным при лечении неосложненного пиелонефрита с помощью бактериологического излечения. скорость равна таковой для триметоприм-сульфаметоксазола.1 При лечении острого неосложненного пиелонефрита у небеременных женщин аналогичная эффективность была показана для левофлоксацина в дозе 250 мг в день в течение семи-10 дней и ципрофлоксацина в дозе 500 мг два раза в день в течение 10 дней. . Однако рецидивы чаще наблюдались при приеме левофлоксацина.1,9 Гатифлоксацин в дозировке 400 мг в день выгодно отличается от ципрофлоксацина в дозе 500 мг два раза в день при лечении осложненных инфекций мочевыводящих путей и пиелонефрита. процент излечения 93% и 91% соответственно.11
Фторхинолоны, особенно левофлоксацин и ципрофлоксацин, ценны при лечении осложненных инфекций мочевыводящих путей и пиелонефрита. Тем не менее, устойчивость к бактериям, рецидив инфекций и рецидивирующие инфекции остаются критическими проблемами. Сложные инфекции мочеполовых путей продолжают оставаться нишей для этого класса антибиотиков.
ПРОСТАТИТ
Хинолоны эффективны при лечении простатита из-за их отличного проникновения в ткань простаты.При приеме в течение четырех-шести недель норфлоксацин, ципрофлоксацин, левофлоксацин и офлоксацин имеют степень эрадикации от 67 до 91 процента.1,17 Неудачи лечения были связаны с более короткими курсами лечения (например, двухнедельный) и менее восприимчивыми бактериями, особенно P .. aeruginosa и Enterococcus разновидностей.1,9,15,18
Левофлоксацин – отличное средство первой линии при лечении простатита. Ципрофлоксацин следует назначать пациентам с резистентным грамотрицательным, псевдомонадным и энтерококковым простатитом из-за его превосходной активности против P.aeruginosa и энтерококки.
ДЫХАТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ
Острый бактериальный синусит может быть осложнением исходного вирусного заболевания. Основными бактериальными изолятами являются S. aureus, S. pneumoniae, Haemophilus influenzae и Moraxella catarrhalis.9 Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) пометило гатифлоксацин, моксифлоксацин, спарфлоксацин и левофлоксацин для использования при лечении острого бактериального синусита. Клинические испытания, сравнивающие фторхинолоны с амоксициллин-клавуланатом калия (Аугментин), цефуроксимаксетилом (Цефтин) и кларитромицином (Биаксин), продемонстрировали эффективность хинолоновых антибиотиков.9 Однако мы считаем, что хинолоны не следует использовать в качестве препаратов первого ряда при лечении острого бактериального синусита из-за возможности развития резистентности бактерий.
Острый бронхит может быть следствием вирусного заболевания, но антимикробная терапия обычно не требуется, если у пациента нет основного заболевания легких. Терапия фторхинолоном при остром бактериальном бронхите была эффективной против H. influenzae и M. catarrhalis, основных возбудителей болезней.1,9 Использование ципрофлоксацина для лечения S.pneumoniae и P. aeruginosa при бронхите приводит к неэффективности клинического лечения и развитию резистентности бактерий1. Как правило, левофлоксацин, спарфлоксацин, офлоксацин, гатифлоксацин и моксифлоксацин выгодно отличаются от цефуроксима, цефаклора (цефаклора (цеклор) и амоксициллина-клавулмоциллина) .1
Внебольничная пневмония является шестой по значимости причиной смерти в США. Даже при оптимальной терапии это заболевание связано с уровнем смертности примерно 14 процентов среди госпитализированных пациентов и менее 1 процента среди пациентов, не нуждающихся в госпитализации.19,20 S. pneumoniae, H. influenzae и M. pneumoniae являются патогенами, наиболее часто выявляемыми при внебольничной пневмонии; реже изолированные патогены включают вирусы, S. aureus, C. pneumoniae, M. catarrhalis, Klebsiella pneumoniae и L. pneumophila.19,20 Патогенами, наиболее часто вызывающими смерть пациентов с внебольничной пневмонией, являются S. A. aureus и L. pneumophila.
Выбор антибиотиков для амбулаторного и стационарного лечения пневмонии был рассмотрен в недавнем консенсусном заявлении Американского общества инфекционистов (IDSA) 19 и в рекомендациях, сформулированных Центрами по контролю и профилактике заболеваний (CDC).20 Предпочтение не отдавалось определенному классу антибиотиков. Перечисленные варианты выбора антибиотиков для амбулаторного лечения включали макролиды, доксициклин (вибрамицин) и фторхинолоны. Выбор антибиотиков для госпитализированных пациентов включал фторхинолоны или пенициллины расширенного спектра действия (пиперациллин [Пипрацил], пиперациллинтазобактам [Зосин] или ампициллинсульбактам [Унасин]), карбапенемы (меропенем [Меррем] и имипенемцилластатин [Примаксидоспорнитин]) и макроломциластатин [Примаксидспоркосин] , клиндамицин (Клеоцин) или метронидазол (Флагил).19,20
Для лечения внебольничной пневмонии у пациентов, госпитализированных в общую палату, IDSA19 рекомендует макролид с цефалоспорином расширенного спектра действия (цефотаксим [Клафоран] или цефтриаксон [Роцефин]) или комбинацию ингибиторов беталактама и бета-лактамазы. с макролидом или только фторхинолоном (левофлоксацин, гатифлоксацин или моксифлоксацин [перечислены в порядке повышения активности против S. pneumoniae]). Для лечения пациентов, госпитализированных в отделение интенсивной терапии, рекомендации IDSA рекомендуют макролид или фторхинолон (левофлоксацин, гатифлоксацин или моксифлоксацин) плюс цефалоспорин расширенного спектра действия (цефотаксим или цефтриаксон) или ингибитор бета-лактама / бета-лактамазы. .
Мы с осторожностью применяем хинолоны и макролиды у пожилых пациентов из-за лекарственных взаимодействий и побочных эффектов. Кроме того, фторхинолоны не следует использовать в качестве препаратов первой линии для эмпирической терапии, если не подозревается опасная для жизни или «атипичная пневмония» (например, инфекция L. pneumophila).
Для лечения атипичной пневмонии макролиды, вероятно, будут эквивалентны фторхинолонам и в настоящее время более рентабельны. Хинолоны обеспечивают исключительную защиту от атипичных патогенов при подозрении на инфицирование этими организмами у пациентов с внебольничной пневмонией.Однако офлоксацин был связан с неэффективностью лечения, а ципрофлоксацин продемонстрировал пониженную активность в отношении видов Chlamydia.1,9
По сравнению с другими хинолонами моксифлоксацин и гатифлоксацин показали более высокую активность in vitro в отношении пневмококков. Хотя эта активность может сделать моксифлоксацин или гатифлоксацин привлекательным выбором для лечения пневмококковых инфекций, эти агенты, вероятно, следует использовать для лечения инфекций с атипичными патогенами или при угрожающих жизни пневмониях.1,9,11,21,22
Из фторхинолонов наиболее широко применялись ципрофлоксацин и тровафлоксацин для лечения нозокомиальной пневмонии. Было обнаружено, что эффективность ципрофлоксацина сравнима с имипенемциластатином у пациентов на ИВЛ. E
Риски антибиотиков: фторхинолоны и тендонит
Антибиотики назначают для лечения инфекций с головы до ног – от бронхита до инфекций мочевыводящих путей (ИМП).Но врачи и пациенты все больше узнают о тревожных побочных эффектах одного конкретного класса фторхинолонов, в который входят ципро и левакин. В последние годы сообщалось о редких случаях серьезных повреждений сухожилий, связанных с применением препарата, среди других побочных эффектов.
Теперь эксперты хотят, чтобы и врачи, и пациенты больше знали об этих потенциальных опасностях. Более разумное назначение фторхинолоновых антибиотиков может помочь контролировать распространение устойчивых инфекций, уменьшая при этом количество побочных эффектов.
Врачи говорят, что проблемы с сухожилиями не были очевидны в 1970-е годы, когда тысячи людей тестировали фторхинолоны в испытаниях до того, как лекарства были одобрены. Поскольку эти лекарства стали популярными для лечения многих распространенных инфекций, включая пневмонию, синусит, бронхит и ИМП, начали проявляться побочные эффекты.
Неясно, как препараты влияют на проблемы с сухожилиями, но они считают, что антибиотики могут влиять на приток крови к коллагену в мышцах, который составляет сухожилия.Было достаточно случаев, когда в 2008 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) добавило к лекарствам черный ящик, предупреждающий о риске тендинита. В 2013 году FDA включило предупреждение о необратимом повреждении нервов, связанном с этими препаратами. А в мае прошлого года агентство сообщило, что фторхинолоны следует использовать только как крайний антибиотик после того, как другие классы были опробованы и не помогли контролировать неосложненные инфекции.
БОЛЬШЕ : Продукты, обработанные антибиотиками
Медицинские группы взяли на себя инициативу FDA.В последние годы организации, включая Американское общество инфекционных заболеваний, Американское торакальное общество и Американский колледж акушеров и гинекологов, перешли от рекомендации класса лекарств в качестве лечения первой линии к тому, что следует рассматривать только после того, как другие антибиотики потерпели неудачу. .
Однако этот совет доходит до отдельных врачей и пациентов дольше. Исследования показывают небольшое снижение назначения фторхинолонов за пределами больницы.
Получите наш информационный бюллетень о здоровье. Подпишитесь, чтобы получать последние новости о здоровье и науке, а также ответы на вопросы о здоровье и советы экспертов.
Спасибо!
В целях вашей безопасности мы отправили электронное письмо с подтверждением на указанный вами адрес.Щелкните ссылку, чтобы подтвердить подписку и начать получать наши информационные бюллетени. Если вы не получите подтверждение в течение 10 минут, проверьте папку со спамом.Есть еще одна причина, по которой некоторые врачи отказываются от фторхинолонов в качестве первого выбора. Когда люди злоупотребляют какими-либо антибиотиками, бактерии могут стать устойчивыми к лекарствам, что сделает неэффективными целые классы антибиотиков.Из других антибиотиков фторхинолоны особенно чувствительны к созданию устойчивых микробов. «Хотя раньше они были на 100% эффективны в уничтожении бактерий, связанных с такими инфекциями, как синусит и ИМП, например, теперь они эффективны только на 70%», – говорит д-р Б. Джозеф Гульельмо, профессор и декан школы Калифорнийского университета в Сан-Франциско Аптека. «[Этого] не ожидалось, когда впервые появились эти лекарства», – говорит он. «Все думали, что это замечательные антибиотики.Но в конечном итоге бактерии всегда умнее нас ».
БОЛЬШЕ : В больницах по-прежнему злоупотребляют антибиотиками
Когда было показано, что эти препараты менее эффективны, их побочные эффекты стали более важными для рассмотрения, поскольку врачи взвешивают преимущества контроля инфекции с рисками, связанными с лекарством. «Начинает происходить то, что по мере того, как вопрос об эффективности становится все более и более важным, вопрос о токсичности становится все более и более важным», – говорит Гульельмо.«Если у вас есть лекарство, которое не обеспечивает той ценности, для которой оно использовалось, тогда вы должны вернуться к рассмотрению причин не использовать его».
Некоторые исследования показывают, что проблемы с сухожилиями из-за фторхинолонов могут быть более распространены среди пожилых людей и тех, кто принимает стероидные препараты. Перед тем, как прописать этот класс антибиотиков, врачи должны спросить пациентов об их употреблении стероидами и о том, были ли у них ранее проблемы с их сухожилиями или мышцами.Лучшая информация об антибиотиках и их потенциальных побочных эффектах может помочь врачам решить, действительно ли они кому-то нужны, и если да, то какие прописать.
Свяжитесь с нами по [email protected].
.