Можно ли принимать антибиотики и противовирусные препараты одновременно?
В современном мире существует очень много заболеваний, вызванных такими невидимыми человеческому глазу возбудителями, как вирусы и бактерии, инфекции, которые содержат в себе несколько микроорганизмов (т.н. микст-инфекции).
Программа лечения инфекций требует внимательности и исключительных знаний в области терапии антибиотиками и противовирусными препаратами.
В связи с этим самолечение недопустимо, поскольку из-за него можно добиться неблагоприятных последствий для здоровья.
Характеристика антибиотиков и противовирусных лекарств
Основой антибиотиков являются вещества, которые препятствуют росту различного вида бактерий, а также убивают их при определенных заболеваниях. Иными словами, антибиотики не дают возможности для размножения патогенных бактерий.
Нужно отметить, что при помощи антибиотиков можно помимо вредоносных уничтожить также полезные бактерии, которые позволяют нашему организму правильно функционировать.
Для каждого из антибиотиков характерно то, что он обладает своей химической структурой, которая может воздействовать на определенный вид бактерий. Поэтому человек, не обладающий необходимым объемом специальных знаний, не сможет самостоятельно правильно выбор препаратов, которые ему стоит пить. В связи с этим очень важно своевременно прийти на прием за медицинской помощью, а затем неукоснительно исполнять все рекомендации врача.
Антибиотики чаще всего применяются в случае возникновения острого воспалительного процесса для облегчения выздоровления больного.
Противовирусные препараты содержат в себе белки, которые вырабатываются, реагируя на попадание в организм вирусов (интерфероны).
Благодаря интерферонам у человека в случае определенных заболеваний начинает активно работать иммунная система..gif) Это происходит за счет, способности клеток запоминать вирусы, которая позволяет организму очень быстро блокировать атакующие вирусы и вывести их из организма человека.
Это происходит за счет, способности клеток запоминать вирусы, которая позволяет организму очень быстро блокировать атакующие вирусы и вывести их из организма человека.
При этом действие противовирусных препаратов обычно длится только лишь в течение первых трех дней болезни, поскольку позже вирусы могут попасть в клетки, где уничтожить их практически невозможно. В связи с этим, действие противовирусных препаратов нередко ставится разными учеными под сомнение, поскольку проникновение вируса внутрь клетки происходит чрезвычайно быстро, и победить его может уже только лишь иммунная система организм.
Совместимы ли антибиотики и противовирусные препараты?
Вопрос о том, возможен ли одновременный прием таких препаратов, задают очень многие люди, особенно если такое назначение сделал им врач. Для того чтобы было можно ответить на этот вопрос нужно определить особенности их воздействия на организм человека.
Ранее уже отмечалось, что антибиотики направлены на то, чтобы убить любые живущие в теле человека микроорганизмы. Действие противовирусных препаратов направлено на то, чтобы организм при необходимости вырабатывал необходимые вещества для борьбы с вирусом. Эти вещества выступают в качестве имитатора вируса, что провоцирует выработку иммунитета на то или иное заболевание.
При определенных вирусных заболеваниях приемом антибиотиков можно привести к ухудшению состояния больного.
В практике сложилось неоднозначное отношение к одновременному применению антибиотиков и противовирусных средств. Это связано с тем, что одновременное применение противовирусных препаратов вместе с антибиотиками по мнению многих ученых не приносит никакого эффекта, поскольку после приема антибиотиков, противовирусный препарат прекращает действовать. Поэтому некоторые врачи считают бессмысленным пациенту пить оба препарата одновременно.
И, вместе с этим, последние проведенные исследования позволили выявить, что некоторые из антибиотиков вполне можно применять с противовирусными препаратами и даже помогают последним более эффективно действовать.
Противовирусные препараты желательно применять для профилактики соответствующих заболеваний, до того, как начали проявляться их симптомы. Многие практикующие врачи настаивают на том, что после того, как болезнь проявилась, принимать противовирусные препараты бессмысленно.
Действие антибиотиков нередко подавляет иммунитет, реакция которого так важна в первые дни заболевания. Поэтому нежелательно принимать антибиотики в первое время появления болезни. Только врачи могут разобраться с тем, какие препараты действительно совместимы, поэтому самолечение в данном случае недопустимо.
Стоит отметить, что комплексная терапия, включающая в себя одновременный прием противовирусных препаратов и антибиотиков, предусматривается в редких случаях, включая суперинфицирование, которое заключается в том что, первичное заболевание является основанием для развития вторичного. Пить одновременно эти препараты можно также, если вирусное заболевание осложняется бактериальным.
Итак, выходит, что одновременное применение антибиотиков и противовирусных препаратов вполне допускается в практической деятельности. Однако необходимо помнить о том, что используемые препараты должны быть совместимы между собой, а также обязательно должны учитываться все особенности заболевания. В противном случае есть риск нанести существенный вред организму больного.
При этом данные препараты, правильно назначаемые вместе, могут существенным образом облегчить состояние больного, нанеся двойной удар по источнику его заболевания – бактериям и вирусам одновременно. Правильное их применение позволит также сохранить нормальное функционирование иммунной системы.
Таким образом, принимать противовирусные препараты и антибиотики одновременно можно, однако назначаться они должны исключительно врачом.
Можно ли одновременно пить антибиотики и противовирусные препараты
Можно ли противовирусные препараты принимать вместе с антибиотиками
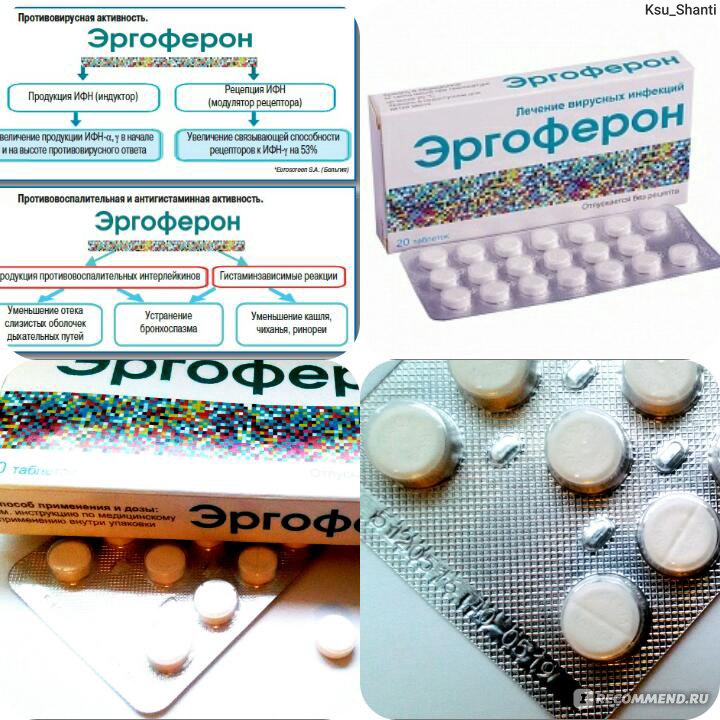 Почему возможно их совместное применение, всегда ли можно пить с противовирусными препаратами одновременно и антибиотики, или же нельзя принимать их вместе?
Почему возможно их совместное применение, всегда ли можно пить с противовирусными препаратами одновременно и антибиотики, или же нельзя принимать их вместе?Лечение антибиотиками
Антибиотики различных классов обладают способностью влиять на общий метаболизм бактерий, вызывая их гибель.
Антибактериальными препаратами лечат бактериальные инфекции, такие как:
- воспаления респираторных органов – пневмонию, бронхит, ангину;
- воспалительные болезни мочеполовой системы – нефрит, уретрит, цистит, простатит, аднексит, эндометрит;
- воспаления органов пищеварительной системы – язвенную болезнь желудка, воспаления различных отделов кишечника.
Препараты этой группы эффективно действуют при смешанных инфекциях. К смешанным инфекциям относятся заболевания, вызванные несколькими видами возбудителей #8212; вирусов и бактерий, бактерий разных видов, бактерий и грибов.
Антибактериальные средства различных видов эффективно подавляют рост и уничтожают бактерии, но они не действуют, если болезнь вызвана исключительно вирусами.
Кроме того, антибактериальные препараты убивают не только патогенные бактерии. Они вызывают гибель полезной микрофлоры кишечника, тем самым отрицательно действуя на иммунную систему.
Как антибиотики влияют на иммунитет
Долгое употребление антибактериальных средств вызывает изменения в реактивности иммунной системы, приводит к следующим нарушениям:
Ослабление иммунной системы при бесконтрольном приеме лекарств этой группы косвенно способствует усилению активности вирусной инфекции. Снижение выработки интерферона, вызванное лечением антибиотиками, лишает организм основного фактора противовирусной защиты.
Лечение противовирусными средствами
Вирусы относятся к абсолютным внутриклеточным паразитам. Собственного метаболизма у них нет, и антибиотик не может никак влиять на этих внутриклеточных паразитов.
А вот противовирусные средства способны подавлять активность этой группы возбудителей болезней. И, хотя противовирусные средства не могут разрушить ДНК или РНК вирусов, они способны:
- усиливать выработку иммунных факторов (интерферона, цитокинов), действующих против вирусов;
- снижать агрессивность инфекции;
- препятствовать проникновению в клетку;
- делать невозможным репликацию в клетке-мишени;
- подавлять сборку новых частиц.

В первые сутки после появления симптомов вирусной инфекции назначают противовирусные средства при болезнях:
- ОРВИ – Римантадин, Арбидол;
- папилломавирусе – Лавомакс;
- гриппе – Тамифлю;
- герпесе – Ацикловир;
- ВИЧ – Ламивудин.
В условиях живого организма эффективность противовирусных препаратов нередко снижается еще и из-за способности вирусной инфекции мутировать с потрясающе высокой скоростью.
Совместимость противовирусных препаратов и антибиотиков
У взрослых сомнения: можно ли одновременно принимать противовирусные препараты и пить антибиотики #8212; возникают при беременности, в пожилом возрасте. В этих случаях нужно строго выполнять рекомендации доктора.
При лечении детей сомнения по поводу приема противовирусных препаратов и, одновременно, антибиотиков, а также вопросы о том, можно ли давать лекарства вместе, возникают у родителей при ОРВИ и гриппе.
Конечно же, в самом начале ОРВИ, когда вирус действует в одиночку, прием антибиотиков бесполезен. Кроме того, в первые дни вирусного заболевания употребление антибиотиков еще и ослабляет иммунитет.
Если спустя 2-3 дня от появления симптомов ОРВИ к вирусной присоединяется бактериальная инфекция, то нужно принимать антибиотики, так как лекарство уничтожит бактерии или остановит их размножение.
Одновременный прием и противовирусных препаратов, и антибиотиков при смешанной вирусно-бактериальной инфекции оказывается эффективным и против бактерий, и против вирусов.
Принимать лекарства нужно курсами, соответственно схеме лечения, которую назначил доктор, и в указанной дозировке.
В стремлении вылечиться побыстрее иногда пытаются ускорить выздоровление, принимая и противовирусные средства, и антибиотики без назначения врача. Но можно ли усилить действие противовирусных препаратов, если совмещать их с антибиотиками?
Против множества разнообразных вирусов и бактерий еще не существует какой-то самой эффективной таблетки, приняв которую можно убить все вредные бактерии и все опасные вирусы в организме.
Энтеровирусная инфекция у детей #8212; симптомы, диагностика и лечение
Как лечить энтеровирусную инфекцию у взрослых
Можно ли противовирусные препараты принимать вместе с антибиотиками
Противовирусные лекарства от гриппа и ОРВИ
Почему нос заложен, а насморка нет
Сложные капли в нос для детей
Занимаясь самолечением вы можете упустить время и нанести вред здоровью!
Копирование материалов разрешено только с указанием активной ссылки на сайт. Всё в оригинальных текстах.
http://loramed.ru/bolezni/prostuda/antibiotiki-i-protivovirusnyie-odnovremenno.html
Можно ли противовирусные препараты принимать вместе с антибиотиками
При ОРВИ иногда назначают противовирусные средства с антибиотиками. Почему возможно их совместное применение, всегда ли можно пить с противовирусными препаратами одновременно и антибиотики, или же нельзя принимать их вместе?
Лечение антибиотиками
Антибиотики различных классов обладают способностью влиять на общий метаболизм бактерий, вызывая их гибель.
Антибактериальными препаратами лечат бактериальные инфекции, такие как:
- воспаления респираторных органов – пневмонию, бронхит, ангину;
- воспалительные болезни мочеполовой системы – нефрит, уретрит, цистит, простатит, аднексит, эндометрит;
- воспаления органов пищеварительной системы – язвенную болезнь желудка, воспаления различных отделов кишечника.
Препараты этой группы эффективно действуют при смешанных инфекциях. К смешанным инфекциям относятся заболевания, вызванные несколькими видами возбудителей #8212; вирусов и бактерий, бактерий разных видов, бактерий и грибов.
Антибактериальные средства различных видов эффективно подавляют рост и уничтожают бактерии, но они не действуют, если болезнь вызвана исключительно вирусами.
Кроме того, антибактериальные препараты убивают не только патогенные бактерии. Они вызывают гибель полезной микрофлоры кишечника, тем самым отрицательно действуя на иммунную систему.
Как антибиотики влияют на иммунитет
Долгое употребление антибактериальных средств вызывает изменения в реактивности иммунной системы, приводит к следующим нарушениям:
Ослабление иммунной системы при бесконтрольном приеме лекарств этой группы косвенно способствует усилению активности вирусной инфекции. Снижение выработки интерферона, вызванное лечением антибиотиками, лишает организм основного фактора противовирусной защиты.
Лечение противовирусными средствами
Вирусы относятся к абсолютным внутриклеточным паразитам. Собственного метаболизма у них нет, и антибиотик не может никак влиять на этих внутриклеточных паразитов.
А вот противовирусные средства способны подавлять активность этой группы возбудителей болезней. И, хотя противовирусные средства не могут разрушить ДНК или РНК вирусов, они способны:
- усиливать выработку иммунных факторов (интерферона, цитокинов), действующих против вирусов;
- снижать агрессивность инфекции;
- препятствовать проникновению в клетку;
- делать невозможным репликацию в клетке-мишени;
- подавлять сборку новых частиц.

В первые сутки после появления симптомов вирусной инфекции назначают противовирусные средства при болезнях:
- ОРВИ – Римантадин, Арбидол;
- папилломавирусе – Лавомакс;
- гриппе – Тамифлю;
- герпесе – Ацикловир;
- ВИЧ – Ламивудин.
В условиях живого организма эффективность противовирусных препаратов нередко снижается еще и из-за способности вирусной инфекции мутировать с потрясающе высокой скоростью.
Совместимость противовирусных препаратов и антибиотиков
У взрослых сомнения: можно ли одновременно принимать противовирусные препараты и пить антибиотики #8212; возникают при беременности, в пожилом возрасте. В этих случаях нужно строго выполнять рекомендации доктора.
При лечении детей сомнения по поводу приема противовирусных препаратов и, одновременно, антибиотиков, а также вопросы о том, можно ли давать лекарства вместе, возникают у родителей при ОРВИ и гриппе.
Конечно же, в самом начале ОРВИ, когда вирус действует в одиночку, прием антибиотиков бесполезен. Кроме того, в первые дни вирусного заболевания употребление антибиотиков еще и ослабляет иммунитет.
Если спустя 2-3 дня от появления симптомов ОРВИ к вирусной присоединяется бактериальная инфекция, то нужно принимать антибиотики, так как лекарство уничтожит бактерии или остановит их размножение.
Одновременный прием и противовирусных препаратов, и антибиотиков при смешанной вирусно-бактериальной инфекции оказывается эффективным и против бактерий, и против вирусов.
Принимать лекарства нужно курсами, соответственно схеме лечения, которую назначил доктор, и в указанной дозировке.
В стремлении вылечиться побыстрее иногда пытаются ускорить выздоровление, принимая и противовирусные средства, и антибиотики без назначения врача. Но можно ли усилить действие противовирусных препаратов, если совмещать их с антибиотиками?
Против множества разнообразных вирусов и бактерий еще не существует какой-то самой эффективной таблетки, приняв которую можно убить все вредные бактерии и все опасные вирусы в организме.
Энтеровирусная инфекция у детей #8212; симптомы, диагностика и лечение
Как лечить энтеровирусную инфекцию у взрослых
Можно ли противовирусные препараты принимать вместе с антибиотиками
Противовирусные лекарства от гриппа и ОРВИ
Почему нос заложен, а насморка нет
Сложные капли в нос для детей
Занимаясь самолечением вы можете упустить время и нанести вред здоровью!
Копирование материалов разрешено только с указанием активной ссылки на сайт. Всё в оригинальных текстах.
http://loramed.ru/bolezni/prostuda/antibiotiki-i-protivovirusnyie-odnovremenno.html
Антибиотики и противовирусные: можно ли принимать одновременно, совместимость препаратов
Причиной появления простудных заболеваний могут быть различные вирусы, бактерии, а также микс-инфекции – инфекции, имеющие одновременно несколько типов микроорганизмов.
Диагностировать заболевание и назначать верное лечение может только врач, поэтому важно отказаться от самолечения даже при обычной простуде и вовремя обратиться за медицинской помощью.
Только после этого, в зависимости от типа болезни, можно принимать антибиотики или противовирусные препараты.
Антибиотики и их особенности
Данные препараты содержат в себе вещество, которое убивает и подавляет рост тех или иных болезнетворных бактерий при простуде и иных заболеваниях. С латыни термин «антибиотики» переводится как «препятствующие жизни».
Иными словами, эти лекарства не позволяют размножаться бактериям патогенного типа. Однако помимо вредных бактерий, антибиотики противовирусные дополнительно убивают и полезные, при этом очень важные бактерии, которые находятся в нашем организме.
Препараты могут иметь:
- Узкий или широкий спектр;
- Также различают антибиотики бактериостатического типа, которые не убивают бактерии, но не допускают их размножения;
- Бактерицидные антибиотики способствуют гибели и выведению из организма бактерий.
Вместе с тем, важно понимать, что бактерии могут хорошо адаптироваться к этим лекарственным средствам, поэтому не все препараты могут быть эффективны при лечении того или иного заболевания.
Во время приема при простуде врач проведет обследование пациента, возьмет мазок носа и горла, на основе чего выявит, к какому именно антибиотику максимально чувствительны возбудители.
Особенности противовирусных препаратов
В отличие от взрослого организма, который может бороться с вирусами за счет наличия человеческих интерферонов, у маленьких детей иммунная система не достаточно развита. Поэтому при простуде малышам назначается интерферон в каплях, которые нужно использовать для глаз или носа.
Чтобы избежать болезни, людям делают прививки, за счет чего организм начинает вырабатывать иммуноглобулин, который при вторжении вируса в клетки сразу же его уничтожает.
Прием антибиотиков и противовирусных препаратов
Антибиотики при ОРВИ можно пить как и при бактериальной инфекции в организме. К таким болезням в первую очередь относят:
Данные виды препаратов можно давать в целях профилактики развития заболеваний, связанных с активацией условно-патогенных микроорганизмов, которые обитают на коже или слизистых оболочках и при определенных условиях могут стать болезнетворными.
Часто прием антибиотиков назначают до или после проведение хирургической операции.
Противовирусные препараты при простуде и иных заболеваниях всегда назначают, если вирусная инфекция уже развивается и для профилактических целей их не используют. Как правило, данные лекарственные средства назначаются при:
- ОРВИ, вирусе простого герпеса, папилломавирусе, цитомегаловирусе;
- ВИЧ-инфекциях и иных видах заболеваний.
Совместимость антибиотиков и противовирусных препаратов
Многие пациенты задаются вопросом, можно ли одновременно принимать при простуде антибиотики и противовирусные средства. Чтобы ответить на этот вопрос, стоит подробнее разобраться, как действуют эти средства на организм.
Итак, можно ли пить антибиотики одновременно с противовирусными препаратами? В целом такое сочетание не даст никакого эффекта. После того, как антибиотик попадает в организм, противовирусные препараты прекращают свое действие. В связи с этим, как считают многие врачи, одновременно давать эти два типа лекарственных средств бессмысленно.
Также эти два типа препаратов одновременно могут быть прописаны, если произошло первичное инфицирование вирусами, которые ослабили иммунную систему, что привело к активации бактериальной флоры. Подобное явление называется суперинфицированием, его выявляют при острой респираторно-вирусной инфекции, которая становится причиной развития вторичной бактериальной пневмонии.
Аналогично может стимулировать развитие бактериального заболевания ВИЧ-инфекция.
Рекомендации врачей
В случае повторного заболевания детям нельзя давать одни и те же антибиотики, даже если симптомы абсолютно одинаковые. Чаще всего находящиеся в организме бактерии выработали иммунитет к данному лекарству.
Даже если симптомы заболевания исчезли, необходимо пройти полный курс лечения. Если не закончить терапию, у пациента может развиться рецидив, и в этом случае потребуется прием более мощных антибиотиков.
При использовании антибиотиков необходимо обязательно принимать пробиотики – данные противогрибковые препараты нормализуют флору и не позволяют погибнуть полезным бактериям. В частности, пробиотики:
В частности, пробиотики:
В заключении рекомендуем видео в этой статье с мнением врача об антибиотиках и целесообразности их приема.
- Какие антибиотики принимать при гриппе и ОРВИ: список названий
- Противовирусные препараты от свиного гриппа: какие лекарства принимать
- Антибиотики при простуде и гриппе: что лучше принимать взрослым
Врач прописал Ингавирин 90 и Амоксиклав 875+125мг. Эффективно будет лечение или нет?
Температура тела была 39.2. На четвертый день температура в норме. Пить препараты или нет?
Антибиотики всегда надо дописать курсом, чтобы недобитые бактерии не приобрели к ним устойчивость.
Во время приема при простуде врач проведет обследование пациента, возьмет мазок носа и горла, на основе чего выявит, к какому именно антибиотику максимально чувствительны возбудители.
http://stopgripp.ru/lechim/preparat/antibiotiki-i-protivovirusnye-odnovremenno.html
Комментариев пока нет!
Можно ли одновременно принимать противовирусные и антибиотики
Антибиотики vs противовирусные препараты
07. 06.2015
06.2015
Противовирусные и антибиотики– есть ли между ними различия? Если да, то когда показаны одни препараты, а когда другие, можно ли их совмещать? Все эти вопросы важны для каждого человека, так как по незнанию можно причинить себе вред, пытаясь вылечить те или иные заболевания.
Разница между антибиотиками и противовирусными средствами
Дословный перевод слова «антибиотики» – это препятствующий жизни. Так и есть. Однако в традиционной медицине под этим понимается препятствие жизни патогенных бактерий. Именно против них проявляют свою активность данные препараты. Но в организме человека тоже живут бактерии, которые необходимы для его нормальной жизнедеятельности. Они, как и патогенные, попадают под действие антибиотиков (противовирусные средства не затрагивают все вышеперечисленные микроорганизмы).
Механизм действия антибиотиков может быть различным. Одни из них подавляют размножение бактерий, не вызывая их гибель (бактериостатические препараты: Эритромицин, Спирамицин и т. д.), а другие убивают бактерии и способствуют их выведению из организма (бактерицидные: Амоксиклав, Флемоксин и т.д.). Активность антибиотиков может проявляться как в отношении узкого спектра бактериальных агентов, так и широкого, что используется при выборе того или иного препарата для лечения конкретных заболеваний.
д.), а другие убивают бактерии и способствуют их выведению из организма (бактерицидные: Амоксиклав, Флемоксин и т.д.). Активность антибиотиков может проявляться как в отношении узкого спектра бактериальных агентов, так и широкого, что используется при выборе того или иного препарата для лечения конкретных заболеваний.
Противовирусные препараты, в отличие от антибиотиков, оказываются эффективными только против вирусных частиц (на бактерии они не воздействуют). В большинстве случаев это препараты экзогенного (поступающего извне) интерферона, который вызывает непосредственную гибель вирусов и подавляют их размножение. Меньшая часть противовирусных препаратов – это стимуляторы образования интерфероновых соединений.
Ситуации, когда необходимы противовирусные и антибиотики
Применение антибиотиков показано при развитии бактериальных инфекций в организме. Наиболее часто это такие заболевания, как:
- Пневмония – воспаление легочной ткани (Ампициллин, Цефтриаксон, Сумамед и другие)
- Пиелонефрит – воспаление почек (Амоксиклав, Аугментин и т.
 д.)
д.) - Цистит – воспалительный процесс мочевого пузыря (Ампициллин, Монурал, 5-НОК и т.д.)
- Язвенная болезнь – следствие инфицирования желудка или двенадцатиперстной кишки батерией хеликобактер (Ампициллин, Метронидазол, Азитромицин)
- Колит и/или энтерит – воспаление толстого (тонкого) кишечника (Фуразолидон, Левомицетин) и т.д.
Также антибиотики применяются и в профилактических целях, чтобы избежать активации условно-патогенных микроорганизмов, обитающих на коже и слизистых оболочках в норме, но при определенных условиях становящиеся болезнетворными. Обычно антибиотикопрофилактика назначается в связи с предстоящим или уже произведенным оперативным вмешательством.
Противовирусные средства всегда назначаются при уже развывшейся инфекции вирусного происхождения. Их никогда не используют с целью профилактики. Чаще всего эти препараты показаны при таких инфекциях, как:
- ОРВИ (Ремантадин, Арбидол, Адалин и т.д.) Цитомегаловирус (Левамизол) Вирус простого герпеса (Ацикловир, Валацикловир, Панавир) Папилломавирус (Лавомакс)
- ВИЧ-инфекция и другие (Зидовудин, Зальцитабин, Ламивудин).

Многих людей интересует вопрос, можно ли одновременно принимать противовирусные препараты и антибиотики. Можно, но когда на это есть строгие показания. Речь идет о первичном инфицировании вирусами, которые дополнительно ослабляют иммунитет, что приводит к активации бактериальной флоры. Эта ситуация называется суперинфицированием. Она может иметь место при острых респираторно-вирусных инфекциях, на фоне которых развивается вторичная бактериальная пневмония. Аналогичная ситуация наблюдается и при ВИЧ-инфекции, которая стимулирует развитие бактериальных заболеваний.
Применение в детском возрасте
Противовирусные препараты и антибиотики для дет
взаимодействий антибиотиков и противозачаточных таблеток: факт или заблуждение?
Медицинская проверка проведена Leigh Ann Anderson, PharmD. Последнее обновление: 20 августа 2020 г.
Можно ли принимать антибиотики вместе с противозачаточными?
Следует ли вам использовать резервный барьерный метод контроля рождаемости (например, презерватив), когда вы также принимаете антибиотик с гормональной формой контрацепции?
- В течение многих лет женщинам говорили, что их противозачаточные средства могут стать менее эффективными, если они одновременно пройдут курс лечения антибиотиками.
 Обычно медицинские работники советуют женщинам добавлять к их противозачаточным средствам барьерные средства контроля рождаемости (например, презервативы) и, возможно, в течение 7 дней после окончания приема антибиотиков, чтобы предотвратить беременность.
Обычно медицинские работники советуют женщинам добавлять к их противозачаточным средствам барьерные средства контроля рождаемости (например, презервативы) и, возможно, в течение 7 дней после окончания приема антибиотиков, чтобы предотвратить беременность. - Сегодня в большинстве исследований утверждается, что антибиотики, за исключением препарата от туберкулеза рифампицин (также известного как рифадин и римактан) и, возможно, других рифамицинов, таких как рифабутин, не влияют на эффективность гормональных форм контроля над рождаемостью, таких как таблетки.Однако критики утверждают, что многие исследования, в которых обнаружено отсутствие взаимодействия, были небольшими и, следовательно, вряд ли позволили выявить нечастые взаимодействия.
- Напротив, крупное, но обсервационное исследование базы данных из BMJ Evidence-Based Medicine , опубликованное в августе 2020 года, предполагает, что существует вероятность беременности при сочетании противозачаточных средств и антибиотиков.
 Однако это исследование не может доказать причинно-следственный результат на основе ретроспективного дизайна и ограничений исследования.
Однако это исследование не может доказать причинно-следственный результат на основе ретроспективного дизайна и ограничений исследования.
Поскольку многие исследования противоречат друг другу, вам следует обсудить эту тему со своим врачом, если вам прописали антибиотик и вы используете гормональную форму контроля над рождаемостью.
- Сообщается, что противозачаточные таблетки не работают в 1% случаев при правильном использовании и в 9% случаев при обычном использовании . Это означает, что при нормальном использовании около 9 из 100 женщин могут забеременеть каждый год, употребляя таблетки.
- Многие женщины не желают принимать дополнительный шанс на беременность при использовании антибиотиков, особенно с противоречивыми данными исследований.
- С другой стороны, некоторым женщинам не нравится мысль о дополнительном барьерном методе контроля рождаемости в течение одной, двух недель или даже дольше.
- Поговорите со своим врачом.
 Ваш лечащий врач может по-прежнему рекомендовать вам использовать дополнительный метод контроля рождаемости (например, презерватив и / или спермицид) к вашему гормональному методу во время короткого курса лечения антибиотиками.
Ваш лечащий врач может по-прежнему рекомендовать вам использовать дополнительный метод контроля рождаемости (например, презерватив и / или спермицид) к вашему гормональному методу во время короткого курса лечения антибиотиками.
Что говорится в исследовании?
Согласно клиническим рекомендациям экспертов и медицинских работников, только один антибиотик – рифампицин (бренды: рифадин и римактан) и в меньшей степени рифабутин – снижает эффективность противозачаточных таблеток.
- Рифампицин снижает эффективность за счет снижения уровня противозачаточных гормонов (этинилэстрадиола и прогестина) у женщин, принимающих оральные контрацептивы. Уровни гормонов необходимы для предотвращения овуляции.
- Рифампицин может индуцировать ферменты в печени, которые расщепляют эстроген быстрее, чем обычно. Снижение уровня гормонов может снизить эффективность ваших противозачаточных средств.
- Рифампицин может также снизить эффективность трансдермального противозачаточного пластыря (Орто Эвра) и вагинального кольца (НоваРинг), поэтому с этими продуктами следует использовать другую форму противозачаточных средств.

- Негормональный метод контроля рождаемости – например, презерватив, диафрагма или медная ВМС рекомендуется с рифампицином. Еще одним вариантом может быть противозачаточная инъекция Депо-Провера.
Обзор 2018 г., опубликованный в Американском журнале акушерства и гинекологии , согласился с этой информацией. Исследователи завершили обзор литературы нескольких исследований, соответствующих критериям включения.
Они стремились определить, приводит ли взаимодействие между не рифамициновыми антибиотиками и гормональными контрацептивами к снижению эффективности или повышению токсичности любой терапии.Авторы не нашли доказательств, подтверждающих существование лекарственного взаимодействия между гормональными контрацептивами и антибиотиками (за исключением рифамицинов).
- Два исследования не обнаружили разницы в частоте наступления беременности у женщин, которые использовали оральные контрацептивы с антибиотиками и без них.
- Никаких различий в подавлении овуляции или прорывном кровотечении не наблюдалось ни в одном исследовании, в котором сочетались гормональные контрацептивы с каким-либо антибиотиком.

- Не наблюдалось значительного снижения фармакокинетических параметров прогестина или этинилэстрадиола при приеме любого антибиотика, за исключением более низкой площади этинилэстрадиола под кривой при введении с диритромицином (больше не доступно в США).
Авторы пришли к выводу, что большинству женщин нельзя ожидать снижения эффективности при использовании гормональных контрацептивов и антибиотиков (за исключением рифамицинов).
В обзоре журнала Американской академии дерматологии говорится, что фармакокинетических данных демонстрируют, что уровни пероральных контрацептивов не меняются при комбинированном применении антибиотиков, в том числе:
Даже с этим исследование данных, связь между использованием антибиотиков и контрацептивной неудачи остается спорным.Крупные клинические испытания еще не завершены, но были оценены многие индивидуальные исследования. Некоторые эксперты утверждают, что исследования слишком малы или плохо спланированы для определения взаимодействия между отдельными антибиотиками и противозачаточными средствами.
В августе 2020 года исследователи из Великобритании опубликовали обсервационное исследование в BMJ Evidence-Based Medicine .
- Это исследование показало (но не могло доказать), что антибиотики могут снижать эффективность гормональных контрацептивов, включая таблетки.
- Исследователи изучили анализ сообщений о нежелательных побочных эффектах (в Великобритании они называются «желтыми карточками») и обнаружили, что нежелательная беременность была в 7 раз более вероятна для тех, кто принимал антибиотики, чем для других типов не связанных лекарств.
- Незапланированная беременность также в 13 раз чаще встречалась в сообщениях о препаратах, индуцирующих ферменты, в том числе некоторых антибиотиках.
- Авторы пришли к выводу, что женщинам, принимающим гормональные контрацептивы, следует рекомендовать принимать дополнительные меры предосторожности, чтобы избежать нежелательной беременности при назначении антибиотиков.Однако они подчеркнули, что риск будет варьироваться от женщины к женщине, в зависимости от ее физиологического состояния и обстоятельств.

Какие другие типы лекарств могут повлиять на эффективность противозачаточных средств?
Другие препараты, помимо рифампицина или рифамицинов, могут влиять на надежность контроля над рождаемостью. Другие препараты, индуцирующие ферменты, могут влиять на гормональный фон вашего противозачаточного средства и снижать его эффективность.
Поэтому всегда просите своего врача или фармацевта выполнять анализ взаимодействия с лекарствами каждый раз, когда вы начинаете или даже прекращаете прием лекарства.Сюда входят лекарства, отпускаемые по рецепту, а также лекарства, отпускаемые без рецепта, витамины и травяные или диетические добавки.
Например:
- Противогрибковое лекарство гризеофульвин может привести к снижению уровня противозачаточных гормонов и снижению эффективности противозачаточных таблеток.
- Некоторые противосудорожные препараты могут также снизить эффективность комбинированных противозачаточных таблеток, например противосудорожные препараты, такие как:
- карбамазепин (Тегретол)
- фенитоин (дилантин)
- примидон (Mysoline)
- топирамат (Topamax, Qudexy XR)
- фелбамат (Felbatol)
- окскарбазепин (Oxtellar XR, Трилептал)
- и барбитураты, такие как фенобарбитал
- Некоторые лекарства от ВИЧ, такие как эфавиренц, ингибиторы протеазы или противовирусные бустеры, также могут влиять на эффективность противозачаточных средств.

- Два небольших исследования показывают, что зверобой может индуцировать ферменты печени, которые могут увеличить метаболизм противозачаточных таблеток и снизить терапевтическую эффективность. Это также возможно с пластырем и противозачаточным кольцом.
Если вы принимаете какие-либо из этих препаратов, используйте презервативы в качестве резервного метода. Поговорите со своим врачом о переходе на другой негормональный метод контроля над рождаемостью (например, медную ВМС или диафрагму), если вы будете принимать эти взаимодействующие препараты в течение длительного времени.
Это еще не все возможные взаимодействия с противозачаточными средствами. Используйте средство проверки взаимодействия с Drugs.com, чтобы проверить возможные взаимодействия лекарств с вашим методом контроля рождаемости и обсудить их со своим врачом или фармацевтом.
И помните, что основная причина, по которой женщины забеременеют, когда принимают таблетки , они не принимают их правильно .
- Противозачаточные таблетки не работают по крайней мере в 1% случаев при идеальных условиях и до 9% времени при обычном использовании, поэтому прием таблетки в соответствии с указаниями или добросовестное использование других надежных методов контрацепции является ключом к предотвращению беременности.
- Другие явления, такие как рвота или диарея в течение более 48 часов, также могут снизить эффективность предотвращения беременности при помощи таблеток.
Дополнительную информацию см. В разделе «Планируемое отцовство».
См. Также
Источники
- Аронсон Дж. К., Фернер РЭ. Анализ отчетов о незапланированных беременностях, связанных с комбинированным использованием неферментативных антибиотиков и гормональных контрацептивов.
BMJ Evidence-Based Medicine, первая публикация в Интернете: 18 августа 2020 г.DOI: 10.1136 / bmjebm-2020-111363 - Антибиотики могут снизить эффективность противозачаточных таблеток.
 Drugs.com. 19 августа 2020 г. https://www.drugs.com/news/antibiotics-might-lower-effectiveness-birth-control-pill-92216.html
Drugs.com. 19 августа 2020 г. https://www.drugs.com/news/antibiotics-might-lower-effectiveness-birth-control-pill-92216.html - Симмонс КБ, Хаддад Л.Б., Нанда К. и др. Лекарственное взаимодействие между антибиотиками рифамицина и гормональной контрацепцией: систематический обзор. BJOG. 2018; 125 (7): 804-811. DOI: 10.1111 / 1471-0528.15027
- Клиника Мэйо. Часто задаваемые вопросы о противозачаточных таблетках: преимущества, риски и возможности выбора.По состоянию на 19 августа 2020 г. https://www.mayoclinic.org/healthy-lifestyle/birth-control/in-depth/birth-control-pill/art-20045136
- Дикинсон Б.Д., Альтман Р.Д., Нильсен Н.Х. и др. Лекарственное взаимодействие между оральными контрацептивами и антибиотиками. Obstet Gynecol. 2001; 98: 853.
- Арчер JS, Арчер Д.Ф. Эффективность оральных контрацептивов и взаимодействие антибиотиков: миф развенчан. J Am Acad Dermatol. 2002; 46: 917.
- Barditch-Crovo P, Trapnell CB, Ette E, et al. Влияние рифампицина и рифабутина на фармакокинетику и фармакодинамику комбинированного перорального контрацептива.
 Clin Pharmacol Ther. 1999; 65: 428.
Clin Pharmacol Ther. 1999; 65: 428. - Weaver K, Glasier A. Взаимодействие между антибиотиками широкого спектра действия и комбинированными пероральными противозачаточными таблетками. Обзор литературы. Контрацепция. 1999; 59: 71.
- Мартин К., Барбьери Р., Кроули В., Мартин К. Актуально. Комбинированные эстроген-прогестиновые оральные контрацептивы: отбор, консультирование и использование пациентов. Лекарственные взаимодействия. По состоянию на 18 августа 2020 г., https://www.uptodate.com/contents/overview-of-the-use-of-combination-oral-contraceptives .
- Обучение пациентов: Гормональные методы контроля рождаемости (помимо основ).До настоящего времени. По состоянию на 19 августа 2020 г. https://www.uptodate.com/contents/hormonal-methods-of-birth-control-beyond-the-basics
- ДеРосси СС, Херш Э.В. Антибиотики и оральные контрацептивы. Dent Clin North Am. 2002; 46 (4): 653-664. DOI: 10.1016 / s0011-8532 (02) 00017-4
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам..jpg)
Заявление об отказе от ответственности за медицинское обслуживание
Что это такое и чем они занимаются?
Вирусы – это микроскопические организмы, которые существуют почти повсюду на Земле.Они могут заражать животных, растения, грибы и даже бактерии.
Иногда вирус может вызвать настолько смертельную болезнь, что приводит к летальному исходу. Другие вирусные инфекции не вызывают заметной реакции.
Вирус может также оказывать одно действие на один тип организмов, но другое воздействие на другой. Это объясняет, как вирус, поражающий кошку, может не повлиять на собаку.
Вирусы различаются по сложности. Они состоят из генетического материала, РНК или ДНК, окруженного белковой, липидной (жировой) оболочкой или гликопротеином.Вирусы не могут размножаться без хозяина, поэтому они классифицируются как паразитические.
Они считаются самым многочисленным биологическим существом на планете.
Краткая информация о вирусах
- Вирусы – это живые организмы, которые не могут размножаться без клетки-хозяина.

- Они считаются самым многочисленным биологическим существом на планете.
- Болезни, вызываемые вирусами, включают бешенство, герпес и Эбола.
- От вируса нет лекарства, но вакцинация может предотвратить его распространение.
Практически каждая экосистема на Земле содержит вирусы.
До попадания в клетку вирусы существуют в форме, известной как вирионы.
На этом этапе они составляют примерно одну сотую размера бактерии и состоят из двух или трех отдельных частей:
- генетического материала, ДНК или РНК
- белковой оболочки или капсида, который защищает генетическую информацию
- липидная оболочка иногда присутствует вокруг белковой оболочки, когда вирус находится вне клетки.
Вирусы не содержат рибосомы, поэтому они не могут производить белки.Это делает их полностью зависимыми от своего хозяина. Это единственный тип микроорганизмов, который не может воспроизводиться без клетки-хозяина.
Это единственный тип микроорганизмов, который не может воспроизводиться без клетки-хозяина.
После контакта с клеткой-хозяином вирус вставит в нее генетический материал и возьмет на себя функции этого хозяина.
После заражения клетки вирус продолжает воспроизводиться, но производит больше вирусного белка и генетического материала вместо обычных клеточных продуктов.
Именно благодаря этому процессу вирусы классифицируются как паразиты.
Вирусы имеют разные формы и размеры, и их можно классифицировать по форме.
Это могут быть:
- Спиральная: Вирус табачной мозаики имеет форму спирали.
- Икосаэдрические, почти сферические вирусы: большинство вирусов животных такие.
- Конверт: Некоторые вирусы покрывают себя модифицированным участком клеточной мембраны, создавая защитную липидную оболочку. К ним относятся вирус гриппа и ВИЧ.
Возможны другие формы, включая нестандартные формы, сочетающие как спиральные, так и икосаэдрические формы.![]()
Вирусы не оставляют ископаемых останков, поэтому их сложно отследить во времени. Молекулярные методы используются для сравнения ДНК и РНК вирусов и выяснения того, откуда они берутся.
Три конкурирующие теории пытаются объяснить происхождение вирусов.
- Гипотеза регрессии или редукции: вирусы возникли как независимые организмы, ставшие паразитами. Со временем они потеряли гены, которые не помогали им паразитировать, и стали полностью зависеть от клеток, в которых обитают.
- Прогрессивная гипотеза или гипотеза бегства: вирусы произошли из участков ДНК или РНК, которые «ускользнули» от генов более крупных организмов. Таким образом они получили возможность стать независимыми и перемещаться между клетками.
- Гипотеза о первом вирусе: вирусы произошли из сложных молекул нуклеиновой кислоты и белков до или одновременно с появлением первых клеток на Земле, миллиарды лет назад
Вирус существует только для того, чтобы воспроизводиться..gif) Когда он размножается, его потомство распространяется на новые клетки и новых хозяев.
Когда он размножается, его потомство распространяется на новые клетки и новых хозяев.
Состав вируса влияет на его способность распространяться.
Вирусы могут передаваться от человека к человеку и от матери к ребенку во время беременности или родов.
Они могут передаваться через:
- прикосновение
- обмен слюной, кашель или чихание
- половой контакт
- зараженную пищу или воду
- насекомые, которые переносят их от одного человека к другому
Некоторые вирусы могут жить на объект в течение некоторого времени, поэтому, если человек коснется предмета с вирусом на руках, следующий человек может подхватить этот вирус, коснувшись того же объекта.Объект известен как фомит.
По мере того, как вирус размножается в организме, он начинает влиять на хозяина. По прошествии периода, известного как инкубационный период, могут начать проявляться симптомы.
Что будет, если вирусы изменятся?
Когда вирус распространяется, он может захватить часть ДНК своего хозяина и передать ее другой клетке или организму.
Если вирус попадает в ДНК хозяина, он может повлиять на более широкий геном, перемещаясь вокруг хромосомы или на новую хромосому.
Это может иметь долгосрочные последствия для человека.У людей это может объяснить развитие гемофилии и мышечной дистрофии.
Это взаимодействие с ДНК хозяина также может вызывать изменения вирусов.
Некоторые вирусы поражают только один тип животных, например птиц. Если вирус, который обычно поражает птиц, случайно попадает в человека, и если он улавливает часть человеческой ДНК, это может произвести новый тип вируса, который с большей вероятностью повлияет на людей в будущем.
Вот почему ученые обеспокоены редкими вирусами, которые передаются от животных к людям.
Вирусы вызывают множество болезней человека.
К ним относятся:
Некоторые вирусы, такие как вирус папилломы человека (ВПЧ), могут вызывать рак.
Что такое дружественные вирусы?
Подобно тому, как в нашем кишечнике существуют дружественные бактерии, которые помогают нам переваривать пищу, люди также могут нести дружественные вирусы, которые помогают защитить от опасных бактерий, в том числе Escherichia coli (E. coli) .
coli) .
Когда иммунная система организма обнаруживает вирус, он начинает реагировать, чтобы клетки могли пережить атаку.
Процесс, называемый интерференцией РНК, разрушает вирусный генетический материал.
Иммунная система вырабатывает специальные антитела, которые могут связываться с вирусами, что делает их неинфекционными. Организм отправляет Т-клетки для уничтожения вируса.
Большинство вирусных инфекций вызывают защитную реакцию иммунной системы, но у вирусов, таких как ВИЧ и нейротропные вирусы, есть способы уклоняться от защиты иммунной системы.
Нейротропные вирусы поражают нервные клетки. Они несут ответственность за такие болезни, как полиомиелит, бешенство, свинка и корь.
Они могут повлиять на структуру центральной нервной системы (ЦНС) с отсроченными и прогрессирующими эффектами, которые могут быть серьезными.
Лечение и лекарства
Бактериальные инфекции можно лечить антибиотиками, но вирусные инфекции требуют либо вакцинации, чтобы предотвратить их в первую очередь, либо противовирусных препаратов для их лечения.
Иногда единственное возможное лечение – облегчение симптомов.
Противовирусные препараты были разработаны в основном в ответ на пандемию СПИДа. Эти препараты не уничтожают возбудителя, но тормозят их развитие и замедляют прогрессирование болезни.
Противовирусные препараты также доступны для лечения инфекций, вызванных вирусом простого герпеса, гепатита B, гепатита C, гриппа, опоясывающего лишая и ветряной оспы.
Вакцины
Вакцины, как правило, являются наиболее дешевым и эффективным способом предотвращения вирусов. Некоторые вакцины помогают избавиться от болезней, таких как оспа.
Вакцинация от вирусов состоит из:
- ослабленной формы вируса
- вирусных белков, называемых антигенами, которые стимулируют организм к образованию антител, которые будут бороться с будущими инфекциями тем же вирусом
- живыми ослабленными вирусами, такими как иммунизация против полиомиелита
Живые аттенуированные вакцины несут риск возникновения первоначального заболевания у людей со слабой иммунной системой.
В настоящее время существуют вакцины от полиомиелита, кори, эпидемического паротита и краснухи, в том числе.Широкое использование этих вакцин резко снизило их распространенность.
Две дозы противокоревой вакцины, например, обеспечивают 97-процентную защиту от этого заболевания.
Вакцина против кори позволила снизить заболеваемость корью в Соединенных Штатах (США) на 99 процентов. Если есть вспышка, она обычно поражает людей, не вакцинированных.
Некоторые люди предпочитают не вакцинировать своих детей, и поскольку большинство людей вокруг них вакцинируются, риск заболеть корью невелик.
Однако, если вакцину получают менее 92–95 процентов людей, община может потерять «коллективный иммунитет» и может произойти вспышка. Резко возрастает риск заболевания.
По словам CDC:
«Антиваксеры помогают вдохнуть новую жизнь в старые болезни».
Это может также затронуть уязвимых людей, которые не могут получить вакцину по какой-либо причине, например, с ослабленной иммунной системой.
Вирусные инфекции обычно проходят без лечения, но лекарства могут облегчить такие симптомы, как боль, жар и кашель.
Границы | Противовирусные агенты из грибов: разнообразие, механизмы и потенциальные применения
Введение
Вирусы вызывают серьезные вспышки на всех континентах, приводящие к тяжелым симптомам и смертности, а также к огромному экономическому бремени для общества. Кроме того, постоянное появление новых серотипов в вирусных группах, которые имеют высокую скорость мутаций и низкую точность репликации вируса, создает проблемы в борьбе с этими вирусами.
Вирусы можно разделить на те, которые содержат липидную оболочку, и те, чей геном покрыт только белковой оболочкой.Оболочечные вирусы менее стабильны и более подвержены деградации при обработке липидными растворителями. Их механизмы заражения обычно основаны на присутствии фузогенных пептидов в липидной оболочке, что приводит к слиянию вирусной и клеточной мембран. Вирусы без оболочки гораздо более стабильны и могут оставаться активными в сточных водах и на поверхностях от нескольких недель до месяцев. Поэтому вирусы без оболочки, такие как вирусы Noro и энтеровирусы, вызывают вспышки, с которыми трудно справиться.Кроме того, они мало чувствительны к химическим дезинфицирующим средствам (Wutzler and Sauerbrei, 2004; Chan and Abu Bakar, 2005). Таким образом, для борьбы с вирусными инфекциями необходимы как вакцины, так и противовирусные препараты. Однако разработка вакцин против широкого круга вновь появляющихся серотипов вирусов является сложной задачей, и в настоящее время вакцины доступны только против небольшого числа вирусов. Кроме того, вакцинация не может помочь, если инфекция уже присутствует в организме.
Противовирусные препараты подавляют вирусную инфекцию, либо специфически воздействуя на вирусные белки, либо на клеточные факторы хозяина, которые вирусы используют для своего воспроизводства (Clercq, 2002).Однако проблема использования вирусных белков в качестве мишеней для лекарств заключается в высокой скорости, с которой вирусы продуцируют мутантные устойчивые к ним штаммы (De Palma et al., 2008). Клеточные факторы, используемые вирусами, также служат потенциальными мишенями для лекарств. Однако они не могут автоматически считаться надежными мишенями, поскольку вирусы могут отклоняться от своего первоначального пути и по-прежнему вызывать эффективную инфекцию (Van der Linden et al., 2015). Кроме того, воздействие на клеточные факторы может отрицательно влиять на нормальное функционирование клеток-хозяев.Более того, менее известны механизмы преодоления барьера мембраны клетки-хозяина вирусами без оболочки, что создает дополнительную проблему при разработке стратегий борьбы с этими вирусами.
Противовирусный препарат должен соответствовать ряду предпосылок при прохождении доклинических и клинических испытаний. Жизненно важным требованием является то, что лекарство должно быть эффективным в подавлении вирусной инфекции, не вызывая какой-либо цитотоксичности и с минимальными побочными эффектами для клеток-хозяев. Кроме того, лекарство должно быть способно полностью подавлять вирусную инфекцию, частичное подавление приводит к образованию устойчивых к лекарственным средствам мутантных штаммов.Благодаря этим предпосылкам только несколько синтетических противовирусных препаратов прошли клиническую фазу. До сих пор успешный подход «одна ошибка – одно лекарство» использовался для разработки противовирусных препаратов. Однако сегодня акцент сместился на разработку противовирусных препаратов широкого спектра действия, которые могут воздействовать на несколько вирусов, воздействуя на общую, но важную вирусную функцию (Vigant et al., 2015). Комбинаторная химия в настоящее время является предпочтительным подходом, адаптированным крупными фармацевтическими компаниями для открытия фармакологически значимых соединений (Strobel and Daisy, 2003).Хотя комбинаторный химический подход оказался успешным в оптимизации структур лекарственных соединений, только одно новое химическое соединение (NCE) de novo было одобрено в качестве лекарственного средства [сорафениб (Нексавар), действующее как противоопухолевое средство] за эти 25 с лишним лет после этого. метод (Cragg and Newman, 2007).
С другой стороны, биоактивные соединения, выделенные из природных биологических источников, обладают огромным и неизученным разнообразием химических структур, не имеющим себе равных даже в самых больших комбинаторных базах данных (Strobel and Daisy, 2003).На протяжении тысячелетий натуральные продукты использовались в традиционной медицине и по-прежнему обеспечивают наиболее доступное лечение болезней во многих развивающихся странах (Amzat and Razum, 2018). Около 40% современных лекарств и 49% новых химических продуктов, зарегистрированных Управлением по контролю за продуктами и лекарствами США (FDA), основаны на натуральных продуктах или их производных (Brewer, 2000). Биоактивные соединения представляют собой метаболиты природного происхождения и / или побочные продукты микроорганизмов, растений или животных (Baker et al., 2000). За последние 25 лет биоактивные соединения из многих традиционных лекарственных растений проверялись на их противовирусную активность различными исследовательскими группами в Азии, на Дальнем Востоке, в Европе и Америке (Jassim and Naji, 2003).
Особое значение для открытий новых лекарств имеют биоактивные молекулы грибного происхождения. В частности, грибы, растущие в уникальной среде, такие как эндофитные и морские грибы, постоянно исследуются на предмет их антибактериального и противогрибкового потенциала.В течение последнего десятилетия было обнаружено множество новых биоактивных природных продуктов, обладающих цитотоксической, противораковой, антибактериальной или противогрибковой активностью из морских грибов (Mayer et al., 2013; Cheung et al., 2014; Singh et al., 2015). Грибы потенциально содержат и / или производят несколько эффективных молекул, которые также могут использоваться в качестве противовирусных препаратов для других хозяев. Открытие и характеристика грибных соединений, обладающих противовирусной активностью, является новой областью исследований, и несколько соединений уже были определены как многообещающие.В этом обзоре мы рассмотрим современные знания об экстрактах грибов и других биологически активных агентах против вирусной инфекции. Мы особенно сосредотачиваемся на том, как оценивается противовирусное действие и сколько известно о механизмах действия и фактических целях.
Грибы как источник противовирусных агентов – обзор
Королевство грибов представляет собой богатый источник различных биологически активных соединений. В течение последних десятилетий были обнаружены тысячи соединений с разнообразной биологической активностью, которые продолжают исследоваться.Грибковые соединения с противовирусной активностью менее изучены, но количество таких исследований также увеличивается. Мы составили список отрядов грибов с положительной противовирусной активностью (Таблица 1), а также нанесли эту информацию на карту иллюстративных филогенетических деревьев (Рисунки 1–3). Виды грибов с заявленной противовирусной активностью приведены в дополнительной таблице S1. Это демонстрирует, что предыдущие исследования были сосредоточены на поздних расходящихся типах грибов (Ascomycota и Basidiomycota) и на довольно ограниченных таксономических группах, в то время как некоторые из них оставались полностью неисследованными.
ТАБЛИЦА 1. Грибковые отряды с положительной противовирусной активностью.
РИСУНОК 1. Древо, иллюстрирующее более крупную филогению грибов, показывает, что происхождение известных в настоящее время противовирусных агентов грибного происхождения (выделено) ограничивается поздними диверсионными типами грибов (Ascomycota и Basidiomycota). Рисунок построен на основе филогенетических отношений грибов в веб-проекте «Древо жизни» (http://tolweb.org). Это дерево является иллюстративным и не представляет реальных филогенетических данных.Пунктирные линии: группа не может быть монофилетической или филогенетическое положение группы не определено.
РИСУНОК 2. В филуме Ascomycota противовирусные агенты были в основном идентифицированы из эндофитов и других микрогрибков, ограниченных числом порядков. Более высокая интенсивность красного цвета указывает на большее количество сообщений в литературе. Рисунок построен на основе филогенетических отношений грибов в веб-проекте «Древо жизни» (http://tolweb.org). Это дерево является иллюстративным и не представляет реальных филогенетических данных.IA, индольные алкалоиды; NRPS, нерибосомные пептиды; ПКС, поликетиды; НРПС-ПКС, гибриды; Т, терпеноиды; N / A, информация недоступна. Пунктирные линии: группа не может быть монофилетической или филогенетическое положение группы не определено.
РИСУНОК 3. Сообщается о противовирусных средствах из филума Basidiomycota. Более высокая интенсивность красного цвета указывает на большее количество сообщений в литературе. Рисунок построен на основе филогенетических взаимоотношений грибов в веб-проекте Tree of Life (http: // tolweb.org). Это дерево является иллюстративным и не представляет реальных филогенетических данных. L, производное лигнина; ПС, полисахариды; Р – белки; C, комплекс полисахарид-белок / аминокислота; NRPS, нерибосомные пептиды; ПКС, поликетиды; Т, терпеноиды; N / A, информация недоступна. Пунктирные линии: группа не может быть монофилетической или филогенетическое положение группы не определено.
Съедобные и лекарственные грибы особенно хорошо изучены в отношении их биологически активных соединений, включая противовирусные препараты.Другая группа грибов, вызывающая интерес, – это эндофитные грибы, особенно те, которые растут в морских средах обитания. Биологически активные соединения можно условно разделить на две основные группы молекул; высокомолекулярные соединения, присутствующие в экстрактах и продуктах, полученных из плодовых тел съедобных и лекарственных грибов, и небольшие органические молекулы (вторичные метаболиты), выделяемые эндофитными и другими грибами в установках для жидкого культивирования (ферментации).
Дальнейшее грубое разделение может быть сделано при рассмотрении репертуара противовирусных соединений, обнаруженных из различных таксономических групп грибов. Картирование противовирусных соединений в более крупной филогенезе грибов (рис. 1) показывает, что все известные в настоящее время вторичные метаболиты были идентифицированы из Ascomycota и Basidiomycota. Ascomycota с противовирусной активностью включает эндофиты и другие микрогрибы, ограниченные числом порядков (рис. 2), в то время как съедобные и лекарственные грибы Agaricales и Polyporales (Basidiomycota) (рис. 3) признаны источником высокомолекулярных соединений.Растущее число опубликованных данных о геноме грибов в сочетании с традиционными методами скрининга биоактивности позволило по-новому взглянуть на истинную способность грибов как продуцентов биоактивных соединений (Bergmann et al., 2007; Khaldi et al., 2010; Brakhage, 2013; Clevanger). и др., 2017). Эти исследования показывают, что между этими двумя типами существуют различия в количестве кластеров вторичных метаболитов, биосинтетических генов, и в их доминировании в их геномах; базидиомицеты обычно имеют меньше по сравнению с аскомицетами (Brakhage, 2013).Однако сообщаемые различия между Ascomycota и Basidiomycota отражают также отклонения от различных методов, которые обычно используются при скрининге их биологически активных соединений, а не различия в их истинных арсеналах биологически активных соединений.
Самые последние оценки, предсказывающие разнообразие видов грибов, показывают, что только 3–8% существующих видов грибов обнаружены и описаны (Hawksworth and Lücking, 2017). Таким образом, грибки, исследованные и обнаружившие потенциальную положительную противовирусную активность, на данный момент представляют лишь незначительную часть этих организмов и их потенциал.
Грибы съедобные и лекарственные
Грибы на протяжении веков были важной частью нашего рациона благодаря своим питательным свойствам. Их богатое содержание белков, углеводов, минералов, витаминов, ненасыщенных жирных кислот и низкое содержание жира и энергии делают их ценным источником пищи (Barros et al., 2007, 2008; ağlarırmak, 2007; Kalač, 2009; Ouzouni et al. ., 2009; Reis et al., 2012).
Некоторые виды, дающие заметные плодовые тела, имеют долгую историю использования в медицине.Биоактивные соединения грибных родов, которые сыграли важную роль в традиционной медицине, такие как Ganoderma , были предметом обширных исследований. Однако существует большое количество других съедобных и лекарственных видов из разных родов, которые считаются потенциальными предшественниками противовирусных препаратов (дополнительная таблица S1 и рисунок 3). Противовирусная активность этих грибов связана в основном с наличием полисахаридов в мицелии и плодовых телах, а также с синтезом вторичных метаболитов тритерпеноидов (Chen et al., 2012; Rincão et al., 2012). Однако сообщалось о большом количестве других потенциально биоактивных соединений и / или генов, участвующих в их синтезе (Shiao, 2003; Chen et al., 2012), что указывает на то, что весь потенциал грибов и лекарственных грибов как источника биоактивных соединений сохраняется. понимается лишь частично. Предыдущее исследование показало значительные различия в содержании биоактивных соединений, продуцируемых на разных этапах жизненного цикла грибов (Chen et al., 2012), подразумевая, что антивирусные исследования должны учитывать фенотипические вариации и условия роста грибкового материала.
Эндофиты, морские грибы и патогены растений
Эндофитные грибы, населяющие надземные ткани здоровых растений, по крайней мере, часть их жизненного цикла, очень разнообразны с точки зрения видового богатства. Считается, что эти в основном аскомицетные (Ascomycota) грибы, распространенные во всех наземных местообитаниях, играют важную экологическую роль в наземных растительных сообществах. Их взаимодействия с растениями-хозяевами и перекрестная связь с другими эндофитными микроорганизмами, колонизирующими одно и то же растение, сложны и динамичны (Kusari et al., 2012). Эндофитные грибы были признаны богатым источником вторичных метаболитов, роль которых в естественной среде обитания, вероятно, включает химическую сигнализацию, защиту от других микроорганизмов и установление симбиоза с растением-хозяином (Schulz and Boyle, 2005; Yim et al., 2007; Khaldi et al., 2010). Некоторые из них также имитируют защитные соединения растений и, следовательно, могут защищать растения-хозяева от травоядных и патогенов (Kusari et al., 2012). Эти вторичные метаболиты, как известно, обладают большим химическим разнообразием и многочисленными биологическими активностями с фармацевтическим и биотехнологическим потенциалом.
Было высказано предположение, что в экстремальных средах обитания происходят большие изменения в связи с открытием новых лекарств (Thatoi et al., 2013; Chávez et al., 2015). Интересно, что богатое разнообразие видов грибов обитает в экстремальных условиях, таких как глубоководные отложения и мангровые экосистемы (Kumaresan and Suryanarayanan, 2001; Mahé et al., 2013). Было обнаружено, что многие аскомицетные виды, обитающие в этих местообитаниях, обладают противовирусной и другой биологической активностью (Desmukh et al., 2018). Считается, что экстремальные условия формируют структуру вторичных метаболитов грибов, и эти грибы признаны особенно многообещающим источником разнообразных и структурно беспрецедентных новых соединений, некоторые из которых уже были структурно охарактеризованы, а некоторые, как было обнаружено, составляют новые углеродные скелеты ( Saleem et al., 2007).
Однако не следует упускать из виду и уже относительно известные грибы. Менее интенсивно исследуемые грибы на предмет их биоактивности включают древесные патогены, которые также кажутся многообещающим источником противовирусных агентов. Предыдущее исследование выявило ряд патогенных грибов растений с различной экологической ролью (грибы белой гнили, грибы мягкой гнили, грибы синей окраски и насекомые-симбионты), обладающих противовирусной активностью (Mlinaric et al., 2005).
Антивирусные исследования и таксономия грибов
Точная идентификация организмов – основа любого биологического исследования и его применения.Это особенно важно для биоактивных соединений, предназначенных для фармацевтических продуктов. Когда об используемом физическом материале сообщается с неправильным названием, воспроизводимость исследования очень низкая. К сожалению, в литературе о биоактивности и механизмах действия изолированных соединений или сырых экстрактов грибного происхождения сообщения о методах, используемых для идентификации грибных материалов, выявляют нечувствительность к соответствующим таксономическим обсуждениям. Методологически только меньшая часть исследований включала комбинацию морфологических и молекулярных методов для идентификации видов (Raja et al., 2017). Учитывая фактическое разнообразие королевства грибов и связанные с этим трудности с разграничением видов и родов, а также постоянные открытия новых для науки видов (Hawksworth and Lücking, 2017), прозрачность в этом вопросе имеет первостепенное значение. Длительные споры среди систематиков о том, следует ли принимать новые названия, разделить старый вид на множество новых или сочетать старые названия, являются повседневным делом в этой области. В некоторых случаях это привело к значительной номенклатурной стратификации, подчеркнув необходимость привлечения таксономистов также к изучению приложений.
Чтобы проиллюстрировать эту проблему, мы проанализировали литературу по одному из наиболее часто упоминаемых названий, появляющихся в исследованиях грибковых противовирусных препаратов, « Ganoderma lucidum », а также по другим видам из рода Ganoderma Karst. Пористые сапротрофные грибы G. lucidum (W. Curt .: Fr.) Karst – краткий пример более широкой проблемы. Традиционное лекарственное использование Ganoderma spp. в Восточной Азии, Юго-Восточной Азии и Африке повысил интерес к изучению биоактивности этих грибов с « G.lucidum ’часто упоминается как вид материала. Однако точное определение видовой концепции для G. lucidum с местонахождением европейского типа было затруднено из-за отсутствия экземпляра голотипа (Steyaert, 1972; Moncalvo and Ryvarden, 1997). После морфологических и молекулярно-филогенетических исследований разнообразия этого рода в последние десятилетия (Moncalvo et al., 1995; Cao et al., 2012; Zhou et al., 2015) в таксономической литературе пришли к единому мнению, что промышленно культивируемые «Linghzi» и «Reishi» не представляют G.lucidum s. str , но на самом деле это другие виды (Wang et al., 2009; Cao et al., 2012). Поэтому при идентификации таких образцов под этим именем требуется тщательное рассмотрение. Здесь мы перечислили описанные методы получения и идентификации, использованные в каждом противовирусном исследовании на Ganoderma (дополнительная таблица S2). Подводя итог, можно сказать, что из 13 исследований только в четырех использовался материал, который, как мы можем с уверенностью предположить, представляет заявленный вид, поскольку проводились консультации с грибковым систематиком. В восьми случаях это кажется маловероятным, учитывая источники материалов, но в принципе может быть подтверждено обратное, предполагая доступ к исходным материалам в гербариях.В одном случае экспериментальная установка, вероятно, не воспроизводима из-за нечеткого описания использованного материала и очевидного отсутствия каких-либо сохранившихся образцов. Ни в одном исследовании не сообщалось о регистрационных номерах данных о последовательностях или морфологических критериях, используемых для определения видов. Существовали различные формы авторства, в том числе устаревшие и ошибочные, с названием G. lucidum .
Правильно ли идентифицирован материал грибов, влияет ли оно на независимую воспроизводимость исследования, а также влияет на понимание характеристик вида (т.е., требования и фенотипические вариации в условиях искусственного культивирования). Существует еще ограниченное количество сравнительных работ по различиям между видами и штаммами состава в биоактивных соединениях в пределах Ganoderma . Публикации, доступные на данный момент, указывают на то, что различия могут быть значительными (Welti et al., 2015; Hennicke et al., 2016), хотя оценки степени встречаемости представляющих интерес соединений в пределах рода снова запутаны непрозрачными представление материалов (Richter et al., 2015). В заключение, учитывая вероятность неправильного использования названий в литературе, цитируя исследования, в которых не указаны критерии идентификации, в качестве доказательства противовирусного потенциала G. lucidum s. ул. необходимо принять во внимание эту двусмысленность.
Неправильная идентификация видов и даже родов еще более вероятна для микроскопических грибов (таких как эндофиты), содержащих мелкие и частично совпадающие морфологические характеристики, таксономия и разнообразие которых остаются в значительной степени неисследованными.Поэтому мы подчеркиваем важность прозрачности в отчетности об использованной номенклатуре, физическом материале грибов и методах идентификации, что имеет первостепенное значение для продвижения исследований противовирусных препаратов от грибов. Кроме того, мы призываем сообщество исследователей натуральных продуктов принять недавно предложенный набор стандартизированных процедур для идентификации грибов (Raja et al., 2017).
Обзор методов оценки противовирусной активности
Наиболее широко используемыми методами первоначального скрининга экстрактов грибов с целью оценки их противовирусной активности является анализ уменьшения зубного налета (Zhu et al., 2004; Фаччин и др., 2007; Rincão et al., 2012), анализ цитопатического эффекта (CPE) (Liu et al., 2004; Zhang et al., 2011) и иммунофлуоресцентный анализ (Faccin et al., 2007) (Таблица 2). Кроме того, также использовались различные коммерчески доступные анализы жизнеспособности, контролирующие, например, клеточные уровни АТФ. Эти анализы также используются для проведения исследований времени добавления и исследования прямой вирулицидной активности экстрактов грибов (Liu et al., 2004; Faccin et al., 2007).
ТАБЛИЦА 2. Методы, используемые для оценки противовирусных эффектов.
Все эти методы по-разному рассчитывают жизнеспособность клеток после воздействия вируса, а противовирусная активность отслеживается как спасение клеток от вирусной инфекции. Считывание для анализа уменьшения бляшек – это визуальный подсчет количества образовавшихся бляшек [единица образования бляшек (БОЕ) / мл], то есть количества неокрашенных «дырок» в культуральной пластине после окрашивания кристаллическим фиолетовым клеток, которые еще прилипли. на тарелке.Это число затем используется для расчета процента вирусного ингибирования (% V.I.) (Zhu et al., 2004). В иммунофлуоресцентном анализе клетки наблюдают под микроскопом и обычно оценивают несколько сотен клеток. Во-первых, количество инфицированных клеток рассчитывается из количества клеток, показывающих высокое содержание вирусных капсидных белков, продуцируемых в цитоплазме клетки (Marjomäki et al., 2002). Затем из полученного номера В.И. рассчитывается по отношению к необработанным инфицированным клеткам (Faccin et al., 2007). В случае анализа CPE считывание основано на показании спектрофотометрического поглощения окрашенных жизнеспособных клеток, которое используется для расчета% V.I. (Лю и др., 2004). Обычно жизнеспособные клетки, оставшиеся на дне культурального планшета и окрашенные кристаллическим фиолетовым, растворяются в буфере для лизиса, чтобы получить гомогенную синюю суспензию, которую легко измерить на спектрофотометре (Schmidtke et al., 2001). Линейный регрессионный анализ графиков% В.И. используется для определения 50% ингибирующей концентрации (IC 50 ), которая в дальнейшем используется для расчета индекса селективности (SI) (Rincão et al., 2012). Расчеты здесь также представлены в виде формул:
% VI, рассчитанный на основе результатов анализа уменьшения бляшек = [1- (количество бляшек в тесте / число бляшек в вирусном контроле)] × 100 (Rincão et al., 2012)% VI, рассчитанный на основе результатов анализа CPE = [(ODt) v – (ODc) v] / [(ODc) mock – (ODc) v] × 100 (Liu et al., 2004)
, где (OD t ) v – оптическая плотность (OD) клетки, обработанной вирусом и биоэкстрактом (тест), (OD c ) v – OD клетки, обработанной вирусом (вирусный контроль) и (OD c ) ложный – OD ложно инфицированной клетки (клеточный контроль).
SI = CC50 / IC50
Где CC50 – это 50% цитотоксическая концентрация, т. Е. Концентрация, которая вызвала 50% снижение количества жизнеспособных клеток или оптической плотности, а IC50 – 50% ингибирующая концентрация, т. Е. Концентрация, способная снизить на 50% БОЕ относительно к элементам управления.
Эти вышеупомянутые методы только подтверждают противовирусный потенциал биологически активных соединений и не раскрывают никакой информации относительно механизма их действия. Только несколько статей были продвинуты, чтобы оценить фактические молекулярные мишени.Для изучения различных вирусных или клеточных мишеней действия лекарств можно использовать несколько подходов. Чтобы изучить прямое воздействие на вирус, можно использовать несколько методов. Во-первых, возможно, самый простой способ увидеть общий эффект на вирусную частицу – это негативно окрасить образцы вируса и наблюдать их под просвечивающим электронным микроскопом (TEM) (Myllynen et al., 2016). Существует характерная особенность, позволяющая отличать интактные вирусы от пустых частиц при визуализации ПЭМ.Окрашивающий краситель, например, 2% уранилацетат или 1% фосфорновольфрамовая кислота, не может проникнуть в капсид интактных вирусов, из-за чего неповрежденные частицы выглядят яркими, то есть неокрашенными, на изображениях ПЭМ (из-за контраста красителя). Однако в случае пустых вирусов, поскольку капсид открыт, краситель проникает в капсид и окрашивает внутренности вируса, создавая темный вид пустых вирусных частиц на изображениях ПЭМ. Центрифугирование в градиенте плотности радиоактивно меченного или немеченого вируса также помогает выявить прямое влияние экстракта на вирус (Marjomäki et al., 2002; Myllynen et al., 2016). Результатом фракционирования с радиоактивным градиентом является радиоактивность [количество импульсов в минуту (CPM)] различных фракций с разной плотностью, показывающая пики более плотного интактного вируса и менее плотного пустого вируса или даже более мелких продуктов, таких как пентамеры. Прямые эффекты биологически активных агентов должны показывать четкие изменения доли интактных и пустых вирусов.
Влияние на прикрепление вируса к клеточным рецепторам было изучено с помощью анализов связывания.Связывание наиболее чувствительно изучается с использованием радиоактивно меченного вируса и путем проведения анализов связывания на холоду, что исключает проникновение вируса внутрь клеток за счет эндоцитоза (Marjomäki et al., 2002). Специфические эффекты молекул, мешающих связыванию рецепторов, также были выполнены in silico с использованием молекулярных докинговых исследований (Zhang et al., 2014). Нацелено ли лекарство на вирус без оболочки in vitro или пока вирус находится внутри клеточных компартментов, можно оценить с помощью спектроскопии в реальном времени с помощью флуоресцентных красителей, связывающих РНК / ДНК (Myllynen et al., 2016) и с использованием исследований фракционирования радиоактивного градиента соответственно. Радиоактивно меченный вирус может быть выделен из клеток для градиентного фракционирования, которое может выявить, есть ли блок в высвобождении вирусного генома, таким образом оставляя вирус нетронутым на более длительные периоды. Чтобы оценить влияние биоэкстракта на эффективность репликации и вирусной трансляции, может быть выполнено иммунофлуоресцентное мечение, которое выявляет продукцию белков капсида вируса и определенных промежуточных продуктов репликации, таких как, например, e.g., дцРНК (Martikainen et al., 2015). Кроме того, для выявления продукции новой вирусной РНК может использоваться количественная ПЦР.
Существуют также более специфические анализы, которые использовались для тестирования биологически активных агентов против вирусспецифических белков, таких как протеазы. Эти анализы были разработаны непосредственно против конкретных вирусов, таких как ВИЧ или цитомегаловирус человека (hCMV) (Guo et al., 2000; Singh et al., 2004). Эти анализы обычно представляют собой анализов in vitro, анализов, основанных на очищенных протеазах.
Биоактивные вещества, действующие как противовирусные препараты
Низкомолекулярные вторичные метаболиты грибов были источником различных лекарств, и те же классы вторичных метаболитов кажутся многообещающими также против вирусов (Таблица 3).Другие биоактивные соединения с потенциальной противовирусной активностью включают высокомолекулярные соединения, такие как полисахариды, белки и производные лигнина.
ТАБЛИЦА 3. Биоактивные вещества против грибков с заявленной противовирусной активностью.
Малые органические молекулы (вторичные метаболиты)
Вторичные метаболиты грибов представляют собой низкомолекулярные соединения, которые, в отличие от первичных метаболитов, не требуются напрямую для роста организма.Их экологическая функция в природе остается широко неизвестной. Было высказано предположение, что вторичные метаболиты способствуют химической связи с другими организмами и конкуренции с ними (Yim et al., 2007; Khaldi et al., 2010). Некоторые из них также имитируют защитные соединения растений и, следовательно, могут защищать растения-хозяева от травоядных и патогенов (Kusari et al., 2012). Большинство известных вторичных метаболитов было идентифицировано у аскомицетов с помощью традиционных подходов к скринингу на основе культур, особый интерес представляют морские и растительные эндофитные грибы (Strobel and Daisy, 2003; Saleem et al., 2007; Кусари и др., 2012; Thatoi et al., 2013; Стирл и Стирл, 2015; Desmukh et al., 2018).
Производство вторичных метаболитов наиболее часто изучается на установках in vitro , где изучаются соединения, секретируемые клетками гиф в культуральную среду. Хотя эти исследования сформировали важную основу для открытия биоактивных метаболитов грибов, вполне вероятно, что истинный потенциал грибов как продуцентов вторичных метаболитов был недооценен.Проекты, основанные на геномах, предоставили новые идеи и продемонстрировали, что многие криптические кластеры генов, участвующие в биосинтезе вторичных метаболитов, молчаливы или плохо выражаются в стандартных условиях культивирования / ферментации, традиционно используемых для скрининга вторичных метаболитов (Bergmann et al., 2007; Khaldi et al. al., 2010; Brakhage, 2013; Clevanger et al., 2017). Чтобы активировать кластеры молчаливых биосинтетических генов, в качестве стимулов использовалось изменение условий роста (таких как источники углерода и азота, температура, свет, pH и аэрация).Однако регуляция пути биосинтеза вторичного метаболизма сложна, и они не являются универсально значимыми стимулами для большинства кластеров генов и видов грибов (Brakhage, 2013). Анализ генома предоставляет новые возможности для понимания генетической основы производства вторичных метаболитов и разработки стратегий активации молчащих метаболических путей (Bergmann et al., 2007; Andersen et al., 2012; Ochi and Hosaka, 2013).
Геном каждого гриба содержит замечательную способность кластеров биосинтетических генов, кодирующих продукцию различных вторичных метаболитов (Khaldi et al., 2010; Чен и др., 2012; Инглис и др., 2013; Han et al., 2016). Хотя вторичные метаболиты структурно очень разнообразны, они продуцируются несколькими общими биосинтетическими путями (Keller et al., 2005). Предыдущие исследования, в которых применялись прогнозы генома, выявили, что кластеры генов нерибосомальной пептид-синтазы (NRPS) и поликетид-синтазы (PKS) являются наиболее распространенными, а также гибридные ферменты NRPS-PKS, пренилтрансферазы (DMATS), терпенциклазы (TC) обычно присутствует в грибах (Bergmann et al., 2007; Khaldi et al., 2010; Андерсен и др., 2012; Han et al., 2016). Эти «основные» ферменты ответственны за синтез структур ядра вторичных метаболитов, которые включают нерибосомные пептиды, поликетиды, гибриды NRPS-PKS, индольные алкалоиды и терпеноиды, соответственно (Hoffmeister and Keller, 2007). Синтезированные ядерные структуры и промежуточные продукты обычно дополнительно модифицируются путем адаптации ферментов до того, как конечный продукт будет транспортироваться за пределы клетки гриба (Andersen et al., 2012; Брахейдж, 2013).
Соединения с высокой молекулярной массой
Клеточная стенка грибов является важным структурным компонентом, который защищает клетки от окружающей среды и других организмов. Клеточная стенка грибов позволяет избирательно обмениваться соединениями с другими клетками и с их окружением. Кроме того, он также придает форму и прочность грибковой клетке. Состав клеточной стенки варьируется между видами грибов и в пределах одного вида или штамма (например,ж., стадия роста, условия роста, факторы окружающей среды). Несмотря на вариабельность состава, основными компонентами, которые обычно можно найти в грибах, являются белки и полисахариды (Bowman and Free, 2006). Сообщалось, что высокомолекулярные полисахариды (такие как глюкан, хитин, маннан, PSK или лентинан) из плодовых тел и мицелия грибов обладают противовирусной активностью (Tochikura et al., 1987, 1988; Cardozo et al., 2011; Rincão et al. др., 2012).
Чтобы изучить механизм действия полисахаридов против детерминированного вируса, необходимо понять его химический состав.Анализ структуры полисахаридов – сложная задача, требующая нескольких этапов выделения. Когда полисахариды извлекаются из образца грибов, определение чистоты становится приоритетной задачей для понимания химической структуры. Знания о составе моносахаридов, положениях связи между гликозидными связями, различии фуранозидных и пиранозидных колец, аномерной конфигурации, последовательностях моносахаридных остатков и повторяющихся единиц, заменах и молекулярной массе, включая их распределение, необходимы для определения структуры определенный полисахарид (Cui, 2005).
Присутствие белков в клеточной стенке также имеет защитную функцию, поскольку они отвечают за восприятие стимулов (Geoghegan et al., 2017). Следовательно, белки участвуют в производстве и регуляции вторичных метаболитов (Bok and Keller, 2016). Более того, их присутствие в клеточной стенке в сочетании с полисахаридными комплексами позволяет взаимодействовать с окружающей средой, помогая грибковой клетке переносить вещества в грибковую клетку и из нее.
В нескольких отчетах упоминается ингибирование репликации для нескольких типов вирусов, предполагая, что и полисахариды, и белки действуют на первых фазах системы репликации вируса (Tochikura et al., 1988; Коллинз и Нг, 1997; Eo et al., 1999a, b, 2000; Пираино и Брандт, 1999; Ким и др., 2000; Ван и Нг, 2000; Нгаи и Нг, 2003; Gu et al., 2007; Cardozo et al., 2011; Ямамото и др., 2013). Однако взаимодействие белков и полисахаридов с системой репликации вируса до конца не изучено.
Противовирусные механизмы
Возможность действовать на разных этапах жизненного цикла вируса
Есть несколько возможностей противодействовать вирусной инфекции (Рисунок 4).Вирусы можно атаковать напрямую вне клетки, чтобы разрушить вирусные частицы до того, как они прикрепятся к клеточным рецепторам. Такие агенты могут необратимо модифицировать вирусные частицы на различных поверхностях или, если они не токсичны, также в организме человека. Для энтеровирусов человека было разработано несколько молекул, которые помещаются в специальный гидрофобный карман, заменяя тем самым алифатическую жирную кислоту, обычно содержащуюся в вирусной частице (De Colibus et al., 2014). Эта стратегия призвана стабилизировать вирусную частицу и предотвратить снятие оболочки вируса.Этот карман также находится близко к области связывания рецептора, и поэтому молекулы, нацеленные в карман, могут потенциально ингибировать связывание рецептора. Эти молекулы продемонстрировали некоторую мощь своего противовирусного действия. Однако связывание с этими карманами обычно носит динамический характер, и результаты долгосрочных исследований не увенчались успехом. Однако в течение коротких периодов времени эти молекулы показали свою эффективность.
РИСУНОК 4. Схематическое изображение жизненного цикла одноцепочечной РНК без оболочки с положительным смыслом.Стадии заражения вирусом, которые включают прикрепление, проникновение, снятие оболочки, высвобождение генома, геномную репликацию, трансляцию, сборку и выход, служат потенциальными мишенями для противовирусных препаратов.
Ингибирование связывания рецептора – еще одна возможность предотвратить вирусную инфекцию. Когда несколько вирусных групп используют похожие рецепторы, эта стратегия дает хорошую возможность предотвратить вирусную инфекцию, например, в случае связывания гепарансульфата (Cagno et al., 2018). Большинство вирусов используют цитоплазматические эндосомы в качестве портала для входа в клетки.Это можно рассматривать как действительный шаг по ограничению скорости для многих вирусов, особенно для вирусов без оболочки. Используя слитые пептиды, которые обычно действуют при низких значениях pH, вирусы в оболочке разработали средства для слияния с ограничивающей мембраной эндосом, высвобождая таким образом их содержимое в цитоплазму. Таким образом, несколько молекул, предотвращающих снижение эндосомального pH, достаточно эффективно подавляют вирусную инфекцию. Однако, поскольку низкий pH является важным событием для нормального поглощения питательных веществ и передачи сигналов через эндосомы, такие стратегии на самом деле неосуществимы.Вирусы без оболочки обычно не зависят от низкой кислотности. Недавно мы показали, что энтеровирусы, как правило, не используют низкий pH в своей стратегии заражения клеток, а скорее накапливаются в эндосомах с более высокой кислотностью (Marjomäki et al., 2015). Пока существует очень мало информации о способах преодоления эндосомного барьера вирусами без оболочки.
Вирусы на основеРНК начинают свою трансляцию и транскрипцию обычно в цитоплазме. Эти события являются хорошей мишенью для нескольких антивирусных препаратов, поскольку многие механизмы могут быть нацелены на большее количество вирусных групп.ДНК-вирусы попадают в ядро и начинают там свою репликацию. Для репликации нескольких вирусов используются различные мембранные органеллы, поскольку обычно репликация происходит на поверхности мембранных структур. В самом деле, вирусная инфекция обычно сильно нарушает функционирование различных эндосом, ER и Гольджи в пользу вирусов. Кроме того, часто холестерин и некоторые более редкие формы липидов используются для репликации вируса и могут служить мишенями для борьбы с вирусной инфекцией.
Во время трансляции и репликации, помимо вирусных структурных белков, в цитоплазме синтезируется несколько неструктурных вирусных белков. Некоторые существующие стратегии против вирусной инфекции нацелены на вирусные протеазы или вирусные полимеразы и могут оказаться успешными в предотвращении вирусной инфекции.
Сборка вируса происходит в цитоплазме нескольких вирусов без оболочки, что, в конце концов, вызывает литическое разрушение клетки и распространение потомства вирусов на соседние клетки.Литическим событиям часто предшествует активация каспаз, способствующая апоптозу. Вирусы являются главными манипуляторами передачи сигналов антиапоптотического фактора роста и проапоптотических каспазных путей. Обычно вирусы пытаются предотвратить апоптоз на ранней стадии заражения, но могут усилить апоптозные процессы позже, чтобы облегчить эффективное распространение в клеточном окружении. Следовательно, стратегии управления апоптозом могут быть сложными. Однако ранее мы показали, что нацеливание на молекулы BCl, таким образом, усиливая апоптоз, способствует раннему уничтожению вирусной инфекции и предотвращает возможность развития у гриппа и HSV сложных симптомов, обычно встречающихся при вирусной инфекции (Bulanova et al., 2017). Таким образом, возможно, в сочетании с другими противовирусными препаратами, эта стратегия, возможно, может быть использована для противовирусного действия.
Вирусы в оболочке обычно берут свою оболочку из плазматической мембраны и используют некоторые компоненты клеточного аппарата, ESCRTS, для облегчения топологически исходящего образования вирусных частиц, как в случае вирусов ВИЧ, отпочковывающихся из клеток. Атака на эти компоненты ESCRT может потенциально предотвратить распространение вируса, но также нацелена на элементарные аспекты формирования мультивезикулярной структуры эндосом.
Механизмы найдены на данный момент
Для механистических исследований до сих пор изучено довольно ограниченное количество вирусов. Вирус простого герпеса (HSV) был наиболее тщательно протестирован против некоторых очищенных и неочищенных грибковых продуктов (Таблица 4). В дополнение к HSV, вирусы гриппа (IF) были протестированы против некоторых очищенных грибковых продуктов. И HSV, и IF – это вирусы с оболочкой, которые, как правило, более склонны к деградации и дестабилизации. Напротив, вирусы без оболочки считаются более устойчивыми и могут сохранять стабильность даже в суровых условиях в течение длительных периодов времени.Возможно, поэтому от грибковых продуктов было обнаружено меньше попаданий. Однако было показано, что полиовирус, являющийся членом энтеровирусов без оболочки, поражается продуктами, производными от Lentinula edodes и Agaricus subrufescens (таблица 4). Кроме того, было показано, что тритерпеноиды из G. lucidum эффективно снижают инфекционность энтеровируса 71 (таблица 4).
ТАБЛИЦА 4. Противовирусные механизмы.
Есть несколько опубликованных антивирусных исследований, особенно с съедобными грибами и их водным и этанол / метанольным экстрактами.Большинство исследований противовирусного действия проводилось с использованием стандартного анализа бляшек или анализа CPE, измеряющего количество инфекционных частиц после лечения. В таких анализах ингибирующее действие могло иметь место на любой стадии вирусной инфекции, начиная с прямого воздействия на саму вирусную частицу. Более подробная информация об ингибирующем эффекте была получена во время дополнительных исследований, когда ингибирующие молекулы добавлялись на разных стадиях вирусной инфекции (Faccin et al., 2007; Ямамото и др., 2013). Эти исследования выявили несколько экстрактов и изолированных молекул, которые показали ингибирующее действие непосредственно на вирусные частицы или на адсорбцию вируса на клетках (см. Таблицу 4). Более подробные исследования тритерпеноидов Ganoderma с использованием инструментов молекулярного докинга показали сродство к гидрофобному карману энтеровируса 71, предполагая, что это может повлиять либо на непокрытие, либо на связывание с клеточным рецептором (Zhang et al., 2014). Эти тритерпеноиды показали лучшую эффективность, когда они были сначала смешаны с вирусом перед добавлением в клетки, подтверждая, что либо снятие оболочки, либо связывание с клетками действительно были мишенью.Однако без дальнейшего анализа, посвященного этим этапам, с помощью тестов специфического связывания или тестов без покрытия фактический механизм остается неизвестным.
Некоторые исследования показали преимущественное ингибирование еще несколько часов p.i. предполагая, что ингибирующее действие, вероятно, было связано с трансляцией или репликацией вирусного белка. Более прямые исследования были проведены с анализами, которые специфически нацелены на вирусные белки in vitro . Эти исследования в большей степени проводились с протеазами ВИЧ и обратными транскриптазами.Такие исследования позволили точно определить ганодеровую кислоту и тритерпеноиды, а также аденозин, велютин и новый агент массой 4,5 кДа, непосредственно воздействующий на белки ВИЧ (Sato et al., 2009). Во многих случаях биоактивное соединение химически модифицируют для повышения его противовирусной активности. Cardozo et al. (2011), получили сульфатированное производное полисахарида, выделенное из Agaricus brasiliensis , и обнаружили, что сульфатированный полисахарид проявляет повышенную противовирусную активность против HSV I.
Перспективы на будущее
В настоящее время на рынках лекарств представлены многочисленные метаболиты грибкового происхождения, такие как ловастатин, антибиотики и противогрибковый агент гризеофульвин.Соединения грибкового происхождения не одобрены для противовирусного лечения. Однако, поскольку многочисленные предыдущие исследования показали, что многие из них обладают потенциальной противовирусной эффективностью (таблицы 1, 4), то, вероятно, это только вопрос времени, когда некоторые молекулы будут взяты для клинических испытаний. Эффективные противовирусные грибковые соединения, демонстрирующие лучшие ADME (фармакокинетические характеристики: адсорбция, распределение, метаболизм и экскреция) in vitro , будут взяты для испытаний на животных in vivo .Однако до сих пор проведено очень мало хорошо спланированных и высококачественных клинических испытаний лечения стандартизированными лекарственными средствами грибкового происхождения (Zhou et al., 2005; Gargano et al., 2017).
Стандартизация биосинтеза биологически активных соединений для испытаний, а также доведение до промышленных масштабов связано со сложностью биологии и экологии грибов. Известно, что межвидовые взаимодействия влияют на метаболизм грибов в естественной среде организма, но их важность для биотехнологических приложений остается малоизученной проблемой (Kusari et al., 2014а, б). Внутривидовая генетическая и морфологическая изменчивость затрудняет оптимизацию условий культивирования (Posch et al., 2013). Тем не менее, увеличение числа последовательностей генома грибов в сочетании с метаболомикой открывает новые возможности для понимания регуляции вторичного метаболизма, повышения выхода целевых соединений, а также предоставляет платформу для открытий новых лекарств (Harvey et al., 2015).
Наряду с культивированием в жидкости из собранных спорокарпов были извлечены потенциальные противовирусные препараты грибов, особенно в исследованиях на базидиомицетах.Одомашнивание различных видов, продуцирующих спорокарпий, было успешным в рамках промышленного симбиоза, основанного на легко доступных лигноцеллюлозных отходах сельского и лесного хозяйства. Этот подход в некоторых случаях поддерживался наблюдаемыми трудностями в получении конкретных метаболитов в противном случае (Chen et al., 2012), хотя есть известные проблемы, связанные с экономическими затратами и контролем качества (Hu et al., 2017; Wu et al., 2017).
Несмотря на эти многочисленные проблемы с видами, которые в некоторых случаях изучались в течение десятилетий, также важно продолжить изучение видового разнообразия грибов, поскольку только небольшое количество известных грибов было исследовано на предмет противовирусной активности.В то время как горячие точки биоразнообразия и малоизученные среды обитания особенно важны для поиска неизвестных видов грибов, загадочные виды представляют собой значительный генетический резерв также в давно изученных экосистемах (Hawksworth and Lücking, 2017). В этом случае особенно актуально междисциплинарное взаимодействие между вирусологами и грибковыми систематиками.
Заключение
Поскольку грибы являются богатым источником биоактивных агентов, накопление ноу-хау о реальных обогащенных биоактивных молекулах и их детальных мишенях в вирусных семействах, вероятно, в ближайшем будущем увеличится.В настоящее время существует довольно ограниченное понимание противовирусных механизмов действия грибковых продуктов на вирусную инфекцию. Таким образом, более подробные знания о реальных молекулярных мишенях имеют решающее значение для дальнейшей разработки этих молекул для эффективной борьбы с вирусными инфекциями в будущем. Для детального понимания механизмов действия необходимы лабораторные анализы, нацеленные непосредственно на различные этапы вирусной инфекции.
Авторские взносы
Все авторы активно участвовали в разработке идеи данной обзорной статьи.Обзор литературы и написание рукописи были выполнены RL, DR, PV, MC-E и VM. HV собрал необходимые ресурсы и прокомментировал рукопись. Все авторы внесли свой вклад в доработку рукописи и одобрили ее к публикации.
Финансирование
Это исследование финансировалось проектом LUKE Leads MushValue, Институт природных ресурсов Финляндии (LUKE). DR при финансовой поддержке Фонда Джейн и Аатоса Эркко, а MC-E – Фондом Ниеми.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmicb.2018.02325/full#supplementary-material
Список литературы
Аморос, М., Басти, Дж., Пи, М.-Л., Эрве, В., и Робин, В. (1997). Противовирусная активность гомобазидиомицетов: оценка экстрактов 121 базидиомицетов на четырех вирусах. Внутр. J. Pharmacogn. 35, 255–260. DOI: 10.1076 / phbi.35.4.255.13308
CrossRef Полный текст | Google Scholar
Амзат Дж. И Разум О. (ред.). (2018). «Традиционная медицина в Африке», в К социологии дискурса здоровья в Африке, , (Чам: Спрингер). DOI: 10.1007 / 978-3-319-61672-8
CrossRef Полный текст | Google Scholar
Андерсен, М.Р., Нильсен, Дж. Б., Клитгаард, А., Петерсен, Л. М., Захариасен, М., Хансен, Т. Дж. И др. (2012). Точный прогноз кластеров генов вторичных метаболитов в мицелиальных грибах. Proc. Natl. Акад. Sci. США 110, E99 – E107. DOI: 10.1073 / pnas.1205532110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Авадх Али, Н.А., Мотана, Р.А., Леснау, А., Пилигрим, Х., и Линдеквист, У. (2003). Противовирусная активность Inonotus hispidus . Fitoterapia 74, 483–485.DOI: 10.1016 / S0367-326X (03) 00119-9
CrossRef Полный текст | Google Scholar
Бейкер Д., Мочек У. и Гарр К. (2000). «Натуральные продукты против комбинаторных: тематическое исследование», в журнале Biodiversity: New Leads for Pharmaceutical and Agrochemical Industries , eds SK Wrigley, MA Hayes, R. Thomas, EJT Chrystal и N. Nicholson (Кембридж: Королевское общество Химия. 66–72.
Google Scholar
Баррос, Л., Баптиста, П., Коррейя, Д. М., Касал, С., Оливейра, Б., и Феррейра, И. К. Ф. Р. (2007). Состав жирных кислот и сахара, а также пищевая ценность пяти диких съедобных грибов из Северо-Восточной Португалии. Food Chem. 105, 140–145. DOI: 10.1016 / j.foodchem.2007.03.052
CrossRef Полный текст | Google Scholar
Баррос, Л., Круз, Т., Баптиста, П., Эстевиньо, Л. М., и Феррейра, И. К. Ф. Р. (2008). Дикие и съедобные грибы как источник питательных веществ и нутрицевтиков. Food Chem. Toxicol. 46, 2742–2747.DOI: 10.1016 / j.fct.2008.04.030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Башял Б. П., Велленсиек Б. П., Рамакришан Р., Фаэт С. Х., Ахмад Н. и Гунатилака А. А. (2014). Альтертоксины с сильной анти-ВИЧ активностью из Alternaria tenuissima QUE1Se, грибкового эндофита Quercus emoryi . Bioorgan. Med. Chem. 2, 6112–6116. DOI: 10.1016 / j.bmc.2014.08.039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бергманн, С., Шюманн, Дж., Шерлах, К., Ланге, К., Брахаге, А. А., и Хертвек, К. (2007). Геномное открытие гибридных метаболитов PKS-NRPS из Aspergillus nidulans . Нат. Chem. Биол. 3, 213–217. DOI: 10.1038 / nchembio869
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бок, Дж. У., и Келлер, Н. П. (2016). «Понимание вторичного метаболизма грибов на основе десятилетних исследований LaeA», в Biochemistry and Molecular Biology , ed.Д. Хоффмайстер (Cham: Springer International Publishing Switzerland), 21–30.
Google Scholar
Брюэр, С. (2000). «Взаимосвязь между натуральными продуктами и синтетической химией в процессе открытия», в Biodiversity: New Leads for Pharmaceutical and Agrochemical Industries , eds SK Wrigley, MA Hayes, R. Thomas, EJT Chrystal и N. Nicholson (Cambridge: The Королевское химическое общество), 59–65.
Google Scholar
Брюггеманн, Р., Орланди, Дж. М., Бенати, Ф. Дж., Фаччин, Л. К., Мантовани, М. С., Нозава, С. и др. (2006). Противовирусная активность Agaricus blazei Murrill ss. Экстракт Heinem против герпесвирусов человека и крупного рогатого скота в культуре клеток. Braz. J. Biol. 37, 561–565.
Google Scholar
Буланова Д., Яневски А., Бугай А., Акимов Ю., Куйванен С., Паавилайнен Х. и др. (2017). Противовирусные свойства химических ингибиторов клеточных антиапоптотических белков Bcl-2. Вирусов 9: E271.DOI: 10.3390 / v71
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bunyapaiboonsri, T., Yoiprommarat, S., Srikitikuchai, P., Srichomthong, K., and Lumyong, S. (2010). Облонголиды эндофитного гриба Phomopsis sp. BCC 9789. J. Nat. Prod. 73, 55–59. DOI: 10.1021 / np0c
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чагларырмак, Н. (2007). Питательные вещества экзотических грибов (виды Lentinula edodes и Pleurotus ) и приблизительный подход к летучим соединениям. Food Chem. 105, 1188–1194. DOI: 10.1016 / j.foodchem.2007.02.021
CrossRef Полный текст | Google Scholar
Каньо В., Андроцци П., Д’Аликарнассо М., Сильва П. Дж., Мюллер М., Галлу М. и др. (2018). Нетоксичные противовирусные наночастицы широкого спектра действия с механизмом подавления вирулицидности. Нат. Mater. 17, 195–203. DOI: 10.1038 / nmat5053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цао Ю., Ву С. и Дай Ю.(2012). Уточнение видов призового лекарственного Ganoderma гриб «Линчжи». Fungal Divers. 56, 49–62. DOI: 10.1007 / s13225-012-0178-5
CrossRef Полный текст | Google Scholar
Cardozo, F. T., Camelini, C. M., Leal, P. C., Kratz, J. M., Nunes, R.J., Mendonça, M. M., et al. (2014). Противогерпетический механизм сульфатированного производного полисахарида плодовых тел Agaricus brasiliensis . Intervirology 57, 375–383. DOI: 10.1159/000365194
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кардозо, Ф. Т., Камелини, К. М., Маскарелло, А., Росси, М. Дж., Барарди, К. Р., де Мендонса, М. М. и др. (2011). Антигерпетическая активность сульфатированного полисахарида из мицелия Agaricus brasiliensis . Antiviral Res. 92, 108–114. DOI: 10.1016 / j.antiviral.2011.07.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чан, Ю. Ф., и Абу Бакар, С.(2005). Вирулицидная активность Virkon S в отношении энтеровируса человека 71. Med. J. Malaysia 60, 246–248.
PubMed Аннотация | Google Scholar
Чавес Р., Фиерро Ф., Гарсиа-Рико Р. О. и Вака И. (2015). Нитчатые грибы из экстремальных условий окружающей среды как многообещающий источник новых биоактивных вторичных метаболитов. Фронт. Microbiol. 6: 903. DOI: 10.3389 / fmicb.2015.00903
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, Л., Шао, Х. Дж., И Су, Ю. Б. (2004). Совместная иммунизация экстракта мюрилл Agaricus blazei мюрилл коровым белком вируса гепатита В с помощью ДНК-вакцины усиливает клеточные и гуморальные иммунные ответы. Внутр. Иммунофармакол. 4, 403–409. DOI: 10.1016 / j.intimp.2003.12.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chen, S., Xu, J., Liu, C., Zhu, Y., Nelson, D. R., Zhou, S., et al. (2012). Последовательность генома модельного лекарственного гриба Ganoderma lucidum . Нат. Commun. 3: 913. DOI: 10.1038 / ncomms1923
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cheung, R. C., Wong, J. H., Pan, W. L., Chan, Y. S., Yin, C. M., Dan, X. L., et al. (2014). Противогрибковые и противовирусные препараты морских организмов. Заявл. Microbiol. Biotechnol. 98, 3475–3494. DOI: 10.1007 / s00253-014-5575-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Клерк, Э. Д. (2002). Стратегии создания противовирусных препаратов. Нат. Ред. 1, 13–25.
Google Scholar
Clevanger, K. D., Bok, J. W., Ye, R., Miley, G. P., Verdan, M. H., Velk, T., et al. (2017). Масштабируемая платформа для идентификации вторичных метаболитов грибов и их кластеров генов. Нат. Chem. Биол. 13, 895–905. DOI: 10.1038 / nchembio.2408
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коллинз Р. А. и Нг Т. Б. (1997). Полисахаропептид из Coriolus versicolor имеет потенциал для использования против инфекции вируса иммунодефицита человека типа 1. Life Sci. 60, 383–387. DOI: 10.1016 / S0024-3205 (97) 00294-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цуй, С. В. (2005). «Структурный анализ полисахаридов», Food Carbohydrates , ed. С. В. Цуй (Бока-Ратон, Флорида: CRC Press), 105–160.
Google Scholar
Де Колибус, Л. Д., Ван, X., Спайро, Дж. А. Б., Келли, Дж., Рен, Дж., Граймс, Дж. И др. (2014). Более мощные ингибиторы вирусов из анализа структуры капсид-связывающих молекул HEV71. Нат. Struct. Мол. Биол. 21, 282–288. DOI: 10.1038 / nsmb.2769
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Десмук, С. К., Пракаш, В., и Ранджан, Н. (2018). Морские грибы: источник потенциальных противораковых соединений. Фронт. Microbiol. 8: 2536. DOI: 10.3389 / fmicb.2017.02536
CrossRef Полный текст | Google Scholar
Эль Дайн, Р. С., Эль Халавани, А. М., Ма, К.-М., и Хаттори, М. (2008). Анти-ВИЧ-1 протеазная активность тритерпенов ланостана из вьетнамского гриба Ganoderma colossum . J. Nat. Prod. 71, 1022–1026. DOI: 10.1021 / np8001139
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эль-Меккави, С., Меселхи, М. Р., Накамура, Н., Тэдзука, Ю., Хаттори, М., Какиучи, Н., и др. (1998). Вещества протеазы против ВИЧ-1 и против ВИЧ-1 из Ganoderma lucidum . Фитохимия 49, 1651–1657. DOI: 10.1016 / S0031-9422 (98) 00254-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Eo, S.-К., Ким, Ю. С., Ли, К. К., и Хан, С. С. (1999a). Антигерпетическая активность различных полисахаридов, связанных с белками, выделенных из Ganoderma lucidum . J. Ethnopharmacol. 68, 175–181. DOI: 10.1016 / S0378-8741 (99) 00086-0
CrossRef Полный текст | Google Scholar
Eo, S.-K., Kim, Y.-O., Lee, C.-K., and Han, S.-S. (1999b). Противовирусная активность различных веществ, растворимых в воде и метаноле, выделенных из Ganoderma lucidum . J. Ethnopharmacol. 68, 129–136.
PubMed Аннотация | Google Scholar
Эо, С.-К., Ким, Ю.С., Ли, К.К., и Хан, С.С. (2000). Возможный режим противовирусной активности полисахарида, связанного с кислым белком, выделенного из Ganoderma lucidum на вирусе простого герпеса. J. Ethnopharmacol. 72, 475–481. DOI: 10.1016 / S0378-8741 (00) 00266-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фаччин, Л.С., Бенати, Ф., Ринкао, В.П., Мантовани, М.С., Соарес, С. А., Гонзага, М. Л. и др. (2007). Противовирусная активность водных и этанольных экстрактов и выделенного полисахарида из Agaricus brasiliensis в отношении полиовируса типа 1. Lett. Appl. Microbiol. 45, 24–28. DOI: 10.1111 / j.1472-765X.2007.02153.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Fang, W., Lin, X., Zhou, X., Wan, J., Lu, X., Yang, B., et al. (2014). Цитотоксические и противовирусные нитробензил-сесквитерпеноиды морского грибка Aspergillus ochraceus Jcma1F17. Med. Chem. Communn. 5, 701–705. DOI: 10.1039 / C3MD00371J
CrossRef Полный текст | Google Scholar
Гао, Х., Го, В., Ван, К., Чжан, Л., Чжу, М., Чжу, Т. и др. (2013a). Аспульвиноны из почвенного гриба ризосферы мангровых зарослей Aspergillus terreus Wwq-48 с активностью против вируса гриппа A (h2N1). Bioorgan. Med. Chem. 23, 1776–1778. DOI: 10.1016 / j.bmcl.2013.01.051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гао, W., Sun, Y., Chen, S., Zhang, J., Kang, J., Wang, Y., et al. (2013b). Грибной лектин усиливал иммуногенность ДНК HBV у трансгенных мышей C57BL / 6 и HbsAg. Vaccine 31, 2273–2280. DOI: 10.1016 / j.vaccine.2013.02.062
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаргано, М., ван Гринсвен, Л., Исихуэмхен, О., Линдеквист, У., Вентурелла, Г., Вассер, С. П. и др. (2017). Лекарственные грибы: ценные биологические ресурсы с высоким эксплуатационным потенциалом. Завод Биосист. 151, 548–565. DOI: 10.1080 / 11263504.2017.1301590
CrossRef Полный текст | Google Scholar
Гринде Б., Хетланд Г. и Джонсон Э. (2006). Влияние на экспрессию генов и вирусную нагрузку лекарственного экстракта из Agaricus blazei у пациентов с хронической инфекцией гепатита С. Внутр. Иммунофармакол. 6, 1311–1314. DOI: 10.1016 / j.intimp.2006.04.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гу, С.-Q., Li, J.-W., Chao, F., Jin, M., Wang, X.-W., и Shen, Z.-Q. (2007). Выделение, идентификация и функция нового белка против HSV-1 из Grifola frondosa . Antiviral Res. 75, 250–257. DOI: 10.1016 / j.antiviral.2007.03.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Го, Б., Дай, Дж. Р., Нг, С., Хуанг, Ю., Леонг, К., Онг, В. и др. (2000). Цитоновые кислоты A и B: новые тридепсидные ингибиторы протеазы hCMV из эндофитных грибов Cytonaema видов. J. Nat. Prod. 63, 602–604. DOI: 10.1021 / np9r
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Го, Х., Сунь, Б., Гао, Х., Чен, X., Лю, С., Яо, X., et al. (2009). Дикетопиперазины из Cordyceps -колонизирующего гриба Epicoccum nigrum . J. Nat. Prod. 72, 2115–2119. DOI: 10.1021 / np4a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хань, X., Чакраборти, А., Чжу, Дж., Лян, З. X., и Ли, Дж. (2016). Секвенирование и функциональная аннотация всего генома мицелиальных грибов Aspergillus westerdiijkiae . BMC Genomics 17: 633. DOI: 10.1186 / s12864-016-2974-x
PubMed Аннотация | CrossRef Полный текст
Харви А. Л., Эдрада-Эбель Р. и Куинн Р. Дж. (2015). Возрождение натуральных продуктов для открытия лекарств в эпоху геномики. Нат. Rev. Drug Discov. 14, 111–129. DOI: 10.1038 / nrd4510
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоксворт, Д.и Люкинг Р. (2017). Разнообразие грибов revisi
Инфекции – бактериальные и вирусные
Многие человеческие инфекции вызываются бактериями или вирусами. Бактерии – это крошечные одноклеточные организмы, которые некоторые исследователи считают родственниками растений. Они являются одними из самых успешных форм жизни на планете, а их среда обитания варьируется от ледяных склонов до пустынь.Бактерии могут быть полезными – например, кишечные бактерии помогают нам переваривать пищу, – но некоторые из них несут ответственность за ряд инфекций.Эти болезнетворные разновидности называются патогенными бактериями. Многие бактериальные инфекции можно успешно лечить соответствующими антибиотиками, хотя начинают появляться устойчивые к антибиотикам штаммы. Иммунизация доступна для предотвращения многих серьезных бактериальных заболеваний.
Вирус – это еще более мелкий микроорганизм, который может воспроизводиться только внутри живой клетки хозяина. Убить вирус очень сложно. Вот почему некоторые из наиболее серьезных инфекционных заболеваний, известных медицине, имеют вирусное происхождение.
Как бактерии и вирусы попадают в организм
Чтобы вызвать болезнь, патогенные бактерии должны проникнуть в организм. Диапазон путей доступа для бактерий включает:
- Порезы
- Загрязненные продукты питания или вода
- Тесный контакт с инфицированным человеком
- Контакт с фекалиями инфицированного человека
- Вдыхание выдыхаемых капель, когда инфицированный человек кашляет или чихает
- Косвенно, касаясь загрязненных поверхностей, таких как краны, ручки унитаза, игрушки и подгузники.
Вирусы передаются от человека к человеку:
- Кашель
- Чихание
- Рвота
- Укусы инфицированных животных или насекомых
- Воздействие инфицированных жидкостей организма в результате таких действий, как половой акт или совместное использование игл для подкожных инъекций.
Типы бактерий
Бактерии, вызывающие заболевания, широко классифицируются в зависимости от их формы.Четыре основные группы включают:
- Bacilli – в форме стержня длиной около 0,03 мм. Такие болезни, как брюшной тиф и цистит, вызываются штаммами бацилл.
- Cocci – имеет форму сферы диаметром около 0,001 мм. В зависимости от сорта кокковые бактерии группируются разными способами, например парами, длинными рядами или плотными скоплениями. Примеры включают стафилококков (вызывающих множество инфекций, включая фурункулы) и гонококков (вызывающих гонорею, передающуюся половым путем).
- Спирохеты – как следует из названия, эти бактерии имеют форму крошечных спиралей. Бактерии спирохеты вызывают целый ряд заболеваний, включая сифилис, передаваемый половым путем.
- Vibrio – в форме запятой. Тропическая болезнь холера, характеризующаяся тяжелой диареей и обезвоживанием, вызывается бактериями вибриона.
Характеристики бактерии
Большинство бактерий, за исключением разновидности кокков, перемещаются с помощью маленьких хвостов (жгутиков) или хлестанием тела из стороны в сторону.В правильных условиях бактерия размножается, разделяясь на две части. Затем каждая «дочерняя» клетка делится на две и так далее, так что одна бактерия может вырасти в популяцию в 500 000 или более человек всего за восемь часов.
Если условия окружающей среды не подходят для бактерий, некоторые разновидности переходят в состояние покоя. Они образуют прочное внешнее покрытие и ждут соответствующего изменения условий. Эти спящие бактерии называются спорами. Споры труднее убить, чем активные бактерии, из-за их внешнего покрытия.
Лечение бактериальной инфекции
Организм реагирует на болезнетворные бактерии, увеличивая местный кровоток (воспаление) и посылая клетки иммунной системы, чтобы атаковать и уничтожить бактерии. Антитела, вырабатываемые иммунной системой, прикрепляются к бактериям и помогают в их уничтожении. Они также могут инактивировать токсины, вырабатываемые определенными патогенами, например столбняком и дифтерией.
Серьезные инфекции можно лечить антибиотиками, которые действуют, нарушая метаболические процессы бактерий, хотя начинают появляться устойчивые к антибиотикам штаммы.Иммунизация доступна для предотвращения многих важных бактериальных заболеваний, таких как Hemophilus influenza типа b (Hib), столбняк и коклюш.
Типы вирусов
Вирус – это крошечный карман белка, который содержит генетический материал. Если вы поместите вирус рядом с бактерией, вирус станет меньше. Например, вирус полиомиелита примерно в 50 раз меньше, чем бактерия Streptococci , длина которой составляет всего 0,003 мм. Вирусы можно описать как РНК- или ДНК-вирусы, в зависимости от типа нуклеиновой кислоты, образующей их ядро.
Четыре основных типа вируса включают:
- Икосаэдрический – внешняя оболочка (капсид) состоит из 20 плоских сторон, что придает сферическую форму. Большинство вирусов икосаэдрические.
- Helical – капсид имеет форму стержня.
- Enveloped – капсид заключен в мешковатую мембрану, которая может менять форму, но часто выглядит сферической.
- Комплекс – генетический материал покрыт оболочкой, но без капсида.
Реакция организма на вирусную инфекцию
Вирусы представляют собой серьезную проблему для иммунной системы организма, поскольку они прячутся внутри клеток. Это затрудняет доступ антител к ним. Некоторые особые клетки иммунной системы, называемые Т-лимфоцитами, могут распознавать и убивать клетки, содержащие вирусы, поскольку поверхность инфицированных клеток изменяется, когда вирус начинает размножаться. Многие вирусы, высвобождаемые из инфицированных клеток, будут эффективно нейтрализованы антителами, которые были продуцированы в ответ на инфекцию или предыдущую иммунизацию.
Лечение вирусной инфекции
Антибиотики бесполезны против вирусных инфекций. Это связано с тем, что вирусы настолько просты, что используют свои хозяйские клетки для выполнения своей деятельности за них. Таким образом, противовирусные препараты действуют иначе, чем антибиотики, вместо этого они влияют на вирусные ферменты.
Противовирусные препараты в настоящее время эффективны только против нескольких вирусных заболеваний, таких как грипп, герпес, гепатиты B и C и ВИЧ, но исследования продолжаются. Природный белок, называемый интерфероном (который организм вырабатывает для борьбы с вирусными инфекциями), теперь можно производить в лаборатории и использовать для лечения инфекций гепатита С.
Иммунизация против вирусной инфекции не всегда возможна
Возможна вакцинация от многих серьезных вирусных инфекций, таких как корь, эпидемический паротит, гепатит А и гепатит В. Агрессивная всемирная кампания вакцинации, возглавляемая Всемирной организацией здравоохранения (ВОЗ), удалось победить оспу. Однако некоторые вирусы, например, вызывающие простуду, способны мутировать от одного человека к другому. Вот как инфекция, вызванная одним и тем же вирусом, может уклоняться от иммунной системы.Вакцинация от этих вирусов затруднена, потому что вирусы уже изменили свой формат к моменту разработки вакцин.
Куда обратиться за помощью
- Ваш врач
- Ваш фармацевт
Что следует помнить
- Многие человеческие болезни вызваны заражением бактериями или вирусами.
- Большинство бактериальных заболеваний можно лечить антибиотиками, хотя начинают появляться устойчивые к антибиотикам штаммы.
- Вирусы представляют собой проблему для иммунной системы организма, поскольку они прячутся внутри клеток.
- Можно сделать прививку от некоторых основных болезнетворных вирусов (таких как корь и полиомиелит), а также от бактериальных заболеваний, таких как Hemophilus influenza типа b (Hib), столбняка и коклюша.
Вакцины и противовирусные средства | IntechOpen
2. Вакцина
Вакцина – это биологический препарат, повышающий иммунитет к определенному заболеванию. Вакцина обычно содержит агент, напоминающий болезнетворный микроорганизм, и часто состоит из ослабленных или убитых форм микроба, его токсинов или одного из его поверхностных белков.Агент стимулирует иммунную систему организма распознавать агент как чужеродный, уничтожать его и «запоминать», чтобы иммунная система могла более легко распознавать и уничтожать любой из этих микроорганизмов, с которыми она позже сталкивается.
Вакцины – это мертвые или инактивированные организмы или очищенные продукты, полученные из них.
Используется несколько типов вакцин. Они представляют собой различные стратегии, используемые для снижения риска заболевания, сохраняя при этом способность вызывать положительный иммунный ответ.
2.1. Инактивированная
Некоторые вакцины содержат убитые, но ранее вирулентные микроорганизмы, которые были уничтожены химическими веществами, нагреванием, радиоактивностью или антибиотиками. Примерами являются вакцина против гриппа, вакцина против холеры, вакцина против бубонной чумы, вакцина против полиомиелита, вакцина против гепатита А и вакцина против бешенства.
2.2. Аттенуированные
Некоторые вакцины содержат живые ослабленные микроорганизмы. Многие из них являются живыми вирусами, которые культивировались в условиях, лишающих их вирулентных свойств, или в которых используются близкородственные, но менее опасные организмы, чтобы вызвать широкий иммунный ответ [1].Обычно они вызывают более стойкие иммунологические реакции и являются предпочтительным типом для здоровых взрослых. Примеры включают вирусные заболевания, желтую лихорадку, корь, краснуху и эпидемический паротит. У ослабленных вакцин есть некоторые преимущества и недостатки. Они обладают способностью к кратковременному росту, поэтому обеспечивают длительную защиту и не требуют дополнительной дозы. Но они могут вернуться в опасную форму и вызвать заболевание.
Рисунок 1.
Назальный спрей против гриппа h2N1 в качестве примера ослабленной вакцины
2.3. Субъединица
Белковая субъединица – вместо того, чтобы вводить инактивированный или ослабленный микроорганизм в иммунную систему (которая составляла бы вакцину «цельного агента»), ее фрагмент может вызывать иммунный ответ. Примеры включают субъединичную вакцину против вируса гепатита В, которая состоит только из поверхностных белков вируса (ранее извлекаемых из кровотока хронически инфицированных пациентов, но теперь получаемых путем рекомбинации вирусных генов в дрожжи), вирусоподобные частицы ( VLP) вакцина против вируса папилломы человека (ВПЧ), которая состоит из главного капсидного белка вируса и субъединиц гемагглютинина и нейраминидазы вируса гриппа.Один из методов получения включает выделение определенного белка из вируса и его введение. Слабость этого метода заключается в том, что изолированные белки могут быть денатурированы и затем связываться с антителами, отличными от белков в вирусе. Второй метод субъединичной вакцины – это рекомбинантная вакцина, которая включает перенос гена белка из целевого вируса в другой вирус. Второй вирус будет экспрессировать белок, но не представляет опасности для инжектора. Это тот тип вакцины, который в настоящее время используется против гепатита, и он пользуется популярностью в экспериментах, поскольку используется для разработки новых вакцин против трудно вакцинируемых вирусов, таких как Эбола и ВИЧ.
2.4. ДНК-вакцина
За последние полтора десятилетия концепция ДНК-вакцины была протестирована и применена против различных патогенов и опухолевых антигенов [2]. Оптимизированная последовательность интересующего гена доставляется к коже, подкожной клетчатке или мышце одним из нескольких способов доставки [3]. Экспрессия генов, кодируемых плазмидой, будет продуцировать чужеродные антигены и вызывать иммунологический ответ. К настоящему времени одобрены четыре продукта ДНК-вакцины, все в области ветеринарии [4].
Вакцины очень эффективны против стабильных вирусов, но имеют ограниченное применение при лечении уже инфицированного пациента. Их также сложно успешно применить против быстро мутирующих вирусов, таких как грипп (вакцина от которого обновляется каждый год) и ВИЧ [5]. В этих случаях особенно полезны противовирусные препараты.
| Vaccine Target | \ n \ t \ t \ tНазвание продукта | \ n \ t \ t \ tУчаствующая компания | \ n \ t \ t \ tДата лицензии и страна | \ n \ t \ t \ tЦелевой организм | \ n \ t \ t \ tПреимущества | \ n \ t \ t
| Вирус Западного Нила | \ n \ t \ t \ tWest Nile Innovator | \ n \ t \ t \ tЦентры по контролю и профилактике заболеваний и лаборатории Fort Dodge | \ n \ t \ t \ t2005 США | \ n \ t \ t \ tЛошади | \ n \ t \ t \ tЗащищает от заражения вирусом Западного Нила | \ n \ t \ t
| Вирус инфекционного гематопоэтического некроза | \ n \ t \ t \ tApex-IHN | \ n \ t \ t \ tNovartis | \ n \ t \ t \ t2005 Канада | \ n \ t \ t \ tЛосось | \ n \ t \ t \ tУлучшает благополучие животных, увеличивает качество и количество продуктов питания | \ n \ t \ t
| Гормон высвобождения гормона роста | \ n \ t \ t \ tLifeTide-SWS | \ n \ t \ t \ tVGX Animal Health | \ n \ t \ t \ t2007 Austrilia | \ n \ t \ t \ tСвиньи и кормовые животные | \ n \ t \ t \ tУвеличивает количество отъемных поросят у племенных свиноматок | \ n \ t \ t
| Меланома | \ n \ t \ t \ tВакцина против меланомы собак | \ n \ t \ t \ tMerial, Мемориальный онкологический центр Слоуна-Кеттеринга и Медицинский центр для животных Нью-Йорка | \ n \ t \ t \ t2007 США, условная лицензия | \ n \ t \ t \ tDogs | \ n \ t \ t \ tЛечит агрессивные формы рака рта, ногтевого ложа, подушечек стопы или других областей в качестве альтернативы лучевой терапии и хирургии. | \ n \ t \ t
Таблица 1.
Текущие лицензированные методы лечения ДНК (адаптировано из Kutzler MA & Weiner et. Al.)
3. Противовирусное средство
Противовирусные препараты – это класс лекарств, используемых специально для лечения вирусных инфекций. Как и антибиотики от бактерий, против конкретных вирусов используются специальные противовирусные препараты. В отличие от большинства антибиотиков, противовирусные препараты не уничтожают свой патоген-мишень; вместо этого они тормозят их развитие [6].
Большинство имеющихся в настоящее время противовирусных препаратов предназначены для борьбы с ВИЧ, вирусами герпеса (наиболее известны тем, что вызывают герпес и генитальный герпес, но на самом деле являются причиной широкого спектра других заболеваний, таких как ветряная оспа), гепатита Вирусы B и C, которые могут вызывать рак печени, а также вирусы гриппа A и B.Исследователи работают над расширением спектра противовирусных препаратов на другие семейства патогенов.
Создать безопасные и эффективные противовирусные препараты сложно, потому что вирусы используют клетки хозяина для размножения. Это затрудняет поиск мишеней для лекарства, которые могли бы взаимодействовать с вирусом, не нанося вреда клеткам организма-хозяина. Более того, основная трудность в разработке вакцин и противовирусных препаратов связана с вирусной изменчивостью.
Рисунок 2.
Жизненный цикл вируса и цели антивирусов
3.1. Перед проникновением в клетку
Одна противовирусная стратегия состоит в том, чтобы помешать способности вируса проникать в клетку-мишень. Для этого вирус должен пройти последовательность шагов, начиная со связывания со специфической молекулой «рецептора» на поверхности клетки-хозяина и заканчивая «снятием оболочки» вируса внутри клетки и высвобождением ее содержимого. Вирусы, имеющие липидную оболочку, должны также слить свою оболочку с клеткой-мишенью или с пузырьком, который транспортирует их в клетку, прежде чем они смогут распустить оболочку [7].
3.1.1. Ингибитор проникновения
Очень ранней стадией вирусной инфекции является проникновение вируса, когда вирус прикрепляется к клетке-хозяину и проникает в нее [8]. Для борьбы с ВИЧ разрабатывается ряд препаратов, «ингибирующих проникновение» или «блокирующих проникновение». ВИЧ наиболее сильно нацелен на белые кровяные тельца иммунной системы, известные как «хелперные Т-клетки», и идентифицирует эти клетки-мишени через поверхностные Т-клеточные рецепторы, обозначенные «CD4» и «CCR5». Попытки помешать связыванию ВИЧ с рецептором CD4 не смогли остановить заражение ВИЧ хелперных Т-клеток, но исследования продолжаются, пытаясь помешать связыванию ВИЧ с рецептором CCR5 в надежде, что это будет более эффективным.
3.1.2. Ингибитор непокрытия
Также были исследованы ингибиторы непокрытия.
Амантадин и римантадин были введены для борьбы с гриппом. Эти агенты действуют на проникновение / снятие покрытия. Они являются ингибиторами M2, которые блокируют ионный канал, образованный белком M2, который охватывает вирусную мембрану. Вирус гриппа проникает в клетку-хозяин посредством рецепторно-опосредованного эндоцитоза. После этого требуется подкисление эндоцитотических везикул для диссоциации белка M1 от рибонуклеопротеиновых комплексов.Только после этого частицы рибонуклеопротеина импортируются в ядро через ядерные поры. Ионы водорода, необходимые для подкисления, проходят через канал M2. Амантадин и римантадин блокируют канал [9].
3.2. Во время вирусного синтеза
Второй подход заключается в нацеливании на процессы, которые синтезируют компоненты вируса после того, как вирус вторгается в клетку.
3.2.1. Обратная транскрипция
Один из способов сделать это – разработать аналоги нуклеотидов или нуклеозидов, которые выглядят как строительные блоки РНК или ДНК, но деактивируют ферменты, которые синтезируют РНК или ДНК, как только аналог включен.Этот подход чаще связан с ингибированием обратной транскриптазы (РНК в ДНК), чем с «нормальной» транскриптазой (ДНК в РНК).
Более глубокие знания о действии обратной транскриптазы привели к созданию более эффективных аналогов нуклеозидов для лечения ВИЧ-инфекций. Один из этих препаратов, ламивудин, был одобрен для лечения гепатита B, который использует обратную транскриптазу как часть процесса репликации. Исследователи пошли дальше и разработали ингибиторы, которые не похожи на нуклеозиды, но все же могут блокировать обратную транскриптазу.
Другая мишень, рассматриваемая для противовирусных препаратов ВИЧ, включает РНКазу H, которая является компонентом обратной транскриптазы, которая расщепляет синтезированную ДНК от исходной вирусной РНК.
Рисунок 3.
Пример механизмов действия противовирусных препаратов: Механизм действия азидотимидина (AZT). АЗТ необходимо фосфорилировать в три этапа до трифосфатной формы, прежде чем он сможет вмешаться в реакцию обратной транскриптазы.
3.2.2. Интеграза
Другой мишенью является интеграза, которая встраивает синтезированную ДНК в геном клетки-хозяина.Похоже, что функционального эквивалента фермента в клетках человека нет. Биохимический механизм интеграции ДНК ВИЧ в геном клетки-хозяина включает тщательно определенную последовательность реакций адаптации ДНК (3 \ ‘- процессинг) и связывания (присоединения или интеграции) [10]. Несмотря на некоторые усилия в этой области, направленные на открытие терапевтически полезных ингибиторов этого вирусного фермента, в клинических условиях не существует лекарств от ВИЧ / СПИДа, механизм действия которых заключается в ингибировании интегразы ВИЧ.Однако есть несколько многообещающих кандидатов в нескольких классах соединений, включая нуклеотиды, динуклеотиды, олигонуклеотиды и различные небольшие молекулы, такие как гетероциклические системы, природные продукты, дикетокислоты и сульфоны, которые были обнаружены как ингибиторы интегразы ВИЧ.
3.2.3. Транскрипция
Как только вирусный геном начинает работать в клетке-хозяине, он генерирует молекулы информационной РНК (мРНК), которые направляют синтез вирусных белков. Производство мРНК инициируется белками, известными как факторы транскрипции.В настоящее время разрабатываются несколько противовирусных препаратов, которые блокируют прикрепление факторов транскрипции к вирусной ДНК. Као и др. недавно путем случайного скрининга было обнаружено соединение под названием нуклеозин, которое, как было установлено, подавляет грипп, взаимодействуя с NP гриппа. Нуклеозин вызывает аномальную агрегацию НЧ и, следовательно, ингибирует нормальную вирусную транскрипцию, нарушая цикл репликации за счет удлинения [11]. Исследование аналога нуклеозина показало, что соединение функционирует путем связывания с двумя копиями NP и образования аномальных димеров, вызывая агрегацию белков и препятствуя их нормальному функционированию.Было также показано, что нуклеозин ингибирует вирус гриппа in vitro и на модели мышей, что делает его многообещающим кандидатом для нового противовирусного препарата.
3.2.4. Трансляция / антисмысловые
Genomics не только помогла найти мишени для многих противовирусных препаратов, но и заложила основу для совершенно нового типа лекарств, основанных на «антисмысловых» молекулах. Это сегменты ДНК или РНК, которые сконструированы как молекула, комплементарная критическим участкам вирусных геномов, и связывание этих антисмысловых сегментов с этими целевыми участками блокирует работу этих геномов.Был представлен фосфоротиоатный антисмысловой препарат под названием фомивирсен, который используется для лечения оппортунистических глазных инфекций у пациентов со СПИДом, вызванных цитомегаловирусом, и другие антисмысловые противовирусные препараты находятся в стадии разработки.
3.2.5. Трансляция / рибозимы
Еще одна антивирусная технология, вдохновленная геномикой, – это набор лекарств на основе рибозимов, которые представляют собой ферменты, которые расщепляют вирусную РНК или ДНК в выбранных местах. В своем естественном ходе рибозимы используются как часть производственной последовательности вируса, но эти синтетические рибозимы предназначены для разрезания РНК и ДНК на участках, которые их выведут из строя.
Был предложен рибозимный противовирусный препарат для лечения гепатита С, а также разрабатываются рибозимные противовирусные препараты для лечения ВИЧ. Интересным вариантом этой идеи является использование генетически модифицированных клеток, которые могут производить рибозимы, адаптированные к индивидуальным потребностям. Это часть более широких усилий по созданию генетически модифицированных клеток, которые можно вводить хозяину для атаки на патогены путем создания специализированных белков, которые блокируют репликацию вируса на различных этапах жизненного цикла вируса [12].
3.2.6. Ингибиторы протеазы
Некоторые вирусы включают фермент, известный как протеаза, который разрезает вирусные белковые цепи, чтобы они могли быть собраны в их окончательную конфигурацию, например саквинавир (рис. 4). ВИЧ включает протеазу, и поэтому были проведены значительные исследования по поиску «ингибиторов протеазы», которые атакуют ВИЧ на этой фазе его жизненного цикла. Ингибиторы протеазы стали доступны в 1990-х годах и доказали свою эффективность, хотя они могут иметь необычные побочные эффекты, например, вызывать накопление жира в необычных местах.В настоящее время разрабатываются улучшенные ингибиторы протеазы [13].
Рисунок 4.
Ингибитор протеазы противовирусный саквинавир.
Состав: цис-N-трет -бутил-декагидро-2- [2 (R) -гидрокси-4-фенил-3 (S) – [[N-2-хинолилкарбонил-1-аспарагинил] амино] бутил] – (4aS-8aS) -изохинолин-3 (S) -карбоксамидметансульфонат, твердые желатиновые капсулы, Invirase ® , также доступны в виде мягких желатиновых капсул (Fortovase ® ).
Спектр активности : ВИЧ (типы 1 и 2).
Механизм действия : пептидомиметический ингибитор протеазы ВИЧ на основе гидроксиэтилена в переходном состоянии.
3.3. Фаза выпуска
Заключительным этапом жизненного цикла вируса является высвобождение завершенных вирусов из клетки-хозяина, и этот этап также стал целью разработчиков противовирусных препаратов. Два препарата, названные занамивир (Реленза) и осельтамивир (Тамифлю), которые были недавно введены для лечения гриппа, предотвращают высвобождение вирусных частиц, блокируя молекулу нейраминидазы, которая обнаруживается на поверхности вирусов гриппа, и также, кажется, постоянна в течение широкий спектр штаммов гриппа [14].
3.4. Соображения по поводу клинической разработки противовирусных агентов
Всего 37 противовирусных соединений (не включая интерфероны или иммуноглобулины) были на данный момент лицензированы для лечения ВИЧ, HBV, герпесвируса, вируса гриппа и / или инфекций HCV [15]. В предыдущих разделах эти соединения обсуждались со следующих точек зрения: химическая структура, спектр активности, механизм действия, основные клинические показания. Другие моменты, которые необходимо рассмотреть, прежде чем можно будет оценить полный клинический потенциал любого данного лекарственного средства, включают: (i) продолжительность лечения, (ii) терапию одним или несколькими лекарствами, (iii) фармакокинетику, (iv) лекарственные взаимодействия. , (v) токсические побочные эффекты и (vi) развитие резистентности.Особый вопрос, который может иметь значение в клинических условиях, заключается в том, будут ли перечисленные анти-ВИЧ агенты в равной степени подходить для лечения инфекций ВИЧ-2 и ВИЧ-1.
Что касается продолжительности лечения, она может варьироваться от нескольких дней (HSV, VZV, вирусные инфекции гриппа) до нескольких месяцев или лет (инфекции ВИЧ, HBV и HCV), в зависимости от того, имеем ли мы дело с острой (первичной) (например, грипп) или рецидивирующая (например, HSV, VZV) инфекция или хроническая, постоянная (например, ВИЧ, HBV, HCV) инфекция.В отношении ВИЧ-инфекций все еще оценивается, можно ли прервать длительное лечение без потери пользы (или увеличения пользы) для пациента (структурированное прерывание лечения, ИППП) [16].
В то время как краткосрочное лечение (5–7 дней) HSV, VZV и вирусных инфекций и даже более длительное лечение инфекций CMV может быть основано на монолекарственной терапии для длительного лечения ВИЧ. Инфекции Комбинация нескольких препаратов в коктейле из трех препаратов (также называемая ВААРТ для «высокоактивной антиретровирусной терапии») стала стандартной процедурой, и, аналогично, долгосрочное лечение инфекций ВГВ может в будущем также развиваться. от монотерапии к двойной или тройной терапии [17].
Фармакокинетические параметры, которые необходимо учитывать при оценке терапевтического потенциала, включают биодоступность (при местном, пероральном или парентеральном введении), аффинность связывания с белками плазмы, распределение в организме (проникновение в ЦНС, когда это необходимо), метаболизм через печень (т.е. ферменты, метаболизирующие лекарственные средства цитохрома Р-450) и выведение через почки. В частности, при составлении комбинаций нескольких препаратов для лечения ВИЧ-инфекции следует принимать во внимание возможные лекарственные взаимодействия: i.е. некоторые соединения действуют как ингибиторы P-450, а другие как индукторы P-450, и это может сильно повлиять на достигаемые уровни лекарств в плазме, особенно в случае ННИОТ и ИП [18].
Токсические побочные эффекты, как краткосрочные, так и долгосрочные, необходимо учитывать, когда препараты необходимо вводить в течение длительного периода, например, при лечении ВИЧ-инфекций. Эти побочные эффекты могут серьезно повлиять на соблюдение режима приема лекарств (соблюдение режима приема лекарств), и их можно, по крайней мере частично, обойти за счет уменьшения количества таблеток, в идеале до приема один раз в день.
Наконец, развитие устойчивости может быть важной проблемой, опять же для тех соединений, которые необходимо принимать в течение длительного периода, как это обычно бывает с большинством НИОТ, ННИОТ и ИП, используемых в настоящее время для лечения ВИЧ-инфекций. Тем не менее, аналоги нуклеозидфосфонатов (НИОТ), тенофовир и адефовир, не приводят к быстрому или быстрому развитию устойчивости даже после более чем 1 года терапии (для ВИЧ и HBV соответственно). Была отмечена устойчивость HBV к ламивудину после длительной терапии (> 6 месяцев), но при устойчивости к ламивудину инфекции HBV по-прежнему поддаются лечению адефовиром дипивоксилом.Как иногда наблюдалось у пациентов с ослабленным иммунитетом, у HSV может развиться устойчивость к ацикловиру, а у CMV – к ганцикловиру, но, если основано на дефиците TK ACV или PK CMV, эти устойчивые вирусы остаются поддающимися лечению фоскарнетом и / или цидофовиром [19]. У иммунокомпетентных пациентов, получающих лечение от острой или эпизодической инфекции HSV, VZV или вируса гриппа, краткосрочная терапия вряд ли вызовет какие-либо проблемы с резистентностью.
Развитие вирусных вакцин со времен Дженнеровской профилактики до современной рекомбинантной технологии была продолжающейся историей успеха.За относительно сырыми вакцинами или вакцинами «первого поколения» от оспы, бешенства и желтой лихорадки последовали улучшенные или новые вирусные вакцины второго и третьего поколения. Применение методов аттенуирования, инактивации и частичной очистки кандидатных вирусов позволило получить безопасные и эффективные вакцины против гриппа, полиомиелита, кори, эпидемического паротита и краснухи. С появлением эффективных национальных программ иммунизации в Соединенных Штатах и других регионах мира, направленных на широкое использование этих вакцин, мы наблюдаем резкое снижение заболеваемости вирусными инфекциями среди детей.Новая биотехнология служит краеугольным камнем для четвертого поколения вакцин и уже предоставила лицензированную рекомбинантную дрожжевую вакцину против гепатита В человека. Перспективы создания широкого спектра новых или улучшенных вакцин весьма обнадеживают не только из-за недавних технических достижений, но и потому, что разработка вакцин признана приоритетной областью исследований. В рамках программы ускоренной разработки новых вакцин Национального института аллергии и инфекционных заболеваний оказывается поддержка исследованиям вакцин против гепатита A и B, гриппа A и B, бешенства, ротавируса, ветряной оспы и респираторно-синцитиального вируса.Перспективы противовирусных препаратов столь же оптимистичны. Те же технологии, которые позволили лучше понять генетику и молекулярную биологию вирусов и, следовательно, средства для создания субъединичных или даже синтетических вакцин, дали данные, которые могут быть применены для успешной разработки целевых противовирусных соединений.
В чем разница между антивирусным и антибиотиком?
Вирусные инфекции и бактериальные инфекции – это два очень разных недуга, хотя каждое из них обычно принимают за другое.Это потому, что симптомы часто бывают одинаковыми или очень похожими. И противовирусный, и антибиотик – это лекарства, предназначенные для предотвращения болезни, воздействуя на то, что вызывает инфекцию. Бактериальные и вирусные инфекции могут быть легкими или опасными для жизни, в зависимости от типа.
Антибиотики можно использовать только для лечения бактериальных инфекций.И противовирусное средство, и антибиотик призваны помочь человеку предотвратить болезнь или болезнь. Они действуют аналогичным образом, воздействуя на клетки, вызывающие болезнь. Существует некоторая полемика по поводу чрезмерного назначения этих препаратов, поскольку введение любого из них в здоровую или нездоровую иммунную систему может вызвать опасные побочные эффекты. Кроме того, чрезмерное использование противовирусных препаратов и антибиотиков может привести к созданию более сильных и устойчивых штаммов опасных организмов.
Антибиотики убивают болезнетворные бактерии при инфекциях мочевыводящих путей.Бактерии – это одноклеточные микроорганизмы, которые распространены повсюду и процветают в любых условиях.Миллионы бактерий могут одновременно присутствовать на всем теле человека, внутри и снаружи, и большинство из них безвредны. Антибиотики были представлены в 1940-х годах и спасли жизни миллионов людей. В большинстве случаев антибиотики убивают болезнетворные бактерии, а не просто подавляют их рост. Общие бактериальные инфекции включают стрептококковое горло, респираторные заболевания и инфекции мочевыводящих путей. Редкие формы бактериальных инфекций могут привести к летальному исходу и включают бактериальный менингит и ботулизм.
Хотя противовирусное лечение и лечение антибиотиками борются с инфекцией, антибиотики убивают как хорошие, так и плохие бактерии в организме, что может потребовать от пациента пополнения полезных бактерий с помощью пробиотических добавок.Вирусы – это микроорганизмы, которым для выживания нужен хозяин. Они бездействуют вне хозяина, и поэтому противовирусные препараты необходимо вводить после того, как кто-то был инфицирован, или их вводят в здоровую систему, чтобы вызвать иммунный ответ. Вирусы не размножаются; вместо этого они захватывают клетки-хозяева и затем заставляют их воспроизводиться. Многие вирусные инфекции можно лечить с помощью противовирусных препаратов, которые предназначены для замедления роста вируса, вызывающего заболевание.Общие вирусы включают вирус гриппа и вирус простуды. Редкие формы вирусов могут быть смертельными, как и редкие бактериальные инфекции, и включают энцефалит и ВИЧ.
Антибиотики играют ключевую роль в предотвращении обострения ангины и других распространенных инфекций.Как правило, противовирусный препарат и антибиотик можно принимать одновременно, если врач сочтет это необходимым. В основном это относится к пациентам с высоким риском, таким как беременные женщины и пожилые люди. Общие побочные эффекты противовирусных препаратов и антибиотиков включают расстройство желудка и диарею, однако в большинстве случаев преимущества намного перевешивают риски.
Чрезмерное использование антибиотиков привело к появлению бактерий, обладающих иммунитетом или устойчивостью к антибиотикам.



 д.)
д.)
 Обычно медицинские работники советуют женщинам добавлять к их противозачаточным средствам барьерные средства контроля рождаемости (например, презервативы) и, возможно, в течение 7 дней после окончания приема антибиотиков, чтобы предотвратить беременность.
Обычно медицинские работники советуют женщинам добавлять к их противозачаточным средствам барьерные средства контроля рождаемости (например, презервативы) и, возможно, в течение 7 дней после окончания приема антибиотиков, чтобы предотвратить беременность. Однако это исследование не может доказать причинно-следственный результат на основе ретроспективного дизайна и ограничений исследования.
Однако это исследование не может доказать причинно-следственный результат на основе ретроспективного дизайна и ограничений исследования.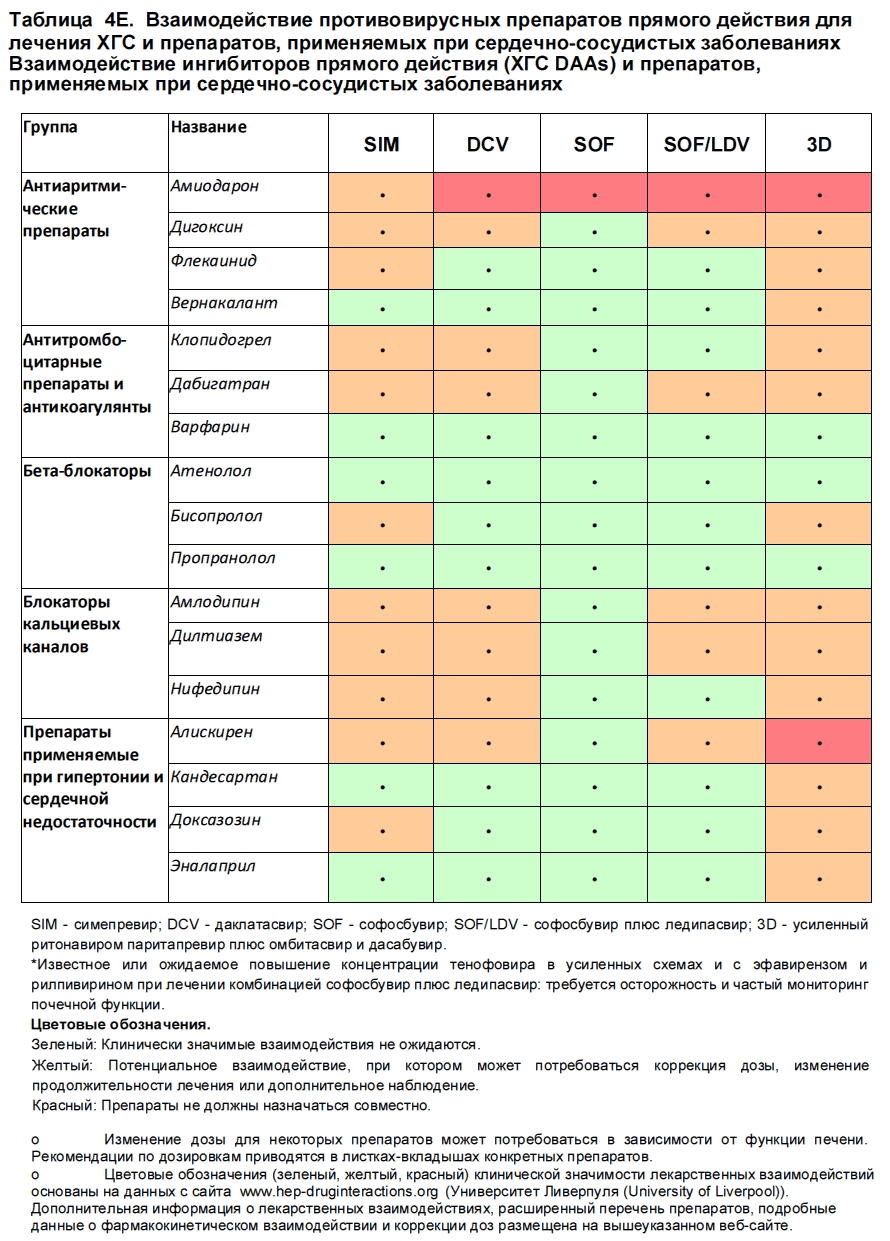 Ваш лечащий врач может по-прежнему рекомендовать вам использовать дополнительный метод контроля рождаемости (например, презерватив и / или спермицид) к вашему гормональному методу во время короткого курса лечения антибиотиками.
Ваш лечащий врач может по-прежнему рекомендовать вам использовать дополнительный метод контроля рождаемости (например, презерватив и / или спермицид) к вашему гормональному методу во время короткого курса лечения антибиотиками.



 Drugs.com. 19 августа 2020 г. https://www.drugs.com/news/antibiotics-might-lower-effectiveness-birth-control-pill-92216.html
Drugs.com. 19 августа 2020 г. https://www.drugs.com/news/antibiotics-might-lower-effectiveness-birth-control-pill-92216.html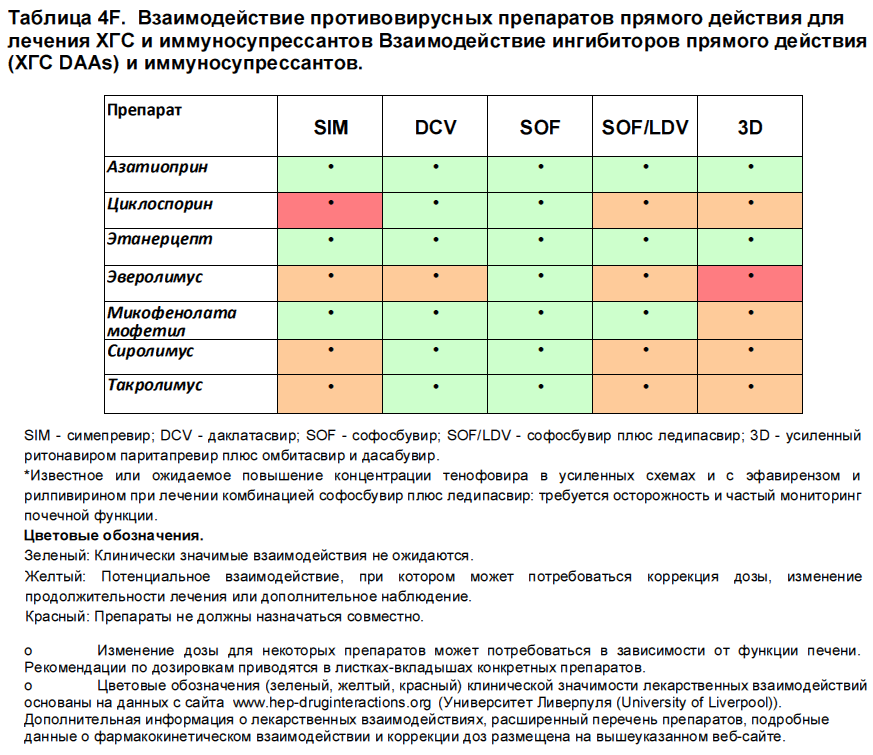 Clin Pharmacol Ther. 1999; 65: 428.
Clin Pharmacol Ther. 1999; 65: 428.