Папилломатоз гортани опасен запущенностью болезни и рецидивами
На Дону операции по удалению папиллом гортани пациентам в детском возрасте делают только в отоларингологическом отделении Областной детской клинической больницы Ростовской области. Почему только здесь?
Как говорит заведующий отделением, врач отоларинголог высшей категории, к.м.н., главный внештатный специалист по детской отоларингологии Минздрава Ростовской области Игорь Балкаров, подобные операции достаточно трудоёмки, их проведение требует определенной аппаратуры и определенного навыка: «Мы делаем их под контролем эндоскопа либо под микроскопом с помощью специальных микроинструментов и с помощью специального лазера».
Папилломатоз в отоларингологии – что это такое и отчего возникает? Обязательно ли хирургическое лечение?
– Первопричиной заболевания является вирус папилломы человека. Он, как и, например, вирус группы герпеса, есть у каждого, но активируется и приводит к болезни отнюдь не у всех, – рассказывает Игорь Олегович.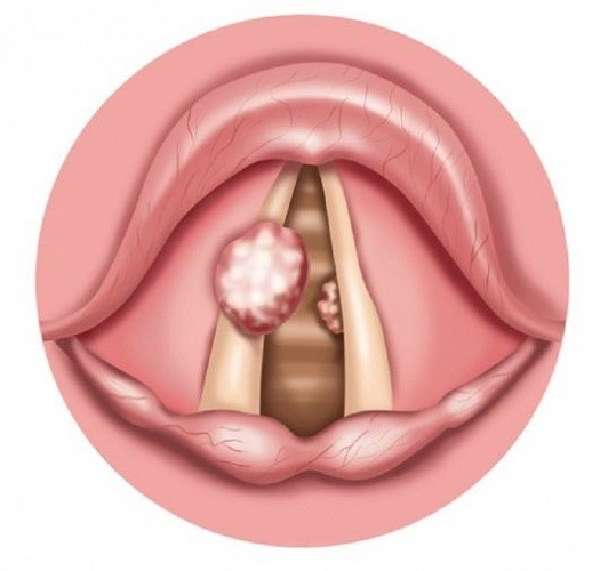
Папилломатоз – заболевание очень неприятное в том плане, что нередко даёт очень быстрый рост, а после лечения очень часты рецидивы.
Папилломы могут быть расположены на слизистой оболочке носа, рта, но хуже всего, когда развивается папилломатоз гортани. Как правило, при этой локализации папилломы возникают в голосовой щели, что провоцирует не просто снижение голоса, но порой полное его отсутствие. Кроме того, папилломы не дают смыкаться голосовой щели, и, как следствие, идет резкое нарушение вдоха, выдоха – т.е. возникают большие проблемы с дыханием. «Вирус очень плохо поддается схемам медикаментозного лечения, и чаще всего наши совместные с иммунологами усилия оказываются недостаточными; приходится эти образования в голосовой щели убирать хирургическим путем, – говорит Игорь Балкаров, хирург-отоларинголог с 25-летним стажем.
Игорь Олегович отмечает, что папилломатоз гортани порой развивается и в нетипичном для этого заболевания возрасте. Рассказывает об одной из пациенток: «Первый раз девочка попала к нам в 8,5 лет, по скорой помощи, практически с полным отсутствием дыхания, с жутчайшим втяжением, состояние её было тяжелым. Запущенный папилломатоз гортани, множественные образования. Мы всё поубирали, конечно, но в силу запущенности заболевания рецидивы у неё возникают чаще. Сейчас ребенку уже 12 лет, но раз в два-три месяца она попадает к нам по скорой помощи (из Каменского района), мы её оперируем, по результатам цитологии иммунологи назначают лечение, но, как я уже говорил, медикаментозное лечение при этом заболевании не является панацеей. Мы очень внимательно наблюдаем эту пациентку, и сегодня самое главное – помочь ей благополучно пройти пубертатный период, который тоже является дополнительным фактором риска для развития данного заболевания (имею в виду частые рецидивы)».
Сейчас ребенку уже 12 лет, но раз в два-три месяца она попадает к нам по скорой помощи (из Каменского района), мы её оперируем, по результатам цитологии иммунологи назначают лечение, но, как я уже говорил, медикаментозное лечение при этом заболевании не является панацеей. Мы очень внимательно наблюдаем эту пациентку, и сегодня самое главное – помочь ей благополучно пройти пубертатный период, который тоже является дополнительным фактором риска для развития данного заболевания (имею в виду частые рецидивы)».
Заведующий отоларингологическим отделением ОДКБ РО И.Балкаров обращает внимание родителей и пациентов на два момента.
Первое архиважно для родителей. Понятно, у каждой семьи свои проблемы. Но здоровье вашего ребенка – это безусловный приоритет. Например, зная, что у вашей дочери рецидивирующий папилломатоз, к тому же еще и отягощенный аллергическим фактором, не надо отправлять её «погулять на цветущем лугу» – после этого «гуляния» она прямиком по скорой помощи попадает на очередную операцию в отоларингологическое отделение ОДКБ. Или если вашему сыну еще 8 лет назад настойчиво рекомендовали операцию по удалению аденоидов, надо было обязательно это сделать. Не сделали, а в итоге 16-летнего подростка тоже по скорой в тяжелейшем состоянии (он вообще не дышит) привозят в ОДКБ…
Или если вашему сыну еще 8 лет назад настойчиво рекомендовали операцию по удалению аденоидов, надо было обязательно это сделать. Не сделали, а в итоге 16-летнего подростка тоже по скорой в тяжелейшем состоянии (он вообще не дышит) привозят в ОДКБ…
И Игорь Олегович, и все сотрудники отделения часто разговаривают на эти темы с родителями пациентов. Почему тянули? Почему больной ребенок был без присмотра? Ответы самые разные. Домашние сложности, проблемы в семье, корова телилась, свиньи поросились, у сына свадьба, «а потом нам сказали, что на больницу денег надо немерено, а у нас денег нет». И вот это последнее не только возмущает, но и глубоко обижает докторов. «Вы лежите с ребенком в нашем отделении не первый раз; всё лечение, включая высокотехнологичное, получаете по полису ОМС, то есть бесплатно; кто-нибудь когда-нибудь заикнулся о деньгах?» – спрашивает Игорь Олегович. «Нет, что вы», – отвечают ему. Но остаётся вопрос, говорит Балкаров, – расскажут ли люди у себя в территории, в своем поселке, городе: на больницу НЕ НАДО денег, по полису ОМС в ОДКБ всё делают бесплатно…
Второе важно для педиатров. Не секрет: узких специалистов, особенно детских отоларингологов, в территориях области не хватает; более того, это общероссийская проблема. В Миллеровском районе вообще нет детского отоларинголога. Дополнительная нагрузка ложится на педиатров. Понятно, что обычный педиатр может не увидеть то, что сразу определит узкий специалист. «Но, пожалуйста, большая просьба: если вы просто заподозрили заболевание, с которым сами не можете разобраться, дайте направление в ОДКБ, позвоните по мобильному телефону профильному главному специалисту Минздрава области. Есть, наконец, служба санитарной авиации. Пусть нас с вами 150 раз поругают, что мы перестраховщики, – мы с вами это переживем. А вот упустить время, в течение которого ребенку в спокойном режиме, без ужасов и тяжелейших состояний, можно оказать помощь, нельзя», – говорит Игорь Олегович.
Не секрет: узких специалистов, особенно детских отоларингологов, в территориях области не хватает; более того, это общероссийская проблема. В Миллеровском районе вообще нет детского отоларинголога. Дополнительная нагрузка ложится на педиатров. Понятно, что обычный педиатр может не увидеть то, что сразу определит узкий специалист. «Но, пожалуйста, большая просьба: если вы просто заподозрили заболевание, с которым сами не можете разобраться, дайте направление в ОДКБ, позвоните по мобильному телефону профильному главному специалисту Минздрава области. Есть, наконец, служба санитарной авиации. Пусть нас с вами 150 раз поругают, что мы перестраховщики, – мы с вами это переживем. А вот упустить время, в течение которого ребенку в спокойном режиме, без ужасов и тяжелейших состояний, можно оказать помощь, нельзя», – говорит Игорь Олегович.
Прислушайтесь к словам Игоря Балкарова:
– Стопроцентных симптомов папилломатоза гортани, конечно, нет. Но есть настораживающие факторы: затрудненное дыхание, снижение голоса, хрип, храп при дыхании, втягивание межреберных промежутков, ребенок периодически синеет, ему не хватает воздуха. И при наличии даже нескольких из этих факторов надо принимать срочные меры.
И при наличии даже нескольких из этих факторов надо принимать срочные меры.
ххх
Добавим: в планах ОДКБ РО на нынешний год – приобретение новейшего оборудования для эндоскопической микрохирургии на гортани и глотке.
Папилломатоз верхних дыхательных путей
Лечением папилломатоза в ФГБУ НМИЦО ФМБА России занимаются специалисты научно-клинического отдела заболеваний гортани под руководством к.м.н. Нажмудинова Ибрагима Исмаиловича, одного из лучших хирургов-оториноларингологов России.
Возвратный папилломатоз верхних дыхательных путей – это одновременно самое частое доброкачественное заболевание гортани у детей и вторая по частоте причина детской охриплости. Лечение данного заболевания зачастую представляет большую проблему из-за его тенденции к частым рецидивам и распространению по верхним дыхательным путям. Хотя наиболее часто вовлекаемым анатомическим образованием является гортань, возвратный папилломатоз может поражать все верхние дыхательные пути и пищевод. Течение заболевания папилломатоз вариабельно – у некоторых пациентов наблюдаются длительные ремиссии, у других – агрессивный рост, требующий множественных хирургических вмешательств в течение многих лет.
Течение заболевания папилломатоз вариабельно – у некоторых пациентов наблюдаются длительные ремиссии, у других – агрессивный рост, требующий множественных хирургических вмешательств в течение многих лет.
ЭТИОЛОГИЯ
Связь между ВПЧ-инфекцией в шейке матки у матери и возвратным папилломатозом у ребенка в настоящее время установлена. Вирусная ДНК была обнаружена в области нормальной слизистой вокруг папилломатозных масс, что может являться одной из причин рецидива после хирургического вмешательства. Имеющийся ВПЧ может проявиться в течение всей жизни, начиная с рождения.
ЭПИДЕМИОЛОГИЯ
Ювенильный (детский) папилломатоз встречается у детей младше 5 лет. Следующий пик заболевания приходится на возраст от 20 до 40 лет. Папилломатоз детей встречается чаще и протекает более агрессивно, чем у взрослых.
В Соединенных Штатах около половины всех пациентов с папилломатозом взрослых перенесли менее чем 5 вмешательств в течение их жизни, в то время как у детей количество таких пациентов составляет менее 25% от общего числа.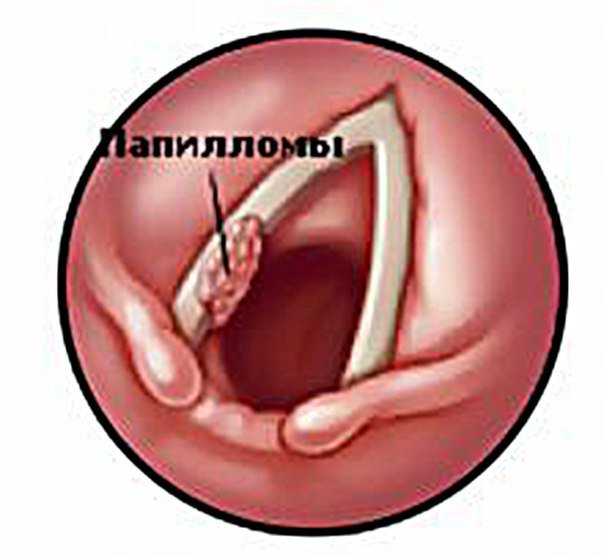 Процент агрессивных форм папилломатоза (более 40 вмешательств в течение жизни) у детей и у взрослых практически равен (17% у детей, 19% – у взрослых). В то время как взрослые набирали необходимое количество операций в течение намного более длительного периода времени.
Процент агрессивных форм папилломатоза (более 40 вмешательств в течение жизни) у детей и у взрослых практически равен (17% у детей, 19% – у взрослых). В то время как взрослые набирали необходимое количество операций в течение намного более длительного периода времени.
ПАТОМОРФОЛОГИЯ, СИМПТОМЫ ПАПИЛЛОМАТОЗА
Типичный папилломатоз верхних дыхательных путей выглядит как сочные, бородавчатые образования с экзофитным ростом. Наиболее часто папилломатоз появляется в местах, где цилиарный эпителий переходит в плоскоклеточный — преддверье носа, носоглоточная поверхность мягкого неба, гортанная поверхность надгортанника, верхний и нижний края желудочков гортани, нижняя поверхность голосовых складок, бифуркация трахеи.
При световой микроскопии обнаруживаются пальцеобразные выросты слоистого плоскоклеточного эпителия, растущего на высоковаскуляризированной соединительнотканной строме. Базальный слой может быть как нормальным, так и гиперпластическим, митотические фигуры, как правило, ограничены этим уровнем.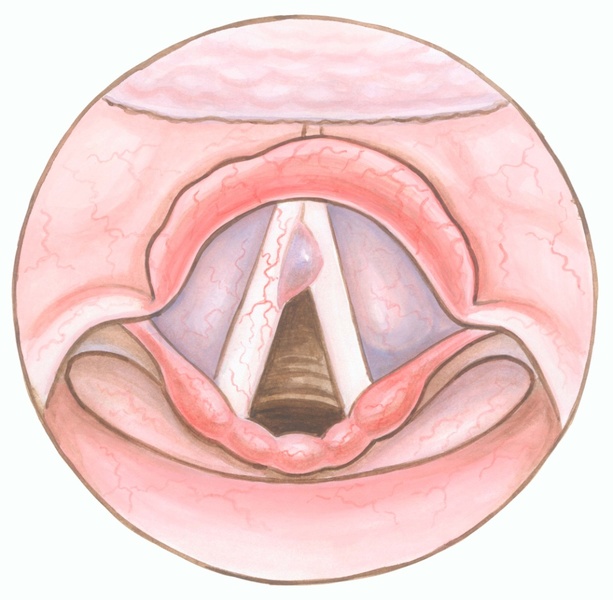
ПУТИ ПЕРЕДАЧИ
Путь передачи ВПЧ инфекции на настоящий момент до конца не выяснен и отличатся у детей и взрослых. Ювенильный папилломатоз передается от матери к ребенку при рождении.
Детские дыхательные пути чаще всего заражаются ВПЧ при родах. Ретроспективные исследования подтвердили возможность вертикальной (от матери к ребенку) передачи ВПЧ. Ученые также предположили, что приобретенный генитальный папилломатоз имеет больше шансов заразить ребенка, чем длительно персистирующий папилломатоз в организме. Вышеупомянутое исследование подтверждаются данными о более частой встречаемости ювенильного папилломатоза от матерей с генитальным папилломатозом.
КЛИНИКА
Так как большинство симптомов папилломатоза гортани связаны с обструкцией дыхательных путей, нет ничего необычного, что у детей папилломатоз ложно принимается за астму, круп или хронический бронхит. Признаком папилломатоза у детей является триада из постепенно прогрессирующих осиплости, стридора и ухудшения дыхания. Хотя на осиплость у детей часто не обращают внимания или смиряются с ней, пока она не достигнет значительной степени, любой новорожденный или ребенок с симптомами изменения голоса должен подвергаться ларингоскопии для исключения любых новообразований и, в частности, папилломатоза гортани как наиболее часто встречающегося заболевания.
Наиболее часто папилломатоз детей начинает проявляться с изменения голоса, дисфонии, в той или и ной степени. Несмотря на это, в детском возрасте изменения голоса довольно часто не замечают.
Вторым симптомом, характеризующим развитие папилломатоза, зачастую является стридор. Он начинается как простой шум при вдохе и становится двухфазным при развитии заболевания.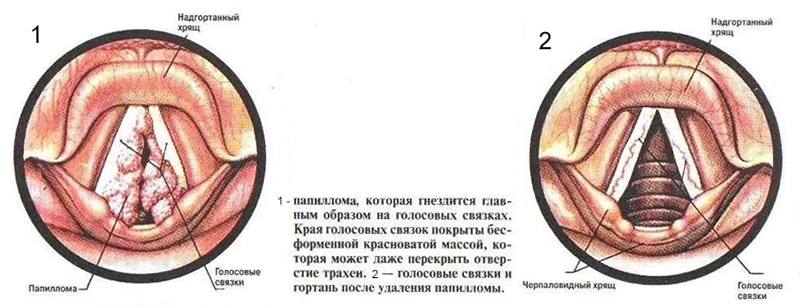
Реже встречаются хронический кашель, постоянно рецидивирующая пневмония, ухудшение состояния, диспноэ, дисфагия и разные острые угрожающие жизни состояния. Продолжительность заболевания до установления заболевания варьируется.
Вследствие редкости и медленного развития заболевания некоторые случаи могут оставаться нераспознанными вплоть до развития обструкции дыхательных путей папилломатозными массами. В этих случаях возникает необходимость в проведении трахеотомии. Папилломатоз у трахеотомированных пациентов проявляется в более раннем возрасте и распространяется шире, вовлекая дистальные дыхательные пути.
Большинство авторов согласно с тем, что трахеотомия – это процедура, которую надо максимально избегать и проводить только в случае острой необходимости. В случае, когда трахеотомии избежать не удалось, декануляцию следует проводить как можно быстрее. Пациенты, нуждающиеся в длительной эндотрахеальной интубации также находятся в группе риска. Повреждение интубационной трубкой слизистой трахеи на большом протяжении может сыграть такую же роль в диссеминации или развитии папилломатоза, как и трахеостома.
Распространение папилломатоза за пределы гортани наблюдается у 30% детей и 16% взрослых. Наиболее частыми местами экстраларингеального распространения являются (по частоте встречаемости): ротовая полость, трахея, бронхи.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Техника удаления папиллом эволюционирует. Использование операционного микроскопа впервые позволило улучшить функциональные результаты путем улучшения обзорности. Использование лазерной техники позволяет удалять папилломы без кровотечения. В настоящее время большую перспективу имеет использование шейвера, исключающего возможность возгорания дыхательной смеси или случайного повреждения. Также шейвер (микродебридер) дешевле, уменьшает время операции и, согласно некоторым исследованиям, приводит к лучшим результатам по сравнению с лазером.
В настоящее время «золотым стандартом» в хирургии папиллом гортани является применение СО2 лазера. Операции проводятся под общей анестезией с использованием микроскопа. Преимуществом СО2 лазера является несомненное удобство применения, широкий выбор мощности, длительности импульса, формы пятна, отсутствие необходимости в длинном и не самом удобном инструменте для подведения лазерного волокна. К недостаткам можно отнести возможность травмирования полости рта, повреждения трахеостомической трубки и даже воспламенения газовой смеси внутри ее.
Преимуществом СО2 лазера является несомненное удобство применения, широкий выбор мощности, длительности импульса, формы пятна, отсутствие необходимости в длинном и не самом удобном инструменте для подведения лазерного волокна. К недостаткам можно отнести возможность травмирования полости рта, повреждения трахеостомической трубки и даже воспламенения газовой смеси внутри ее.
Клинический случай папилломатоза гортани |
|
| Пациентка М. до операции | Пациентка М. год после операции |
ФОТОДИНАМИЧЕСКАЯ ТЕРАПИЯ
Фотодинамическая терапия это новый и один из наиболее многообещающих методов в лечении папилломатоза и других заболеваний области поражений головы и шеи.
Основные преимущества ФДТ перед химио- и лучевой терапией – это 100% специфичность, отсутствие нежелательных системных эффектов и возможность повторного использования в той же анатомической области в случае рецидива заболевания. Все эти свойства основаны на способности опухолевых клеток аккумулировать фотосенсибилизатор лучше, чем нормальная ткань и свойстве фотосенсибилизаторов не накапливаться в клеточном ядре. Эти две опции дают нам возможность использовать ФДТ в области предраковых и злокачественных заболеваний.
При помощи и поддержке Департамента оториноларингологии и хирургии головы и шеи Phillips-University, Марбург, Германия мы разработали наш собственный метод в лечении папилломатоза гортани с применением 5-аминолевулиновой кислоты, который позволил нам добиться увеличения межрецидивного периода на срок более года у 70% больных.
Современное состояние проблемы респираторного папилломатоза гортани | Свистушкин В.М., Волкова К.Б.
В статье приведено современное состояние проблемы респираторного папилломатоза гортани
Для цитирования. Свистушкин В.М., Волкова К.Б. Современное состояние проблемы респираторного папилломатоза гортани // РМЖ. 2015. No 23. С. 1377 –1380.
Свистушкин В.М., Волкова К.Б. Современное состояние проблемы респираторного папилломатоза гортани // РМЖ. 2015. No 23. С. 1377 –1380.
Резюме: папилломатоз гортани остается одной из неразрешимых проблем современной оториноларингологии. В статье отражается историческая последовательность изучения заболевания, приводятся варианты лечения и результаты собственного исследования, в ходе которого сравнивались 2 способа лечения больных папилломатозом гортани.
Ключевые слова: папилломатоз гортани, вирус папилломы человека, противовирусная терапия.
Папилломатоз гортани (ПГ) – доброкачественное новообразование, развивающееся из клеток плоского или переходного эпителия [1, 2]. Это заболевание хорошо известно с античных времен. В XVII в. M. Donalus ввел термин «warts in the throat» – «бородавки гортани», а термин «папиллома» предложил английский оториноларинголог S. Morell MacKenzie в 1871 г. в своем труде «Заболевания глотки, гортани и трахеи» [3]. В 1979 г. L. Gissmann выделил ВПЧ-6 из папилломатозной ткани гортани, а в 1981 г. – ВПЧ-11 из ювенильных папиллом гортани человека, которые сейчас признаны основным этиологическим фактором происхождения папиллом [4].
В 1979 г. L. Gissmann выделил ВПЧ-6 из папилломатозной ткани гортани, а в 1981 г. – ВПЧ-11 из ювенильных папиллом гортани человека, которые сейчас признаны основным этиологическим фактором происхождения папиллом [4].Имеющиеся к настоящему моменту данные о распространенности и заболеваемости респираторным папилломатозом свидетельствуют о его относительной редкости. Так, в США регистрируют от 1500 до 2500 вновь заболевших ежегодно [5, 6]. Уровень распространенности среди детей оценивают в 4,3 на 100 тыс., среди взрослых – в 1,8 [7–9]. Данные регистров заболеваемости Дании несколько отличаются: 3,62 на 100 тыс. детей и 3,94 на 100 тыс. взрослых [10–12]. Достоверной тенденции к росту или снижению данных показателей не наблюдается. В других странах, включая РФ, респираторный папилломатоз не подлежит обязательному учету, поэтому соответствующие данные отсутствуют.
ПГ вызывается следующими типами ВПЧ – 6, 11, 16, 18. Принято считать, что типы 6 и 11 ответственны за более чем 90% случаев ПГ в общей популяции, причем инфицированность ВПЧ-11 ассоциирована с достоверно более высоким риском обструкции верхних дыхательных путей (ВДП), требующей трахеостомии для лечения [13–15], а ВПЧ-16 и -18 встречаются преимущественно у детей и ассоциированы с более тяжелым течением заболевания [16].

Единая точка зрения относительно путей заражения у взрослых отсутствует. Существует по крайней мере 2 концепции, принципиально не исключающие друг друга: респираторный папилломатоз у взрослых как результат заражения через слюну и как реактивация врожденной ВПЧ-инфекции под действием ряда факторов [17–19].
Характер течения заболевания весьма вариабелен: от спонтанной долгосрочной ремиссии до часто рецидивирующего [20, 21]. В среднем с момента появления первых симптомов до установления клинического диагноза у детей проходит около 1 года [22–24]. Наиболее частым симптомом дебюта является в разной степени выраженная дисфония. В дальнейшем к ней присоединяется стридор – вначале инспираторный, затем смешанный. Реже в качестве начальных признаков отмечаются хронический кашель, рецидивирующие пневмонии, дисфагия, задержка психомоторного развития. Часто папилломатоз выступает под маской хронической рецидивирующей инфекции ВДП. Нередко таким детям ставят диагноз хронического ларингита, бронхиальной астмы, ложного крупа, иногда – певческих узелков или хронического бронхита [25, 26].
 В тех случаях, когда папилломатоз дебютирует с острой дыхательной недостаточности, вызванной обструкцией дыхательных путей опухолью, часто приходится прибегать к трахеотомии. Замечено, что такие пациенты моложе и имеют более массивное поражение гортани, часто распространяющееся на трахею. Более того, трахеостомия, по некоторым данным, способствует распространению процесса в половине случаев. Поэтому рекомендуется прибегать к ней только при крайней необходимости и как можно быстрее деканюлировать больного после активного эндоларингеального вмешательства [27, 28]. Однако не совсем ясно, является ли экстраларингеальное распространение результатом трахеостомии, либо же в случаях, требующих таковой, течение процесса изначально агрессивное, и трахеостомия никак не влияет на течение заболевания. Последнее предположение тоже имеет клиническое подтверждение [9, 13, 17, 22]. Для получения точного ответа на этот вопрос необходимо проанализировать состав опытных и контрольных групп в данных исследованиях с целью поиска возможных провоцирующих факторов.
В тех случаях, когда папилломатоз дебютирует с острой дыхательной недостаточности, вызванной обструкцией дыхательных путей опухолью, часто приходится прибегать к трахеотомии. Замечено, что такие пациенты моложе и имеют более массивное поражение гортани, часто распространяющееся на трахею. Более того, трахеостомия, по некоторым данным, способствует распространению процесса в половине случаев. Поэтому рекомендуется прибегать к ней только при крайней необходимости и как можно быстрее деканюлировать больного после активного эндоларингеального вмешательства [27, 28]. Однако не совсем ясно, является ли экстраларингеальное распространение результатом трахеостомии, либо же в случаях, требующих таковой, течение процесса изначально агрессивное, и трахеостомия никак не влияет на течение заболевания. Последнее предположение тоже имеет клиническое подтверждение [9, 13, 17, 22]. Для получения точного ответа на этот вопрос необходимо проанализировать состав опытных и контрольных групп в данных исследованиях с целью поиска возможных провоцирующих факторов.
Прогрессирующий характер заболевания с возможностью развития угрожающих жизни и снижающих ее качество осложнений обусловливает необходимость лечения папилломатоза дыхательных путей. К настоящему моменту известно не менее 50 различных методов лечения, ни один из которых не гарантирует излечения. В последних обзорах литературы на данную тему выделяют 3 основные направления поиска новых методов лечения: 1) разработка новых и усовершенствование уже существующих методик хирургического лечения; 2) поиск эффективных средств адъювантной терапии; 3) предотвращение заболевания путем вакцинации от ВПЧ [5, 22, 23, 27–29].
Целями хирургического вмешательства при ПГ являются: полное удаление папилломатозных разрастаний с сохранением подлежащей неповрежденной ткани, минимизация риска рубцевания. При наличии разрастаний в области передней и/или задней комиссур, а также при агрессивном течении заболевания достижение последней цели, равно как и предотвращение образования мембран гортани, приобретают особое значение [29, 30].
 В связи с этим на сегодняшний день удаление папиллом «холодными» инструментами (например, гортанными полипными щипцами) нельзя считать методом выбора. По сравнению с ним хирургия с использованием CO2-лазера отличается более длинными межрецидивными периодами и достоверно снижает частоту развития стенозов гортани, требующих наложения трахеостомы, согласно результатам ряда исследований [5, 11, 15].
В связи с этим на сегодняшний день удаление папиллом «холодными» инструментами (например, гортанными полипными щипцами) нельзя считать методом выбора. По сравнению с ним хирургия с использованием CO2-лазера отличается более длинными межрецидивными периодами и достоверно снижает частоту развития стенозов гортани, требующих наложения трахеостомы, согласно результатам ряда исследований [5, 11, 15].С 1968 г., когда Bredemeier предложил устройство для эндохирургического применения CO2-лазера, и по сей день этот метод не теряет популярности. Однако он требует общей анестезии и потому может быть применен только в условиях операционной [3, 13, 25]. Метод требует также соблюдения известных мер предосторожности в связи с тем, что образующийся при работе лазера пар содержит вирусные частицы, которые могут осесть на окружающих тканях и инфицировать оперирующего хирурга – в литературе описан по крайней мере 1 такой случай [11, 14].
В амбулаторной практике возможно применение FPD-лазера, обладающего несколько иным механизмом действия: длина волны его излучения находится в видимом спектре, что обусловливает поглощение излучения молекулами гемоглобина с последующим местным гемолизом и микротромбированием.
 Этим объясняются меньшая глубина проникновения излучения (2 мм) и возможность сохранения эпителия интактным, что в ряде исследований использовалось для удаления папиллом голосовых связок и передней комиссуры [6, 14, 19]. Лечение не сопровождалось побочными эффектами, рубцевания или образования спаек через 3 мес. и через 1 год не отмечалось. Необходимы более масштабные контролируемые испытания для проверки эффективности и безопасности метода. KTP-лазер действует по схожему принципу, но более удобен в обращении [28].
Этим объясняются меньшая глубина проникновения излучения (2 мм) и возможность сохранения эпителия интактным, что в ряде исследований использовалось для удаления папиллом голосовых связок и передней комиссуры [6, 14, 19]. Лечение не сопровождалось побочными эффектами, рубцевания или образования спаек через 3 мес. и через 1 год не отмечалось. Необходимы более масштабные контролируемые испытания для проверки эффективности и безопасности метода. KTP-лазер действует по схожему принципу, но более удобен в обращении [28].В клинике ЛОР-болезней МОНИКИ им. М.Ф. Владимирского внедрен в клиническую практику метод деструкции папиллом гортани с использованием ИАГ- гольмиевого лазера (длина волны – 2,09 мкм). Отмечены более быстрое заживление послеоперационной раневой поверхности, чем при применении CO2-лазера (3–4 сут вместо 5–8), лучший косметический и гемостатический эффект. У детей, оперированных с применением данной методики, удалось достичь клинического выздоровления в 45,8% случаев [1].

Метод ультразвуковой дезинтеграции папиллом также обладает меньшей, нежели у «холодной» хирургии, травматичностью. На базе МОНИКИ им. М.Ф. Владимирского с 1984 по 1998 г. этим методом с использованием специального волновода было пролечено 58 детей в возрасте от 2 до 15 лет. При анализе клинических и морфологических данных отмечено, что ультразвук оказывает избирательное воздействие на папилломатозную ткань путем образования микротромбов в сосудах микроциркуляторного русла. Это ведет к полному разрушению опухоли с минимальным кровотечением. При соблюдении техники работы с оборудованием здоровые ткани не подвергаются воздействию, а на участке воздействия образуется зона асептического некроза с практически полным отсутствием клеток эритроидного ряда. Применение данной методики привело к клиническому излечению у 41,4% детей, удлинению межрецидивных периодов в 2 раза и более – у 50% детей [9].
Метод коблации впервые применен в 1995 г. [4, 7, 19]. Радиочастотная холодная аблация (коблация) подразумевает пропускание переменного электрического тока радиочастоты через солевой раствор в небольшом его объеме.
 Это приводит к образованию плазменного поля ионов натрия, которое способно разрушать межклеточные соединения, что ведет к вапоризации ткани при сравнительно невысокой температуре – 60–65° C [9, 13]. Кроме того, исключается образование аэрозоля вирусных частиц за счет низкой температуры. Метод впервые был применен для обработки суставных хрящей в ортопедии. Опыт его применения при лечении рецидивирующего ПГ включает несколько описаний серий случаев, в которых отмечены достоверно более длительные межрецидивные периоды (по сравнению с лечением CO2-лазером), отсутствие рубцевания, лучшая сохранность голоса в ближайшем и отдаленном послеоперационном периоде [2, 4, 17].
Это приводит к образованию плазменного поля ионов натрия, которое способно разрушать межклеточные соединения, что ведет к вапоризации ткани при сравнительно невысокой температуре – 60–65° C [9, 13]. Кроме того, исключается образование аэрозоля вирусных частиц за счет низкой температуры. Метод впервые был применен для обработки суставных хрящей в ортопедии. Опыт его применения при лечении рецидивирующего ПГ включает несколько описаний серий случаев, в которых отмечены достоверно более длительные межрецидивные периоды (по сравнению с лечением CO2-лазером), отсутствие рубцевания, лучшая сохранность голоса в ближайшем и отдаленном послеоперационном периоде [2, 4, 17]. Как уже было упомянуто, ни одна из хирургических методик не гарантирует бессрочной ремиссии. Каждый следующий рецидив требует более радикального вмешательства на уже измененных тканях, что рано или поздно может привести к ряду осложнений. Стремление удлинить межрецидивный период, снизить необходимость в хирургическом вмешательстве, а также уменьшить его объем привело к появлению ряда методов адъювантной терапии ПГ.
В качестве абсолютных показаний к адъювантной терапии ПГ были выделены: 1) необходимость в 4 и более вмешательствах в год; 2) распространение разрастаний в подголосовую полость; 3) дыхательные нарушения, обусловленные быстрым рецидивированием папиллом [9, 14, 31].
Первым из предложенных в качестве адъювантной терапии лекарственных средств был α-интерферон. Точный механизм действия интерферона при ПГ неизвестен. Вероятно, имеет место механизм, аналогичный таковому при других вирусных инфекциях, – увеличение продукции эндонуклеаз, ингибирующих cборку белков вируса внутри клетки, и протеинкиназ, изменяющих структуры мембран соседних клеток, что может помешать внедрению в них вирусных частиц [16, 19]. Применение интерферона сопровождается развитием ряда острых побочных реакций (гриппоподобный синдром, головная боль, миалгия, тошнота), имеющих тенденцию к ослаблению при длительном курсе введения препарата, а также хронических реакций (задержка роста у детей, подъем уровня трансаминаз в сыворотке, лейкопения, фебрильные судороги, тромбоцитопения, полиморфная сыпь, алопеция, усталость) [2, 4, 18].
В клинике ЛОР-болезней МОНИКИ им. М.Ф. Владимирского в 1984–1998 гг. было проведено исследование эффективности дискретного плазмафереза, экстракта тимуса, молграмостима и противогерпетического препарата ацикловир в лечении респираторного папилломатоза у детей. Анализ отдаленных клинических результатов показал, что использование указанных методик позволяет увеличить группу больных с полным клиническим выздоровлением (отсутствие рецидивов в течение 2,5 года и более) на 10–15% по сравнению с группой, где применялись чисто хирургические методики. Применение экстракта тимуса, молграмостима, ацикловира и дискретный плазмаферез при соблюдении необходимых предосторожностей не приводят к выраженным побочным эффектам, вызывая в то же время достоверные изменения ряда иммунологических показателей: увеличение относительного числа T4-клеток, снижение содержания ЦИК, рост содержания ГМ-КСФ, увеличение фагоцитарной активности полиморфноядерных клеток [5, 9, 19, 31].
Механизм действия противовирусного препарата рибавирин при рассматриваемом заболевании также неизвестен.
 В иностранных источниках есть описание случая успешного применения рибавирина у 3-летней девочки с агрессивным течением папилломатоза на фоне иммуносупрессии после пересадки печени, сообщение о пилотном исследовании и еще одно описание клинического случая, продемонстрировавшие способность рибавирина вызывать стойкую ремиссию продолжительностью не менее 2 мес. в дозе 23 мг/кг/сут при наличии побочных эффектов в виде лейкопении и анемии [8, 19, 26].
В иностранных источниках есть описание случая успешного применения рибавирина у 3-летней девочки с агрессивным течением папилломатоза на фоне иммуносупрессии после пересадки печени, сообщение о пилотном исследовании и еще одно описание клинического случая, продемонстрировавшие способность рибавирина вызывать стойкую ремиссию продолжительностью не менее 2 мес. в дозе 23 мг/кг/сут при наличии побочных эффектов в виде лейкопении и анемии [8, 19, 26].Активность еще одного противовирусного препарата – ацикловира определяется активностью вирусной тимидинкиназы. Несмотря на отсутствие данного фермента у ВПЧ, обнаружена противовирусная активность ацикловира в 2 сериях случаев, когда имело место коинфицирование ВПЧ и вирусом простого герпеса (ВПГ) – 1, цитомегаловирусом и вирусом Эпштейна – Барр [21, 27].
В последние годы внимание исследователей привлек цидофовир – аналог цитозина. У него была обнаружена антирепликативная активность в отношении ВПЧ, ЦМВ, ВПГ и аденовирусов.
 Первые попытки применения цидофовира у детей датированы 1998 г. (Snoeck et al.), 1999 и 2000 гг. (Pransky et al.). При его системном введении наблюдался ряд побочных действий (нефротоксичность, нейтропения, тошнота, диарея). Однако инъекционный путь введения непосредственно в место поражения не вызывал достоверных изменений в анализах мочи и перечисленных осложнений. К настоящему моменту накоплено достаточно много данных об использовании препарата в терапии рецидивирующего респираторного папилломатоза, которые свидетельствуют о его способности увеличивать межрецидивный период и снижать тяжесть рецидивов [7, 13].
Первые попытки применения цидофовира у детей датированы 1998 г. (Snoeck et al.), 1999 и 2000 гг. (Pransky et al.). При его системном введении наблюдался ряд побочных действий (нефротоксичность, нейтропения, тошнота, диарея). Однако инъекционный путь введения непосредственно в место поражения не вызывал достоверных изменений в анализах мочи и перечисленных осложнений. К настоящему моменту накоплено достаточно много данных об использовании препарата в терапии рецидивирующего респираторного папилломатоза, которые свидетельствуют о его способности увеличивать межрецидивный период и снижать тяжесть рецидивов [7, 13]. Несмотря на это, цидофовир остается и по сей день наиболее распространенным препаратом для адъювантной терапии респираторного папилломатоза и используется десятками хирургов во всем мире по не проверенным методами доказательной медицины протоколам [7, 19].
Ряд авторов высказывают опасения по поводу способности цидофовира вызывать злокачественную трансформацию.
 Так, FDA считает цидофовир потенциально канцерогенным на основании экспериментально выявленного повышения риска развития рака молочных желез у мышей. Однако Broekema сообщает об отсутствии статистически значимого добавочного риска (2,7% риск малигнизации при терапии цидофовиром против 2–3% среди всех больных ПГ). Гистологические исследования биоптатов из папилломатозных разрастаний до и после курса местного лечения подтвердили отсутствие диспластических изменений [9, 24, 26].
Так, FDA считает цидофовир потенциально канцерогенным на основании экспериментально выявленного повышения риска развития рака молочных желез у мышей. Однако Broekema сообщает об отсутствии статистически значимого добавочного риска (2,7% риск малигнизации при терапии цидофовиром против 2–3% среди всех больных ПГ). Гистологические исследования биоптатов из папилломатозных разрастаний до и после курса местного лечения подтвердили отсутствие диспластических изменений [9, 24, 26]. С 1986 г. Shikowitz et al. разрабатывали метод фотодинамической терапии для лечения ПГ. Сущность метода – парентеральное введение определенного фоточувствительного химического вещества, которое накапливается в метаболически активных опухолях, с последующим облучением опухоли лазером с определенной длиной волны. Это вызывает распад фотосенсибилизатора с высвобождением свободных радикалов, запускающих процесс иммунного цитолиза в опухоли с последующим ее некрозом и регрессом [5, 7, 12, 19]. Предложены следующие фотосенсибилизаторы: дигематопорфириновый эфир (DHE) (характерно длительное выведение из организма в течение 2–6 нед.
 ), мезотетра(гидроксифенил-)хлорин (m-THPC) (выводится быстрее) и фталоцианин, прошедший успешные испытания на животных [22]. В контролируемом испытании показано, что проведение сеанса фотодинамической терапии в совокупности со стандартными методиками лечения приводит в большинстве случаев к стойкой ремиссии, развивающейся после кратковременной (до 6 мес.) стабилизации или небольшого ухудшения течения заболевания. Ремиссия продолжается до 3–5 лет, а развивающиеся рецидивы – достоверно менее тяжелые, нежели при использовании обычных методик (микродебридер, CO2-лазер). Метод активизирует клеточные механизмы иммунитета, но не приводит к элиминации вирусной ДНК из пораженных участков и поэтому не позволяет добиться полного излечения. В то же время метод не влияет на течение ПГ и почти у 1/4 пациентов приводит к тем или иным осложнениям, среди которых – фоточувствительность кожи, усугубление дыхательных расстройств при массивных поражениях гортани за счет отека [4, 7, 27].
), мезотетра(гидроксифенил-)хлорин (m-THPC) (выводится быстрее) и фталоцианин, прошедший успешные испытания на животных [22]. В контролируемом испытании показано, что проведение сеанса фотодинамической терапии в совокупности со стандартными методиками лечения приводит в большинстве случаев к стойкой ремиссии, развивающейся после кратковременной (до 6 мес.) стабилизации или небольшого ухудшения течения заболевания. Ремиссия продолжается до 3–5 лет, а развивающиеся рецидивы – достоверно менее тяжелые, нежели при использовании обычных методик (микродебридер, CO2-лазер). Метод активизирует клеточные механизмы иммунитета, но не приводит к элиминации вирусной ДНК из пораженных участков и поэтому не позволяет добиться полного излечения. В то же время метод не влияет на течение ПГ и почти у 1/4 пациентов приводит к тем или иным осложнениям, среди которых – фоточувствительность кожи, усугубление дыхательных расстройств при массивных поражениях гортани за счет отека [4, 7, 27].Индол-3-карбинол является биологически активной добавкой к пище, способной подавлять гиперпластический рост.
 Он содержится в листьях растений семейства крестоцветных. Индол-3-карбинол ингибирует образование в тканях 16-α-гидроксиэстерона и стимулирует синтез 2-гидроксиэстерона, что приводит к подавлению опухолевого роста. В отечественном исследовании 46 пациентам в возрасте от 2 до 15 лет индол-3-карбинол вводился перорально из расчета 100–300 мкг/кг/сут не менее 12 нед. Клинический эффект (отсутствие рецидивов на протяжении 2 лет и более; увеличение межрецидивного периода в 1,5 раза и более) отмечен у 65,2% исследуемых, причем процент эффективности мало зависел от распространенности процесса [3, 4]. Эти данные в целом перекликаются с данными зарубежных источников [23, 25] – у 1/3 больных отмечается полное отсутствие эффекта от лечения.
Он содержится в листьях растений семейства крестоцветных. Индол-3-карбинол ингибирует образование в тканях 16-α-гидроксиэстерона и стимулирует синтез 2-гидроксиэстерона, что приводит к подавлению опухолевого роста. В отечественном исследовании 46 пациентам в возрасте от 2 до 15 лет индол-3-карбинол вводился перорально из расчета 100–300 мкг/кг/сут не менее 12 нед. Клинический эффект (отсутствие рецидивов на протяжении 2 лет и более; увеличение межрецидивного периода в 1,5 раза и более) отмечен у 65,2% исследуемых, причем процент эффективности мало зависел от распространенности процесса [3, 4]. Эти данные в целом перекликаются с данными зарубежных источников [23, 25] – у 1/3 больных отмечается полное отсутствие эффекта от лечения.Достаточно давно замечено, что витамин А, равно как и его производное – 13-цис-ретиноевая кислота, участвуют в регуляции процессов кератинизации в эпителии, а именно: его недостаток повышает риск развития плоскоклеточной метаплазии, а избыток – железистой [3, 23].
 Это привело к возникновению предположения о протективной роли ретиноидов при ПГ. Однако на практике оно не получило подтверждения: исследование пришлось прекратить из-за выраженных побочных эффектов от лечения и отсутствия улучшения [10, 13, 24].
Это привело к возникновению предположения о протективной роли ретиноидов при ПГ. Однако на практике оно не получило подтверждения: исследование пришлось прекратить из-за выраженных побочных эффектов от лечения и отсутствия улучшения [10, 13, 24].С недавних пор внимание исследователей привлекает противоопухолевый препарат бевацизумаб – моноклональные IgG иммуноглобулины к рецептору VEGF. Блокировка указанных рецепторов приводит к резкому замедлению ангиогенеза, что тормозит рост опухоли и нередко приводит к циторедуктивному эффекту [5, 6, 8]. Применение бевацизумаба в сочетании с KTF-лазером показало в ряде исследований как эффективность, так и полное отсутствие побочных эффектов у детей и взрослых в суммарных дозировках от 5 до 88 мг на 1 процедуру в виде инъекций в пораженные участки 1 раз в 4–6 недель. Наблюдались уменьшение тяжести поражения по шкале Derkay в среднем на 58% и увеличение межрецидивных периодов в 1,6–3,25 раза [11, 15, 29]. Полагают, что длина волны излучения данного лазера (532 нм) способствует почти полному его поглощению эритроцитами в поверхностных сосудах, что, с одной стороны, предотвращает коагуляционный некроз глубжележащих тканей, а с другой – потенцирует эффект.
 Понятно, что все эти предположения требуют подтверждения в более масштабных клинических испытаниях. Возможно, бевацизумаб оказывает аналогичный эффект в виде монотерапии [6, 8,18]. Необходима также серьезная оценка отдаленных результатов применения методики.
Понятно, что все эти предположения требуют подтверждения в более масштабных клинических испытаниях. Возможно, бевацизумаб оказывает аналогичный эффект в виде монотерапии [6, 8,18]. Необходима также серьезная оценка отдаленных результатов применения методики.Эпителиальные клетки папилломы отличаются от нормальных плоских эпителиоцитов повышенным количеством рецепторов EGFR (эпителиального фактора роста), которые, как было выяснено, запускают путь фосфатидил-3-инозитол-киназы, приводящий к трансляции большого количества циклооксигеназы (ЦОГ) -2, в свою очередь синтезирующей простагландины, в т. ч. PG E2. Последний способен по механизму положительной обратной связи активировать EGFR. Этот порочный круг, как считают, является одним из механизмов роста папиллом [7, 19, 23]. Было сделано предположение, что разорвать его можно с помощью ингибиторов ЦОГ-2, например, целекоксиба.
Весьма привлекательной выглядит идея вакцинопрофилактики ВПЧ-инфекции. Существующая на сегодняшний день тетравалентная вакцина (против ВПЧ-6, -11, -16, -18) получила широкое распространение в качестве средства профилактики цервикального рака.
 Вакцина совершенно безопасна в плане возможности заражения, высокоиммуногенна и практически лишена побочных эффектов [1]. В одном из последних клинических испытаний тетравалентной вакцины в качестве средства противорецидивной терапии получены обнадеживающие результаты: частота рецидивирования спустя 9 мес. после оперативного вмешательства у больных опытной группы составила 4,8% против 23,5% в группе контроля (p=0,02) [22, 27]. В ряде описаний клинических случаев показано, что использование тетравалентной вакцины у больных ПГ позволяет заметно повлиять на течение процесса [23].
Вакцина совершенно безопасна в плане возможности заражения, высокоиммуногенна и практически лишена побочных эффектов [1]. В одном из последних клинических испытаний тетравалентной вакцины в качестве средства противорецидивной терапии получены обнадеживающие результаты: частота рецидивирования спустя 9 мес. после оперативного вмешательства у больных опытной группы составила 4,8% против 23,5% в группе контроля (p=0,02) [22, 27]. В ряде описаний клинических случаев показано, что использование тетравалентной вакцины у больных ПГ позволяет заметно повлиять на течение процесса [23].Все эти методики не привели к единогласному решению относительно схемы лечения папилломатоза, что заставляет искать новые пути решения проблемы.
На базе ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского» (г. Москва) и Первого МГМУ им. И.М. Сеченова (г. Москва) проведено исследование, куда было включено 50 больных, 25 из которых получали терапию тридекапептидом по схеме согласно протоколу в комплексе с эндоларингеальной микрохирургией с применением холодной плазмы, и 25 человек, которые были прооперированы методом эндоларингеальной микрохирургии с применением холодной плазмы без назначения медикаментозной терапии.
 По первым полученным результатам (срок наблюдения – 9 мес.) выявлено, что у пациентов 1-й группы увеличился межрецидивный период и уменьшилась частота рецидивов. По данным результатов исследования слюны и материала методом ПЦР уменьшилась активность вируса ВПЧ 6 и 11 типа у 20 пациентов (80%), получавших комбинированное лечение.
По первым полученным результатам (срок наблюдения – 9 мес.) выявлено, что у пациентов 1-й группы увеличился межрецидивный период и уменьшилась частота рецидивов. По данным результатов исследования слюны и материала методом ПЦР уменьшилась активность вируса ВПЧ 6 и 11 типа у 20 пациентов (80%), получавших комбинированное лечение.Таким образом, несмотря на низкую распространенность, рецидивирующий респираторный папилломатоз – одна из актуальных проблем современной оториноларингологии, требующая дальнейшего изучения, разработки и внедрения новых способов консервативного и хирургического лечения.
.
Диагностика папилломатоза гортани » Лор-клиника “ЛОР-ПРАКТИКА” в Алматы, услуги врача ухо-горло-носа недорого для детей и взрослых
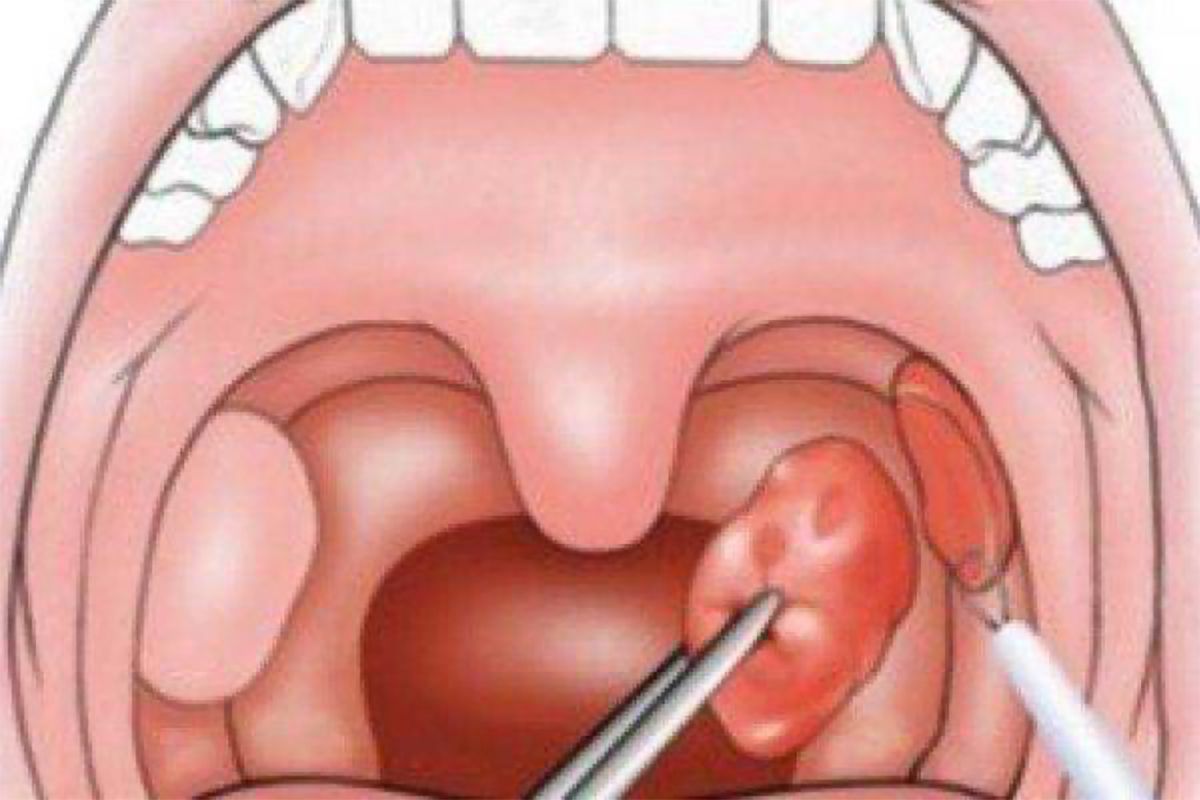
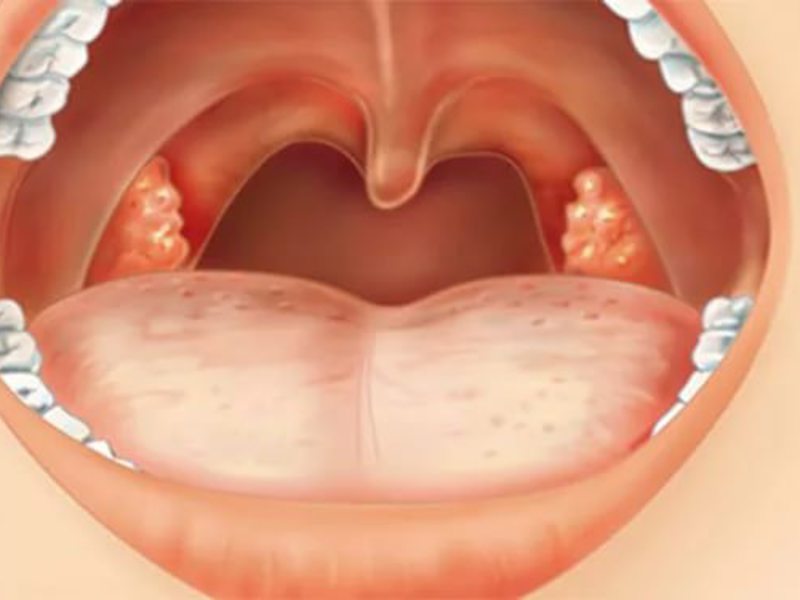
Папилломы гортани встречаются почти столь же часто, как и полипы гортани. Они представляют собой результат пролиферативного процесса, развивающегося в эпителии и соединительно-тканных элементах слизистой оболочки гортани.
Одиночные папилломы встречаются очень редко, в подавляющем большинстве случаев это множественные образования, которые могут возникать не только в гортани, но и одновременно на мягком нёбе, небных миндалинах, губах, коже, слизистой оболочке трахеи.
Вероятно, благодаря особой предрасположенности эпителия папилломы рецидивируют очень часто, из-за чего это заболевание получило название папилломатоза.
Папилломы возникают чаще всего в раннем детстве и у лиц молодого возраста. Описаны случаи врожденных папиллом, имеется наследственная предрасположенность к данному заболеванию.
Симптомы
- Основным симптомом как у детей, так и у взрослых является нарастающая охриплость голоса, достигающая полной афонии. У детей одновременно нарастают и явления нарушения дыхания, одышка при физических нагрузках.
- В некоторых случаях приступы асфиксии возникают внезапно во время банальной ОРВИ, при которой развивается отек гортани. Чем меньше ребенок, тем опаснее эти приступы, что обусловлено значительным развитием рыхлой соединительной ткани в подскладочном пространстве, малыми размерами дыхательных путей и тем, что у маленьких детей папилломатоз носит диффузный характер и развивается очень быстро.
 Все эти факторы риска асфиксии следует иметь в виду при наблюдении за такими детьми. У взрослых приступы удушья не наблюдаются, и единственным симптомом, свидетельствующим о наличии объемного образования в области голосовой щели, является охриплость голоса.
Все эти факторы риска асфиксии следует иметь в виду при наблюдении за такими детьми. У взрослых приступы удушья не наблюдаются, и единственным симптомом, свидетельствующим о наличии объемного образования в области голосовой щели, является охриплость голоса.
Диагностика
- Диагностика затруднений не вызывает, диагноз ставят при помощи прямой ларингоскопии, видеоларингоскопии по характерным внешним признакам опухоли. Для дифференциальной диагностики производят обязательную биопсию. У детей папилломатоз гортани дифференцируют от дифтерии, ложного крупа, инородного тела, врожденных злокачественных опухолей. При папилломах гортани у лиц зрелого возраста следует соблюдать онкологическую настороженность, поскольку такие папилломы, особенно так называемые твердые папилломы беловато-серого цвета, обладают тенденцией к малигнизации.
Лечение
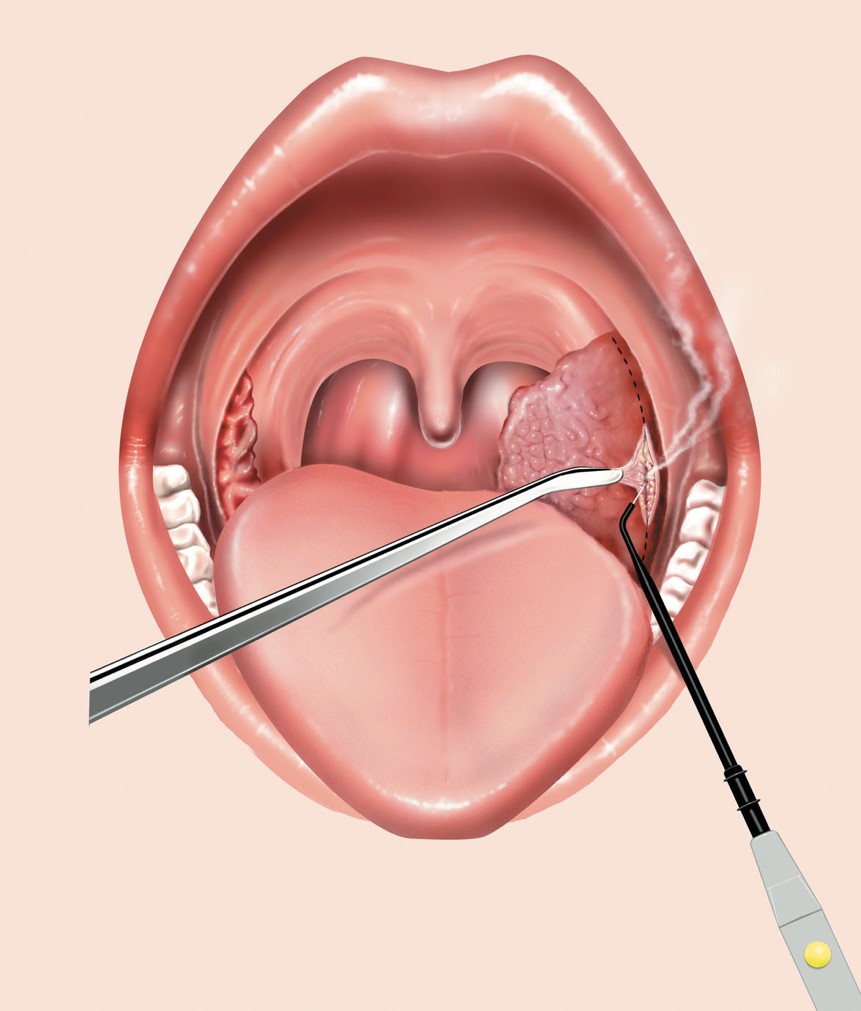
Основной метод лечения папилломатоза гортани – хирургический. Эндоларингеальное удаление папиллом возможно под наркозом или местной анестезией при прямой или непрямой микроларингоскопии, с использованием лазера, радиоволны или ультразвука. Необходимо тщательное и щадящее удаление папиллом. К сожалению, заболевание имеет вирусную природу и нередко рецидивирует. Число хирургических вмешательств необходимо свести к минимуму из-за опасности развития рубцевания гортани.
Необходимо тщательное и щадящее удаление папиллом. К сожалению, заболевание имеет вирусную природу и нередко рецидивирует. Число хирургических вмешательств необходимо свести к минимуму из-за опасности развития рубцевания гортани.
Медикаментозное лечение
Важную роль играет лечение послеоперационного ларингита – антибиотикотерапия, местная и общая противовоспалительная терапии. Допустимо местное применение цитостатиков, противовирусных препаратов и лекарственных средств, влияющих на уровень метаболитов эстрогена и др. На основании исследования иммунного статуса проводят иммунокоррекцию.
Лечение папилломатоза гортани в немецкой клинике голоса
Анамнез
Пациент Х., 39-летний клерк, основная обязанность которого — телефонные переговоры, в течение 1-2 лет наблюдал постепенное ухудшение качества голоса с легкой хрипотцой и усталостью голоса после длительных обсуждений. Поскольку он курит 20-40 сигарет в день в течение 20 лет, он обеспокоен тем, что в гортани могут быть злокачественные изменения. При первом осмотре 1 год назад у лечащего врача ЛОР-патологии не было замечено.
При первом осмотре 1 год назад у лечащего врача ЛОР-патологии не было замечено.
Обследование
Голос звучит хрипло во время осмотра. При крупномасштабной видеоларингоскопии на обеих голосовых связках видны поверхностные изменения слизистой оболочки. Внешний вид, типичный для папиллом, особенно хорошо просматривается при крупном плане по технологии NBI.
Рекомендации и курс лечения
Рекомендуется операция по удалению папиллом под общим наркозом. Гистологическое исследование собранной ткани выявляет папилломы 6 типа ВПЧ без признаков злокачественности. После операции у пациента Х. больше нет жалоб по поводу качества голоса. Однако ему сообщили, что следует ожидать рецидива папиллом, и в этом случае потребуются дальнейшие операции. В качестве альтернативы операции под общей анестезией, была предложена амбулаторная операция при аэрозольной анестезии с новым лазером KTP.
Комментарии
Папилломы в гортани обнаруживаются на голосовых связках и приводят к охриплости. Они возникают в связи с инфекцией ВПЧ (вирусом папилломы человека). Большая часть населения заражена, но развитию заболевания подвержены лишь немногие (в Германии 3 из 100 000). Причина этого пока не выяснена.
Они возникают в связи с инфекцией ВПЧ (вирусом папилломы человека). Большая часть населения заражена, но развитию заболевания подвержены лишь немногие (в Германии 3 из 100 000). Причина этого пока не выяснена.
Злокачественное течение заболевания очень редко встречается среди наиболее распространенных типов вирусов (типы ВПЧ 6 и 11). Папилломатоз голосовых связок — это поверхностное изменение слизистой оболочки. Операция должна только удалить это поверхностное изменение, чтобы избежать рубцов. Во многих случаях рецидивирующие папилломы голосовых связок (рецидивирующий папилломатоз гортани) продолжают появляться годами и требуют дальнейшего операционного вмешательства. Некоторым пациентам приходится проходить процедуру несколько раз в год. Общепризнанного и одобренного в Германии лечения пока нет, но есть несколько терапевтических подходов, которые все еще ожидают клинических испытаний, чтобы продемонстрировать эффективность. Поэтому рекомендуется вакцина против ВПЧ. В течение нескольких лет рекомендуется повторная инъекция противовирусного препарата в пораженные участки. По-видимому, это приводит к снижению частоты рецидивов у некоторых пациентов. Данные о частоте ремиссии можно найти в литературе, хотя исследований пока недостаточно. В Германии препарат еще не одобрен для лечения папилломатоза гортани. Тем не менее, у многих наших пациентов мы неоднократно вводили противовирусный препарат в гортань непосредственно в пораженную ткань по фиксированной схеме, и в некоторых случаях наблюдали удивительные улучшения.
По-видимому, это приводит к снижению частоты рецидивов у некоторых пациентов. Данные о частоте ремиссии можно найти в литературе, хотя исследований пока недостаточно. В Германии препарат еще не одобрен для лечения папилломатоза гортани. Тем не менее, у многих наших пациентов мы неоднократно вводили противовирусный препарат в гортань непосредственно в пораженную ткань по фиксированной схеме, и в некоторых случаях наблюдали удивительные улучшения.
Папилломатоз гортани
Папилломатоз гортани
Что такое папилломатоз гортани?
Папиллома гортани – доброкачественное бородавкообразное образование, вызванное 11 и 6 типами вируса папилломы человека (ВПЧ). Различают ювенильный и взрослый тип папилломатоза гортани. В редких случаях при резких гормональных изменениях, таких, как при беременности, состояние может резко ухудшиться, и папилломы могут перерасти в злокачественную форму. Существует мнение, что подобные явления связаны с курением или радиотерапией.
Существует мнение, что подобные явления связаны с курением или радиотерапией.
В соответствии с данными различных научных докладов, в случае ювенильного папилломатоза гортани инфицирование ребенка происходит при прохождении им родовых путей матери, страдающей от остроконечных кондилом. Ввиду механических причин, воспаления, гормонов, наследственности и несбалансированного питания рецидив наступает чаще, чем в случае других доброкачественных образований.
Скачать брошюру о лечении папилломатоза гортаниСимптомы папилломатоза гортани
Это заболевание чаще встречается у детей. Главным симптомом является охриплость, а в случаях широкого распространения папиллом – затруднение дыхания.
Лечение папилломатоза гортани
В Центре голоса Есон проводят микрохирургию гортани с введением противовирусного препарата (цидофовира) в очаг поражения. В случае, если у пациента есть рубцы или область распространения папилломатозной ткани очень широкая, то послеоперационную поверхность обрабатывают лазером на цветных красителях (PDL), что помогает восстановить ткани голосовых складок и сократить возможность рецидива.
В случае, если у пациента есть рубцы или область распространения папилломатозной ткани очень широкая, то послеоперационную поверхность обрабатывают лазером на цветных красителях (PDL), что помогает восстановить ткани голосовых складок и сократить возможность рецидива.
ФДТ в оториноларингологии. Папилломатоз.
Папилломатоз является патологическим процессом, характеризуется образованием множественных папиллом на каком-либо участке кожи или слизистой оболочки.
Папилломатоз гортани – доброкачественная опухоль, развивающаяся из плоского или переходного эпителия и выступающая над его поверхностью в виде сосочка.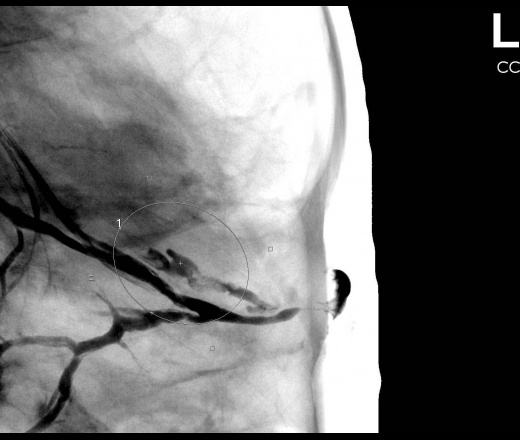
Папилломы гортани встречаются почти столь же часто, как и полипы гортани. Они представляют собой результат пролиферативного процесса, развивающегося в эпителии и соединительно-тканных элементах слизистой оболочки гортани под действием вируса папилломы человека. В подавляющем большинстве случаев это множественные образования, которые могут возникать не только в гортани, но и одновременно на мягком нёбе, небных миндалинах, губах, коже, слизистой оболочке трахеи. Папилломы очень часто рецидивируют, из-за чего это заболевание получило название папилломатоза.
В литературе представлены результаты применения ФДТ для лечения папилломатоза гортани и трахеи с Фотодитазином. ФС вводили в/в, облучение проводили через 1-3 часа после введения излучением с длиной волны 662 нм мощностью 0.5-2.0 Вт [аппарат 1], доза световой энергии варьировалась в пределах 250-1800 Дж. Облучение проводили как под местной, так и под общей анестезией с использованием ларингоскопов разных размеров для вестибулярного, голосового, подголосового отделов и верхней трети трахеи, фиброскопа и катетера для средней и нижней части трахеи. Полный регресс был достигнут в 60-80% случаев, отмечаются рецидивы. По этим причинам ФДТ при лечении папилломатоза (особенно запущенных случаев) чаще применяется в качестве адъювантной терапии после проведения хирургического вмешательства. Здесь отмечается высокая эффективность данного метода.
Полный регресс был достигнут в 60-80% случаев, отмечаются рецидивы. По этим причинам ФДТ при лечении папилломатоза (особенно запущенных случаев) чаще применяется в качестве адъювантной терапии после проведения хирургического вмешательства. Здесь отмечается высокая эффективность данного метода.
При небольшой распространенности патологии может применяться аппликационный способ нанесения ФС.
[Материалы взяты из: Сборник трудов под редакцией Н.Н. Петрищева, 2011, http://www.allokin.ru/human-papilloma-virus/papillomatoz-gortani/, Автореферат диссертации на соискание кан.мед. наук ФДТ новообразований ЛОР-органов, Улупов М.Ю].
Папиллома гортани – Центр голоса и глотания UC Davis Центр голоса и глотания UC Davis
Папилломы – это доброкачественные эпителиальные опухоли, которые возникают в результате инфицирования вирусом папилломы человека (ВПЧ). Это самые распространенные доброкачественные новообразования, поражающие гортань и верхние дыхательные пути.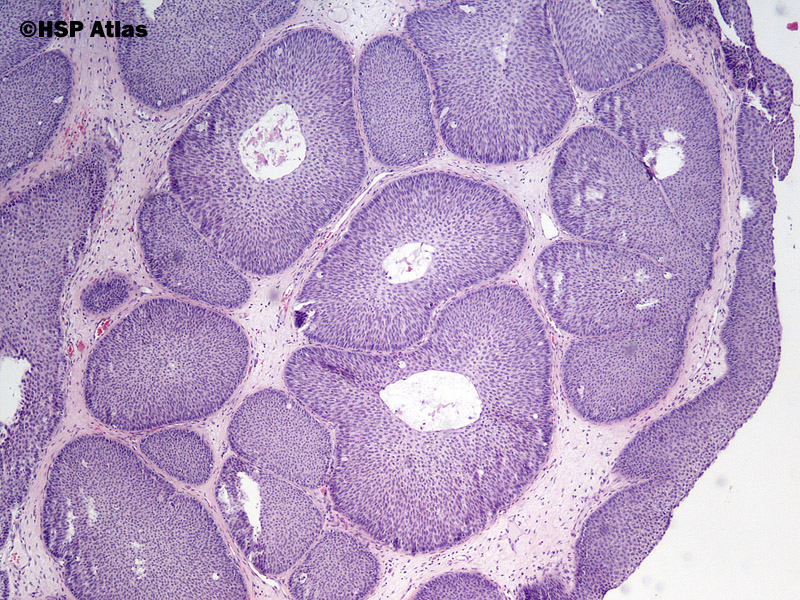 Злокачественное перерождение в плоскоклеточный рак может произойти, но очень редко. Общая распространенность колеблется от 2 на 100 000 взрослых до 4,5 на 100 000 детей. Таким образом, более 10 000 американцев страдают респираторными папилломами.
Злокачественное перерождение в плоскоклеточный рак может произойти, но очень редко. Общая распространенность колеблется от 2 на 100 000 взрослых до 4,5 на 100 000 детей. Таким образом, более 10 000 американцев страдают респираторными папилломами.
Папилломы гортани похожи на бородавки на коже (обычная бородавка) и остроконечные кондиломы, или остроконечные кондиломы. Заражение вирусом повсеместно. Используя высокочувствительные методы обнаружения, такие как полимеразная цепная реакция, оценки инфицирования ВПЧ варьируются от 60 до 80% женщин детородного возраста. Остается неясным, почему у некоторых инфицированных людей развиваются клинические проявления папилломы (респираторные, генитальные или кожные), а у некоторых никогда не развиваются клинические заболевания.Реальность такова, что некоторые люди кажутся восприимчивыми к вирусу, а другие нет. Хотя некоторые люди могут заразиться вирусом при интимном контакте, вирус может передаваться от матери к плоду, и папилломатоз гортани (респираторный) НЕ считается заболеванием, передающимся половым путем.
На рисунке ниже слева показано оптоволоконное изображение нормальной гортани. Изображение справа отображает изображение папилломы гортани. Изображение перевернуто, потому что во время эндоскопической операции пациент лежит на спине.Папиллома на передней поверхности левой голосовой связки. Если папиллома не удаляется осторожно, на голосовой складке может образоваться рубец, и может произойти изменение голоса.
Из-за их склонности к рецидиву после хирургического удаления это заболевание часто называют рецидивирующим респираторным папилломатозом (RRP). Расстройство далее классифицируется на RRP с началом у взрослых (AORRP) и RRP с ювенильным началом (JORRP). Эта классификация основана на различных клинических картинах, влияющих на детей и взрослых.
JORRP обычно определяется в младенчестве или детстве. Обычно он проявляется в виде охриплости или стридора (шумного дыхания) и характеризуется обширным поражением гортани с частыми рецидивами. Существует некоторая связь между остроконечными кондиломами у матери и развитием РПБ у детей. Однако риск развития JORRP у детей, рожденных от матерей с активными остроконечными кондиломами, составляет менее 0,5%. Вирус также обнаружен в околоплодных водах матерей с острой кондиломой.Поэтому, если бородавки не настолько велики, что препятствуют прохождению родовых путей, кесарево сечение рекомендуется редко.
Однако риск развития JORRP у детей, рожденных от матерей с активными остроконечными кондиломами, составляет менее 0,5%. Вирус также обнаружен в околоплодных водах матерей с острой кондиломой.Поэтому, если бородавки не настолько велики, что препятствуют прохождению родовых путей, кесарево сечение рекомендуется редко.
Хотя папилломы доброкачественные, их быстрый рост может вызвать обструкцию дыхательных путей, что может привести к удушью, если не лечить. В некоторых случаях может потребоваться трахеотомия, но ее избегают любой ценой. Папиллома может поражать голосовые связки и / или надгортанник, а иногда может распространяться дистально, поражая трахею или бронхи. Лечение обычно состоит из частых ларингоскопий с хирургическим удалением с помощью углекислотного (CO2) лазера.Поскольку вирус живет в нормально выглядящей ткани, окружающей папиллому, вероятен рецидив, и часто требуется повторное эндоскопическое удаление. Некоторым детям может потребоваться иссечение 1-2 раза в месяц (обычно в амбулаторных условиях). Папилломы могут спонтанно регрессировать в период полового созревания, хотя многим детям требуется лечение на всю жизнь.
Папилломы могут спонтанно регрессировать в период полового созревания, хотя многим детям требуется лечение на всю жизнь.
РПН у взрослых обычно более локализована и менее серьезна, чем у молодых. Одной ларингоскопии с иссечением часто бывает достаточно для лечения.Однако иногда AORRP может вести себя так же агрессивно, как JORRP. Хирургическое иссечение с помощью CO2-лазера обычно является методом выбора. Следует проявлять большую осторожность, чтобы не повредить окружающий нормальный эпителий гортани, поскольку это может привести к рубцеванию голосовых связок с постоянной охриплостью. Сейчас мы проводим абляцию папилломы гортани в офисе с помощью импульсного лазера на красителе (PDL). PDL можно использовать в офисе с помощью гибкого ларингоскопа без необходимости похода в операционную.Процедура выполняется в вертикальном кресле для осмотра, может занять от 5 до 15 минут, в целом безболезненна и при необходимости может быть повторена. Избегают риска применения общей анестезии. Лазер считается «умным» лазером и нацелен на папилому, не повреждая нормальный эпителий гортани. Человек может вернуться к работе и возобновить нормальную деятельность сразу после процедуры.
Лазер считается «умным» лазером и нацелен на папилому, не повреждая нормальный эпителий гортани. Человек может вернуться к работе и возобновить нормальную деятельность сразу после процедуры.
Композиция ниже показывает гортань до и после лечения папилломы гортани с помощью PDL.На изображении слева показана папиллома гортани, полностью включающая слизистую оболочку голосовых складок. На изображении справа показаны нормальные голосовые складки после 2 процедур PDL.
Хотя дополнительная терапия используется редко с момента введения PDL, тщательное обсуждение всех возможных вариантов лечения пациентов по-прежнему оправдано.
Из-за агрессивного характера заболевания у некоторых людей для лечения RRP использовались дополнительные методы лечения.Были опробованы такие варианты, как лучевая терапия, вакцинация, фотодинамическая терапия и различные химиотерапевтические средства. С момента введения в практику лазерной терапии с использованием PDL в этих дополнительных методах лечения не было необходимости. для лечения РРП. Были опробованы такие варианты, как лучевая терапия, вакцинация, фотодинамическая терапия и различные химиотерапевтические средства.
для лечения РРП. Были опробованы такие варианты, как лучевая терапия, вакцинация, фотодинамическая терапия и различные химиотерапевтические средства.
Интерфероны (интерфероны) – это вещества, вырабатываемые естественным путем в организме, которые используются для борьбы с инфекциями и опухолями.Также доступны синтетические версии. Хотя некоторые исследователи сообщают об успехе использования интерферона для лечения агрессивного RRP, частые побочные эффекты, такие как усталость, головокружение, недомогание, ломота в теле, головная боль и лихорадка, а также склонность папиллом к рецидиву после воздействия интерферона. были остановлены, предотвратили его широкое распространение.
Индол-3-карбинол, природное производное крестоцветных овощей (капуста и брокколи), как было показано, изменяет структуру роста RRP.Он безопасен, хорошо переносится и может оказаться эффективным дополнительным лечением агрессивного РРП у некоторых пациентов.
Метотрексат (метотрексат) принадлежит к классу химиотерапевтических агентов, называемых антиметаболитами. Это лекарство блокирует фермент (дигидрофолатредуктазу), необходимый опухолевым клеткам для жизни. Поскольку рост нормальных клеток также будет затронут, также могут возникнуть побочные эффекты (проблемы с кровью, печенью или почками, диарея, выпадение волос и т. Д.). Некоторые исследователи сообщили о клинической пользе дополнительного применения метотрексата у некоторых пациентов с агрессивным РПЭ.Однако необходимы дополнительные исследования для дальнейшего определения его терапевтической эффективности.
Это лекарство блокирует фермент (дигидрофолатредуктазу), необходимый опухолевым клеткам для жизни. Поскольку рост нормальных клеток также будет затронут, также могут возникнуть побочные эффекты (проблемы с кровью, печенью или почками, диарея, выпадение волос и т. Д.). Некоторые исследователи сообщили о клинической пользе дополнительного применения метотрексата у некоторых пациентов с агрессивным РПЭ.Однако необходимы дополнительные исследования для дальнейшего определения его терапевтической эффективности.
Цидофовир (si-DOF-o-veer) – противовирусный препарат, который используется для лечения вирусных инфекций. Недавнее использование этого лекарства при лечении РРП показало некоторые надежды. Для лечения РПБ цидофовир вводили непосредственно в папиллому (локально) во время эндоскопии. Насколько нам известно, серьезных побочных эффектов не было, и у некоторых пациентов наблюдалась полная регрессия папилломы после нескольких инъекций.
Недавно была обнаружена связь между ларингофарингеальным рефлюксом и РРП. Неясно, способствует ли раздражение, вызванное забросом содержимого желудка, развитию папиллом или наличие папиллом предрасполагает к рефлюксу. Тем не менее, у пациентов с РРП наблюдается высокая распространенность РПР. Пациенты с LPR, проходящие лечение от папилломы, также, по-видимому, имеют более высокую распространенность хирургических осложнений, в первую очередь, развития перепонки гортани.Требуется дальнейшее расследование.
Неясно, способствует ли раздражение, вызванное забросом содержимого желудка, развитию папиллом или наличие папиллом предрасполагает к рефлюксу. Тем не менее, у пациентов с РРП наблюдается высокая распространенность РПР. Пациенты с LPR, проходящие лечение от папилломы, также, по-видимому, имеют более высокую распространенность хирургических осложнений, в первую очередь, развития перепонки гортани.Требуется дальнейшее расследование.
СВОДКА
Респираторные папилломы – это доброкачественные эпителиальные образования, похожие на бородавки на коже. Они вызываются вирусом (ВПЧ) и часто повторяются. Наш подход к людям с РРП адаптирован к конкретным потребностям каждого человека. У взрослого с AORRP простая лазерная хирургия PDL в офисе может быть излечима. При объемных заболеваниях, препятствующих проходимости дыхательных путей, или для тех редких людей, которые не переносят офисную процедуру PDL, может потребоваться поездка в операционную.Это выполняется под общим наркозом с помощью СО2-лазера, микродебридера или «холодных» микрохирургических инструментов под микроскопическим контролем, чтобы ограничить повреждение здоровых подлежащих тканей и сохранить голосовую функцию.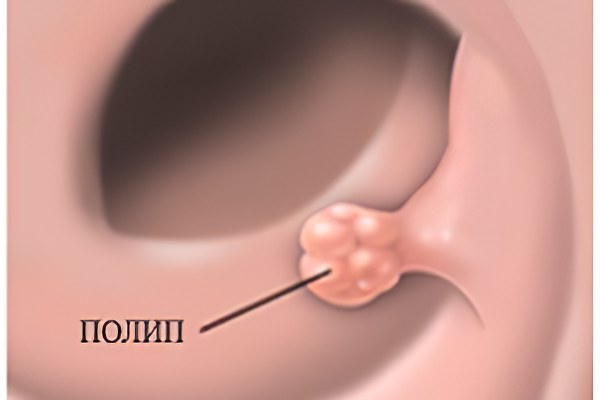 Присутствие рефлюкса будет оценено и, если оно есть, будет контролироваться с помощью антирефлюксных препаратов. Мы применяем более агрессивную схему лечения пациентов с очень рецидивирующей формой заболевания. Если повторное хирургическое удаление не привело к регрессу, мы рассмотрим терапию цидофовиром, индол-3-карбинолом или одним из других доступных химиотерапевтических средств.Конечная цель – полный регресс заболевания и сохранение голосовой функции.
Присутствие рефлюкса будет оценено и, если оно есть, будет контролироваться с помощью антирефлюксных препаратов. Мы применяем более агрессивную схему лечения пациентов с очень рецидивирующей формой заболевания. Если повторное хирургическое удаление не привело к регрессу, мы рассмотрим терапию цидофовиром, индол-3-карбинолом или одним из других доступных химиотерапевтических средств.Конечная цель – полный регресс заболевания и сохранение голосовой функции.
Детские папилломы гортани
Папилломы гортани представляют собой небольшие бородавчатые наросты, которые образуются на гортани и голосовых связках. Они могут повлиять на нормальную функцию голосовых связок и привести к затруднению дыхания.
Что такое детские папилломы гортани?
Папилломы гортани (также известные как рецидивирующий респираторный папилломатоз) образуются разных размеров и развиваются в дыхательных путях, чаще всего поражая гортань (голосовой ящик). Когда голосовые связки (также называемые голосовыми связками) покрываются этими быстро производящимися узелками, они не вибрируют эффективно для воспроизведения звука. В результате голос вашего ребенка хриплый и слабый.
Когда голосовые связки (также называемые голосовыми связками) покрываются этими быстро производящимися узелками, они не вибрируют эффективно для воспроизведения звука. В результате голос вашего ребенка хриплый и слабый.
По мере распространения папиллом в дыхательных путях они могут расти на трахее (дыхательное горло), бронхах и иногда в легких. Когда папилломы закупоривают дыхательные пути, они могут вызвать затруднение дыхания.
Папилломы гортани в подавляющем большинстве случаев представляют собой доброкачественные (доброкачественные) образования.В редких случаях – менее 1 процента – они могут стать злокачественными. Папилломы могут быть стойкими при удалении и часто снова вырастают.
Папилломы гортани обычно диагностируются в возрасте 12 лет и могут перейти в ремиссию (исчезнуть), когда ребенок достигнет половой зрелости (в возрасте от 10 до 14 лет для девочек и в возрасте от 12 до 16 лет для мальчиков *).
Каковы признаки и симптомы папиллом гортани у детей?
Младенцы (от рождения до 1 года **):
Симптомы папиллом гортани у младенцев включают:
Дети от 1 года:
Самый частый симптом у детей – охриплость голоса. Симптомы также могут включать:
Симптомы также могут включать:
- Удушье
- Хронический кашель
- Затрудненное и шумное дыхание
- Затруднение глотания
- Ощущение, будто в горле застряло инородное тело
- Потеря голоса
- Одышка
- Проблемы при разговоре
- Слабый, напряженный, хриплый или низкий голос
* Возраст полового созревания – от среднего детства до подросткового возраста, согласно определению Центра по контролю за заболеваниями (CDC).
** Возраст младенцев согласно определению Всемирной организации здравоохранения (ВОЗ).
Каковы причины папиллом гортани у детей?
Вирус папилломы человека (ВПЧ) вызывает папилломы гортани. В большинстве случаев он передается детям, когда они проходят через родовые пути своей матери с ВПЧ. Некоторые случаи развиваются до рождения.
Факторы риска
Наибольшему риску папиллом гортани подвержены дети, если они:
- Первенец
- Вводится вагинально
- Родились, когда матери не исполнилось 20 лет
Папилломатоз гортани | Новости ЛОР и аудиологии
Папилломатоз гортани остается одним из самых тяжелых состояний, с которыми сталкиваются ларингологи.Сэм Маджумдар дает нам обзор современной науки и клинической практики.
Вирус папилломы человека представляет собой небольшой (> 8 т.п.н.) двухцепочечный ДНК-вирус с примерно 200 подтипами [1]. Он принадлежит к семейству вирусов Папова. Подтипы 6, 11 вызывают около 90% папиллом гортани. Остальные 10% относятся к ВПЧ типов 16, 18. Тип 11 является клинически агрессивным типом, в то время как типы 16 и 18 имеют более высокий потенциал злокачественной трансформации.ВПЧ типов 6, 11, 16 и 18 вместе вызывают большинство случаев рака шейки матки, что стало центральной логикой разработки четырехвалентной вакцинации.
Заболеваемость рецидивирующим респираторным папилломатозом (РРП) составляет 4,3 на 100 000 населения у детей и 1,8 на 100 000 у взрослых. РРП имеет бимодальное возрастное распределение при первом проявлении – обычно оно поражает подростков и людей четвертого десятилетия жизни. Появление РРП в возрасте до 12 лет классифицируется как РРП с ювенильным началом (JORRP).Все проявления после 12 лет классифицируются в группу взрослых с дебютом RRP (AORRP).
Представление РРП в возрасте до трех лет часто связано со значительно более высокими шансами распространения и злокачественной трансформации в более позднем возрасте. Частота злокачественной трансформации РРП у детей составляет 1-2% (2).
Трансмиссия
Инфекция ВПЧ у детей чаще всего передается вертикально при рождении от инфицированных ВПЧ матерей. Трансплацентарная передача ВПЧ плоду происходит примерно в 12% случаев.Наличие аногенитальных папиллом у матери может увеличить риск развития РПБ в 231 раз. У взрослых вирус ВПЧ передается половым путем. Подсчитано, что более 80% из нас заразятся ВПЧ в течение жизни. К сожалению, огромное количество инфекций ВПЧ высокого риска могут оставаться бессимптомными и оставаться незамеченными, что увеличивает риск распространения среди населения и долгосрочный риск злокачественной трансформации у инфицированных вирусом.
«Многие пациенты очень расстроены и огорчены диагнозом ИППП (инфекция, передающаяся половым путем), вызывающей повреждение и деформацию их гортани.”
Клиническая картина
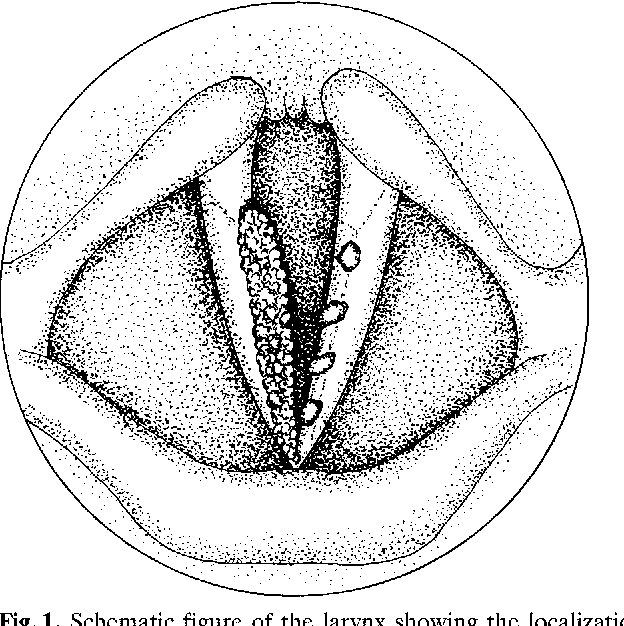
Стойкая охриплость голоса, одышка в покое или при физической нагрузке, кашель и стридор – некоторые из распространенных симптомов папилломатоза гортани. Клиническая картина зависит от места и размера поражения. Поражение передней спайки, передних двух третей голосовой связки или объемное заболевание, препятствующее соединению голосовых связок во время генерации голоса, как правило, проявляется раньше. Вовлечение надгортанника может долгое время оставаться незамеченным (рис. 1).
Рис. 1. Множественное поражение папилломы гортани.
Диагностика
Всем пациентам необходима формальная диагностическая ларинго-трахео-бронхоскопия для правильной оценки и определения стадии заболевания. Гистопатологические данные подтверждают диагноз. Подтип ВПЧ настоятельно рекомендуется в качестве хорошей практики, поскольку он помогает найти агрессивную разновидность (то есть подтип 11) и тех, у кого более высокая предрасположенность к злокачественной трансформации (т.е. подтипы 16, 18).
Менеджмент
Многие пациенты очень расстроены и огорчены диагнозом ИППП (инфекция, передающаяся половым путем), вызывающей повреждение и деформацию их гортани. Тщательная оценка голосовой функции и регистрация показателя ДМС-10 до и после хирургических вмешательств очень полезны для успокоения и реабилитации пациентов. Все пациенты с дисфонией и папилломой с поражением голосовой щели должны пройти стробоскопическое обследование и иметь фотодокументацию заболевания.
В настоящее время нет лечебных средств от папилломатоза гортани. Частой практикой является удаление инфицированной ВПЧ эпителиальной ткани, которая проявляется в виде видимого экзофитного отека в гортани, оставляя пространство Рейнке нетронутым, где это возможно. Можно использовать лезвие скиммера микродебрайдера, и некоторые хирурги комбинируют его с лазером CO2 в режиме сканирования для удаления папилломы вблизи голосовых связок. Использование КТР и других ангиолитических лазеров в качестве основного инструмента для удаления основной части папилломы гортани не так широко практикуется в Великобритании.Совсем недавно кобляция была предложена в качестве лечения (рис. 2).
Рис. 2. РРП поражения передней спайки через шесть месяцев после лечения.
Адъювантная терапия
Целью такой терапии является предотвращение рубцевания, местного распространения, диссеминации и рецидивов. На сегодняшний день не показано, что адъювантная терапия имеет существенное преимущество в лечении папилломатоза гортани. Ни один из этих методов лечения не получил широкого распространения в клинической практике, хотя некоторые из них оказались многообещающими и ожидают дальнейших исследований.
Интерферон
Интерферон был самой первой адъювантной терапией, использованной для контроля диссеминированного RRP. Интерфероны стимулируют выработку антигена лимфоцитами. IFN-α2b показал частичный ответ в некоторых испытаниях. Лейкопения, тромбоцитопения и неврологические расстройства являются одними из неприятных побочных эффектов терапии интерфероном. Использование интерферона больше не приветствуется [2].
Цидофовир
Цидофовир ингибирует вирусную ДНК-полимеразу, таким образом подавляя репликацию вируса.Цидофовир внутри очага поражения является предпочтительным способом введения этого препарата. Частые рецидивы РПЭ и агрессивное заболевание – это ситуации, в которых Цидофовир успешно применялся некоторыми авторами. Сообщаемое развитие диспластических изменений в 2,5% из серии из 188 случаев RRP, леченных цидофовиром внутри очага поражения, было серьезной причиной для беспокойства [3]. Однако, учитывая естественную тенденцию диспластического изменения ВПЧ на 2-3%, трудно приписать это исключительно рассматриваемому препарату.О заметном регрессе папилломы и полной ремиссии заболевания сообщалось в небольших проспективных исследованиях, в которых использовался цидофовир внутри очага поражения. В других исследованиях сообщается о 75% полной ремиссии со стабилизацией заболевания в течение 33,4 месяцев у подростков с РРП. В одном из исследований рабочей группы RRP, в котором приняли участие 74 ларинголога, было выявлено использование цидофовира в качестве адъювантной терапии у пациентов, нуждающихся в частом хирургическом удалении массы тела, и было высказано предостережение, что доза должна оставаться ниже безопасного предела 3 м / кг и объема.Необходимы крупные рандомизированные контролируемые испытания, чтобы поддержать использование цидофовира и успокоить как пациентов, так и хирургов.
Бевацизумаб
Это рекомбинантное моноклональное антитело обладает способностью ингибировать фактор роста эндотелия сосудов и, таким образом, индуцированный вирусами ангиогенез. Способ доставки – внутри очага поражения. Сообщалось, что бевацизумаб снижает рецидивы ВПЧ при использовании в качестве адъювантной терапии после удаления опухоли папилломы с помощью KTP-лазера. В небольших испытаниях у этого препарата было очень мало побочных эффектов.
«Хотя 85% родителей хотели бы, чтобы их дети мужского пола были вакцинированы, эта вакцина все еще не включена в программу профилактики заболеваний в Великобритании».
Пембролизумаб
Это гуманизированное моноклональное антитело, которое активирует Т-лимфоциты, избирательно блокируя некоторые рецепторы, тем самым помогая иммунным клеткам распознавать и уничтожать аномальные клетки, инфицированные вирусом. Известно, что пембролизумаб ингибирует белок запрограммированной гибели клеток 1, который высоко экспрессируется некоторыми опухолями головы и шеи, связанными с ВПЧ.
В рамках продолжающегося клинического исследования фазы II (NCT02632344) изучается безопасность и иммуномодулирующий эффект пембролизумаба при лечении запущенных случаев RRP с поражением трахео-бронхо-легочных артерий.
Митомицин С
Это не адъювантная терапия; хотя используется некоторыми хирургами. Местное применение Митомицина С использовалось для предотвращения рубцевания голосовой щели. Поэтому митомицин С используется некоторыми ларингологами, особенно при лечении папиллом, поражающих переднюю спайку.
Вакцинация гардасилом
Вакцинация против ВПЧ повышает титр сывороточных антител у пациентов. Кин Чо Гун и др. [4] в небольшом исследовании показали семикратное снижение частоты рецидивов папилломы гортани в поствакцинальной группе, нуждающейся в хирургическом вмешательстве.
Вакцинация и профилактика
ВПЧ – самая распространенная инфекция, передаваемая половым путем в Великобритании. Инфекция ВПЧ практически отсутствует у людей, никогда не имевших половых контактов.Половой контакт в раннем возрасте и наличие нескольких сексуальных партнеров – две наиболее важные детерминанты инфекций ВПЧ у взрослых. Центры США по контролю и профилактике заболеваний рекомендовали рутинную вакцинацию девочек в возрасте 11-15 лет и вакцинацию до 26 лет в качестве наверстывания для тех, кто пропустил вакцинацию, чтобы предотвратить рак шейки матки. Гардасил, четырехвалентная вакцина от Merck, была одобрена для этой цели Управлением по контролю за продуктами и лекарствами США в 2006 году.FDA также одобрило другую бивалентную вакцинацию Церварикс для иммунизации против ВПЧ 16, 18, которая имеет ограниченное применение при папилломатозе гортани. Обе эти вакцины доказали свою высокую эффективность в клинических испытаниях. Гардасил-9 (9-валентная вакцина против ВПЧ) был недавно одобрен.
Вакцинация мальчиков
Вакцинация против инфекции ВПЧ наиболее эффективна у детей в возрасте до любого сексуального контакта. В Великобритании вакцинация против ВПЧ девочек 12-13 лет началась в 2008 году.Хотя 85% родителей хотели бы, чтобы их дети мужского пола были вакцинированы, эта вакцина все еще не включена в программу профилактики заболеваний в Великобритании. В 2013 году в Австралии началась программа вакцинации мальчиков против ВПЧ. Ежегодные затраты на проведение программы вакцинации мальчиков оцениваются в 22 миллиона фунтов стерлингов по сравнению со значительно более высокими экономическими и человеческими издержками, связанными с этой печально известной сложной болезнью, не поддающейся искоренению. Ориентировочная дата вакцинации мальчиков от ВПЧ в Великобритании – 2020 год; в результате чего 400000 мальчиков ежегодно будут подвергаться риску заражения ВПЧ (Gender Neutral Vaccination – www.HPVAction.org ).
«Самая большая проблема в борьбе с ВПЧ – это, вероятно, неумолимое распространение этого вируса среди всех групп населения».
Будущие направления и вызовы
Самой большой проблемой в борьбе с ВПЧ, вероятно, является неумолимое распространение этого вируса среди всех групп населения. Программы вакцинации могут эффективно защитить тех, кто еще не инфицирован вакциной. Также появляются новые данные о защитном эффекте вакцинации в качестве адъювантной терапии и профилактики инфекции у взрослых.
Некоторые подтипы ВПЧ потенциально онкогенные. Рак головы и шеи, связанный с ВПЧ, впервые был заподозрен в 1983 году в группе рака ротоглотки. Основываясь на молекулярных исследованиях, в настоящее время считается, что 80% плоскоклеточного рака ротоглотки являются HPV-положительными. ВПЧ-16 обнаружен в 80 из этих опухолей [5].
Американский объединенный комитет по раку (AJCC) и Международный союз борьбы с раком (UICC) включили тестирование на ВПЧ в свои рекомендации в качестве стандартной патологической оценки рака ротоглотки.
Обеспечение гендерной нейтральности вакцинации против ВПЧ внесет значительный вклад в повышение коллективного иммунитета. Использование вакцинации у пациентов с РРП может иметь адъювантные преимущества. Исследования показали связь между повышенным титром сывороточных антител к HPB и ремиссией клинического заболевания.
Первичные вмешательства и использование адъювантной терапии папилломатоза гортани демонстрируют некоторые различия между практикующими врачами в Великобритании и во всем мире. Мы надеемся, что создание и использование национальной базы данных и руководств поможет пациентам посредством стандартизации практики, основанной на фактических данных; наряду с распространением знаний о передовой практике.В идеале все пациенты с папилломатозом гортани должны получать прямую помощь ларинголога с фонохирургическими навыками и одновременную помощь многопрофильной бригады [6].
Список литературы
1. Fortes HR, von Ranke FM, Escuissato DL, et al. Рецидивирующий респираторный папилломатоз: современный обзор. Респираторная медицина 2017; 126 : 116-21.
2. Иванчич Р., Икбал Х., де Сильва Б., Пан К., Матрка Л.Текущее и будущее лечение рецидивирующего респираторного папилломатоза. Ларингоскопы следственной отоларингологии. 2018; 3 (1) : 22-34.
3. Брукема Ф., Диккерс Ф.Г. Побочные эффекты цидофовира при лечении рецидивирующего респираторного папилломатоза. Eur Arch Оториноларингол 2008 г .; 265 : 871-9.
4. Кин Чо Гун П., Шольц Л.-У, Судхофф Х., FRCS FRCPath. Рецидивирующий респираторный папилломатоз (РРП) – время расплаты? Ларингоскоп Исследовательская отоларингология 2017; 2 .
5. Спенс Т., Брюс Дж., Ип К.В., Лю Ф.Ф. Связанный с ВПЧ рак головы и шеи. Раки 2016; 8 (8) .
6. Фридрих Г., Ремакл М., Бирчалл М., Мари Дж. П., Аренс К. Определение фонохирургии: предложение по классификации и номенклатуре Комитетом по фонохирургии Европейского ларингологического общества (ELS). Eur Arch Оториноларингол 2007; 264 : 1191-200.
Рецидивирующий респираторный папилломатоз: история болезни, патофизиология, этиология
Автор
Элоиза М. Харман, доктор медицины Штатный врач и директор отделения легких, Медицинский центр по делам ветеранов Гейнсвилля
Элоиза М. Харман, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж грудных врачей, American Medical Женская ассоциация, Американское торакальное общество, Phi Beta Kappa, Sigma Xi, The Scientific Research Honor Society
Раскрытие: нечего раскрывать.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу. для: Medscape.
Гарольд Л. Мэннинг, доктор медицины Профессор, кафедры медицины, анестезиологии и физиологии, отделение легочной медицины и реанимации, Дартмутская медицинская школа
Гарольд Л. Мэннинг, доктор медицины, является членом следующих медицинских обществ: Американский колледж грудных врачей , Американский колледж врачей, Американское торакальное общество
Раскрытие информации: нечего раскрывать.
Главный редактор
Заб Мосенифар, доктор медицины, FACP, FCCP Джери и Ричард Браверман, заведующий кафедрой легочной медицины и реанимации, профессор и исполнительный вице-председатель медицинского факультета, медицинский директор Института легких женской гильдии, Медицинский центр Сидарс-Синай, Калифорнийский университет, Лос-Анджелес, Медицинская школа Дэвида Геффена
Заб Мосенифар, доктор медицины, FACP, FCCP является членом следующих медицинских обществ: Американский колледж грудных врачей, Американский колледж врачей, Американская федерация медицинских исследований, Американское торакальное общество
Раскрытие информации : Ничего не раскрывать.
Дополнительные участники
Сат Шарма, доктор медицины, FRCPC Профессор и руководитель отделения легочной медицины, отделение внутренней медицины, медицинский факультет Университета Манитобы; Директор отделения респираторной медицины, больница общего профиля Св. Бонифация, Канада
Сат Шарма, доктор медицины, FRCPC является членом следующих медицинских обществ: Американской академии медицины сна, Американского колледжа грудных врачей, Американского колледжа врачей-Американского общества внутренних болезней. Медицина, Американское торакальное общество, Канадская медицинская ассоциация, Королевский колледж врачей и хирургов Канады, Королевское медицинское общество, Общество интенсивной терапии, Всемирная медицинская ассоциация
Раскрытие информации: не раскрывать.
Благодарности
Medscape Reference благодарит Виджая Рамакришнана, доктора медицины, доцента кафедры отоларингологии Медицинской школы Университета Колорадо за помощь с видео-вкладом в эту статью.
Институт голоса Шона Паркера
Что такое папиллома?
Папиллома – это бородавчатое разрастание гортани, обычно вызываемое вирусом папилломы человека (ВПЧ). Различные типы вирусов семейства ВПЧ вызывают аналогичные разрастания в других частях тела.Вирус папилломы обычно передается от человека к человеку при интимном контакте. Однако не у всех, кто вступает в контакт с вирусом, разовьется папиллома, и возможно, что некоторые люди переносят вирус невольно, не развивая рост, поэтому понимание передачи было затруднено. Рост очагов папилломы обычно представляет собой взаимодействие между вирусом и восприимчивостью иммунной системы данного человека. Использование голоса не влияет на образование папиллом.
Папиллома наиболее известна как болезнь маленьких детей, большинство из которых, по-видимому, инфицированы при прохождении через родовые пути (остроконечные кондиломы также вызываются ВПЧ). Однако это также может повлиять на взрослых. У взрослых он обычно менее агрессивен, чем у детей, что означает, что папилломы растут медленнее и с меньшей вероятностью вырастут за пределы гортани.
Подобно бородавкам, папилломы представляют собой очень стойкие образования, которые имеют тенденцию к отрастанию независимо от того, насколько полностью они удалены.По этой причине заболевание также называется рецидивирующим респираторным папилломатозом и рассматривается как хроническое неизлечимое заболевание с непредсказуемым течением.
Каковы симптомы папилломы?
Папиллома обычно вызывает безболезненную охриплость голоса, которая со временем ухудшается примерно пропорционально размеру и объему поражения. Если позволить ему бесконтрольно расти, он может заблокировать дыхательные пути и вызвать серьезные затруднения дыхания.
Как выглядит папиллома?
Папиллома имеет характерный точечный нарост, похожий на малину.Эти поверхностные неровности называются сосочками и дают название поражению.
Неровные точечные наросты по краям обеих голосовых складок на этом снимке – папилломы.
Папиллома – это поверхностное поражение, которое растет наружу от слизистой оболочки. По неизвестным причинам вирус папилломы человека, по-видимому, предпочитает слизистую голосовой складки, хотя поражения могут расти и действительно растут на окружающих поверхностях. У взрослых папиллома может ограничиваться одной областью голосовой складки и расти, имитируя внешний вид полипа, или может распространяться на всю поверхность одной или обеих складок.
В редких случаях, обычно при иммунном заболевании, папиллома может распространяться за пределы гортани, поражая ротовую полость, горло и легкие. Были сообщения о переходе папилломы в рак, но это крайне редкое событие.
Папиллома охватывает почти всю длину голосовой складки слева на изображении выше. Другая сторона не затронута.
Как лечится папиллома?
Не существует надежного лекарства от папилломы. Хирургия, которая остается основой лечения, используется для контроля болезни и симптомов, но следует ожидать повторного роста папиллом, независимо от того, насколько тщательным является иссечение.В некоторых случаях у взрослых, особенно если болезнь ограничена одним участком гортани, папиллома может исчезнуть после одного или нескольких хирургических вмешательств. Вероятно, это связано с тем, что собственная иммунная система человека обеспечивает эффективную защиту от рецидива.
Поскольку операция не излечивает папилломатоз, функциональные аспекты, такие как качество голоса, остаются актуальными в операционной. Часто агрессивная резекция, необратимо нарушающая голос, дает мало пользы. Большинство пациентов сталкиваются с несколькими процедурами, и оставлять небольшое количество болезни на месте, чтобы минимизировать шрам, часто является разумной практикой.Это особенно верно в отношении передней части голосовых связок, где операция на обеих сторонах может привести к образованию шрамов или паутины.
Объемная папиллома почти заполняет пространство между голосовыми складками. Если игнорировать, папиллома может вырасти настолько, что нарушит дыхание.
Если заболевание рецидивирует, решение о повторной операции принимается в зависимости от тяжести заболевания и нарушения голоса. У людей с широко распространенным заболеванием гортани, как правило, мало причин для повторной операции на каждом небольшом участке рецидива, если симптомы отсутствуют.Больному может быть трудно принять это, но более частые операции не влияют на общее течение болезни и могут без необходимости подвергать человека риску хирургического вмешательства и кумулятивному ущербу от рубца. Поскольку слизистая оболочка голосовой связки должна быть удалена в области папилломы, заживление часто приводит к нарушению вибрации голосовой связки (см. Нормальная функция голоса). Редко, когда обширные случаи заболевания могут быть прооперированы несколько раз, не вызывая необратимого изменения голоса.
В случаях, когда действительно требуется частая операция – а в исключительных случаях она может проводиться каждые два или три месяца – целесообразно рассмотреть возможность проведения исследовательской терапии. Из-за неприятного характера болезни существует множество альтернативных и экспериментальных методов лечения. В настоящее время в центре внимания медицины находится цидофовир – препарат, применяемый внутривенно против других вирусов. Идеальная дозировка и частота приема в настоящее время исследуются.Исследователи также изучают способы изменить иммунную систему, чтобы она могла лучше бороться с болезнью.
Центр информации, поддержки и защиты рецидивирующего респираторного папилломатоза – это обширная информация о папилломе, которая обновляется и обновляется его веб-мастером и взаимодействием его членов.
Папилломатоз гортани – Beverly Hills Voice
Вызванный вирусом папилломы человека (ВПЧ), папилломатоз гортани (также называемый рецидивирующим респираторным папилломатозом или RRP) представляет собой бородавчатое образование, расположенное на гортани.При отсутствии лечения папиллома будет продолжать расти и может повлиять на качество вашего голоса или даже потенциально заблокировать дыхательные пути.
Хотя в настоящее время нет лекарства от папилломатоза гортани, его можно контролировать с помощью хирургии и новых методов лечения. Как и бородавки, повторный рост встречается очень часто, но может навсегда исчезнуть после нескольких операций. Но поскольку операция не всегда является постоянной и не излечивает папилломатоз гортани, важно подумать обо всех различных последствиях, которые частые операции могут иметь для качества ваших голосовых связок.Доктор Барбу является экспертом в этом типе хирургии и обсудит с вами все возможные варианты, чтобы убедиться, что вы согласны с вашим решением.
Находясь в Гарварде, д-р Барбу был частью команды, которая впервые применила бевацизумаб (Авастин ™) у пациентов с рецидивирующим респираторным папилломатозом (RRP). План лечения, разработанный бывшим коллегой и наставником, доктором Стивеном Зейтелсом, показал положительный эффект при папилломатозе гортани уколами Авастина в голосовые связки. Узнать больше о Drs.Публикация Zeitels и Barbu здесь.
Использование этого инновационного метода лечения RRP привело к тому, что д-р Барбу стал приглашенным докладчиком по этой теме на национальном уровне в других учреждениях, таких как Johns Hopkins, и на международном уровне на Панъевропейской конференции голоса и других конференциях по исследованию вируса папилломы человека.
Выполнение в тот же день инъекций Авастина в офисе для лечения РРП – еще один пример того, как доктор Барбу привносит инновации Лиги плюща в Южную Калифорнию.
Неожиданная причина стридора
30-месячная девочка, поступившая в отделение неотложной помощи, с двухдневной историей одышки, кашля и «хрипов».
Пациентка родилась в срок после неосложненной беременности и родов. Ее рост и развитие были подходящими. Ее прививки были свежими. Примерно в 1 год у нее начались приступы хрипов.Была диагностирована стойкая астма средней степени тяжести, и было начато лечение флутиказоном и ингаляционным альбутеролом.
Ее текущее заболевание началось на две недели раньше, с постепенно ухудшающейся охриплостью, легкой ринореей и кашлем. Ее дыхание было шумным. Сообщений о случаях лихорадки или удушья не поступало. В остальном обзор систем был нормальным.
Был поставлен предположительный диагноз круп. Пациенту вводили рацемический распыленный адреналин и внутримышечно вводили дексаметазон.Когда ее симптомы не улучшились, назначали небулайзерный альбутерол безрезультатно. Больной госпитализирован.
При физикальном обследовании был выявлен ребенок с афебрильной формой нетоксичного вида, с хорошей перфузией и гидратированием. Однако ей потребовался 1 литр кислорода через носовую канюлю, чтобы поддерживать уровень насыщения кислородом выше 93%. Голос у нее был хриплый. У нее был двухфазный стридор и затрудненное дыхание. Ни ринореи, ни слюнотечения не было. Ее ротоглотка выглядела нормальной; гемангиом и зоба не было.Пульс на плечах был одинаковым на обеих руках. На качество стридора не повлияло сгибание шеи или принятие положения лежа. Поля легких были чистыми, за исключением передаваемых звуков. Других отклонений от нормы при физикальном обнаружении не было.
ЭТО ГРУППА?
Круп обычно проявляется стридором – обычно на вдохе – острого начала после инфекции верхних дыхательных путей (URI). Постепенное ухудшение симптомов, отсутствие каких-либо признаков URI, присутствие охриплости голоса и гипоксии, а также отсутствие реакции на традиционное лечение крупа предполагали альтернативный диагноз.Дальнейшие исследования были проведены для определения причины.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Тщательное всестороннее обследование иногда может указать на причину стридора у ребенка. Например, доликоцефальный череп у недоношенного младенца с проблемами вентиляции в анамнезе может указывать на сужение подсвязочного канала. Любые признаки гидроцефалии должны вызывать подозрение на уродство Арнольда-Киари, ведущее к стридору. Гемангиомы, особенно в «области бороды», могут указывать на гемангиому гортани.Зоб или любое другое образование шеи может указывать на загрудинное расширение, которое сдавливает дыхательные пути.
Сгибание шеи может усилить стридор, вызванный сосудистыми кольцами или стропами. Если аберрантная правая подключичная артерия сдавливает дыхательные пути, плечевые импульсы могут быть неравными. Стридор от ларингомаляции уменьшается, когда пациент принимает положение лежа. Слабый или ненормальный крик от рождения указывает либо на паралич голосовых связок, либо на паутину.
При внегрудной обструкции вибрационный звук стридора является инспираторным; при внутригрудной обструкции – выдох.Когда обструкция очевидна во время обеих фаз дыхания, обструкция может быть различной и может одновременно влиять как на внутригрудные, так и на внегрудные дыхательные пути. Если этого не произошло, возможно, препятствие стало критическим. 1
В таблице перечислены причины повторяющегося или постоянного стридора у детей. 2
КАКИЕ ИССЛЕДОВАНИЯ НЕОБХОДИМЫ НА ЭТОМ ЭТАПЕ?
Были сделаны рентгенограммы шеи пациента ( Рисунок 1 ).На пленках видна тень мягких тканей в области голосовых связок. Снимки грудной клетки показали нормальные результаты.
Вызывало беспокойство неровность мягких тканей голосовых связок. Возможно, это опухоль на голосовой связке или инородное тело, не являющееся рентгеноконтрастным. Получена консультация оториноларинголога, рекомендовано хирургическое вмешательство. Микроларингоскопия показала папилломоподобные поражения на голосовой связке, которые почти перекрывали дыхательные пути (, рис. 2, ). Поражения были иссечены хирургическим путем.Гистологическая картина соответствовала папилломатозу.
Ювенильный папилломатоз гортани
Эпидемиология. Ювенильный папилломатоз гортани, также известный как ювенильный респираторный папилломатоз или рецидивирующий респираторный папилломатоз, встречается относительно редко. Обычно для него характерны экзофитные поражения, похожие на бородавки, которые имеют тенденцию к поражению гортани. Расчетная заболеваемость составляет 4,3 случая на миллион; ориентировочная стоимость ухода в США колеблется от 40 до 123 миллионов долларов в год. 3,4
Этиология. Ювенильный папилломатоз гортани вызван вирусной инфекцией; Наиболее частым виновником является подтипы 6 и 11 вируса папилломы человека (ВПЧ) – подтипы, связанные с генитальными кондиломами. Есть веские доказательства того, что заболевание приобретается во время родов. Ретроспективные исследования показывают, что около 30% детей с ювенильным папилломатозом гортани в молодом возрасте рождаются от матерей с генитальными кондиломами на момент родов. 5 Дополнительные подтипы, такие как 16 и 18, были идентифицированы в ювенильных папилломах гортани и, как полагают, представляют большой риск злокачественной трансформации примерно в 2% случаев. 6
Наличие симптомов. Юношеский папилломатоз гортани обычно проявляется у маленьких детей, обычно в младенчестве. Охриплость голоса – частое начальное проявление. Стридор обычно возникает на более поздних стадиях заболевания при закупорке дыхательных путей.
Первоначально заболевание может быть ошибочно диагностировано как астма, круп или бронхит. 7 У большинства детей заболевание проявляется остро после вирусного URI, что может ввести врача в заблуждение.Если охриплость голоса сохраняется у детей более 6 недель или если острая обструкция дыхательных путей не поддается лечению рацемическим адреналином или бронходилататорами, необходимо тщательно продумать дифференциальный диагноз и назначить дальнейшее отоларингологическое обследование.
Диагностика. Диагноз «ювенильные папилломы гортани» должен быть подтвержден прямой ларингоскопией. Однако на рентгенограммах шеи поражения могут проявляться как тонкие изменения в мягких тканях – как в этом случае.
Терапия. Не существует окончательного метода лечения ювенильных папиллом гортани. Цель терапии – уменьшить обструкцию дыхательных путей и улучшить качество голоса. Наиболее распространенный метод лечения – иссечение очагов поражения с помощью микроларингеальной хирургии. Иссечение может выполняться различными способами, такими как микроларингеальный инструмент, лазер на диоксиде углерода, микродебридер или импульсный лазер на красителе.
Многие хирурги по-прежнему предпочитают микроларингеальную хирургию – самый старый метод, потому что здоровые ткани не повреждаются, что предотвращает образование рубцов и стойкую охриплость голоса.К недостаткам относится аспирация крови или фрагментов папилломатозной ткани в нижние дыхательные пути после операции. 3
В обзоре отоларингологов в 1995 г. рабочая группа по рецидивирующим респираторным папилломам сообщила, что 92% респондентов предпочли углекислый лазер для начального лечения; остальные 8% высказались за холодное иссечение. 4 Однако недавние исследования показали, что импульсный лазер на красителе полезен для минимизации бремени папиллом без образования рубцов; процедура короче и меньше сопутствующих заболеваний.Причем это можно сделать и в офисе. 8,9
Лечение рецидивирующих поражений. Папилломы имеют тенденцию повторяться, и повторные иссечения не редкость. Искоренить папилломавирус с поверхности слизистой оболочки очень сложно.
Примерно 10% пациентов с рецидивирующим респираторным папилломатозом нуждаются в адъювантной терапии. Такая терапия показана, когда рецидивы требуют хирургического вмешательства более 4 раз в год, когда быстрое возобновление роста папиллом нарушает дыхательные пути или когда имеется дистальное распространение. 10 Были опробованы многочисленные агенты, включая изотретиноин, альфа-интерферон, индол-3-карбинол, метотрексат, ацикловир и рибавирин. Ни один из них не получил широкого распространения из-за системной токсичности и дозирования.
Цидофовир обладает противовирусной активностью против ряда ДНК-вирусов, включая вирус простого герпеса и цитомегаловирус. 11 Внутриочаговые инъекции этого препарата в настоящее время рекомендуются пациентам с частыми рецидивами. Однако сообщения о канцерогенезе в исследованиях на животных ограничивают широкое использование цидофовира. 12
Трахеотомия показана, если поражения полностью перекрывают дыхательные пути или если дыхательные пути не могут быть защищены интубацией. В противном случае следует по возможности избегать трахеотомии, чтобы предотвратить распространение папиллом на остальные дыхательные пути.
Профилактика. Доступная в настоящее время профилактическая четырехвалентная вакцина против ВПЧ (6, 11, 16, 18) очень эффективна для предотвращения поражений шейки матки. Комбинированная эффективность против стойкой инфекции ВПЧ типов 6, 11, 16 и 18 составила 90% через тридцать месяцев после вакцинации. 13 Будет ли введение этой новой вакцины против ВПЧ девочкам и подросткам предотвратить или снизить заболеваемость ювенильным папилломатозом гортани, станет ясно после продолжительного периода использования.
Итоги
Педиатры и врачи скорой медицинской помощи должны учитывать широкий спектр детей со стридором, который не поддается традиционной терапии крупа. Гипоксия – признак обструкции дыхательных путей. Ювенильный папилломатоз гортани – редкое заболевание, требующее высокой подозрительности и своевременной консультации отоларинголога.*
Ссылки:
Ссылки:
1.
Brown MA, Morgan WJ, eds. Обследование ребенка с обструкцией дыхательных путей. В:
Учебник детской респираторной медицины.
Нью-Йорк: Мосби; 1999: 145-146.
2.
Лодка TF, Green TP. Хронические или повторяющиеся респираторные симптомы. В: Kliegman R, Nelson WF, Behrman RE, et al, eds.
Учебник по педиатрии Нельсона.
18 изд. Филадельфия: У. Б. Сондерс; 2007: 1758-1762.
3.
Бишай Д., Кашима Х., Шах К. Стоимость рецидивирующего респираторного папилломатоза с юношеским началом.
Arch Otolaryngol Head Neck Surg.
2000; 126: 935-939.
4.
Derkay CS. Рабочая группа по рецидивирующим респираторным папилломам: предварительный отчет.
Arch Otolaryngol Head Neck Surg.
1995; 121: 1386-1391.
5.
Аалтонен Л., Рихканен Х., Вахери А. Папиллома человека в гортани.
Ларингоскоп.
2002; 112: 700-707.
6.
Альтман К.В. Масса голосовых связок.
Otolaryngol Clin North Am.
2007; 40: 1091-1108.
7.
Derkay CS, Darrow DH. Рецидивирующие респираторные папилломы.
Ann Otol Rhinol Laryngol.
2006; 115: 1-11.
8.
Вальдес Т.А., Макмиллан К., Шапшай С.М. Новое лазерное лечение папилломы голосовых связок – импульсный краситель 585 нм.
Отоларингол Head Neck Surg.
2001; 124: 421-425.
9.
Koufman JA, Rees CJ, Frazier WD, et al. Лазерная хирургия гортани в офисе: обзор 443 случаев с использованием трех длин волн.
Отоларингол Head Neck Surg.
2007; 137: 146-151.
10.
Грин Дж.Э., Бауман Н.М., Смит Р.Дж. Патогенез и лечение рецидивирующего респираторного папилломатоза ювенильного происхождения.
Otolaryngol Clin North Am.
2000; 33: 187-207.
11.
De Clercq E. Терапевтический потенциал цидофовира (HPMPC, Vistide) для лечения инфекций, вызванных ДНК-вирусами (т.е. герпес-, папова-, покс- и аденовирусами).
Verh K Acad Geneeskd Belg.
1996; 58: 19-49.
12.
Деркай С; Многопрофильная рабочая группа по рецидивам респираторных папиллом. Цидофовир при рецидивирующем респираторном папилломатозе (РРП): переоценка рисков.
Int J Pediatr Otorhinolaryngol.

 Все эти факторы риска асфиксии следует иметь в виду при наблюдении за такими детьми. У взрослых приступы удушья не наблюдаются, и единственным симптомом, свидетельствующим о наличии объемного образования в области голосовой щели, является охриплость голоса.
Все эти факторы риска асфиксии следует иметь в виду при наблюдении за такими детьми. У взрослых приступы удушья не наблюдаются, и единственным симптомом, свидетельствующим о наличии объемного образования в области голосовой щели, является охриплость голоса.