Ученые нашли способ справиться с золотистым стафилококком
22.08.2019
Серьезные инфекции, вызванные бактериями вида золотистый стафилококк (S. aureus), часто сложно поддаются лечению из-за того, что возбудители оказываются устойчивыми к противомикробным препаратам. Но ученые из Медицинской школы Университета Северной Каролины нашли способ исправить ситуацию: они выяснили, как сделать эти опасные бактерии более восприимчивыми к действию распространенных антибиотиков.
Рассчитать стоимость леченияВ статье, опубликованной в научном издании Cell Chemical Biology, американские исследователи рассказали о своем недавнем открытии. Они обнаружили, что молекулы из семейства полисахаридов – рамнолипиды – могут в сотни раз усиливать действие аминогликозидных антибиотиков, таких как тобрамицин, против S. aureus, включая живучие штаммы, которые иными способами одолеть невозможно. По словам ученых, рамнолипиды видоизменяют мембраны клеток золотистого стафилококка, делая их более гибкими и податливыми, что облегчает проникновение в них антибиотика.
«Существует огромная потребность в новых – более эффективных – методах борьбы с бактериями, которые хорошо переносят лечение стандартными антибиотиками или развивают устойчивость к ним, – говорит главный автор исследования Брайан Конлон, доцент кафедры микробиологии и иммунологии Медицинской школы Университета Северной Каролины. – В поисках таких методов мы обнаружили, что изменение проницаемости клеточных мембран бактерий для лучшего поглощения ими аминогликозида является чрезвычайно эффективной стратегией в борьбе с золотистым стафилококком».
S. aureus считается самым опасным из всех распространенных стафилококков. Он может вызывать широкий спектр заболеваний, начиная с легких кожных инфекций до смертельно опасных состояний, таких как пневмония, менингит и сепсис. Этот вид бактерий входит в пятерку наиболее частых причин внутрибольничных инфекций, часто вызывая послеоперационные раневые инфекции. Порядка 30% населения мира являются постоянными носителями золотистого стафилококка, который может жить на кожных покровах и слизистых оболочках верхних дыхательных путей.
Порядка 30% населения мира являются постоянными носителями золотистого стафилококка, который может жить на кожных покровах и слизистых оболочках верхних дыхательных путей.
По данным американского Центра по контролю и профилактике заболеваний, в 2017 году S. aureus стал причиной почти 120 000 случаев серьезных инфекций кровотока в США, из которых 20 000 оказались смертельными.
Стандартные методы борьбы с большинством штаммов золотистого стафилококка оказываются неэффективными либо потому, что бактерии генетически приобрели устойчивость к определенным антибиотикам, либо потому, что они растут в организме особым образом, который изначально делает их менее уязвимыми. Например, S. aureus способен адаптировать свой метаболизм для выживания в зонах с низким содержанием кислорода – в тканях с гнойным воспалением или заполненных слизью легких у людей с муковисцидозом. В таких средах мембрана бактерий становится относительно непроницаемой для аминогликозидных антибиотиков, таких как тобрамицин.
Брайан Колнон и его коллеги, включая первого автора исследования Лорена Радлински, два года назад обнаружили, что рамнолипиды значительно усиливают действие тобрамицина против стандартных тест-штаммов золотистого стафилококка. Эти полисахариды представляют собой маленькие молекулы, продуцируемые бактериями вида Pseudomonas aeruginosa, известными как синегнойная палочка, и служат их естественным оружием в конкурентной борьбе с другими микроорганизмами в дикой природе. В высоких дозах они продырявливают клеточные мембраны бактерий-противников.
Тогда ученые выяснили, что рамнолипиды существенно увеличивают поглощение молекул тобрамицина, даже в низких дозах, в которых они не имеют собственного антибактериального действия. В новом исследовании они испытали комбинацию рамнолипида и тобрамицина против популяций S. aureus, с которыми в обычной клинической практике справиться не удается. Ученые обнаружили, что полисахариды усиливают действие тобрамицина против:
- бактерий S.
 aureus, растущих в областях с низким содержанием кислорода;
aureus, растущих в областях с низким содержанием кислорода; - метициллин-резистентных S. aureus, представляющих собой семейство опасных разновидностей золотистого стафилококка с генетически приобретенной устойчивостью к лекарственным препаратам;
- тобрамицин-резистентных штаммов S. aureus, выделенных у пациентов с муковисцидозом;
- устойчивых форм S. aureus, которые обычно имеют сниженную восприимчивость к антибиотикам, потому что растут очень медленно.
«Дозы тобрамицина, которые обычно мало или вовсе не влияют на эти популяции S. aureus, быстро убивают их в сочетании с рамнолипидами», – говорит доктор Радлински.
Ученые установили, что даже в низких дозировках рамнолипиды способны видоизменять мембрану бактерий золотистого стафилококка, делая ее намного более проницаемой для аминогликозидных антибиотиков. Каждый из препаратов этого семейства, которые они протестировали, включая тобрамицин, гентамицин, амикацин, неомицин и канамицин, демонстрировали повышенную эффективность. Более того, эксперименты показали, что эта стратегия, подразумевающая усиление их действия, работает не только с S. aureus, но и с некоторыми другими видами бактерий, в том числе Clostridium difficile, которая является основной причиной серьезных, часто фатальных диарейных заболеваний среди пожилых людей и пациентов в больницах.
Рамнолипиды бывают разных типов, и сейчас ученые надеются выяснить, существуют ли среди них оптимальный тип, который будет максимально эффективно бороться с другими бактериями, будучи мало или вовсе нетоксичным для человеческих клеток. Команда также планирует изучить другие виды молекул, являющиеся природным оружием одних бактерий против других, чтобы отыскать новые способы повысить эффективность существующих антибиотиков.
Запрос цены«Существует множество видов бактериального межвидового взаимодействия, которые потенциально могут влиять на действие наших антибиотиков, – говорит доктор Радлински. – Мы стремимся отыскать их с единственной целью – повысить эффективность современных препаратов и замедлить рост устойчивости к антибиотикам».
– Мы стремимся отыскать их с единственной целью – повысить эффективность современных препаратов и замедлить рост устойчивости к антибиотикам».
- 5
- 4
- 3
- 2
- 1
Сальмонелла (небрюшнотифозная)
Обзор
Бремя болезней пищевого происхождения весьма значительно: каждый год заболевает почти каждый десятый человек, что приводит к потере 33 миллионов лет здоровой жизни. Болезни пищевого происхождения могут быть тяжелыми, особенно у детей раннего возраста. Диарейные болезни — наиболее распространенные заболевания, вызванные нездоровой пищей. Ими ежегодно заболевает 550 миллионов человек, в том числе 220 миллионов детей младше 5 лет. Salmonella является одной из четырех основных причин диарейных болезней во всем мире.
Salmonella представляет собой род грамотрицательный бактерий, имеющих форму палочек, и относится к семейству энтеробактерий. На сегодняшний день в рамках двух видов — Salmonella bongori и Samonella enterica— выявлено более 2500 различных серотипов или «сероваров». Salmonella является повсеместно встречающейся и стойкой бактерией, которая может выживать в течение нескольких недель в сухой окружающей среде и нескольких месяцев в воде.
Хотя вызывать заболевание людей могут все серотипы, некоторые из них являются специфичными по хозяину и могут жить лишь в одном или нескольких видах животных: так, например, серотип Dublin Salmonella enterica живет в крупном рогатом скоте, а серотип Choleraesuis Salmonella enterica — в свиньях. Когда эти конкретные серотипы вызывают болезнь у человека, такая болезнь часто бывает инвазивной и может представлять угрозу для жизни.
Однако большинство серотипов присутствует в широком ряде носителей. Такие серотипы обычно вызывают гастроэнтерит, который часто протекает без осложнений и не требует лечения, но может протекать в тяжелой форме у детей, пожилых людей и пациентов с ослабленным иммунитетом. К этой группе относятся серотип Enteritidis Salmonella enterica и серотип Typhimurium Salmonella enterica
К этой группе относятся серотип Enteritidis Salmonella enterica и серотип Typhimurium Salmonella enterica
Болезнь
Сальмонеллез — это болезнь, вызываемая бактерией Salmonella. Для нее обычно характерны резкое повышение температуры, боль в области живота, диарея, тошнота и иногда рвота.
Симптомы болезни появляются через 6-72 часа (обычно через 12-36 часов) после поглощения Salmonella, и болезнь длится от 2 до 7 дней.
Симптомы сальмонеллеза протекают относительно легко, и в большинстве случаев пациенты выздоравливают без специального лечения. Однако в некоторых случаях, особенно у детей и пожилых пациентов, связанное с болезнью обезвоживание может становиться тяжелым и представлять угрозу для жизни.
Хотя крупные вспышки Salmonella обычно привлекают внимание СМИ, от 60 до 80% всех случаев заболевания сальмонеллезом не регистрируется в рамках известных вспышек болезни. Такие случаи заболевания классифицируются как спорадические или же вообще не диагностируются в этом качестве.
Источники и передача инфекции
- Бактерия Salmonella широко распространена среди домашних и диких животных, преимущественно среди животных, используемых в пищу, таких как домашняя птица, свиньи и крупный рогатый скот; а также среди домашних животных, включая кошек, собак, птиц и рептилий, таких как черепахи.
- Salmonella может проходить через всю пищевую цепь — от корма для животных, первичного производства и до дома или предприятий общественного питания.
- Люди заражаются сальмонеллезом, как правило, в результате потребления зараженных пищевых продуктов животного происхождения (в основном яиц, мяса, домашней птицы и молока), хотя к передаче инфекции могут быть причастны и другие пищевые продукты, включая зеленые овощи, загрязненные навозом.
- Может иметь место и передача инфекции от человека человеку фекально-оральным путем.

- Случаи заболевания людей происходят также при контактах с инфицированными животными, включая домашних животных. У инфицированных животных признаки болезни часто не проявляются.
Лечение
В тяжелых случаях заболевания лечение заключается в восполнении электролитов (для обеспечения поступления в организм электролитов, таких как ионы натрия, калия и хлора, выведенных с рвотой и диареей) и регидратации.
При легких случаях заболевания или заболевании средней тяжести у здоровых людей обычная терапия противомикробными препаратами не рекомендуется. Это связано с тем, что противомикробные препараты могут не уничтожить бактерию полностью и способствовать селекции устойчивых штаммов, что может впоследствии привести к тому, что лекарство станет неэффективным. .
Однако такие группы риска, как дети грудного возраста, пожилые люди и пациенты с ослабленным иммунитетом, могут нуждаться в лечении противомикробными препаратами. Противомикробные препараты обычно назначаются и в случаях, когда инфекция распространяется из кишечника на другие части организма.
В связи с глобальным усилением устойчивости к противомикробным препаратам необходимо регулярно пересматривать руководящие принципы лечения, принимая во внимание модель устойчивости бактерии с учетом данных местной системы эпиднадзора
Методы профилактики
Для профилактики требуются контрольные меры во всех звеньях пищевой цепи — от сельскохозяйственного производства до обработки, производства и приготовления пищевых продуктов как в коммерческих организациях, так и в домашних условиях.
Профилактические меры для защиты от Salmonella в домашних условиях схожи с мерами, принимаемыми для защиты от других бактериальных болезней пищевого происхождения (см. приведенные ниже «Рекомендации для лиц, занимающихся обработкой и приготовлением пищевых продуктов»).
Контакты между детьми грудного или раннего возраста и домашними животными (кошками, собаками, черепахами и т.
Национальные и региональные системы эпиднадзора за болезнями пищевого происхождения являются важными средствами для изучения и отслеживании ситуации с таким болезнями, а также для выявления сальмонеллеза и других кишечных инфекций на ранних стадиях и принятия ответных мер, что позволяет предотвращать дальнейшее распространение таких болезней.
Рекомендации для населения и лиц, совершающих поездки
Обеспечить безопасность во время поездок помогут следующие рекомендации:
- Обеспечить, чтобы пищевые продукты прошли надлежащую тепловую обработку и были все еще горячими при их подаче.
- Избегать употребления сырого молока и продуктов, приготовленных из сырого молока. Пить только пастеризованное или кипяченое молоко.
- Избегать употребления льда, если только он не был изготовлен из безопасной воды.
- При наличии сомнения в безопасности воды, прокипятить ее или, если это невозможно, продезинфицировать ее с помощью какого-либо надежного дезинфицирующего вещества медленного действия (обычно такие вещества можно приобрести в аптеках).
- Тщательно мыть руки и часто использовать мыло, особенно после контактов с домашними или сельскохозяйственными животными, а также после посещения туалета.
- Тщательно мыть фрукты и овощи, особенно при их потреблении в сыром виде. По возможности снимать кожуру с овощей и фруктов.
Рекомендации для лиц, занимающихся обработкой и приготовлением пищевых продуктов
ВОЗ сформулировала следующие рекомендации для лиц, занимающихся обработкой и приготовлением пищевых продуктов:
- Лицам, занимающимся обработкой и приготовлением пищевых продуктов как профессионально, так и в домашних условиях, следует проявлять бдительность при приготовлении пищи и соблюдать касающиеся приготовления пищи правила гигиены.
- Лица, профессионально занимающиеся обработкой и приготовлением пищевых продуктов, у которых наблюдается повышенная температура, диарея, рвота или заметные инфицированные повреждения кожи, должны незамедлительно сообщить об этом своему работодателю.

- Брошюра ВОЗ «Пять важнейших принципов безопасного питания» служит основой образовательных программ для подготовки лиц, занимающихся обработкой и приготовлением пищевых продуктов, и для просвещения потребителей. Эти принципы особенно важны для предотвращения пищевых отравлений. Указанные пять принципов заключаются в следующем:
Рекомендации для производителей фруктов, овощей и рыбы
Брошюры ВОЗ «Пять важнейших принципов выращивания более безопасных фруктов и овощей: укрепление здоровья посредством уменьшения микробного заражения» и «Пять важнейших принципов повышения безопасности продукции аквакультуры в целях охраны здоровья населения» знакомят сельскохозяйственных рабочих, в том числе мелких фермеров, выращивающих свежие фрукты, овощи и рыбу для себя, своих семей и для продажи на местных рынках, с ключевыми практическими методами для предотвращения заражения микробами.
Пять важнейших принципов выращивания более безопасных фруктов и овощей заключаются в следующем:
- Соблюдайте надлежащую личную гигиену.
- Защищайте поля от загрязнения фекалиями животных.
- Используйте обработанные фекалии.
- Оценивайте риски, которые представляют ирригационные воды, и управляйте такими рисками.
- Содержите собранный урожай и оборудование для его хранения в чистоте и сухости.
«Пять важнейших принципов повышения безопасности продукции аквакультуры в целях охраны здоровья населения»
- Соблюдайте надлежащую личную гигиену.
- Содержите пруд в чистоте.
- Следите за качеством воды.
- Следите за здоровьем рыбы.
- Используйте чистое оборудование и контейнеры для сбора рыбы.
Деятельность ВОЗ
В сотрудничестве с другими заинтересованными сторонами ВОЗ решительно отстаивает важную роль безопасности пищевых продуктов как одной из ключевых составляющих обеспечения доступа к безопасной и питательной диете. ВОЗ разрабатывает меры политики и рекомендации, охватывающие всю пищевую цепь от производства до потребления, опираясь при этом на разные виды экспертных знаний и опыта в самых разных областях.
ВОЗ работает над укреплением систем обеспечения безопасности пищевых продуктов во все более глобализованном мире. Установление международных стандартов безопасности пищевых продуктов, повышение качества эпидназдора за болезнями, просвещение потребителей и подготовка лиц, занимающихся обработкой и приготовлением пищевых продуктов, в области безопасного обращения с пищевыми продуктами входят в число важнейших способов предотвращения болезней пищевого происхождения.
ВОЗ укрепляет потенциал национальных и региональных лабораторий в области эпиднадзора за патогенами пищевого происхождения, такими как Campylobacter и Salmonella.
Кроме того, ВОЗ способствует комплексному эпиднадзору за устойчивостью патогенов, присутствующих в пищевой цепи, к противомикробным препаратам, собирая образцы у людей, животных и образцы пищевых продуктов и анализируя данные, полученные в разных секторах.
ВОЗ совместно с ФАО оказывает помощь государствам-членам, координируя международные усилия по раннему выявлению вспышек болезней пищевого происхождения и соответствующим ответным мерам через сеть национальных органов в государствах-членах.
Кроме того, ВОЗ осуществляет научную оценку, которая используется в качестве основы для разрабатываемых Комиссией ФАО/ВОЗ по Кодекс алиментариус международных стандартов, принципов и рекомендаций в отношении пищевых продуктов для профилактики болезней пищевого происхождения.
К вопросу о стафиллококках | Управление Роспотребнадзора по Карачаево-Черкесской республике
К вопросу о стафиллококках
В настоящее время во всем мире наблюдается активизация условно-патогенных (или оппортунистических, потенциально-патогенных) бактерий (УПМ, ППБ), которые являются нормальными обитателями тела здорового человека. Они могут вызывать самые различные инфекционные заболевания, в том числе гнойно-воспалительные (ГВЗ), являющиеся наиболее распространенными, при определенных условиях: при снижении защитных сил организма, в младенческом и старческом возрасте, при истощении, в послеоперационный период, в экстремальных ситуациях (нервный стресс, холод), после вирусных инфекций, снижающих иммунитет.
Среди большого количества условно-патогенных возбудителей лидируют кокки (бактерии круглой, или шаровидной, формы), к которым относятся и стафилококки. Стафилококки – уникальные микроорганизмы: они могут вызывать более 100 различных заболеваний, поражать любую ткань, любой орган, начиная от заболеваний кожи и подкожной клетчатки (фурункулы, карбункулы, маститы, послеоперационные раны), органов дыхания (пневмонии, бронхиты, ангины), воспаления желчных и мочевых путей, заболеваний пищеварительного тракта (гастроэнтероколиты) до тяжелейшего сепсиса (заражения крови), в том числе у новорожденных. Инфицирование стафилококками пищевых продуктов – частая причина пищевых отравлений.
Эти свойства обусловлены наличием у возбудителя большого комплекса факторов болезнетворности, позволяющим ему проникать в органы и ткани, закрепляться и размножаться там, вырабатывать вредные вещества, в том числе токсины, не разрушающиеся при воздействии температурного фактора, быть относительно устойчивым во внешней среде и активно размножаться в продуктах питания (кремовых изделиях, молочных продуктах, салатах).
При этом стафилококки могут вырабатывать устойчивость к противомикробным препаратам, которая нарастает и свидетельствует о постоянных изменениях биологических свойств возбудителя, что затрудняет лечение. Способность стафилококков образовывать биопленки позволяет не только противостоять воздействию лекарственных средств (установлено, что в биопленке бактерии в 1000 раз устойчивее к действию антибиотиков), но и прятаться от защитных сил организма человека.
Биопленка – это скопление микроорганизмов, – полезных или болезнетворных, – прикрепленных в виде многоклеточного слоя к какому-либо биологическому (или небиологическому) материалу, в том числе эпителию слизистой оболочки различных органов (полости носа, зева, кишечника и других). Биомасса пленки может быть различной, и чем больше ее толщина и протяженность, тем тяжелее протекает заболевание. Установлено, что с биопленками могут быть связаны хронические заболевания стафилококковыми инфекциями, а также бессимптомное носительство (без клинических проявлений) стафилококков. Кроме того, именно стафилококки выступают в роли инициаторов биопленочного процесса, подготавливая почву для других микробов и образуя с ними ассоциации возбудителей заболеваний.
Кроме того, именно стафилококки выступают в роли инициаторов биопленочного процесса, подготавливая почву для других микробов и образуя с ними ассоциации возбудителей заболеваний.
Актуальность проблемы стафилококковых инфекций определяется также ростом числа лиц с нарушением механизмов противомикробной защиты (снижением иммунитета).
Более 60% стафилококковых инфекций вызывает Staphylococcusaureus(золотистый стафилококк), но их возбудителями могут быть также S. epidermidis(эпидермальный стафилококк), S. saprophiticus(сапрофитный стафилококк) и некоторые другие виды. Стафилококки легко проникают в организм через мельчайшие повреждения кожи и слизистых оболочек воздушно-капельным путем (при разговоре, кашле, чихании), который имеет наименьшее значение при непосредственном контакте с носителем возбудителя (через поцелуи, например), через общие вещи – полотенца, предметы личной гигиены, игрушки, а также при употреблении пищевых продуктов, контаминированных (зараженных) возбудителем или оставшимся после гибели самого микроба термостойким токсином. Возможным фактором передачи S.aureusдетям при грудном вскармливании является женское молоко, если мать страдает маститом (воспалением грудной железы).
Главным резервуаром стафилококков являются кожные покровы человека и животных и их слизистые оболочки (носа, зева, кишечника), сообщающиеся с внешней средой. Особенно опасно носительство Staphylococcusaureusмедицинским персоналом лечебно-профилактических учреждений (ЛПУ). Ретроспективный анализ носительства золотистого стафилококка сотрудниками ЛПУ отражает сохраняющуюся высокую степень их пораженности этим возбудителем, которая составляет в среднем по Российской Федерации по разным данным от 1,4% до 3%.
Пораженность персонала родовспомогательных учреждений Staphylococcusaureusведет к обсеменению кожных покровов и пупочной культи новорожденных, т.к. по научным данным основная роль как источника инфекции принадлежит медицинскому персоналу, имеющему непосредственный контакт с детьми первых часов и дней жизни (через руки, пеленки, другие предметы).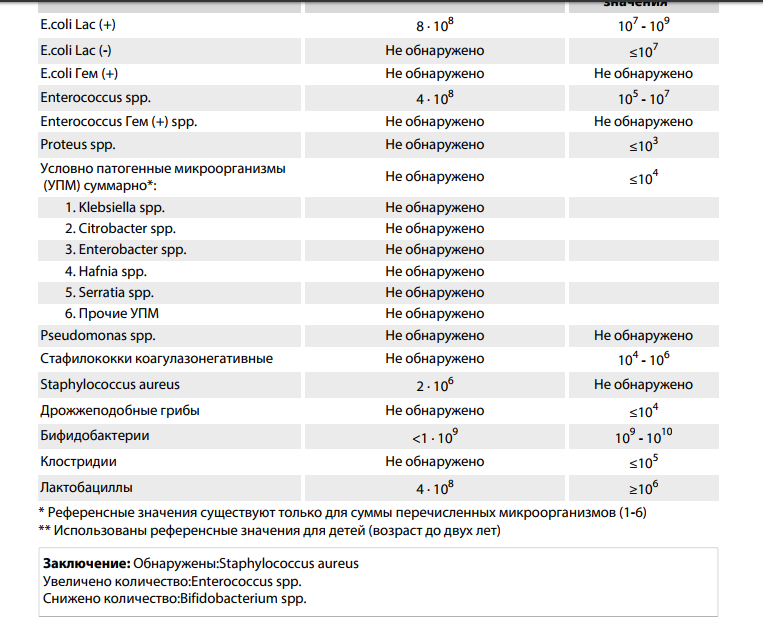
В стационарах могут формироваться резервуары устойчивых к антибиотикам микроорганизмов, в частности стафилококков, которые могут стать причиной возникновения внутрибольничных инфекций, особенно в сочетании с другими микроорганизмами (клебсиеллами, протеями). Возбудители могут попадать в организм больного человека при обсеменении ими рук персонала, предметов, соприкасающихся с раной, ручек дверей и холодильников, кранов умывальников, белья, полотенец при несоблюдении режима обеззараживания.
При микробиологических исследованиях по определению колонизации кишечника золотистым стафилококком наибольшая пораженность, по нашим данным, наблюдалась среди детей первого года жизни (около 70% от общего числа обследованных лиц этого возраста). При этом она сопровождалась высокой частотой встречаемости возбудителя на миндалинах и слизистой оболочке носа (до 75%). В других возрастных группах доля высевов с нарастанием возраста постепенно снижается, оставаясь высокой.
С целью лечения при стафилококковых инфекциях используют различные противомикробные средства: антибиотики, стафилококковый бактериофаг, препараты, приготовленные из продуктов жизнедеятельности микробов – антагонистов стафилококка, лекарственные растения.
При тестировании лабораторией ФБУЗ Центр гигиены и эпидемиологии в КЧР чувствительности выделенных культур Staphylococcusaureusк антибиотикам десяти групп высокую антистафилококковую активностьдемонстрировали линезолид, клиндамицин, офлоксацин, гентамицин, амикацин, рифампицин, линкомицин, цефуроксим, цефотаксим, ципрофлоксацин, оксациллин в то же время бензилпенициллин и ампициллин не сдерживали рост и размножение возбудителя, что подтверждает нецелесообразность их использования для лечения.
Чтобы предупредить распространение S.aureusи снизить заболеваемость стафилококковыми инфекциями, Министерством здравоохранения и социального развития Российской Федерации издан Приказ от 12.04.2011г № 302н, которым определены контингенты лиц, обязанных с 01. 01.2012г проходить обследование на носительство S.aureusперед поступлением на работу, а также в процессе трудовой деятельности.
01.2012г проходить обследование на носительство S.aureusперед поступлением на работу, а также в процессе трудовой деятельности.
Обязательное предварительное (до поступления на работу) исследование мазка из зева и носа на стафилококк должны проходить:
– работники организаций пищевой промышленности, баз и складов продовольственных товаров, имеющие контакт с пищевыми продуктами в процессе их производства, хранения, реализации, в том числе работы по санитарной обработке и ремонту инвентаря, обрудования, а также при транспортировке на всех видах транспорта, если имеется контакт с продуктами
– работники организаций общественного питания, торговли, буфетов, пищеблоков, в том числе на транспорте
– медицинский персонал лечебно-профилактических учреждений, включая родильные дома (отделения), детские больницы (отделения) и поликлиники, отделения патологии новорожденных, недоношенных.
Медицинские работники ЛПУ обязаны проходить также периодические медицинские обследования на носительство S.aureusс кратностью 1 раз в 6 месяцев.
В случае возникновения гнойно-воспалительного заболевания необходимо определить вид возбудителя, его количество, чувствительность к химиотерапевтическим препаратам обязательно до начала их применения. Это делается с целью целенаправленного и эффективного использования лекарственных средств.
Выполнить исследования по определению микрофлоры в любом отделяемом при воспалительных заболеваниях можно в лаборатории ФБУЗ Центр гигиены и эпидемиологии в Карачаево-Черкесской Республике (КЧР, г. Черкесск, проспект Ленина, 136.Телефон: (8782) 20-05-97) в рабочие дни с 8 часов утра до 14 часов дня (перерыв с 1200 до 1300). Лаборатория имеет лицензию на право работы с микроорганизмами и на медицинскую деятельность. Анализ проводят высококвалифицированные врачи-бактериологи, обладающие глубокими профессиональными знаниями и большим опытом практической работы, не раз подтверждавшие свою компетентность, правильно решая бактериологические задачи, присылаемые Центральным органом по аккредитации лабораторий, выполняющих санитарно-эпидемиологические исследования.
При этом используется новейшее оборудование, аттестованное и проходящее поверку, современные искусственные питательные среды, реактивы и тест-системы для выращивания микроорганизмов, определения их вида, чувствительности к антибиотикам, противогрибковым препаратам, бактериофагам обязательно осуществляется внутрилабораторный контроль условий проведения исследований, что обеспечивает достоверность получаемых результатов.
Учитывая необходимость доставки нативного материала на исследование в течение 2-х часов, чтобы не произошло изменений в составе микрофлоры отобранной пробы и результат был достоверен, для жителей Карачаево – Черкесии выполнение анализа на территории республики наиболее приемлемо.
Для более четкого понимания поставленной цели исследования желательно предоставить направление от врача лечебной сети, но и по желанию пациента (без направления) материал будет принят. Оплата выполненной работы производится после заключения договора в кассе учреждения, согласно прейскуранту цен на конкретный вид анализа.
Исследуемым материалом с целью обнаружения стафилококков могут быть: кровь, гной из фурункулов, абсцессов, ран слизь из зева и носа, плевральный и другие пунктаты, кал, отделяемого глаз, ушей, мокрота и другое. Как правило, материал из пораженного органа отбирает врач-специалист лечебной сети (поликлиники, стационара). Несмотря на то, что для посетителей на стенде вывешены подробные правила забора материала и выдаются напечатанные памятки, каждому заказчику их подробно объясняют в индивидуальном порядке. Повторим основные требования:
1. Материал на анализ доставляется до начала противомикробного лечения антибиотиками, нитрофурановыми и препаратами, бактериофагами и другими, подавляющими рост и размножение микроорганизмов. Возможно также проводить исследование через 3-5 дней по окончании приема лекарственных средств, если проводимое лечение оказалось неэффективным.
2. Не допускается забирать материал в посуду, обработанную в домашних условиях! Для сбора и доставки проб используют стерильные (т. е. не содержащие микрофлоры) стеклянные флаконы, полученные в лаборатории в лаборатории также выдаются емкости с питательной средой, если исследуемый материал необходимо внести в нее сразу. Сроки хранения лабораторной стерильной посуды ограничиваются 3-7 днями, поэтому лучше брать емкость накануне или в день отбора пробы. Можно приобрести стерильные одноразовые контейнеры с завинчивающейся крышкой в аптечной сети. Наличие в контейнере для отбора проб транспортной питательной среды удлиняет срок исследования и не позволяет выдать количественный результат.
е. не содержащие микрофлоры) стеклянные флаконы, полученные в лаборатории в лаборатории также выдаются емкости с питательной средой, если исследуемый материал необходимо внести в нее сразу. Сроки хранения лабораторной стерильной посуды ограничиваются 3-7 днями, поэтому лучше брать емкость накануне или в день отбора пробы. Можно приобрести стерильные одноразовые контейнеры с завинчивающейся крышкой в аптечной сети. Наличие в контейнере для отбора проб транспортной питательной среды удлиняет срок исследования и не позволяет выдать количественный результат.
3. Отобранная проба должна быть доставлена в лабораторию не позднее 2-х часов от момента сбора материала.
Особенности отбора материала в домашних условиях:
Мокрота. Забирается свободно отделяемая (отхаркиваемая) мокрота – обязателен утренний сбор. Перед сбором пробы необходимо почистить зубы, сполоснуть рот и горло теплой кипяченой водой. Не собирать слюну или носоглоточное отделяемое. Пробу мокроты, полученную в результате глубокого кашля, собирают в стерильный флакон с крышкой.
Моча. Достаточный объем пробы – 20-30 мл (около 2-х столовых ложек). Не допускается собирать мочу с белья или из мочеприемника. При естественном мочеиспускании используют среднюю утреннюю порцию или не ранее 4-х часов после последнего мочеиспускания. Перед сбором пробы необходимо тщательно обмыть наружные половые органы и область заднего прохода теплой кипяченой водой с мылом не допускается использовать дезинфектанты (раствор марганцовокислого калия, фурациллина и др.). Не допускается использовать пробу из суточной мочи.
Кал.Испражнения (кал) отбираются в день исследования из предварительно продезинфицированных (мытье с моющим средством, Белизной и др.), тщательно промытых, ополоснутых несколько раз кипятком и охлажденных до комнатной температуры судна или горшка в стерильный флакон при помощи стерильного шпателя-ложечки. При наличии в испражнениях слизи, крови, хлопьев, гноя их включают в отбираемую пробу. Если фекалии жидкие, то во флакон их отбирают в объеме, равном половине чайной ложки. Можно использовать чайную ложку, предварительно прокипяченную 30 минут. Если фекалии оформленные, плотные – помещают во флакон 1,5-2,0 г (кал размером с горошину из последней порции). Анализу не подлежит материал, собранный с белья.
При наличии в испражнениях слизи, крови, хлопьев, гноя их включают в отбираемую пробу. Если фекалии жидкие, то во флакон их отбирают в объеме, равном половине чайной ложки. Можно использовать чайную ложку, предварительно прокипяченную 30 минут. Если фекалии оформленные, плотные – помещают во флакон 1,5-2,0 г (кал размером с горошину из последней порции). Анализу не подлежит материал, собранный с белья.
Несмотря на актуальность проблемы, связанной с распространенностью и тяжестью стафилококковых инфекций, развитием во всем мире исследований по поиску средств, способных защитить от инфекции, вызываемой S.aureus, до настоящего времени нет профилактических коммерческих препаратов с доказанной эффективностью. Наряду с этим научными исследованиями доказано, что ранняя вакцинация противостафилококковыми препаратами предупреждает формирование биопленок.
Для терапии и создания искусственного иммунитета (защиты) против стафилококковой инфекции применяют стафилококковый анатоксин, который реализуется через аптечную сеть и вводится по определенной схеме после согласования с лечащим врачом. Профилактической иммунизации могут быть подвергнуты как отдельные лица, предрасположенные к частым заболеваниям стафилококковой этиологии, беременные женщины с целью снижения заболеваемости среди детей первых месяцев жизни, так и определенные контингенты людей, для которых эти заболевания приобретают характер профессиональных (например, работники транспорта). Иммунизация медицинских работников, которая раньше была обязательной для сотрудников родильных домов, могла бы послужить важным мероприятием по снижению заболеваемости стафилококковыми инфекциями среди детей раннего возраста и предупреждению внутрибольничных инфекций.
Врачи-бактериологи ФБУЗ Центр гигиены
и эпидемиологии в КЧР В.И.Арапова
Т.Д.Пилипенко
как подготовиться, какие анализы нужно сдавать и где это сделать?
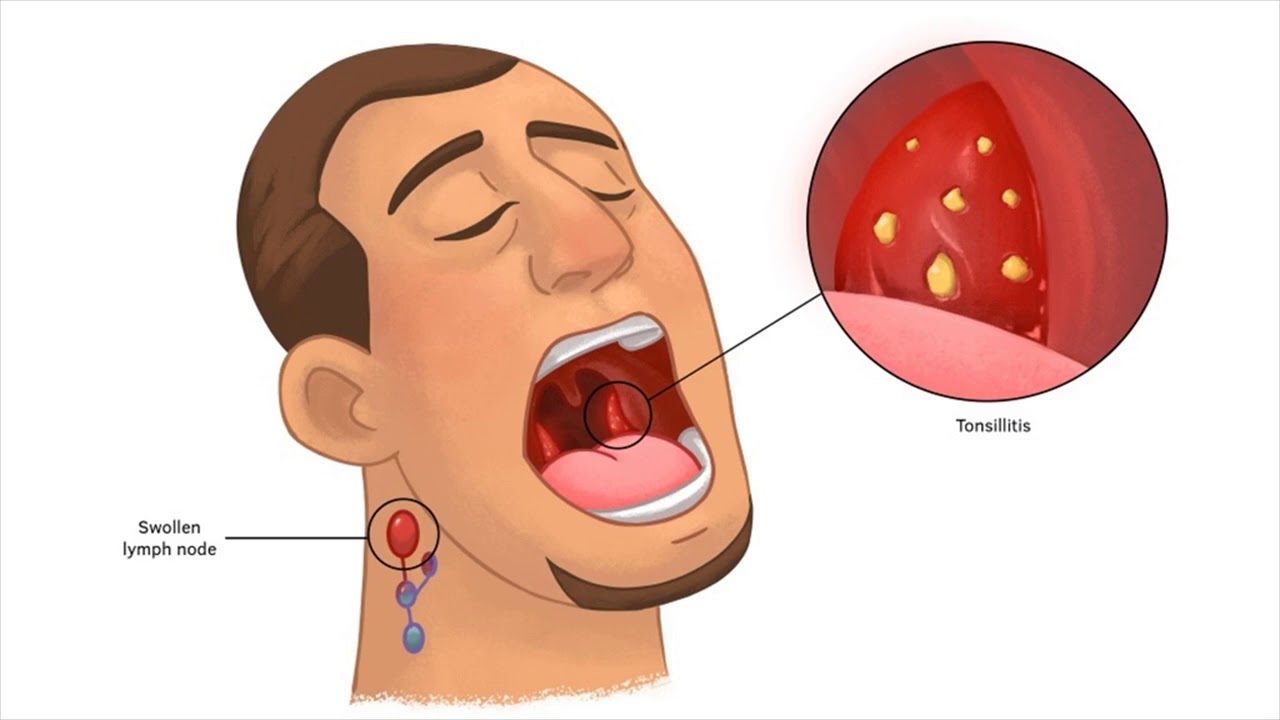
Знаете ли вы, что простуда или постоянные воспаления на коже могут оказаться следствием активности золотистого стафилококка — опасной и очень распространенной бактерии, которой можно заразиться где угодно? Чем грозит заражение стафилококком и как понять, что вам необходимо сдать пробу на этот микроорганизм? В статье мы расскажем о вариантах инфицирования и проведения анализа, а также дадим несколько советов по выбору клиники для исследования.
Типы анализов на выявление стафилококков
Стафилококковые бактерии имеют шарообразную форму, относятся к грамположительным, и насчитывается их около 30-ти видов. Некоторые представители рода присутствуют в организме, на слизистых и коже человека, не нанося вреда. Но золотистый, сапрофитный и эпидермальный стафилококки могут нанести серьезный удар по здоровью. В некоторых случаях бактерии вызывают воспалительные процессы. Действие опасных представителей стафилококков заключается в поражении организма токсинами, которые они вырабатывают в процессе жизнедеятельности, а также в снижении барьерной функции иммунитета.
Сапрофитный стафилококк локализуется в основном в мочевыводящих и половых органах, чаще у женщин, чем у мужчин, и может вызвать цистит. Эпидермальный стафилококк всегда живет на поверхности нашей кожи, но если при повреждении покровов он попадает в кровь, то при ослабленном иммунитете может вызвать ее заражение.
Самый опасный — золотистый стафилококк — может навредить абсолютно любым органам. Он одинаково легко поражает женщин и мужчин, пожилых и детей. В основном вызывает гнойные процессы на коже или во внутренних органах (мозг, сердце и др.), а также может стать причиной пищевого отравления, воспаления легких, менингита и других заболеваний. И самое страшное — золотистый стафилококк очень трудно победить, он не боится ни высоких температур, ни чистого спирта, резистентен ко многим антибиотикам и антисептикам. Несмотря на то, что бактерия давно и довольно подробно изучена, стопроцентно эффективного лечения пока не существует.
Заразиться золотистым стафилококком можно воздушно-капельным путем, через внешний контакт (пыль, поверхности вещей, одежда), через кровь, нестерильные медицинские инструменты. Спровоцировать патологическую активность стафилококков можно сильным переохлаждением организма, постоянным употреблением никотина и алкоголя, перманентными стрессами и недосыпом.
Кстати
«Подхватить» золотистый стафилококк можно, съев просроченный продукт. Особенно это касается молочных и кисломолочных изделий: творога, кефира, простокваши и даже ультрапастеризованного молока. Обязательно проверяйте сроки годности и, если они вышли, выбрасывайте продукт, даже если он не издает неприятного запаха, а вкус не изменился.
Особенно это касается молочных и кисломолочных изделий: творога, кефира, простокваши и даже ультрапастеризованного молока. Обязательно проверяйте сроки годности и, если они вышли, выбрасывайте продукт, даже если он не издает неприятного запаха, а вкус не изменился.
Поскольку стафилококк может локализоваться практически в любом отделе организма, только квалифицированный врач способен решить, какой именно биоматериал нужно сдать, чтобы подтвердить или опровергнуть наличие бактерии. Для анализа на стафилококк чаще всего берут мазок из носа, глотки или с других слизистых оболочек. Также сдают кровь, мочу или кал, грудное молоко.
Появление патологической активности стафилококков не бывает бессимптомным. Существует ряд признаков, которые могут указывать на наличие заражения. Если вы их заметили, необходимо срочно обратиться к врачу.
Когда следует сдавать анализы на выявление стафилококковой инфекции
Если человек замечает на коже высыпания, частые и, казалось бы, беспричинные воспаления сальных или потовых желез, волосяных фолликулов — это повод обратиться к специалистам. Постоянный насморк, который никак не удается вылечить, вечная заложенность носа или обильные выделения тоже могут свидетельствовать об активности стафилококков. Боль в горле, сухой или влажный кашель, повышение температуры тела — даже эти «привычные» симптомы могут быть вызваны стафилококком. Вероятность, конечно, не велика (около 5%), но сдать анализ будет не лишним.
Есть группы людей, которых вышеперечисленные симптомы обязывают пройти обследование на стафилококк. Дело в том, что они легче заражаются этими бактериями и им труднее от них избавиться. В группе риска люди, страдающие онкологическими заболеваниями, сахарным диабетом или ВИЧ, пациенты на гемодиализе. Здесь же те, кто часто получает травмы кожи (порезы, ожоги), работает в медицинских учреждениях или в сельском хозяйстве. Пожилые и новорожденные, кормящие матери и люди с ослабленным иммунитетом также входят в число тех, для кого повышен риск заражения стафилококком.
Анализ на стафилококк сдают не только носители симптомов. Его обязательно назначают беременным, чтобы исключить возможность внутриутробного заражения, госпитализированным пациентам в целях профилактики, сотрудникам общепита и медицинскому персоналу. Направление на анализ может дать терапевт или педиатр, ЛОР, инфекционист, уролог, маммолог, дерматолог и даже гастроэнтеролог. Если человек получил такое направление, то необходимо выполнить ряд предписаний, влияющих на степень достоверности результата.
Как подготовиться к исследованию
Перед сдачей анализа на золотистый стафилококк нельзя принимать антибиотики в течение двух месяцев. Если же пациент проходил курс лечения антибактериальными препаратами, нужно обязательно сообщить об этом врачу. То же касается и противовирусных лекарственных средств, если проводится анализ крови. Забор материала производится натощак, обычно утром. Перед посещением лаборатории лучше воздержаться от курения в течение нескольких часов.
Пациенту, сдающему на анализ мокроту из носа или зева, нужно выпить побольше жидкости за 10–12 часов до пробы. Так выделения станут менее густыми, и врачу легче будет взять материал. За восемь часов до анализа нельзя пить и есть, чистить зубы, поэтому обычно исследование назначают на утро.
За двое суток перед сдачей мочи пациенту нужно прекратить прием мочегонных средств, а за трое суток перед сдачей кала — отказаться от слабительных или иных препаратов, влияющих на работу кишечника (в том числе свечей и мазей). Если сдается мазок из половых органов, то мужчинам рекомендуется не посещать туалет за три часа до процедуры, а женщинам приходить на анализ перед менструацией или через два дня после ее окончания.
Как правильно сдать биоматериал на анализ
Если пациент собирает биоматериал самостоятельно, на нем лежит ответственность за правильность процедуры. Необходимо помнить, что кал или мочу нужно собирать в стерильную емкость, которую можно купить в любой аптеке. Не стоит стерилизовать тару в домашних условиях, это не дает стопроцентной гарантии чистоты.
Сбор материала в медицинском учреждении происходит следующим образом. Мазок со слизистой носа и ротоглотки берут небольшим ватным тампоном, процедура абсолютно безболезненная. Затем врач помещает пробу в специальную питательную среду, где бактерии, если они есть, будут стремительно размножаться. А вот забор крови может доставить несколько неприятные ощущения, потому что ее берут из вены.
Забор выделений из раны или какой-либо другой пораженной области производится тоже с помощью ватного тампона. Будет ли это болезненным, зависит от характера повреждения, но, как правило, врачу достаточно очень маленького количества биоматериала, поэтому боль терпимая.
Результаты анализа на стафилококк
Получить результат анализа крови или мазка можно уже по прошествии суток, кала или мочи — чуть позже. В последнем случае сроки зависят от особенностей работы медицинского учреждения (от полутора до трех дней).
Если результат отрицательный, значит, в организме человека нет бактерий золотистого стафилококка. Если же результат положительный, это значит, что человек либо болен, либо является носителем инфекции. И в том, и в другом случае необходимо пройти курс лечения, так как бактерия обязательно проявит агрессию и даст о себе знать неприятными проявлениями.
Не обладающий медицинскими знаниями человек не может самостоятельно определить факт заражения стафилококковой инфекцией. Никакие симптомы не могут однозначно указать на наличие бактерии в организме. Поэтому при частом возникновении заболеваний дыхательных путей, воспалений, в случае периодических отравлений лучше обратиться к специалистам и сдать анализ на золотистый стафилококк. Оперативное получение результата и своевременное лечение может избавить пациента от многих осложнений, некоторые из которых перетекают в хронические заболевания и почти не лечатся.
Импетиго | Сидарс-Синай
Не то, что вы ищете?Что такое импетиго?
Импетиго – инфекция внешний слой кожи. Чаще всего это вызвано бактериями Staphylococcus aureus или Streptococcus pyogenes. Импетиго гораздо чаще встречается у детей, но взрослые могут его получить. тоже. Это чаще встречается в летние месяцы.
Обычно ваша кожа покрыта миллионами бактерий.Многие из них безвредны, а некоторые могут быть полезны для вас. Но иногда на вашей коже могут расти вредные бактерии. Если они пройдут через внешний слой кожи (эпидермис), они могут начать расти еще больше. Это может вызвать импетиго.
Существует 3 вида импетиго:
- Небуллезное импетиго. Это самый распространенная форма у взрослых. Они образуют толстые корочки медового цвета.
- Буллезное импетиго. Это вызывает образование больших волдырей на коже.
- Ecthyma. Этот тип более серьезный форма, которая обычно возникает в результате невылеченного импетиго и вызывает язвенные язвы, которые выходят вниз в более глубокие слои кожи.
Некоторое импетиго вызывается бактериями, устойчивыми к метициллину Staphylococcus aureus (MRSA). Этот тип бактерий трудно убить. Этот тип импетиго трудно поддается лечению.
Что вызывает импетиго?
Импетиго вызывается бактериями. Наиболее распространенным является золотистый стафилококк, также известный как «стафилококк». Бактерии стрептококков также могут вызывать импетиго.
Многие люди имеют такие бактерии на их теле время от времени. У меньшего количества людей есть постоянные колонии этих вредных бактерий на коже. Это известно как колонизация бактерии.Эти бактерии могут расти внутри вашего носа, подмышек, горла, гениталий, рук, или в какой-то другой области. Когда эти бактерии находятся только на поверхности кожи, они обычно не вызвать проблемы или симптомы. Но небольшой разрыв на коже позволяет бактериям вызывать инфекция.
Кто подвержен риску импетиго?
Люди, у которых есть эти бактерии их кожа более подвержена импетиго.Вы также можете получить импетиго, если у вас порез. который был в контакте с кем-то колонизированным бактериями.
Эти риски выше у людей с:
- Атопический дерматит или экзема
- Диабет
- Проблемы с печенью
- ВИЧ / СПИД-инфекция
- Диализное лечение
- Внутривенное (внутривенное) употребление наркотиков
- Язвы на коже, например, от чесотки
У вас также может быть повышенный риск если вы живете или работаете в месте, где люди находятся в тесном контакте.Это включает в себя общежития, бараки или тюрьмы. Наличие члена семьи с импетиго также может увеличить ваш риск. Отказ от мытья рук после прикосновения к человеку с импетиго значительно увеличивает риск заражения.
Каковы симптомы импетиго?
Импетиго вызывает образование красных шишек на коже, часто на лице, руках или ногах. Затем эти шишки превращаются в волдыри.Эти волдыри лопаются и покрываются коркой, образуя желто-коричневую корку. Кожа также может выглядеть красноватые или сырые в местах вскрытия волдырей. Сыпь обычно начинается с одного пятно, но оно может распространиться на другие части тела при расчесывании. Сыпь может быть слегка болезненна на ощупь, а также может чесаться.
Если у вас буллезный тип импетиго, у вас могут быть более крупные волдыри, заполненные прозрачной жидкостью. Если у вас эктима, у вас могут быть более глубокие язвы с желтой коркой и фиолетовыми краями.
Как диагностируется импетиго?
Вам может поставить диагноз лечащий врач или дерматолог. Дерматолог – это врач, специализирующийся на кожных заболеваниях.
Ваш лечащий врач спросит о вашей истории болезни, симптомах и контактировали ли вы с кем-либо, кто импетиго.
Вам также предстоит пройти медицинский осмотр, включая тщательный осмотр вашей кожи.Ваш лечащий врач должен убедиться, что ваши симптомы не вызваны другими кожными проблемами, имеющими аналогичные симптомы. Он или она может взять образец гноя из одного из ваших пузырей, чтобы проверить наличие бактерий.
Как лечится импетиго?
Антибиотики – основное лечение для импетиго. Если у вас всего несколько пораженных участков, которые не проникают глубоко в кожу, вам могут дать крем или мазь с антибиотиком.Вы наносите этот антибиотик на пораженные участки кожи.
Если у вас более серьезная инфекция, вам, вероятно, потребуется перорально принять антибиотик. Ваш лечащий врач может выбрать антибиотик в зависимости от типа бактерий, вызвавших импетиго. Очень важно принимать антибиотики столько, сколько назначит врач, даже если инфекция пройдет раньше. В противном случае существует риск рецидива инфекции.
Ваш лечащий врач также может дать вам инструкции по очистке пораженных участков водой с мылом. раз в день.Вам также придется часто мыть руки. Это поможет избежать распространения инфекция другим. Вам также может потребоваться прикрыть пораженные участки тела. Это может помочь предотвратить распространение инфекции на другие части тела и другим людям.
Обычно инфекция проходит в течение недели или около того при правильном лечении. Лишь в редких случаях инфекция оставляет шрамы.
При повторных приступах импетиго, вашему врачу может потребоваться проверить вас на наличие проблемы с кожей, которая вызывает Вам сложно полноценно бороться с инфекцией.
Какие возможные осложнения импетиго?
Отсутствие лечения импетиго может привести к более глубокому инфицированию, особенно если оно вызвано стафилококком. Возможные осложнения включают:
- Более глубокая инфекция кожи (целлюлит)
- Инфекция лимфатической системы (лимфангит)
- Бактерии в кровотоке (бактериемия)
- Костная инфекция (остеомиелит)
- Инфекция суставов (септическая артрит)
- Септицемия (реакция всего организма на инфекция)
Им может потребоваться дополнительное лечение антибиотиками и другие виды медицинской помощи.
Редкие осложнения включают:
- Гломерулонефрит. Это воспаление фильтрующей части почек. Это может произойти после некоторых видов стрептококковых инфекций. Это может вызвать лишь незначительные проблемы. Но это может вызвать внезапная временная почечная недостаточность.
- Ревматическая лихорадка. Это также может быть вызвано инфекцией стрептококкового импетиго.Это заболевание может повлиять на сердце, суставы, кожа и мозг.
Что я могу сделать, чтобы предотвратить импетиго?
Часто импетиго распространяется при прямом контакте кожи с кожей. Вы можете предотвратить импетиго, предприняв определенные шаги. Например:
- Всегда мойте водой с мылом сразу после контакта с инфицированным человеком.
- Не передавайте личные вещи, такие как полотенца или гребни для волос.
- Постирать полотенца и постельное белье в горячей воде.
- Мойте руки после работы с салфетками, которые могут содержать микробы.
- Чихайте в сгиб руки, а не в ладони, чтобы предотвратить распространение микробов.
Когда мне следует позвонить своему врачу?
Позвоните своему врачу, если ваша инфекция не проходит. в течение недели после начала лечения или если ваше состояние ухудшается хуже.
Ключевые моменты импетиго
- Импетиго – инфекция наружного слой вашей кожи. Часто это вызвано бактериями стафилококка или стрептококка, которые проникают в травмированная кожа. Сыпь может покрыться волдырями, стать красной или желтой с твердой коркой.
- У вас может быть больший риск импетиго, если вы колонизированы определенными бактериями или если у вас есть определенные заболевания.
- Антибиотики являются основным средством лечения импетиго.Возможно, вам понадобится нанести крем на кожу. Или вам может потребоваться пероральный прием антибиотика.
- Отсутствие лечения импетиго может вызвать серьезные осложнения, например, более глубокую инфекцию.
- Мытье рук и другие меры могут помочь предотвратить возникновение или распространение импетиго.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от визита к врачу:
- Знайте причину вашего визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Возьмите с собой кого-нибудь, кто поможет вам задать вопросы и запомнить, что вам говорит поставщик.
- Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции, которые дает вам ваш провайдер.
- Узнайте, почему прописано новое лекарство или лечение и как они вам помогут.Также знайте, каковы побочные эффекты.
- Спросите, можно ли вылечить ваше состояние другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если вы не примете лекарство, не пройдете тест или процедуру.
- Если вам назначена повторная встреча, запишите дату, время и цель этого визита.
- Узнайте, как вы можете связаться с вашим поставщиком медицинских услуг, если у вас возникнут вопросы.
Роль Staphylococcus aureus у пациентов с хроническим синуситом и полипозом носа
Curr Allergy Asthma Rep. Автор рукописи; доступно в PMC 2019 30 апреля.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC64
NIHMSID: NIHMS1025048
Thad W. Vickery
1 Отделение хирургии головы и шеи Дэвида Геффа Медицина, Калифорнийский университет в Лос-Анджелесе, 10833 Le Conte Ave., CHS 62-132, Лос-Анджелес, CA
Виджей Р. Рамакришнан
2 Отделение отоларингологии – хирургия головы и шеи, Университет Колорадо, 12631 E 17th Ave., B205, Aurora, CO 80045, USA
Jeffrey D. Suh
1 Отделение хирургии головы и шеи, Медицинская школа Дэвида Геффена, Калифорнийский университет в Лос-Анджелесе, 10833 Le Conte Ave., CHS 62-132, Los Angeles, CA
1 Отделение хирургии головы и шеи, Медицинская школа Дэвида Геффена, Калифорнийский университет в Лос-Анджелесе, 10833 Le Conte Ave., CHS 62-132, Лос-Анджелес, CA
2 Отделение отоларингологии – хирургия головы и шеи, Университет Колорадо, 12631 E 17th Ave., B205, Aurora, CO 80045, USA
См. Другие статьи в PMC, цитирующие опубликованную статью.Abstract
Цель обзора
Staphylococcus aureus ( S. aureus ) коррелирует с развитием стойкого тяжелого воспалительного заболевания верхних дыхательных путей, включая хронический риносинусит с полипами носа (CRSwNP).Присутствие S. aureus связано с атопическим заболеванием, включая аллергический ринит и атопический дерматит, и связано с плохими результатами.
Недавние открытия
Несколько различных штаммов S. aureus генерируют различные токсины и генные продукты, которые могут определять патогенность организма. S. aureus бактерии и их антигены формируют микробиом бактерий и грибов и нишу слизистой оболочки, которая вызывает реакции хозяина, которые могут быть причиной воспаления.Фенотипы множественных заболеваний и молекулярные эндотипы, наблюдаемые в CRSwNP, могут быть охарактеризованы средой Т-хелперных клеток в воспалительной среде, наличием дисфункции эпителиального барьера, аберрантным метаболизмом эйкозаноидов, плохим заживлением ран и дисфункциональными взаимодействиями бактерий-хозяев, которые приводят к устойчивому заболеванию. и худшие хирургические результаты.
Резюме
Понимание патомеханизмов, которые S. aureus использует для стимулирования образования полипов носа, длительного воспаления тканей и бактериального дисбактериоза, имеет важное значение в наших усилиях по поиску новых терапевтических подходов для лечения этого хронического воспалительного процесса.
Ключевые слова: Хронический риносинусит, Носовые полипы, Staphylococcus aureus , Врожденная и адаптивная иммунная система, Суперантигены
Введение
Хронический риносинусит (ХРБ) продолжает оставаться широко распространенным и патологическим клиническим синдромом. полость носа и придаточные пазухи носа, что приводит к симптомам заложенности носа, ринореи, лицевой боли и аносмии. CRS обычно классифицируется по наличию или отсутствию носовых полипов при эндоскопии или визуализации в соответствии с последними рекомендациями AAO-HNS [1].CRS широко распространен с зарегистрированной распространенностью 4,5–12% в общей популяции, а подгруппа пациентов с полипозом носа, наблюдаемая в популяционных исследованиях, колеблется от 0,5–4,3%, причем более высокая распространенность наблюдается в западных странах, у пациентов мужского пола, пожилые люди и астматики [2] [3].
Несмотря на более высокую частоту полипоза у мужчин, женщины с СВК и полипозом носа (CRSwNP) имеют более тяжелые признаки заболевания, чем мужчины, включая более высокие показатели чувствительности к аспирину и сопутствующей астмы [4].Симптомы и клинические данные, которые определяют СВК, представляют собой общую конечную точку для нескольких отдельных патогенных процессов, которые в совокупности способствуют нарушению регуляции врожденного и адаптивного иммунного ответа, дисфункции эпителиального барьера и нарушениям во взаимодействиях хозяин-микроб. Понимание специфических для хозяина и факторов окружающей среды, которые предрасполагают людей к развитию СВК, включая роль Staphylococcus aureus в патогенезе CRSwNP, является активной областью исследований [5 ••].
Этиология СВК
Этиология СВК, как известно, многофакторна. Хотя как CRS без назальных полипов (CRSsNP), так и с назальными полипами (CRSwNP) характеризуются стойким воспалением, цитокиновый профиль воспалительной среды у пациентов с назальными полипами заметно отличается. Исторически считалось, что CRSsNP является результатом не полностью разрешенного острого бактериального синусита с воспалительным фенотипом, обогащенным полиморфными нейтрофилами, с высокими уровнями провоспалительных цитокинов (IL-1, IL-6, IFNγ и TNFα) и T H 1 искажение популяции Т-клеток.Напротив, CRSwNP классически связан с эозинофильным воспалением, типичным примером которого являются Т-клетки T H 2, с обильным содержанием IgE, гистамина, эозинофильного катионного белка (ECP) и воспалительных цитокинов типа II (IL-5, IL-13) [6– 8]. CRSwNP также связан с более высокой скоростью колонизации верхних дыхательных путей Staphylococcus aureus ( S. aureus ) и образованием биопленок, что коррелирует с более тяжелыми фенотипами заболевания [9, 10].
На практике CRSwNP представляет собой гетерогенную структуру со схожими фенотипами, имеющими разные профили иммунологических цитокинов и биомаркеров, которые варьируются в зависимости от географического положения выборки.Например, плодотворное исследование Zhang et al. наблюдаемые полипы из западных стран генерировали более высокие уровни цитокинов T H 2, эозинофилов и соответствующих факторов транскрипции по сравнению с полипами от пациентов из Юго-Восточной Азии, у которых были обнаружены нейтрофильные воспалительные сигнатуры с повышенным T H 1 / T H 17 и повышенный уровень миелопероксидазы [11]. Это было подтверждено в последующем исследовании, демонстрирующем более высокие уровни IL-1β, IL-6 и IL-8 и более низкие уровни IL-5 в полипах Юго-Восточной Азии [12].Многоцентровое исследование Wang et al. обнаружили, что более 50% пациентов с CRSwNP в Европе, Австралии и Японии демонстрировали преимущественно эозинофильный эндотип по сравнению с менее чем 30% пациентов в Юго-Восточной Азии, что измерялось по соотношению эозинофильный катионный белок / миелопероксидаза (ECP / MPO). Это же исследование показало, что уровни Staphylococcus aureus энтеротоксин-специфических IgE были значительно выше у пациентов с CRSwNP из Европы, Австралии и Японии и значительно ниже их количества в когортах Юго-Восточной Азии, что предполагает переменный эффект колонизации Staphylococcus в патогенезе носовые полипы [13 •].
Стафилококковая колонизация носа является обычным явлением примерно у 50% населения в целом с периодической носовой колонизацией Staphylococcus aureus [14]. Роль носовой колонизации S. aureus в патогенезе CRSwNP все еще выясняется. Распространенность колонизации sinus S. aureus полностью не изучена; однако у 64% пациентов с носовыми полипами наблюдается колонизация носовой полости S. aureus по сравнению только с 33% и 20% пациентов с ХРС без полипов и здоровыми людьми из контрольной группы соответственно [10].Пациенты, колонизированные специфическими патогенными штаммами S. aureus , по-видимому, сохраняют один и тот же штамм с течением времени вместо того, чтобы укрывать разные изоляты с течением времени, что свидетельствует либо о патогенной устойчивости к терапевтическому вмешательству, либо о существовании резервуара для реколонизации [15]. Было описано несколько уникальных факторов вирулентности и иммуномодулирующего действия S. aureus , которые остаются важными для принятых в настоящее время теорий о патогенезе СВК. Исторически считалось, что стафилококковая инфекция является возбудителем патогенеза СВК с рецидивирующими инфекциями, отобранными для все более вирулентных и устойчивых к антибиотикам штаммов S.aureus [16, 17]. Колонизация S. aureus все чаще рассматривается как модификатор заболевания, который способствует нарушению регуляции иммунитета, дисфункции барьера и бактериальному дисбиозу, ведущему к образованию биопленок и устойчивому заболеванию.
Стафилококковые токсины и CRS
Известно, что штаммы стафилококков продуцируют многие факторы вирулентности и энтеротоксины, способствующие воспалению, включая стафилококковые суперантигены. Эти белковые токсины являются мощными активаторами Т-клеток, которые связываются непосредственно с рецептором Т-клеток за пределами нативного антигенсвязывающего сайта и обходят главный комплекс гистосовместимости (MHC) антигенпрезентирующих клеток человеческого лейкоцитарного антигена (HLA) класса II.Этот прямой путь связывания приводит к чрезмерному и нескоординированному ответу Т-клеток с одновременной пролиферацией В-клеток, вызывающей локальную продукцию поликлональных IgE и, как следствие, активацию эозинофилов [18]. Известно, что массивная активация В-клеток суперантигенами усиливает выработку IL-4, Il-5 и Il-13, что приводит к продукции поликлонального IgE и высвобождению гистамина. IgE-антитела против стафилококковых суперантигенов часто выявляются и обогащаются у пациентов с CRSwNP, особенно в подгруппе пациентов с назальным полипозом с сопутствующей астмой, и было продемонстрировано, что они сохраняют эозинофильное воспаление T H 2 [19].Штаммы S. aureus , выделенные из среднего прохода, с большей вероятностью обладают вариантами дополнительных регуляторов гена (AGR), связанными с заболеванием, опосредованным энтеротоксином [20]. Метаболизм эйкозаноидов в ткани назального полипа регулируется наличием стафилококковых суперантигенов, которые оказывают сильное влияние на воспалительные фенотипы тканей. Например, суперантигены S. aureus снижают продукцию метаболитов арахидоновой кислоты, таких как простагландин E2 (PGE 2 ) и фермент циклооксигеназа 2 (COX-2), в эпителиальных клетках носа, культивируемых in vitro [21].И наоборот, более высокие уровни метаболитов липоксигеназного пути, таких как цис-лейкотриены, лейкотриен B4 и липоксин A4, в гомогенатах тканей носовых полипов с высокими уровнями антител IgE к стафилококковому энтеротоксину B (SEB). Эти сдвиги в метаболизме эйкозаноидов в ткани полипа с высоким уровнем SEB предполагают путь нарушения регуляции врожденного иммунитета, который может привести к стойкому воспалению [22]. В аналогичных экспериментах Patou et al. стимулированные тканевые супернатанты, полученные из образцов нижних носовых раковин от пациентов с СВК с СЭБ.В этих экспериментах они наблюдали значительное повышение ключевых провоспалительных цитокинов, включая IL1β, TNFα, IFNγ, IL-2, IL-4, IL-5, IL-10 и IL-13, что указывает на асимметрию типа 2. воспалительный фенотип в образцах CRSwNP. Часто наблюдаемый иммунный ответ типа 2 способствует дифференцировке иммунотолерантных макрофагов M2, которые демонстрируют сниженный фагоцитоз S. aureus и могут способствовать его сохранению в CRSwNP (23).
Врожденные и адаптивные иммунные ответы на S.aureus суперантигены, которые способствуют формированию полипов и фенотипам болезни в CRSwNP
, стафилококковый энтеротоксин B также регулирует Т-фолликулярные вспомогательные клетки в носовых полипах за счет увеличения количества IL-21 и IL-21-положительных Т-клеток в ткани хирургических пазух стимулировали SEB ex vivo [24]. Takeda и его коллеги продемонстрировали, что S. aureus – не единственные бактерии, которые стимулируют воспаление T H 2 в ткани полипа носа.Эта группа выделила клоны специфических моноклональных антител IgE, находящиеся в плазмобластах носовых полипов, и обнаружила специфические антитела против множества бактерий, включая S. aureus , Streptococcus pyogenes и Haemophilus influenzae . Это исследование также предоставляет доказательства того, что антитела IgE обладают большим количеством мутаций, что позволяет предположить, что соматическая гипермутация играет роль в генерации специфичных для бактериального штамма антител. Кроме того, наблюдаемый специфический для бактерий IgE, идентифицированный в назальных полипах, имеет несколько почти идентичных последовательностей гена VH с подтипами IgA и IgG, что позволяет предположить, что IgE фактически может быть получен в результате рекомбинации с переключением классов из антител IgA и IgG [25 •].Это наблюдение предполагает, что множественные пути способствуют выработке IgE и продукции антистафилококковых антител в ткани носового полипа. Более того, энтеротоксины – не единственный механизм, с помощью которого S. aureus проявляет свой эффект перекоса T H 2. Lan et al. продемонстрировали, что S. aureus также напрямую связывается с толл-подобным рецептором 2 (TLR-2) в отсутствие энтеротоксина, что приводит к увеличению продукции IL-5, IL-13, IL-33 и стромального лимфопоэтина тимуса (TSLP). ) в ткани полипа носа [26].
S. aureus Влияние на эпителий синусаРоды стафилококков, включая коагулазонегативные стафилококки, часто наблюдаются для колонизации верхних пищеварительных трактов у здоровых людей [27]. Специфические взаимодействия комменсальных бактерий и патогенных штаммов, таких как S. aureus , с поверхностью слизистой оболочки хозяина в патогенном состоянии, важно понимать, чтобы отличить патоген от постороннего человека. Исследования in vitro с использованием культивированных эпителиальных клеток пациентов с CRSwNP, подвергшихся воздействию S.В супернатантах aureus было обнаружено значительно большее количество внутриклеточных бактерий, чем у пациентов без полипов. Внутриклеточный S. aureus также продемонстрировал пролонгированную внутриклеточную выживаемость в качестве показателя в исследовании «персистентности» in vitro [28]. Взятые вместе, эти результаты предполагают уклонение от гомеостатических бактериальных сообществ и потенциальную локальную персистенцию патогенными родами, предполагая, что локальный внутриклеточный S. aureus является резервуаром для рецидива заболевания и / или сопротивляемости.Эти наблюдения нуждаются в дальнейшем изучении в контексте микробиома хозяина для дальнейшего определения целей лечения, включая лучшее выяснение полезности уничтожения S. aureus из носовых пазух и содействие гомеостазу за счет восстановления разнообразного микробного сообщества. Предыдущие исследования, разрабатывающие «гипотезу иммунного барьера», предположили, что грибы Alternaria и токсикогенные штаммы S. aureus способствуют разрушению иммунологического и механического барьера, способствуя нарушению мукоцилиарного клиренса, ведущему к бактериальной инвазии и деградации межклеточных белков плотного соединения [29].Совсем недавно Алтунбулаки и его коллеги продемонстрировали, что инфицирование здоровой нижней носовой раковины S. aureus усиливает экспрессию мРНК нескольких белков плотных контактов, включая клаудин, окклюдин, трицеллулин, ZO-3 и E-кадгерин, тогда как ткань из CRSwNP подвергается воздействию та же инфекция S. aureus не показала никаких изменений, а в некоторых случаях снизила уровни белков плотных контактов [30]. Это наблюдение, что стафилококковая инфекция может способствовать барьерной функции в гомеостазе здорового эпителия и дисфункции врожденного иммунитета у пациентов с CRSwNP, иллюстрирует потенциальную важность дисфункциональных взаимодействий между хозяином и микробом в нашем понимании CRS.Известно также, что заживление ран при CRSwNP нарушается. Недавнее исследование Valera et al. продемонстрировали, что S. aureus ингибирует заживление ран в первичных эпителиальных клетках, полученных от пациентов с CRSwNP. Это наблюдение характеризовалось пониженной организацией цитоскелета и более медленной ламеллиподной активностью при воздействии экзопродуктов S. aureus в культуральной среде. Этот эффект не наблюдался при введении ингибиторов Rho-ассоциированной киназы спиральной спирали (ROCK) и совместной инкубации с бактериями и культурами CRSwNP.Это предполагает, что S. aureus играет роль в плохом заживлении ран, наблюдаемом у пациентов с полипами [31 •].
Биопленки, ведущие к CRSwNP
Биопленки образуются, когда планктонные микробы организуются в трехмерные многослойные колонии, в которых они выделяют факторы вирулентности, делятся питательными веществами, уклоняются от защитных механизмов хозяина и способствуют физической и химической устойчивости к противомикробным препаратам [9]. Присутствие бактериальных биопленок в придаточных пазухах носа обычно наблюдается при СВК с зарегистрированной распространенностью 42–80% и еще более высокой распространенностью при СВЧНП [9, 32–35].Наиболее часто встречающиеся организмы в биопленках СВК – это S. aureus и Pseudomonas aeruginosa . Известно, что биопленки чаще встречаются у пациентов, перенесших ревизионную операцию на носовых пазухах, и поэтому считаются маркером стойкого и тяжелого заболевания [36, 32]. Форман и его коллеги продемонстрировали, что биопленок, связанных с S. aureus , связаны с эозинофильными маркерами воспаления, включая ECP и IL-5, что указывает на потенциальный механизм появления биопленок Staphylococcus в наблюдаемом перекосе T H 2, обнаруженном в CRSwNP [37].
Стафилококк и микробиомПомимо стафилококковых суперантигенов и биопленок, большой интерес представляет роль стафилококков в большом микробном сообществе. В связи с широким внедрением независимых от культуры методов исследования микробиома в состоянии здоровья и болезни, наличие S. aureus у пациентов с СВК считается модификатором заболевания, а не основным этиологическим агентом [38]. Все чаще биоразнообразие (измеряемое по насыщенности и равномерности) оценивается как маркер здоровья тканей верхних дыхательных путей.Используя мазки как от пациентов с СВК, так и от пациентов без СВК, Feazel et al. продемонстрировали, что повышенная относительная численность S. aureus коррелирует со снижением общего бактериального биоразнообразия. Это исследование также показало, что увеличение воздействия антибиотиков коррелирует с меньшим разнообразием, потенциально связывая два вывода, предполагая, что частое использование антибиотиков способствует устойчивому нарушению микробиома, что приводит к хронической колонизации S. aureus . Несколько исследований продемонстрировали, что общая бактериальная нагрузка у пациентов с СВК и без него одинакова, но пациенты с СВК демонстрируют распространение патогенных микробов, в частности S.aureus и анаэробы. Более того, CRSwNP – и особенно подгруппа этих пациентов с коморбидной астмой – имеют более высокую относительную численность – S. aureus [39–41]. Например, в исследовании Ramakrishnan et al., 22% здоровых субъектов демонстрируют колонизацию носовых пазух S. aureus по сравнению с 15% и 24% пациентов с CRSsNP и CRSwNP, соответственно. Интересно, что присутствие S. aureus у пациентов с СВК и астмой составило 21%, что свидетельствует об аналогичных показателях колонизации у пациентов с полипами носа и астмой.Эти исследования также демонстрируют, что повышенное относительное количество актинобактерий, в частности Propionibacterium acnes ( P. acnes ), неизменно связано со здоровым состоянием. Экспансия P. acnes в ткани придаточных пазух носа обратно коррелирует с S. aureus , причем более высокие уровни, как полагают, играют роль в поддержании здорового микробного сообщества, ограничивая распространение S. aureus за счет исключения патогенов.Недавнее исследование Chalermwatanachai и его коллег воспроизвело более ранние результаты, демонстрирующие распространение S. aureus у пациентов с CRSwNP, но также выявило повышенное количество Proteobacteria и H. influenzae . Эти авторы предполагают, что помимо S. aureus , эти Proteobacteria играют важную роль в установлении воспаления типа II, которое характерно для CRSwNP в западных странах [42].
Многие предполагают, что эти уникальные основные микробиомные сообщества, характерные для отдельных людей, могут колебаться по своему составу между здоровым, больным и послеоперационным состояниями.Недавнее долгосрочное исследование микробиома при СВК, проведенное Кутсурелакисом и его коллегами, демонстрирует, что ~ 25% таксонов придаточных пазух носа остаются стабильными с течением времени, включая S. aureus . Так называемые стабильно многочисленные виды присутствовали как в состоянии здоровья, так и в отношении болезней. Однако эти основные виды сопровождаются многочисленными таксонами с меньшей распространенностью, которые, как считается, изменяют динамику сообщества микробной ниши [43, 44]. Возможно, состав этих бактерий с низкой распространенностью важен для гомеостаза, и обилие Staphylococcus становится клинически очевидным в условиях частого приема стероидов, антибиотиков и хронического воспаления.
Варианты лечения
Местные интраназальные кортикостероиды продолжают оставаться основой лечения CRSwNP, и есть доказательства, подтверждающие, что они безопасны и эффективны для улучшения симптомов, уменьшения размера полипа и замедления рецидива полипа. Также известно, что местные стероидные спреи и стероидные полоскания носа более эффективны после эндоскопической хирургии носовых пазух [45–47]. При умеренных симптомах пероральные кортикостероиды также показаны для лечения CRSwNP, и в рандомизированных плацебо-контролируемых исследованиях было показано уменьшение назальных симптомов и уменьшение размера полипов при приеме в умеренных дозах [48]. S. aureus , как известно, трудно искоренить из придаточных пазух носа, и не было доказано, что внутривенные антибиотики помогают для этой цели. Несмотря на это, появился значительный интерес к противомикробным и противовоспалительным / иммуномодулирующим эффектам терапии доксициклином в качестве лечения полипов носа. Ван Зеле и его коллеги провели рандомизированное, двойное слепое и плацебо-контролируемое исследование, в котором сравнивали использование перорального метилпреднизона и доксициклина у 47 пациентов с CRSwNP, наблюдавшихся в течение 12 недель.Это исследование показало, что оба лечения были эффективны в уменьшении размера полипов, причем эффект длился немного дольше в группе, получавшей доксициклин, по сравнению с метилпреднизоном (12 недель против 8). Хотя в этом исследовании не рассматривалось влияние доксициклина на колонизацию S. aureus , они все же количественно оценили воспалительные медиаторы Th3 в носовых секретах этих пациентов и обнаружили более низкие уровни ECP, IL-5 и IgE в носовых секретах пациенты, получавшие метилпреднизон, в то время как когорта, получавшая доксициклин, продемонстрировали снижение уровней ECP, миелопероксидазы и матриксной металлопротеиназы 9 (MMP-9) [49].Матричные металлопротеиназы представляют собой ферменты цинк-металлопротеиназы, которые разрушают внеклеточный матрикс, в котором может быть повышено количество CRSwNP, и предполагается, что они вызывают чрезмерное воспаление и отек, способствующие образованию полипов [50]. Исследования in vitro продемонстрировали, что доксициклин регулирует действие трансформирующего фактора роста бета-1 (TGFβ-1) в тканях носовых полипов, включая регуляцию ММП. В фибробластах назальных полипов, предварительно обработанных TGFβ-1, первоначально повышенная экспрессия MMP-2 оказалась ниже при лечении доксициклином [51].В аналогичных исследованиях с использованием фибробластов пациентов с назальным полипом, предварительно стимулированных TGFβ-1 и подвергшихся воздействию доксициклина, были выявлены более низкие уровни α-актина гладких мышц (SMA) и фибронектина, измеренные по экспрессии белков и генов. Кроме того, лечение доксициклином снижает общую экспрессию коллагена. Взятые вместе, эти данные подтверждают гипотезу о том, что даже если доксициклин не полностью устраняет колонизацию S. aureus , он, вероятно, играет роль в модуляции дифференцировки фибробластов и продукции внеклеточного матрикса в ткани носового полипа [52].
Усилия по лечению СВК с использованием других противостационарных агентов включают исследования более целенаправленных местных антибиотиков, таких как мупироцин. Было проведено несколько систематических обзоров для определения эффективности местного лечения СВК без носовых полипов, но аналогичные исследования для CRSwNP отсутствуют [53]. Множественные рандомизированные контрольные испытания были проведены для изучения местных полосканий антибиотиками для лечения СВК, но не специально для носовых полипов. Одно исследование стойких S. aureus положительных CRS продемонстрировало, что пациенты, получавшие в течение 1 месяца полоскания носа большим объемом мупироцина, имели меньше шансов иметь Staph-положительные культуры по сравнению с контрольной группой в конце периода лечения.Это исследование также продемонстрировало краткосрочное улучшение оценки тяжести симптомов [54]. Кроме того, было показано, что полоскания мупироцином эффективны при лечении метициллин-резистентных S. aureus (MRSA), обнаруженных во время вспышек СВК [55]. Эти эффекты, вероятно, непостоянны, но могут использоваться в алгоритме лечения острых инфекционных обострений в качестве альтернативы пероральным антибиотикам.
С повсеместной доступностью таргетной терапии антителами для конкретных иммунных мишеней возникает новый интерес к роли биопрепаратов в лечении СВК.В текущих исследованиях терапевтических средств с использованием моноклональных антител используются образцы небольшого размера, а конкретные рекомендации по выбору агента на основе эндотипа отсутствуют. Однако ранние исследования моноклональных антител против модуляторов воспаления T H 2 показывают многообещающие в снижении воспалительных фенотипов, улучшении контроля симптомов и снижении стероидной нагрузки. Последние данные об использовании моноклональных антител для лечения CRSwNP, включая анти-IgE (омализумаб), IL-4 (дупилумаб) и IL-5 (реслизумаб и меполизумаб), обобщены в обзоре Lane и Halderman [56 •].Недавние данные также показали способность моноклональных антител снижать потребность в хирургическом вмешательстве у пациентов с тяжелым рецидивирующим CRSwNP. Недавнее рандомизированное плацебо-контролируемое исследование 105 пациентов, проведенное группой Bachert, продемонстрировало, что пациенты с тяжелым CRSwNP, получавшие меполизумаб, больше не нуждались в хирургическом вмешательстве, что измерялось по визуально-аналоговой шкале тяжести назального полипоза (ВАШ) после 4 недель лечения [57]. Эти исследования не включали данные о культуре для количественной оценки воздействия иммунотерапевтического лечения на S.каретка aureus . Однако эти ранние данные, демонстрирующие улучшение тяжести заболевания при иммунотерапии, отражают природу CRSwNP как воспалительного заболевания, характеризующегося иммунной дисрегуляцией, при котором S. aureus служит важным модификатором заболевания вместо этиологического агента.
Роль хирургии
Эндоскопическая хирургия придаточных пазух носа остается важным методом лечения для восстановления проходимости и аэрации носовых пазух, а также для повышения эффективности местного лечения эпителия носа.Хирургия чаще выполняется при CRSwNP, чем при CRSsNP. Это может быть связано с неблагоприятным обстоятельством рецидива заболевания с течением времени при CRSwNP или из-за наблюдения значительного улучшения качества жизни при хирургическом вмешательстве по поводу CRSwNP. Примерно 30% всех операций на носовых пазухах выполняется по поводу CRSwNP. Эти операции обычно более длительные, обширные и с большей вероятностью используют визуализацию, чем операции по поводу неполипного CRS [58]. Отчетность о первичных результатах хирургического вмешательства на носовых пазухах варьируется и зависит от носовой эндоскопии, рентгенографических данных или инструментов для определения симптомов, таких как исследование SNOT-22.Недавний систематический обзор Le et al. рассмотрели 3048 пациентов с CRSwNP из 15 статей. В этом метаанализе оценки пациентов по SNOT-22 значительно улучшились в среднем на 23 балла, причем наибольшее улучшение наблюдалось у пациентов старшего возраста, более высокого предоперационного SNOT-22, предшествующей операции на носовых пазухах и астмы [59]. О частоте рецидивов СВК сообщалось в большом ретроспективном когортном исследовании 61 000 пациентов, которое показало, что частота повторных пересмотров ESS составляет 6,65%. В этом же исследовании использовалось многомерное регрессионное моделирование для выявления пациентов с CRSwNP как имеющих более высокий риск ревизионной операции [60].Влияние S. aureus на эффективность ESS детально не изучалось, но вариации носового микробиома могут повлиять на исход хирургии носовых пазух [61]. Исследовательские исследования показывают, что повышенное биоразнообразие (измеряемое по богатству, равномерности и сложности) предвещает лучшие результаты для пациентов, проходящих ESS. Проводимые в настоящее время исследования влияния микробиома на результаты хирургического вмешательства не обладают достаточной мощностью, чтобы понять точную роль распространения стафилококков в микробиоме на результаты хирургического вмешательства [41].
Обсуждение / заключение
S. aureus остается важным бактериологическим подозреваемым в патогенезе CRSwNP. S. aureus , как известно, регулирует как врожденный, так и адаптивный иммунитет, способствуя воспалению типа II, нарушая функцию тканевого барьера, способствуя нарушению мукоцилиарного клиренса и стимулируя образование полипов. Несмотря на высокую распространенность S. aureus в CRSwNP, не все пациенты с полипами колонизированы токсиногенными штаммами Staphylococcus , и, следовательно, его вклад суперантигена и дисфункции барьера в CRSwNP является неполным.Остается много вопросов о точном значении S. aureus в микробиоме носа, поскольку он связан с тяжелым устойчивым заболеванием, которое часто наблюдается при полипах носа. Отсутствие эффекта от антистафилококковых терапевтических средств предполагает, что искоренение S. aureus не может быть основной целью лечения CRSwNP.
Хотя теперь мы понимаем воспалительную природу CRSwNP, все же большую роль могут играть стафилококковые суперинфекции во время обострений.Возможно, присутствие S. aureus в CRSwNP верхних дыхательных путей способствует более значительному эозинофильному состоянию с хроническим аллергическим и астматическим заболеванием, представляющим собой континуум объединенных верхних и нижних дыхательных путей. Необходимы дальнейшие усилия, чтобы понять особую роль S. aureus как иммуномодулятора, члена бактериального сообщества и модификатора заболевания для CRSwNP, чтобы понять его потенциал в качестве терапевтической мишени, снизить периоперационную нагрузку антибиотиками и понять специфические качества, которые способствуют микробному гомеостазу в носовых пазухах.
Благодарности
Сведения о финансировании Эта работа была поддержана Национальным институтом глухоты и других коммуникативных расстройств (NIDCD), одним из Национальных институтов здравоохранения, Бетезда, Мэриленд, США, в рамках грантов K23DC014747 и T32DC012280. Эта финансирующая организация не участвовала в разработке или проведении этого исследования: подготовке, рассмотрении, утверждении или решении представить эту рукопись для публикации.
Сноски
Конфликт интересов Авторы заявляют об отсутствии конфликта интересов.
Права человека и животных и осознанное согласие Эта статья не содержит исследований с участием людей или животных, выполненных кем-либо из авторов.
Примечание издателя Springer Nature сохраняет нейтралитет в отношении юрисдикционных претензий на опубликованных картах и принадлежностей организаций.
Ссылки
Недавно опубликованные статьи, представляющие особый интерес, были отмечены как:
• Важные
•• Важные
1.Розенфельд Р.М., Пичкирилло Дж. Ф., Чандрасекхар С. С., Брук I, Ашок Кумар К., Крампер М. и др. Руководство по клинической практике (обновленное): резюме синусита у взрослых. Otolaryngol Head Neck Surg. 2015; 152: 598–609. [PubMed] [Google Scholar] 2. Фоккенс WJ и другие. Европейский позиционный документ по риносинуситу и полипам носа, 2012 г. Rhinol Suppl. 2012; 3. Предыдущее оглавление – 1–298 [PubMed] [Google Scholar] 3. ДеКонд А.С., Солер З.М. Хронический риносинусит: эпидемиология и бремя болезни. Am J Rhinol Allergy.2016; 30: 134–9. [PubMed] [Google Scholar] 4. Стивенс У.В., Петерс А.Т., Су Л., Нортон Дж. Э., Керн Р. К., Конли Д. Б. и др. Ретроспективное поперечное исследование показывает, что женщины с CRSwNP имеют более тяжелое заболевание, чем мужчины. Immun Inflamm Dis. 2015; 3: 14–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. ••. Derycke L, Perez-Novo C, Van Crombruggen K, Corriveau M-N, Bachert C. Staphylococcus aureus и хроническое заболевание дыхательных путей. World Allergy Organ J. 2010; 3: 223–8 [Бесплатная статья PMC] [PubMed] [Google Scholar]Всесторонний обзор роли S.aureus . при заболеваниях верхних дыхательных путей 6. Ван Зеле Т. и др. Дифференциация хронических заболеваний носовых пазух путем измерения медиаторов воспаления. Аллергия. 2006; 61: 1280–9. [PubMed] [Google Scholar] 8. Форман А., Холтаппельс Дж., Псалтис А. Дж., Джервис-Барди Дж., Филд Дж., Вормальд П. Дж. И др. Адаптивные иммунные ответы при хроническом риносинусите, ассоциированном с биопленкой Staphylococcus aureus. Аллергия. 2011; 66: 1449–56. [PubMed] [Google Scholar] 9. Suh JD, Ramakrishnan V, Palmer JN. Биопленки. Отоларингол Clin N Am. 2010; 43: 521–30 viii.[PubMed] [Google Scholar] 10. van Zele T., Gevaert P, Watelet JB, Claeys G, Holtappels G, Claeys C и др. Колонизация золотистого стафилококка и образование IgE-антител к энтеротоксинам увеличивается при полипозе носа. J Allergy Clin Immunol. 2004; 114: 981–3. [PubMed] [Google Scholar] 11. Zhang N, van Zele T., Perez-Novo C., van Bruaene N, Holtappels G, DeRuyck N, et al. Различные типы Т-эффекторных клеток организуют воспаление слизистой оболочки при хроническом заболевании носовых пазух. J Allergy Clin Immunol. 2008. 122: 961–8.[PubMed] [Google Scholar] 12. Ba L, Zhang N, Meng J, Zhang J, Lin P, Zhou P и др. Связь между бактериальной колонизацией и воспалительным паттерном у пациентов с китайским хроническим риносинуситом и полипами носа. Аллергия. 2011; 66: 1296–303. [PubMed] [Google Scholar] 13. •. Ван X и др. Разнообразие профилей цитокинов TH у пациентов с хроническим риносинуситом: многоцентровое исследование в Европе, Азии и Океании. J Allergy Clin Immunol. 2016; 138: 1344–53. [PubMed] [Google Scholar]
Многоцентровое исследование, изучающее географические вариации профилей воспалительных цитокинов при СВК.14. Франк Д. Н., Физел Л. М., Бессезен М. Т., Прайс К. С., Янофф Е. Н., Пейс Н. Р.. Микробиота носа человека и носительство золотистого стафилококка. PLoS One. 2010; 5: e10598. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Drilling A, Coombs GW, Tan HL, Pearson JC, Boase S, Psaltis A и др. Двоюродные братья, братья и сестры или копии: геномика рецидивирующих инфекций Staphylococcus aureus при хроническом риносинусите. Int Forum Allergy Rhinol. 2014; 4: 953–60. [PubMed] [Google Scholar] 17. Manarey CRA, Anand VK, Huang C. Заболеваемость метициллин-резистентным золотистым стафилококком, вызывающим хронический риносинусит.Ларингоскоп. 2004. 114: 939–41. [PubMed] [Google Scholar] 18. Шуберт MS. Суперантигенная гипотеза патогенеза хронического гипертрофического риносинусита, аллергического грибкового синусита и родственных заболеваний. Ann Allergy Asthma Immunol. 2001; 87: 181–8. [PubMed] [Google Scholar] 19. Zhang N, Gevaert P, van Zele T., Perez-Novo C, Patou J, Holtappels G и др. Обновленная информация о влиянии энтеротоксинов Staphylococcus aureus при хроническом синусите с полипозом носа. Ринология. 2005; 43: 162–8. [PubMed] [Google Scholar] 20.van Zele T, Vaneechoutte M, Holtappels G, Gevaert P, van Cauwenberge P, Bachert C. Обнаружение ДНК энтеротоксина в штаммах Staphylococcus aureus , полученных из среднего прохода у контрольной группы и пациентов с полипами носа. Am J Rhinol. 2008; 22: 223–7. [PubMed] [Google Scholar] 21. Pérez Novo CA, Waeytens A, Claeys C, Cauwenberge PV, Bachert C. Энтеротоксин B стафилококка aureus регулирует синтез, рост и миграцию простагландина E2 в фибробластах носовой ткани. J Infect Dis. 2008; 197: 1036–43.[PubMed] [Google Scholar] 22. Pérez-Novo CA, et al. Метаболизм эйкозаноидов и эозинофильное воспаление у пациентов с полипами носа с иммунным ответом на энтеротоксины Staphylococcus aureus . Am J Rhinol. 2006; 20: 456–60. [PubMed] [Google Scholar] 23. Мартинес Ф.О., Хелминг Л., Гордон С. Альтернативная активация макрофагов: иммунологическая функциональная перспектива. Анну Рев Иммунол. 2009. 27: 451–83. [PubMed] [Google Scholar] 24. Калус Л., Дерик Л., Дуллаерс М., ван Зеле Т., де Рейк Н., Перес-Ново С. и др.Уровень IL-21 увеличивается при полипозе носа и после стимуляции энтеротоксином B. Int Arch Allergy Immunol. 2017; 174: 161–9. [PubMed] [Google Scholar] 25. •. Такеда К. и др. Аллергическая конверсия защитного иммунитета слизистой оболочки против носовых бактерий у пациентов с хроническим риносинуситом с полипозом носа. J Allergy Clin Immunol. 2018. 10.1016 / j.jaci.2018.07.006. [PubMed] [CrossRef] [Google Scholar]
Исследование, предполагающее, что переключение класса иммуноглобулинов В-клеток (с IgA и IgG на IgE) во время реакции слизистой оболочки против носовых бактерий способствует фенотипу IgE, часто наблюдаемому при CRSwNP.26. Лан Ф, Чжан Н., Холтаппельс Дж., Де Рюк Н., Крыско О., ван Кромбругген К. и др. Золотистый стафилококк индуцирует иммунный ответ слизистой оболочки 2 типа посредством цитокинов, происходящих из эпителиальных клеток. Am J Respir Crit Care Med. 2018; 198: 452–63. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Рамакришнан В.Р., Физел Л.М., Гитомер С.А., Ир Д., Робертсон К.Э., Франк Д.Н. Микробиом среднего прохода у здоровых взрослых. PLoS One. 2013; 8: e85507. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Sachse F, Becker K, von Eiff C, Metze D, Rudack C.Staphylococcus aureus проникает в эпителий при полипозе носа и индуцирует IL-6 в эпителиальных клетках носа in vitro. Аллергия. 2010; 65: 1430–7. [PubMed] [Google Scholar] 29. Керн Р.К., Конли Д.Б., Уолш В., Чандра Р., Като А., Трипати-Петерс А. и др. Перспективы этиологии хронического риносинусита: гипотеза иммунного барьера. Am J Rhinol. 2008. 22: 549–59. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Алтунбулаклы C, et al. Staphylococcus aureus усиливает целостность барьера плотного соединения в здоровой ткани носа, но не в полипах носа.J Allergy Clin Immunol. 2018; 142: 665–668.e8. [PubMed] [Google Scholar] 31. •. Валера FCP, et al. Staphylococcus aureus нарушает восстановление эпителия придаточных пазух носа: эффекты у пациентов с хроническим риносинуситом с полипами носа и у пациентов контрольной группы. J Allergy Clin Immunol. 2018. 10.1016 / j.jaci.2018.05.035. [PubMed] [CrossRef] [Google Scholar]
Исследование, демонстрирующее негативное влияние стафилококка на заживление ран при CRSwNP.32. Сингх П., Мехта Р., Агарвал С., Мишра П. Бактериальная биопленка на слизистой оболочке носовых пазух здоровых субъектов и пациентов с хроническим риносинуситом (с полипозом носа или без него).J Laryngol Otol. 2015; 129: 46–9. [PubMed] [Google Scholar] 33. Сандерсон А.Р., Лейд Дж. Г., Хансакер Д. Бактериальные биопленки на слизистой оболочке носовых пазух людей с хроническим риносинуситом. Ларингоскоп. 2006; 116: 1121–6. [PubMed] [Google Scholar] 34. Санклемент Дж. А., Вебстер П., Томас Дж., Рамадан Х. Х. Бактериальные биопленки в хирургических препаратах больных хроническим риносинуситом. Ларингоскоп. 2005; 115: 578–82. [PubMed] [Google Scholar] 35. Dlugaszewska J, Leszczynska M, Lenkowski M, Tatarska A, Pastusiak T, Szyfter W.Патофизиологическая роль бактериальных биопленок при хроническом синусите. Eur Arch Otorhinolaryngol. 2016; 273: 1989–94. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Князь А.А. и др. Распространенность биопленкообразующих бактерий при хроническом риносинусите. Am J Rhinol. 2008; 22: 239–45. [PubMed] [Google Scholar] 37. Форман А., Холтаппельс Дж., Псалтис А. Дж., Джервис-Барди Дж., Филд Дж., Вормальд П. Дж. И др. Адаптивные иммунные ответы при хроническом риносинусите, ассоциированном с биопленкой Staphylococcus aureus. Аллергия. 2011; 66: 1449–56.[PubMed] [Google Scholar] 38. •. Викери Т.В., Рамакришнан VR Бактериальные патогены и микробиом. Отоларингол Clin N Am. 2017; 50: 29–47. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Обзорная статья, обобщающая текущее понимание взаимодействий между хозяином и микробом и их роли в CRS.39. Абреу Н.А. и др. Истощение разнообразия микробиома носовых пазух и обогащение Corynebacterium tuberculostearicum опосредуют риносинусит. Sci Transl Med. 2012; 4: 151ra124. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40.Рамакришнан В.Р., Физел Л.М., Абрасс Л.Дж., Франк Д.Н. Распространенность и обилие Staphylococcus aureus в среднем проходе у пациентов с хроническим риносинуситом, полипами носа и астмой. Int Forum Allergy Rhinol. 2013; 3: 267–71. [PubMed] [Google Scholar] 41. Рамакришнан В.Р. и др. Микробиота носовых пазух варьирует в зависимости от фенотипа хронического риносинусита и позволяет прогнозировать исход операции. J Allergy Clin Immunol. 2015; 136: 334–42.e1. [PubMed] [Google Scholar] 42. Чалермватаначай Т., Вилчес-Варгас Р., Хольтаппельс Г., Лакоэр Т., Хауреги Р., Керкхоф FM и др.Хронический риносинусит с полипами носа характеризуется дисбактериозом микробиоты носа. Научный доклад 2018; 8: 7926. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Куцурелакис I, Халдерман А., Халил С., Хиттл Л. Э., Монгодин Э. Ф., Лейн А. П. Временная нестабильность послеоперационной микробиоты гайморовой пазухи. BMC Infect Dis. 2018; 18: 441. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Франк Д. Н., Чжу В., Сартор Р. Б., Ли Э. Изучение биологического и клинического значения дисбиоза человека. Trends Microbiol.2011; 19: 427–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Чонг Л.Й. и др. Интраназальные стероиды в сравнении с плацебо или отсутствие вмешательства при хроническом риносинусите. Кокрановская база данных Syst Rev.2016; 4: CD011996. [PubMed] [Google Scholar] 46. Марсела ФК, Макдональд К.И., Ли Дж., Виттерик АйДжей. Использование послеоперационных местных кортикостероидов при хроническом риносинусите с полипами носа: систематический обзор и метаанализ. Am J Rhinol Allergy. 2013; 27: e146–57. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47.Юн Х.Й., Ли Х.С., Ким И.Х., Хван Ш. Послеоперационное орошение кортикостероидами при хроническом риносинусите после эндоскопической хирургии носовых пазух: метаанализ. Клин Отоларингол. 2018; 43: 525–32. [PubMed] [Google Scholar] 48. Хиссария П., Смит В., Вормальд П. Дж., Тейлор Дж., Вадас М., Гиллис Д. и др. Краткий курс системных кортикостероидов при полипозе придаточных пазух носа: двойное слепое рандомизированное плацебо-контролируемое исследование с оценкой результатов. J Allergy Clin Immunol. 2006. 118: 128–33. [PubMed] [Google Scholar] 49.ван Зеле Т. и др. Пероральные стероиды и доксициклин: два разных подхода к лечению полипов носа. J Allergy Clin Immunol. 2010; 125: 1069–1076.e4. [PubMed] [Google Scholar] 50. Watelet JB, Bachert C, Claeys C, van Cauwenberge P. Матричные металлопротеиназы MMP-7, MMP-9 и их тканевой ингибитор TIMP-1: экспрессия при хроническом синусите против полипоза носа. Аллергия. 2004; 59: 54–60. [PubMed] [Google Scholar] 51. Шин Дж. М. и др. Влияние доксициклина на индуцированную трансформирующим фактором роста-бета-1 экспрессию матриксной металлопротеиназы 2, миграцию и сокращение коллагена в фибробластах носовых полипов.Am J Rhinol Allergy. 2016; 30: 385–90. [PubMed] [Google Scholar] 52. Шин Дж-М, Пак Дж-Х, Парк Ай-Х, Ли Х-М. Доксициклин подавляет индуцированную TGF-β1 продукцию внеклеточного матрикса в фибробластах, происходящих из носовых полипов. Int Forum Allergy Rhinol. 2016; 6: 256–63. [PubMed] [Google Scholar] 53. Рудмик Л, Солер З.М. Лечебные методы лечения хронического синусита у взрослых: систематический обзор. ДЖАМА. 2015; 314: 926–39. [PubMed] [Google Scholar] 54. Джервис-Барди Дж., Боас С., Псалтис А., Бригадир А., Вормальд П. Дж. Рандомизированное испытание полосканий носовых пазух мупироцином по сравнению с физиологическим раствором при хирургически стойком стафилококковом хроническом риносинусите.Ларингоскоп. 2012; 122: 2148–53. [PubMed] [Google Scholar] 55. Solares CA, Batra PS, Hall GS, Citardi MJ. Лечение обострений хронического риносинусита, вызванного метициллинрезистентным золотистым стафилококком, орошением мупироцином. Am J Otolaryngol. 2006; 27: 161–5. [PubMed] [Google Scholar] 56. •. Хальдерман А.А., Лейн А.П. Иммуномодуляторы в лечении полипоза носа. Adv Оториноларингол. 2016; 79: 103–13. [PubMed] [Google Scholar]
Всесторонний обзор текущих данных об использовании биологических иммуномодуляторов для лечения CRSwNP.57. Bachert C, et al. Снижение потребности в хирургическом вмешательстве при тяжелом полипозе носа с применением меполизумаба: рандомизированное исследование. J Allergy Clin Immunol. 2017; 140: 1024–1031.e14. [PubMed] [Google Scholar] 58. Ференс Э. Х., Сух Дж. Д., Тан Б. К., Смит СС. Как часто выполняется операция на носовых пазухах при хроническом риносинусите с полипами носа или без них? Am J Rhinol Allergy 2018; 32: 34–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Le PT, et al. Систематический обзор и метаанализ результатов SNOT-22 после операций по поводу хронического риносинусита с полипозом носа.Otolaryngol Head Neck Surg. 2018; 159: 414–23. [PubMed] [Google Scholar] 60. Миглани А., Дивекар Р. Д., Азар А., Ранг М. А., Лал Д. Ревизионные показатели эндоскопических операций на носовых пазухах по подтипу хронического риносинусита. Int Forum Allergy Rhinol. 2018; 8: 1047–51. [PubMed] [Google Scholar] 61. Сингхал Д., Форман А., Джервис-Барди Дж., Барди Дж. Дж., Вормолд П. Дж. Биопленки золотистого стафилококка: заклятие эндоскопической хирургии носовых пазух. Ларингоскоп. 2011; 121: 1578–83. [PubMed] [Google Scholar]
Стафилококковая инфекция кожи | DermNet NZ
Автор: Эми Стэнвей МБЧБ, регистратор отделения дерматологии больницы Вайкато, Гамильтон, Новая Зеландия, 2002 г.Обновлено доктором Джаннет Гомес, аспирантом в области клинической дерматологии, Лондонский университет королевы Марии, Соединенное Королевство; Главный редактор: д-р Аманда Окли, дерматолог, Гамильтон, Новая Зеландия, декабрь 2015 г.
Что такое стафилококковая инфекция?
Стафилококковая инфекция – это распространенная бактериальная инфекция кожи.
Стафилококки («стафилококки») представляют собой распространенный тип бактерий, обитающих на коже и слизистых оболочках (например, в ноздрях) людей.Золотистый стафилококк (S aureus) является наиболее важным из этих бактерий при заболеваниях человека. Другие стафилококки, включая S epidermidis, считаются комменсалами или нормальными обитателями поверхности кожи.
Около 15-40 процентов здоровых людей являются носителями S aureus, то есть у них есть бактерии на коже без какой-либо активной инфекции или болезни (колонизации). Местами-носителями обычно являются ноздри и изгибы, где бактерии могут обнаруживаться периодически или каждый раз, когда их ищут.
Что вызывает стафилококковую инфекцию?
Несмотря на то, что S aureus безвреден для большинства людей, он может вызывать различные инфекции кожи и других органов. Инфекция S aureus часто встречается у людей с частыми повреждениями кожи, особенно если кожа сухая. Кожные инфекции, вызванные стафилококком, чаще всего наблюдаются у детей предпубертатного возраста и некоторых профессиональных групп, например, у медицинских работников. Но они могут возникать без очевидной причины у здоровых людей.
Большинство стафилококковых инфекций возникает у здоровых людей, но основное заболевание и некоторые кожные заболевания повышают риск заражения.К ним относятся:
Бактериология стафилококковой инфекции
Бактерии S. aureus классифицируются как грамположительные кокки на основании их внешнего вида под микроскопом. Они могут встречаться поодиночке или сгруппированными парами, короткими цепочками или гроздьями винограда. Обычно это факультативные анаэробы, то есть они способны выживать при различных уровнях оксигенации и, как правило, очень выносливые организмы.
Они могут проникать только через поврежденную кожу или слизистые оболочки, поэтому неповрежденная кожа является отличной защитой для человека.После вторжения у них есть различные способы избежать защиты хозяев. Они:
- Скрывают свои антигены, чтобы избежать иммунного ответа
- Убить клетки, борющиеся с инфекциями (фагоциты)
- Выжить в клетках-хозяевах, борющихся с инфекциями.
- Развитие устойчивости к антибиотикам
- Выпуск токсинов (интоксикация) – для их действия не требуется присутствие живых бактерий.
Кожные заболевания, вызванные стафилококковой инфекцией
Стафилококковая инфекция кожи может проявляться различными путями:
Стафилококковая инфекция
Кожные заболевания, вызванные токсинами, продуцируемыми бактериями, включают:
- Синдром ошпаренной кожи стафилококка (SSSS), который обычно поражает детей в возрасте до пяти лет или, в редких случаях, взрослых с почечной недостаточностью.
- Синдром токсического шока. Это относительно редкое заболевание, обычно возникающее в результате выброса токсина-1 при синдроме токсического шока (TSST-1) или энтеротоксина B. Эти токсины также известны как суперантигены, поскольку они способны вызывать массивную воспалительную реакцию. Предыдущее воздействие делает пациента невосприимчивым к этим токсинам, то есть у него не будет повторной атаки.
- Стафилококковая скарлатина (скарлатина).
Стафилококковые токсины также могут вызывать пищевое отравление.
Как диагностируется стафилококковая инфекция?
Диагноз стафилококковой инфекции кожи часто ставится на основании клинических данных. Если возникают трудности с диагностикой или лечение первой линии не дает результатов, диагноз может быть подтвержден положительным лабораторным посевом мазка из инфицированного места или посевом крови.
При стафилококковой интоксикации могут отсутствовать жизнеспособные бактерии для культивирования, и диагноз может быть установлен ретроспективно на основании анализа крови, демонстрирующего иммунный ответ (сероконверсию) на токсины после совместимого заболевания.
Как лечится стафилококковая инфекция?
Лечение стафилококковой инфекции включает:
- Соответствующие антибиотики, включая пероральные антибиотики цефалексин, клиндамицин, амоксициллин / клавуланат
- Вытекание гноя из очага заражения
- Хирургическое удаление (санация) омертвевших тканей (некроза)
- Удаление инородных тел (например, швов), которые могут быть очагом персистирующей инфекции
- Лечение основного кожного заболевания (например, атопической экземы)
Устойчивость к антибиотикам
Стафилококки становятся все более устойчивыми ко многим широко используемым антибиотикам, включая пенициллины, макролиды, такие как эритромицин, тетрациклины и аминогликозиды.
Устойчивость к пенициллину у S aureus обусловлена выработкой фермента, называемого бета-лактамазой или пенициллиназой. Метициллин (метициллин) и флуклоксациллин являются пенициллинами, устойчивыми к лактамазе, поэтому являются антибиотиками выбора при большинстве стафилококковых инфекций кожи. К сожалению, сейчас наблюдается рост устойчивости к метициллину (MRSA).
Пенициллины с ингибитором бета-лактамаз, таким как амоксициллин + клавулоновая кислота, могут использоваться для лечения Staph. aureus и иногда эффективны против бактерий, устойчивых к флуклоксациллину.Эти антибиотики обладают широким спектром действия против нескольких бактерий и лучше всего подходят для пациентов со смешанными бактериальными инфекциями.
Пациенты с аллергией на пенициллин наиболее надежно лечатся ванкомицином, хотя при незначительных инфекциях могут подойти макролиды, такие как эритромицин. Устойчивость к макролидам также высока среди S aureus, но макролиды можно принимать внутрь, тогда как ванкомицин требует внутривенного введения. Другие варианты включают клиндамицин и рифампицин.
Профилактика стафилококковой инфекции
Из-за широко распространенной устойчивости к антибиотикам лучше предотвратить стафилококковую инфекцию там, где это возможно.
- Самый эффективный способ – часто мыть руки, а также до и после прикосновения к поврежденной коже.
- Также важно удалять бактерии, колонизирующие ноздри и под ногтями, с помощью мази с антибиотиком (например, фузидиевой кислоты или мупироцина) или вазелином несколько раз в день в течение одной недели каждого месяца.
- Полезны хлорные ванны два раза в неделю.
Локализация Staphylococcus aureus в ткани преддверия носа у здоровых носителей | BMC Microbiology
Коул AM, Tahk S, Oren A, Yoshioka D, Kim YH, Park A, Ganz T. Детерминанты носового носительства Staphylococcus aureus . Clin Diagn Lab Immunol. 2001; 8: 1064–9.
CAS PubMed PubMed Central Google Scholar
VandenBergh MF, Verbrugh HA. Носительство Staphylococcus aureus : эпидемиология и клиническое значение. J Lab Clin Med. 1999; 133: 525–34.
CAS Статья PubMed Google Scholar
Kluytmans JA, Wertheim HF. Носовое носительство Staphylococcus aureus и профилактика внутрибольничных инфекций. Инфекционное заболевание. 2005; 33: 3–8.
CAS Статья PubMed Google Scholar
van Belkum A, Verkaik NJ, de Vogel CP, Boelens HA, Verveer J, Nouwen JL, Verbrugh HA, Wertheim HF. Реклассификация Staphylococcus aureus типов носового носа. J Infect Dis. 2009; 199: 1820–6.
Артикул PubMed Google Scholar
Wertheim HF, Vos MC, Ott A, van Belkum A, Voss A, Kluytmans JA, van Keulen PH, Vandenbroucke-Grauls CM, Meester MH, Verbrugh HA. Риск и исход внутрибольничной бактериемии Staphylococcus aureus у носителей через нос по сравнению с лицами, не являющимися носителями.Ланцет. 2004; 364: 703–5.
Артикул PubMed Google Scholar
Мерц Д., Фрей Р., Периат Н., Циммерли М., Баттегай М., Флукигер Ю., Видмер А.Ф. Exclusive Staphylococcus aureus глоточное носительство: группы риска. Arch Intern Med. 2009. 169: 172–8.
Артикул PubMed Google Scholar
von Eiff C, Becker K, Machka K, Stammer H, Peters G.Носительство как источник бактериемии Staphylococcus aureus . Исследовательская группа. N Engl J Med. 2001; 344: 11–6.
Артикул Google Scholar
Коутс Т., Бакс Р., Коутс А. Деколонизация носа Staphylococcus aureus мупироцином: сильные и слабые стороны и перспективы на будущее. J Antimicrob Chemother. 2009; 64: 9–15.
CAS Статья PubMed PubMed Central Google Scholar
Ли CJ, Шанкаран С., Мукерджи Д.В., Апа З.Л., Хафер Калифорния, Райт Л., Ларсон Е.Л., Лоуи Ф.Д. Staphylococcus aureus Орофарингеальное носительство у заключенных. Clin Infect Dis. 2011; 52: 775–8.
Артикул PubMed PubMed Central Google Scholar
Kluytmans J, van Belkum A, Verbrugh H. Назальное носительство Staphylococcus aureus : эпидемиология, основные механизмы и связанные риски. Clin Microbiol Rev.1997; 10: 505–20.
CAS PubMed PubMed Central Google Scholar
Mody L, Kauffman CA, McNeil SA, Galecki AT, Bradley SF. Деколонизация Staphylococcus aureus на основе мупироцина у пациентов в 2 учреждениях длительного ухода: рандомизированное двойное слепое плацебо-контролируемое исследование. Clin Infect Dis. 2003; 37: 1467–74.
Артикул PubMed PubMed Central Google Scholar
Мехта МС, Хацек Д.М., Куфнер Б.А., Прайс С, Петерсон Л.Р. Исследование диапазона доз для оценки применения интраназальной 2% -ной мази с мупироцином кальция для уничтожения носовой колонии Staphylococcus aureus . Хирургическая инфекция. 2013; 14: 69–72.
Артикул Google Scholar
Ammerlaan HS, Kluytmans JA, Berkhout H, Buiting A, de Brauwer EI, van den Broek PJ, van Gelderen P, Leenders SA, Ott A, Richter C, Spanjaard L, Spijkerman IJ, van Tiel FH, Воорн Г.П., Вульф М.В., ван З.Дж., Трельстра А., Бонтен М.Дж.Искоренение носительства метициллин-резистентным Staphylococcus aureus : факторы, определяющие неэффективность лечения. J Antimicrob Chemother. 2011; 66: 2418–24.
CAS Статья PubMed Google Scholar
Гилпин Д.Ф., Смолл С., Бакши С., Кирни М.П., Кардуэлл С., Танни М.М. Эффективность стандартного протокола деколонизации метициллин-резистентного Staphylococcus aureus в рутинной клинической практике. J Hosp Infect.2010; 75: 93–8.
CAS Статья PubMed Google Scholar
Plouin-Gaudon I, Clement S, Huggler E, Chaponnier C, Francois P, Lew D, Schrenzel J, Vaudaux P, Lacroix JS. Внутриклеточная резидентность часто связана с рецидивирующим риносинуситом Staphylococcus aureus . Ринология. 2006; 44: 249–54.
CAS PubMed Google Scholar
Clement S, Vaudaux P, Francois P, Schrenzel J, Huggler E, Kampf S, Chaponnier C, Lew D, Lacroix JS. Доказательства наличия внутриклеточного резервуара в слизистой оболочке носа у пациентов с рецидивирующим риносинуситом Staphylococcus aureus . J Infect Dis. 2005; 192: 1023–8.
Артикул PubMed Google Scholar
Weidenmaier C, Goerke C, Wolz C. Staphylococcus aureus Детерминанты носовой колонизации.Trends Microbiol. 2012; 20: 243–50.
CAS Статья PubMed Google Scholar
Рамакришнан В.Р., Физел Л.М., Гитомер С.А., Ир Д., Робертсон К.Э., Франк Д.Н. Микробиом среднего прохода у здоровых взрослых. PLoS One. 2013; 8: e85507.
Артикул PubMed PubMed Central Google Scholar
SanMiguel A, Grice EA. Взаимодействие между факторами хозяина и микробиомом кожи.Cell Mol Life Sci. 2015; 72: 1499–515.
CAS Статья PubMed Google Scholar
Fritsch H, Kuehnel W. Цветной атлас анатомии человека; Vol. 2 .; внутренние органы.; с.406. 5-е издание. Штутгарт: Георг Тиме Верлаг; 2008.
Google Scholar
Nestle FO, Di Meglio P, Qin JZ, Nickoloff BJ. Кожные иммунные стражи здоровья и болезней. Nat Rev Immunol.2009; 9: 679–91.
CAS PubMed PubMed Central Google Scholar
Grice EA, Segre JA. Микробиом кожи. Nat Rev Microbiol. 2011; 9: 244–53.
CAS Статья PubMed PubMed Central Google Scholar
Кришна С., Миллер Л.С. Взаимодействие «хозяин-патоген» между кожей и Staphylococcus aureus . Curr Opin Microbiol.2012; 15: 28–35.
Артикул PubMed Google Scholar
Burian M, Rautenberg M, Kohler T., Fritz M, Krismer B, Unger C., Hoffmann WH, Peschel A, Wolz C, Goerke C. Временная экспрессия факторов адгезии и активность глобальных регуляторов во время установления Золотистый стафилококк колонизация носа. J Infect Dis. 2010; 201: 1414–21.
CAS Статья PubMed Google Scholar
Weidenmaier C, Kokai-Kun JF, Kulauzovic E, Kohler T., Thumm G, Stoll H, Gotz F, Peschel A. Дифференциальная роль заякоренных сортазой поверхностных белков и тейхоевой кислоты стенки в носовой колонизации Staphylococcus aureus . Int J Med Microbiol. 2008; 298: 505–13.
CAS Статья PubMed Google Scholar
Burian M, Wolz C, Goerke C. Регулирующая адаптация Staphylococcus aureus во время носовой колонизации людей.PLoS One. 2010; 5: e10040.
Артикул PubMed PubMed Central Google Scholar
О’Брайен Л.М., Уолш Э.Дж., Масси Р.С., Пикок С.Дж., Фостер Т.Дж. Staphylococcus aureus Фактор слипания B (ClfB) способствует приверженности к цитокератину человека I типа 10: последствия для носовой колонизации. Cell Microbiol. 2002; 4: 759–70.
Артикул PubMed Google Scholar
Clarke SR, Brummell KJ, Horsburgh MJ, McDowell PW, Mohamad SA, Stapleton MR, Acevedo J, Read RC, Day NP, Peacock SJ, Mond JJ, Kokai-Kun JF, Foster SJ. Идентификация экспрессируемых in vivo антигенов Staphylococcus aureus и их использование в вакцинации для защиты от носительства через нос. J Infect Dis. 2006; 193: 1098–108.
CAS Статья PubMed Google Scholar
Wertheim HF, Walsh E, Choudhurry R, Melles DC, Boelens HA, Miajlovic H, Verbrugh HA, Foster T., van Belkum A.Ключевая роль фактора слипания B в носовой колонизации Staphylococcus aureus человека. PLoS Med. 2008; 5: e17.
Артикул PubMed PubMed Central Google Scholar
Кларк С.Р., Андре Дж., Уолш Э.Дж., Дюфрен Ю.Ф., Фостер Т.Дж., Фостер С.Дж. Регулируемый железом поверхностный детерминантный белок а опосредует адгезию Staphylococcus aureus к белкам оболочки корнеоцитов человека. Заражение иммунной. 2009; 77: 2408–16.
CAS Статья PubMed PubMed Central Google Scholar
Aly R, Shinefield HI, Strauss WG, Maibach HI. Прилипание бактерий к клеткам слизистой оболочки носа. Заражение иммунной. 1977; 17: 546–9.
CAS PubMed PubMed Central Google Scholar
Фостер Т.Дж., Геогеган Дж.А., Ганеш В.К., Хук М. Адгезия, инвазия и уклонение: многие функции поверхностных белков Staphylococcus aureus . Nat Rev Microbiol. 2014; 12: 49–62.
CAS Статья PubMed Google Scholar
Askarian F, Ajayi C, Hanssen AM, van Sorge NM, Pettersen I, Diep DB, Sollid JU, Johannessen M. Взаимодействие между Staphylococcus aureus SdrD и десмоглеином 1 важно для адгезии к клеткам-хозяевам. Научный доклад 2016; 6: 22134.
CAS Статья PubMed PubMed Central Google Scholar
Garzoni C, Kelley WL. Staphylococcus aureus : новые доказательства внутриклеточной персистенции.Trends Microbiol. 2009; 17: 59–65.
CAS Статья PubMed Google Scholar
Garzoni C, Francois P, Huyghe A, Couzinet S, Tapparel C, Charbonnier Y, Renzoni A, Lucchini S, Lew DP, Vaudaux P, Kelley WL, Schrenzel J. Общий вид Staphylococcus aureus 906 экспрессия всего генома при интернализации в эпителиальных клетках человека. BMC Genomics. 2007; 8: 171.
Артикул PubMed PubMed Central Google Scholar
Заутнер А.Е., Краузе М., Стропаль Г., Хольтфретер С., Фрикманн Х., Малецки С., Крайкемейер Б., По Х.В., Подбельски А. Внутриклеточный персистирующий Staphylococcus aureus является основным возбудителем рецидивирующего тонзиллита. PLoS One. 2010; 5: e9452.
Артикул PubMed PubMed Central Google Scholar
Эллингтон Дж., Харрис М., Уэбб Л., Смит Б., Смит Т., Тан К., Хадсон М. Внутриклеточный Staphylococcus aureus .Механизм вялости остеомиелита. J Bone Joint Surg Br. 2003; 85: 918–21.
CAS PubMed Google Scholar
Jacobsen BK, Eggen AE, Mathiesen EB, Wilsgaard T, Njolstad I. Профиль когорты: исследование Тромсё. Int J Epidemiol. 2012; 41: 961–7.
Артикул PubMed Google Scholar
Сангвик М., Олсен Р.С., Олсен К., Симонсен Г.С., Фурберг А.С., Соллид Ю.Ю.Связанные с полом и возрастом Staphylococcus aureus СПА-типов, обнаруженные среди носителей носа в общей популяции: исследование стафилококка Тромсо и кожи J Clin Microbiol. 2011; 49: 4213–8.
Артикул PubMed PubMed Central Google Scholar
Бибель Диджей, Али Р., Шайнфилд Х.Р., Майбах Х.И., Штраус РГ. Важность ороговевших эпителиальных клеток в прикреплении бактерий. J Invest Dermatol. 1982; 79: 250–3.
CAS Статья PubMed Google Scholar
Brooker BE, Fuller R. Адгезия коагулазонегативных стафилококков к коже человека и ее значение для бактериальной флоры молока. J Appl Bacteriol. 1984; 57: 325–32.
CAS Статья PubMed Google Scholar
Тен Брук-Смитс, штат Нью-Джерси, Куммер Дж. А., Блейс Р.Л., Флюит АС, Боэль СН. Волосяные фолликулы как ниша Staphylococcus aureus в носу; нужна ли более эффективная стратегия деколонизации? J Hosp Infect.2010; 76: 211–4.
CAS Статья PubMed Google Scholar
Nouwen JL, Ott A, Kluytmans-Vandenbergh MF, Boelens HA, Hofman A, van Belkum A, Verbrugh HA. Прогнозирование носового носителя Staphylococcus aureus : вывод и проверка «правила посева». Clin Infect Dis. 2004; 39: 806–11.
Артикул PubMed Google Scholar
Margadant C, Charafeddine RA, Sonnenberg A. Уникальные и повторяющиеся функции интегринов в эпидермисе. FASEB J. 2010; 24: 4133–52.
CAS Статья PubMed Google Scholar
Олсен К., Фальч Б.М., Даниэльсен К., Йоханнесен М., Эриксон Соллид Ю.Ю., Тун И., Гримнес Г., Йорде Р., Симонсен Г.С., Фурберг А.С. Staphylococcus aureus Носительство в носу связано с уровнем 25-гидроксивитамина D в сыворотке крови, полом и статусом курения.Исследование стафилококка Тромсе и кожи. Eur J Clin Microbiol Infect Dis. 2012; 31: 465–73.
CAS Статья PubMed Google Scholar
Килдо Б.Дж., Конради Дж. П., Робсон Р. Ноздри здоровых добровольцев независимы в отношении носительства Staphylococcus aureus . J Clin Microbiol. 2012; 50: 3744–6.
Артикул PubMed PubMed Central Google Scholar
Sakwinska O, Blanc DS, Lazor-Blanchet C, Moreillon M, Giddey M, Moreillon P. Экологическая временная стабильность Staphylococcus aureus носового носителя. J Clin Microbiol. 2010. 48: 2724–8.
Артикул PubMed PubMed Central Google Scholar
Gresham HD, Lowrance JH, Caver TE, Wilson BS, Cheung AL, Lindberg FP. Выживание золотистого стафилококка внутри нейтрофилов способствует инфицированию.J Immunol. 2000. 164: 3713–22.
CAS Статья PubMed Google Scholar
Ellington JK, Reilly SS, Ramp WK, Smeltzer MS, Kellam JF, Hudson MC. Механизмы инвазии Staphylococcus aureus культивированных остеобластов. Microb Pathog. 1999; 26: 317–23.
CAS Статья PubMed Google Scholar
Dziewanowska K, Patti JM, Deobald CF, Bayles KW, Trumble WR, Bohach GA.Фибронектин-связывающий белок и тирозинкиназа клетки-хозяина необходимы для интернализации Staphylococcus aureus эпителиальными клетками. Заражение иммунной. 1999; 67: 4673–8.
CAS PubMed PubMed Central Google Scholar
Мензис Б.Е., Куртева И. Интернализация Staphylococcus aureus эндотелиальными клетками вызывает апоптоз. Заражение иммунной. 1998; 66: 5994–8.
CAS PubMed PubMed Central Google Scholar
Simpson CL, Patel DM, Green KJ. Деконструкция кожи: цитоархитектурные детерминанты эпидермального морфогенеза. Nat Rev Mol Cell Biol. 2011; 12: 565–80.
CAS Статья PubMed PubMed Central Google Scholar
Узнайте об этом и о том, как снизить риск заражения
Золотистый стафилококк
Золотистый стафилококк (полное название золотистый стафилококк ) – группа бактерий, которые могут вызывать ряд заболеваний в результате инфицирования различных тканей организма.Стафилококк более известен как Staph (произносится как «посох»). Инфекции могут быть вызваны особым типом стафилококков, который называется Staphylococcus aureus . Заболевания и инфекции, связанные со стафилококком, могут быть от легких до тяжелых и, возможно, со смертельным исходом.
До 25–30% здоровых взрослых носят Staph aureus в носу и на коже. В большинстве случаев бактерии не вызывают болезни. Однако открытые поражения или раны на коже или другие повреждения кожи могут позволить бактериям расти и развиваться инфекциям.
Золотистый стафилококк вызывает инфекции в больнице и за ее пределами. Он может вызывать фурункулы, пневмонию, импетиго и является основной причиной инфекций в области хирургического вмешательства (SSI) в США. Статистика показывает, что от 1 до 3 человек из каждых 100 человек, перенесших операцию, заболевают инфекциями, связанными с стафилококком. Более подробная информация доступна на сайте CDC.
Определенные группы людей могут подвергаться большему риску. Например, люди с ослабленной иммунной системой, новорожденные, кормящие женщины и люди с хроническими заболеваниями.
Семьи и отдельные лица, которые посещают детские сады, тренажерные залы, школы, раздевалки, тренажерные центры и игровые площадки, должны знать о фактах Staph aureus. В этих местах может быть повышенный риск передачи от кожи к контакту с кожей или от кожи к контакту с оборудованием.
Инфекции, вызванные стафилококком, заразны. Патогены могут передаваться через прямой контакт с инфицированным участком, через повязки или через предметы личной гигиены, такие как бритва. Раны, которые кажутся красными, опухшими, имеют дренаж или сопровождаются лихорадкой, могут быть инфицированы.
Многие больницы принимают профилактические меры с помощью таких продуктов, как мазь с антибиотиком, тампоны с йодом и антисептик Nozin® Nasal Sanitizer®. Эти приложения используются для уменьшения носовой колонизации у пациентов и медицинских работников. Лечение антибиотиками может осложняться развитием устойчивых к антибиотикам штаммов Staph aureus (например, MRSA). Это может затруднить лечение реальных инфекций, что приведет к увеличению показателей смертности, увеличению продолжительности пребывания в больнице и увеличению затрат.(http://www.ncbi.nlm.nih.gov/pubmed/116)
Все раны, порезы и царапины должны быть чистыми и закрытыми. Staph aureus может передаваться от одной части тела к другой, например, от носа к руке к открытой ране. Важно соблюдать гигиену рук и носа как дома, так и в больнице.
Родители должны немедленно позаботиться о порезах и обратить внимание детей на важность гигиены рук. Необходимо следить за появлением признаков инфекции и немедленно устранять бугорки или волдыри, чтобы предотвратить распространение инфекции.
Дезинфицирующее средство для носа Nozin уменьшает носительство Staph aureus без антибиотиков. Многие медицинские работники рекомендуют использовать дезинфицирующее средство для носа Nozin, чтобы снизить риск заражения.
Staph. Инфекции – симптомы, причины, лечение и профилактика
На этой странице
Что такое стафилококковая инфекция?
Бактерии золотистого стафилококка (стафилококка) – относительно распространенный тип бактерий, который обычно не причиняет никакого вреда. Однако инфекция стафилококка может возникнуть, когда бактерии стафилококка проникают в организм и размножаются.
Многие люди переносят множество различных штаммов стафилококковых бактерий либо на поверхности кожи, либо в носу, и в большинстве случаев они не вызывают никаких проблем.
Однако, если бактерии попадают в организм, они могут размножаться и вызывать инфекцию.
Существует множество различных типов стафилококковой инфекции, от фурункулов до заражения крови, и некоторые из них устойчивы к обычным антибиотикам.
Некоторые стафилококковые инфекции могут быть опасными для жизни.Обратитесь к врачу как можно скорее или позвоните по номеру Triple Zero (000) и попросите скорую помощь, если у вас есть следующие симптомы инвазивной инфекции стафилококка:
Кто подвержен риску заражения стафилококком?
Любой человек может заболеть стафилококковой инфекцией, но некоторые люди более склонны к стафилококковой инфекции, чем другие. К числу тех, у кого более высока вероятность развития инфекций, относятся:
- дети и младенцы, у которых может развиться инфекция, известная как «школьные язвы» (импетиго), когда они начинают посещать детский сад, дошкольное учреждение или школу
- человек с ослабленной иммунной системой, например, люди с ВИЧ / СПИДом или принимающие лекарства для подавления их иммунной системы
- человек, в тело которых регулярно попадает медицинское оборудование, например, во время диализа почек или при использовании катетеров, трубок для кормления или дыхания
- человек, длительное время находившихся в больнице в связи с контактом с медицинскими работниками и близостью к другим больным
Что вызывает стафилококковые инфекции?
Существует несколько различных типов стафилококковой инфекции.Кожные инфекции чаще встречаются в людных местах с частым контактом с кожей, например в детских учреждениях. Вы также можете заболеть от пищевого отравления, если пища, которую вы едите, загрязнена бактериями стафилококка.
Кожные инфекции, вызванные стафилококком
Стафилококковые инфекции на коже включают импетиго, раневую инфекцию, целлюлит и стафилококковый синдром ошпаривания кожи (SSSS). Вы можете узнать больше об этом типе инфекции в статье о кожных инфекциях стафилококка healthdirect.
Симптомы кожной инфекции стафилококка включают покраснение, отек, боль, жар и / или язвы, заполненные гноем.
Инвазивные стафилококковые инфекции
Инвазивные стафилококковые инфекции встречаются гораздо реже, чем кожные, но обычно более серьезны. Существует много типов инвазивных инфекций стафилококка, и вы можете узнать больше, прочитав нашу статью об инвазивных инфекциях стафилококка.
Симптомы инвазивной инфекции стафилококка могут включать общее недомогание, высокую температуру, неконтролируемые тряски и / или одышку.
Как лечат стафилококковые инфекции?
Большинство стафилококковых кожных инфекций лечат курсом антибиотиков.
Простые можно лечить дома. Серьезных необходимо лечить в больнице с помощью внутривенных антибиотиков и других методов лечения.
Устойчивость к антибиотикам
Некоторые золотистые стафилококки устойчивы ко многим антибиотикам. Метициллин-устойчивый золотистый стафилококк (MRSA) обладает сильной устойчивостью к антибиотику под названием метициллин и может вызывать тяжелые инфекции, которые нельзя вылечить с помощью большинства антибиотиков.
Из-за MRSA врачи стали более осторожно назначать антибиотики.Используйте антибиотики только тогда, когда они вам действительно нужны, чтобы снизить риск резистентности бактерий.
Когда мне следует обратиться к врачу?
Обратитесь к врачу, если:
- у вас инфекция – участок красной, раздраженной или болезненной кожи или волдыри, заполненные гноем
- у вас жар
- инфекция усиливается или распространяется
- длится больше недели
- у вас ослабленная иммунная система
- Вы продолжаете заражаться стафилококком
НАЙТИ ЗДРАВООХРАНЕНИЕ – Наша поисковая служба поможет вам найти врачей, аптеки, больницы и другие медицинские услуги.
Можно ли предотвратить заражение стафилококком?
В большинстве случаев вы можете избежать развития кожной инфекции стафилококка с помощью элементарной гигиены. Всегда тщательно мойте руки проточной водой с мылом и вытирайте их чистым полотенцем или одноразовым бумажным полотенцем.
В частности, мойте руки:
- до и после прикосновения или очистки зараженной области
- после туалета
- после сморкания
- перед обработкой и приемом пищи
- после обращения с животными, включая домашних животных
Если вы живете с кем-то, у кого кожная инфекция стафилококка, вы можете избежать развития инфекции с помощью:
- не делиться с ними какими-либо личными вещами, такими как зубные щетки, полотенца, одежда и белье
- Немедленно вымойте руки при контакте с ними
- обеспечивает ежедневную чистку постельного белья и полотенец горячей водой с отбеливателем до исчезновения инфекции
Если вы подвержены риску развития инвазивной стафилококковой инфекции, важно вести здоровый образ жизни, поддерживать здоровую диету, регулярно заниматься спортом, сводить к минимуму употребление алкоголя и избегать курения и употребления запрещенных наркотиков.
Вы можете избежать пищевого отравления, следя за чистотой рабочих поверхностей и кухонной утвари и всегда мыть руки перед приготовлением пищи. Не трогайте пищу, если вы больны, особенно если у вас проблемы с желудком или у вас есть открытые язвы и порезы.
Стафилококковое пищевое отравление
Вы можете избежать пищевого отравления, соблюдая высокие стандарты пищевой гигиены на протяжении всего процесса приготовления.
Обеспечьте безопасность продуктов, всегда готовя их должным образом, избегая загрязнения приготовленных продуктов сырыми продуктами и храня продукты при правильной температуре.
Инфекция золотистым стафилококком: основы практики, общие сведения, патофизиология
Jamal N, Teach SJ. Некротический фасциит. Скорая помощь педиатру . 2011 27 декабря (12): 1195-9; викторина 1200-2. [Медлайн].
Jaramillo D. Инфекции: опорно-двигательный аппарат. Педиатр Радиол . 2011 Май. 41 Приложение 1: S127-34. [Медлайн].
Chou H, Teo HE, Dubey N, Peh WC. Тропический пиомиозит и некротический фасциит. Semin Musculoskelet Radiol . 2011 15 ноября (5): 489-505. [Медлайн].
Lane JW, Tang J, Taggard D, Byun R. Успешное использование даптомицина и линезолида без хирургического вмешательства при лечении обширного эпидурального абсцесса и бактериемии из-за метициллин-резистентного золотистого стафилококка (MRSA). Инфекция Дис Клиническая Практика . Сентябрь 2011 г. 19 (5): 362-364.
Абдель-Хак Н., Кесада М., Асмар Б.И. Заглоточный абсцесс у детей: рост числа устойчивых к метициллину Staphylococcus aureus. Pediatr Infect Dis J . 2012 июля 31 (7): 696-9. [Медлайн].
McNeil JC, Hulten KG, Kaplan SL, Mahoney DH, Mason EO. Инфекции, вызванные Staphylococcus aureus, у больных детской онкологией: высокие показатели устойчивости к противомикробным препаратам, антисептическая толерантность и осложнения. Pediatr Infect Dis J . 2012 11 сентября [Medline].
Elliott DJ, Zaoutis TE, Troxel AB, Loh A, Keren R. Эмпирическая антимикробная терапия детской кожи и инфекций мягких тканей в эпоху метициллин-резистентного золотистого стафилококка. Педиатрия . 2009 июн.123 (6): e959-66. [Медлайн].
Lee S, Choe PG, Song KH, Park SW, Kim HB, Kim NJ, et al. Менее ли цефазолин по сравнению с нафциллином при лечении бактериемии, вызванной чувствительным к метициллину Staphylococcus aureus? Противомикробные агенты Chemother . 2011 ноябрь 55 (11): 5122-6. [Медлайн]. [Полный текст].
Williams DJ, Cooper WO, Kaltenbach LA, Dudley JA, Kirschke DL, Jones TF и др. Сравнительная эффективность стратегий лечения антибиотиками при инфекциях кожи и мягких тканей у детей. Педиатрия . 2011 15 августа [Medline].
[Рекомендации] Лю С., Байер А., Косгроув С.Е., et al. Руководство по клинической практике Американского общества инфекционистов по лечению устойчивых к метициллину инфекций Staphylococcus Aureus у взрослых и детей. Clin Infect Dis . 2011 г. 1. 52 (3): e18-e55. [Медлайн].
Кемпер А.Р., Долор Р.Дж., Фаулер В.Г. Младший. Лечение кожных абсцессов педиатрами первичной медико-санитарной помощи. Clin Pediatr (Phila) . 2011 июн. 50 (6): 525-8. [Медлайн].
Sreeramoju P, Porbandarwalla NS, Arango J, Latham K, Dent DL, Stewart RM и др. Рецидивирующие инфекции кожи и мягких тканей, вызванные устойчивым к метициллину Staphylococcus aureus, требующие хирургической обработки раны. Am J Surg . 2011 Февраль 201 (2): 216-20. [Медлайн].
Pääkkönen M, Kallio PE, Kallio MJ, Peltola H. Лечение костно-суставных инфекций, вызванных Staphylococcus aureus, аналогично лечению других этиологий: анализ 199 стафилококковых инфекций костей и суставов. Pediatr Infect Dis J . 2012 май. 31 (5): 436-8. [Медлайн].
Боггс В. Даптомицин лечит бактериемию S. aureus без нефротоксичности. Медицинские новости Medscape. 8 января 2013 г. Доступно по адресу http://www.medscape.com/viewarticle/777276. Доступ: 15 января 2013 г.
von Eiff C, Becker K, Machka K, Stammer H, Peters G. Носовое носительство как источник бактериемии Staphylococcus aureus. Исследовательская группа. N Engl J Med . 2001 4 января.344 (1): 11-6. [Медлайн].
van Belkum A, Verkaik NJ, de Vogel CP, Boelens HA, Verveer J, Nouwen JL. Реклассификация типов носового носительства Staphylococcus aureus. J Заразить Dis . 2009 15 июня. 199 (12): 1820-6. [Медлайн].
Венцель Р.П., Perl TM. Значение носительства Staphylococcus aureus через нос и частота послеоперационной раневой инфекции. Дж Хосп Инфекция . 1995 31 сентября (1): 13-24. [Медлайн].
Ruimy R, Angebault C, Djossou F и др.Является ли генетика хозяина доминирующей детерминантой стойкого носительства Staphylococcus aureus через нос у людей? J Заразить Dis . 2010 15 сентября. 202 (6): 924-34. [Медлайн].
Chen CJ, Hsu KH, Lin TY, Hwang KP, Chen PY, Huang YC. Факторы, связанные с носовой колонизацией метициллин-резистентного золотистого стафилококка среди здоровых детей на Тайване. Дж. Клин Микробиол . 2011 января 49 (1): 131-7. [Медлайн]. [Полный текст].
Нерби Дж. М., Горвиц Р., Лешер Л., Джуни Б., Джавахир С., Линфилд Р.Факторы риска передачи в домашних условиях связанного с сообществом метициллин-устойчивого Staphylococcus aureus. Pediatr Infect Dis J . 2011 30 ноября (11): 927-32. [Медлайн].
Fritz SA, Krauss MJ, Epplin EK, Burnham CA, Garbutt J, Dunne WM, et al. Естественная история современной носовой колонизации Staphylococcus aureus у общинных детей. Pediatr Infect Dis J . 2011 Апрель 30 (4): 349-51. [Медлайн]. [Полный текст].
Джезуальдо Ф., Бонджорно Д., Риццо С., Белла А., Меничелла Д., Стефани С. и др.Колонизация носа MRSA у детей: метаанализ распространенности, обзор факторов риска и молекулярная генетика. Pediatr Infect Dis J . 2013 21 января [Medline].
Петерс П.Дж., Брукс Д.Т., Макаллистер С.К., Лимбаго В., Лоури Г.К., Фосхейм Г. и др. Колонизация метициллин-резистентного золотистого стафилококка в паху и риск клинической инфекции среди ВИЧ-инфицированных взрослых. Emerg Infect Dis . Апрель 2013. 19 (4): 623-629.
Faden H, Lesse AJ, Trask J, Hill JA, Hess DJ, Dryja D.Значение места колонизации в современной эпидемии стафилококковых кожных абсцессов. Педиатрия . 2010 15 февраля. [Medline].
Ли С.Дж., Шанкаран С., Мукерджи Д.В., Апа З.Л., Хафер К.А., Райт Л. Staphylococcus aureus ротоглоточное носительство у заключенных. Clin Infect Dis . 2011 15 марта. 52 (6): 775-8. [Медлайн].
Nowrouzian FL, Dauwalder O, Meugnier H, Bes M, Etienne J, Vandenesch F и др. Гены адгезина и суперантигена и способность Staphylococcus aureus колонизировать детский кишечник. J Заразить Dis . 2011 Сентябрь 204 (5): 714-21. [Медлайн].
Милстон А.М., Сонг Х, Коффин С., Элвард А. Идентификация и искоренение колонизации метициллин-устойчивого золотистого стафилококка в отделении интенсивной терапии новорожденных: результаты национального исследования. Инфекционный контроль Hosp Epidemiol . 2010 июля 31 (7): 766-8. [Медлайн]. [Полный текст].
Накамура М.М., Макадам А.Дж., Сандора Т.Дж., Морейра К.Р., Ли Г.М. Более высокая распространенность носительства Staphylococcus aureus через глотку, чем через нос, в педиатрических отделениях интенсивной терапии. Дж. Клин Микробиол . 2010 августа 48 (8): 2957-9. [Медлайн].
Matheson EM, Mainous AG 3rd, Everett CJ, King DE. Потребление чая и кофе и носовое носительство MRSA. Энн Фам Мед . 2011 июл-авг. 9 (4): 299-304. [Медлайн].
Зангер П., Нурджади Д., Гайле М., Габриш С., Кремснер П.Г. Использование гормональных контрацептивов и стойкое носительство Staphylococcus aureus. Clin Infect Dis . 2012 декабрь 55 (12): 1625-32. [Медлайн].
Bartlett AH, Hulten KG. Патогенез золотистого стафилококка: системы секреции, адгезины и инвазины. Pediatr Infect Dis J . 2010 сентября, 29 (9): 860-1. [Медлайн].
Tuchscherr L, Heitmann V, Hussain M, Viemann D, Roth J, von Eiff C, et al. Варианты небольших колоний Staphylococcus aureus являются адаптированными фенотипами для внутриклеточной персистенции. J Заразить Dis . 2010 г., 1. 202 (7): 1031-40. [Медлайн].
Verkaik NJ, Dauwalder O, Antri K, Boubekri I, de Vogel CP, Badiou C.Иммуногенность токсинов при инфицировании золотистым стафилококком. Clin Infect Dis . 2010 г. 1. 50 (1): 61-8. [Медлайн].
Aalfs AS, Oktarina DA, Diercks GF, Jonkman MF, Pas HH. Стафилококковый синдром ошпаренной кожи: потеря десмоглеина 1 в коже пациента. Eur J Dermatol . 2010 июл-авг. 20 (4): 451-6. [Медлайн].
Bassetti M, Nicco E, Mikulska M. Почему MRSA, ассоциированный с сообществами, распространяется по всему миру и как это изменит клиническую практику ?. Int J Антимикробные агенты . 2009 июл. 34 Приложение 1: S15-9. [Медлайн].
Дэвид MZ, Daum RS. Связанный с сообществом метициллин-устойчивый золотистый стафилококк: эпидемиология и клинические последствия возникающей эпидемии. Clin Microbiol Ред. . 2010 июл.23 (3): 616-87. [Медлайн].
Пикетт А., Уилкинсон М., Менох М., Снелл Дж., Инигес Р., Буллох Б. Изменение частоты кожных абсцессов, вызванных метициллин-резистентным золотистым стафилококком, в педиатрическом отделении неотложной помощи. Скорая помощь педиатру . 2009 25 декабря (12): 831-4. [Медлайн].
Kairam N, Silverman ME, Salo DF, Baorto E, Lee B, Amato CS. Кожный метициллин-резистентный золотистый стафилококк в педиатрическом отделении пригородной городской больницы. J Emerg Med . 2011 ноябрь 41 (5): 460-5. [Медлайн].
Boucher HW, Кори ГР. Эпидемиология метициллин-устойчивого золотистого стафилококка. Clin Infect Dis . 2008 г. 1 июня.46 Приложение 5: S344-9. [Медлайн].
Tenover FC, Goering RV. Метициллин-резистентный штамм золотистого стафилококка USA300: происхождение и эпидемиология. J Antimicrob Chemother . 2009 Сентябрь 64 (3): 441-6. [Медлайн].
Talan DA, Krishnadasan A, Gorwitz RJ, Fosheim GE, Limbago B, Albrecht V, et al. Сравнение Staphylococcus aureus от инфекций кожи и мягких тканей у пациентов отделения неотложной помощи США, 2004 и 2008 гг. Clin Infect Dis .2011 Июль 53 (2): 144-149. [Медлайн].
Long CB, Madan RP, Herold BC. Диагностика и лечение внебольничных инфекций MRSA у детей. Expert Rev Anti Infect Ther . 2010 февраля 8 (2): 183-95. [Медлайн].
Lowy FD. Как золотистый стафилококк адаптируется к своему хозяину. N Engl J Med . 2011 26 мая. 364 (21): 1987-90. [Медлайн].
Hay R, Noor NM. Лейкоцидин Пантона-Валентайна и тяжелые инфекции кожи, вызванные Staphylococcus aureus: единственный виновник или у него есть сообщники? Curr Opin Infect Dis . 2011 24 апреля (2): 97-9. [Медлайн].
Ритц Н., Кертис Н. Роль лейкоцидина Пантон-Валентайн в мышечно-скелетных инфекциях, вызванных Staphylococcus aureus, у детей. Pediatr Infect Dis J . 2012 май. 31 (5): 514-8. [Медлайн].
Mendes RE, Deshpande LM, Smyth DS, Shopsin B, Farrell DJ, Jones RN. Характеристика устойчивых к метициллину штаммов Staphylococcus aureus, полученных в результате клинического испытания фазы IV линезолида по сравнению с ванкомицином для лечения нозокомиальной пневмонии. Дж. Клин Микробиол . 2012 ноябрь 50 (11): 3694-702. [Медлайн]. [Полный текст].
Hermos CR, Yoong P, Pier GB. Высокие уровни антител к пантон-валентинному лейкоцидину не связаны с устойчивостью к инфекциям кожи и мягких тканей, связанным со Staphylococcus aureus. Clin Infect Dis . 2010 15 ноября. 51 (10): 1138-46. [Медлайн].
Grundmeier M, Tuchscherr L, Bruck M, Viemann D, Roth J, Willscher E. Штаммы стафилококков сильно различаются по своей способности вызывать воспалительный ответ в эндотелиальных клетках. J Заразить Dis . 2010 15 марта. 201 (6): 871-80. [Медлайн].
Strandberg KL, Rotschafer JH, Vetter SM, Buonpane RA, Kranz DM, Schlievert PM. Стафилококковые суперантигены вызывают у кроликов летальную болезнь легких. J Заразить Dis . 2010 декабрь 1. 202 (11): 1690-7. [Медлайн].
Li M, Cheung GY, Hu J, Wang D, Joo HS, Deleo FR, et al. Сравнительный анализ вирулентности и экспрессии токсинов глобальных сообществ устойчивых к метициллину штаммов Staphylococcus aureus. J Заразить Dis . 2010 15 декабря. 202 (12): 1866-76. [Медлайн].
Torres VJ, Stauff DL, Pishchany G, Bezbradica JS, Gordy LE, Iturregui J, et al. Регуляторная система золотистого стафилококка, которая реагирует на гем хозяина и модулирует вирулентность. Клеточный микроб-хозяин . 2007, 19 апреля. 1 (2): 109-19. [Медлайн]. [Полный текст].
Пищанский Г., Маккой А.Л., Торрес В.Дж., Краузе Дж.К., Кроу Дж.Э. младший, Фабри М.Э. и др. Специфичность для человеческого гемоглобина усиливает инфекцию Staphylococcus aureus. Клеточный микроб-хозяин . 2010 16 декабря. 8 (6): 544-50. [Медлайн]. [Полный текст].
Кобаяши С.Д., Малахова Н., Уитни А.Р., Браутон К.Р., Гарднер Д.Д., Лонг Д. и др. Сравнительный анализ детерминант вирулентности USA300 в модели инфекции кожи и мягких тканей кролика. J Заразить Dis . 2011 Сентябрь 204 (6): 937-41. [Медлайн]. [Полный текст].
Хота Б., Лайлс Р., Рим Дж., Попович К.Дж., Райс Т., Аручева А. Предикторы клинической вирулентности при внебольничных метициллин-устойчивых инфекциях Staphylococcus aureus: важность USA300 и пневмонии. Clin Infect Dis . 2011 Октябрь 53 (8): 757-65. [Медлайн].
Пейрани П., Аллен М., Вимкен Т.Л., Хак Н.З., Зервос М.Дж., Форд К.Д. и др. Тяжесть заболевания и клинические исходы у пациентов с внутрибольничной пневмонией, вызванной метициллин-устойчивыми штаммами Staphylococcus aureus, на которые не влияет наличие гена лейкоцидина Пантона-Валентина. Clin Infect Dis . 2011 Октябрь 53 (8): 766-71. [Медлайн].
Кебайер С., Чемберленд Р.Р., Аллен И.К., Гао Х, Брольи П.М., Холл Дж. Д.Staphylococcus aureus a-Hemolysin опосредует вирулентность в мышиной модели тяжелой пневмонии посредством активации инфламмасомы NLRP3. J Заразить Dis . 2012 Март 205 (5): 807-17. [Медлайн].
Рудкин JK, Эдвардс AM, Bowden MG, Brown EL, Pozzi C, Waters EM. Устойчивость к метициллину снижает вирулентность связанного со здоровьем метициллин-устойчивого золотистого стафилококка, вмешиваясь в систему определения кворума agr. J Заразить Dis . 2012 Март.205 (5): 798-806. [Медлайн].
Sharma-Kuinkel BK, Ahn SH, Rude TH, Zhang Y, Tong SY, Ruffin F и др. Наличие генов, кодирующих пантон-валентинский лейкоцидин, не является основным фактором, определяющим исход у пациентов с внутрибольничной пневмонией, вызванной Staphylococcus aureus. Дж. Клин Микробиол . 2012 Март 50 (3): 848-56. [Медлайн]. [Полный текст].
Soong G, Chun J, Parker D, Prince A. Staphylococcus aureus Активация каспазы 1 / передачи сигналов кальпаина опосредует вторжение через кератиноциты человека. J Заразить Dis . 2012 май. 205 (10): 1571-9. [Медлайн].
Отто М. Как золотистый стафилококк поражает нашу кожу и вызывает инфекцию. J Заразить Dis . 2012 май. 205 (10): 1483-5. [Медлайн].
Wehrhahn MC, Робинсон Дж.О., Паско Е.М., Кумбс Г.В., Пирсон Дж.С., О’Брайен Ф.Г. Тяжесть болезни при инвазивной инфекции Staphylococcus aureus, возникшей в сообществе, и наличие генов вирулентности. J Заразить Dis . 2012 июн.205 (12): 1840-8.[Медлайн].
Garofalo A, Giai C, Lattar S, Gardella N, Mollerach M, Kahl BC. Длина полиморфной области белка Staphylococcus aureus регулирует воспаление: влияние на острую и хроническую инфекцию. J Заразить Dis . 2012 Июль 206 (1): 81-90. [Медлайн].
Shallcross LJ, Fragaszy E, Johnson AM, Hayward AC. Роль лейкоцидинового токсина Пантона-Валентайна в стафилококковой инфекции: систематический обзор и метаанализ. Lancet Infect Dis . 2013 января 13 (1): 43-54. [Медлайн]. [Полный текст].
Сурядевара М., Кларк А.Э., Волк Д.М., Карман А., Розенбаум П.Ф. Молекулярная характеристика инвазивной инфекции Staphylococcus aureus у детей из центральной части Нью-Йорка: важность двух клональных групп и несогласованное присутствие выбранных детерминант вирулентности. J Педиатр Infect Dis Soc . Март 2013. 2 (1): 30-39.
Schneider-Lindner V, Quach C, Hanley JA, Suissa S.Антибактериальные препараты и риск развития метициллин-резистентного золотистого стафилококка, ассоциированного с сообществом, у детей. Arch Pediatr Adolesc Med . 1 августа 2011 г. [Medline].
Смит Т.Л., Пирсон М.Л., Уилкокс К.Р. и др. Возникновение устойчивости к ванкомицину у золотистого стафилококка. Рабочая группа по гликопептиду-промежуточному стафилококку. N Engl J Med . 1999 18 февраля. 340 (7): 493-501. [Медлайн].
Zheng X, Qi C, Arrieta M, O’Leary A, Wang D, Shulman ST.Отсутствие повышения устойчивости к ванкомицину у детских метициллин-устойчивых изолятов Staphylococcus aureus с 2000 по 2007 год. Pediatr Infect Dis J . 2010 сентября, 29 (9): 882-4. [Медлайн].
Кэмерон Д.Р., Уорд Д.В., Костулиас X, Хауден Б.П., Меллеринг Р.К. младший, Элиопулос Г.М. Серин / треонинфосфатаза Stp1 способствует снижению чувствительности к ванкомицину и вирулентности золотистого стафилококка. J Заразить Dis . 2012 июн.205 (11): 1677-87. [Медлайн].
Cheung A, Duclos B. Stp1 и Stk1: Инь и Ян чувствительности и вирулентности ванкомицина в штаммах золотистого стафилококка промежуточного звена с ванкомицином. J Заразить Dis . 2012 июн.205 (11): 1625-7. [Медлайн].
Shore AC, Deasy EC, Slickers P, et al. Обнаружение стафилококковой кассетной хромосомы mec типа XI, кодирующей сильно дивергентные гены mecA, mecI, mecR1, blaZ и ccr в клиническом клональном комплексе человека 130 Метициллин-устойчивый Staphylococcus aureus. Противомикробные агенты Chemother . 2011 г. 2 июня [Medline].
Гарсия-Альварес Л., Холден М. Т., Линдси Х и др. Метициллин-устойчивый золотистый стафилококк с новым гомологом mecA в популяциях людей и крупного рогатого скота в Великобритании и Дании: описательное исследование. Lancet Infect Dis . 2011 г. 2 июня [Medline].
Кэмерон Д.Р., Хауден Б.П., Пелег А.Ю. Связь между устойчивостью к антибиотикам и вирулентностью Staphylococcus aureus и ее влияние на клинические исходы. Clin Infect Dis . 2011 Сентябрь 53 (6): 576-82. [Медлайн].
[Рекомендации] CDC. Временные рекомендации по профилактике стафилококковой инфекции, связанной со сниженной чувствительностью к ванкомицину, и борьбе с ней. MMWR Morb Mortal Wkly Rep . 1997 г. 11 июля. 46 (27): 626-8, 635. [Medline].
Ивамото М., Мю И, Линфилд Р., Буленс С.Н., Надл Дж., Арагон Д. и др. Тенденции инвазивных метициллин-устойчивых инфекций Staphylococcus aureus. Педиатрия . 13 октября 2013 г., 132 (4): e817-e824. [Медлайн].
Лэйдман Дж. Число случаев MRSA, связанных с сообществами, растет у детей. Medscape [сериал онлайн]. Доступно на http://www.medscape.com/viewarticle/811483. Доступ: 30 сентября 2013 г.
Helwick C. MRSA растет у детей с мышечно-скелетными инфекциями. Medscape [сериал онлайн]. Доступно на http://www.medscape.com/viewarticle/813484. Доступ: 4 ноября 2013 г.
Saravolatz LD, Pawlak J, Johnson LB.Чувствительность in vitro и молекулярный анализ изолятов стафилококка, устойчивых к ванкомицину, и устойчивых к ванкомицину изолятов Staphylococcus aureus. Clin Infect Dis . 2012 августа. 55 (4): 582-6. [Медлайн].
Frei CR, Makos BR, Daniels KR, Oramasionwu CU. Появление внебольничных инфекций кожи и мягких тканей Staphylococcus aureus, устойчивых к метициллину, как частая причина госпитализации детей в США. J Педиатр Хирург . 2010 Октябрь 45 (10): 1967-74.[Медлайн].
Hadler JL, Petit S, Mandour M, Cartter ML. Тенденции инвазивного заражения метициллин-резистентным золотистым стафилококком, Коннектикут, США, 2001-2010 гг. Emerg Infect Dis . 2012 июн. 18 (6): 917-24. [Медлайн]. [Полный текст].
Сурядевара М., Моро М.Р., Розенбаум П.Ф., Киска Д., Ридделл С., Вайнер Л.Б. Частота инвазивных внебольничных инфекций Staphylococcus aureus у детей в Центральном Нью-Йорке. Дж. Педиатр .2010 Январь 156 (1): 152-154.e1. [Медлайн].
Landrum ML, Neumann C, Cook C, Chukwuma U, Ellis MW, Hospenthal DR. Эпидемиология Staphylococcus aureus крови и инфекций кожи и мягких тканей в системе военного здравоохранения США, 2005-2010 гг. Staphylococcus aureus в вооруженных силах США. JAMA . 2012 июл 4. 308 (1): 50-9. [Медлайн].
Сян М.С., Шиау Р., Надле Дж., Чан Л., Ли Б., Чемберс Х.Ф. и др. Эпидемиологическое сходство у педиатрических сообществ, устойчивых к метициллину и чувствительных к метициллину Staphylococcus aureus в районе залива Сан-Франциско. J Педиатр Infect Dis Soc . Сентябрь 2012. 1 (3): 200-211.
Рейес Дж., Ринкон С., Диаз Л. и др. Распространение устойчивой к метициллину линии передачи типа 8 Staphylococcus aureus USA300 в Латинской Америке. Clin Infect Dis . 2009 15 декабря. 49 (12): 1861-7. [Медлайн]. [Полный текст].
Sutter DE, Milburn E, Chukwuma U, Dzialowy N, Maranich AM, Hospenthal DR. Изменение восприимчивости к Staphylococcus aureus в педиатрической популяции США. Педиатрия . 2016 г. 1 марта [Medline].
Смит Дж., Согаард М., Шёнхейдер Х.С., Нильсен Х., Фрослев Т., Томсен Р.В. Диабет и риск внебольничной бактериемии Staphylococcus aureus: популяционное исследование случай-контроль. Eur J Endocrinol . 2016 г. 10 марта [Medline].
Давенпорт Л. Пациенты с диабетом с повышенным риском заражения крови S aureus. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/860376.15 марта 2016 г .; Доступ: 27 апреля 2016 г.
Saxena S, Thompson P, Birger R, Bottle A, Spyridis N, Wong I. Увеличение кожных инфекций и осложнений Staphylococcus aureus у детей, Англия, 1997-2006 гг. Emerg Infect Dis . 2010 марта 16 (3): 530-533. [Медлайн].
Otter JA, French GL. Молекулярная эпидемиология ассоциированного с сообществами метициллин-устойчивого Staphylococcus aureus в Европе. Lancet Infect Dis . 2010 апр.10 (4): 227-239. [Медлайн].
Lessa FC, Mu Y, Davies J, Murray M, Lillie M, Pearson A. Сравнение частоты инфицирования кровотока метициллин-резистентным золотистым стафилококком между Англией и США, 2006-2007 гг. Clin Infect Dis . 15 октября 2010 г. 51 (8): 925-8. [Медлайн].
Голдинг Г.Р., Леветт П.Н., Макдональд Р.Р., Ирвин Дж., Куинн Б., Нсунгу М. Высокие показатели инфекции Staphylococcus aureus USA400, Северная Канада. Emerg Infect Dis . 2011 Апрель 17 (4): 722-5. [Медлайн].
Голдинг Г.Р., Леветт П.Н., Макдональд Р.Р., Ирвин Дж., Нсунгу М., Вудс С. и др. Сравнение факторов риска, связанных с устойчивыми к метициллину и восприимчивыми к метициллину инфекциями Staphylococcus aureus в отдаленных районах. Эпидемиологическая инфекция . 2010 май. 138 (5): 730-7. [Медлайн].
Ким Дж., Феррато С., Голдинг Г. Р., Малви М. Р., Симмондс К. А., Свенсон Л. В. и др.Изменение эпидемиологии метициллин-устойчивого золотистого стафилококка в Альберте, Канада: популяционный эпиднадзор, 2005-2008 гг. Эпидемиологическая инфекция . 2010 21 сентября. 1-10. [Медлайн].
Matlow A, Forgie S, Pelude L, Embree J, Gravel D, Langley JM и др. Национальный эпиднадзор за метициллин-устойчивым золотистым стафилококком среди детей, госпитализированных в канадские отделения неотложной помощи, 1995-2007 гг. Pediatr Infect Dis J . 2012 31 августа (8): 814-20.[Медлайн].
Алесана-Слейтер Дж., Ричи С.Р., Хеффернан Х., Лагерь Т., Ричардсон А., Гербисон П., Staphylococcus aureus, устойчивый к метициллину, Самоа, 2007-2008 гг. Emerg Infect Dis . 2011 июн.17 (6): 1023-9. [Медлайн].
Сузуки М., Ямада К., Нагао М., Аоки Е., Мацумото М., Хираяма Т. и др. Противомикробные мази и устойчивый к метициллину Staphylococcus aureus USA 300. Emerg Infect Dis . 2011 17 (10) октября: 1917-20. [Медлайн].
Тонг С.Ю., Епископ Э.Дж., Лиллибридж Р.А. и др. Связанные с сообществами штаммы устойчивых к метициллину Staphylococcus aureus и чувствительных к метициллину S. aureus у коренных жителей Северной Австралии: эпидемиология и результаты. J Заразить Dis . 2009 15 мая. 199 (10): 1461-70. [Медлайн].
Salmenlinna S, Lyytikainen O, Vainio A, Myllyniemi AL, Raulo S, Kanerva M, et al. Случаи заболевания человека метициллин-резистентным золотистым стафилококком CC398, Финляндия. Emerg Infect Dis . 2010 16 октября (10): 1626-9. [Медлайн].
Tappe D, Schulze MH, Oesterlein A, Turnwald D, Müller A, Vogel U, et al. Пантон-Валентайн, лейкоцидин-положительные инфекции Staphylococcus aureus у возвращающихся путешественников. Am J Trop Med Hyg . 2010 Октябрь 83 (4): 748-50. [Медлайн]. [Полный текст].
Чуа К., Лоран Ф., Кумбс Дж., Грейсон М.Л., Хауден Б.П. Не связанный с сообществом устойчивый к метициллину Staphylococcus aureus (CA-MRSA)! Руководство для клиницистов по сообществу MRSA – его развивающаяся устойчивость к противомикробным препаратам и последствия для терапии. Clin Infect Dis . 2011 Январь 52 (1): 99-114. [Медлайн].
Никерсон EK, Wuthiekanun V, Kumar V, Amornchai P, Wongdeethai N, Chheng K. Возникновение метициллин-устойчивого носительства золотистого стафилококка у детей в Камбодже. Am J Trop Med Hyg . 2011 Февраль 84 (2): 313-7. [Медлайн].
Hamdan-Partida A, Sainz-Espuñes T, Bustos-Martínez J. Характеристика и устойчивость штаммов Staphylococcus aureus, выделенных из передних ноздрей и глотки здоровых носителей в мексиканском сообществе. Дж. Клин Микробиол . 2010 май. 48 (5): 1701-5. [Медлайн].
Muttaiyah S, Coombs G, Pandey S, Reed P, Ritchie S, Lennon D, et al. Заболеваемость, факторы риска и исходы инфекций Staphylococcus aureus, чувствительных к метициллину, чувствительных к метициллину, по шкале Пантон-Валентайн, в Окленде, Новая Зеландия. Дж. Клин Микробиол . 2010 Октябрь 48 (10): 3470-4. [Медлайн]. [Полный текст].
Адлер А., Гивон-Лави Н., Мозес А. Е., Блок C, Даган Р. Носительство связанного с сообществом метициллин-устойчивого золотистого стафилококка в когорте младенцев на юге Израиля: факторы риска и молекулярные особенности. Дж. Клин Микробиол . 2010 Февраль 48 (2): 531-8. [Медлайн]. [Полный текст].
Васька В.Л., Гримвуд К., Голе Г.А., Ниммо Г.Р., Патерсон Д.Л., Ниссен М.Д. Связанный с сообществом метициллин-устойчивый золотистый стафилококк, вызывающий орбитальный целлюлит у детей Австралии. Pediatr Infect Dis J . 2011 30 ноября (11): 1003-1006. [Медлайн].
Марра Ф., Патрик Д.М., Чонг М., Маккей Р., Хоанг Л., Боуи В. Р.. Популяционное исследование увеличения частоты инфекций кожи и мягких тканей и связанного с ними применения противомикробных препаратов. Противомикробные агенты Chemother . 2012 декабрь 56 (12): 6243-9. [Медлайн]. [Полный текст].
Jenkins TC, Sabel AL, Sarcone EE, Price CS, Mehler PS, Burman WJ. Инфекции кожи и мягких тканей, требующие госпитализации в академическом медицинском центре: возможности для управления антимикробными препаратами. Clin Infect Dis . 15 октября 2010 г. 51 (8): 895-903. [Медлайн].
Spellberg B. Инфекции кожи и мягких тканей: современная эволюция древней проблемы. Clin Infect Dis . 15 октября 2010 г. 51 (8): 904-6. [Медлайн]. [Полный текст].
Carrillo-Marquez MA, Hulten KG, Hammerman W, Lamberth L, Mason EO, Kaplan SL. Staphylococcus aureus Пневмония у детей в эпоху внебольничной устойчивости к метициллину в Детской больнице Техаса. Pediatr Infect Dis J . 2011 июл.30 (7): 545-50. [Медлайн].
Vander Have KL, Karmazyn B, Verma M, Caird MS, Hensinger RN, Farley FA.Связанный с сообществом метициллин-устойчивый золотистый стафилококк при острой скелетно-мышечной инфекции у детей: правила игры. J Педиатр Ортоп . 2009 29 декабря (8): 927-31. [Медлайн].
Fretzayas A, Moustaki M, Tsagris V, Brozou T., Nicolaidou P. Пузырьковый дистальный дактилит MRSA и обзор зарегистрированных случаев. Педиатр дерматол . 2011 июл-авг. 28 (4): 433-5. [Медлайн].
Carrillo-Marquez MA, Hulten KG, Hammerman W, Mason EO, Kaplan SL.USA300 является преобладающим генотипом, вызывающим септический артрит Staphylococcus aureus у детей. Pediatr Infect Dis J . 2009 28 декабря (12): 1076-80. [Медлайн].
Carrillo-Marquez MA, Hulten KG, Mason EO, Kaplan SL. Клиническая и молекулярная эпидемиология Staphylococcus aureus Катетер-ассоциированная бактериемия у детей. Pediatr Infect Dis J . 2010 май. 29 (5): 410-4. [Медлайн].
Jacobson JA, Kasworm E, Daly JA. Риск развития синдрома токсического шока, связанного с токсином 1 синдрома токсического шока, после негенитальной стафилококковой инфекции. Ред. Заразить Dis . 1989 янв-фев. 11 Дополнение 1: S8-13. [Медлайн].
Джон С.К., Нирманн М., Шарон Б., Петерсон М.Л., Кранц Д.М., Шливерт П.М. Синдром стафилококкового токсического шока, эритродермия ассоциируется с суперантигенностью и гиперчувствительностью. Clin Infect Dis . 2009 15 декабря. 49 (12): 1893-6. [Медлайн]. [Полный текст].
Ramirez-Schrempp D, Dorfman DH, Baker WE, Liteplo AS. Аппликации УЗИ мягких тканей в педиатрическом отделении неотложной помощи: сливать или не сливать ?. Скорая помощь педиатру . 2009 25 января (1): 44-8. [Медлайн].
Sivitz AB, Lam SH, Ramirez-Schrempp D, Valente JH, Nagdev AD. Влияние прикроватного ультразвука на лечение инфекции мягких тканей у детей. J Emerg Med . 2010 ноябрь 39 (5): 637-43. [Медлайн].
Кори ГР. Бактериемия и эндокардит Staphylococcus aureus: роль диагностической оценки. Инфекция Дис Клиническая Практика . 2011/09. 19 (5): 307-312.
Kaasch AJ, Fowler VG Jr, Rieg S, Peyerl-Hoffmann G, Birkholz H, Hellmich M, et al.Использование простого набора критериев для ведения эхокардиографии при нозокомиальной бактериемии Staphylococcus aureus. Clin Infect Dis . 2011 июл 1. 53 (1): 1-9. [Медлайн]. [Полный текст].
Сориано А., Менса Дж. Обязательна ли чреспищеводная эхокардиография при бактериемии Staphylococcus aureus, приобретенной в больнице ?. Clin Infect Dis . 2011 г. 1. 53 (1): 10-2. [Медлайн].
Showler A, Burry L, Bai AD, Steinberg M, Ricciuto DR, Fernandes T, et al.Использование трансторакальной эхокардиографии в лечении бактериемии Staphylococcus aureus с низким риском: результаты ретроспективного многоцентрового когортного исследования. JACC Cardiovasc Imaging . 2015 8 июля [Medline].
Боггс В. Трансторакальная эхокардиография, достаточная для исключения инфекционного эндокардита. http://www.medscape.com/viewarticle/848780. Доступно на http://www.medscape.com/viewarticle/848780. 30 июля 2015 г .; Доступ: 7 августа 2015 г.
Патель Вайли Ф, Каплан С.Л., Мейсон Е.О., Аллен СН.Аспирация игл для этиологической диагностики детей с целлюлитом в эпоху внебольничного метициллинрезистентного Staphylococcus aureus. Clin Pediatr (Phila) . 2011 июн. 50 (6): 503-7. [Медлайн].
Duong M, Markwell S, Peter J, Barenkamp S. Рандомизированное контролируемое испытание антибиотиков при лечении внебольничных кожных абсцессов у педиатрических пациентов. Энн Эмерг Мед . 2010 май. 55 (5): 401-7. [Медлайн].
Ли М.С., Риос А.М., Атен М.Ф., Мехиас А., Кавуоти Д., Маккракен Г.Х. младший и др.Лечение и исходы у детей с абсцессами кожи и мягких тканей, вызванными внебольничным метициллин-устойчивым золотистым стафилококком. Pediatr Infect Dis J . 2004 г., 23 (2): 123-7. [Медлайн].
Раджендран П.М., Янг Д., Маурер Т., Чемберс Х., Пердро-Ремингтон Ф., Ро П. Рандомизированное двойное слепое плацебо-контролируемое исследование цефалексина для лечения неосложненных кожных абсцессов в популяции, подверженной риску внебольничного метициллина -резистентная инфекция Staphylococcus aureus. Противомикробные агенты Chemother . 2007 ноябрь 51 (11): 4044-8. [Медлайн].
Рухе Дж. Дж., Смит Н., Брэдшер Р. В., Менон А. Возникшие в сообществе устойчивые к метициллину инфекции кожи и мягких тканей Staphylococcus aureus: влияние антимикробной терапии на результат. Clin Infect Dis . 2007 15 марта. 44 (6): 777-84. [Медлайн].
Karchmer AW. Бактериемия Staphylococcus aureus и эндокардит нативного клапана: роль антимикробной терапии. Инфекция Дис Клиническая Практика . Март 2012. 20 (2): 100-108.
Чен А.Е., Кэрролл К.С., Динер-Вест М., Росс Т., Ордун Дж., Голдштейн М.А. и др. Рандомизированное контролируемое испытание цефалексина по сравнению с клиндамицином при неосложненных кожных инфекциях у детей. Педиатрия . 2011 Март 127 (3): e573-80. [Медлайн].
McNamara WF, Hartin CW Jr, Escobar MA, Yamout SZ, Lau ST, Lee YH. Альтернатива открытому разрезу и дренажу при внебольничных абсцессах мягких тканей у детей. J Педиатр Хирург . 2011 Март 46 (3): 502-6. [Медлайн].
Keller DM. Схема Staph aureus сокращает хирургическую инфекцию. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/833457. Доступ: 19 октября 2014 г.
Schweizer M, et al. Многоцентровое вмешательство для снижения инфекций в области хирургического вмешательства у пациентов, перенесших операции на сердце и тотальную артропластику суставов (STOP SSI STUDY). Доклад, представленный на IDWeek; 8-12 октября 2014 г .; Филадельфия, Пенсильвания.[Полный текст].
Смит Дж., Лопес-Кортес Л.Е., Томсен Р.В., Шёнхейдер Х.С., Нильсен Х., Фрослев Т. и др. Использование статинов и риск внебольничной бактериемии Staphylococcus aureus: популяционное исследование «случай-контроль». Mayo Clin Proc . 2017 Октябрь 92 (10): 1469-1478. [Медлайн].
Брукс М. Статины могут помочь защититься от бактериемии S aureus. Новости Medscape. Доступно по адресу https://www.medscape.com/viewarticle/887676#vp_1. 26 октября 2017 г .; Доступ: 1 ноября 2017 г.
Nailor MD, Sobel JD. Антибиотики от грамположительных бактериальных инфекций: ванкомицин, тейкопланин, хинупристин / далфопристин, оксазолидиноны, даптомицин, далбаванцин и телаванцин. Инфекция Dis Clin N Am . Dec 2009. 23 (4): 965-82.
Thwaites GE, Edgeworth JD, Gkrania-Klotsas E, Kirby A, Tilley R, Török ME. Клиническое лечение бактериемии Staphylococcus aureus. Lancet Infect Dis . 2011 марта, 11 (3): 208-222.[Медлайн].
Weisman LE, Thackray HM, Steinhorn RH, Walsh WF, Lassiter HA, Dhanireddy R, et al. Рандомизированное исследование моноклональных антител (пагибаксимаб) для предотвращения стафилококкового сепсиса. Педиатрия . 2011 августа 128 (2): 271-9. [Медлайн].
Jimenez-Truque N, Thomsen I, Saye E, Creech CB. Следует ли нацеливать более высокие минимальные уровни ванкомицина на инвазивные внебольничные метициллин-резистентные инфекции Staphylococcus aureus у детей? Pediatr Infect Dis J . 2010 г., 29 (4): 368-70. [Медлайн].
Aguado JM, San-Juan R, Lalueza A, Sanz F, Rodríguez-Otero J, Gómez-Gonzalez C, et al. Высокий МПК ванкомицина и осложненная метициллин-чувствительная бактериемия золотистого стафилококка. Emerg Infect Dis . 2011 июн.17 (6): 1099-102. [Медлайн].
Lubin AS, Snydman DR, Ruthazer R, Bide P, Golan Y. Прогнозирование высокой минимальной ингибирующей концентрации ванкомицина при инфекциях кровотока, вызванных устойчивым к метициллину Staphylococcus aureus. Clin Infect Dis . 2011 г. 15 апреля. 52 (8): 997-1002. [Медлайн].
Куллар Р., Дэвис С.Л., Левин Д.П., Рыбак М.Дж. Воздействие ванкомицина на исходы у пациентов с метициллин-резистентной бактериемией Staphylococcus aureus: поддержка согласованных руководящих принципов предлагает целевые показатели. Clin Infect Dis . 2011 15 апреля. 52 (8): 975-81. [Медлайн].
Патель Н, Пай М.П., Родволд К.А., Ломаэстро Б., Друсано Г.Л., Лодизе Т.П. Ванкомицин: отсюда мы не можем добраться. Clin Infect Dis . 2011 г. 15 апреля. 52 (8): 969-74. [Медлайн].
van Hal SJ, Lodise TP, Paterson DL. Клиническое значение минимальной ингибирующей концентрации ванкомицина при инфекциях, вызванных Staphylococcus aureus: систематический обзор и метаанализ. Clin Infect Dis . 2012 Март 54 (6): 755-71. [Медлайн].
Дересински С. Метициллин-устойчивый золотистый стафилококк и ванкомицин: минимальная ингибирующая концентрация имеет значение. Clin Infect Dis . 2012 марта 54 (6): 772-4. [Медлайн].
Wunderink RG, Niederman MS, Kollef MH, Shorr AF, Kunkel MJ, Baruch A, et al. Линезолид при нозокомиальной пневмонии, устойчивой к метициллину Staphylococcus aureus: рандомизированное контролируемое исследование. Clin Infect Dis . 2012 марта 54 (5): 621-9. [Медлайн].
Рамирес П., Фернандес-Барат Л., Торрес А. Новые варианты лечения MRSA с респираторной инфекцией / пневмонией. Curr Opin Infect Dis .2012 Апрель 25 (2): 159-65. [Медлайн].
Morales G, Picazo JJ, Baos E, Candel FJ, Arribi A, Pelaez B. Устойчивость к линезолиду опосредована геном cfr в первом сообщении о вспышке устойчивого к линезолиду Staphylococcus aureus. Clin Infect Dis . 2010 15 марта. 50 (6): 821-5. [Медлайн].
Санчес Гарсия М., Де ла Торре М.А., Моралес Г. и др. Клиническая вспышка линезолид-устойчивого золотистого стафилококка в отделении интенсивной терапии. JAMA . 2010 июн 9. 303 (22): 2260-4. [Медлайн].
Prokocimer P, De Anda C, Fang E, Mehra P, Das A. Тедизолид фосфат против линезолида для лечения острых бактериальных инфекций кожи и кожных структур: рандомизированное исследование ESTABLISH-1. JAMA . 2013 13 февраля. 309 (6): 559-69. [Медлайн].
Prokocimer P, Bien P, Deanda C, Pillar CM, Bartizal K. Активность тедизолида (TR-700) и микробиологическая эффективность in vitro в отношении грамположительных клинических изолятов из исследования фазы 2 перорального приема тедизолид фосфата (TR-701) у пациентов с осложненными инфекциями кожи и кожных структур. Противомикробные агенты Chemother . 2012 Сентябрь 56 (9): 4608-13. [Медлайн]. [Полный текст].
Prokocimer P, De Anda C, Fang E, Mehra P, Das A. Тедизолид фосфат против линезолида для лечения острых бактериальных инфекций кожи и кожных структур: рандомизированное исследование ESTABLISH-1. JAMA . 2013 13 февраля. 309 (6): 559-69. [Медлайн].
Moran GJ, Fang E, Corey GR, Das AF, De Anda C., Prokocimer P. Тедизолид в течение 6 дней по сравнению с линезолидом в течение 10 дней при острых бактериальных инфекциях кожи и кожных структур (ESTABLISH-2): рандомизированный, двойной- слепое, фаза 3, испытание не меньшей эффективности. Lancet Infect Dis . 2014 5 июня. [Medline].
Lowes, R. Новый антибиотик тедизолид (Sivextro), одобренный FDA. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/827168. Дата обращения: 26 июня 2014 г.
Saravolatz LD, Stein GE, Johnson LB. Телаванцин: новый липогликопептид. Clin Infect Dis . 2009 15 декабря. 49 (12): 1908-14. [Медлайн].
Brooks M. FDA разрешает использовать Oritavancin (Orbactiv) для лечения кожных инфекций. Medscape Medical News . 7 августа 2014 г. [Полный текст].
Moellering RC, Jr, Ferraro MJ. Оритаванцин для лечения серьезных грамположительных инфекций. Clin Infect Dis . 15 апреля 2012 г. 54 (Дополнение 3): S201-S243.
Кори Г.Р., Уилкокс М., Талбот Г.Х. и др. Комплексный анализ CANVAS 1 и 2: многоцентровые рандомизированные двойные слепые исследования фазы 3 для оценки безопасности и эффективности цефтаролина по сравнению с ванкомицином плюс азтреонам при осложненной инфекции кожи и кожных структур. Clin Infect Dis . 2010 15 сентября. 51 (6): 641-50. [Медлайн].
Saravolatz LD, Stein GE, Johnson LB. Цефтаролин: новый цефалоспорин с активностью против метициллин-резистентного золотистого стафилококка. Clin Infect Dis . 2011 Май. 52 (9): 1156-63. [Медлайн].
Gums JG. Цефтаролин фосамил: цефалоспорин широкого спектра действия с метициллин-резистентной активностью золотистого стафилококка. Инфекция Дис Клиническая Практика .Март 2012. 20 (2): 122-130.
Фаррелл DJ, Castanheira M, Mendes RE, Sader HS, Jones RN. Активность цефтаролина in vitro против Staphylococcus aureus и Streptococcus pneumoniae с множественной лекарственной устойчивостью: обзор опубликованных исследований и программы наблюдения AWARE (2008-2010). Clin Infect Dis . 2012 сентябрь 55 Приложение 3: S206-14. [Медлайн].
Sader HS, Flamm RK, Farrell DJ, Jones RN. Анализ активности изолятов стафилококка от детей, взрослых и пожилых пациентов: Программа наблюдения за цефтаролином AWARE. Clin Infect Dis . 2012 сентябрь 55 Приложение 3: S181-6. [Медлайн].
Jones RN, Mendes RE, Sader HS, Castanheira M. Результаты антимикробных исследований in vitro фузидовой кислоты против современных (2008-2009 гг.) Грамположительных организмов, собранных в Соединенных Штатах. Clin Infect Dis . 2011 июн. 52 Приложение 7: S477-86. [Медлайн].
Craft JC, Moriarty SR, Clark K, Scott D, Degenhardt TP, Still JG. Рандомизированное двойное слепое исследование фазы 2, сравнивающее эффективность и безопасность перорального режима ударных доз фузидиевой кислоты и перорального линезолида для лечения острых бактериальных инфекций кожи и кожных структур. Clin Infect Dis . 2011 июн. 52 Приложение 7: S520-6. [Медлайн].
Фернандес П., Перейра Д. Усилия по поддержке разработки фузидиевой кислоты в США. Clin Infect Dis . 2011 июн. 52 Приложение 7: S542-6. [Медлайн].
Lee AS, Macedo-Vinas M, François P, Renzi G, Schrenzel J, Vernaz N. Влияние комбинированного низкого уровня мупироцина и генотипической устойчивости к хлоргексидину на стойкое носительство метициллин-устойчивого Staphylococcus aureus после деколонизирующей терапии: исследование случай-контроль . Clin Infect Dis . 2011 г. 15 июня. 52 (12): 1422-30. [Медлайн].
Джейн Р., Кралович С.М., Эванс М.Э. и др. Инициатива по делам ветеранов по профилактике метициллин-резистентных инфекций Staphylococcus aureus. N Engl J Med . 2011, 14 апреля. 364 (15): 1419-30. [Медлайн].
Robotham JV, Graves N, Cookson BD, Barnett AG, Wilson JA, Edgeworth JD. Стратегии скрининга, изоляции и деколонизации в борьбе с метициллин-резистентным Staphylococcus aureus в отделениях интенсивной терапии: оценка экономической эффективности. BMJ . 2011. 343: d5694. [Медлайн].
Simor AE. Стафилококковая деколонизация: эффективная стратегия профилактики инфекции ?. Lancet Infect Dis . 2011 Декабрь 11 (12): 952-62. [Медлайн].
Fritz SA, Hogan PG, Hayek G, Eisenstein KA, Rodriguez M, Epplin EK, et al. Домашние и индивидуальные подходы к искоренению связанного с сообществом Staphylococcus aureus у детей: рандомизированное исследование. Clin Infect Dis .2012 Март 54 (6): 743-51. [Медлайн]. [Полный текст].
Миллер LG. Где мы находимся в области профилактики золотистого стафилококка, связанного с сообществами, – а пока что мы говорим нашим пациентам ?. Clin Infect Dis . 2012 марта 54 (6): 752-4. [Медлайн].
Kling J. Скрининг методом ПЦР сокращает внутрибольничную инфекцию. Medscape Medical News . 14 мая 2013 г. [Полный текст].
Милстон AM, Голднер Б.В., Росс Т., Шепард Дж.В., Кэрролл К.С., Perl TM.Колонизация метициллин-резистентного золотистого стафилококка и риск последующей инфекции у тяжелобольных детей: важность профилактики внутрибольничной передачи метициллин-резистентного золотистого стафилококка. Clin Infect Dis . 2011 ноябрь 53 (9): 853-9. [Медлайн]. [Полный текст].
Хуанг С.С., Септимус Э., Клейнман К., Муди Дж., Хикок Дж., Эйвери Т.Р. и др. Целенаправленная и универсальная деколонизация для предотвращения инфекции в отделениях интенсивной терапии. N Engl J Med . 2013 29 мая.[Медлайн].
Эдмонд МБ, Венцель Р.П. Скрининг стационарных пациентов на MRSA – Дело закрыто. N Engl J Med . 2013 29 мая. [Medline].
Laidman J. MRSA: Универсальная деколонизация превосходит скрининг и изоляцию. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/805005. Доступ: 11 июня 2013 г.
Шеной Е.С., Ким Дж., Розенберг Е.С., Коттер Дж. А., Ли Х., Валенски Р.П. и др. Прекращение контактных мер предосторожности в отношении метициллин-устойчивого Staphylococcus aureus: рандомизированное контролируемое испытание, сравнивающее пассивный и активный скрининг с культивированием и полимеразной цепной реакцией. Clin Infect Dis . 2013 июль 57 (2): 176-84. [Медлайн]. [Полный текст].
Lin Y-C, Петерсон М.Л. Новые взгляды на профилактику стафилококковых инфекций и синдрома токсического шока. Эксперт Рев Клин Фармакол . 2010. 3: 753-767.
Худа Т., Наир Х, Теодорату Э, Згага Л., Фаттом А, Эль Арифин С. и др. Оценка новых вакцин и иммунотерапии против стафилококковой пневмонии у детей. BMC Общественное здравоохранение .2011 г., 13 апреля. 11 Прил. 3: S27. [Медлайн]. [Полный текст].
Даум Р.С., Спеллберг Б. Прогресс в создании вакцины против золотистого стафилококка. Clin Infect Dis . 2012 Февраль 54 (4): 560-7. [Медлайн].
Theilacker C, Kropec A, Hammer F, Sava I, Wobser D, Sakinc T. Защита от золотистого стафилококка с помощью антител к полиглицеринфосфатной основе гетерологичной липотейхоевой кислоты. J Заразить Dis . 2012 апр.205 (7): 1076-85.[Медлайн].
Проктор Р.А. Проблемы универсальной вакцины против Staphylococcus aureus. Clin Infect Dis . 2012 апр. 54 (8): 1179-86. [Медлайн].
Андерсон А.С., Скалли И.Л., Тимофеева Ю., Мерфи Е., Макнил Л.К., Минини Т. и др. Staphylococcus aureus Транспортный белок C марганца – это высококонсервативный белок клеточной поверхности, который вызывает защитный иммунитет против S. aureus и Staphylococcus epidermidis. J Заразить Dis .2012 июн.205 (11): 1688-96. [Медлайн]. [Полный текст].
Fritz SA, Tiemann KM, Hogan PG, Epplin EK, Rodriguez M, Al-Zubeidi DN, et al. Серологический коррелят защитного иммунитета против внебольничной инфекции Staphylococcus aureus. Clin Infect Dis . 2013 июнь 56 (11): 1554-61. [Медлайн]. [Полный текст].
McNeil JC, Hulten KG, Kaplan SL, Mahoney DH, Mason EO. Инфекции, вызванные Staphylococcus aureus, у больных детской онкологией: высокие показатели устойчивости к противомикробным препаратам, антисептическая толерантность и осложнения. Pediatr Infect Dis J . 2013 Февраль 32 (2): 124-8. [Медлайн].
Creel AM, Durham SH, Benner KW, Alten JA, Winkler MK. Тяжелые инвазивные внебольничные метициллинрезистентные инфекции Staphylococcus aureus у ранее здоровых детей. Pediatr Crit Care Med . 2009 Май. 10 (3): 323-7. [Медлайн].
Vergnano S, Menson E, Smith Z, Kennea N, Embleton N, Clarke P. Характеристики инвазивного Staphylococcus aureus в неонатальных отделениях Соединенного Королевства. Pediatr Infect Dis J . 2011 30 октября (10): 850-4. [Медлайн].
Мениф К., Бузири А., Халди А., Хамди А., Бельхадж С., Борги А. и др. Связанные с сообществом метициллинрезистентные инфекции Staphylococcus aureus в педиатрическом отделении интенсивной терапии. J Infect Dev Ctries . 2011 12 августа. 5 (8): 587-91. [Медлайн].
Генрих Н., Мюллер А., Бартманн П., Саймон А., Бирбаум Г., Энгельхарт С. Успешное ведение вспышки MRSA в отделении интенсивной терапии новорожденных. Eur J Clin Microbiol Infect Dis . 2011 июл.30 (7): 909-13. [Медлайн].
Woodlief RS, Markowitz JE. Нераспознанная инвазивная инфекция у новорожденного, колонизированного метициллин-резистентным золотистым стафилококком. Дж. Педиатр . 2009 декабрь 155 (6): 943-943.e1. [Медлайн].
Арора П., Калра В.К., Паппас А. Множественные абсцессы головного мозга у новорожденного после инфицирования кровотока метициллин-резистентным золотистым стафилококком. Дж. Педиатр .2012 Сентябрь 161 (3): 563-563.e1. [Медлайн].
Niemann S, Ehrhardt C, Medina E, Warnking K, Tuchscherr L, Heitmann V, et al. Совместное действие вируса гриппа и Staphylococcus aureus panton-valentine leukocidin вызывает тяжелое повреждение эпителия легких.

 aureus, растущих в областях с низким содержанием кислорода;
aureus, растущих в областях с низким содержанием кислорода;