Пять мифов о бронхите – Новости Барановичей, Бреста, Беларуси, Мира. Intex-press
Бронхит (воспаление слизистой оболочки бронхов) – одна из самых распространенных патологий дыхательной системы. Заболевание может протекать в острой или хронической форме. При правильном лечении острый бронхит проходит за 10-12 дней, но в хроническом варианте навязчивый кашель может мучить больного несколько месяцев. Несмотря на то, что заболевание хорошо изучено, относительно его лечения и происхождения существует много мифов. Рассмотрим самые известные.
Бронхит не заразен
По-видимому, утверждение связано с тем, что бронхит зачастую возникает после перенесенного ОРЗ, и многие полагают, что инфицирование возбудителем «основного» заболевания уже невозможно, а кашель (основной симптом бронхита) – что-то вроде остаточного явления. На самом деле это не так. Как правило, бронхит развивается вследствие вирусной или бактериальной инфекции, проникшей в организм воздушно-капельным путем. Яркие симптомы появляются на 5–10-е сутки от заражения, но кашляющий больной уже распространяет возбудителя болезни. Вот почему следует избегать тесных контактов с человеком, страдающим бронхитом, не использовать его посуду и полотенце, как можно чаще проветривать комнату, где он находится, сообщается на сайте neboleem.net.
Бронхит развивается из-за длительного насморка
На слизистой оболочке дыхательных путей каждого человека обитает множество условно-патогенных микроорганизмов. При нормально функционирующей иммунной системе их жизнедеятельность подавляется, развития заболеваний не происходит. Если иммунитет снижен, микроорганизмы активизируются. Они могут размножиться в полостях носа, вызвав насморк, или в нижних дыхательных путях, спровоцировав воспаление слизистой оболочки бронхов. Таким образом, затяжной насморк не является причиной бронхита, но может повлечь снижение иммунитета, что облегчит развитие других заболеваний, возможно и бронхита.
Отхаркивающие средства предупреждают развитие болезни
Отхаркивающие препараты (в том числе растительные) неэффективны для профилактики заболеваний.
Начальная стадия бронхита характеризуется сухим изматывающим кашлем, усиливающимся по ночам. Прием отхаркивающих средств в такой ситуации не только бесполезен, но и может ухудшить состояние. Через несколько дней у пациента повышается температура тела, а кашель становится влажным; в этом случае прием отхаркивающих препаратов может оказаться целесообразным, однако назначать их должен врач.
Водные процедуры при бронхите противопоказаны
Принимать душ при бронхите не просто можно, а необходимо; повышенная температура тела не должна стать причиной отказа от водных процедур. Болезнь сопровождается повышенным потоотделением, и очищение кожи от выводящихся с потом токсинов облегчает состояние пациента и способствует его выздоровлению.
Вода в душе не должна быть горячей. После процедур надо насухо вытереться и лечь в постель. Комнату нужно проветрить и проследить, чтобы в ней не было сквозняков. При таких условиях душ принесет большую пользу.
Бронхит лечится только антибиотиками
В большинстве случаев острый бронхит развивается вследствие инфицирования вирусами (возбудителями гриппа, риновирусом, коронавирусом и т. д.). Антибиотики против них бессильны. Кроме того, существуют виды заболевания, обусловленные бронхоспазмом (так называемый обструктивный бронхит), который вызывается агрессивными агентами, в роли которых могут выступать не только вирусы, но и аллергены.
Антибиотики применяются только в тех случаях, когда появляется подозрение на присоединение бактериальной инфекции. В любом случае все лекарственные препараты больному бронхитом должен назначать врач. Самолечение в такой ситуации может привести к весьма нежелательным последствиям.
Люди, разделяющие заблуждения о бронхите, рискуют здоровьем. Особенно опасно распространенное мнение, что длительный «остаточный» кашель после перенесенного острого респираторного заболевания лечения не требует.
Автор: neboleem.net
В каких случаях бронхит заразен? Как защитить себя от болезни?
В каких случаях бронхит заразен и как обезопасить себя от данного заболевания? Мы даем ответы на самые важные вопросы.
В холодное время года обычно наступает сезон вирусных заболеваний, среди которых на первых местах находится такой недуг, как бронхит. Он часто начинается с простуды и сопровождается следующими симптомами: боль в горле, кашель с мокротой, насморк и одышка. Еще одним признаком болезни может быть высокая температура. Бронхит обычно вызывают простудные вирусы.
Является ли каждый бронхит контагиозным?
Будет ли бронхит заразным или нет, зависит от конкретной формы заболевания. Развитие острого бронхита, как правило, провоцируют вирусы, поэтому такой тип болезни может передаваться другим людям. А вот хронический бронхит, наоборот, возникает не после атаки патогенных микроорганизмов, а вследствие курения или контакта с раздражающими или токсичными веществами. По этой причине данная форма является неопасной для остальных.
Риск заражения острым бронхитом возникает уже тогда, когда здоровый человек находится в одной комнате с больным. Инфекция передается двумя путями: воздушно-капельным (через воздух при разговоре, чихании или кашле) и контактным (при рукопожатии или касании предметов, которыми пользовался больной).
Как долго сохраняется опасность заражения?
По мнению медиков, наиболее контагиозным является бронхит в начальной стадии. Считается, что он заразен до тех пор, пока слизь в бронхах и связанный с ней кашель не исчезнут. Неосложненный бронхит заканчивается, как правило, через 14 дней.
Как уберечься от инфекции?
Лучшая защита от инфекционных заболеваний – комплексная гигиена. Следующие меры минимизируют вероятность заражения бронхитом:
Следующие меры минимизируют вероятность заражения бронхитом:
- Частое мытье рук с мылом в течение не менее 20 секунд под проточной водой;
- Дезинфекция поверхности: предметы, к которым часто прикасается заболевший, следует чистить несколько раз в день дезинфицирующими средствами;
- Увлажнение воздуха в комнатах: микробы распространяются в помещении с сухим воздухом. Увлажнители или мокрые полотенца на батарее поддержат влажность воздуха в норме и, таким образом, снизят риск заражения;
- Отдельное белье и посуда: больной обязан пользоваться отдельными принадлежностями, которые после перенесенного заболевания необходимо обеззаразить при температуре от 60ºC.
Инфекционный бронхит кур
Инфекционный бронхит кур
Инфекционный бронхит кур (ИБК) — высококонтагиозная болезнь, характеризующаяся поражением органов дыхания у молодняка, поражением репродуктивных органов и потерей продуктивности у взрослых кур-несушек, а также нефрозонефритным синдромом.
Эпизоотические данные. К заболеванию в основном восприимчивы цыплята в возрасте до 30 дней, а также куры в возрасте 5-6месяцев. Кроме домашней птицы, заболевание регистрируется у фазанов и перепелов. Особенностью болезни является то, что через 3-5дней после ее появления она быстро поражает всех птиц в стаде. Вначале заболевают цыплята, а затем болезнь переходит на молодых и взрослых кур. Основной источник инфекции – больные цыплята, куры и переболевшая птица. Больная птица выделяет вирус в течении 3 месяцев с слизистыми истечениями из дыхательных путей, с яйцом и пометом. Длительность вирусносительства у переболевшей птицы доходит до 12 месяцев. Птица заражается главным образом аэрогенным путем. Факторами передачи служит – корм, вода, подстилка и другие предметы, загрязненные выделениями больной птицы.
Патогенез. После попадения вируса развивается лимфоидная инфильтрация, пораженный эпителий регенерирует, размножение вируса прекращается, но за дело берется секундарная микрофлора, преимущественно, патогенная. Переболевшая ИБК птица становится беззащитной перед колибактериями, пастереллами, Микоплазмами, возбудителем инфекционного ларинготрахеита.
Переболевшая ИБК птица становится беззащитной перед колибактериями, пастереллами, Микоплазмами, возбудителем инфекционного ларинготрахеита.
Смертность среди цыплят может достигать 40%. Ремонтный молодняк страдает меньше, процент гибели среди курочек не превышает 5%. Взрослые от ИБК не умирают.
Симптомы. Заразный бронхит кур протекает в нижеперечисленных разновидностях:
· респираторная;
· нефрозонефритическая;
· репродуктивная.
Респираторный синдром. Чаще всего наблюдают его у цыплят. Он сопровождается расстройством терморегуляции. Проявляется нижеперечисленными симптомами:
· Птенцы мерзнут, сбиваются в кучки.
· Возникает угнетенное состояние.
· Опускаются крылья.
· Дыхание становится напряженным.
· Появляются трахеальные хрипы.
· Цыплята чихают.
· Развивается ринит и конъюнктивит.
· Опухают подглазничные пазухи.
Среди птенцов, не достигших двух недель, наблюдают значительный падеж из-за удушья. Большинство цыплят выздоравливают, но отставание в росте преодолеть не удается. Такую птицу приходиться выбраковывать.
Нефрозонефритический синдром.Эта разновидность заболевания характеризуется поражением почек. Страдает подращенный молодняк и несушки. При возникновении бронхита у кур наблюдают следующие характерные симптомы:
· Диарея с примесью уратных конкрементов.
· Кашель, хрипы.
· Низкая продуктивность.
· Куры несут деформированные яйца с мягкой скорлупой.
Среди молодняка наблюдают высокую смертность. У кур симптомы инфекционного бронхита стертые. Иногда они проявляются только низкой яйценоскостью.
Репродуктивный синдром. Клинические проявления нехарактерны. Чаще всего удается заметить следующие симптомы инфекционного бронхита:
· Ринит.
· Конъюнктивит.
· Дыхание курицы затруднено.
· Инкубационные качества яиц низкие. Эмбриональная смертность высока.
Диагностика.
· Биопроба на эмбрионах.
· Серологические исследования. Востребованы ИФА, РНГА, РН, ПЦР.
Лечение. Прежде, чем начинать лечить бронхит у кур, требуется привести зоогигиенические параметры в соответствие с нормативами. Стационарно неблагонадежные птичники регулярно санируют дезинфицирующими препаратами:
· Однохлористым йодом. Его наливают в керамическую либо стеклянную емкость, добавляют измельченный алюминий. Выделяется газообразный, фиолетовой окраски йод, который санирует помещение.
· Люголь-спреем. Проводят в домашних условиях на небольшом поголовье, орошая клювы и ноздри птицы.
· Глютексом. Ингаляционное средство растворяют водой 1/200. Обрабатывают курятник из расчета 0,35 дм3/м2 помещения.
При массовом заболевании следует провести замену птицы. Исцелившаяся курочка никогда не станет хорошей несушкой, потому что поражаются репродуктивные органы.
Профилактика. Надежный способ предотвращения Инфекционного бронхита — иммунизация цыплят раннего возраста, проводимая интраназально, аэрозольно либо энтерально, с питьем. Родительское поголовье перед началом яйцекладки иммунизируют внутримышечной инъекцией комплексной инактивированной вакцины.
Инфекционный бронхит — заболевание кур, с которым трудно бороться. Поскольку возбудителем является вирус, использование противомикробных препаратов для лечения заболевания не эффективно. У выздоровевшей птицы происходят функциональные
изменения репродуктивных органов, поэтому от нее нельзя ожидать высокой яйценоскости.
Ветеринарный врач : Воробьёва О.Г.
спасаем близких от распространения вируса
Катастрофа: у главы семейства течет из носа, он постоянно чихает и жалуется на ломоту во всем теле… А в доме двое детей! Что делать? Ссылать больного на дачу или всем остальным уезжать на неделю к родственникам?
– Во-первых, стоит помнить, что наиболее заразным человек бывает во время инкубационного периода, который при простуде длится 2 – 3 дня и может протекать бессимптомно, – напоминает врач Ирина Рыжкова. – Так что уезжать куда-то зачастую уже поздно. Во-вторых, если соблюдать несложные правила «домашнего карантина», от распространения вирусов близких вполне можно будет спасти.
– Так что уезжать куда-то зачастую уже поздно. Во-вторых, если соблюдать несложные правила «домашнего карантина», от распространения вирусов близких вполне можно будет спасти.
– Заболевшего необходимо сразу изолировать. А если квартира однокомнатная? Тогда отгородите его постель плотной ширмой или шкафом. Выделите больному индивидуальную посуду, предметы туалета. Посуду его стоит иногда кипятить около 10 минут, грязное белье ни в коем случае не складывать вместе с бельем здоровых домочадцев. Термометр рекомендуется протирать водкой или спиртом после каждого применения.
– Не забывайте проветривать квартиру не реже 3 – 4 раз в сутки по 20 – 30 минут. Больного в это время желательно хорошо укутать. Систематическое проветривание уменьшает концентрацию патогенных вирусов в воздухе почти на 80 – 90%.
– Влажная уборка квартиры необходима 2 – 3 раза в день. Эффективно использовать любые моющие средства. Если в доме есть лампа с ультрафиолетовым свечением, продезинфицируйте квартиру.
– Будет очень хорошо, если вы обрызгаете комнату водой, добавив туда ароматические масла. Это не только хорошо обеззараживает воздух, но и улучшает настроение. Кроме того, можно поставить в комнате больного аромалампу. Хорошо борется с вирусами масло чайного дерева и эвкалипта, подойдут также масла любых цитрусовых.
– Такие народные средства, как нарезанная на четвертинки луковица или дольки чеснока на подоконниках, вполне могут стать хорошими дополнительными средствами в борьбе с распространением инфекции. Содержащиеся в них фитонциды губительно действуют на гнилостные и болезнетворные бактерии.
– В нескольких местах комнаты, особенно возле батарей центрального отопления, разместите емкости с водой. Слишком сухой воздух в помещении подсушивает оболочку верхних дыхательных путей, которые в это время у больного особенно ранимы, и значительно ухудшает их функционирование.
– Тем, кто ухаживает за больным, желательно надеть марлевую повязку, которую необходимо менять (либо кипятить и затем утюжить) каждые 4 часа.
Здоровому человеку поможет уберечься от инфекции при общении с больным регулярное промывание носа мыльной водой, полоскание горла и полости рта слаборозовым раствором марганцевокислого калия или содо-йодно-солевым раствором (на 1 л теплой кипяченой воды – 1 ст. л. соды, 1 ст. л. соли, 30 – 40 капель 5% раствора йода). Перед тем как подойти к больному, неплохо вначале смазать ноздри любым жирным кремом либо оксолиновой мазью (2 – 3 раза в день). Ежедневно принимайте комплексные витаминные препараты. И, конечно, часто мойте руки и лицо горячей водой. Уже через 10 минут после попадания на чистую кожу гибнет до 85% всех микробов.
КСТАТИ
Зараза или нет?
В природе существует превеликое множество вирусов. Во внешней среде они быстро гибнут, а вот от человека к человеку передаются очень быстро – воздушно-капельным путем. От момента заражения до проявления первых признаков болезни порой достаточно нескольких часов, иногда не более четырех дней. Но некоторые «заразы» на самом деле таковыми не являются. «Комсомолка» составила свой рейтинг заразных простудных заболеваний.
1-е место: грипп.
Самая заразная болезнь. Вирус способен изменять свой антигенный состав. И у большинства людей будет полностью отсутствовать иммунитет к новому варианту вируса гриппа. 7 дней вирус выделяется при кашле, чиханье и разговоре. У детей – в течение 10 дней, а при осложнениях вирус остается в организме еще дольше.
Больной остается заразным, пока повышена температура, и еще минимум 5 дней после этого. И не меньше 5 дней начиная с момента заражения.
2-е место: парагрипп.
Больной особенно опасен от момента заражения до проявления первых признаков заболевания (около 1 – 3 дней). Парагрипп имеет более легкое течение, чем грипп, дает меньше осложнений.
3-е место: риновирусная и аденовирусная инфекции
Риновирусная инфекция заразна первые 2 – 3 дня. Кашель и насморк, которые могут остаться дольше, менее опасны, чем в начале заболевания.
4-е место: ангина.
Заразность ангины всего лишь меньше 15%. Это ниже, чем у гриппа и других ОРВИ. Но, конечно, большое значение имеет состояние иммунной системы человека.
5-е место: пневмония
В большинстве случаев воспаление легких – это осложнение ОРВИ. Заразна только вирусная пневмония. Обычная пневмония опасна только в первые дни болезни.
6-е место: бронхит, трахеит, ларингит.
В большинстве случаев эти заболевания вызывают те же вирусы, что и простуду, и ОРВИ. Поэтому опасны в первые дни болезни. Кашель может сохраняться еще 1 – 2 недели, но он уже не заразен для окружающих.
ВОЗЬМИ НА ЗАМЕТКУ
Чем опасен чихающий человек…
Насморк передается только воздушно-капельным путем. Не только неприятно, но и опасно общаться с сопливым и громкоговорящим человеком, не желающим прикрывать свое лицо платком. Дело в том, что при громкой речи слизь стекает в глотку и при разговоре и чиханье вырывается наружу. Зачастую это грозит тем, что вы можете подхватить насморк сами. Все будет зависеть от состояния вашего здоровья и иммунитета.
Выброс бактерий при чихании идет на несколько метров. Если у вас насморк, но необходимо выйти из дома, то попробуйте сделать такую мини-ингаляцию: 2 – 3 капли масла мяты накапать на носовой платок и глубоко вдохнуть этот аромат.
При первых признаках насморка очень полезно применять сухое тепло, которым надо хорошенько прогреть переносицу, но не пазухи. Использовать можно мешочек с солью, картошку, сваренную в мундире или вареное яйцо.
… и кашляющий
Уже за сутки до проявления симптомов, например, гриппа, вирус способен выделяться через кашель из организма инфицированного. Поэтому, общаясь с кашляющим на вас человеком, смело делайте ему замечания. По возможности отойдите от него на безопасное расстояние (не менее метра). Если это кто-то из домашних, предложите ему носовой платок или салфетку, в которую он будет кашлять, не распространяя инфекцию.
ИНТЕРЕСНО ЗНАТЬ
…Вирус гриппа способен выживать на металлических предметах (например, столовых приборах) 24 – 48 часов, на руках – 8 – 15 минут, в воздухе 2 – 9 часов. При понижении влажности и температуры воздуха устойчивость вируса возрастает. Поэтому эпидемия гриппа возникает в холодное время года.
При понижении влажности и температуры воздуха устойчивость вируса возрастает. Поэтому эпидемия гриппа возникает в холодное время года.
…На тех предметах, куда могли попасть капельки слизи больного при кашле и чиханье, вирус гриппа живет в течение 2 – 8 часов. Убрать их можно только при влажной уборке с использованием моющих средств.
БУДЬ В КУРСЕ!
Чем опасно самолечение?
Современные лекарства могут творить чудеса, например, быстро снять основные симптомы простуды, снизить температуру, избавить от насморка и кашля. Но надо знать, что лекарства загоняют болезнь внутрь и потому она может затянуться. Повышение температуры, насморк, кашель, отказ от еды – все это способы борьбы организма с возбудителями инфекции. Поэтому не торопитесь быстро встать на ноги. Любое заболевание необходимо вылежать минимум 5 дней.
Сколько длится заразный период у гриппа, ветрянки и других заболеваний
Вот данные по различным инфекционным заболеваниям, которые приводит Национальная служба здравоохранения Великобритании.
Бронхит
Всё зависит от причины бронхита. Чаще всего он развивается из-за тех же вирусов, которые вызывают обычную простуду и грипп. Поэтому вы можете заразить других, пока у вас есть симптомы этих заболеваний.
Простуда
Ей можно заразить окружающих за несколько дней до появления симптомов и до полного их исчезновения. Обычно это около двух недель. Симптомы выражены острее всего в первые два-три дня болезни. Именно в это время риск заразить других особенно высок.
Грипп
Грипп наиболее заразен в течение трёх-семи дней после появления симптомов. У детей и людей со сниженным иммунитетом заразный период может длиться на несколько дней дольше.
Ветрянка
Она заразна уже за день-два до появления сыпи. И заразный период длится, пока все волдыри не покроются корочкой. Обычно это происходит через пять-шесть дней после первого появления сыпи.
Инфекционный мононуклеоз
Этим острым вирусным заболеванием можно заразиться во время инкубационного периода.
У некоторых людей вирус сохраняется в слюне на протяжении нескольких месяцев после выздоровления. А иногда он периодически появляется в слюне в течение нескольких лет.
Корь
Симптомы кори появляются примерно через 10 дней после заражения. Она особенно заразна после появления первых симптомов, но до возникновения сыпи.
Первые симптомы кори — высокая температура, покраснение глаз, чувствительность к свету, признаки простуды (насморк, слезящиеся глаза, распухшие веки). Спустя два-четыре дня появляется сыпь в виде красно-коричневых пятнышек. Обычно они проходят примерно через неделю.
Свинка
При свинке опухают слюнные железы, расположенные рядом с ушами. Заразный период начинается за несколько дней до появления симптомов и продолжается ещё несколько несколько дней после выздоровления.
Краснуха
Она заразна уже за неделю до появления сыпи. После этого заразный период длится ещё три-четыре дня. Оставайтесь дома в течение недели после возникновения сыпи, чтобы не инфицировать других. И старайтесь не контактировать с беременными женщинами.
Опоясывающий лишай
Заразный период продолжается с первого появления сыпи до тех пор, пока не зарубцевался последний пузырёк. Обычно это происходит через 10–14 дней.
Профилактика коклюша
Что такое коклюш?
Коклюш-это опасное инфекционное заболевание дыхательных путей, которое вызывается бактериями Bordatella pertussis (традиционно «коклюшевая палочка»)
Несмотря на широкое использование вакцинации, уровень заболеваемости коклюшем очень высок и в мире, и в России.
Были проведены исследования, в результате которых было установлено, что 40% детей и подростков кашляют именно из-за коклюша. Также, коклюш является причиной хронического кашля у взрослых.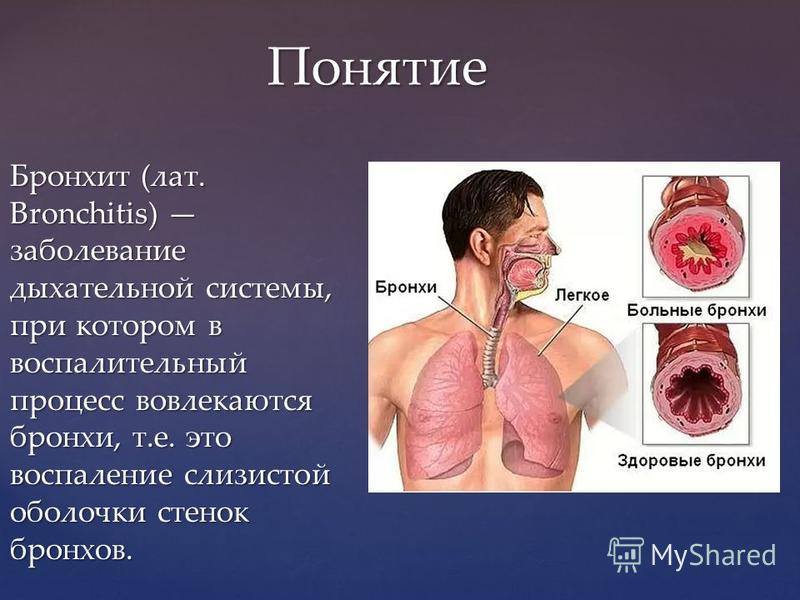 Взрослые, являясь резервуаром инфекции, передают ее младенцам не привитым или не достигшим возраста, когда проводится вакцинация против этого заболевания, либо детям, не привитым по тем или иным причинам.
Взрослые, являясь резервуаром инфекции, передают ее младенцам не привитым или не достигшим возраста, когда проводится вакцинация против этого заболевания, либо детям, не привитым по тем или иным причинам.
Заболеваемость у взрослых в настоящее время составляет около 25% случаев.
Первое описание этой болезни было дано французским врачом Гийеном де Байоном во время парижской эпидемии коклюша в 1538г.
Коклюш крайне заразен.
Источником заражения может быть только человек (больной типичными или атипичными формами коклюша или здоровые бактерионосители).
Путь передачи инфекции – воздушно-капельный. Обильное выделение возбудителя происходит при чихании и кашле.
Инкубационный период при коклюше длится от двух дней до двух, максимум трех недель. Особенно опасны больные с 1 по 25 день заболевания.
Люди обладают очень высокой восприимчивостью к коклюшу.
Как проявляется коклюш.
После того как прошел инкубационный период у больного появляется насморк, чихание, общее недомогание, отсутствие аппетита, легкий кашель, который не уменьшается от противокашлевых средств. Этот период называется катаральный и длится он как обычная простуда 1-2 недели. Постепенно к 3 неделе кашель усиливается, особенно в ночное время. Так начинается новый период лающего кашля. После глубокого свистящего вдоха следует серия коротких кашлевых толчков, напоминающих лай собаки.
Во время приступа кашля лицо больного краснеет или синеет, возможны носовые кровотечения или кровоизлияния в глаза. Кашель заканчивается выделением вязкой мокроты, иногда рвотой. В сутки таких приступов может быть 10-15. Этот период длится от недели до месяца, иногда дольше.
Процесс выздоровления затягивается на несколько месяцев. Постепенно улучшаются сон и аппетит.
Осложнения коклюша.
Осложнения коклюша наиболее часто наблюдаются у детей младше 1 года, с повышенным риском тяжелого течения у недоношенных младенцев.
Очень часто детям требуется госпитализация.
Чаще всего коклюш вызывает осложнения, связанные с развитием вторичной бактериальной инфекции.
• Бактериальная пневмония – наиболее частое осложнение коклюша (является наиболее распространенной причиной смерти от коклюша)
• Бронхит, плеврит, эмфизема, коллапс легкого
• Гипоксия
• У детей раннего возраста коклюш может способствовать развитию бронхоэктатической болезни
• Синусит, отит, разрыв барабанных перепонок
• Обезвоживание
• Кровотечение из носа
• Ушибы
• Грыжи, разрыв мышц брюшной стенки
• Отслойка сетчатки
• Судороги
• Заболевания головного мозга
• Отставание в развитии
Коклюш у взрослых проходит довольно тяжело и может стать причиной серьезных осложнений, таких как судороги и энецфалопатия. У пациентов в возрасте старше 30 лет в 5-9 % случаев возникает пневмония. У женщин старше 50 лет в 34% случаев выявляется недержание мочи, связанное с коклюшем. Кроме того регистрируются такие осложнения, как переломы ребер, паховая грыжа, удушье, грыжа поясничного диска, обмороки.
Симптомы коклюша у взрослых:
• Общее недомогание и снижение аппетита
• Незначительное увеличение температуры тела, которое сопровождается насморком и небольшим кашлем, симптомы начинают быстро усиливаться
• Симптомы у взрослых напоминают симптомы бронхита, поэтому заболевание сразу выявить не очень просто.
• У некоторых болезнь проходит незаметно, что ведет к массовому инфицированию контактных лиц.
Коклюш и беременность
Любое инфекционное заболевание во время беременности может негативно влиять на развитие плода и вызывать у него различные врожденные пороки, например, глухоту, катаракту, поражение сердца, скелета. Так же коклюш может провоцировать выкидыш и рождение мертвого ребенка.
Лечение
Дети младшего возраста наиболее подвержены развитию осложнений коклюша и поэтому их зачастую госпитализируют.
При лечении коклюша назначают антибиотики, так же антигистаминные препараты.
• Обильное питье для предотвращения обезвоживания
• Частые приемы пищи малыми порциями для того чтобы во время рвоты уменьшить потерю жидкости
• В комнате больного должен быть прохладный воздух
• Не допускать наличие в воздухе раздражителей, которые могут спровоцировать приступы кашля (пыль, дым, вещества с резким запахом)
• Частые проветривания
Так как обычно приступы происходят в теплом и душном помещении вечером, больным рекомендуется спать с открытым окном.
Изоляция больного на 25 дней от начала заболевания. Карантин на контактных детей (возраст до 7 лет) на 14 дней.
Профилактика коклюша.
Для детей следует придерживаться графика прививок для АКДС (дифтерия, столбняк, коклюш).
Вакцинация проводится в плановом порядке, в соответствии с Национальным календарем профилактических прививок, утвержденным Приказом Министерства здравоохранения РФ от 2 марта 2014г № 125н.
Согласно Национальному календарю профилактических прививок вакцинация проводится с 3 месяцев жизни трехкратно с интервалом в 1.5 месяца. Ревакцинация через 1.5 года.
Для детей и взрослых, чье состояние не требует госпитализации есть несколько советов, которые позволяют облегчить течение болезни, снизят риск заражения окружающих и ускорят выздоровление:
• Изоляция больного, пока не пройден курс антибиотиков в течение 5 дней.
• Те, кто вступает в контакт с больными, должен носить хирургические маски.
• Хорошая профилактика – мытье рук.
• В очаге инфекции производится тщательная дезинфекция
• Детям до года и непривиым лицам, контактировавшим с больным, проводят экстренную профилактику.
Что нужно знать о коклюше.
Пути передачи коклюша
Коклюш – опасное инфекционное заболевание, основным симптомом которого является приступообразный кашель. Чаще всего этим недугом болеют дети дошкольного возраста, но, несмотря на это, и подростки, и взрослые находятся в группе риска. Чтобы защитить себя и ребенка от этой болезни, следует знать, как передается коклюш и какие профилактические меры наиболее эффективны в борьбе с ним.
Возбудитель и симптомы инфекции
Бактерия бордетелла пертуссис, которая является возбудителем коклюша, очень неустойчивая к условиям окружающей среды. Попадая на предметы обихода при кашле и чихании, инфекция моментально гибнет. Возбудитель не выживает при кипячении и замораживании. Размножается бактерия в человеческом организме при температуре 37С – это самая благоприятная среда для ее жизни.
Учитывая, что коклюш – это инфекционная болезнь, вопрос о том, заразен он или нет, попросту не стоит. Ребенок или взрослый может быть инфицирован уже давно, но не ощущать никаких признаков недомогания во время инкубационного периода. Кашель не сразу начинает душить больного, так как скрытая фаза болезни может длиться от пяти дней до 3 недель. В этот временной промежуток человек не заразен.
Первичная симптоматика заболевания ничем не отличается от обычной простуды: вначале появляется насморк, повышенная температура и общее недомогание. Через пару дней бактерия начинает выделять токсин, который раздражающе действует на бронхи и трахею и вызывает приступообразный кашель. Еще через пять дней начинает выделяться густая прозрачная мокрота.
Способы передачи коклюша
Коклюш передается воздушно-капельным путем – самый распространенный способом передачи респираторных вирусных заболеваний. Пути его передачи следующие:
- При дыхании, кашле и чихании. Для того чтоб произошло инфицирование, контакт с больным должен быть тесным. Если расстояние между болеющим и неинфицированным лицом превышает 2,5 метра, то заболевание передаться не может.
 Бактерии выделяются с частичками слизи и слюны и попадают в дыхательные пути здорового человека.
Бактерии выделяются с частичками слизи и слюны и попадают в дыхательные пути здорового человека. - При поцелуях и объятьях. Это самый верный способ заразиться коклюшем. Слюна больного попадает в ротовую полость здорового человека, а затем в органы дыхания, и таким образом передается этот заразный недуг.
- Недуг может передаваться и через общие столовые приборы. Например, если больная мать поела из одной тарелки с младенцем либо ребенок облизал ложку после того, как ею ел инфицированный человек.
- Возбудитель не живет на поверхности бытовых предметов и, по мнению медиков, передача опасного недуга контактным путем невозможна. Однако в случае если малыш облизал игрушку, на которую прямо перед этим чихнул больной, он может заболеть. Если же частички слизи и слюны высохли и прошло немного времени, то бактерии не смогут передаться, так как просто-напросто тут же погибнут в окружающей среде.
Продолжительность периода заражения
Сколько по времени заразен коклюш? Основной период заражения длится около трех недель. При этом статистика заболеваемости такова:
- на первой неделе болеющий особенно опасен для окружающих, так как в этот временной промежуток бактерия наиболее активна. При контакте с ним в течение острой фазы, уровень заражаемости достигает 100%;
- на второй неделе этот показатель значительно снижается и передается уже 60%;
- на третьей неделе бактерия уже не столь агрессивна, и коклюш передается в этот период только 30% контактирующих с больным людей;
- в последующем, даже если симптомы сохраняются еще долгое время, инфекция может передаваться только 10% окружающих.
При корректной диагностике и своевременном начале приема антибиотиков недуг не передается другим уже на пятый день болезни. Именно поэтому, если в детском коллективе имел место прецедент заболевания коклюшем, зараженный отстраняется от общения со сверстниками минимум на 5 суток при условии, что он получает соответствующее лечение антибиотиком.
Когда в силу каких-либо причин прием таких препаратов противопоказан и лечение проводится более легкими лекарственными средствами – интерферонами, гомеопатией или противовирусными, ребенок не может посещать детское учреждение, пока активная фаза болезни полностью не пройдет, а это минимум 21 день. И в том, и в другом случае, кашель может сохраняться еще не одну неделю, но при этом больной коклюшем уже не заразен.
Степени тяжести болезни
Различают три степени тяжести заболевания:
- легкая форма. Человек кашляет нечасто, приступов кашля от 8-15 в сутки. В целом общее состояние при этом нормальное, а температура повышается максимум до 37,5С;
- среднетяжелая форма. Спазматический кашель донимает от 16-25 раз в сутки, при этом больной очень изможден. Симптомы могут сохраняться долго, а человек продолжает болеть до 5 недель;
- тяжелая форма. Количество приступов достигает 30 раз в сутки. Человек при этом бледнеет, аппетит у него пропадает полностью, он начинает терять массу тела. Спазматический кашель настолько сильный, что способен привести к удушью.
После того как человек поборол болезнь, у него вырабатывается иммунитет, который остается не на всю жизнь, а защищает от заражения всего в течение 3-5 лет. Однако случаи повторного заражения крайне редкие, а если такое произошло, то недуг протекает в более легкой форме.
Профилактика коклюша
Примитивные профилактические меры важны, но малоэффективны. После тесного контакта с больным следует сразу же промыть нос солевым раствором и воспользоваться увлажнителем воздуха, добавив в него несколько капель масла пихты, эвкалипта или можжевельника. Но если объект, распространяющий инфекцию, переживает период острой фазы заболевания, то это вряд ли поможет, так как инфекция передается и проникает внутрь очень быстро.
Единственным действенным средством считается только вакцинация. Первая прививка делается малышу еще в 3-месячном возрасте, после чего проводится еще 2 иммунизации с интервалом в 1,5 месяца. После ребенок подвергается ревакцинации в полтора года.
После ребенок подвергается ревакцинации в полтора года.
Эта профилактическая прививка не дает стопроцентной гарантии того, что малыш не заболеет. Иммунитет после нее вырабатывается в 80-85% случаев, а если привитый заболевает, то переносит недуг гораздо легче, а продолжительность болезни значительно сокращается.
Иммунизация осуществляется несколькими типами вакцин. Все они комбинированные – противококлюшный компонент вводится вместе с противодифтерийным и противостолбнячным в составе одного препарата. Вакцины делятся на цельноклеточные (ТЕТРАКОК, АКДС) и бесклеточные (Инфанрикс, Гексаксим, Пентаксим и т.д.). И те, и другие эффективны, и запускают процесс выработки антител к бактерии-возбудителю коклюшной инфекции.
Если ребенок, не достигший 7-летнего возраста, контактировал с больным, он обследуется на наличие иммунитета к инфекции и клеток вируса в крови. Всем не привитым детям и младенцам до года в этом случае вводится противокоревой иммуноглобулин два дня подряд.
Коклюш опасен тем, что передается даже новорожденным. В этом случае его можно не распознать вовремя, так как у ребенка в возрасте до полугода даже бронхит может протекать без кашля, поэтому есть риск упустить время. У детей до года показатели смертности от этой опасной инфекции особенно высоки.
Бактерия бордетелла пертуссис коварна еще и тем, что у взрослых она может вызывать стертые симптомы, а это нередко мешает своевременно обнаружить заболевание. Такие случаи особенно опасны, так как не получающие адекватного лечения больные передают инфекцию окружающим в транспорте, в семье и на работе и при этом долгое время не подозревают, в чем кроется причина их недомогания.
Анализируя приведенную выше информацию можно подытожить, что коклюш – это тяжелое инфекционное заболевание, которое передается единственным путем – воздушно-капельным. Бактерия-возбудитель этой опасной инфекции не способна выжить вне человеческого организма, поэтому она не остается на предметах обихода.
Единственный верный способ уберечь себя и окружающих от коклюша – это вакцинация. Болезнь очень заразна, особенно на первых неделях, поэтому стандартные меры профилактики тут практически бессильны.
https://pulmono.ru/gorlo/koklyush/puti-peredachi-koklyusha
Инфекционный бронхит у кур
Инфекционный бронхит (ИБ) – это острое высококонтагиозное респираторное заболевание кур, вызываемое вирусом инфекционного бронхита (ИБК), разновидностью коронавируса. Существует несколько различных серотипов и штаммов IBV, которые встречаются во всем мире.IBV-инфекция первоначально возникает в дыхательных путях, причем основной мишенью является трахея. Он остается там около недели, где он воспроизводится и вызывает различные повреждения эпителия, предрасполагая птиц к вторичным инфекциям патогенными бактериями, особенно E.coli и Mycoplasma .
В зависимости от штамма вируса он может мигрировать из трахеи в другие части тела курицы, чаще всего в почки, репродуктивную систему (яйцеводы курицы и семенники петуха) или пищеварительный тракт.
Трансмиссия
Вирус ИБ передается при вдыхании или прямом контакте с инфицированными птицами или косвенно в результате контакта с зараженной окружающей средой. Капли, содержащие вирус, выделяются при кашле или чихании, а также выделяются с фекалиями или яйцами инфицированных птиц.Вирус не передается от курицы к цыпленку через яйцо. После выздоровления куры могут оставаться носителями и распространять вирус до 15-20 недель.
Курс болезней
У ИБ короткий инкубационный период. В зараженном стаде у всех птиц клинические признаки обычно появляются в течение 24-48 часов. Клиническое заболевание обычно длится 7 дней.
Клинические признаки
Клинические признаки включают водянистый или пенистый экссудат в глазах, кашель, трахеальные хрипы, выделения из носа и чихание.Молодые цыплята обычно выглядят подавленными и ютятся возле источника тепла.
 В некоторых случаях у них может развиться тяжелая респираторная недостаточность. Инфекция у очень молодых цыплят может привести к развитию кистозных яйцеводов.
В некоторых случаях у них может развиться тяжелая респираторная недостаточность. Инфекция у очень молодых цыплят может привести к развитию кистозных яйцеводов.У взрослых кур, активно откладывающих яйца, часто наблюдается резкое падение яйценоскости на 10–14 дней. Они также могут откладывать тонкую, морщинистую или шероховатую яичную скорлупу с жидким водянистым белком. Яйца с коричневой скорлупой часто теряют пигмент.
Неосложненные случаи респираторного заболевания обычно проходят в течение пары недель.Однако повреждение дыхательной системы, вызванное инфекцией, часто приводит к сложным сочетанным инфекциям с условно-патогенными бактериями. Кроме того, в зависимости от штамма вируса, после репликации вируса в трахее он распространяется на другие органы. Если он распространяется на почки, у пораженных птиц часто развивается мочекаменная болезнь и почечная недостаточность. Когда он распространяется на репродуктивные органы, он может вызвать осложнения и нарушения, связанные с яйцекладкой.Диагностика
В течение первой недели заражения можно взять мазок из трахеи пораженной птицы и отправить в ветеринарную диагностическую лабораторию для подтверждения ИБК.По истечении первой недели предпочтительнее использовать мазки из клоаки. Если курица умерла, образцы можно взять из трахеи, миндалин слепой кишки, легких, почек, яичек или яйцевода.
Профилактика
Существует несколько типов вакцин против ИБК, которые широко используются в коммерческом птицеводстве. Куры-несушки и производители бройлеров сначала получают живую аттенуированную вакцину, которую вводят молодым цыплятам в массовом порядке путем распыления или с питьевой водой. Затем через 4-6 недель вводят инактивированную вакцину в качестве ревакцинации.
PoultryWorld – Инфекционный бронхит
Происхождение: По всему миру.
Пораженные виды: Только куры.
Возраст пострадавших: Наиболее восприимчивы все, молодые.
Причины: Вирус инфекционного бронхита является коронавирусом и является наиболее заразным респираторным респираторным вирусом домашней птицы.
Эффекты: Чихание и слезотечение появляются на ранней стадии, за ними следуют депрессия, кашель и выделения из носа. Птицы-производители демонстрируют снижение яйценоскости или прибавки в весе.У яиц плохое качество скорлупы и водянистый альбумин. Слои также имеют взъерошенные перья и мокрый помет. Также наблюдаются хрипы в трахее, затрудненное дыхание и уратный понос.
Причины
Это вызвано коронавирусом.
Способ передачи
Очень заразно и быстро распространяется с помощью аэрозоля. Зараженные фекалии, мусор и фомиты распространяют вирус.Это одно из самых заразных вирусных респираторных заболеваний домашней птицы.
Клинические признаки
Чихание и слезотечение появляются на ранней стадии, за ними следует депрессия, кашель и выделения из носа. Плохое качество яичной скорлупы, водянистый белок, взъерошенные перья и мокрый помет наблюдаются у птиц-несушек. Также наблюдается снижение яйценоскости и прибавки в весе, хрипы в трахее, затрудненное дыхание и уратная диарея.
Посмертные поражения
Наблюдается экссудат в трахее, носовых раковинах, утолщенные или пенистые воздушные мешочки и пневмония.У молодых птиц деформированные (непатентованные и гипогландулярные) яйцеклетки и яйцеводы, а также желток в брюшной полости. Иногда обнаруживаются опухшие бледные почки с уратами.
Диагностика
Нейтрализация вируса, тест HI или ELISA для измерения антител полезны. Выделение вируса в эмбрионах или культурах клеток почек курицы и / или ПЦР необходимы для окончательного диагноза. Керлинг, задержка роста и гибель эмбрионов можно наблюдать в инокулированных яйцеклетках.Респираторные признаки и поражения с поражением почек позволяют предположить диагноз.
Лечение и контроль
P относительно v e n t io n
Вакцинируйте птиц с несколькими серотипами (в зависимости от региона) для защиты широкого спектра действия.
На международном уровне обычно используются единичные вакцины (h220 или клонированный тип MA5) или вакцины Mass-Conn.В США различные вакцины также содержат подтипы Ga или Ark. Их вводят распылением в дневном возрасте в инкубатории или в поле с питьевой водой или распылением. Подтипы вирусов можно определить с помощью ПЦР в реальном времени или с использованием моноклональных антител и ELISA.
Эволюция вируса инфекционного бронхита в полевых условиях после введения гомологичной вакцины | Ветеринарные исследования
Jackwood MW, Hall D, Handel A (2012) Молекулярная эволюция и появление птичьих гаммакоронавирусов.Infect Genet Evol 12: 1305–1311
CAS PubMed Статья PubMed Central Google ученый
King AMQ, Lefkowitz EJ, Mushegian AR, Adams MJ, Dutilh BE, Gorbalenya AE, Harrach B, Harrison RL, Junglen S, Knowles NJ, Kropinski AM, Krupovic M, Kuhn JH, Nibert ML, Rubino L , Sabanadzovic S, Sanfaçon H, Siddell SG, Simmonds P, Varsani A, Zerbini FM, Davison AJ (2018) Изменения в таксономии и Международный кодекс классификации и номенклатуры вирусов, ратифицированные Международным комитетом по таксономии вирусов (2018).Arch Virol 163: 2601–2631
CAS PubMed Статья PubMed Central Google ученый

Кавана Д. (2007) Коронавирус птичьего инфекционного бронхита. Vet Res 38: 281–297
CAS PubMed Статья PubMed Central Google ученый
Tan L, Liao Y, Fan J, Zhang Y, Mao X, Sun Y, Song C, Qiu X, Meng C, Ding C (2016) Прогнозирование и идентификация новых эпитопов CTL, полученных из белка S1 IBV, в курица.Вакцина 34: 380–386
CAS PubMed Статья PubMed Central Google ученый
Wickramasinghe INA, van Beurden SJ, Weerts EAWS, Verheije MH (2014) Спайк-белок птичьего коронавируса. Virus Res 194: 37–48
CAS PubMed Статья PubMed Central Google ученый
Valastro V, Holmes EC, Britton P, Fusaro A, Jackwood MW, Cattoli G, Monne I (2016) Филогения вируса инфекционного бронхита на основе гена S1: попытка согласовать классификацию вирусов.Infect Genet Evol 39: 349–364
PubMed Статья PubMed Central Google ученый
Moreno A, Franzo G, Massi P, Tosi G, Blanco A, Antilles N, Biarnes M, Majó N, Nofrarías M, Dolz R, Lelli D, Sozzi E, Lavazza A, Cecchinato M (2017) Новый вариант вируса инфекционного бронхита, возникший в результате событий рекомбинации в Италии и Испании. Авиан Патол 46: 28–35
PubMed Статья PubMed Central Google ученый
Duffy S, Shackelton LA, Holmes EC (2008) Темпы эволюционных изменений вирусов: закономерности и детерминанты.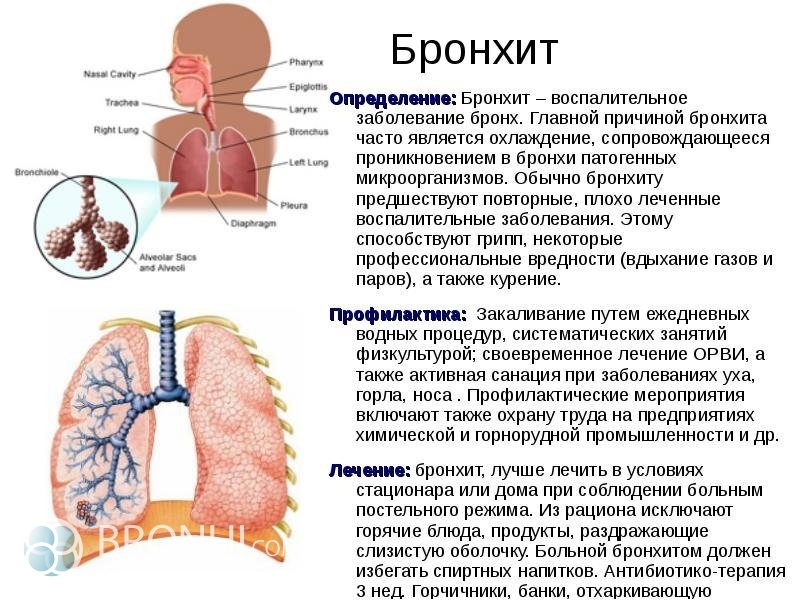 Nat Rev Genet 9: 267–276
Nat Rev Genet 9: 267–276
CAS PubMed Статья PubMed Central Google ученый
de Wit JJS, Cook JKA, van der Heijden HMJF (2011) Варианты вируса инфекционного бронхита: обзор истории, текущей ситуации и мер контроля. Avian Pathol 40: 223–235
Статья Google ученый
Bande F, Arshad SS, Hair Bejo M, Moeini H, Omar AR (2015) Прогресс и проблемы в разработке вакцин против птичьего инфекционного бронхита. J Immunol Res 2015: 424860
PubMed PubMed Central Статья Google ученый
Cook JKA, Orbell SJ, Woods MA, Huggins MB (1999) Широта защиты дыхательных путей, обеспечиваемая различными живыми аттенуированными вакцинами против инфекционного бронхита от заражения вирусами инфекционного бронхита гетерологичных серотипов.Авиан Патол 28: 477–485
CAS PubMed Статья PubMed Central Google ученый
Holmes EC (2009) Эволюция и появление РНК-вирусов. Oxford University Press, Нью-Йорк
Google ученый
Рид А.Ф., Байгент С.Дж., Пауэрс С., Кгосана Л.Б., Блэквелл Л., Смит Л.П., Кеннеди Д.А., Уолкден-Браун С.В., Наир В.К. (2015) Несовершенная вакцинация может усилить передачу высоковирулентных патогенов.PLoS Biol 13: e1002198
PubMed PubMed Central Статья CAS Google ученый
Гандон С., Маккиннон М.Дж., Ни С., Рид А.Ф. (2001) Несовершенные вакцины и эволюция вирулентности патогенов. Nature 414: 751–756
CAS PubMed Статья Google ученый
FitzSimons D, François G, Hall A, McMahon B, Meheus A, Zanetti A, Duval B, Jilg W, Böcher WO, Lu SN, Akarca U, Lavanchy D, Goldstein S, Banatvala J, Damme PV (2005) Долгосрочная эффективность вакцины против гепатита В, политика бустерных доз и влияние мутантов вируса гепатита В.Вакцина 23: 4158–4166
CAS PubMed Статья Google ученый
Cecchinato M, Catelli E, Lupini C, Ricchizzi E, Clubbe J, Battilani M, Naylor CJ (2010) Участие белка прикрепления птичьего метапневмовируса (AMPV) в вероятной эволюции вируса одновременно с массовым внедрением живой вакцины. Vet Microbiol 146: 24–34
CAS PubMed Статья Google ученый
Franzo G, Tucciarone CM, Cecchinato M, Drigo M (2016) Эволюция цирковируса свиней типа 2 (PCV2) до и после внедрения вакцинации: крупномасштабное эпидемиологическое исследование. Научный представитель 6: 39458
CAS PubMed PubMed Central Статья Google ученый
Рид AF, Mackinnon MJ (2010) Эволюция патогенов в вакцинированном мире. Evol Heal Dis 2: 139–152
Google ученый

Franzo G, Massi P, Tucciarone CM, Barbieri I, Tosi G, Fiorentini L, Ciccozzi M, Lavazza A, Cecchinato M, Moreno A (2017) Мыслить глобально, действовать локально: филодинамическая реконструкция генотипа QX вируса инфекционного бронхита (IBV) (Линия GI-19) выявляет различную популяционную динамику и модели распространения при оценке по разным эпидемиологическим шкалам. PLoS ONE 12: e0184401
PubMed PubMed Central Статья CAS Google ученый
Игнятович Дж., Сапатс С. (2005) Идентификация ранее неизвестных антигенных эпитопов на белках S и N вируса птичьего инфекционного бронхита. Arch Virol 150: 1813–1831
CAS PubMed Статья PubMed Central Google ученый
Franzo G, Tucciarone CM, Blanco A, Nofrarías M, Biarnés M, Cortey M, Majó N, Catelli E, Cecchinato M (2016) Влияние различных стратегий вакцинации на динамику популяции IBV QX и клинические вспышки.Вакцина 34: 5670–5676
PubMed Статья PubMed Central Google ученый
Franzo G, Naylor CJ, Lupini C, Drigo M, Catelli E, Listorti V, Pesente P, Giovanardi D, Morandini E, Cecchinato M (2014) Продолжение использования вакцины IBV 793B требует переоценки после ее отмены к исчезновению генотипа. Vaccine 32: 6765–6767
PubMed Статья PubMed Central Google ученый
Cavanagh D, Mawditt K, Britton P, Naylor CJ (1999) Продольные полевые исследования вируса инфекционного бронхита и птичьего пневмовируса у бройлеров с использованием типоспецифичных полимеразных цепных реакций. Авиан Патол 28: 593–605
Авиан Патол 28: 593–605
CAS Статья Google ученый
Като К., Стэндли Д.М. (2013) Программное обеспечение MAFFT для множественного выравнивания последовательностей, версия 7: улучшения производительности и удобства использования. Mol Biol Evol 30: 772–780
CAS PubMed PubMed Central Статья Google ученый
Trifinopoulos J, Nguyen LT, von Haeseler A, Minh BQ (2016) W-IQ-TREE: быстрый онлайн-филогенетический инструмент для анализа максимального правдоподобия. Нуклеиновые кислоты Res 44: W232–235
CAS PubMed PubMed Central Статья Google ученый
Darriba D, Taboada GL, Doallo R, Posada D (2012) JModelTest 2: больше моделей, новая эвристика и параллельные вычисления. Nat Methods 9: 772
CAS PubMed PubMed Central Статья Google ученый
Abascal F, Zardoya R, Telford MJ (2010) TranslatorX: множественное выравнивание нуклеотидных последовательностей, управляемое трансляциями аминокислот. Nucleic Acids Res 38 (Suppl 2): W7–13
CAS. PubMed PubMed Central Статья Google ученый
Мартин Д.П., Мюррелл Б., Голден М., Хосал А., Мухир Б. (2015) RDP4: обнаружение и анализ паттернов рекомбинации в геномах вирусов. Virus Evol 1: vev003
PubMed PubMed Central Статья Google ученый
Косаковский пруд С.Л., Мороз С.Д., Муза С.В. (2005) HyPhy: проверка гипотез с использованием филогении. Биоинформатика 21: 676–679
Статья CAS Google ученый
Косаковский пруд С.Л., Фрост С.Д. (2005) В конце концов, не такие уж и разные: сравнение методов определения селектируемых аминокислотных сайтов. Mol Biol Evol 22: 1208–1222
PubMed Статья CAS PubMed Central Google ученый
Murrell B, Moola S, Mabona A, Weighill T, Sheward D, Kosakovsky Pond SL, Scheffler K (2013) FUBAR: быстрое и неограниченное байесовское приближение для умозаключения выбора. Mol Biol Evol 30: 1196–1205
CAS PubMed PubMed Central Статья Google ученый
Murrell B, Wertheim JO, Moola S, Weighill T, Scheffler K, Kosakovsky Pond SL (2012) Выявление отдельных участков, подлежащих эпизодическому диверсификационному отбору.PLoS Genet 8: e1002764
CAS PubMed PubMed Central Статья Google ученый
Murrell B, de Oliveira T, Seebregts C, Kosakovsky Pond SL, Scheffler K (2012) Моделирование лекарственной устойчивости ВИЧ-1 как эпизодического направленного отбора. PLoS Comput Biol 8: e1002507
CAS PubMed PubMed Central Статья Google ученый
Waterhouse A, Bertoni M, Bienert S, Studer G, Tauriello G, Gumienny R, Heer FT, de Beer TAP, Rempfer C, Bordoli L, Lepore R, Schwede T (2018) ШВЕЙЦАРСКАЯ МОДЕЛЬ: гомология моделирование белковых структур и комплексов. Nucleic Acids Res 46: W296–303
Nucleic Acids Res 46: W296–303
CAS. PubMed PubMed Central Статья Google ученый
Петтерсен Э.Ф., Годдард Т.Д., Хуанг С.К., Коуч Г.С., Гринблатт Д.М., Менг ЕС, Феррин Т.Э. (2004) Система визуализации UCSF Chimera-A для поисковых исследований и анализа. J Comput Chem 25: 1605–1612
CAS Статья Google ученый
Shang J, Zheng Y, Yang Y, Liu C, Geng Q, Luo C, Zhang W, Li F (2018) Крио-ЭМ-структура белка шипа коронавируса инфекционного бронхита показывает структурную и функциональную эволюцию шипа коронавируса белки.PLoS Pathog 14: e1007009
PubMed PubMed Central Статья CAS Google ученый
Гандон С., День Т (2007) Эволюционная эпидемиология вакцинации. Интерфейс J R Soc 4: 803–817
PubMed PubMed Central Статья Google ученый
Уилсон Б.А., Гаруд Н.Р., Федер А.Ф., Ассаф З.Дж., Пеннингс П.С. (2016) Популяционная генетика эволюции лекарственной устойчивости в естественных популяциях вирусных, бактериальных и эукариотических патогенов.Мол Экол 25: 42–66
CAS PubMed Статья Google ученый
Мойя А., Холмс Е.С., Гонсалес-Канделас Ф. (2004) Популяционная генетика и эволюционная эпидемиология РНК-вирусов. Nat Rev Microbiol 2: 279–288
CAS PubMed Статья Google ученый
Kant A, Koch G, Van Roozelaar DJ, Kusters JG, Poelwijk FAJ, Van der Zeijst BAM (1992) Расположение антигенных сайтов, определяемых нейтрализующими моноклональными антителами на гликополипептиде вируса птичьего инфекционного бронхита S1.J Gen Virol 73: 591–596
CAS PubMed Статья PubMed Central Google ученый
Zou N, Xia J, Wang F, Duan Z, Miao D, Yan Q, Cao S, Wen X, Liu P, Huang Y (2015) Два новых нейтрализующих антигенных эпитопа белка субъединицы s1 QX-подобный штамм вируса птичьего инфекционного бронхита Sczy3, выявленный с использованием библиотеки пептидов фагового дисплея. Vet Immunol Immunopathol 168: 49–55
CAS PubMed Статья PubMed Central Google ученый
Terregino C, Toffan A, Serena Beato M, De Nardi R, Vascellari M, Meini A, Ortali G, Mancin M, Capua I (2008) Патогенность штамма QX вируса инфекционного бронхита у свободных от конкретных патогенов и коммерческих цыплят-бройлеров, и оценка защиты, вызванной программой вакцинации на основе серотипов Ma5 и 4/91. Авиан Патол 37: 487–493
CAS PubMed Статья PubMed Central Google ученый
de Wit JJ, Swart WAJM, Fabri THF (2010) Эффективность вакцинации против вируса инфекционного бронхита в полевых условиях: связь между ответом на IgM α-IBV, параметрами защиты и параметрами применения вакцины. Авиан Патол 39: 123–131
PubMed Статья CAS PubMed Central Google ученый
Вирулентный вирус птичьего инфекционного бронхита, Китайская Народная Республика – Том 18, номер 12 – декабрь 2012 г.
 – Журнал Emerging Infectious Diseases
– Журнал Emerging Infectious DiseasesСведения об авторах: Сведения об авторах: Ключевая лаборатория эпидемиологии животных и зоонозов, Министерство сельского хозяйства, Китайский сельскохозяйственный университет, Пекин, Китайская Народная Республика (J.Л. Фэн, Ю. X. Ху, J.X. Zhao, G.Z. Чжан); Животноводческая и ветеринарная станция Пекина, Пекин (Z.J. Ma, Q. Yu, X.D. Liu)
Вирус инфекционного бронхита птиц (IBV), член семейства Coronaviridae, отряд Nidovirales, вызывает очень заразное респираторное, а иногда и мочеполовое заболевание цыплят, которое характеризуется респираторными симптомами, нефритом или снижением яйценоскости и качества яиц у кур-несушек. IBV является основным патогеном домашней птицы, который является эндемичным во всем мире и приводит к серьезным экономическим потерям.
Основным методом защиты домашней птицы от инфекционного бронхита (ИБ) является введение живых или убитых вакцин. Однако, несмотря на интенсивные программы вакцинации во многих странах, ИБ по-прежнему наносит экономический ущерб птицеводству ( 1 – 5 ). Вспышки ИБ часто возникают из-за инфекций штаммами, серологически отличными от используемых для вакцинации ( 2 , 6 ). С тех пор, как ИБК был впервые описан в 1931 году, появилось большое количество серотипов или вариантов, и некоторые из них стали эндемичными во всем мире ( 4 , 7 – 12 ).Хорошо известно, что перекрестная защита между различными серотипами IBV незначительна или отсутствует ( 13 ). Следовательно, постоянное определение эпидемического серотипа и производство новых поколений вакцин имеют решающее значение для борьбы с ИБ в каждом географическом регионе или стране.
IBV был впервые выделен в Китайской Народной Республике в начале 1980-х годов; с тех пор живые аттенуированные вакцины против ИБ (например, h220, H52, Ma5, W93 и 28/86) Массачусетского типа (например, h220, H52, Ma5, и 28/86) и вакцины инактивированной убитой масляной эмульсии используются для предотвращения и контроля заболевания. Однако эпидемиологически установлено, что серотипы используемых вакцин отличаются от серотипов преобладающих изолятов IBV в Китае, которые образуют 2 большие группы уникальных штаммов, названных штаммами, подобными A2 и QXIBV ( 5 , 6 , 14 – 18 ). Таким образом, из-за отсутствия вакцины против эндемичных штаммов ИБК в Китае инфекция ИБК остается проблемой в птицеводстве Китая.
Однако эпидемиологически установлено, что серотипы используемых вакцин отличаются от серотипов преобладающих изолятов IBV в Китае, которые образуют 2 большие группы уникальных штаммов, названных штаммами, подобными A2 и QXIBV ( 5 , 6 , 14 – 18 ). Таким образом, из-за отсутствия вакцины против эндемичных штаммов ИБК в Китае инфекция ИБК остается проблемой в птицеводстве Китая.
Мы выделили вирулентный штамм ИБК от 30-дневных цыплят-бройлеров в провинции Юньнань и охарактеризовали его, используя выравнивание последовательностей, филогенетический анализ, исследования патогенности, гистопатологическое наблюдение и иммуногистохимическое (ИГХ) исследование.Результаты показывают, что изолят генетически подобен большинству распространенных штаммов IBV, обнаруженных в Китае. Мы также показали, что изолят YN IBV проявляет более серьезную патогенность, чем ранее охарактеризованные штаммы в Китае.
Вирус и животные
Штамм YN был выделен в 2005 г. от 30-дневных бройлеров, которым вводили окулоназально вакцины против ИБК h220 на 1, 7 и 21 день соответственно. У больных птиц были респираторные симптомы, тяжелое заболевание почек и уровень смертности 30%.Вирус размножали в 10-дневных куриных яйцах, свободных от специфических патогенов (SPF), при 37 ° C в течение 40 часов. Аллантоисную жидкость выделяли из инфицированных яиц и хранили при -80 ° C. Все исследования на животных были одобрены Пекинским административным комитетом лабораторных животных под руководством Пекинской ассоциации науки и технологий (идентификатор разрешения – SYXK [Пекин] 2007–0023).
Экстракция вирусной РНК, ПЦР с обратной транскрипцией и секвенирование ДНК
На основе нуклеотидных последовательностей IBV (M41, A2, BJ, ZJ971 и SC021202; инвентарные номера GenBank.DQ834384, AY043312, AY319651, AF352313 и AY237817 соответственно), 22 пары специфических праймеров (таблица 1) были разработаны для амплификации полного генома (за исключением 5′- и 3′-концевых сегментов) штамма YN. Вирусную РНК экстрагировали из инфицированной вирусом аллантоисной жидкости с использованием Trizol Reagent (Invitrogen, Carlsbad, CA, USA) в соответствии с инструкциями производителя. Обратную транскрипцию (RT) выполняли при 37 ° C в течение 1 ч с использованием 3 мкг общей РНК, 1 мкл случайных праймеров (500 мкг / мл, случайные гексадеоксинуклеотиды; Promega, Мэдисон, Висконсин, США) и 0.5 мкл M-MLV RT (200 Ед / мкл) (Promega). Для ПЦР 1 ед. ДНК-полимеразы Taq (Promega) и 10 пмоль каждого праймера добавляли к 100 нг кДНК в качестве матрицы в общем реакционном объеме 20 мкл. ПЦР проводили при 95 ° C в течение 5 мин, затем следовали 35 циклов денатурации (95 ° C, 45 с), отжига (53 ° C или 55 ° C, 45 с) и полимеризации (72 ° C, 2 мин). , а стадию постполимеризации проводили при 72 ° C в течение 10 мин. Амплифицированные последовательности анализировали электрофорезом в 1,2% агарозном геле.
Вирусную РНК экстрагировали из инфицированной вирусом аллантоисной жидкости с использованием Trizol Reagent (Invitrogen, Carlsbad, CA, USA) в соответствии с инструкциями производителя. Обратную транскрипцию (RT) выполняли при 37 ° C в течение 1 ч с использованием 3 мкг общей РНК, 1 мкл случайных праймеров (500 мкг / мл, случайные гексадеоксинуклеотиды; Promega, Мэдисон, Висконсин, США) и 0.5 мкл M-MLV RT (200 Ед / мкл) (Promega). Для ПЦР 1 ед. ДНК-полимеразы Taq (Promega) и 10 пмоль каждого праймера добавляли к 100 нг кДНК в качестве матрицы в общем реакционном объеме 20 мкл. ПЦР проводили при 95 ° C в течение 5 мин, затем следовали 35 циклов денатурации (95 ° C, 45 с), отжига (53 ° C или 55 ° C, 45 с) и полимеризации (72 ° C, 2 мин). , а стадию постполимеризации проводили при 72 ° C в течение 10 мин. Амплифицированные последовательности анализировали электрофорезом в 1,2% агарозном геле.
Амплифицированные продукты ДНК очищали с использованием набора для экстракции ДНК из геля AxyPrep (AxyGEN, Union City, CA, USA), и очищенные продукты лигировали с системой pMD18-T Easy Vector (Promega).Рекомбинантные плазмиды экстрагировали из положительных клонов с помощью E.Z.N.A.R. Набор Plasmid Miniprep Kit (Omega, Norcross, GA, USA), идентифицированный с помощью рестрикционного расщепления Eco RI (Promega). Реакции нуклеотидного секвенирования были выполнены Sunbio Biotech (Bejjing, China).
Последовательность и филогенетический анализ
Полный геном или последовательности гена S1 IBV были получены из GenBank, и эти последовательности IBV и полная кодирующая последовательность изолята YN IBV были выровнены и проанализированы с использованием алгоритма множественного выравнивания ClustalW в программе MegAlign пакета программ DNASTAR (версия 3.1; DNAstar, Мэдисон, Висконсин, США).
Филогенетическое дерево гена S1 или полных геномных последовательностей было построено с использованием программного обеспечения MEGA4.0 (www.megasoftware. net) методом объединения соседей (1000 повторений начальной загрузки). Эволюционные расстояния рассчитывались методом попарных расстояний с использованием модели максимального совокупного правдоподобия ( 19 ).
net) методом объединения соседей (1000 повторений начальной загрузки). Эволюционные расстояния рассчитывались методом попарных расстояний с использованием модели максимального совокупного правдоподобия ( 19 ).
Клинико-патологическое обследование цыплят
Сорок 30-дневных цыплят белого леггорна SPF случайным образом делили на 2 группы по 20 птиц в каждой.Всем птицам в 1 группе вводили интраназально не менее 10 5 50% инфекционной дозы яиц на 0,2 мл штамма IBV YN. Птиц из другой группы инокулировали 0,2 мл фосфатно-солевого буфера (PBS) в качестве неинфицированного контроля. Птиц содержали в изоляторах, им давали корм и воду ad libitum.
Всех птиц ежедневно наблюдали на предмет признаков болезни (например, растрепанные перья, депрессию, респираторные симптомы или диарею) и смерти в течение 21 дня. Наблюдались общие патологические изменения, и ткани (трахея, легкие, почки, бурса, печень и мозг) были собраны для ОТ-ПЦР от 10 случайно выбранных кур, которые умерли в течение 4–10 дней после инокуляции, выделения вируса, гистопатологического исследования и ИГХ. анализы.Образцы сыворотки, взятые у выживших птиц, тестировали на антитела к IBV с помощью коммерческого набора для ELISA (IDEXX Laboratories, Westbrook, ME, США). Конечные титры рассчитывали в соответствии с инструкциями производителя, и титры> 396 считались положительными для антител против IBV.
ОТ-ПЦР образцов тканей
Образцы тканей умерших птиц были собраны и использованы для ОТ-ПЦР для определения тканевого распределения вируса. Суммарную РНК получали с использованием реагента Trizol (Invitrogen), как рекомендовано для образцов тканей.ОТ-ПЦР выполняли, как описано выше, с использованием пары праймеров (прямой: 5′-TTTTGGTGATGACAAGATGAA-3 ‘; обратный: 5′-CGCATTGTTCCTCTCCTC-3’), которые амплифицируют и детектируют фрагмент 403 п.н. гена S1 IBV. Продукты ПЦР анализировали на 1,5% агарозных гелях.
Повторное выделение вируса из образцов инфицированных тканей
Образцы ткани, собранные после контрольного заражения, использовали для выделения вируса. Вкратце, по крайней мере 6 эмбрионов SPF были засеяны через аллантоисную полость, причем каждый образец содержал 10 000 Ед / мл пенициллина и 10 000 мкг / мл стрептомицина (0.2 мл / яйцо). Яйца просвечивали ежедневно, и аллантоисные жидкости от 3 инокулированных эмбрионов собирали через 48 часов после инокуляции для амплификации ОТ-ПЦР. Оставшиеся эмбрионы исследовали через 6 дней после инокуляции на предмет характерных повреждений IBV, таких как карликовость, задержка роста или скручивание эмбрионов.
Вкратце, по крайней мере 6 эмбрионов SPF были засеяны через аллантоисную полость, причем каждый образец содержал 10 000 Ед / мл пенициллина и 10 000 мкг / мл стрептомицина (0.2 мл / яйцо). Яйца просвечивали ежедневно, и аллантоисные жидкости от 3 инокулированных эмбрионов собирали через 48 часов после инокуляции для амплификации ОТ-ПЦР. Оставшиеся эмбрионы исследовали через 6 дней после инокуляции на предмет характерных повреждений IBV, таких как карликовость, задержка роста или скручивание эмбрионов.
Гистопатология
Ткани (трахея, легкое, почка, бурса, печень и мозг) собирали и фиксировали погружением в 10% нейтральный формалин при комнатной температуре на 48 часов. Затем ткань обычно обрабатывали, заливали парафином и разрезали на срезы 5 мкм.Срезы окрашивали гематоксилином и эозином и исследовали с помощью световой микроскопии на предмет повреждений, вызванных инфекцией IBV.
Иммуногистохимия
Все взятые образцы тканей были исследованы методом ИГХ для обнаружения вирусного антигена. Вкратце, срезы ткани размером 5 мкм подвергали поиску антигена ( 20 ) и затем инкубировали в 10% нормальной козьей сыворотке в PBS в течение 30 минут для блокирования участков неспецифического связывания. Затем слайды инкубировали с куриной гипериммунной сывороткой против IBV в разведении 1: 500 в PBS в течение 2 часов с последующей инкубацией с кроличьим куриным IgG, конъюгированным с пероксидазой хрена, в течение 1 часа.Реакцию визуализировали добавлением 3,3-диаминобензидина (DAB; Sigma, Сент-Луис, Миссури, США) в течение 15 минут. После окрашивания ИГХ срезы контрастировали гематоксилином, сушили на воздухе и исследовали с помощью световой микроскопии.
Секвенирование генома
Полная последовательность генома (за исключением 5′- и 3′-концевых сегментов) штамма YN была получена путем сборки 22 перекрывающихся последовательностей в диапазоне от 856 до 1686 пар оснований с помощью программного обеспечения DNAstar. Нуклеотидные последовательности были отправлены в GenBank под номером доступа.JF893452. Полные геномные последовательности (за исключением 5′- и 3′-концевых сегментов) изолята YN содержали 27 635 нуклеотидов, которые предположительно содержат 6 различных генов, каждый из которых содержит одну или несколько открытых рамок считывания.
Нуклеотидные последовательности были отправлены в GenBank под номером доступа.JF893452. Полные геномные последовательности (за исключением 5′- и 3′-концевых сегментов) изолята YN содержали 27 635 нуклеотидов, которые предположительно содержат 6 различных генов, каждый из которых содержит одну или несколько открытых рамок считывания.
Филогенетический анализ
Рисунок 1
Рисунок 1.. Филогенетическое дерево вируса инфекционного бронхита птиц на основе нуклеотидных последовательностей полного генома (A), гена S1 (B), гена S2 (C), гена E (D), гена M (E) и …
Филогенетические деревья для генома и каждого гена IBV подкрепляли результаты секвенирования вирусных нуклеотидов, предполагая, что изолят YN имеет непосредственного предка штамма SC021202 (рис. 1).Чтобы выяснить филогенетические отношения между штаммами China IBV, мы дополнительно проанализировали гены S1 70 IBV, включая 51 китайский изолят и 19 стандартных штаммов или вакцинных штаммов (рис. 1, панель B). Данные показали, что китайские изоляты можно разделить на 3 отдельные генетические группы или генотипы. Группа I включала 41 из 51 полевого изолята, которые были условно названы А2-подобными вирусами. Четыре полевых изолята China были включены в группу II, которые предварительно были названы LSD-подобными вирусами. Китайская группа III включала 6 изолятов, которые были сгруппированы по серотипу Массачусетса.Эти результаты показали, что в птичьих стадах в Китае существовало по крайней мере 3 отдельные группы, а A2-подобные и M41-подобные вирусы были в основном ответственны за панзоотик IB, что согласуется с результатами наших предыдущих исследований ( 5 , 16 ).
Сравнение последовательностей
Десять вирусных последовательностей были отобраны для попарного сравнения со штаммом YN в соответствии с филогенетическим анализом для S1 (Рисунок 1, панель B), который включал 2 распространенных вакцинных штамма в Китае (M41 и h220) и 8 китайских изолятов из 3 различных кластеров генов. (DY07, LX4, A2 и SC021202 из кластера I; CK / CH / LSD / 05I и CK / CH / LHB / 100801 из кластера II; CK / CH / LHLJ / 07VII и CK / CH / LDL / 101212 из кластера III ) (Таблица 2).В целом, полные геномные последовательности (за исключением 5′- и 3′-концевых сегментов) были на 87,1–98,0% идентичны среди изолятов, а штамм YN имел наивысшую нуклеотидную идентичность (98,0%) штамму SC021202, выделенному в южных районах. Китай (регистрационный номер GenBank EU714029). Для каждого гена идентичность варьировала от 93,7% до 100% между штаммами YN и SC021202 (таблица 2).
(DY07, LX4, A2 и SC021202 из кластера I; CK / CH / LSD / 05I и CK / CH / LHB / 100801 из кластера II; CK / CH / LHLJ / 07VII и CK / CH / LDL / 101212 из кластера III ) (Таблица 2).В целом, полные геномные последовательности (за исключением 5′- и 3′-концевых сегментов) были на 87,1–98,0% идентичны среди изолятов, а штамм YN имел наивысшую нуклеотидную идентичность (98,0%) штамму SC021202, выделенному в южных районах. Китай (регистрационный номер GenBank EU714029). Для каждого гена идентичность варьировала от 93,7% до 100% между штаммами YN и SC021202 (таблица 2).
Рисунок 2
Рисунок 2.. Выравнивание аминокислотных последовательностей гена S1 (A, B) и гена S2 (C) 14 штаммов вируса инфекционного бронхита птиц.Штаммы YN, SC021202, A2 и SAIBK имеют …
S-гликопротеин является основным функциональным белком IBV; таким образом, предполагаемые различия между штаммом YN и другими IBV были исследованы. Анализы показали, что вставка одной аминокислоты присутствовала в положении 22 (рис. 2, панель A) в дополнение к вставке 7-аа в положениях 74–81 (рис. 2, панель B) в гене S1 изолята YN, в где был обнаружен предполагаемый сайт N-гликозилирования. Среди доступных последовательностей в GenBank штаммы A2, BJ, CQ04–1, SC021202 и SAIBK имели такую же вставку в гене S1.По сравнению с другими доступными штаммами, делеции 9-аа были расположены на N-конце гена S2 (рис. 2, панель C) от основного перехода (G → T) в положении 1849 нуклеотидов, что привело к преждевременному стоп-кодону в открытом считывании. Рамка.
Клинико-патологическое обследование цыплят
Рисунок 3
Рисунок 3.. Сероконверсия и процент выживаемости цыплят, экспериментально инфицированных вирусом инфекционного бронхита (IBV), Китайская Народная Республика. А) Выживаемость цыплят после инокуляции штаммом YN IBV.Б) Обнаружение …
Клинически некоторые птицы выглядели подавленными с взъерошенными перьями; эти птицы потребляли больше воды и сбились в кучу в группе инокуляции YN через 2 дня после заражения (dpi). При 4 dpi признаки ИБ стали очевидны у всех инфицированных цыплят, а некоторые птицы были умерщвлены из-за тяжелого заболевания. Смерти произошли до 21 dpi; уровень смертности достиг 65% (Рисунок 3, панель A). В контрольной группе смертей или клинических признаков не наблюдалось.
При 4 dpi признаки ИБ стали очевидны у всех инфицированных цыплят, а некоторые птицы были умерщвлены из-за тяжелого заболевания. Смерти произошли до 21 dpi; уровень смертности достиг 65% (Рисунок 3, панель A). В контрольной группе смертей или клинических признаков не наблюдалось.
Рисунок 4
Рисунок 4.. Грубые поражения тканей почек кур, экспериментально инфицированных вирусом инфекционного бронхита (ИБК). А) Ткань почек неинфицированного контрольного цыпленка. Б) Очевидное увеличение и отложение уратов в …
Легкое кровоизлияние с серозным катаральным экссудатом можно было увидеть в трахее всех умерщвленных птиц. Также присутствовали поражения воздушного мешка, характеризующиеся выраженным утолщением стенки воздушного мешка и желтым казеозным экссудатом. У всех умерщвленных кур наблюдались типичные поражения почек.Пораженные почки были значительно увеличены, а в канальцах и мочеточниках часто наблюдались отложения бледных уратов (рис. 4). Ни у одной из птиц контрольной группы грубых повреждений не наблюдалось.
Ответы антител у птиц, переживших инфекцию, измеряли с помощью коммерческого набора для ELISA (IDEXX Laboratories). Все, кроме 1 курицы, показали положительную реакцию (фиг. 3, панель B) с помощью ELISA, и средний титр, индуцированный штаммом YN, составил 1250,35 при 21 dpi.
ОТ-ПЦР и выделение вирусов на тканях
Для дальнейшего изучения патогенности YN ИБК тканевый тропизм штамма исследовали с помощью ОТ-ПЦР и выделения вируса с использованием суспензий тканей мертвых птиц.Штамм YN хорошо реплицировался в различных органах, включая почки, трахею, легкие и сумку (Таблица 3; Техническое приложение).
Гистопатологический анализ и анализ IIHC
Рисунок 5
Рисунок 5.. Гистопатологический анализ (окраска гематоксилином и эозином) тканей 30-дневных цыплят, инфицированных штаммом вируса инфекционного бронхита YN. Панели A, C, E и G соответствуют контрольным тканям. Б) Трахея, . ..
..
Рисунок 6
Рисунок 6.. Иммуногистохимическое определение антигенов вируса инфекционного бронхита птиц (ИБК) в тканях после экспериментального заражения штаммом ИБК YN.Панели A, C, E и G соответствуют контрольным тканям. B) Трахея …
Микроскопическое исследование тканей трахеи выявило обширную дегенерацию и некроз мерцательных эпителиальных клеток, иногда с псевдоацинарными структурами, возникающими в результате выпадения мертвых клеток (рис. 5, панель B). Вирусный антиген был обнаружен на высоких уровнях в эпителиальных клетках слизистой оболочки трахеи (рис. 6, панель B). Поражения легких характеризовались кровоизлиянием, застоем и лимфоцитарной инфильтрацией в просвете альвеол (Рисунок 5, панель D), а вирусный антиген был обнаружен в альвеолярных клетках (Рисунок 6, панель D).Часто наблюдались тяжелые поражения почек, включая дегенерацию и некроз эпителиальных клеток почечных канальцев, лимфоцитарную инфильтрацию в интерстиции, расслоение эпителиальных клеток почечных канальцев и эритроцитов (Рисунок 5, панель F). Вирусные антигены широко выявлялись в эпителиальных клетках почечных канальцев (рис. 6, панель F). Серьезная атрофия лимфоидных фолликулов и расширение интерстиция наблюдались в сумке Фабрициуса (Рисунок 5, панель H), а вирусные антигены широко обнаруживались в эпителии слизистой оболочки сумки Фабрициуса (Рисунок 6, панель H).Спорадические застойные явления наблюдались также в печени и головном мозге.
IBV-инфекция приводит к серьезным экономическим потерям в птицеводстве из-за низкого набора веса и эффективности кормления бройлеров или снижения яйценоскости и качества яиц у птиц-несушек. Смертность часто бывает низкой (<30%), если вторичные бактериальные инфекции не вызывают повышенную смертность птиц ( 21 , 22 ). Оценка патогенности ИБК была основана на нескольких критериях, включая: клинические признаки, грубые патологические поражения, гистопатологические изменения и тропизм тканей.В этом исследовании штамм China IBV, выделенный из 30-дневного вакцинированного стада бройлеров, у которого в анамнезе имелись респираторные симптомы, тяжелое заболевание почек и более высокий, чем ожидалось, уровень смертности был проанализирован клиническим наблюдением, гистопатологическим исследованием, ОТ-ПЦР. выделение вирусов и иммуногистохимия. Анализы показали, что штамм YN вызывает тяжелую патогенность у 30-дневных кур SPF с 65% смертностью и значительным поражением почек.
выделение вирусов и иммуногистохимия. Анализы показали, что штамм YN вызывает тяжелую патогенность у 30-дневных кур SPF с 65% смертностью и значительным поражением почек.
Анализ последовательности гена S1 изолята YN показал высокое нуклеотидное сходство с CQ04–1 (99.5% нуклеотидов и 98,8% аминокислотных остатков) и SC021202 (99,3% нуклеотидов и 98,6% аминокислотных остатков). Филогенетический анализ также показал, что по крайней мере 3 различных генетических кластера IBV присутствовали в стадах цыплят в Китае, названных A2-подобными, LSD-подобными и M41-подобными штаммами. Большинство полевых изолятов китайского IBV принадлежали к одному и тому же генетическому кластеру (A2-подобному), но серотипы этих преобладающих штаммов IBV отличались от серотипов вакцин, используемых в настоящее время в Китае (M41-подобные, например, h220, Ma5, 28/86 , и W93), которые считаются основной причиной вспышек заболеваний ( 5 , 15 – 17 ).В Китае срочно необходима аттенуированная или инактивированная вакцина, соответствующая пандемическим штаммам, для борьбы с инфекцией ИБК.
IBV реплицируется во многих респираторных тканях (включая трахею, легкие и воздушный мешок), вызывая респираторные заболевания; в некоторых тканях мочеполовой системы (включая почки), вызывая незначительный или большой нефрит; и во многих частях пищеварительного тракта (включая пищевод, преджелудок и кишечник) ( 23 – 25 ). Как и ожидалось, YN чаще всего обнаруживался в трахее, легких, почках и сумке с помощью ОТ-ПЦР, выделения вируса и анализа ИГХ.Кроме того, мы обнаружили антигены YN частично из печени (1/10) и мозга (1/10).
Среди 4 основных структурных белков гликопротеин S, как известно, содержит области, которые индуцируют нейтрализующие, серотип-специфические, мембранные слияния, прикрепление и ингибирующие гемагглютинацию антитела ( 5 , 26 – 28 ). Кроме того, белок S является детерминантой клеточного тропизма ( 29 , 30 ). Наши данные показали вставку 7-аа между положениями 72 и 78 (фиг. 2, панель A) в гене S1 штамма YN и делецию 9-аа в N-конце S2, генерирующую стоп-кодон.Эти изменения, возможно, связаны с повышенной вирулентностью, наблюдаемой для YN IBV, и для подтверждения этих результатов необходимы обратные генетические анализы.
Наши данные показали вставку 7-аа между положениями 72 и 78 (фиг. 2, панель A) в гене S1 штамма YN и делецию 9-аа в N-конце S2, генерирующую стоп-кодон.Эти изменения, возможно, связаны с повышенной вирулентностью, наблюдаемой для YN IBV, и для подтверждения этих результатов необходимы обратные генетические анализы.
В заключение мы показали, что YN-подобные вирусы являются преобладающим штаммом в Китае и что YN IBV проявляет широкий тканевой тропизм и серьезную патогенность у кур. Чтобы лучше контролировать ИБК в Китае, необходим более подробный анализ биологических и антигенных характеристик преобладающих изолятов ИБК, а также оценка эффективности существующих вакцин против этих изолятов.
Г-жа Фэн – аспирант Колледжа ветеринарной медицины Сельскохозяйственного университета Китайской Народной Республики в Пекине. Ее научные интересы включают эпидемиологию и патогенность вирусов птичьего инфекционного бронхита.
Вершина
Выводы, выводы и мнения, выраженные авторами, работающими в этом журнале, не обязательно отражают официальную позицию Министерства здравоохранения и социальных служб США, Службы общественного здравоохранения, Центров по контролю и профилактике заболеваний или аффилированных с авторами учреждения.Торговые наименования используются только для идентификации и не подразумевают одобрения какой-либо из вышеперечисленных групп.
Границы | Патогенность TW-подобного штамма вируса инфекционного бронхита и оценка защиты от него QX-подобным штаммом
Введение
Инфекционный бронхит (ИБ) – это острое высококонтагиозное респираторное и урогенитальное заболевание, вызываемое вирусом инфекционного бронхита (ИБК). Геном IBV состоит из 27 РНК с положительной цепью.6 т.п.н., и вирус принадлежит к роду Gammacoronavirus (семейство Coronaviridae , порядок Nidovirales ; Cavanagh et al., 1992). Заболевание, поражающее цыплят всех возрастов, представляет собой серьезную экономическую угрозу для птицеводства во всем мире из-за плохого набора веса и снижения эффективности кормления бройлеров, а также снижения количества и качества яиц у птиц-несушек (Yu et al., 2001 ; Xu et al., 2007; Jackwood, 2012).
В настоящее время основным методом защиты цыплят от ИБ является вакцинация как живой, так и инактивированной вакцинами (Zhao et al., 2015). Однако эффективная вакцинация подрывается быстро приобретаемыми генетическими изменениями в IBV (например, вставкой, мутацией, делецией и реконструкцией гена; Dolz et al., 2008; Kuo et al., 2010). Кроме того, иммунитет против IBV обеспечивает низкую степень перекрестной защиты между различными серотипами IBV (Cowen and Hitchner, 1975), что подтверждает результаты молекулярно-эпидемиологических исследований IBV (Han et al., 2011; Li et al., 2012). Из-за неточности РНК-зависимой РНК-полимеразы коронавируса и высокой частоты рекомбинации гомологичных РНК постоянно сообщается о появлении новых вариантных штаммов, генотипов и серотипов ИБК (Cavanagh et al., 1986). Существующие вакцины против ИБК больше не обеспечивают защиты и, как правило, неэффективны против эпидемических штаммов ИБК, когда появляются новые вариантные изоляты ИБК или когда появляются новые серотипы (Sun et al., 2011). Следовательно, скрининг новых живых аттенуированных вакцинных штаммов на основе новых изолятов необходим для защиты цыплят от обычных эпидемических штаммов ИБК.
Преобладающий тип ИБК, QX-подобный ИБК, циркулирует в Китае с 1998 года, когда был зарегистрирован первый вариант этого типа (Wang et al., 1998; Чжао и др., 2014). Со временем мы наблюдаем устойчивый рост QX-подобного генотипа в Китае (с 11,7 до почти 70% в настоящее время; Zhao et al., 2016). Одновременно появляется все больше сообщений о QX-подобных случаях во многих других странах (Таиланд, Зимбабве, Корея, Дания, Франция, Германия, Россия, Испания и Великобритания), где вовлеченные вирусы имеют сходство последовательностей с QX-подобными вирусами ( Domanskablicharz et al., 2006; Worthington, Jones, 2006; Worthington et al., 2008; Valastro et al., 2010; Крапеж и др., 2011; Абро и др., 2012; Амин и др., 2012; Мо и др., 2013). Однако с тех пор, как первый TW-подобный домашний штамм CK / CH / LSD / 05I был выделен в провинции Шаньдун Китая, все большее количество TW-подобных штаммов также было выделено в материковом Китае (Liu et al., 2008), что подтверждается нашими предыдущими выводами (Xu et al., 2016).
Здесь мы определили патогенность TW-подобного штамма GD ИБК. Мы также оценили защитную эффективность, индуцированную QX-подобным штаммом JS против TW-подобного полевого штамма GD, наблюдая клинические признаки и грубые поражения, а также анализ распределения вируса, выделения вируса и активности ресничек трахеи у экспериментальных цыплят.Наши результаты предполагают, что TW-подобный IBV GD является очень вирулентным и что QX-подобный JS может обеспечить эффективную защиту вакцины от TW-подобных IBV вирусов.
Материалы и методы
Вирусы
TW-подобный штамм GD ИБК был выделен от кур, пораженных ИБ, в китайской провинции Гуандун. Эти куры были вакцинированы вакцинами массового типа против ИБК и страдали респираторными и почечными заболеваниями. Полный геном штамма GD ИБК был секвенирован в нашем предыдущем исследовании (Xu et al., 2016). QX-подобный штамм JS IBV, который обладает низкой естественной вирулентностью, был выделен от цыплят, пораженных ИБ, в провинции Цзянсу, Китай, в 2012 году. Вирусы JS и GD были очищены путем лимитирующего разведения, а также очищены JS или GD, содержащие аллантоисную жидкость. Штаммы титровали путем инокуляции в аллантоисные мешочки 10-дневных яиц с эмбрионами, свободных от специфических патогенов (SPF). Средние инфекционные дозы эмбрионов (EID 50 ) штаммов JS и GD были рассчитаны как 10 8,02 EID 50 / мл и 10 8.03 EID 50 / мл соответственно.
Заявление о животных и этике
Куры белого леггорна, не содержащие специфических патогенов, были приобретены у Beijing Merial Vital Laboratory Animal Technology Co., Ltd, Китай. За всеми животными, использованными в этом исследовании, ухаживали в соответствии с установленными руководящими принципами, а протоколы экспериментов (включая возможность смерти животных без эвтаназии) были одобрены Комитетом по благополучию животных и этической цензуре Китайского сельскохозяйственного университета (разрешение No.SYXK 2013-0013).
Тестирование патогенности
Группирование и выборка
Пятьдесят трехнедельных цыплят SPF случайным образом распределили по четырем группам. Группы A и B использовали для наблюдения за смертностью цыплят ( n = 10 каждая). Для выборки использовались группы C и D ( n = 15 каждая). Всех цыплят содержали в изоляторах под положительным давлением в помещениях с кондиционированием воздуха, а пищу и воду обеспечивали ad libitum . Группы A и C инокулировали 200 мкл аллантоисной жидкости, содержащей 10 904 · 10 6.00 EID 50 вируса GD интраназальным и внутриглазным путями. Группы B и D оставались неинфицированными контролями. За всеми цыплятами наблюдали ежедневно в течение 14 дней. Трех цыплят из групп C и D умерщвляли через 3, 5, 7 и 10 дней после заражения (dpc). У птиц оценивали грубые поражения и цилиарную активность трахеи. Были собраны образцы тканей трахеи, легких, селезенки, железистого желудка, почек и сумки Фабрициуса. Некоторые птицы погибли в период клинических наблюдений, также были собраны образцы их тканей.Образцы ткани помещали в 10% нейтральный формалин для гистологии или хранили при -80 ° C для обнаружения вирусной РНК с использованием полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР).
Обнаружение вирусного выделения
Мазки из ротовой полости и клоаки собирали случайным образом при 5 и 7 dpc у 10 птиц в контрольной группе C и пяти птиц в контрольной группе D для обнаружения выделения вируса с помощью RT-PCR. Вирусную РНК экстрагировали с помощью реагента TRIzol ® (Invitrogen, Carlsbad, CA, USA) в соответствии с инструкциями производителя.RT выполняли при 37 ° C в течение 1 ч с 3 мкг тотальной РНК, 1 мкл случайных гексамерных праймеров (500 мкг / мл; Promega, Madison, WI, США) и 0,5 мкл обратной транскриптазы M-MLV (200 ед. / мкл; Промега). ПЦР выполняли в реакционном объеме 20 мкл, содержащем 10 мкл Taq SuperMix (TransGen, Пекин, Китай), 10 пмоль каждого праймера, 100 нг кДНК в качестве матрицы и 7 мкл воды. Термоциклирование проводили при 95 ° C в течение 5 мин, затем следовали 30 циклов денатурации (95 ° C, 45 с), отжига (55 ° C, 45 с) и полимеризации (72 ° C, 1 мин) и заключительный этап удлинения проводили при 72 ° C в течение 10 мин.В ПЦР использовали пару праймеров (прямой: 5′-GTTGTGTGGTGTTGTTGTG-3 ‘; обратный: 5′-CAAGGGTGCAATTTGTCT-3’), которые амплифицировали фрагмент 800 п.н. гена N IBV. Амплифицированные фрагменты детектировали электрофорезом в 1,0% агарозном геле.
Обнаружение вирусной РНК в образцах инфицированных тканей
Суммарную РНК экстрагировали из трахеи, легких, селезенки, железистого желудка, почек и сумки Фабрициуса с помощью реагента TRIzol ® (Invitrogen) в соответствии с протоколом производителя.Для транскрипции первой цепи кДНК используется смесь, содержащая 1 мкл случайных праймеров (500 мкг / мл), 2,0 мкл dNTP (2,5 мМ), 1,5 мкл RNasin ® (50 Ед / мкл), 0,5 мкл M- Обратная транскриптаза MLV (10 Ед / мкл) и 4 мкл матрицы РНК инкубировали при 37 ° C в течение 60 минут, а затем при 72 ° C в течение 5 минут. Продукт использовали для ПЦР, как описано выше.
Подавление активности ресничек
Для оценки цилиостаза трахеи анализировали три участка верхней, средней и нижней частей трахеи (девять колец на птицу).Кольца помещали в 96-луночные планшеты с культуральной средой Игла, содержащей 10% фетальной бычьей сыворотки. Затем их исследовали с помощью инвертированной световой микроскопии при увеличении в 400 раз для определения степени целостности и сохранения цилиарного движения в эпителиальных клетках трахеи. Оценка 0 давалась, если реснички в полной секции трахеи демонстрировали движение; оценка 1 присваивалась, если 75–100% ресничек в трахеальном разрезе демонстрировали движение; оценка 2 давалась, если 50–75% ресничек в трахеальном разрезе демонстрировали движение; оценка 3 присваивалась, если 25–50% ресничек в трахеальном разрезе демонстрировали движение; и оценка 4 давалась, если <25% ресничек в трахеальном разрезе показывали движение или не было движения вообще.Для каждой группы рассчитывали средний балл цилиостаза.
Гистопатология
Образцы тканей трахеи, легких, селезенки, железистого желудка, почек и сумки Фабрициуса фиксировали в 10% нейтральном формалине в течение 48 часов при комнатной температуре. Эти образцы обрабатывали в обычном порядке, заливали парафином и разрезали на срезы 5 мкм. Срезы окрашивали гематоксилином и эозином (H&E) и исследовали на предмет повреждений с помощью световой микроскопии.
Эффективность штамма JS против вызывающих инфекций штаммом GD
Сорок восемь 6-недельных цыплят SPF случайным образом разделили на три группы по 16 цыплят в каждой, а затем поместили в разные изоляторы.Группу JS-GD вакцинировали 200 мкл 10 7,00 EID 50 штамма JS путем интраназального и внутриглазного введения. Группу контроля и контрольную группу GD инокулировали одинаковым объемом стерильного физиологического раствора одним и тем же методом. Через 21 день после инокуляции (dpi) группы JS-GD и контрольный GD заражали 200 мкл штамма GD, содержащего 10 6,00 EID 50 , интраназальным и глазным путями. Группу контроля инокулировали стерильным физиологическим раствором с использованием того же метода.Птиц всех групп содержали в одинаковых условиях.
Всех цыплят ежедневно обследовали на предмет клинических признаков, связанных с инфекцией ИБ, в течение 14 дней после заражения. По три цыпленка из каждой группы были гуманно умерщвлены и рассечены при 5 и 7 dpc. В случае гибели цыплят в период наблюдения вскрытия проводились своевременно. Внешние и внутренние исключительные ситуации были подробно записаны, и образцы трахеи, легких, почек, селезенки, железистого желудка и сумки Фабрициуса были собраны для обнаружения вирусов с помощью ОТ-ПЦР.Дополнительно, десять мазков из гортани из каждой группы были собраны для обнаружения вируса с помощью ОТ-ПЦР путем случайной выборки при 5 и 7 dpc. Активность ресничек трахеи оценивали на 5 и 7 dpc. ОТ-ПЦР и оценку цилиостаза трахеи проводили, как описано в тестах на патогенность. Образцы крови от десяти цыплят в каждой группе собирали при 21 dpi и 14 dpc для анализа антител против IBV с использованием иммуноферментного анализа (ELISA; IDEXX Laboratories, Westbrook, ME, USA).
Статистический анализ
Данные были проанализированы с использованием непарного теста t в GraphPad Prism версии 6.0 для Windows, чтобы получить статистический анализ различий между группой контроля-GD и JS-GD в тесте защитной эффективности. Для теста ингибирования активности ресничек собранные данные были проанализированы с использованием двухфакторного дисперсионного анализа, чтобы увидеть, есть ли какие-либо существенные различия между различными группами. Множественные сравнения между группами проводились с использованием теста множественного сравнения Тьюки. Статистическая значимость считалась следующей: значимой при ∗ P ≤ 0.05; высокая значимость при ∗∗ P ≤ 0,01; и очень значимо при ∗∗∗ P ≤ 0,001.
Результаты
Тестирование патогенности
Клинические наблюдения
Трехнедельные цыплята с SPF, зараженные штаммом GD, показали клинические признаки инфекции уже через 3 дня на день, и эти признаки сохранялись до 10 дней на день. У больных цыплят наблюдались признаки кашля, чихания, трахеальных и бронхиолярных хрипов, вялости, сбивчивости и взъерошенности перьев.Четыре птицы в группе А, инокулированной GD, погибли во время эксперимента, начиная с 5 dpc и достигая пика при 8 dpc, а уровень смертности достиг 40% (рис. 1A). Птицы контрольных групп были бдительны и активны во время эксперимента.
РИСУНОК 1. Процент выживаемости (A) и крупных поражений почек (B) 3-недельных цыплят, свободных от специфических патогенов (SPF), зараженных штаммом GD вируса инфекционного бронхита (IBV). (a) Ткань почек неинфицированного контрольного цыпленка.(b, c) Очевидное увеличение почек и отложение уратов через 5 и 7 дней после заражения (dpc), соответственно, у цыпленка, инфицированного штаммом GD IBV. (d) Очевидные бледные увеличенные почки с отложениями уратов от цыпленка, инфицированного штаммом GD, который умер при 6 dpc.
Грубые поражения
При вскрытии были обнаружены явные поражения в дыхательных путях, легких, почках и сумке Fabricius у цыплят, инфицированных штаммом GD, включая точечное кровоизлияние в горло и трахею и катаральный экссудат в носовой полости.Основными проявлениями у отобранных цыплят были опухшие почки с отложениями уратов, которые часто наблюдались в канальцах и мочеточниках («пятнистые почки») при 5 и 7 dpc, а у мертвых цыплят – на 6 dpc (рис. 1B, b – d). Бурса Фабрициуса показала сильный экссудат слизи и в некоторых случаях была атрофирована. Никаких явных повреждений не было выявлено ни в каких других органах в группе, зараженной инфекцией, или у птиц, выздоровевших после заражения штаммом GD. Никаких серьезных повреждений не наблюдалось ни у одной птицы в контрольной группе (рис. 1В, а).
Гистопатология
Поражения от умеренных до тяжелых были обнаружены преимущественно между 5 и 7 dpc в органах, взятых у зараженных инфекцией цыплят. У цыплят, подвергшихся воздействию штамма GD, наблюдались следующие поражения: утолщение и кровоизлияние в собственную пластинку слизистой оболочки трахеи, инфильтраты воспалительных клеток и разную степень десквамации эпителия и некроз мерцательных клеток трахеи на 3, 5 и 7 dpc. соответственно (Рисунки 2C, E, G). Очаги некроза, интенсивного мультифокального нефрита с лимфоплазмоцитарной инфильтрацией и дилатации мезенхимы были разбросаны по почкам инокулированных GD цыплят с 3, 5 и 7 dpc соответственно (Рисунки 2D, F, H).Кровоизлияние, застой, эритроциты и лимфоциты часто обнаруживались в просвете бронхов и воздушных капилляров легких. В сумке обнаружены некроз эпителиальных клеток и опорожнение лимфоцитов. У контрольных птиц поражений, связанных с ИБК, не наблюдалось (рисунки 2А, В).
РИСУНОК 2. Патогистологические изменения трахеи (A, C, E, G) и почек (B, D, F, H) 3-недельных кур SPF, зараженных штаммом GD IBV. (A) В контрольной группе не наблюдалось явных поражений трахеи; (B) в контрольной группе не было обнаружено явных повреждений почек; (C) черная стрелка указывает на утолщение собственной пластинки слизистой оболочки трахеи и инфильтрацию воспалительных клеток; (D, E) кровоизлияние; (F) отделение канальцев почек от базилярной мембраны; (G) белая стрелка указывает на обширное выпадение, дегенерацию и некроз мерцательных эпителиальных клеток; (H) черные стрелки указывают на некроз эпителиальных клеток почек, а белая стрелка указывает на инфильтрацию воспалительных клеток.
Подавление активности ресничек
Подавление активности ресничек в трахее измеряли при 3, 5, 7 и 10 dpc. Группа, зараженная инфекцией, показала максимальный средний балл цилиостаза примерно 4, тогда как у контрольной группы был <1. Разница в цилиостазе между группой, инфицированной штаммом GD, и контрольной группой была очень значимой ( p <0,0001).
Вирусное выделение
Скорость выделения вируса, определенная с помощью ОТ-ПЦР, составляла 100% в зараженной группе при 5 и 7 dpc.В контрольной группе вирусной РНК не обнаружено.
Обнаружение вирусной РНК в образцах инфицированных тканей
Не было обнаружено вирусной РНК ни в каких тканях контрольной группы. В группе, зараженной инфекцией, вирусная РНК была обнаружена в трахее, почках и сумке Fabricius при 3–10 dpc и в легких, селезенке и железистом желудке на 3–7 dpc. Доля вирус-положительных образцов в группе, инфицированной GD, составила 62,5% (45/72). В таблице 1 показаны результаты обнаружения вирусной РНК для инфицированных групп и контрольных групп.
ТАБЛИЦА 1. Обнаружение вирусной РНК в отобранных тканях у 3-недельных цыплят, свободных от специфических патогенов (SPF), зараженных штаммом GD вируса инфекционного бронхита (IBV) с помощью полимеразной цепной реакции с обратной транскрипцией (RT-PCR) .
Эффективность штамма JS против заражения штаммом GD
Клинические проявления
В контрольной группе GD у четырех цыплят были обнаружены признаки депрессии, трахейные и бронхиолярные хрипы на 7 dpc.Смертность группы контроля-GD составила 30% в течение 14-дневного периода наблюдения (рис. 3A). Основными клиническими проявлениями у мертвых цыплят были отек почек, отложение уратов на почках и обильный экссудат льняной слизи на сумке Фабрициуса (рис. 3В). Психический статус и аппетит в группе JS-GD не показали явных изменений. Органы также не проявляли видимых патологических изменений после заражения в группе JS-GD в течение периода наблюдения.
РИСУНОК 3. Процент выживаемости (A) и грубые поражения сумки Фабрициуса (B) у 9-недельных кур SPF, экспериментально зараженных штаммом IBV GD. (a) В сумке Фабрициуса в группе JS-GD не обнаружено явных повреждений. (б) Обильные экссудаты льняной слизи на бурсе Фабрициуса в группе GD.
Обнаружение вируса в органах после заражения
Обратная транскрипция – полимеразная цепная реакция была использована для обнаружения вирусной РНК в отобранных тканях после заражения штаммом IBV GD.Для контрольной группы GD распределение вируса в различных пропорциях было обнаружено во всех органах при 5 и 7 dpc, в дополнение к селезенке при 7 dpc. В группе иммунизированных JS-GD вирус был положительным только в бурсе Фабрициуса цыплят при 7 dpc. Доля положительных образцов в группе JS-GD была значительно ниже, чем в группе контроля-GD. Кроме того, ни в одном органе контрольной группы вируса не обнаружено (таблица 2).
ТАБЛИЦА 2. Обнаружение вирусной РНК для органов и тканей от 9-недельных кур SPF, зараженных штаммом IBV GD с помощью RT-PCR.
Обнаружение вируса в мазках из гортани после заражения
Как показано в Таблице 3, для всех мазков, взятых из гортани невакцинированных цыплят при 5 и 7 dpc в контрольной группе GD, уровень вирус-положительных результатов составил 100%. Напротив, процент положительных результатов для всех образцов группы JS-GD был равен 0, в то время как в контрольной группе вирусы не были обнаружены в мазках из гортани.
ТАБЛИЦА 3. Обнаружение вирусной РНК для гортани от 9-недельных цыплят SPF, зараженных штаммом IBV GD с помощью RT-PCR.
Оценка цилиарной активности трахеи
Мы определили степень подавления активности ресничек на 5 и 7 dpc в трахее. Группа контроля-GD показала максимальный средний балл цилиостаза 4, в то время как средний балл цилиостаза для контрольной группы и группы JS-GD был ниже 1 (Рисунок 4). Разница в уровне цилиостаза была чрезвычайно значительной между группой, вакцинированной штаммом JS, и невакцинированной группой ( P <0,001).
РИСУНОК 4. Показатели цилиостаза трахеи у 9-недельных кур SPF, экспериментально зараженных штаммом IBV GD. Степень подавления активности ресничек определялась при 5 и 7 dpc в трахее. Полоса ошибок указывает стандартное отклонение. Сравнение между двумя группами проводилось с использованием теста t . Статистическая значимость считалась следующей: очень высокая значимость при ∗∗∗ P ≤ 0,001.
Определение антител с помощью ELISA
Образцы сыворотки были собраны для тестов на антитела ELISA из 21 dpi и 14 dpc.Все цыплята, инокулированные штаммом JS, показали положительный сывороточный ответ антител при 21 dpi, и средний титр антител составил 1966,93. И средние титры групп контроля-GD и JS-GD составляли 5402,60 и 3632,59 при 14 dpc, соответственно. Антитела против IBV никогда не обнаруживались в контрольной группе (рис. 5).
РИСУНОК 5. Сероконверсия у кур, экспериментально инфицированных штаммами IBV. (A) Средние титры антител через 21 день после инокуляции (dpi) штаммом IBV JS. (B) Средние титры антител при 14 dpc для штамма IBV GD. Пороговый титр = 396. Полоса ошибок указывает стандартное отклонение.
Обсуждение
Несмотря на то, что различные живые аттенуированные и инактивированные вакцины против ИБК, полученные из большого числа генетически различных штаммов и широко используемые во всем мире, вспышки ИБ все еще происходят спорадически, потому что перекрестная защита между различными серотипами ИБК практически отсутствует, и постоянно появляются новые варианты Cook et al., 2001; Лю и др., 2009; Чжао и др., 2015). Как только появится новый эпидемический серотип, защита, обеспечиваемая существующими вакцинными штаммами, значительно снизится. Появление TW-подобных штаммов увеличивается и широко распространяется в Китае в последние годы, и эти TW-подобные изоляты отдаленно связаны с преобладающей вакциной h220 и другими распространенными штаммами (Xu et al., 2016). В этом исследовании мы определили патогенность TW-подобного штамма IBV GD и оценили защитную эффективность, вызванную экспериментальными инфекциями с QX-подобным штаммом JS.
TW-подобный штамм IBV GD был высокопатогенным для кур SPF, вызывая 100% заболеваемость и 30-40% смертность. IBV GD вызвала бледность и опухание почек, а также расширение почечных канальцев и мочеточников уратами. Крупные поражения и гистопатологические изменения, вызванные штаммом GD, были аналогичны описанным в отчете о нефропатогенных штаммах IBV (Boroomand et al., 2012), что характеризует GD как нефропатогенный штамм IBV. Кроме того, у части мертвых цыплят в группе контрольной инфекции наблюдались обильные слизистые экссудаты или атрофия в сумке Фабрициуса, что аналогично результатам, полученным для других полевых штаммов в нескольких ранее проведенных исследованиях (Toro et al., 2006; Feng et al., 2012). Необходимо провести дополнительные работы, чтобы прояснить это и изучить его влияние на цыплят.
Тест на цилиостаз часто используется для определения степени повреждения трахеи после роста IBV в этой ткани (Cook et al., 1976; Tarpey et al., 2006). В настоящем исследовании мы оценили степень целостности и сохранение цилиарного движения в эпителиальных клетках трахеи на уровне 3–10 dpc после заражения штаммом IBV GD. Результаты показали, что IBV GD вызывает тяжелое респираторное заболевание и поражения у экспериментальных цыплят, а связанный с ним цилиостаз является чрезвычайно тяжелым.Следовательно, вторичная инфекция, вызванная другими патогенами, может быть легче приобретена, когда защитная способность ресничек трахеи ослаблена или утрачена.
QX-подобный штамм IBV JS имеет от природы низкую вирулентность и показывает хорошую защитную эффективность против QX-подобных вирулентных полевых штаммов. Наши результаты в этом исследовании также показали, что штамм QX-подобного IBV JS также обеспечивает эффективную защиту от TW-подобных вирусов без явных клинических признаков или грубых поражений, явного снижения цилиостаза и снижения скорости репликации тканей и выделения вирусов в тканях. инфицированные цыплята.
Таким образом, наше исследование показало, что TW-подобный штамм IBV GD является высокопатогенным для цыплят и что QX-подобный штамм JS обеспечивает эффективную защиту от TW-подобных вирусов IBV, что указывает на то, что штамм JS может быть полезен в программах вакцинации. в полевых условиях для снижения экономических потерь, вызванных TW-подобными инфекциями IBV.
Авторские взносы
Задумал и спроектировал эксперименты: S-hY, JZ и G-zZ. Проведены эксперименты: S-hY, YC и GX.Проанализированы данные: JZ, YZ и G-zZ. Предоставленные реагенты / материалы / инструменты анализа: G-zZ. Написал бумагу: S-hY, YC и G-zZ.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарность
Это исследование было поддержано Пекинским сельскохозяйственным инновационным консорциумом системы исследований в области птицеводства (BAIC04-2016).
Список литературы
Абро, С. Х., Ренстрём, Л. Х. М., Ульман, К., Исакссон, М., Зохари, С., Янссон, Д. С. и др. (2012). Появление новых штаммов вируса инфекционного бронхита птиц в Швеции. Вет. Microbiol. 155, 237–246. DOI: 10.1016 / j.vetmic.2011.09.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Амин, О. Г., Валастро, В., Сальвиато, А., Драго, А., Каттоли, Г., и Монн, И. (2012). Циркуляция QX-подобного вируса инфекционного бронхита на Ближнем Востоке. Вет. Рек. 171, 530–531. DOI: 10.1136 / vr.100896
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боруманд, З., Асаси, К., и Мохаммади, А. (2012). Патогенез и тканевое распределение изолята вируса инфекционного бронхита птиц IRFIBV32 (серотип 793 / B) у экспериментально инфицированных цыплят-бройлеров. Sci. Мир J. 2012, 402537. doi: 10.1100 / 2012/402537
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кавана, Д., Дэвис, П. Дж., Кук, Дж. К., Ли, Д., Кант, А., и Кох, Г. (1992). Расположение аминокислотных различий в субъединице гликопротеина шипа S1 близкородственных серотипов вируса инфекционного бронхита. Avian Pathol. 21, 33–43. DOI: 10.1080 / 03079459208418816
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кавана Д., Дэвис П. Дж., Дарбишир Дж. Х. и Петерс Р. У. (1986). Коронавирус IBV: вирус, сохраняющий спайковый гликополипептид S2, но не S1, не может индуцировать вирус-нейтрализующие или ингибирующие гемагглютинацию антитела или индуцировать защиту трахеи цыпленка. J. Gen. Virol. 67 (часть 7), 1435–1442. DOI: 10.1099 / 0022-1317-67-7-1435
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кук, Дж. К., Чешер, Дж., Баксендейл, В., Гринвуд, Н., Хаггинс, М. Б., и Орбелл, С. Дж. (2001). Защита цыплят от поражения почек, вызванного вирусом нефропатогенного инфекционного бронхита. Avian Pathol. 30, 423–426. DOI: 10.1080 / 03079450120066421
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кук, Дж.К., Дарбишир Дж. Х. и Петерс Р. У. (1976). Использование культур трахеальных органов цыплят для выделения и анализа вируса птичьего инфекционного бронхита. Arch. Virol. 50, 109–118. DOI: 10.1007 / BF01318005
CrossRef Полный текст | Google Scholar
Коуэн Б. С. и Хитчнер С. Б. (1975). Серотипирование вирусов инфекционного бронхита птиц с помощью теста на нейтрализацию вирусов. Avian Dis. 19, 583–595. DOI: 10.2307 / 1589084
CrossRef Полный текст | Google Scholar
Дольц, Р., Пухольс, Дж., Ордоньес, Г., Порта, Р., и Майо, Н. (2008). Молекулярная эпидемиология и эволюция вируса птичьего инфекционного бронхита в Испании за четырнадцатилетний период. Вирусология 374, 50–59. DOI: 10.1016 / j.virol.2007.12.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Domanskablicharz, K., Minta, Z., Smietanka, K., and Porwan, T. (2006). Новый вариант IBV в Польше. Вет. Рек. 158, 808. DOI: 10.1136 / vr.158.23.808-c
PubMed Аннотация | CrossRef Полный текст
Фэн Дж., Hu, Y., Ma, Z., Yu, Q., Zhao, J., Liu, X., et al. (2012). Вирулентный вирус инфекционного бронхита птиц, Китайская Народная Республика. Emerg. Заразить. Дис. 18, 1994–2001. DOI: 10.3201 / eid1812.120552
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, З., Сунь, К., Янь, Б., Чжан, X., Ю, В., Ли, К. и др. (2011). 15-летний анализ молекулярной эпидемиологии коронавируса птичьего инфекционного бронхита в Китае. Заражение. Genet. Evol. 11, 190–200.DOI: 10.1016 / j.meegid.2010.09.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крапеж У., Славец Б. и Ройс О. З. (2011). Циркуляция штаммов вируса инфекционного бронхита из Италии 02 и генотипов QX в Словении в период с 2007 по 2009 год. Avian Dis. 55, 155–161. DOI: 10.1637 / 9533-091710-Case.1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куо, С. М., Ван, К. Х., Хоу, М. Х., Хуанг, Ю. П., Као, Х. У. и Су, Х.Л. (2010). Эволюция вируса инфекционного бронхита на Тайване: характеристика рекомбинации РНК в гене нуклеокапсида. Вет. Microbiol. 144, 293–302. DOI: 10.1016 / j.vetmic.2010.02.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, М., Ван, X. Y., Wei, P., Chen, Q.Y., Wei, Z.J., и Mo, M. L. (2012). Разнообразие серотипов и генотипов вирусов инфекционного бронхита, выделенных в 1985-2008 гг. В Гуанси. Китай. Arch. Virol. 157, 467–474.DOI: 10.1007 / s00705-011-1206-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю С., Ван, Ю., Ма, Ю., Хань, З., Чжан, К., Шао, Ю. и др. (2008). Выявление недавно изолированного варианта коронавируса птичьего инфекционного бронхита в Китае, проявляющего сродство с дыхательными путями. Avian Dis. 52, 306–314. DOI: 10.1637 / 8110-091307-ResNote.1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю, X. Л., Су, Дж.Л., Чжао, Дж. Х., Чжан, Г. З. (2009). Полный анализ последовательности генома преобладающего штамма вируса инфекционного бронхита (IBV) в Китае. Гены вирусов 38, 56–65. DOI: 10.1007 / s11262-008-0282-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мо, М. Л., Хонг, С. М., Квон, Х. Дж., Ким, И. Х., Сонг, К. С., и Ким, Дж. Х. (2013). Генетическое разнообразие генов spike, 3a, 3b и E вирусов инфекционного бронхита и появление новых рекомбинантов в Корее. Вирусы 5, 550–567. DOI: 10.3390 / v5020550
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sun, C., Han, Z., Ma, H., Zhang, Q., Yan, B., Shao, Y., et al. (2011). Филогенетический анализ коронавирусов инфекционного бронхита, недавно выделенных в Китае, а также патогенность и оценка защиты, вызванной вакциной серотипа h220 Массачусетса против QX-подобных штаммов. Avian Pathol. 40, 43–54. DOI: 10.1080 / 03079457.2010.538037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тарпей, И., Орбелл, С. Дж., Бриттон, П., Касаис, Р., Ходжсон, Т., Лин, Ф. и др. (2006). Безопасность и эффективность вируса инфекционного бронхита, используемого для вакцинации куриных эмбрионов. Vaccine 24, 6830–6838. DOI: 10.1016 / j.vaccine.2006.06.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Торо, Х., ван Сантен, В. Л., Ли, Л., Локкаби, С. Б., ван Сантен, Э., и Хёрр, Ф. Дж. (2006). Эпидемиологические и экспериментальные доказательства иммунодефицита при инфекционном бронхите птиц. Avian Pathol. 35, 455–464. DOI: 10.1080 / 03079450601028811
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валастро, В., Монне, И., Фасолато, М., Чекчеттин, К., Паркер, Д., Террегино, К. и др. (2010). Вирус инфекционного бронхита типа QX в промышленных стадах в Великобритании. Вет. Рек. 167, 865–866. DOI: 10.1136 / vr.c6001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Ю., Ван, Ю., Чжан, З., Фань, Г., Jiang, Y., Liu, X., et al. (1998). Выделение и идентификация ИБК типа железистого желудка (QX IBV) у кур. Подбородок. J. Ani. Каранитин 15, 1–3.
Google Scholar
Уортингтон, К. Дж., Карри, Р. Дж., И Джонс, Р. К. (2008). Обзор генотипов вируса инфекционного бронхита в Западной Европе с 2002 по 2006 гг. С помощью обратной транскриптазы-полимеразной цепной реакции. Avian Pathol. 37, 247–257. DOI: 10.1080 / 03079450801986529
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюй, К., Чжао, Дж., Ху, X., и Чжан, Г. (2007). Выделение и идентификация четырех штаммов вируса инфекционного бронхита в Китае и анализ их гена гликопротеина S1. Вет. Microbiol. 122, 61–71. DOI: 10.1016 / j.vetmic.2007.01.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюй, Г., Лю, X. Y., Чжао, Ю., Чен, Ю., Чжао, Дж., И Чжан, Г. З. (2016). Характеристика и анализ штамма вируса инфекционного бронхита, выделенного на юге Китая в 2013 г. Virol. J. 13, 1–9. DOI: 10.1186 / s12985-016-0497-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Yu, L., Jiang, Y., Low, S., Wang, Z., Nam, S.J., Liu, W., et al. (2001). Характеристика трех изолятов вируса инфекционного бронхита из Китая, ассоциированного с преджелудками у вакцинированных цыплят. Avian Dis. 45, 416–424. DOI: 10.2307 / 1592981
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, Ю., Cheng, J. L., Liu, X. Y., Zhao, J., Hu, Y. X., и Zhang, G. Z. (2015). Безопасность и эффективность аттенуированного штамма китайского QX-подобного вируса инфекционного бронхита в качестве вакцины-кандидата. Вет. Microbiol. 180, 49–58. DOI: 10.1016 / j.vetmic.2015.07.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, Ю., Лю, X. Y., Ченг, Дж. Л., Ву, Ю. П., и Чжан, Г. З. (2014). Молекулярная характеристика штамма вируса инфекционного бронхита, выделенного из северного Китая в 2012 г. Arch. Virol. 159, 3457–3461. DOI: 10.1007 / s00705-014-2213-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, Ю., Чжан, Х., Чжао, Дж., Чжун, К., Цзинь, Дж. Х. и Чжан, Г. З. (2016). Эволюция вируса инфекционного бронхита в Китае за последние два десятилетия. J. Gen. Virol. 97, 1–9. DOI: 10.1099 / jgv.0.000464
PubMed Аннотация | CrossRef Полный текст | Google Scholar
исследований вируса инфекционного бронхита птиц (IBV)
Эндрюс, К. Х., Хорстманн, Д. М .: Восприимчивость вирусов к этиловому эфиру. J. gen. Microbiol. 3 , 290–297 (1949).
Google ученый
Купер, П. Д .: Химическая основа классификации вирусов животных. Nature 190 , 302–305 (1961).
Google ученый
Коуэн Б.С., Хитчнер С.Б .: Исследования стабильности pH с использованием штаммов вируса птичьего инфекционного бронхита (коронавируса).J. Virol. 15 , 430–432 (1975).
Google ученый
Коуэн Б.С., Хитчнер С.Б., Убертини Т .: Характеристика нового изолята вируса инфекционного бронхита II. Некоторые химические и физические свойства Clark 333. Avian Dis. 15 , 527–532 (1971).
Google ученый
Каннингем, К. Х .: Птичий инфекционный бронхит. В: Брандли, К.А., Корнелиус К. Э. (ред.), Достижения ветеринарии и сравнительной медицины, Vol. 14, 105–148. Нью-Йорк: Academic Press 1970.
Google ученый
Каннингем, К. Х., Спринг, М. П .: Некоторые исследования вируса инфекционного бронхита в культуре клеток. Птичий Дис. 9 , 182–193 (1965).
Google ученый
Каннингем, К. Х., Стюарт, Х. О .: pH-стабильность вируса инфекционного бронхита кур.Cornell Vet. 37 , 99–103 (1947).
Google ученый
Дюбоз, Р. Т., Грамблс, Л. С., Флауэрс, А. И.: Дифференциация вируса бронхита перепелов и вируса инфекционного бронхита по термостабильности. Амер. J. vet. Res. 21, , 740–743 (1960).
Google ученый
Эстола, Т .: Исследования вируса инфекционного бронхита кур, выделенных в Финляндии.Acta vet. Сканд. 18 , 1–111, приложение (1966).
Google ученый
Фельдман, Х. А., Ван, С. С .: Чувствительность различных вирусов к хлороформу. Proc. Soc. опыт Биол. (Нью-Йорк) 106 , 736–738 (1961).
Google ученый
Хамре, Д., Прокоу, Дж. Дж .: Новый вирус, выделенный из дыхательных путей человека. Proc. Soc. опыт Биол. (Н.Ю.) 121 , 190–193 (1966).
Google ученый
Хираи К., Шимакура С .: Выделение и характеристики вируса инфекционного бронхита, вызывающего нефроз птиц (коронавирус). Яп. J. vet. Sci. 33 , 209–216 (1971).
Google ученый
Хофстад, М. С .: Стабильность вируса птичьего инфекционного бронхита при 56 ° C. Cornell Vet. 46, , 122–128 (1956).
Google ученый
Моханти, С. Б., Чанг, С. С. Развитие и эфирная чувствительность вируса инфекционного бронхита кур в клеточных культурах. Амер. J. vet. Res. 24 , 822–826 (1963).
Google ученый
Оцуки, К., Такахаши, К., Цубокура, М., Итагаки, К., Нишио, С.: Обнаружение нейтрализующих антител с использованием нескольких серологических типов вируса птичьего инфекционного бронхита в районе птицеводства.Япония. Пульт. Sci. 13 , 20–25 (1976).
Google ученый
Оцуки, К., Цубокура, М., Ямамото, Х., Имамура, М., Сакагами, Ю., Сайо, Х., Хосокава, Д .: Некоторые свойства птичьих аденовирусов, выделенных от кур с гепатитом с тельцами включения в Японии. Птичий Дис. 20 , 694–705 (1976).
Google ученый
Пейдж, К.А., Каннингем, К.H .: Тест на нейтрализацию вируса инфекционного бронхита. Амер. J. vet. Res. 23 , 1065–1071 (1962).
Google ученый
Quiroz, C.A., Hanson, R.P .: Физико-химическая обработка инокулята как средство разделения и идентификации птичьих вирусов. Птичий Дис. 2 , 94–98 (1958).
Google ученый
Рид, Л. Дж., Мюнх, Х.A .: Простой метод оценки пятидесяти процентов конечных точек. Амер. J. Hyg. 27, , 493–497 (1938).
Google ученый
Сингх В. П., Малик Б. С., Верма К. К. Физические и химические характеристики местного штамма вируса инфекционного бронхита ИБК домашней птицы. Индиан Дж. Поулт. Sci. 9 , 168–171 (1974).
Google ученый
Стил, Ф.М., Лугинбуль, Р. Э .: Тесты прямой и непрямой фиксации комплемента на вирус инфекционного бронхита. Амер. J. vet. Res. 25 , 1249–1255 (1964).
Google ученый
фон Бюлов, В .: Infektiöse Bronchitis der Hühner IV. Charakterisierung eines neuen Feldstammes des IB-Virus (IBV-10). Zbl. Вет.-Мед. 14 , 151–162 (1967).
Google ученый
Винтерфилд, Р. В., Фадли, А. М., Хэнли, Дж. Э .: Характеристики изолята вируса инфекционного бронхита от кур во Флориде. Птичий Дис. 15 , 305–311 (1971).
Google ученый
Инфекционный бронхит и небольшие стада несушек | Манитоба Сельское хозяйство
Версия PDF (52 КБ)
Если у вас на заднем дворе стадо птиц разных возрастов или типов, никогда не покупайте взрослых кур на коммерческой птицеферме.Эти старые птицы могут быть инфицированы инфекционным бронхитом и распространять этот вирус среди других птиц на вашей ферме. Инфекционный бронхит может вызывать снижение яйценоскости, образование жидких яичных белков и тонкую, грубую или неправильную форму яичной скорлупы. Смертность среди взрослых кур не является обычным явлением, но вирус может поражать дыхательные пути, яйцеводы или почки молодых или непривитых птиц.
Куры, которых вы покупаете на коммерческой ферме, были вакцинированы против этой болезни, но защита не идеальна.

 Бактерии выделяются с частичками слизи и слюны и попадают в дыхательные пути здорового человека.
Бактерии выделяются с частичками слизи и слюны и попадают в дыхательные пути здорового человека.