Все о бактериофагах – публикации в СМИ
20.12.2013 | Новая аптека No. 12
Инфекционно-воспалительные заболевания уха и верхних дыхательных путей – одна из наиболее частых причин обращения за медицинской помощью. Важная составляющая комплекса мероприятий, применяемых в лечении пациентов с бактериальной инфекционной патологией, – антимикробная терапия. Однако рост устойчивости к антибиотикам настолько стремителен, что в большинстве стран проблема антибиотикорезистентности признана угрозой национальной безопасности.
На каких фронтах воюем
Лидирующую позицию в общей структуре лор-патологий занимают ринит, фарингит, тонзиллит и отит. Ринит — это воспаление слизистой оболочки носа, при котором затрудняется носовое дыхание, появляются выделения из носовых ходов. Часто он осложняется воспалением околоносовых пазух. Ринит сопровождают неприятные ощущения в носу: сухость, зуд, иногда жжение.
Причиной ринита могут стать бактерии и вирусы, пыль, холодный воздух, аллергены, раздражающие вещества и т. д.
Фарингит — воспаление слизистой глотки, нёбного язычка и миндалин. Основные симптомы фарингита: боль в горле, першение, сухой кашель, повышение температуры тела, увеличение
шейных лимфатических узлов. Отмечается покраснение и рыхлость слизистой глотки, могут быть увеличены нёбные миндалины. Наиболее часто встречается вирусный фарингит, как правило, он сопутствует любому ОРВИ. Бактериальный фарингит возникает реже и вызывается стрептококком, иногда нейссериями, микоплазмами и хламидиями.
Тонзиллит – это воспаление нёбных миндалин. Общими жалобами являются резкая боль при глотании, общая слабость организма, температура, болевые ощущения при пальпации лимфоузлов, головная боль.
Отит – воспалительный процесс в ухе. В зависимости от локализации процесса различают наружный, средний и внутренний отит. При наружном отите наблюдаются покраснение и отек наружного слухового прохода, периодические ноющие боли, резкая болезненность при надавливании на козелок ушной раковины.
При среднем отите появляются пульсирующие или ноющие боли (прострелы) разной интенсивности, температура обычно повышается до 38–39°С, возникает ощущение заложенности уха, различные шумы, гноетечение.
Внутренний отит – это последствие запущенного отита среднего уха. Наблюдаются головокружение, снижение слуха, тошнота, рвота. Главной причиной отита считается инфекция, часто проникающая в ухо из носоглотки. Произойти это может даже при высмаркивании, поэтому часто отит и ринит идут рука об руку. Причиной отита может стать и тонзиллит, скарлатина, корь и т. д. Отит может развиться на фоне травм уха.
Бактерии наступают
Вопросы, связанные с лечением инфекционно-воспалительных заболеваний уха и верхних дыхательных путей, чрезвычайно актуальны. Как уже было отмечено, возбудителями заболеваний могут быть бактерии и вирусы. В первом случае показано применение антибиотиков, а вот при вирусных инфекциях оно не только бесперспективно, но и опасно. В мире около 75% антимикробных средств применяются нерационально. Антибиотики не оказывают противовирусного действия, не предотвращают развитие бактериальных осложнений, но могут вызвать формирование к ним резистентности у бактерий, а так же стать причиной возникновения у пациентов нежелательных побочных эффектов лекарств.
Так, на сегодняшний день 90% штаммов стафилококков устойчивы к природным пенициллинам [3]. Ученые полагают, что в течение ближайших десятилетий может сложиться ситуация, когда не останется ни одного эффективного антибиотика.
Альтернатива антибиотикам
Передовые технологи будущего заложены в прошлом. Еще до наступления эры антибиотиков, в 1896 г., были открыты бактериофаги. Это вирусы, которые размножаются, питаясь клетками болезнетворных микроорганизмов, разрушая их изнутри.
Поэтому фаготерапия – метод лечения максимально приближенный к естественному природному процессу (фаголизис – разрушение бактерий фагами – происходит в пораженном бактериями органе при естественном выздоровлении).
Поскольку бактериофаги постоянно эволюционируют, бактерии не вырабатывают к ним устойчивость. Поэтому фаги способны уничтожать микробы, перед которыми антибиотики уже бессильны. Кроме того, в отличие от антибиотиков, они действуют строго избирательно. Определенный вид фага уничтожает только соответствующий вид болезнетворных бактерий. Это позволяет сохранить нормальный биоценоз организма и не допустить побочных эффектов. А чтобы столь специфичные «вкусовые пристрастия» бактериофагов не снижали эффективности терапии, разработаны препараты, в которых содержится не один, а несколько групп фагов, действующих на разные виды бактерий.
Бактериофаги – новая эра лекарств:
- высокоспецифичны – воздействуют на виды чувствительных к ним бактерий;
- самовоспроизводимы – действуют до полного исчезновения бактериальной инфекции;
- саморегулируемы – в отсутствие специфических бактерий выводятся из организма через почки;
- не вызывают аллергических реакций;
- стимулируют специфический и неспецифический иммунитет;
- совместимы с любыми другими лекарственными препаратами;
- обладают высоким профилем безопасности – можно назначать детям, кормящим и беременным женщинам.
Бактериофаги можно рекомендовать тем посетителям аптеки, которые по медицинским показаниям не могут применять антибиотики (при диареях, вызванных антибиотиками, дисбактериозе, аллергических реакциях на антибиотики, беременным, детям, включая новорожденных, и др. ).
).
Они эффективны при воспалительных заболеваниях пазух носа, ротовой полости, верхних дыхательных путей, инфекциях желудочно-кишечного тракта, мочеполовой системы и др. Они могут применяться не только для лечения, но и для профилактики.
Секстафаг – у микробов белый флаг!
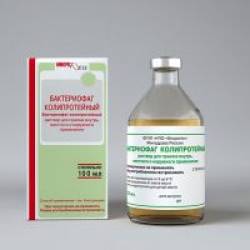
Лекарственный препарат бактериофагов Секстафаг производства ФГУП «НПО «Микроген» Минздрава России применяют для лечения и профилактики воспалительных заболеваний, вызванных воздействием 6-ти разных микробов (стафилококков, стрептококков, протея, клебсиелл пневмонии, синегнойной и кишечной палочек).
Спектр показаний к применению препарата очень широк, но в профилактике и лечении инфекционно-воспалительных заболеваний уха и верхних дыхательных путей Секстафаг можно рекомендовать в случае ринита, отита, фарингита, тонзиллита.
Препарат выпускается в виде раствора для приема внутрь, местного и наружного применения (флакон 20 мл No 4). При инфекционно-воспалительных заболеваниях уха и верхних дыхательных путей Секстафаг применяется по следующей схеме:
- для профилактики – промывание носа и полоскание горла;
- для лечения – принимается внутрь по 10 мл 3 раза в день; промывание носа и полоскание горла в течение 3-х – 14-ти дней.
Противопоказаний к использованию препарата нет (за исключением индивидуальной повышенной чувствительности к компонентам). Побочные эффекты так же не выявлены. Из аптек Секстафаг отпускается без рецепта.
Назад к списку
Бактериофаги: медицина будущего
На днях начал работу первый в России Биологический ресурсный центр исследования бактериофагов – вирусов, поражающих бактерии. Новая структура создана на базе компании «Микроген», входящей в холдинг «Нацимбио» Госкорпорации Ростех.
Центр станет своеобразной коллекцией, в которой уже насчитывается около 10 тыс. микроорганизмов. Это уникальный материал, на основе которого удастся создать новые препараты бактериофагов и в перспективе 5-7 лет разработать основу для перехода к персонализированной фаготерапии.
микроорганизмов. Это уникальный материал, на основе которого удастся создать новые препараты бактериофагов и в перспективе 5-7 лет разработать основу для перехода к персонализированной фаготерапии.
Бактериофаги – «пожиратели» бактерий
На самом деле, бактериофаги – это вирусы. Но только не те вирусы, которые поражают человека или животных. Бактериофаги уничтожают исключительно бактерии, или точнее – пожирают их (от греческого phagos – «пожиратель»). Эти миниатюрные (размером в среднем от 20 до 200 нанометров) враги бактерий очень распространены на нашей планете, найти их можно практически везде: в воде, глубоко под землей, в почве и даже в макроорганизмах. Бактериофаги используют в научных исследованиях, но, конечно, их основное практическое применение – борьба с бактериями.
Каждый бактериофаг поражает только те бактерии, против которых направлен. Когда фаг замечает «свою» бактерию, он моментально прикрепляется к оболочке ее клетки, после чего вводит собственную нуклеиновую кислоту (геном) внутрь бактерии. Его цель – заставить бактериальную клетку «работать на себя», то есть начать в ней процесс своего размножения.
Бактериофаговая активность. Маленькие пятна – область лизиса бактерий, вызванного фагами
Вскоре внутри бактерии формируются новые бактериофаги, и начинается процесс лизиса – распада бактериальной клетки и выход зрелых фагов. Таким образом, на свет появляются сотни новых бактериофагов, готовых к нападению. «Литический цикл» вновь повторяется. При всей своей кажущейся агрессивности, этот процесс абсолютно безвреден и не причиняет никаких побочных эффектов остальной микрофлоре организма.
Бактериофаги – далеко не новый биологический вид, а древнейшая группа вирусов.
В 1940 году бактериофагами заинтересовались за океаном – американские фармацевтические компании пытаются коммерциализировать идею фаготерапии. Но «фаготерапевтическому буму» вскоре приходит конец. Событие, которое отложило исследование фаготерапии на долгие годы – начало промышленного производства пенициллина. Несмотря на то что Александр Флеминг открыл пенициллин еще в 1928 году, первое время его идея не получила широкого применения из-за отсутствия возможности химического производства антибиотика. И только в начале 1940-х годов в Англии, США и СССР организуется промышленный выпуск пенициллина.
Бактерии vs. Человечество: глобальное сопротивление
Случайное открытие Флеминга ознаменовало начало новой эры в медицине. Человечество смогло побороть множество смертельных бактериальных заболеваний, которые на протяжении тысячелетий оставались неизлечимыми.
Но наряду с возможностями антибиотиков, Флеминг обнаружил и другое – при недостаточном количестве пенициллина или если его действие было непродолжительным, бактерии приобретали устойчивость к антибиотику. Флеминг об этом рассказывал в своих выступлениях по всему миру и не раз предупреждал, что не стоит использовать пенициллин, пока заболевание не будет диагностировано, а при необходимости применения антибиотика, его нельзя использовать в течение короткого времени и в совсем малых количествах. К сожалению, это предостережение не помогло.
К сожалению, это предостережение не помогло.
Уже к 1945 году пенициллин стал доступен повсеместно, активно создавались и другие антибиотики. На протяжении последующих десятилетий они применялись практически бесконтрольно. К примеру, одной из проблем стало самолечение антибиотиками среди населения. Причем при самостоятельном выборе антибиотика часто предпочтение отдавалось именно препаратам широкого спектра действия. Антибиотики стали также широко применяться в сельском хозяйстве – до 80% всех антибиотиков в мире используют для лечения скота. Все это ускорило темпы формирования «антибиотикорезистентности» (от английского resist – «сопротивляться») и привело к тому, что многие инфекционные заболевания снова стали неизлечимы.
Легионеллы – патогенные грамотрицательные бактерии
«Все хотят жить, в том числе и микробы, – рассказывает РИА «Новый день» доктор медицинских наук Тамара Перепанова. – Они развивают сопротивляемость. И эта борьба складывается в пользу микроорганизмов. Они вырабатывают новые штаммы быстрее, чем все фармакологии мира разрабатывают новые препараты. И вот уже антибиотик неэффективен». К слову, самый первый антибиотик – пенициллин – практически бесполезен сегодня: у бактерий к нему развилась почти полная устойчивость.
В 2017 году Всемирная организация здравоохранения (ВОЗ) впервые опубликовала список устойчивых к действию антибиотиков «приоритетных патогенов» – 12 видов бактерий, представляющих наибольшую угрозу для здоровья человека. В их числе – Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacteriaceae, Enterococcus faecium, Staphylococcus aureus, Helicobacter pylori, Campylobacter spp., Salmonellae, Neisseria gonorrhoeae, Streptococcus pneumoniae, Haemophilus influenzae, Shigella. За всеми этими названиями – очень серьезные заболевания: сепсис, менингит, пневмония, брюшной тиф, дизентерия и другие.
По данным ВОЗ практически все существующие патогенные для человека бактерии приобретут устойчивость к антибиотикам уже через 10-20 лет. По прогнозам, к 2050 году число жертв бактериальных инфекций возрастет до 10 млн в год. Кстати, с уверенностью можно констатировать, что для любого жителя нашей страны вероятность подцепить бактериальную инфекцию, устойчивую ко всем основным антибиотикам, сейчас гораздо выше, чем заразиться вирусом из Китая.
По прогнозам, к 2050 году число жертв бактериальных инфекций возрастет до 10 млн в год. Кстати, с уверенностью можно констатировать, что для любого жителя нашей страны вероятность подцепить бактериальную инфекцию, устойчивую ко всем основным антибиотикам, сейчас гораздо выше, чем заразиться вирусом из Китая.
Антибиотики и бактериофаги – оружие против одного врага
Сегодня существующие антибиотики в большинстве случаев все еще работают. Но ученые уже назвали борьбу с бактериями «главным вызовом времени». Проблема антимикробной резистентности рассматривается на глобальном уровне, и мировое научное сообщество активно ищет пути ее решения. Конечно, первый выход из ситуации – это создание новых видов антибиотиков. Но на разработку одного препарата, его клинические испытания и внедрение в массовое производство уходит в среднем 10 лет. Второй явный минус – это стоимость: создание нового антибиотика обходится в миллиарды долларов.
Поэтому ученые все чаще стали вспоминать «старую» альтернативу антибиотикам – бактериофаги. Как отмечают эксперты отрасли, создание бактериофага обходится в десятки раз дешевле, чем антибиотика. Но главное преимущество фагов – не в стоимости, а в их способности изменяться вслед за бактерией. Кроме того, бактериофаги не имеют побочных эффектов и не нарушают естественную флору организма.
Структура типичного миовируса бактериофага
Тем не менее антибиотики никуда не исчезнут с полок аптек и из арсенала врачей. Как отмечают специалисты, антибиотики и бактериофаги – оружие против одного врага. Только действуют они по-разному. Антибиотики можно сравнить с тяжелой артиллерией. Они необходимы, когда действовать нужно быстро, и возможные побочные эффекты меркнут перед критическим состоянием пациента. Бактериофаги – это снайпер, который прицельно уничтожает только один вид бактерий.
Действительно, плюс антибиотиков – отсутствие узкой специализации. Один антибиотик способен лечить довольно широкий круг бактериальных инфекций. Но, как уже отмечалось выше, не обходится без побочных эффектов – от антибиотиков страдают не только инфекционные бактерии, но и полезные бактерии нашей микрофлоры. Поэтому длительное употребление антибиотиков нередко вызывает дисбактериоз.
Один антибиотик способен лечить довольно широкий круг бактериальных инфекций. Но, как уже отмечалось выше, не обходится без побочных эффектов – от антибиотиков страдают не только инфекционные бактерии, но и полезные бактерии нашей микрофлоры. Поэтому длительное употребление антибиотиков нередко вызывает дисбактериоз.
Бактериофаги обладают узкой специализацией, поэтому для каждой бактерии нужно выделить свой терапевтический фаг. Положительная сторона такой специализации – более «прицельный» удар: ликвидируется только инфекционная бактерия, а полезные не страдают.
Фаготерапия по-русски
Эксперты отмечают, что производство бактериофагов – весьма перспективное направление в фармацевтической промышленности. Кстати, наша страна в производстве бактериофагов исторически занимает ведущие позиции. Уже в годы Великой Отечественной войны применялась фаготерапия. Особое внимание уделялось разработке бактериофагов против кишечных инфекций – холеры, брюшного тифа, дизентерии и сальмонеллеза. Всего в военное время для фронта было изготовлено более 200 тыс. литров бактериофагов.
Сегодня в нашей стране развитие производства лекарственных препаратов на основе бактериофагов входит в Стратегию предупреждения распространения антимикробной резистентности в Российской Федерации до 2030 года, принятую Правительством РФ. Единственный в стране производитель препаратов бактериофагов – компания «Микроген» холдинга «Нацимбио» Госкорпорации Ростех. В период с 2017 по 2019 год продажи бактериофагов «Микрогена» выросли более чем на 25% в денежном выражении.
Компанией разработаны и выпускаются 19 наименований лекарств на основе бактериофагов против множества известных возбудителей инфекционных заболеваний: дизентерии, брюшного тифа, сальмонеллеза, гнойно-септических и других. Кроме того, разработаны комбинированные препараты, например «Секстафаг» (Пиобактериофаг поливалентный). Он обладает способностью справиться с бактериями стафилококков, стрептококков (в том числе энтерококков), протея, клебсиелл пневмонии, синегнойной и кишечной палочек. Данный препарат отличается высокой степенью очистки от бактериальных метаболитов, что позволяет успешно использовать его для лечения новорожденных и детей раннего возраста, а также применять для беременных.
Он обладает способностью справиться с бактериями стафилококков, стрептококков (в том числе энтерококков), протея, клебсиелл пневмонии, синегнойной и кишечной палочек. Данный препарат отличается высокой степенью очистки от бактериальных метаболитов, что позволяет успешно использовать его для лечения новорожденных и детей раннего возраста, а также применять для беременных.
В рамках Стратегии по борьбе с антимикробной резистентностью ученые НПО «Микроген» проводят множество исследований. В настоящий момент предприятие приступило к созданию первого в России Биологического ресурсного центра для углубленного изучения бактериофагов.
«Задача Биологического ресурсного центра – объединить микробные производственные коллекции, собранные на территории России. На данный момент это более 10 тыс. штаммов. В коллекцию также входят бактериофаги для терапевтических целей. Это уникальный материал, представляющий собой государственную ценность, на его основе удастся создать новые виды лекарств», – прокомментировал исполнительный директор Госкорпорации Ростех Олег Евтушенко.
Но, пожалуй, самой амбициозной целью нового центра является создание основы для перехода к персонализированной фаготерапии в ближайшие 5-7 лет. Персонально подобранный «коктейль» из бактериофагов может спасти жизнь пациентам, которым уже не помогают антибиотики.
Успехи российских и зарубежных ученых вселяют надежду на то, что проблема антимикробной резистентности в скором времени может быть преодолена. Тем временем каждый из нас в этой борьбе с «супербактериями» может внести свой маленький вклад – соблюдать правила, которые помогут уберечься от вирусов и бактерий, остановить появление новых опасных инфекций. Все просто: не забывать о гигиене, вести здоровый образ жизни, вовремя обращаться к врачам и ограничить использование антибиотиков.
Пио бактериофаг жидкий 20 мл №4 жидк. д/приема внутрь, местного и наружного прим.
 во фл.
во фл.Инструкция по медицинскому применению
лекарственного средства
Пио бактериофаг жидкий
Торговое название
Пио бактериофаг жидкий
Международное непатентованное название
Нет
Лекарственная форма
Жидкость для приема внутрь, местного и наружного применения
Состав
1 мл препарата содержит
активное вещество:
Смесь стерильный фильтрат фаголизатов бактерий:
Staphylococcus,
Streptococcus,
Escherichia coli.
Proteus,
Pseudomonas aeruginosa,
титр фага не менее 1х106;
вспомогательное вещество: нет
Описание
Прозрачная жидкость желтого цвета различной интенсивности со специфическим вкусом.
Фармакотерапевтическая группа
Антибактериальные препараты для системного использования.
Другие антибактериальные препараты
Код АТХ J01XX
Фармакологические свойства
Фармакокинетика
Независимо от способа введения, препараты бактериофагов проникают в кровь и лимфу и попадают в очаг воспаления. Основная часть препарата выводится почками, оказывая санирующий эффект на мочевыводящие пути, а остальная часть – через желудочно-кишечный тракт.
Фармакодинамика
Бактериофаг является специфическим вирусом бактерии, который адсорбируется на мембране клетки гомологической бактерии, проникает в клетку и лизирует ее. В состав Пио бактериофаг жидкий входят селективные, только вирулентные фаги бактерий: Streptococcus, Staphylococcus, Escherichia coli, Pseudomonas aeruginosa, Proteus, что обеспечивает высокую активность и эффективность препарата.
Показания к применению
Лечение и профилактика гнойно-воспалительных заболеваний, обусловленных бактериями Streptococcus, Staphylococcus, Escherichia coli, Pseudomonas aeruginosa, Proteus
– инфекции лор-органов и дыхательных путей (воспаление пазух носа, среднего уха, ангина, фарингит, ларингит, трахеит, бронхит, пневмония, плеврит)
– хирургические инфекции (гнойная рана, ожог, абсцесс, флегмона, фурункул, карбункул, гидроаденит, панариций, парапроктит, мастит, бурсит, остеомиелит)
– урогенитальные инфекции (уретрит, цистит, пиелонефрит, кольпит, эндометрит, сальпингоофорит)
– инфекции желудочно-кишечного тракта (стоматит, парадонтит,
холецистит, энтероколит, дисбактериоз кишечника)
– генерализованные септические заболевания
– гнойно-воспалительные заболевания новорожденных (омфалит, пиодермия, конъюнктивит, сепсис)
– обработка свежих ран для профилактики гнойных осложнений при хирургических манипуляциях и операциях
– профилактика бактериальных осложнений при острых респираторно-
вирусных заболеваниях
Способ применения и дозы
Важным условием успешного применения препаратов бактериофагов является определение фагочувствительности возбудителя и ранее применение препарата. Особенно эффективен препарат в начальной стадии заболевания и при применении непосредственно в очаге поражения.
Особенно эффективен препарат в начальной стадии заболевания и при применении непосредственно в очаге поражения.
Пио бактериофаг жидкий назначается для приема внутрь (через рот, в виде клизм), местно (в виде полосканий, орошений, примочек), для введения в полость (рана, абсцесс, брюшная, плевральные полости, флегмона, нос, пазухи носа, среднего уха, мочевого пузыря, матки, влагалища).
Для лечения гноино-восполительных заболеваний с локальныими поражениями Пио бактериофаг жидкий назначается одновременно: как местно, так для приема внутрь (per os). Длительность курса лечения препаратом от 5 до 10 дней.
Дозировка определяется индивидуально, в зависимости от размеров пораженного участка. Препарат вводится в полость очага после удаления гноя с помощью пункции. Количество вводимого препарата должно быть несколько меньше объёма удаленного гноя.
В последующие дни, вводится препарат в инфицированную полость, с помощью дренажа.
Процедура проводится 1 раз в день, в течение 3-5 дней.
· При циститах, пиелонефритах, уретритах препарат принимается внутрь.
В случае если полость мочевого пузыря или почечной лоханки дренированы, бактериофаг вводят 2 раза в день по 20-30 мл в мочевой пузырь и по 5-10 мл в почечную лоханку;
· При гнойно-воспалительных гинекологических заболеваниях препарат вводится в полость вагины, матки, в дозе 5-10 мл ежедневно, однократно.
· При гнойно-воспалительных заболеваниях уха, горла, носа препарат вводится в дозе 2-10 мл 1-3 раза в день. Бактериофаг используют для полоскания, промывания, закапывания, введения смоченных турунд (оставляя их на 1 час). Для лечения гнойного Тонзиллита препарат применяется для полоскания и назначается также, per so, одновременно.
· При лечении стоматитов и хронических генерализованных пародонтитов препарат применяется в виде полосканий полости рта 3-4 раза в день в дозе 10-20 мл, а также вводиться в пародонтальные карманы турунды, пропитанные пиобактериофагом, на 5-10 минут.
· При кишечных формах заболевания, заболеваниях внутренних органов, дисбактериоз, Пио бактериофаг жидкий применяется через рот и в клизме.
Препарат дается пить натощак, за 1 час до еды.
В виде клизм назначается 1 раза в день, вечером, перед сном, после опорожнения кишечника.
Рекомендуемые дозировки препарата:
Возраст
через рот
в клизме
До 6 месяцев
5 мл х 1 раз в день
10 мл х 1 раз в день
От 6 до 12 месяцев
5 мл х 2 раза в день
10 мл х 1 раз в день
От 1 года до 3 лет
5 мл х 3 раза в день
20 мл х 1 раз в день
От 3 лет до 8 лет
10 мл х 2-3 раза в день
30 мл х 1 раз в день
8 лет и старше
20 мл х 2-3 раза в день
40 мл х 1 раз в день
Доза лекарственного средства для профилактического использования
определяется врачом .
Примечание
В случае если до применения препарата Пио бактериофага для лечения ран применялись химические антисептики, рана должна быть тщательно промыта стерильным 0,9% раствором натрия хлорида.
Побочные действия
Препараты бактериофагов нетоксичны. Нежелательные эффекты и реакции связанные с применением Пио бактериофаг жидкий не отмечены.
Противопоказания
Гиперчувствительность к какому-либо компоненту содержимого флакона препарата.
Лекарственные взаимодействия
Взаимодействие с другими лекарственными средствами препаратов бактериофагов не установлено. Пио бактериофаг жидкий может применяться с другими лекарственными средствами, в том числе и с антибактериальными препаратами.
Особые указания
При помутнении препарат не применять!
Вследствие содержания в препарате питательной среды, в которой могут развиваться бактерии из окружающей среды, вызывая помутнение препарата, необходимо при вскрытии флакона соблюдать следующие правила:
– тщательно мыть руки;
– обработать колпачок спиртсодержащим раствором;
– снять колпачок, не открывая пробки;
– не класть пробку внутренней поверхностью на стол или другие предметы;
– не оставлять флакон открытым;
– вскрытый флакон хранить только в холодильнике.
При использовании малых доз (2-8 капель) препарат необходимо отбирать стерильным шприцем в объеме 0,5-1 мл.
Препарат из вскрытого флакона при соблюдении условий хранения, вышеперечисленных правил и отсутствии помутнения может быть использован в течение 24 часов после вскрытия, при хранении в соответствующих условиях.
Беременность и период лактации
Препараты бактериофагов можно применять в период беременности и лактации.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Специальных предписаний нет.
Передозировка
Симптомы передозировки препаратов бактериофагов неизвестны.
Форма выпуска и упаковка
По 20 мл во флаконе из медицинского стекла, по 4 флакона вместе с инструкцией по медицинскому применению в каробке картонной.
Условия хранения
Препарат хранится при температуре 2oС – 25oС в сухом защищенном от света месте.
Хранить в недоступном для детей месте.
Срок хранения
2 года.
Не применять после истечения срока годности указанного на упаковке.
Условия отпуска из аптек
Без рецепта врача.
Производитель
АО «Биохимфарм»
Адрес: ул. Готуа 3, Тбилиси 0160, Грузия,
Тел: +995 32 2 244777 / 2 244778, факс: +995 32 2 380895;
Эл-почта: [email protected] ; www.biochimpharm.ge
Наименование и страна владельца регистрационного удостоверения
АО «Биохимфарм»
Адрес: ул. Готуа 3, Тбилиси 0160, Грузия
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара)
Представитель в РК г.Алматы 050012 ул. Казыбек би дом № 125 / 198
телефон +7 707 723 27 72
+7 707 728 02 71
+7 727 301 81 83
адрес электронной почты: [email protected]
Бактерии, устойчивые ко всем популярным антибиотикам, добрались до Великобритании
21 декабря британские биологи объявили об обнаружении в различных бактериальных пробах, взятых на острове как у людей, так и у домашнего скота, бактерий, содержащих ген mcr-1. Этот ген, появляющийся у микроорганизмов благодаря недавно открытому механизму передачи генов MCR-1, наделяет их способностью сопротивляться колистину – антибиотику, обычно используемому в качестве «последнего средства».
Этот ген, появляющийся у микроорганизмов благодаря недавно открытому механизму передачи генов MCR-1, наделяет их способностью сопротивляться колистину – антибиотику, обычно используемому в качестве «последнего средства».
Первый антибиотик, принадлежащий к классу пенициллинов, был открыт в 1928 году, а широкое распространение получил во время Второй Мировой войны. С тех пор было открыто большое разнообразие антибиотиков, разделяемое специалистами на группы, подгруппы и классы. Однако последний класс антибиотиков был открыт в 1987 году – но эволюцию микроорганизмов никто не останавливал.
В рамках естественного отбора после появления нового класса антибиотиков неизбежно появляются бактерии, устойчивые и к этому классу. В связи с этим некоторые исследователи предупреждают об опасности “апокалипсиса антибиотиков” – наступления такого момента, когда против новых штаммов бактерий все известные антибиотики окажутся бессильными. По словам исследователей, после этого человечество вернётся в то не очень приятное прошлое, в котором можно умереть от простого пореза пальца.
В частности, известно понятие «госпитального штамма», когда разные формы золотистого стафилококка выживают в условиях стационаров, где усиленно применяются антибиотики, и мутируют в устойчивые к лекарствам формы.
Причины замедления исследований в области антибиотиков называются самые разные. Например, фармацевтическим компаниям гораздо выгоднее заниматься лекарствами от диабета или повышенного давления, поскольку такие лекарства очень быстро и широко выходят на рынок. Антибиотики же остаются средством, применяемым в последнюю очередь.
Кроме этого, некоторые говорят о торможении медицинских исследований, происходящем по причинам защиты авторских прав. Многие обвиняют в трудностях подобных исследований слишком сильные ограничения, наложенные регуляторами в данных областях. Сами же учёные в настоящий момент чрезмерно увлечены генетическими исследованиями, наноинженерией и синтетической биологией, в результате чего вопрос исследования антибиотиков отошёл на второй план.
В настоящий момент одобренным антибиотиком последнего поколения является колистин. Впервые он был открыт японским учёным ещё в 1949 году, и сейчас к нему обращаются в тех случаях, когда остальные антибиотики не помогли.
В ноябре 2015 года впервые был открыт механизм переноса гена устойчивости к колистину, MCR-1, в Китае. Скорее всего, из-за чрезмерного увлечения этим антибиотиком на фермах, выращивающих домашний скот, у бактерий и появился ген, дающий устойчивость к колистину. Такие бактерии были обнаружены у каждого пятого животного и в 15% из проверенного свежего мяса. При этом было обнаружено уже несколько видов бактерий, содержащих ген mcr-1: E. coli, Klebsiella pneumoniae и Pseudomonas aeruginosa.
А уже в декабре бактерии, имеющие подобный механизм, были обнаружены в Нидерландах, Лаосе, Малайзии, Португалии и Дании. Два дня назад об обнаружении бактерий сообщили и из Британии.
«Теперь у нас есть все компоненты, необходимые для наступления пост-антибиотической эры,- предостерегает британский профессор Тимоти Уолш [Timothy Walsh] из Университета Кардиффа, участвовавший в исследовании бактерий. – Если MCR-1 превратится в глобальное явление,- а точнее, не если, а когда,- а затем этот ген скооперируется с другими генами, придающими устойчивость к другим видам антибиотиков, что неизбежно, это будет означать появление нового мира без антибиотиков. После этого, если пациент, допустим, заражён E. coli, вы не сможете ничего для него сделать».
Механизм передачи генов, придающих устойчивость к антибиотикам
В принципе, механизмы сопротивления колистину уже попадались биологам – но на этот раз передача мутировавших генов происходит просто, как никогда. Профессор Марк Уилкокс [Mark Wilcox] утверждает, что скорость передачи этих генов «до смешного» высока. Уилкокс говорит, что хотя пока не было зафиксировано какого-то одного достаточно крупного события, знаменующего конец эры антибиотиков, «битву мы точно проигрываем».
Недавно учёные объявили об открытии антибиотика нового типа – тейксобактина. Но его исследования ещё не завершены, учёные ещё пока даже не разобрались в механизме его действия и не отнесли его к какому-то определённому классу. Поэтому использовать его на людях и даже на домашнем скоте пока не представляется возможным.
Но его исследования ещё не завершены, учёные ещё пока даже не разобрались в механизме его действия и не отнесли его к какому-то определённому классу. Поэтому использовать его на людях и даже на домашнем скоте пока не представляется возможным.
официальная инструкция по применению, аналоги, цена, наличие в аптеках
Изделие медицинского назначения. Не является лекарством
гель c бактериофагамиРегистрационный номер:
ТС N RU Д-RU.АЮ18.В.00677Торговое название препарата:
ОтофагМеждународное непатентованное название:
Лекарственная форма:
гельСостав
Активное вещество: стерильная суспензия фаговых частиц в физиологическом растворе;Вспомогательные вещества: вода очищенная, карбопол, экстракт календулы.
Описание
Гель с бактериофагами для гигиены кожи ушных раковин
Фармакотерапевтическая группа
Код АТХ:
Фармакологические свойства
Гель с бактериофагами для гигиены кожи ушных раковин «Отофаг» (далее – Отофаг) применяют с целью нормализации микрофлоры и профилактики бактериальных воспалительных заболеваний уха, в том числе, при заболеваниях других ЛОР-органов.Отофаг содержит комплекс из 32 видов бактериофагов коллекции ООО НПЦ «МикроМир», подавляющих рост следующих патогенных бактерий:
- Bacteroides spp.
- Escherichia coli spp.
- Haemophilus influenzae spp.
- Klebsiella spp.
- Moraxella catarrhalis
- Morganella morganii
- Neisseria spp.
- Proteus vulgaris spp.
- Providencia rettgeri spp.
- Pseudomonas aeruginosa spp.
- Staphylococcus aureus spp.
- Streptococcus pyogenes spp.
Бактериофаги (с др.-гр.
 – «пожиратели бактерий») – вирусы, избирательно поражающие бактерии: каждый вид бактериофагов активен только в отношении определённого вида бактерий и нейтрален в отношении других видов. В клинической практике используются бактериофаги, которые уничтожают патогенные бактерии, не нарушая нормофлору человека и не взаимодействуя с его органами и системами. Это позволяет применять их у всех категорий пациентов (включая новорожденных, беременных и кормящих матерей) как эффективное и безопасное антибактериальное средство профилактики и терапии, в т. ч. в комбинации с антибиотиками. («Рациональное применение бактериофагов в лечебной и противоэпидемической практике. Федеральные клинические (методические) рекомендации». М., 2014).
– «пожиратели бактерий») – вирусы, избирательно поражающие бактерии: каждый вид бактериофагов активен только в отношении определённого вида бактерий и нейтрален в отношении других видов. В клинической практике используются бактериофаги, которые уничтожают патогенные бактерии, не нарушая нормофлору человека и не взаимодействуя с его органами и системами. Это позволяет применять их у всех категорий пациентов (включая новорожденных, беременных и кормящих матерей) как эффективное и безопасное антибактериальное средство профилактики и терапии, в т. ч. в комбинации с антибиотиками. («Рациональное применение бактериофагов в лечебной и противоэпидемической практике. Федеральные клинические (методические) рекомендации». М., 2014). Особенную актуальность имеет профилактический приём бактериофагов в тех случаях, когда клинические признаки бактериального инфицирования отсутствуют, а применение антибиотиков нежелательно из-за их побочных эффектов. Например, профилактика бактериофагами бактериальных осложнений вирусных и грибковых инфекций, травм, ожогов, хирургических вмешательств, а также профилактика собственно бактериальных инфекций при наличии различных факторов риска (сопутствующие заболевания, отдельные состояния, опасная эпидемиологическая ситуация и другие неблагоприятные факторы внешней среды).
В результате применения бактериофагов уничтожаются патогенные бактерии, поддерживается нормальный баланс микрофлоры, ослабляется негативное воздействие на организм инфекционного воспаления. Комплексное защитное действие бактериофагов помогает организму справиться с инфекцией и её последствиями, а регулярное профилактическое использование бактериофагов предотвращает новые случаи инфекционного воспаления или значительно снижает тяжесть его течения.
Показания к применению
- Гигиена ушных раковин у здоровых людей, в том числе, в период неблагоприятной эпидемиологической обстановки, при смене климатических поясов, при вредных воздействиях внешней среды и других рисках заражения бактериальными инфекциями.

- Профилактика бактериальных воспалительных заболеваний уха при наличии факторов риска, в том числе, сахарного диабета, онкологических заболеваний (особенно в период проведения лучевой и химиотерапии), сниженного местного и общего иммунитета, грибковых и вирусных инфекциях ЛОР-органов, аутоиммунных и других системных заболеваниях.
- Профилактика бактериальных воспалительных заболеваний уха (наружный и средний отит) и их рецидивов, в том числе, при заболеваниях носа (гайморит, ринит), горла (фарингит, абсцессы, ангина, хронический тонзиллит) и других респираторных заболеваниях (бронхит, эпиглоттит, грипп, ОРВИ).
- Профилактика бактериальных осложнений при хирургических вмешательствах и других лечебных манипуляциях в области уха и других ЛОР-органов.
- По назначению врача в других клинических ситуациях, при которых важно обеспечить высокую антибактериальную защиту и отсутствие побочных эффектов.
Противопоказания
Повышенная чувствительность к компонентам Отофага.Способ применения и дозы
- В домашних условиях Отофаг наносят на обрабатываемый участок непосредственно из флакона или салфеткой (ватным тампоном). Обработанный участок не мочить (гель не смывать) в течение 40 минут после применения Отофага.
- В условиях приёма специалиста Отофагом обрабатываются поражённые или травмированные участки уха и других ЛОР-органов.
Схемы применения и дозы
- гигиена ушных раковин у здоровых людей, в том числе, в период неблагоприятной эпидемиологической обстановки, при смене климатических поясов, при вредных воздействиях внешней среды и других рисках заражения бактериальными инфекциями:
- 1 мл Отофага (одно нажатие) наносят 2-3 раза в день после гигиенических мероприятий.

- Длительность профилактического курса – от 7 до 14 дней. Курс рекомендуется повторять каждый месяц.
- Длительность применения Отофага в профилактических целях не ограничена.
- 1 мл Отофага (одно нажатие) наносят 2-3 раза в день после гигиенических мероприятий.
- профилактика бактериальных воспалительных заболеваний уха при наличии факторов риска, в том числе, сахарного диабета, онкологических заболеваний(особенно в период проведения лучевой и химиотерапии), сниженного местного и общего иммунитета, грибковых и вирусных инфекциях ЛОР-органов, аутоиммунных и других системных заболеваниях:
- 1 мл Отофага (одно нажатие) 2-3 раза в день после гигиенических мероприятий.
- Длительность курса соответствует длительности действия фактора риска.
- При прекращении действия фактора риска рекомендуется схема применения для здоровых людей.
- профилактика бактериальных воспалительных заболеваний уха (наружный и средний отит) и их рецидивов, в том числе, при заболеваниях носа (гайморит, ринит), горла (фарингит, абсцессы, ангина, хронический тонзиллит) и других респираторных заболеваниях (бронхит, эпиглоттит, грипп, ОРВИ):
- доза Отофага определяется врачом исходя из конкретной клинической ситуации.
- Рекомендуется сочетать с применением в домашних условиях: 1 мл Отофага (одно нажатие) 3-4 раза в день после гигиенических мероприятий.
- Длительность курса домашних процедур – 3-4 недели. Частота повторения курсов -по рекомендации врача.
- Далее рекомендуется схема применения для здоровых людей.
- профилактика бактериальных осложнений при хирургических вмешательствах и других лечебных манипуляциях в области уха и других ЛОР-органов:
- доза Отофага определяется врачом исходя из конкретной клинической ситуации.
- Перед хирургическим вмешательством – 2-3 раза в день после гигиенических мероприятий в течение 7 дней до начала вмешательства.
- После хирургического вмешательства – 2-3 раза в день после гигиенических мероприятий в течение 7 дней.

- Далее рекомендуется схема применения для здоровых людей.
- по назначению врача в других клинических ситуациях, при которых важно обеспечить высокую антибактериальную защиту и отсутствие побочных эффектов:
- врач определяет схему применения, кратность и объём использования Отофага исходя из конкретной клинической ситуации.
Взаимодействие с другими лекарственными препаратами
- антибактериальные средства: Отофаг можно применять одновременно с антибактериальными средствами.
- антисептические средства:
- Отофаг можно применять одновременно с растворами хлоргексидина биглюконата 0,05% и 0,2%, гидроксиметилхиноксалиндиоксида 2,0%;
- из-за инактивации бактериофагов, входящих в состав Отофага, не рекомендуется одновременное использование с Отофагом следующих средств:
– средств на основе октенидина и феноксиэтанола;
– средств на основе солей полиакриловой кислоты;
– растворов перекиси водорода.
Особые указания
Предохранять дозатор от попадания грязи и инородных веществ. Очищать носик дозатора и колпачок от остатков геля. После использования следует всегда закрывать дозатор колпачком.Форма выпуска
Гель во флаконе 50 мл с дозатором и защитным колпачком.Срок годности
2 года.Условия хранения
В сухом, защищённом от света месте при температуре от 2°С до 8°С в течении 24 месяцев.После начала использования допускается хранение Отофага при комнатной температуре (не более 25°С) при условиях соблюдения стерильности и использования всего содержимого флакона в течение 60 дней. Тем не менее, в домашних условиях предпочтительным местом хранения Отофага является холодильник.
Условия отпуска
Отпускается без рецепта.Производитель
ООО «НВЦ Агроветзащита С. -П.», Россия,
-П.», Россия, 141315, Московская обл., г. Сергиев Посад, ул. Центральная, д. 1 по заказу ООО НПЦ «МикроМир», Россия,
107031, г. Москва, пер. Нижний Кисельный, д. 5/23, стр. 1.
Декларация о соответствии
№ ТС RU Д-RU.АЮ18.В.00677 от 12.12.2012 г., ТР ТС 009/2011.
Реквизиты организации, уполномоченной принимать претензии от потребителей
ООО НПЦ «МикроМир», Россия, 107031, г. Москва, пер. Нижний Кисельный, д. 5/23, стр. 1.
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Страница не найдена | Ліки-Інфо
ДОСТАВКА ТОВАРА ПО ВСЕЙ УКРАИНЕАвдеевка, Александрия, Александровск, Алмазная, Алупка, Алушта, Алчевск, Амвросиевка, Ананьев, Андрушёвка, Антрацит, Апостолово, Армянск, Артёмово, Артёмовск, Артёмовск, Арциз, Ахтырка, Балаклея, Балта, Бар, Барановка, Барвенково, Батурин, Бахмач, Бахчисарай, Баштанка, Белая Церковь, Белгород, Белз, Белицкое, Белогорск, Белозёрское, Белополье, Беляевка, Бердичев, Бердянск, Берегово, Бережаны, Березань, Березно, Березо́вка, Берестечко, Берислав, Бершадь, Бобринец, Бобрка, Бобровица, Богодухов, Богуслав, Болград, Болехов, Борзна, Борислав, Борисполь, Борщёв, Боярка, Бровары, Броды, Брянка, Бурштын, Бурынь, Буск, Буча, Бучач, Валки, Васильевка, Васильков, Ватутино, Вахрушево, Вашковцы, Великие Мосты, Верхнеднепровск, Верховцево, Вижница, Вилково, Винники, Винница, Виноградов, Вишнёвое, Владимир, Вознесенск, Волноваха, Волочиск, Волчанск, Вольногорск, Вольнянск, Ворожба, Вышгород, Гадяч, Гайворон, Гайсин, Галич, Геническ, Герца, Глобино, Глухов, Глиняны, Гнивань, Голая Пристань, Горловка, Горное, Горняк, Городенка, Городище, Городня, Городок, Городок, Горохов, Гребёнка, Гуляйполе, Дебальцево, Деражня, Дергачи, Джанкой, Дзержинск, Димитров, Днепродзержинск, Днепропетровск, Днепрорудное, Добромиль, Доброполье, Докучаевск, Долина, Долинская, Донецк, Дрогобыч, Дружба, Дружковка, Дубляны, Дубно, Дубровица, Дунаевцы, Евпатория, Енакиево, Жашков, Ждановка, Жёлтые Воды, Жидачов, Житомир, Жмеринка, Жолква, Залещики, Запорожье, Заставна, Збараж, Зборов, Звенигородка, Здолбунов, Зеленодольск, Зеньков, Зимогорье, Змиёв, Знаменка, Золотое, Золотоноша, Золочев, Зоринск, Зугрэс, Ивано, Измаил, Изюм, Изяслав, Иловайск, Ильинцы, Ильичёвск, Инкерман, Ирмино, Ирпень, Иршава, Ичня, Кагарлык, Казатин, Калиновка, Калуш, Каменец, Каменка, Каменка, Каменка, Камень, Канев, Карловка, Каховка, Керчь, Киверцы, Киев, Килия, Кировоград, Кировское, Кицмань, Кобеляки, Ковель, Кодыма, Коломыя, Комсомольск, Конотоп, Константиновка, Корец, Коростень, Коростышев, Корсунь, Корюковка, Косов, Костополь, Котовск, Краматорск, Красилов, Красноармейск, Красноград, Краснодон, Краснопартизанск, Красноперекопск, Красный Лиман, Красный Луч, Кременец, Кременчуг, Кривой Рог, Кролевец, Кузнецовск, Купянск, Ладыжин, Лановцы, Лебедин, Лисичанск, Лозовая, Лохвица, Лубны, Луганск, Лутугино, Луцк, Львов, Любомль, Люботин, Малин, Марганец, Мариуполь, Макеевка, Малая Виска, Мелитополь, Мена, Мерефа, Миргород, Мироновка, Миусинск, Могилёв, Молодогвардейск, Молочанск, Монастыриска, Монастырище, Мостиска, Мукачево, Надворная, Николаев, Николаев, Никополь, Нежин, Немиров, Нетешин, Новая Каховка, Новая Одесса, Новый Буг, Новоазовск, Нововолынск, Новгород, Новогродовка, Новомиргород, Новоград, Новодружеск, Новоднестровск, Новомосковск, Новопсков, Новоселица, Новоукраинка, Новый Роздол, Носовка, Обухов, Овруч, Одесса, Орджоникидзе, Орехов, Острог, Очаков, Павлоград, Первомайск, Первомайск, Первомайский, Перевальск, Перемышляны, Перечин, Перещепино, Переяслав, Першотравенск, Петровское, Пирятин, Погребище, Подволочиск, Подгайцы, Подгородное, Пологи, Полонное, Полтава, Попасная, Почаев, Приволье, Прилуки, Приморск, Припять, Пустомыты, Путивль, Пятихатки, Рава, Радехов, Радомышль, Радивилов, Рахов, Ржищев, Рогатин, Ровеньки, Ровно, Рожище, Ромны, Рубежное, Рудки, Саки, Самбор, Сарны, Свалява, Сватово, Свердловск, Светловодск, Севастополь, Северодонецк, Седнев, Селидово, Семёновка, Середина, Симферополь, Синельниково, Скадовск, Скалат, Сквира, Сколе, Славута, Славутич, Славянск, Смела, Снежное, Снигирёвка, Снятын, Сокаль, Сокиряны, Соледар, Старобельск, Староконстантинов, Старый Крым, Старый Самбор, Стаханов, Сторожинец, Стрый, Судак, Сумы, Суходольск, Счастье, Таврийск, Тальное, Тараща, Татарбунары, Теплодар, Тернополь, Терновка, Тетиев, Тысменица, Тлумач, Теребовля, Тростянец, Трускавец, Токмак, Торез, Тульчин, Тячев, Угледар, Угнев, Узин, Украинка, Ужгород, Умань, Устилуг, Фастов, Феодосия, Харцызск, Харьков, Херсон, Хмельник, Хмельницкий, Хорол, Хотин, Христиновка, Хуст, Хыров, Цюрупинск, Червоноград, Червонозаводское, Червонопартизанск, Черкассы, Чернигов, Чернобыль, Черновцы, Чигирин, Чоп, Чортков, Чугуев, Шаргород, Шахтёрск, Шепетовка, Шостка, Шпола, Шумск, Щёлкино, Щорс, Энергодар, Южное, Южноукраинск, Яворов, Яготин, Ялта, Ямполь, Яремче, Ясиноватая
Бактериофаги: Что? Как? Когда?
Тема конференции заинтересовала многих, и это понятно: с заболеваниями уха, горла и носа время от времени сталкивается каждый из нас. И все мы заинтересованы в поисках наилучшего способа лечения. Именно о нем и шла речь в рамках нашей конференции.
И все мы заинтересованы в поисках наилучшего способа лечения. Именно о нем и шла речь в рамках нашей конференции.
Вопросов мы получили много, действительно много, что лишний раз подтвердило: когда речь идет о здоровье – своем и близких, – мы готовы докапываться до сути, искать самые лучшие, безопасные и эффективные средства. И конечно, многие заинтересовались тем, что же такое «бактериофаги», о которых было заявлено в теме конференции. Спасибо всем, кто участвовал в нашем разговоре.
Вирусы или бактерии?
Мы обратили внимание на то, что нашему эксперту пришлось несколько раз подчеркивать, что ЛОР-заболевания могут иметь разную природу – бактериальную или вирусную. В зависимости от этого лечение будет разным. Хочется еще раз остановиться на этом важном моменте, чтобы в дальнейшем все мы могли избежать ошибок при выборе препаратов.
Вирусы – это живая форма, которая проникает в организм, размножается и повреждает клетки. За счет этого развивается вирусная инфекция. Вирусы вызывают такие распространенные заболевания, как грипп и ОРВИ. Сначала начинаются катаральные явления, затем очень быстро присоединяются температура и общие недомогания. Для лечения заболеваний применяются противовирусные препараты.
Бактерии бывают вредными (патогенными) и полезными (например, бактерии, обеспечивающие процесс пищеварения). Патогенные бактерии становятся причиной таких болезней, как ангина, бронхит, пневмония, синусит, воспаление уха.
Бактериальные инфекции часто возникают как осложнение после вирусного заболевания. Это связано с тем, что иммунитет человека, который перенес ОРВИ, ослаблен, поэтому организм быстрее сдается под натиском бактерий. Основной способ справиться с бактериальным заболеванием – это использование антибиотиков, которые бессильны против вирусов. Или же применение бактериофагов.
Бактериофаги действуют против бактерий
Отвечая на вопросы читателей, эксперт неоднократно подчеркивал – для лечения бактериальных (а не вирусных!) заболеваний врачи рекомендуют использовать препараты бактериофагов, которые отличаются высокой эффективностью и безопасностью.
Бактериофаги: Что? Как? Когда?
«Бактериофаги абсолютно безвредны для человека и уничтожают только бактерии, в том числе возбудителей различных ЛОР-заболеваний (стафилококков, стрептококков и др.). Препараты бактериофагов можно использовать для профилактики бактериальных осложнений (синуситы, риносинуситы, фарингиты, тонзиллиты, отиты), часто возникающих после вирусных инфекций», – отметил он.
В чем же преимущество бактериофагов, в том числе и перед антибиотиками? Их несколько. Во-первых, безопасность, что особенно подчеркивал эксперт. Во-вторых, возможность использовать их для профилактики осложнений после вирусных инфекций. В-третьих, бактериофаги можно принимать беременным и кормящим женщинам, а также их можно давать грудным младенцам. В случае приема антибиотиков для этих категорий пациентов существует множество оговорок, а вот при приеме бактериофагов – нет. И в-четвертых, бактериофаги можно применять множеством разных способов: их действенность от этого не меняется. «Препаратами бактериофагов можно полоскать горло, закапывать их в нос», – отметил эксперт.
Современные технологии позволяют изготавливать препараты, содержащие несколько бактериофагов. Они оказываются более эффективными в борьбе с инфекциями, так как действуют сразу в нескольких направлениях. Например, «Секстафаг®», который производит российская компания ФГУП «НПО «Микроген» Минздрава России, содержит шесть активных компонентов. Благодаря сложному составу, «Секстафаг®» предотвращает или эффективно лечит воспалительные заболевания уха, горла, носа, дыхательных путей. А стимулирование местного иммунитета помогает избежать повторной атаки бактерий на организм.
Необходима консультация специалиста
Реклама
Что такое бактериофаги и чем они могут нам помочь?
Антибиотики перестанут работать.
 Бактерии развивают резистентность к лекарствам, которые мы используем для их лечения, и нет никаких сомнений в том, что без каких-либо действий заражение тонзиллитом, инфекция или хирургическое вмешательство будут намного более опасными. В связи с глобальным кризисом в области здравоохранения, ученые всего мира сейчас пытаются найти альтернативы лекарствам, которые поддерживали нашу жизнь в течение последнего десятилетия.
Бактерии развивают резистентность к лекарствам, которые мы используем для их лечения, и нет никаких сомнений в том, что без каких-либо действий заражение тонзиллитом, инфекция или хирургическое вмешательство будут намного более опасными. В связи с глобальным кризисом в области здравоохранения, ученые всего мира сейчас пытаются найти альтернативы лекарствам, которые поддерживали нашу жизнь в течение последнего десятилетия.Одно из возможных решений – использование бактериофагов. Они звучат немного чуждо, они даже выглядят немного чуждыми, но эти микроскопические солдаты могут стать ключом к борьбе с некоторыми из самых смертоносных бактерий, когда наши нынешние противомикробные препараты в конечном итоге не сработают.
Доктор Антония Сагона – исследователь из Школы наук о жизни в Уорике, работает над пониманием того, как фаги борются с инфекциями.
Пожиратели бактерийОна объясняет: «Бактериофаги или фаги – это вирусы, которые могут специфически заражать бактерии.Название буквально означает «пожиратель бактерий», и они действуют, паразитируя на бактериальных клетках, поедая их изнутри. Бактериофаги распространены на Земле в изобилии и присутствуют там, где есть их хозяева. Одним из наиболее важных структурных элементов бактериофага являются волокна хвоста, которые делают каждый тип фага специфичным для бактерий-хозяев.
«Благодаря своей способности бороться с бактериями, бактериофаги могут использоваться в качестве антибактериальных средств. У фагов небольшой геном, поэтому с учетом последних достижений синтетической биологии мы можем модифицировать их, выбирая предпочтительные характеристики и адаптируя их для различных приложений.
«Сейчас они используются для различных работ в области биодетектирования, промышленного применения и пищевых технологий. , и в настоящее время мы также работаем над этими направлениями. Но наиболее важным в настоящее время является разработка фагов для использования в мире медицины ».
Использование старой идеи для решения современной проблемыИспользование бактериофагов в терапевтических целях против бактерий-хозяев называется «фаговой терапией». Звучит очень современно, но идея не нова.
Доктор Сагона продолжает: «Фаги были официально открыты Фредериком Творт и Феликсом д’Эреллем в 1915-1917 годах, и с тех пор они используются в качестве лечебных средств, особенно в таких странах, как Россия и Грузия. Причина отказа от фаговой терапии в западной цивилизации в основном связана с открытием антибиотиков – в 1928 году был открыт пенициллин, а с 1940-х годов появилось все больше и больше антибиотиков. Эти препараты оказались очень эффективными при лечении бактериальных инфекций и спасении жизней.
«Но с 1990-х годов возникла проблема устойчивости к антибиотикам, и идея фаговой терапии снова стала актуальной».
Уже истории успехаВ принципе, фаговая терапия может применяться для лечения любой бактериальной инфекции, для которой присутствует определенный фаг. Примеры инфекций, которые уже лечатся фаговой терапией, включают инфекции мочевыводящих путей, менингит, желудочно-кишечные инфекции, стафилококковые кожные заболевания и многое другое.
Д-р Сагона объясняет: «Были реальные истории успеха, когда использовалась фаговая терапия, например, лечение 15-летнего пациента с муковисцидозом, у которого была диссеминированная инфекция Mycobacterium abscessus. Пациентка получила внутривенный коктейль из генетически модифицированных бактериофагов с отличным результатом . Это показывает большой потенциал фаговой терапии, особенно с учетом того, что бактериофаги можно модифицировать, чтобы они были более безопасными и эффективными для лечения пациентов.
«В Великобритании сейчас все больше и больше людей интересуются фаговой терапией, и идет дискуссия о создании больниц для терапевтического использования фагов, как это имеет место в других странах, включая Финляндию, Брюссель, Грузию, Россию и США.
«У фаговой терапии есть множество преимуществ, в том числе то, что она очень специфична и эффективна. Побочных эффектов очень мало, и, как правило, фаги легко доступны, поскольку они встречаются в природе, и мы можем генетически модифицировать их, чтобы сделать их еще лучше.Кроме того, поскольку фаги могут мутировать вместе с бактериями, у нас есть потенциал хорошо реагировать на возможные устойчивые к фагам бактерии »
Что нам мешает использовать фаговую терапию?Итак, если она оказалась настолько успешной, почему бы нам не использовать фаговую терапию более широко?
Д-р Сагона объясняет: «Когда дело доходит до фаговой терапии, есть еще некоторые проблемы, которые необходимо решить. Поскольку фаги являются вирусами, существуют некоторые этические ограничения на их терапевтическое использование.У некоторых пациентов может возникнуть иммунный ответ, и все еще существуют трудности с определением клинической дозы. Кроме того, фаги быстро выделяют токсины, когда они активны, нам нужно больше понимать клеточные механизмы, которые управляют фаговой терапией.
«Тем не менее, все эти ограничения можно устранить, и исследования проводятся каждый день. Сейчас мы показываем, как бактериофаг проникает и взаимодействует с человеческими клетками и внутриклеточными патогенными бактериями . Доступны дополнительные исследования потенциала иммунного ответа при нанесении фага .Когда дело доходит до определения клинической дозы, мы показали, что работа по инкапсуляции бактериофагов в липосомы, которые зависят от pH и которые позволяют высвобождать фаг специально на целевой орган, может обеспечить решение. Очевидно, что бактериофаги обладают огромным потенциалом для решения проблемы устойчивости к противомикробным препаратам. Достижения в области медицинских технологий продолжают позволять ученым ускорять исследования в этой области и помогают сделать фаготерапию реальной альтернативой антибиотикам, которые мы сможем использовать еще более успешно в будущем.
Доктор Сагона среди ученых, выступающих на следующем мероприятии Science on the Hill в кампусе Уорика в Гиббет-Хилле.
Восстание супербактерий: убьет ли вас следующая инфекция?
10 декабря 2019 с 18:00 – 20:00
Чтобы зарегистрироваться, нажмите здесь.
Для получения дополнительной информации: [email protected]
Хотите победить устойчивые к антибиотикам супербактерии? Переосмыслить средства от стрептококковой инфекции горла | Горизонты исследования
Заболело горло? Врач может быстро выписать рецепт на пенициллин или амоксициллин и одним росчерком пера помочь подорвать общественное здоровье и ваше собственное здоровье в будущем, поощряя бактерии выработать устойчивость к антибиотикам.
Согласно новому аналитическому докладу ученых из Технологического института Джорджии, пора разработать альтернативы антибиотикам при небольших инфекциях, и сделать это быстро.
Широко сообщалось, что бактерии эволюционируют и к середине века антибиотики станут в основном неэффективными против них, и текущие стратегии восполнения прогнозируемого дефицита не сработали.
Одна из возможных проблем заключается в том, что стратегии разработки лекарств были сосредоточены на замене антибиотиков при тяжелых инфекциях, таких как сепсис, когда каждая минута без эффективного лекарства увеличивает риск смерти.
Но эволюционный процесс, который вызывает устойчивость к антибиотикам, не происходит почти так часто при этих больших инфекциях, как при множестве мелких, таких как синусит, тонзиллит, бронхит и инфекции мочевого пузыря, говорят исследователи Технологического института Джорджии.
«Назначение антибиотиков против этих небольших заболеваний составляет около 90 процентов использования антибиотиков, и поэтому они, вероятно, являются основным двигателем эволюции резистентности», – сказал Сэм Браун, доцент Школы биологических наук Технологического института Джорджии.Бактерии, которые выживают в этих многочисленных маленьких битвах с антибиотиками, становятся сильнее и численнее, чтобы стать грозными армиями в больших инфекциях, таких как те, которые поражают после операции.
«Возможно, имеет смысл назначать антибиотики реже и сохранять их эффективность до тех пор, пока они действительно не понадобятся. И разработать альтернативные методы лечения небольших инфекций », – сказал Браун.
Браун, специализирующийся на эволюции микробов и бактериальной вирулентности, и первый автор Кристофер Воллейн Вальдетофт, врач и научный сотрудник лаборатории Брауна, опубликовали в декабре эссе с подробным изложением своего предложения по переориентации разработки препаратов для борьбы с бактериями. 28, 2017, в журнале PLOS Biology .
Двойные антибиотикиРазвитие устойчивости к антибиотикам может быть совершенно двуличным.
«Если вы или ваш ребенок обращаетесь к врачу с инфекцией верхних дыхательных путей, вы часто получаете амоксициллин, который является антибиотиком относительно широкого спектра действия», – сказал Браун. «Таким образом, он убивает не только стрептококк, но и множество других бактерий, в том числе в таких местах, как пищеварительный тракт, и это имеет довольно широкое воздействие».
E. coli широко распространена в кишечнике человека, и некоторые штаммы выделяют ферменты, препятствующие действию антибиотиков, а другие – нет.Антибиотик широкого спектра действия может убить больше уязвимых, менее опасных бактерий, оставляя более опасные и устойчивые бактерии для размножения.
«Вы принимаете антибиотик, чтобы избавиться от этой штуки в горле, и в итоге у вас появляются кишечные бактерии, которые обладают сверхустойчивостью», – сказал Браун. «Позже, если вам предстоит операция, у вас возникнут проблемы. Или вы даете эту устойчивую кишечную палочку пожилому родственнику “.
Слишком часто супербактерии попадали в больницы в чьем-то кишечнике, где за годы периодического лечения небольшими инфекциями антибиотиками выработали высокую резистентность.Затем эти бактерии заразили пациентов со слабой иммунной системой.
Возникли яростные инфекции, практически неуязвимые для антибиотиков, за которыми следовали сепсис и смерть.
Альтернативы получают букву «F»Разработчики лекарств, столкнувшиеся со снижением эффективности антибиотиков против эволюционирующих бактерий, искали несколько альтернативных методов лечения. Часто основное внимание уделялось поиску какого-либо нового класса лекарств, который работает так же хорошо или лучше, чем антибиотики, но до сих пор ничего не помогло, сказал Браун.
Воллейн Вальдетофт наткнулся на исследовательскую статью в медицинском журнале Lancet Infectious Diseases , в которой рассматривалось исследование за исследованием таких альтернативных методов лечения серьезных смертельных инфекций.
«Это было своего рода оценочная карта, и она почти всегда была отрицательной», – сказал Браун. «Эти альтернативные методы лечения, такие как фаговые или противовирулентные препараты или бактериоцины – вы называете это – просто не достигли той же планки эффективности, что существующие антибиотики».
«Это была своего рода мрачная бумага, в которой говорилось, что, как только антибиотики закончатся, у нас возникнут проблемы», – сказал Браун.«Фармацевтические компании по-прежнему инвестируют в исследования альтернативных лекарств, потому что разработка новых эффективных антибиотиков очень и очень сложна. Других вариантов у нас не так много “.
Но сосредоточение внимания на новых методах лечения экстремальных инфекций обеспокоило исследователей, потому что основная область, где происходит большая часть эволюции резистентности, – это небольшие инфекции. «Мы чувствовали, что здесь происходит разрыв связи», – сказал Браун.
Не убивай стрептококк, победи егоИсследователи предложили другой подход: «Уберите легкие задачи, такие как боль в горле, без антибиотиков и оставьте антибиотики для этих действительно серьезных состояний.”
Может оказаться проще разработать неантибиотические методы лечения ангины, инфекций мочевого пузыря и бронхита, что будет способствовать инвестициям и исследованиям в фармацевтике.
Например, один конкретный вид стрептококков группы А , стрептококки , ответственен за подавляющее большинство бактериальных инфекций верхних дыхательных путей. Люди часто носят его, не взламывая.
Стрептококковые бактерии выделяют соединения, способствующие воспалению и распространению бактерий.Если антивирулентный препарат может бороться с выделениями, он может вернуть стрептококк обратно в организм, но не вызвать тошноту.
Браун предупредил, что стрептококковая инфекция может привести к ревматической болезни сердца, смертельному заболеванию, которое очень редко встречается в промышленно развитых странах, но по-прежнему наносит урон в других частях мира. «Менее мощное лекарство может быть достаточно хорошим, если в вашей истории болезни нет серьезных проблем с фарингитом», – сказал он.
Иногда все, что нужно, – это противодействовать вирулентным бактериям, пока иммунная система организма не справится с ними.Возможно, удастся разработать спрей с бактериофагами, вирусами, атакующими бактерии.
Если бы у врачей было достаточно альтернатив антибиотикам для множества небольших инфекций, которые они лечат, они могли бы помочь сохранить эффективность антибиотиков дольше при гораздо менее распространенных, но гораздо более смертоносных инфекциях, от которых они больше всего нужны.
Хотите узнать больше? Прочтите: FDA использует Технологию Джорджии, чтобы снизить стоимость производства антибиотиков
Исследование финансировалось Фондом Саймонса (грант 396001), Центрами по контролю и профилактике заболеваний (грант OADS-2016-N-17812), Фондом Веннера-Грена и Физографическим обществом Лунда.Любые мнения, выводы, выводы или рекомендации, выраженные в этом материале, принадлежат авторам и не обязательно отражают точку зрения спонсоров.
15.12B: Scarlet Fever – Biology LibreTexts
Цели обучения
- Опишите бактерию Streptococcus pyogenes , вызывающую скарлатину
Бактериофаг Автостопщик
Скарлатина – инфекционное заболевание, которым чаще всего страдают дети в возрасте 4–8 лет.Симптомы включают боль в горле, лихорадку и характерную красную сыпь. Обычно он передается при вдыхании. Вакцины нет, но болезнь эффективно лечится антибиотиками. Скарлатина вызывается эритрогенным токсином – веществом, вырабатываемым бактерией Streptococcus pyogenes (стрептококк группы А) при ее заражении определенным бактериофагом.
Рисунок: Скарлатина : Розовые щеки и белая область вокруг рта – типичные симптомы скарлатины.Скарлатина вызывается секрецией пирогенных (вызывающих лихорадку) экзотоксинов инфицированным стрептококком.Экзотоксин A (speA), вероятно, является наиболее изученным из этих токсинов. Он переносится бактериофагом Т12, который интегрируется в геном стрептококка, откуда транскрибируется токсин.
Сам фаг интегрируется в ген сериновой тРНК на хромосоме. Сам вирус T12 не был включен в таксон Международным комитетом по таксономии вирусов. Он имеет геном двухцепочечной ДНК; по морфологическим признакам он является членом Siphoviridae. Ген speA был клонирован и секвенирован в 1986 году.Его длина составляет 753 пары оснований, и он кодирует белок 29,244 килодальтона (кДа). Белок содержит предполагаемый сигнальный пептид из 30 аминокислот. Удаление сигнальной последовательности дает прогнозируемую молекулярную массу секретируемого белка 25,787 (кДа). И промотор, и сайт связывания рибосомы (последовательность Шайна-Дальгарно) присутствуют выше гена. Терминатор транскрипции расположен на 69 оснований ниже кодона терминации трансляции. Карбоксиконцевая часть белка демонстрирует обширную гомологию с карбокси-концом энтеротоксинов B и C1 Staphylococcus aureus.Другие стрептококковые фаги, кроме Т12, также могут нести ген speA.
Ключевые моменты
- Скарлатина обычно поражает детей. Исторически это имело разрушительные последствия.
- Хотя антибиотики эффективны против скарлатины, болезнь на самом деле вызывается бактериофагом, инфицировавшим человека Streptococcus.
- Бактериофаг Т12 вставляется в геном Streptococcus. Это приводит к выделению экзотоксина, вызывающего скарлатину.
Ключевые термины
- скарлатина : стрептококковая инфекция, в основном встречающаяся у детей и характеризующаяся красной кожной сыпью, болью в горле и лихорадкой
- Последовательность Шайна-Дальгарно : сайт связывания рибосомы в мРНК прокариот.
- экзотоксин : Любой токсин, выделяемый микроорганизмом в окружающую среду.
- энтеротоксин : Любой из нескольких токсинов, продуцируемых кишечными бактериями
Вооружение вирусов для борьбы с инфекциями> Новости> Yale Medicine
Фаговая терапия – использование определенных вирусов для борьбы с тяжелыми бактериальными инфекциями – представляет большие перспективы в качестве инструмента для решения проблемы устойчивых к антибиотикам бактерий (также называемых супербактериями).Здесь, в Йельской медицине, экспериментальное лечение уже использовалось для оказания помощи некоторым пациентам – хорошая новость, учитывая, что устойчивые к антибиотикам бактерии теперь считаются одной из самых тревожных проблем общественного здравоохранения. В недавнем отчете Центров по контролю и профилактике заболеваний (CDC) виновата проблема смерти каждые 15 минут здесь, в США
С момента открытия пенициллина врачи использовали антибиотики для лечения людей от некогда смертельных бактериальных инфекций. Но теперь мы знаем, что со временем бактерии обладают способностью защищать себя, развиваясь, становясь сильнее и сложнее (это называется устойчивостью к антибиотикам).Исследователи обнаружили, что вирусы могут быть мощным инструментом, который можно использовать против них.
В частности, тип дружественного вируса, называемого бактериофагом (иногда его называют просто фагом), можно использовать в качестве оружия для борьбы даже с самыми тяжелыми бактериальными инфекциями. Это работает, потому что, в отличие от вирусов, от которых мы болеем, фаги могут инфицировать только бактерии, и они даже избирательно выбирают, на какие бактерии нацелены. Эти фаги не редкость; фаги происходят от природы и встречаются почти повсюду в мире.Это дает им возможность потенциально стать супергероями в нашей битве с устойчивыми супербактериями.
В этом видео объясняется, как ученый-исследователь из Йельского университета Бенджамин Чан, доктор философии, сотрудничает с такими докторами Йельской медицины, как Джонатан Кофф, доктор медицинских наук, чтобы не только разработать фаговую терапию, но и использовать ее для лечения людей, особенно уязвимых к инфекции (например, пациентов с кистозный фиброз). Цель состоит в том, чтобы разработать библиотеку эффективных методов лечения определенных типов бактерий и сделать эти методы лечения доступными для пациентов с устойчивыми к антибиотикам инфекциями, когда другие варианты исчерпаны.
«Это определенно мечта», – говорит Чан. «Замечательно перейти от фундаментального исследования к пациенту в клинике».
Использование бактериофагов в ветеринарии при интенсивном выращивании скота | Журнал вирусологии
Сальмонеллез
Сальмонелла является общей мишенью для фаговой терапии, потому что она вызывает заболевания у широкого круга эндотермических животных, а также у людей и приводит к значительным потерям в продуктивности домашнего скота.Некоторые серотипы Salmonella (например, S. enterica серотипа Typhi) известны как «ограниченные хозяином», потому что они вызывают тяжелое системное заболевание, подобное брюшному тифу, у одного хозяина (или небольшого числа родственных хозяев). Однако фаговая терапия в основном сосредоточена на серотипах, не ограниченных хозяином (в основном, Enteritidis и Typhimurium), которые обычно приводят к менее тяжелой желудочно-кишечной инфекции у гораздо более широкого круга видов и приводят к большинству бактериальных инфекций пищевого происхождения в развитых странах [17 , 18].
Фаговая терапия использовалась для борьбы с Salmonella у кур с разной степенью успеха. Sklar et al. использовали фаги на модели цыплят-бройлеров, чтобы продемонстрировать, что колонизация слепой кишки Salmonella может быть значительно снижена почти на 1 log 10 Колониеобразующих единиц (КОЕ) / г содержимого кишечника в течение 14 дней путем введения коктейля из четырех фагов в подача (10 9 единиц образования зубного налета (БОЕ) / г) [19]. Кроме того, обработка фагом, по-видимому, уменьшала признаки вторичной инфекции у птиц, поскольку только у трех из 10 животных в группе, обработанной фагом, наблюдалось легкое воспаление воздушных мешков, в то время как у 8 из 10 птиц в необработанной контрольной группе наблюдались признаки воздушного саккулита.Fiorentin et al. продемонстрировали, что однократная пероральная доза из трех фагов каждый по 10 11 БОЕ может уменьшить S . Колонизация цыплят-бройлеров Enteritidis 3,5 log 10 КОЕ / г в слепой кишке цыплят-бройлеров при контакте с цыплятами-сеялками в возрасте 7 дней, инфицированными 10 8 КОЕ S . Enteritidis [20].
Аттербери и др. [21] отобрали три литических фага (выделенных из птицефабрик и сточных вод в Великобритании) с широким диапазоном хозяев против S. Enteritidis, S. Hadar и S. Typhimurium. Суспензию 9,0 log 10 БОЕ каждого фага использовали для лечения 36-дневных цыплят-бройлеров Ross, которые были отдельно инфицированы тремя разными серотипами. Все протестированные фаги уменьшили колонизацию слепой кишки Salmonella , но только S. Enteritidis и S . Тифимуриум значительно уменьшился; примерно на 2,19–2,52 log 10 КОЕ / г по сравнению с контролем.Нечувствительные к бактериофагу мутанты (BIM) были выделены из животных, обработанных фагом. Однако этот фенотип устойчивости к фагам не поддерживался ни in vitro после последовательного субкультивирования, ни in vivo, когда BIM вводили в новую группу птиц в отсутствие давления отбора фагов.
Lim et al. продемонстрировали, как фаг может быть использован для предотвращения горизонтальной инфекции Salmonella Enteritidis в коммерческой модели сеялки для цыплят-несушек [22]. Группы однодневных цыплят заражали 5 × 10 11 КОЕ Salmonella Enteritidis и в течение следующих 21 дней совместно жили с неинфицированными контактными цыплятами, получая лечение в трех независимых группах одним из трех титров (10 5). , 10 7 или 10 9 БОЕ / г) бактериофага, приготовленного в качестве кормовой добавки.Все обработки значительно ( P <0,05) снижали колонизацию кишечника до 1 log 10 КОЕ / г в конце 21 дня, при этом 70% контактных цыплят, получавших наивысший титр фага, не имели детектируемого Salmonella Колонизация Enteritidis. Borie et al. [23] вводили комбинацию из трех Salmonell a-специфических фагов (10 8 БОЕ / мл / доза) с помощью грубого распыления или питьевой воды 10-дневным цыплятам за 24 ч до экспериментального заражения 9.6 × 10 5 КОЕ S. Enteritidis. Доставка фагов как с помощью грубого распыления, так и с помощью питьевой воды значительно снизила среднее значение кишечных S. Enteritidis до 1,6 log 10 КОЕ / мл.
Ахмади и др. [24] определили способность фагов снижать S . Enteritidis в слепой кишке японских перепелов. Фаг «PSE» вводили группам 8-дневных перепелов через желудочный зонд или профилактически (10 5 БОЕ) за три дня до заражения 10 8 КОЕ S .Enteritidis; или терапевтически сразу после S . Enteritidis вызов. Профилактическое введение снизило обнаружение Salmonella в слепой кишке до 33,3 и 20%, через 24 часа и 7 дней после введения PSE, соответственно, тогда как в инфицированной контрольной группе все птицы дали положительный результат на S. Enteritidis в слепых миндалинах. У птиц, получавших терапевтическую терапию, такого снижения не наблюдалось. В следующем эксперименте группы однодневных перепелов обрабатывали 10 8 БОЕ фагового PSE ежедневно в течение шести дней либо через желудочный зонд, либо через вентиляционную губу.На четвертый день этим птицам вводили 10 8 КОЕ S . Enteritidis. Salmonella была обнаружена в слепой кишке птиц, получавших перорально фагом PSE через 6 часов после заражения Salmonella , но не позднее чем через 35 дней после заражения. Некоторые птицы (до 2 из 8), обработанные фагом PSE через вентиляционную губу, периодически давали положительный результат на S . Enteritidis на протяжении всего периода исследования, но большинство из них оставалось свободным от S .Enteritidis.
Помимо применения в птицеводстве, было продемонстрировано действие фаговых коктейлей против Salmonella у свиней. Wall et al. [25] вводили 5 × 10 9 КОЕ S . Typhimurium γ4232 и одновременно микрокапсулированные альгинатные гранулы, содержащие 5 × 10 9 БОЕ 16 фагов, смешанные в виде коктейля, с 3-4-недельными свиньями через желудочный зонд. Авторы сообщили о снижении на 2–3 log 10 КОЕ / г количества Salmonella в подвздошной кишке, слепой кишке и миндалинах.В другой экспериментальной схеме свиньям рыночного веса вводили 5 × 10 9 КОЕ S . Typhimurium перорально, а затем обрабатывали 10 10 БОЕ микрокапсулированного фагового коктейля через 48 часов (вводили перорально три раза с интервалом 2 часа между дозами) с последующим смешиванием с свиньями-сеялками, инфицированными Salmonella . Salmonella Среднее количество слепых кишок у обработанных фагом свиней было значительно снижено на 1,4 log 10 КОЕ / мл по сравнению с необработанным контролем.
Saez et al. [26] вводили коктейль с бактериофагами в качестве микрокапсулированной кормовой добавки и продемонстрировали, что это может быть эффективным и практичным способом уменьшения колонизации и выделения Salmonella у свиней. В план эксперимента входила 21 свинья, случайным образом разделенная на три группы. Группе 1 давали кормовую добавку, содержащую микрокапсулированный коктейль фагов (5 × 10 11 БОЕ в день) в течение 5 дней перед пероральным введением 5 мл 10 9 КОЕ / мл Salmonella Typhimurium.Группе 2 давали 60 мл коктейля фагов (5 × 10 11 БОЕ) каждые 2 часа после контрольного заражения в течение всего 6 часов. Группа 3 не получала фаговой обработки, и всем группам на пятый день вводили орально 5 мл 10 9 КОЕ / мл S . Бактериальная суспензия Typhimurium. Результаты показали более низкое выделение S. Typhimurium с фекалиями через 2 часа после заражения (группа 1 = 38,1%, группа 2 = 71,4%, группа 3 = 71,4%, P <0,05) и через 4 часа после заражения (группа 1 = 42.9%, группа 2 = 81,1%, группа 3 = 85,7%, P <0,05), когда фаговый коктейль вводили в качестве кормовой добавки. Дополнительно S . Количество тифимурия в содержимом подвздошной и слепой кишки было на 1 log 10 КОЕ / г ниже в группе, обработанной фагами, по сравнению с контрольной группой.
Seo et al. [27] определили терапевтический потенциал коктейля бактериофагов, способного убить 34 эталонных штамма и 99 изолятов (107 протестированных) S .Тифимуриум. Группам четырехнедельных свиней давали 5 мл фагового коктейля из расчета 10 9 БОЕ / мл до конца исследования (15 дней), а на 7 день заражали 10 мл S . Typhimurium (ATCC140828) при 10 8 КОЕ / мл. Выделение Salmonella не было обнаружено в образцах фекалий через 7 дней после инфицирования в группе, обработанной фагом, по сравнению со средней колонизацией 1,0 log 10 КОЕ / мл для необработанной контрольной группы.
Введение фагов Salmonella орально подвергает их воздействию потенциально враждебных условий, таких как низкий pH желудка / мускулатуры и активность желчи и ферментов в двенадцатиперстной кишке, что может повлиять на жизнеспособность бактериофагов.Для смягчения потенциального ущерба, который могут вызвать эти состояния, использовались различные подходы, включая одновременное введение антацида [21], микрокапсулирование с хитозаном / альгинатом [28], микрокапсулирование с альгинатом [29], микрокапсулирование с антацидом / альгинатом [30] и наноинкапсуляция липосом [31].
Колибактериоз
Патогенные штаммы Escherichia coli домашней птицы являются возбудителем колибактериоза, который вызывает значительную смертность домашних птиц. E. coli Колонизация дыхательных путей птиц может прогрессировать до воздушных мешков, вызывая сепсис и, в конечном итоге, смерть [32]. У цыплят-бройлеров Huff et al. [33] продемонстрировали эффективность введения смеси фагов с высоким титром с помощью спрея для снижения смертности, связанной с колибактериозом. В этой модели высокие титры двух фагов (SPR02, 2,6 × 10 8 БОЕ / мл и DAF6, 2,35 × 10 9 БОЕ / мл) вводили спреем на 7 день с последующим заражением патогенным E .coli вводили непосредственно в грудной воздушный мешок (5,6 × 10 4 КОЕ) на 7, 8 или 10 день. Обработка фагом приводила к значительному снижению смертности, которое было наиболее выраженным, когда фаг вводили одновременно с фагом. бактериальная инфекция (смертность 30% против 60% смертности необработанных контрольных птиц). Примечательно, что одна экспериментальная группа птиц уже была инфицирована E. coli , чувствительной к лизису фагом SPR02. Авторы подозревали, что это произошло из-за естественной инфекции, но это не было подтверждено.Эти птицы имели немного меньший вес вылупления и значительно более высокую смертность в необработанной контрольной группе (20%) и контрольной группе с распыляемым буфером (27%) по сравнению с группой, обработанной фагом (3%). Это предполагает, что введение фага могло обеспечить терапевтическое лечение уже существующего колибактериоза.
Huff et al. [34] снова использовали фаг SPR02 в другой модели фаговой терапии. Группам из десяти трехдневных цыплят вводили от 10 3 до 10 4 КОЕ E.coli путем прямой инъекции в воздушные мешочки. Одной группе вводили фаг (10 3 или 10 6 БОЕ) одновременно с E. coli , второй группе вводили фаг с питьевой водой. Введение фага с питьевой водой не имело защитного эффекта, тогда как одновременное введение было связано со снижением смертности (25% или 5% для птиц, получавших 10 3 и 10 6 БОЕ, соответственно). Это выгодно отличается от 80% смертности, зарегистрированной в необработанной контрольной группе.Однако смешение фага и хозяина во время введения, вероятно, даст искусственно положительные результаты, поскольку у фага будет возможность инфицировать и размножаться внутри бактерий, прежде чем у них появится возможность установить инфекцию; эффективно уменьшая проблему.
Huff et al. [35] снова использовали фаги SPR02 и DAF6 для лечения колибактериоза, на этот раз с помощью аэрозольного спрея или внутримышечной инъекции. Для заражения использовали 5,96 × 10 4 КОЕ E. coli , введенные в левый грудной воздушный мешок 7-дневных цыплят.Обработка фагом с использованием аэрозольного спрея (7,65 × 10 8 и 2,83 × 10 9 БОЕ / мл, DAF6 и SPR02, соответственно) обеспечила значительную защиту птиц, о чем свидетельствует низкая смертность в группе, получавшей лечение (20% ) по сравнению с контрольной группой (50%). Однако, если лечение фагом откладывалось на 24 или 48 ч после бактериального заражения, терапевтического эффекта не наблюдалось. Напротив, птицы, получавшие комбинацию фагов (1,88 × 10 9 и 6,35 × 10 8 БОЕ / мл DAF6 и SPR02, соответственно) посредством внутримышечной инъекции, имели значительно более низкую смертность (≤ 20%) по сравнению с контролем. группа (53%) независимо от того, вводили ли фаг сразу или в течение 48 часов после бактериального заражения.Эти результаты подтверждают мнение о том, что способ введения играет фундаментальную роль в исходе фаговой терапии, поскольку наилучшие результаты, по-видимому, достигаются путем инъекции фага птицам, что, учитывая характер птицеводства, вряд ли может предложить практическое решение проблемы колибактериоза. .
Huff et al. [36] оценили потенциальную синергию антибиотиков и фаговой терапии колибактериоза. Группы из десяти семидневных цыплят заражали 6 × 10 4 КОЕ E.coli вводили в левый грудной воздушный мешок. Сразу после этого производилась инъекция одного из двух фагов непосредственно в мышцу бедра (3,7 × 10 9 и 9,3 × 10 9 БОЕ на мл фагов DAF6 или SPR02, соответственно). Энрофлоксацин вводили в питьевую воду птиц в концентрации 50 частей на миллион в течение 7 дней подряд, начиная сразу после заражения E. coli . Высокая летальность (68%) была зарегистрирована в нелеченой контрольной группе. Это по сравнению с 15% смертностью в группе, обработанной фагом, 3% смертностью в группе, обработанной энрофлоксацином, и 0% для птиц, обработанных как фагом, так и антибиотиком.Это привело авторов к предположению о возникновении синергизма между обоими терапевтическими агентами при использовании в сочетании с повышенной эффективностью.
Oliveira et al. [37] тестировали доставку фага с помощью распылителя с мелкими каплями на экспериментально инфицированных и естественно инфицированных цыплятах. Группы из двенадцати 10-недельных цыплят Rhode Island Red заражали 1 × 10 8 КОЕ птичьего патогенного E. coli H839E путем инъекции в левый грудной воздушный мешок. Группе, обработанной фагом, давали суспензию 1.5 × 10 9 PFU phi F78E, перорально и в виде спрея. Результаты показали значительно ( P <0,05) более низкий балл патологии (≈2,5), заболеваемость (≈60%) и смертность (≈45%) в группе, обработанной фагом, по сравнению с необработанной контрольной патологией (≈4). , показатели заболеваемости (≈100%) и смертности (≈75%). Более того, средняя смертность была на 25,0% ниже, средняя заболеваемость - на 41,7%, а поражения, обнаруженные на тушах, также были менее серьезными в группе, обработанной фагом, по сравнению с необработанным контролем.
Эль-Гохари и др. [38] протестировали распыление фагов на подстилку как средство уменьшения колибактериоза. На поверхность подстилки в загонах размером 3,9 м. 2 опрыскивали 200 мл 2,8 × 10 8 КОЕ / мл культуры патогенной E. coli . Для групп, обработанных фагом, ручки немедленно опрыскивали 200 мл суспензии фага SPR02 8 × 10 8 БОЕ / мл. Смертность в контрольной и обработанной фагом группах составила 25 и 5% соответственно.Авторы предполагают, что дезинфекция окружающей среды с помощью фагов снижает уровень целевого патогена до уровня ниже инфекционной, препятствуя возникновению бактериальных заболеваний, и заявляют, что это практичный и эффективный способ предотвращения колибактериоза у цыплят-бройлеров. Однако метаболическое состояние бактерий, культивируемых in vitro, таких как бактерии, опрысканные на подстилку, может существенно отличаться от сублетально поврежденных клеток, которые могут быть обнаружены в естественных условиях на ферме. Таким образом, может быть сложно повторить эти результаты в реальном сценарии птицефабрики.
Помимо респираторных инфекций у домашней птицы, колибактериоз на модели менингита и сепсиса у домашней птицы лечился с помощью фаговой терапии [39]. В экспериментальном плане использовались трехнедельные цыплята Rhode Island Red, инфицированные E. coli h347 K1 + внутримышечно или внутричерепно с последующей внутримышечной инъекцией фага R в количестве 10 4 или 10 6 БОЕ. Смертность в группах, обработанных фагом, была равна нулю, по сравнению со 100% в необработанной контрольной группе.Ни одна из птиц, обработанных фагом, не показала клинических признаков инфекции. Более того, отсрочка лечения фагом до появления клинических признаков заболевания все еще приводила к значительной защите, поскольку все 10 необработанных контрольных птиц погибли по сравнению с 3 из 10 в группе, обработанной фагом. Профилактическое введение фага за два дня до бактериального заражения также было эффективным в снижении смертности до 1 из 9 в группе, обработанной фагом, по сравнению с 4 из 9 в контрольной группе. Фаг R смог размножаться в крови и проникать через гематоэнцефалический барьер.Вместе эти данные подтверждают идею о том, что даже острые инфекции можно лечить фагами.
Новаторская работа в области фаговой терапии, направленной на лечение колибактериоза у свиней (а также мышей, крупного рогатого скота и овец), была проведена в 1980-х годах Смитом и Хаггинсом [40,41,42]. В одном исследовании диарею у поросят вызывали путем введения им 3 × 10 8 КОЕ патогенных E. coli O20: K101 987P семи поросятам, а через 13-16 часов их лечили пероральным введением смеси (10 10 БОЕ) двух фагов (P433 / 1 и P433 / 2) или одного фага (P433 / 1).Симптомы болезни у обработанных фагом поросят исчезли через 18-22 часа, в то время как зараженные необработанные поросята были серьезно больны, значительно обезвожены, атаксичны, умственно сбиты с толку, и если их кормили не через желудочный зонд, авторы утверждают, что вся группа из семи поросята погибли бы [41].
Jamalludeen et al. [43] показали положительный эффект фагов на свиней-отъемышей, инфицированных энтеротоксигенной E. coli O149: h20: F4. Свиньям перорально с помощью шприца инокулировали 10 10 КОЕ E.coli с последующей обработкой шестью фагами (GJ1-GJ7) по отдельности или в комбинации в дозе 10 9 БОЕ каждого фага. Эти фаги вводили либо профилактически (через 15 минут после заражения), либо терапевтически (через 24 часа после заражения). Антибиотик флорфеникол использовали до бактериального заражения в попытке усилить колонизацию E. coli . Профилактическое использование шести фагов по отдельности значительно уменьшило продолжительность и тяжесть диареи, что продемонстрировано оценкой клинических симптомов <4 по сравнению с ≈10 для зараженного контроля.Более того, терапевтическое введение коктейля из двух фагов значительно уменьшило симптомы, развитие диареи и выделение патогенной E. coli без изменения количества комменсальных E.coli [43]. Использование бактериофагов в качестве кормовой добавки для свиней в профилактических целях было признано безопасным, поскольку не имело неблагоприятных иммунологических эффектов, а также могло привести к улучшению набора веса [44,45,46,47].
Campylobacteriosis
Campylobacter spp.является наиболее серьезной причиной острых бактериальных болезней пищевого происхождения в ЕС [48]. Примерно 95% всех зарегистрированных случаев являются результатом заражения одним видом, C. jejuni . Campylobacter хорошо приспособлен к колонизации кишечника птиц и имеет относительно низкую инфекционную дозу для человека (предположительно, около 500 клеток [49]). Имеется иммунный ответ хозяина, который проявляется в титре антител sIgA, однако он практически не влияет на уровень колонизации C.jejuni у бройлеров [50]. Большое количество бактерий Campylobacter на слепых кишках бройлеров может привести к заражению туши на бойне. Было подсчитано, что уменьшение количества Campylobacter на тушах на 2 log 10 может привести к 30-кратному снижению заболеваемости кампилобактериозом человека [51]. Профиль устойчивости к антибиотикам 486 кампилобактеров, выделенных от розничных кур Агентством по пищевым стандартам Великобритании с 2016 по 17 год, показал устойчивость к ципрофлоксацину (251), тетрациклину (322), налидиксовой кислоте (247), стрептомицину (18) и эритромицину (2).Множественная устойчивость к трем и более антибиотикам зарегистрирована у 17 изолятов [52]. Эти результаты подчеркивают необходимость эффективного решения проблемы заражения тушек птицы Campylobacter .
Wagenaar et al. [53] определили, может ли препарат фага, вводимый через желудочный зонд (с 7 по 16 день), защитить 10-дневных цыплят-бройлеров Ross или взрослых цыплят от заражения C. jejuni (10 5 КОЕ / мл на день 10). Препарат фага не проявлял какого-либо защитного действия у птиц, однако при введении после бактериального заражения наблюдалось снижение на 3 log 10 КОЕ / г количества C.jejuni наблюдали в слепой кишке обработанных фагом птиц. Loc-Carrillo et al. [54] выбрали два фага (CP8 и CP34) из 53 выделенных из куриных фекалий для использования в качестве кандидатов для снижения Campylobacter у цыплят. Фаги были отобраны на основе благоприятной кинетики репликации in vitro и широкого круга хозяев. Цыплята-бройлеры Росс были экспериментально инфицированы изолятами C. jejuni HPC5 и GIIC8 в различных дозах (от 2,7 до 7,8 log 10 КОЕ) через желудочный зонд в возрасте от 18 до 20 дней.Однократное введение фага (5–9 log 10 БОЕ) вводили в возрасте 25 дней через желудочный зонд. C. jejuni Количество в верхнем отделе кишечника и слепой кишке обработанных фагами птиц снижалось на 0,5-5 log 10 КОЕ / г, когда фаги применялись в количестве ≥10 7 БОЕ. Устойчивые к фагам Изоляты C. jejuni были выделены из обработанных фагом птиц (4%), но это было заметно ниже, чем восстановление устойчивых изолятов в исследованиях in vitro (11%). Авторы предположили, что в отсутствие давления отбора фагов устойчивые к фагам мутанты могут менее эффективно колонизировать кишечник цыпленка.Эта интерпретация подтверждается наблюдением авторов, что при использовании устойчивых к фагам изолятов для заражения птиц в отсутствие фага 97% кампилобактеров вернулись к фагочувствительному фенотипу [54]. В предыдущем исследовании та же группа показала, что в 90 стадах бройлеров Великобритании количество C. jejuni в присутствии встречающихся в природе бактериофагов было ниже по сравнению с образцами, в которых фаг не был обнаружен (5,1 против 6,9 log 10 КОЕ / г соответственно) [55].
Литические фаги, которые инфицируют Campylobacter , были разделены на три группы (от I до III) в зависимости от структуры, размера генома и рецептора, используемого для заражения хозяина [56]; и фаги из групп II и II очевидно используют множественные рецепторы клетки-хозяина для связывания [57,58,59]. Эль-Шибины и др. [60] зарегистрировали снижение на 2 log 10 КОЕ / г количества Campylobacter HPC5 в слепой кишке через 48 часов после введения однократной дозы бактериофага СР220 группы II из 10 7 БОЕ.Было показано, что частота устойчивости к фагам у колонизированных цыплят после обработки фагом остается остаточной, только около 2% популяции [60]. Совсем недавно Hammerl et al. [61] использовали комбинированное лечение фагами II и III групп. Группы 20-дневных цыплят-самцов Vrolix инокулировали 10 9 КОЕ C . jejuni . Через 7 дней инфицированным птицам вводили суспензию фага 5 × 10 8 БОЕ CP14 (группа III), CP81 (группа III) или CP68 (группа II), отдельно или в комбинации.В возрасте 31 дня экспериментальные птицы были умерщвлены, и подсчет C. jejuni в слепой кишке показал снижение колонизации слепой кишки на 1 log 10 КОЕ / г при обработке одним CP14 по сравнению с контрольной группой. Добавление CP81 к CP14 не улучшило этого сокращения. Однако было зарегистрировано снижение на 3 log 10 КОЕ / г, когда на следующий день после лечения CP14 последовал CP68. Авторы утверждают, что различные рецепторы-хозяева, используемые фагами групп II и III, являются основной причиной как значительного снижения количества Campylobacter , так и более низких уровней резистентных изолятов, полученных при использовании смеси фагов групп II и III (3% ) по сравнению с одним фагом CP14 (4%) или двумя фагами из той же группы III (8%).
Поскольку Campylobacter колонизирует слепую кишку у птиц и не является очень инвазивным, фаг обычно вводят перорально. Карвалью и др. [62] обнаружили, что введение коктейля из трех фагов цыплятам-бройлерам через желудочный зонд и корм уменьшило колонизацию C. jejuni и C. coli в фекалиях цыплят-бройлеров примерно на 2 log 10 КОЕ / г. Авторы сообщают, что количество Campylobacter поддерживалось на 1 log 10 КОЕ ниже в группе, обработанной фагом, по сравнению с необработанным контролем.Однако фагоустойчивые изоляты, выделенные из фекалий (13%), не показали сниженной способности колонизировать кишечник цыпленка или вернуться к фагочувствительному фенотипу. Совсем недавно было определено влияние на микробиоту цыплят-бройлеров, инфицированных Campyobacter jejuni HPC5, после обработки коктейлем из двух фагов [63]. Авторы показали снижение на 2 log 10 КОЕ / г по количеству Campylobacter в содержимом слепой кишки, что in vivo фаги реплицируются и сохраняются в виде стабильной популяции, и, кроме того, инфицирование C.jejuni тестируемыми фагами не влияли на микробиоту [63].
Клостридиоз
Clostridium perfringens является возбудителем некротического энтерита, болезни, поражающей цыплят и патогенез которой не полностью изучен. Считается, что участие токсинов и гидролаз, секретируемых бактериями, имеет отношение к вирулентности и колонизации кишечника анаэробными C. perfringens [64]. Кроме того, известно, что паразиты видов Eimeria , которые колонизируют тонкий кишечник, такие как Eimeria maxima и Eimeria acervulina , предрасполагают к некротическому энтериту из-за утечки плазмы в просвет кишечника, который обеспечивает необходимый ростовой субстрат для обширного размножения. из Clostridium perfringens [65].Обработка фагами показала некоторую эффективность в уменьшении симптомов и прогрессировании заболевания у кур. В исследовании с использованием в общей сложности 900 птиц в различных экспериментальных проектах Miller et al. [66] показали, что пероральное введение коктейля из пяти фагов в концентрации 10 5 БОЕ / мл через желудочный зонд или питьевую воду экспериментально инфицированным цыплятам-бройлерам Cobb (от 0 до 42 дней) с C. perfringens привело к 92 % снижение смертности по сравнению с необработанной контрольной группой. Кроме того, авторы приходят к выводу, что в период 0–42 дней использованный конкретный коктейль (INT-401) увеличивал привес и коэффициенты конверсии корма как в группе фага в воде (2.618 ± 0,059 кг) и группы фага в корме (2,547 ± 0,059 кг) по сравнению с зараженной нелеченой группой (2,296 ± 0,059 кг), и может быть эффективной терапией для контроля некротического энтерита, вызванного C. .
C. perfringens является грамположительной бактерией, это означает, что толстый пептидогликановый слой является наиболее удаленным барьером для контакта с окружающей средой. Кодируемые фагом эндолизины, ферменты, которые нацелены и гидролизуют специфические связи внутри пептидогликановой сетки, как сообщается, являются достаточными для достижения бактериального лизиса [67].Использование очищенных эндолизинов из фагов, нацеленных на C. perfringens , показано как многообещающий способ уменьшить колонизацию или лечить инфекцию этим патогеном, как описано и является предметом обзора в другом месте [8, 68,69,70].
Холодный
Болезни уха, носа и горла
- Бактериофаги применяются при гнойно-воспалительных заболеваниях уха (отит), горла (ангина, хронический тонзиллит) и носа (синусит).
- Бактериофаги применяются местно (полоскание, промывание, закапывание) и перорально.
- Бактериофаги применяются при полирезистентности бактерий-возбудителей к антибиотикам.
- Бактериофаги применяются для лечения пациентов с непереносимостью антибиотиков или противопоказаниями к их применению.
- Бактериофаги можно использовать в сочетании с другими противомикробными средствами.
- Бактериофаги могут быть использованы для профилактики бактериального обострения вирусных инфекций в группах риска: у пожилых людей, пациентов с аллергией, пациентов с ослабленным иммунитетом, пациентов с хроническими заболеваниями.
Гнойно-воспалительные заболевания уха, носа и горла обычно развиваются как обострение после острой респираторной вирусной инфекции (ОРВИ). Заболевания уха, носа и горла часто вызываются условно-патогенной флорой – стафилококками , стрептококками, Pseudomonas Aureginos a и др. Эти бактерии населяют слизистые оболочки дыхательных путей почти у каждого человека и провоцируют заболевание только в случае ослабления. иммунной системы (в частности, при ОРВИ).Возбудители условно-патогенной микрофлоры человека часто развивают множественную лекарственную устойчивость к антибиотикам. Использование бактериофагов при гнойно-воспалительных заболеваниях уха, носа и горла позволяет не только устранить инфекцию, но и стимулировать собственные иммунные реакции организма.
Гайморит – гайморит, фронтит, решетчатая гайморит
Если ринит длится более 10 дней, появляются желто-зеленые выделения из носа, головная боль, светобоязнь и слезотечение; у нас есть все основания подозревать острый гнойный гайморит – бактериальное заболевание придаточных пазух носа.При гайморите из-за воспаления опухшей слизистой оболочки узкие отверстия, соединяющие полость и придаточные пазухи носа, практически полностью перекрываются. Выделения перестают вытекать, вентиляция и дренирование носовых пазух прекращается, что создает благоприятные условия для роста бактерий и усиления воспаления. Воздух вместе с гнойными и другими выделениями давит на стенки пазух и вызывает боль, а бактериальные токсины и продукты разложения тканей, всасываемые через слизистую оболочку придаточных пазух носа в кровь, вызывают общую интоксикацию организма.
Без адекватного лечения эти заболевания могут перейти в хроническую форму, вызвать осложнения во внутренних органах. Бронхит и пневмония гораздо чаще встречаются у пациентов с хроническим синуситом.
Лечение гнойного гайморита включает устранение отека носа и эвакуацию слизи из носовых пазух, а также антибактериальную терапию. Для устранения инфекции целесообразно применять препараты, содержащие бактериофаги, лизирующие наиболее распространенные возбудители гнойных синуситов, в частности, лекарственный препарат Пиофаг®.Фаговые продукты обладают высокой специфичностью – они убивают болезнетворные бактерии, оставляя нетронутой полезную микрофлору полости рта и кишечника. Из-за высокого запаса прочности Пиофаг® разрешен к применению у детей (см. Инструкцию). Кроме того, бактериофаги стимулируют специфические и неспецифические факторы иммунитета, что очень важно при лечении хронических воспалительных заболеваний у ослабленных пациентов.
При гайморите лекарственный препарат Пиофаг® применяется как местно, так и перорально.
Для местного применения используют хлопковые турунды, смоченные в растворе бактериофага (неразбавленный продукт). Пакеты вводят в носовые ходы после промывания носовых пазух и оставляют на 1 час. Пачки меняют до 3-х раз в сутки. Для полоскания носа средство разводят кипяченой водой комнатной температуры в соотношении 1: 3, то есть 10 мл средства на 30 мл воды.
Препарат применяют внутрь в соответствии с возрастной дозой 3 раза в день за 1 час до еды в течение 7-20 дней.
Отит
Боль в ухе, нарушения слуха и лихорадка могут указывать на начало отита. Вирусный отит при отсутствии лечения переходит в гнойную форму. Самая распространенная форма отита – это средний отит. Бактерии попадают в полость уха из носоглотки при рините, фарингите; они могут попасть в слуховую трубу с током крови и лимфы; в раннем возрасте воспаление и увеличение аденоидной вегетации может привести к блокированию отверстия среднего уха и нарушению его естественной вентиляции.При бактериальном отите гнойный гной накапливается в полости среднего уха и разносит барабанную перепонку. Боль усиливается и начинает иррадиировать в височную область. Гной может разорвать барабанную перепонку и вытечь наружу. Если гнойные выделения не отделяются, инфекция может распространиться на окружающие ткани (внутреннее ухо, мозговые оболочки, тройничный нерв), что приведет к ухудшению слуха.
Лечение гнойного отита включает уменьшение отека слизистой оболочки и восстановление нормального сообщения между полостью носа и средним ухом.Противовоспалительные и обезболивающие препараты применяются как местно в виде капель, так и системно. В основе лечения гнойного отита лежит антибактериальная терапия. Эффективным и безопасным вариантом последней является фаготерапия – лечение бактериофагами, лизирующими наиболее распространенные возбудители гнойного отита, в частности, лекарственным средством Пиофаг®. Продукты фага, убивающие патогенные бактерии, не затрагивают полезную микрофлору. Пиофаг® разрешен к применению у детей (см.Инструкции). Бактериофаги стимулируют иммунную систему, что очень важно при лечении хронических воспалительных заболеваний.
При отите лекарственное средство Пиофаг® применяется как местно, так и перорально.
Для местного применения используют хлопковые турунды, смоченные в растворе бактериофага (неразбавленный продукт). Турунды вводят в слуховой проход и оставляют на 1 час. Турунды меняют до 3-х раз в сутки.Препарат применяют внутрь в соответствии с возрастной дозой 3 раза в день за 1 час до еды в течение 7-20 дней.
Ангина (острый тонзиллит)
Сильная боль в горле с резким повышением температуры до 38–39 °, головная боль, утомляемость, появление желтых гнойничков или серо-белого налета на миндалинах – частые симптомы ангины (острого тонзиллита). В большинстве случаев причиной стенокардии является стрептококковая инфекция. По ряду причин (неправильное лечение, снижение иммунитета) острый тонзиллит может перейти в хроническую форму, когда воспаление горла наблюдается постоянно, а периодически обостряется.Кроме того, бактерии, населяющие миндалины, выделяют токсичные продукты, которые в конечном итоге могут привести к развитию ревматизма, миокардита, артрита, гломерулонефрита и т. Д.
Лечение стенокардии включает постельный режим, увеличение жидкости и антибактериальную терапию – как местную, так и систематическую. Целесообразно включение бактериофагов в комплекс лечения ангины, лизирующих стрептококков и других возбудителей заболевания, в частности, лекарственного средства Пиофаг®.Продукты фага влияют только на патогенные бактерии, оставляя полезную микрофлору, и не вызывают дисбактериоз. Кроме того, бактериофаги стимулируют иммунную систему. Пиофаг® одобрен для использования у детей (см. Инструкции).
При тонзиллите лекарственный препарат Пиофаг® применяется как местно, так и перорально.
Средство применяется для полоскания горла 3-4 раза в день в количестве 10-20 мл, а также для целевого промывания миндалин.Препарат применяют внутрь в соответствии с возрастной дозой 3 раза в день за 1 час до еды в течение 7-20 дней.
- Возрастные дозы препарата указаны в Инструкции по медицинскому применению лекарственного средства Пиофаг®.
- Полная информация о продукте содержится в инструкции по медицинскому применению.
- Перед применением прочтите Инструкцию по медицинскому применению лекарственного препарата Пиофаг®.
Скачать инструкцию по медицинскому применению лекарственного препарата Пиофаг®
Р.С. № UA / 15974/01/01. Утверждено приказом Минздрава Украины № 478 от 28.04.2017.
Информация о продукте представлена только в информационных целях и не может использоваться в качестве руководства при самолечении. Только врач может принять решение о назначении препарата, а также о его дозах и способе применения.
Альтернативные терапевтические средства для самоограниченных инфекций – непрямой подход к проблеме устойчивости к антибиотикам
Abstract
Альтернативные методы лечения инфекционных заболеваний являются высшим приоритетом, но какие инфекции должны быть основными мишенями? В настоящее время основное внимание уделяется методам лечения тяжелых инфекций, для которых наиболее необходимо эффективное лечение, но с этими инфекциями трудно справиться, и прогресс был ограниченным.Здесь мы исследуем другой подход. Применяя эволюционную перспективу к обзору исследований по назначению антибиотиков, мы выявляем инфекции, которые, вероятно, вносят большой вклад в эволюцию устойчивости во многих таксонах, но являются клинически легкими и, таким образом, представляют собой более легкие мишени для разработки терапевтических средств. Мы утверждаем, что альтернативные методы лечения этих инфекций косвенно спасли бы жизни, сохранив высокую эффективность существующих антибиотиков для пациентов, которые в них больше всего нуждаются.
Образец цитирования: Воллейн Вальдетофт К., Браун С.П. (2017) Альтернативные методы лечения самоограничивающихся инфекций – косвенный подход к проблеме устойчивости к антибиотикам.ПЛоС Биол 15 (12): e2003533. https://doi.org/10.1371/journal.pbio.2003533
Академический редактор: Эндрю Рид, Университет штата Пенсильвания, Соединенные Штаты Америки
Опубликовано: 28 декабря 2017 г.
Авторские права: © 2017 Wollein Waldetoft, Браун. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Фонд Саймонса https://www.simonsfoundation.org/ (номер гранта 396001). CDC https://www.cdc.gov/ (номер гранта OADS-2016-N-17812). Фонды Веннера-Грена http://www.swgc.org/. Королевское физиографическое общество Лунда https://www.fysiografen.se/en/. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Сокращения: АРФ, г. острая ревматическая лихорадка; DDD, определенная суточная доза; ESBL, β-лактамаза расширенного спектра действия; ГАЗ, стрептококки группы А; IDSA, Американское общество инфекционных болезней
Происхождение: Не введен в эксплуатацию; внешняя экспертная оценка.
Введение
Развитие устойчивости к противомикробным препаратам – одна из самых серьезных проблем для общественного здравоохранения в наше время [1], и разработка новых терапевтических средств для замены традиционных антибиотиков, вероятно, будет играть ключевую роль в решении этой проблемы [2].Состояние конвейера альтернативных терапевтических средств недавно было оценено в отчете, подготовленном Wellcome Trust [2]. Сосредоточившись на «методах лечения, которые могут быть разработаны для лечения системных / инвазивных, а не поверхностных инфекций» [2], авторы оценили потенциал основных текущих направлений исследований в этой области, включая бактериофаги, литические ферменты фагов, пробиотики и антимикробные пептиды. [2]. Однако в настоящее время методы лечения-кандидаты далеки от серьезных конкурентов антибиотикам при лечении тяжелых инфекций, и авторы отчета приходят к выводу, что, вместо того, чтобы быть настоящими альтернативами, эти терапевтические средства могут «использоваться в качестве дополнений к антибиотикам, поскольку они сама по себе деятельность может не обеспечить достаточного терапевтического эффекта »[2].
В дополнение к усилиям, предпринимаемым в области биомедицины, среди эволюционных биологов растет интерес к разработке лекарств, более устойчивых к эволюции резистентности. Это может быть сделано, например, путем нацеливания на черты, общие для бактериальных клеток, такие как восприятие кворума или сидерофоры, и, таким образом, используя преимущества эволюционных конфликтов между группами и индивидуумами [3,4]. Хотя эти стратегии обещают быть менее склонными к развитию резистентности, они лишь в ограниченной степени подавляют размножение бактерий и, таким образом, вряд ли будут такими же эффективными методами лечения, как классические антибиотики, которые эффективно убивают патоген.И было бы трудно полагаться на такое лекарство в качестве единственного антибактериального средства при лечении тяжелой инвазивной инфекции.
Таким образом, разрабатываются новые типы терапевтических средств, но они имеют общую проблему, заключающуюся в том, что, прямо говоря, они недостаточно хороши для лечения тяжелых инфекций. В этой статье мы делаем один шаг назад и обращаемся к фундаментальному вопросу о том, какую функцию должны выполнять альтернативные терапевтические средства для лечения инфекционных заболеваний, и намечаем путь вперед, сосредоточив внимание на распространенных легких инфекциях.
Двойная роль альтернатив антибиотикам
Есть по крайней мере 2 способа, которыми альтернативные терапевтические препараты могут помочь облегчить кризис резистентности. Во-первых, их можно использовать для лечения инфекций, которые больше не поддаются лечению антибиотиками, потому что бактерии устойчивы. Эта роль предполагает сосредоточение внимания на тяжелых инфекциях, от которых больше всего требуется эффективное лечение, и поэтому предъявляет высокие требования к эффективности. Это цель, продвигаемая ВОЗ [5], которую мы в настоящее время не достигаем [2].
Во-вторых, альтернативные терапевтические средства могут заменить антибиотики, чтобы снизить потребление антибиотиков и, таким образом, ослабить селекцию на устойчивость. В этом случае следует сосредоточить внимание на инфекциях, которые вносят большой вклад в развитие резистентности и являются реальными мишенями для альтернативных методов лечения.
Для каких инфекций наиболее приемлемы альтернативные методы лечения?
Причины текущего отсутствия успеха (см. Выше), вероятно, сложны, но мы думаем, что важным аспектом является сосредоточение внимания на тяжелых инфекциях (например,g., сепсис) и поэтому трудно поддается лечению. Обращая внимание на легкие и самоограничивающиеся инфекции [6] (например, стрептококковое горло), мы можем снизить планку и, таким образом, увеличить вероятность успеха.
Легкие инфекции также легче лечить новыми терапевтическими методами, включая антивирулентные препараты, тушители кворума и другие терапевтические средства, которые могут быть менее эффективными методами лечения, но могут быть более устойчивыми к эволюции резистентности, чем традиционные антибиотики [3].Кроме того, поскольку легкие инфекции оставляют больше времени для диагностики, чем тяжелые инфекции, которые необходимо лечить без промедления [7], они лучше поддаются лечению с узким спектром и, следовательно, меньшим негативным воздействием на комменсальную биоту.
При легких инфекциях пациенту могут быть лучше альтернативные препараты
Наилучшим вариантом для пациента является тот, который обеспечивает наилучший баланс между пользой лечения и побочными эффектами. Что касается антибиотиков, последние включают повышенный риск будущей устойчивости к антибиотикам [8] и диареи, связанной с антибиотиками [9].Поскольку альтернативные терапевтические средства не являются антибиотиками и часто имеют узкий спектр (например, фаги, лизины, специфические ингибиторы факторов вирулентности), вероятно, что эти побочные эффекты будут менее выраженными. (Потенциал других типов побочных эффектов трудно оценить для альтернатив в целом.) Следовательно, альтернативные методы лечения могут быть лучше для пациента, учитывая, что инфекция достаточно легкая, чтобы разница в эффективности лечения не перевешивала разницу в этих побочных эффектах. последствия.
Важны ли легкие инфекции для развития резистентности?
Это бесспорное, что эволюция устойчивости к антибиотикам обусловлена применением антибиотиков, но количественный вклад легких инфекций клинический важному сопротивлению неполностью известен. Здесь мы используем мысленный эксперимент, основанный на теории эволюции и соответствующий эмпирическим данным, чтобы обсудить вклад потребления антибиотиков в обществе в значимое с медицинской точки зрения сопротивление.
Рассмотрим следующий сценарий. У индивидуума имеется штаммов Escherichia coli с генами, кодирующими β-лактамазы, и без них, в бессимптомном состоянии носительства. Затем человек заболевает стрептококковым фарингитом, консультируется с терапевтом и ему назначают амоксициллин. Е . coli β-лактамазы придают устойчивость к амоксициллину [10], и при обработке это дает штамму, продуцирующему β-лактамазу, конкурентное преимущество перед непродуцирующим штаммом.Таким образом, количество штамма, продуцирующего β-лактамазу, увеличивается в микробиоте пациента, временно или более постоянно. Это, в свою очередь, увеличивает вероятность того, что он передается другим людям или распространяется на анатомическое место, где вызывает заболевание, тем самым способствуя проблеме резистентности как у отдельного пациента, так и в обществе.
В соответствии с этим сценарием, недельный курс амоксициллина, проведенный здоровыми добровольцами, привел к увеличению E . coli , положительный по гену β-лактамазы в фекалиях [11], и однократная доза перорального ампициллина, вводимая пациентам с гонореей, сопровождалась увеличением фекального содержания E . coli устойчивы к этому препарату [12]. Кроме того, предыдущее использование пенициллина является фактором риска развития β-лактамаз расширенного спектра (БЛРС) и энтеробактерий с множественной лекарственной устойчивостью при инфекциях мочевыводящих путей в сообществе [13,14]. Актуальность этого для тяжелой инфекции подтверждается обнаружением того, что носительство ESBL положительно E . coli является фактором риска бактериемии, вызванной этими микроорганизмами [15].
Этот мысленный эксперимент иллюстрирует 2 основных момента. Во-первых, при системном лечении антибиотиками выбирается резистентность всей микробиоты пациента, а не только патогена, на который она направлена. Таким образом, сравнивая преимущества лечения с проблемой выбора резистентности, нужно выйти за рамки имеющейся инфекции и принять во внимание микробиоту в целом.
Во-вторых, использование одного антибиотика может способствовать повышению устойчивости к целому ряду лекарств, если детерминанты устойчивости встречаются вместе в одних и тех же бактериальных штаммах, что часто имеет место [10].Речь идет о β-лактамазах, особенно БЛРС, поскольку они придают устойчивость к нескольким антибиотикам из группы β-лактамов (например, пенициллинам и цефалоспоринам [16]). Но также гены, кодирующие неродственные механизмы устойчивости, могут встречаться вместе на одних и тех же мобильных генетических элементах или иным образом в одних и тех же бактериях. Если штамм устойчив к нескольким антибиотикам, ему будет благоприятствовать отбор, налагаемый любым из этих препаратов, а когда штамм увеличивается в частоте из-за этого отбора, то же самое происходит со всеми детерминантами устойчивости, которые он кодирует.Таким образом, штаммы с множественной устойчивостью позволяют различным детерминантам устойчивости «путешествовать автостопом» [17] друг с другом. С точки зрения нашего мысленного эксперимента с β-лактамазой, продуцирующей E . coli , значимость этого эффекта, даже для механически не связанных детерминант устойчивости, подтверждается совместным возникновением устойчивости к цефалоспоринам третьего поколения и фторхинолонам, а также обнаружением того факта, что предыдущее использование хинолонов является фактором риска для ESBL в сообществе: приобретенные инфекции мочевыводящих путей [10,13,18].Проблема множественной резистентности может дополнительно усугубляться тем фактом, что мультирезистентные штаммы предпочтительны при большем количестве схем лечения и, следовательно, у большей части пациентов по сравнению со штаммами, устойчивыми к одному типу антибиотиков.
В более общем плане систематические обзоры и метаанализы обнаружили связь между потреблением антибиотиков и резистентностью в обществе [19], а также между назначением антибиотиков в первичной медико-санитарной помощи и резистентностью у отдельного пациента [8], и существует эпидемиологическая связь между назначение антибиотиков в сообществе и устойчивость при инвазивной инфекции [20–22].Хотя эти исследования оставляют много открытий, они все же предполагают роль потребления антибиотиков в обществе в распространении важной с медицинской точки зрения устойчивости. Это неудивительно, потому что сообщество доминирует в использовании антибиотиков. Например, в Европейском союзе (2011 г.) на 1 000 жителей в день в сообществе было назначено в среднем 19,5 установленных суточных доз (DDD), по сравнению с 1,8 DDD на 1 000 жителей в день в больничном секторе [23].
Таким образом, эволюционные последствия лечения антибиотиками выходят за рамки используемого антибиотика и патогена, на который оно нацелено, и вполне вероятно, что рецепт в сообществе вносит значительный вклад в развитие устойчивости.Затем мы обратимся к показаниям, которые стимулируют использование этого антибиотика.
Какие инфекции больше всего способствуют потреблению антибиотиков в обществе?
Чтобы ответить на этот вопрос, мы просматриваем опубликованную в сообществе литературу по рецептам антибиотиков (подробности см. В тексте S1).
Назначение антибиотиков в сообществе было изучено в ряде стран [24–44], и хотя различия в диагностических классификациях между исследованиями не позволяют проводить подробные сравнения, общая картина очевидна: большая часть рецептов вызвана инфекциями, которые ранее здоровые люди обычно мягкие и склонны к самоограничению.Многие случаи относятся к верхним дыхательным путям и прилегающим к ним структурам. Действительно, в Соединенных Штатах синусит, средний отит и фарингит занимают первое, второе и третье места соответственно и вместе составляют почти 30% рецептов [24].
В целом, фарингит / тонзиллит и инфекция мочевыводящих путей входят в число 4 основных показаний более чем в половине исследований, и на них приходится в среднем 8,5% и 9,3% назначений соответственно. Однако между странами существуют различия, и, например, в Швеции на эти два диагноза приходится 19% и 20% соответственно.
Таким образом, существуют возможности для значительного сокращения использования антибиотиков за счет разработки альтернативных терапевтических средств для лечения относительно легких инфекций. Для той части этих инфекций, которые являются вирусными, можно уменьшить назначение антибиотиков даже при отсутствии альтернатив. Краткое изложение результатов представлено на рис. 1, а подробности – в тексте S1.
Рис. 1. Легкие инфекции вносят большой вклад в назначение антибиотиков.
Была проанализирована литература по назначению антибиотиков в сообществе, и были извлечены 4 основных показания в каждой исследуемой стране.Выше представлены 6 диагнозов, которые входили в топ-4 в наибольшей доле исследований, с столбцами, представляющими долю исследований (страны, n = 21), в которых диагноз входил в топ 4 (подробности см. В тексте S1. ).
https://doi.org/10.1371/journal.pbio.2003533.g001
Стрептококковый фаринготонзиллит как кандидат на альтернативную терапию
В этом разделе мы обсуждаем возможные альтернативные методы лечения фаринготонзиллита.Мы обсуждаем это состояние, в частности, потому, что оно вносит важный вклад в потребление антибиотиков (см. Выше), но доступные альтернативные стратегии лечения и типы проблем, которые необходимо учитывать, имеют отношение и к другим состояниям.
Бактериальный фаринготонзиллит почти всегда имеет стрептококковую этиологию, при этом стрептококки группы А (ГАЗ) составляют большинство случаев [45]. При ГАЗ-фарингите препаратом выбора являются пенициллины [46], и, несмотря на широкое применение пенициллина, ГАЗ неизменно чувствителен.Таким образом, лечение ГАЗ-инфекций пенициллином может показаться несложным с точки зрения резистентности. Однако, поскольку эти инфекции вносят большой вклад в использование антибиотиков, они могут влиять на развитие устойчивости у других бактерий, в соответствии с мысленным экспериментом и обсуждением выше.
При оценке пригодности стрептококкового фарингита для альтернативной терапии важно рассмотреть причины, по которым это состояние в настоящее время лечат антибиотиками. В своих рекомендациях по лечению ГАЗ-фарингита Американское общество инфекционных заболеваний (IDSA) ссылается на следующие причины лечения: профилактика острой ревматической лихорадки (ОРЛ), профилактика гнойных осложнений, улучшение клинических признаков и симптомов, снижение контагиозности / передача и ускоренное возобновление нормальной деятельности [46].К этому можно добавить профилактику синдрома Лемьера, вызванного, например, фарингитом Fusobacterium necrophorum , который может быть ошибочно диагностирован как стрептококк. Однако последний риск должен быть небольшим при адекватных диагностических процедурах.
Эффект лечения антибиотиками при ангине, в том числе стрептококковой, оценивался в систематическом обзоре Кокрановской библиотеки [47]. Авторы приходят к выводу, что «абсолютные преимущества скромны» [47], но указывают на проблему зависимости от контекста.Случай с ARF служит иллюстрацией этой проблемы. Лечение антибиотиками снижает риск ОПН примерно до четверти [47]. Однако заболеваемость ОПН сильно различается среди населения [48], и абсолютный риск этого осложнения необходимо оценивать на местном уровне. Например, в Швеции в действующих руководствах по лечению указывается, что риск ОПН слишком низок, чтобы мотивировать использование антибиотиков [49]. (Лечение антибиотиками по-прежнему рекомендуется по другим причинам.) Проблема зависимости от контекста относится также и к гнойным осложнениям [47].Таким образом, мы пришли к выводу, что альтернативное терапевтическое средство для лечения стрептококкового фарингита в идеале должно учитывать все причины для лечения, перечисленные в рекомендациях IDSA, но минимально приемлемый уровень эффективности в предотвращении последствий будет различаться в разных популяциях. С другой стороны, уменьшение симптомов и сокращение периода инфицирования актуальны для всех групп населения. Далее мы обсуждаем альтернативные подходы, которые, по нашему мнению, имеют потенциал.
Бессимптомное носительство ГАЗ является обычным явлением и обычно не требует лечения антибиотиками, поскольку риск осложнений и передачи считается низким [46].Таким образом, одной из потенциальных стратегий может быть разработка антивирулентных препаратов, которые превращают симптоматическую инфекцию в бессимптомное носительство, уменьшают симптомы и риски, связанные с инфекцией, или помогают иммунной системе избавиться от бактерий. Конкретные представляющие интерес факторы включают суперантигены, такие как пирогенный экзотоксин A стрептококка, который вызывает воспаление и может вносить вклад как в симптомы, так и в бактериальную нагрузку при фарингите [50,51], а также стрептокиназу, которая участвует в уклонении от защиты хозяина при фарингите. микрососудистая сеть, а также слюна [52,53].Кроме того, как суперантигены, так и стрептокиназа, вероятно, будут общественным достоянием бактерий и, таким образом, поддаются более эволюционно устойчивой терапии [3], хотя тот факт, что разные штаммы имеют разные суперантигенные профили, предполагает возможность замены штамма в ответ на вмешательства. Хотя осуществимость этого подхода трудно оценить, тот факт, что механизмы вирулентности GAS были широко изучены на молекулярном уровне, говорит в его пользу.
Другой подход – использование бактериофагов. По сравнению с антивирулентным подходом, он убивает бактерии и, таким образом, делает его более похожим на нынешнее лечение. Недавнее исследование, проведенное российскими военными, показало многообещающие результаты с использованием фагов в качестве профилактики инфекций дыхательных путей, включая тонзиллит [54]. Однако мы будем интерпретировать это исследование осторожно, поскольку опубликованный полный текст является неполным, а некоторые страницы опущены.
Механизмы, с помощью которых фаги убивают стрептококки, известны, и работы по их секвестированию в терапевтических целях достигли значительного прогресса.Таким образом, было показано, что литические ферменты фагов эффективны против ГАЗ на мышиных моделях инвазивной инфекции [55], а также при оральной колонизации [56].
Обсуждаемые выше терапевтические пути могут устранить все причины текущего лечения ГАЗ-фаринготонзиллита антибиотиками, как указано в рекомендациях IDSA. Кроме того, терапевтические средства будут более специфичными для ГАЗ, чем современные антибиотики. В случае антивирулентных препаратов это происходит из-за того, что нацелены конкретные молекулярные механизмы вирулентности, в то время как узкий круг фагов-хозяев имеет аналогичный эффект при терапии фагами и их литическими ферментами.Таким образом, эти потенциальные терапевтические средства должны быть менее разрушительными для микробиоты пациента и ограничивать выбор других бактерий по сравнению с традиционными антибиотиками.
Обсуждение и заключение
Здесь мы сделали 2 взаимосвязанных пункта. Во-первых, относительно легкие инфекции вносят большой вклад в назначение антибиотиков, и вполне вероятно, что это приводит к значительному давлению отбора на устойчивость к антибиотикам.
Во-вторых, обращая наше внимание на инфекции, которые вносят большой вклад в развитие резистентности, но являются клинически легкими, мы можем увеличить вероятность успеха разработки альтернативных терапевтических средств и снизить давление отбора для устойчивости к существующим антибиотикам.Мы сосредоточились на вкладе в массовое потребление антибиотиков, но важны и более тонкие аспекты. Например, разные группы пациентов (например, возрастные группы) различаются по частоте конкретных инфекций, а также по бактериям, которые они несут бессимптомно, а также по сопутствующим заболеваниям и истории болезни, и это может повлиять на тип предотвращаемой резистентности.
В заключение, вместе с другими стратегиями, такими как более короткие курсы [8] и использование антибиотиков более узкого спектра [12], где это применимо, альтернативные терапевтические средства для легких инфекций снизят давление отбора для устойчивости к антибиотикам и, таким образом, помогут сохранить эффективность существующих антибиотиков, чтобы мы могли продолжать использовать их для лечения тяжелых инфекций, для которых нам не удается разработать новые лекарства.
Вспомогательная информация
S1 Текст. Была проанализирована литература о назначении антибиотиков в сообществе.
S1 Text предоставляет стратегию поиска, метод выбора исследований, включенные исследования и данные, лежащие в основе резюме результатов, приведенных в основном тексте и на рис. 1.
https://doi.org/10.1371/journal.pbio.2003533.s001
(PDF)
Благодарности
Авторы благодарят Эвелину Кульцинскую и Николая Петрова Брайкова за помощь в оценке Акимкина и др.Они также благодарят Рольфа Луда, Йорана Кронвалла, Тимоти О’Салливана, Лизу И. Полман, Магнуса Расмуссена, Ики Хао, Ингу-Марию Фрик, Дэвида МакАдамса, Ифэй Ванга и Джеймса Герни за их вклад в предыдущие проекты.
Список литературы
- 1. Совещание высокого уровня Организации Объединенных Наций по устойчивости к противомикробным препаратам [Интернет]. [цитировано 7 октября 2016 г.]. http://www.who.int/antimicrobial-resistance/events/UNGA-meeting-amr-sept2016/en/
- 2. Czaplewski L, Bax R, Clokie M, Dawson M, Fairhead H, Fischetti VA, et al.Альтернативы антибиотикам – обзор портфолио. Lancet Infect Dis. 2016; 16: 239–51. pmid: 26795692
- 3. Аллен Р.С., Попат Р., Диггл С.П., Браун С.П. Противодействие вирулентности: можем ли мы создавать препараты, устойчивые к эволюции? Nat Rev Microbiol. Издательская группа «Природа»; 2014; 12: 300–8. pmid: 24625893
- 4. Росс-Гиллеспи А., Вейгерт М., Браун С.П., Кюммерли Р. Гашение сидерофоров, опосредованное галлием, как эволюционно устойчивое антибактериальное лечение. Общественное лечение Evol Med.2014; 2014: 18–29. pmid: 24480613
- 5. ВОЗ. Пресс-релизы ВОЗ [Интернет]. [цитировано 27 февраля 2017 г.]. http://www.who.int/mediacentre/news/releases/2017/bacteria-antibiotics-needed/en/
- 6. Левин Б.Р., Бакеро Ф., Анкомах П.П., МакКолл ИК. Фагоциты, антибиотики и купирующие бактериальные инфекции. Trends Microbiol. Elsevier Ltd; 2017; В прессе: 1–15. pmid: 28843668
- 7. Кумар А., Робертс Д., Вуд К.Э., Лайт Б., Паррилло Дж. Э., Шарма С. и др.Продолжительность гипотензии до начала эффективной противомикробной терапии является решающим фактором выживаемости при септическом шоке у человека. Crit Care Med. 2006; 34: 1589–1596. pmid: 16625125
- 8. Костелло С., Меткалф С., Любовник А., Мант Д., Хэй А.Д. Влияние назначения антибиотиков в первичной медико-санитарной помощи на устойчивость к противомикробным препаратам у отдельных пациентов: систематический обзор и метаанализ. BMJ. 2010; 340: c2096. pmid: 20483949
- 9. Бартлетт Дж. Клиническая практика.Диарея, связанная с антибиотиками. N Engl J Med. Соединенные Штаты; 2002; 346: 334–339. pmid: 11821511
- 10. Европейский центр профилактики и контроля заболеваний (ECDC). Эпиднадзор за устойчивостью к противомикробным препаратам в Европе, 2014 г., 2015 г.
- 11. Киршнер М., Мафура М., Хант Т., Абу-Оун М., Нуньес-Гарсия Дж., Ху Y и др. Характеристики устойчивости к противомикробным препаратам и приспособленность грамотрицательных фекальных бактерий добровольцев, получавших миноциклин или амоксициллин. Front Microbiol.Швейцария; 2014; 5: 722. pmid: 25566232
- 12. Малкахи FM, Лейси СиДжей, Барр К., Лейси Р.У. Устойчивость к Escherichia coli после однократной дозы ампициллина для лечения гонореи. Genitourin Med. 1986; 62: 166–169. pmid: 3525384
- 13. Колоднер Р., Рок В., Чазан Б., Келлер Н., Гай Н., Сакран В. и др. Факторы риска развития бактерий, продуцирующих бета-лактамазы расширенного спектра действия, у негоспитализированных пациентов. Eur J Clin Microbiol Infect Dis. 2004. 23: 163–167.pmid: 14986159
- 14. Rossignol L, Maugat S, Blake A, Vaux S, Heym B, Le Strat Y и др. Факторы риска резистентности к инфекциям мочевыводящих путей у женщин общей практики: перекрестное исследование. J Infect. 2015; 71: 302–311. pmid: 26054878
- 15. Дени Б., Лафори М., Доней Дж. Л., Фонтен Дж. П., Оксенхендлер Е., Раффу Е. и др. Распространенность, факторы риска и влияние на клинические исходы бактериемии, продуцирующей бета-лактамазы расширенного спектра действия Escherichia coli : пятилетнее исследование.Int J Infect Dis IJID Off Publ Int Soc Infect Dis. Канада: Международное общество инфекционных болезней; 2015; 39: 1–6. pmid: 26189774
- 16. Рупп МЭ, Фей Полицейский. Enterobacteriaceae, продуцирующие бета-лактамазы расширенного спектра (ESBL): соображения по диагностике, профилактике и медикаментозному лечению. Наркотики. 2003. 63: 353–365. pmid: 12558458
- 17. Мейнард Смит Дж., Хей Дж. Автостопный эффект благоприятного гена. Genet Res. 1974; 23: 23–35. pmid: 4407212
- 18.Soraas A, Sundsfjord A, Sandven I, Brunborg C, Jenum PA. Факторы риска внебольничных инфекций мочевыводящих путей, вызванных производящими ESBL Enterobacteriaceae – исследование методом случай-контроль в стране с низкой распространенностью. PLoS ONE. 2013; 8 (7). pmid: 23936052
- 19. Белл Б.Г., Шеллевис Ф., Стобберинг Э., Гуссенс Х., Прингл М. Систематический обзор и метаанализ влияния потребления антибиотиков на устойчивость к антибиотикам. BMC Infect Dis. 2014; 14: 13. Pmid: 24405683
- 20.Гуссенс Херман, Ферех Матус, Вандер Стихеле Роберт, Э. М. Амбулаторное использование антибиотиков в Европе и связь с устойчивостью: исследование базы данных из разных стран. Ланцет. 2005; 365: 579–587. pmid: 15708101
- 21. Хикс Л.А., Чиен Ю.В., Тейлор Т.Х., Хабер М., Клугман К.П. Амбулаторное назначение антибиотиков и невосприимчивых стрептококков пневмонии в США, 1996–2003 гг. Clin Infect Dis. 2011; 53: 631–639. pmid: 218
- 22. Отео Дж., Кампос Дж., Лазаро Э., Куэвас О, Гарсия-Кобос С., Перес-Васкес М. и др.Повышенная устойчивость к амоксициллину и клавулановой кислоте в изолятах крови Escherichia coli , Испания. Emerg Infect Dis. Соединенные Штаты; 2008. 14: 1259–1262. pmid: 18680650
- 23. Европейский центр профилактики и контроля заболеваний (ECDC). Эпиднадзор за потреблением противомикробных препаратов в Европе, 2011. 2014.
- 24. Fleming-Dutra KE, Hersh AL, Shapiro DJ, Bartoces M, Enns EA, File TM и др. Распространенность неправильного назначения антибиотиков среди посещений амбулаторных служб США, 2010–2011 гг.Джама. 2016; 315: 1864–1873. pmid: 27139059
- 25. Аб Рахман Н., Чеонг Л. Т., Сивасампу С. ШАБЛОН – Назначение антибиотиков в государственной и частной практике: перекрестное исследование в клиниках первичной медико-санитарной помощи в Малайзии. BMC Infect Dis. BMC Инфекционные заболевания; 2016; 16: 208.
- 26. Андраджати Р., Тилакза А., Супарди С. Факторы, связанные с рациональным назначением антибиотиков в общественных медицинских центрах в городе Депок, Индонезия. J заразить общественное здравоохранение. Университет медицинских наук короля Сауда бин Абдель Азиза; 2015; 10: 41–48.pmid: 26952648
- 27. Салех Н., Авада С., Аввад Р., Джибай С., Арфул С., Зайтер Л. и др. Оценка назначения антибиотиков в ливанской общине: пилотное исследование. Infect Ecol Epidemiol. 2015; 5: 27094. pmid: 26112266
- 28. Этьен С., Пульчини С. Перспективная оценка рецептов антибиотиков для французских врачей. Нажмите Medicale. Elsevier Masson SAS; 2015; 44: e59 – e66.
- 29. Фернандес-Уррусуно Р., Флорес-Дорадо М, Вильчес-Аренас А, Серрано-Мартино С., Корраль-Баэна С., Монтеро-Балоса МС.Adecuación de la prescripción de antibióticos en un área de atención primaria: estudio descriptivo transversal. Enferm Infecc Microbiol Clin. SEGO; 2014; 32: 285–292.
- 30. ван ден Брук д’Обренан Дж., Верхей Т.Д.М., Нуманс М.Э., ван дер Фельден А.В. Использование антибиотиков в первичной медико-санитарной помощи в Нидерландах: взаимосвязь между диагностикой, консультацией и лечением. J Antimicrob Chemother. 2014; 69: 1701–1707. pmid: 24508898
- 31. Nord M, Engström S, Mölstad S. Mycket varierande förskrivning av antibiotika i primärvården.Läkartidningen. 2013; 110: 1–3.
- 32. Думпис У., Диминя Э., Акерманис М., Тиранс Э., Вейде С. Оценка назначения антибиотиков латвийскими врачами общей практики. BMC Fam Pract. 2013; 14: 9. pmid: 23311389
- 33. Мерфи М., Брэдли С.П., Бирн С. Назначение антибиотиков в первичной медико-санитарной помощи, соблюдение руководящих принципов и ненужное назначение – с ирландской точки зрения. BMC Fam Pract .; 2012; 13: 1–8.
- 34. Патхак А., Махадик К., Данерия С.П., Шарма А., Эрикссон Б., Лундборг К.С.Назначение антибиотиков в амбулаторных условиях: больничные и сезонные колебания в Удджайне, Индия. Scand J Infect Dis. 2011; 43: 479–88. pmid: 21299365
- 35. Петерсен I, Хейворд AC. Назначение антибактериальных препаратов в первичной медико-санитарной помощи. J Antimicrob Chemother. 2007; 60. pmid: 17656380
- 36. Avci IY, Kilic S, Acikel CH, Ucar M, Hasde M, Eyigun CP и др. Амбулаторное назначение пероральных антибиотиков в больнице для тренировок в Турции: тенденции последнего десятилетия. J Infect. 2006; 52: 9–14.pmid: 16181680
- 37. Пан Й., Хендерсон Дж., Бритт Х. Назначение антибиотиков в общей врачебной практике Австралии: как оно изменилось с 1990–91 по 2002–2003 годы? Respir Med. 2006; 100: 2004–2011. pmid: 16616483
- 38. Джелински С., Парфри П., Хатчинсон Дж. Использование антибиотиков в общественной практике: согласование руководящих принципов и необходимость рецепта. Pharmacoepidemiol Drug Saf. 2005. 14: 319–326. pmid: 15386724
- 39. Rautakorpi U-M, Klaukka T, Honkanen P, Mäkelä M, Nikkarinen T, Palva E, et al.Использование антибиотиков по показаниям: основа для активной политики в отношении антибиотиков в обществе. Scand J Infect Dis. 2001; 33: 920–926. pmid: 11868766
- 40. Чанг С.С., Шиу М-Н, Чен Т-Дж. Использование антибиотиков в отделениях первичной медико-санитарной помощи на Тайване после учреждения национального медицинского страхования. Диагностика Microbiol Infect Dis. 2001; 40: 137–143. pmid: 11502383
- 41. Stürchler M, Vuille P, Zemp E, Tschud i P, Zimmerli W. Диагностика и антибактериальная терапия инфекций в амбулаторных условиях.Schweiz Med Wochenschr. 2000; 130: 1437–46. pmid: 11075407
- 42. Straand J, Rokstad K, Sandvik H. Назначение системных антибиотиков в общей практике. Отчет об исследовании рецептов Møre & Romsdal. Scand J Prim Heal Care. 1998. 16: 121–7.
- 43. Гаде-Кристенсен А., Кнудсен Э., Мёллер Б., Сидениус Дж., Остербай П. Лечение инфекционных заболеваний антибактериальными препаратами в общей практике. Ugeskr Laeger. 1991; 153: 176–81. pmid: 1998236
- 44.Obaseiki-Ebor EE, Akerele JO, Ebea PO. Обследование амбулаторного назначения антибиотиков и самолечения антибиотиками. J Antimicrob Chemother. 1987. 20: 759–763. pmid: 3429377
- 45. Pichichero ME. Стрептококковый тонзиллофарингит группы А: рентабельная диагностика и лечение. Ann Emerg Med. 1995; 25: 390–403. pmid: 7864482
- 46. Shulman ST, Bisno AL, Clegg HW, Gerber MA, Kaplan EL, Lee G и др. Руководство по клинической практике по диагностике и лечению стрептококкового фарингита группы А: обновление 2012 г., подготовленное Американским обществом инфекционистов.Clin Infect Dis. 2012; 55: 86–102. pmid: 22965026
- 47. Spinks A, Glasziou PP, Del Mar CB. Антибиотики при ангине (Обзор). Кокрановская база данных Syst Rev.2013; CD000023. pmid: 241
- 48. Карапетис-младший, Макдональд М, Уилсон, штат Нью-Джерси. Острая ревматическая лихорадка. Ланцет. 2005. 366: 155–68. pmid: 16005340
- 49. Läkemedelsverket, СМИ, Strama. Behandlingsrekommendationer for vanliga Infktioner i öppenvård. 2013. С. 1–20.
- 50.Kasper KJ, Zeppa JJ, Wakabayashi AT, Xu SX, Mazzuca DM, Welch I, et al. Бактериальные суперантигены способствуют острой носоглоточной инфекции Streptococcus pyogenes в зависимости от класса II MHC человека. PLoS Pathog. 2014; 10 (5): e1004155. pmid: 24875883
- 51. Commons RJ, Smeesters PR, Proft T, Fraser JD, Robins-Browne R, Curtis N. Стрептококковые суперантигены: категоризация и клинические ассоциации. Тенденции Мол Мед. Англия: Elsevier Ltd; 2013; 20: 1–15. pmid: 24210845
- 52.Воллейн Вальдетофт К., Моханти Т., Карлссон С., Моргелин М., Фрик И.-М., Мальмстрём Дж.