Раствор натрия хлорида: инструкция по применению
Иногда бывает так, что те вещества, с которыми мы постоянно сталкиваемся в быту, помогают в критических ситуациях поддержать здоровье. Именно к ним относится и привычная поваренная соль – натрий хлорид, инструкция по применению и аналоги которого рассматриваются в статье.
Подарок природы
Химические соединения изучаются фармацевтами постоянно, ведь даже самые обыденные и тривиальные из них могут стать незаменимыми помощниками в медицине. Вот соль из кухонной солонки. Без нее не обойтись: каждое блюдо, в меру посоленное, становится только вкуснее. Правильное же название этого столового помощника – натрия хлорид. Что это такое за вещество и почему оно нашло применение как в кулинарии, так и в медицине?
Именно раствор соединения натрия и хлора придает морской воде соленый вкус. В природе хлорид натрия в кристаллическом состоянии является каменной солью или же минералом галитом. Он прозрачен, если не имеет примесей, хотя можно встретить и его розовые, сиреневые, охряные или зеленоватые формы, цвет которых зависит от добавочных компонентов. Люди добывали соль для своих каждодневных нужд с давних времен различными путями. Раствор натрия хлорида сегодня является веществом с многофункциональной нагрузкой, используется во многих сферах жизнедеятельности человека, и одна из них – медицина.
В природе хлорид натрия в кристаллическом состоянии является каменной солью или же минералом галитом. Он прозрачен, если не имеет примесей, хотя можно встретить и его розовые, сиреневые, охряные или зеленоватые формы, цвет которых зависит от добавочных компонентов. Люди добывали соль для своих каждодневных нужд с давних времен различными путями. Раствор натрия хлорида сегодня является веществом с многофункциональной нагрузкой, используется во многих сферах жизнедеятельности человека, и одна из них – медицина.
Фармацевтическая форма
Фармацевтическая промышленность старается максимально использовать любые натуральные, полусинтетические и синтетические компоненты, которые способны оказать влияние на состояние здоровья человека, помогают справляться с болезнями и патологиями, а также служат средствами профилактики. Вот и натрия хлорид, свойства которого важны для организма человека, не стал исключением и выпускается фармацевтическими компаниями в нескольких лекарственных формах. Это раствор для проведения инъекций, как внутривенных и внутримышечных, так и для капельных или струйных инфузий. Также это спреи и жидкости для промывания носовых проходов, кристаллический порошок для приготовления растворов различной концентрации для внутреннего и наружного применения. Для лечебных целей предпочтительнее использовать специальные препараты, а не разводить кухонную поваренную соль в стакане с водой. Сделать это стоит из-за правильного соблюдения концентрации раствора, а также из соображений отсутствия примесей в фармацевтических препаратах, которые могут содержаться в поваренной соли.
Это раствор для проведения инъекций, как внутривенных и внутримышечных, так и для капельных или струйных инфузий. Также это спреи и жидкости для промывания носовых проходов, кристаллический порошок для приготовления растворов различной концентрации для внутреннего и наружного применения. Для лечебных целей предпочтительнее использовать специальные препараты, а не разводить кухонную поваренную соль в стакане с водой. Сделать это стоит из-за правильного соблюдения концентрации раствора, а также из соображений отсутствия примесей в фармацевтических препаратах, которые могут содержаться в поваренной соли.
Фармакологическая принадлежность
Для такого лекарственного средства, как натрия хлорид, инструкция по применению может указывать разную фармакологическую принадлежность. Связано это с тем, для каких целей предназначается конкретное лекарство. В общем перечне лекарственных средств химическое соединение можно найти в следующих группах:
- антиконгестанты;
- вспомогательные вещества, реактивы или полупродукты;
- регуляторы водно-электролитного баланса или кислотно-щелочного состояния.

В зависимости от концентрации раствора хлорида натрия будет находиться оказываемое им действие и его фармакологическая принадлежность.
Как работает вещество?
Сталкиваясь с необходимостью применения практически такого же вещества, какое есть в каждом доме в солонке, у человека возникает вопрос: “Натрия хлорид – что это такое?”. Как химическое соединение, оно является натриевой солью соляной кислоты. А именно соляная кислота служит одним из компонентов так называемого желудочного сока – секрета желудка, занимающегося расщеплением пищи для дальнейшего усвоения необходимых ее ингредиентов.
Натрий – то вещество, ионы которого осуществляют передачу межклеточных импульсов в тканях организма. Так что две основные составляющие натрия хлорида уже сами по себе являются важнейшими элементами всего живого.
Хлорид натрия обладает удивительной особенностью – его осмотическое давление равно осмотическому давлению биологических жидкостей человека – крови, слезам. Поэтому раствор соли способен поддерживать межклеточное давление и давление плазмы крови на нужном человеку уровне. Если же концентрация хлористого натрия в организме недостаточна, то вода просачивается из клеток в межклеточное пространство, что вызывает спазмы мышц, нарушение работы сердечно-сосудистой и нервной систем.
Поэтому раствор соли способен поддерживать межклеточное давление и давление плазмы крови на нужном человеку уровне. Если же концентрация хлористого натрия в организме недостаточна, то вода просачивается из клеток в межклеточное пространство, что вызывает спазмы мышц, нарушение работы сердечно-сосудистой и нервной систем.
Учеными установлено, что лишь концентрация 0,9 % раствора натрий хлора изотонична жидкостям организма человека. Этим объясняется необходимость использовать только специально приготовленные препараты с выдержанным соотношением воды и соли хлора, а не пользоваться разведенной на глаз в стакане с водой солью. Впрочем, рецепты народной медицины, в которых используется крепкий соляной раствор (например, для полоскания горла), основаны также на физике осмотического давления и позволяют качественно лечить гнойники и воспаления.
Для чего назначается?
Всю важную информацию рассказывает для препарата “Натрия хлорид” инструкция по применению. Ее обязательно следует внимательно прочитать и специалисту, назначающему лекарство с солью, и пациенту, нуждающемуся в лечении данным природным веществом.
Сложные законы физики должны соблюдаться в применении хлорида натрия (раствора) — биологического заменителя плазмы крови. Чтобы использовать препарат для разведения лекарств и введения их в кровь, нужно получить изотонический раствор. Учеными установлено, что это может быть лишь 0,9 % раствор хлорида натрия. Такая концентрация позволяет клеткам крови находиться в стабильном правильном состоянии. Если использовать более насыщенную жидкость, например, 3-10 %, то она будет считаться гипертонической, а клетки под давлением концентрированного раствора будут сжиматься за счет выхода воды из них. Если же кровь заменить совершенно слабым раствором хлорида натрия или обычной водой, то клетки станут разрушаться, так как вода извне будет стремиться проникнуть внутрь клеток, вызывая распад мембраны. Поэтому ответ на вопрос: “Натрия хлорид для чего используют?” будет зависеть от того, какова концентрация раствора.
Ключевые направления применения препарата, в основе которого лежит обычная столовая соль, но используемая в растворе строго определенной концентрации, таковы:
- 0,9 % раствор натрия хлорида показания к применению имеет связанные с потерей внеклеточной жидкости, или, как еще говорят, при обезвоживании.
 Это состояние может быть вызвано токсической диспепсией, диареей, сильной или долго не прекращающейся рвотой, холерой, сильной экссудацией при обширном ожоговом поражении кожных покровов, гипохлоремией и гипонатриемией с обезвоживанием. Такая концентрация раствора соли используется при кишечной непроходимости как дезинтоксикационное средство; им промывают раны, глаза, полость носа. Также такой раствор используют для приготовления различных лекарственных веществ или увлажнения перевязочного материала;
Это состояние может быть вызвано токсической диспепсией, диареей, сильной или долго не прекращающейся рвотой, холерой, сильной экссудацией при обширном ожоговом поражении кожных покровов, гипохлоремией и гипонатриемией с обезвоживанием. Такая концентрация раствора соли используется при кишечной непроходимости как дезинтоксикационное средство; им промывают раны, глаза, полость носа. Также такой раствор используют для приготовления различных лекарственных веществ или увлажнения перевязочного материала; - Гипертонический, то есть 3-10 % раствор хлорид натрия применение нашел при легочных, желудочных и кишечных кровотечениях. Его используют в качестве вспомогательного осмотического диуретика, который выводит излишки жидкости при проведении форсированного диуреза, обезвоживании, отравлении нитратом серебра. Данная концентрация раствора соли используется для обработки гнойных ран наложением повязки, то есть местно, или при запоре, путем введения в задний проход, то есть ректально в виде клизмы.

Раствор натрия хлорида в более слабой, чем 0,9 % концентрации, никакой физиологически значимой роли не играет. Вводить его внутривенно нельзя из-за риска разрушения клеток крови за счет нарушения изотонии жидкостей.
Негативные последствия
Казалось бы, препарат “Натрия хлорид”, приобретенный в аптеке, а значит, имеющий строго выдержанную концентрацию, абсолютно биосовместим с организмом человека. Но как и у любого другого лекарственного средства, у него есть свои побочные эффекты. Они могут проявиться как при использовании раствора высокой концентрации, так и при длительном или чрезмерном введении изотонического раствора. Для препарата “Натрия хлорид” инструкция по применению указывает на следующие побочные эффекты:
- ацидоз – нарушение кислотно-щелочного баланса организма в сторону увеличения окисления;
- гипергидратация – нарушение водно-солевого баланса, проявляющееся отеками, асцитом;
- гипокалиемия – недостаток калия, отражающийся на работе многих органов и систем, особенно страдает при таком дисбалансе сердечно-сосудистая система.

Для того чтобы избежать их появления, необходимо использовать данный препарат только по рекомендации врача, в строго указанной дозировке и режиме применения. Кажущаяся естественность раствора соли для организма человека, используемого неправильно, может стать причиной ухудшения самочувствия.
А если передозировка?
Одно из изотонических средств, используемых в современной медицине, – препарат “Хлорид натрия”. Инструкция по его применению оговаривает, что случаи передозировки не зафиксированы, а потому данных о проявлении такого состояния нет. Впрочем, чрезмерное введение даже изотонического раствора хлорида натрия способно привести к гипергидратации и развитию гипокалиемии.
Если препарат применять нельзя?
Раствор соли, используемый в качестве средства разведения лекарственных препаратов, или жидкости, способной на некоторое время заменить плазму крови, следует рассматривать как медицинское средство, имеющее свои противопоказания к применению. Гипертонический в 3-10 % и изотонический раствор 0,9 % нельзя применять при:
- ацидозе;
- гипергидратации внеклеточной;
- гипернатриемии;
- гиперхлоремии;
- гипокалиемии;
- нарушениях циркуляторных, угрожающих отеком легких и/или мозга;
- отеке легких;
- отеке мозга;
- недостаточности левожелудочковой в острой форме;
Для препарата “Натрия хлорид” инструкция и свойства оговаривают, что его не рекомендуется использовать при проведении терапии глюкокортикоидами в высоких дозах из-за усиления риска развития побочных эффектов при лечении тем и другим препаратами.
Некоторые условности
Для такого лекарственного средства, как раствор “Натрия хлорида”, существуют некоторые ограничения, когда его можно применять, но под тщательным наблюдением специалиста. Такими ограничениями будут:
- гипертензия артериальная;
- нарушение функции почек;
- сердечная недостаточность;
- отеки периферические.
В больших объемах данное лекарственное средство не рекомендуется использовать во время токсикоза беременных. Но в то же время, как те же примочки на основе гипертонического раствора, назальный спрей или же как основу для разведения необходимых лекарств, натрия хлорид можно применять и в терапии беременных женщин. Все вышеперечисленные состояния могут использовать в терапии раствор соли, но больного в период лечения должен наблюдать специалист.
Как принимают препарат?
Для лекарственного препарата “Натрия хлорид” инструкция по применению будет соответствовать форме выпуска. Лекарство на основе привычной поваренной соли, но приготовленное на фармацевтическом производстве в определенной концентрации, выпускается в виде растворов для разных видов инъекций, а также назального спрея.
В большинстве случаев изотонический раствор натрия хлорида используется для внутривенного введения как самостоятельного препарата или как основы для получения определенных лекарственных средств. Для такой инъекции применяют капельный метод. Чтобы улучшить замещение плазмы таким соляным раствором, его предварительно подогревают до 36-37 °С. Определяя количество жидкости для вливания, специалист должен учесть не только потерю, которую нужно восполнить, но и общее самочувствие пациента, его возраст и массу тела. Рекомендуемая скорость введения такого лекарственного препарата составляет 540 мл за 1 час. Если есть необходимость, например, при сильной интоксикации организма, то за сутки взрослому человеку можно вливать внутривенно до 3 литров изотонического раствора. Детям рассчитывают максимальное количество изотонического раствора исходя из массы тела – на 1 кг можно вводить ребенку от 20 до 100 мл препарата за сутки.
Если в физрастворе необходимо разводить некоторые лекарства, то концентрацию будущего препарата определяет специалист. Разброс достаточно велик – от 50 до 250 мл на одну дозу, количество растворителя и лекарства определяется врачом в соответствии с потребностью.
Разброс достаточно велик – от 50 до 250 мл на одну дозу, количество растворителя и лекарства определяется врачом в соответствии с потребностью.
Гипертонический раствор – от 3 % до 10 % натрия хлорида в дистиллированной воде, используется для проведения ректальных клизм с целью вызвать дефекацию. Медленное введение такой клизмы используется для снятия отеков, вызванных нарушениями в работе сердца или почек, а также при гипертонии и повышенном внутричерепном давлении. Объем раствора в этом случае составляет от 10 до 30 мл. При использовании такого способа избавления от отеков следует помнить, что ректальные клизмы не применяют при язвенных и воспалительных процессах в толстом кишечнике.
Насморк – проблема людей разного возраста – от младенческого до преклонных лет. Для избавления от слизи и заложенности носа востребованы препараты натрия хлорид. Инструкция по применению к таким лекарствам указывает на дозировку в соответствии с возрастом. Чаще всего изотоническим раствором промывают носовые пазухи, а гипертоническим – избавляют от заложенности и выделяемого секрета. Слабый солевой раствор можно использовать и в профилактических целях в период обострения простудных заболеваний, закапывая детям по 1 капле в каждую ноздрю, а взрослым по 2 капли.
Слабый солевой раствор можно использовать и в профилактических целях в период обострения простудных заболеваний, закапывая детям по 1 капле в каждую ноздрю, а взрослым по 2 капли.
Гипертонический раствор, в котором соли содержится от 3 до 10 %, используется для компрессов на гнойных поражениях кожи. В этом случае осмотическое давление позволяет как бы вытягивать гнойное содержимое, что делает процесс выздоровления и заживления раны более активным. В этом случае раствор можно приготовить и в домашних условиях – на стакан воды берется 1 чайная ложка поваренной соли, тщательно размешивается. Затем в полученном составе смачивается марля или бинт и накладывается на обрабатываемую поверхность, закрепляется компрессом и оставляется на некоторое время.
Изотонический солевой раствор часто назначается для ингаляций через небулайзер. Такое лечение помогает малышам и взрослым смягчить сухой кашель, облегчить состояние при лор-заболеваниях или приступах аллергии. Естественно, что дозу и длительность такой процедуры должен рекомендовать лечащий врач.
Совместное применение
Для препарата “Хлорид натрия” инструкция по использованию, в зависимости от формы выпуска, оговаривает условия комплексного применения с другими лекарственными средствами. В абсолютном большинстве случаев изотонический раствор натрия хлорида совместим в лекарственными веществами. Единственное требование – наблюдать визуально при смешивании выпадение осадка. По некоторым данным, раствор соли не рекомендуется совмещать в одном флаконе с филграстимом и полимиксином В. Также всегда следует помнить, что изотонический раствор позволяет усваиваться растворенным в нем веществам более полноценно, увеличивая их биодоступность.
Аптечные средства
Вся информация о препарате “Натрия хлорид” — в инструкции по применению. Аналоги данного лекарственного вещества должны обладать теми же характеристиками, что и раствор соли. В аптеках можно приобрести в качестве физиологического раствора многокомпонентное средство “Реосорбилакт”, в состав которого входит и натрия хлорид. Оно также является плазмозаменителем и используется для восполнения циркулирующей крови.
Оно также является плазмозаменителем и используется для восполнения циркулирующей крови.
Сам же раствор натрия хлорида фармацевтические компании выпускают под названием активного компонента с добавлением брендового имени завода, например, “Натрия Хлорид Браун”.
Назальные спреи с солевым раствором имеют собственные наименования, причем во многих случаях концентрация для детей и взрослых определяется приставкой “беби”, “софт”, “стронг”, например, “Аквамарис-Стронг”, “Аквалор-Беби” и тому подобное. Консультацию по применению того или иного препарата может дать только специалист.
Мнение специалистов и пациентов о препарате
Рассказывают об особенностях применения препарата “Натрия хлорид” инструкция и отзывы врачей и пациентов. Обычные люди говорят в основном о том, что раствор соли помогает справляться с насморком у малышей и взрослых, качественно избавляет от гнойников при наружном применении. Физраствор эффективен в случаях купирования приступов кашля, вызванного простудой или аллергией. Специалисты же могут судить о растворе натрия хлорида более масштабно, ведь именно это вещество обладает изотоничностью крови, позволяя нормализовать уровень жидкости, восполняя необходимые вещества и доставляя лекарства в ткани. Раствор соли используется в медицине очень и очень давно, и, по-видимому, замену ему найдут еще нескоро.
Специалисты же могут судить о растворе натрия хлорида более масштабно, ведь именно это вещество обладает изотоничностью крови, позволяя нормализовать уровень жидкости, восполняя необходимые вещества и доставляя лекарства в ткани. Раствор соли используется в медицине очень и очень давно, и, по-видимому, замену ему найдут еще нескоро.
Для чего назначают капельницу Натрия хлорид?
Натрия хлорид – препарат, который давно используется в медицине. Этот физиологический раствор ставится внутривенно в виде капельниц и внутримышечно, используется для ингаляций и пр.
В медицине хлорид натрия используют:
- Для внутривенного вливания как раствор натрия в виде капельницы.
- Для разведения препаратов для инъекций.
- Для обеззараживания порезов и ран.
- Для промывания носа.
Для чего назначают капельницы с хлоридом натрия и при каких состояниях его прописывают – подробно описано ниже.
Что это такое?
- В человеческой крови растворено множество химических биоактивных соединений.

- Концентрация хлоридов в крови играет большую роль в слаженной работе всех внутренних систем.
- Хлориды регулируют гидробаланс плазмы и жидкостей организма, нормализуют кислотно-щелочной метаболизм.
- Когда организм заболевает, в первую очередь, он начинает реагировать на болезнь обезвоживанием.
При обширном обезвоживании хлор с ионами калия из организма вымывается. Уменьшение их концентрации вызывает сгущение крови, спазмы, судороги гладкой мускулатуры, а также нарушения работы ЦНС, сердца и сосудов.
В этом случае и назначают обычно капельницу с физраствором хлорида натрия.
Из чего состоит капельница?
Состав физраствора представляет хлористый натрий — плазмозамещающее вещество, которое готовится из солей натрия NaCl (в быту известен как поваренная соль).
Натрия хлорид (NaCl) представляет собой кристаллы белого цвета, быстрорастворимые в воде.
Хлор в чистом виде ядовит, но известен как эффективный обеззараживатель разных жидкостей. Хлор в соединении с натрием присутствует в плазме крови.
Хлор в соединении с натрием присутствует в плазме крови.
В организм вещество поступает вместе с водой и пищей.
Естественно, применение натрия хлорида в быту ограничено преимущественно кулинарией.
Поэтому если выпить раствор натрия хлорид — ничего не случится. Не стоит беспокоиться даже если ребенок выпил раствор из-за недогляда взрослых.
Свойства натрия хлорид
Солевой раствор натрия хлорид оказывает регидратирующее действие — то есть, восстанавливающее водный баланс.
Натрия хлорид эффективен при разных патологиях.0,9%-ный натрия хлорид имеет одинаковое осмотическое давление с кровью человека, поэтому может быстро выводиться.
Наружное применение помогает вывести из раны гной и устранить патологическую микрофлору.
Использование физраствора через капельницы внутривенно увеличивает мочеотделение и восполняет нехватку хлора и натрия.
Виды физраствора
Физраствор натрия хлорид для капельниц в настоящее время выпускается в 2-х видах, различающихся по степени концентрированности.
Фото (кликабельны):
Изотонический физиологический Nacl 0,9%-ный раствор Браун от немецкого производителя назначают для:
- Восстановления внутриклеточной плазмы, утерянной в результате длительной диспепсии.
- Восполнения межклеточной жидкости, утерянной в результате обезвоживания.
- Восполнения ионов при интоксикациях и при кишечной непроходимости.
- Как наружное средство.
- Для разведения концентрированных лекарств.
Гипертонический 3, 5 и 10%-ный раствор натрия хлорид применяют:
- Как наружный антисептик.
- Для разведения клизменных растворов.
- Внутривенное для восполнения жидкости при диурезе.
- Вливание при снятии мозговых отеков или для повышения низкого давления (в частности при внутренних кровотечениях).
- Как антиотечное средство в офтальмологии.
Продается натрия хлорида раствор в ампулах для растворения лекарств для введения инъекций и во флаконах емкостью до 1-го литра для наружного и клизменного применения, внутривенного вливания.
Также производятся таблетки для приема перорально и делают назальный спрей во флакончиках.
Форма выпуска, состав и упаковка
Раствор для инъекций 0.9% — 100 мл, натрия хлорид 900 мг
- 1 мл — ампулы (10) — пачки картонные.
- 2 мл — ампулы (10) — пачки картонные.
- 5 мл — ампулы (10) — пачки картонные.
- 10 мл — ампулы (10) — пачки картонные.
Для чего назначают натрия хлорид?
Физраствор натрия хлорид — пожалуй, самое универсальное средство.
Капельницы с натрием хлоридом ставят в любой комплексной терапии.
Внутривенно средство капают для:
- Быстрого восполнения объема крови.
- Срочного восстановления деятельности внутренних органов в состоянии шока.
- Насыщения органов жизненно необходимыми ионами.
- Остановки процессов интоксикации и снятия симптомов отравления.
При этих состояниях чаще всего назначается срочное использование натрия хлорид в капельницах:
- Диарее.

- Рвоте.
- Диспепсии.
- При наличии обширных ожогов.
- При холере.
- При обезвоживании организма.
При беременности
Натрия хлорид используют для лечения тяжелых патологий беременных женщин.
Физраствор абсолютно безвреден и для организма женщины и развивающегося плода.
Обычно натрий хлор нужен при терапии беременным нужен для разведения лекарственных препаратов для однократного вливания до 400 мл.
Если нужно восстановить уровень крови, количество физраствора увеличивают до 1400 мл.
Ещё хлорид натрия для беременных применяют:
- При сильном токсикозе физраствор насыщают дополнительно витаминами.
- При гестозе.
- При детоксикации.
- В процессе осложненных родов, происходящих при пониженном давлении.
- При кесаревом для женщин, страдающих гипотензией.

- Для насыщения органов хлоридами и витаминами.
Разрешено применение физраствора после родов в период лактации.
У раствора хлорида натрия при беременности есть и противопоказания. Его нельзя использовать беременной:
- С избыточной гипергидратацией.
- С сердечной недостаточностью.
- Во время лечения кортикостероидами.
- С патологиями циркуляции внутриклеточной жидкости.
- С диагностированной нехваткой калия с одновременным переизбытком натрия и хлора в организме.
При алкогольной интоксикации
При сильном отравлении этиловым спиртом человеку требуется квалифицированная медицинская помощь, в состав которой входят терапевтические мероприятия, а также капельницы с физраствором натрия хлорида.
Именно капельницы снимают симптоматику алкогольной абстиненции.
Другие препараты — как таблетки или суспензии обычно малоэффективны, так как по причине частой рвоты их сложно принять.
А лекарство, вливаемое в вену по капельнице попадает в кровь моментально и сразу начинает работать.
NaCl отлично совмещается со многими лекарствами.
Солевым раствором хлорида натрия можно развести одновременно несколько необходимых медпрепаратов: витамины, седативные, глюкозу и прочее.
При разведении обязательно нужно контролировать совместимость визуально, обращая внимание не появился ли осадок в процессе смешивания, не изменился ли цвет.
Терапия при тяжелой алкогольной интоксикации проводится следующим образом:
- Доктор осматривает больного, оценивая тяжесть его состояния.
- Измеряется давление, пульс, проводится ЭКГ.
- Доктор назначает препараты, которые должны быть добавлены в физраствор для введения.
- Капельницы используют в течение 3—4 суток.
Как вводится физраствор?
Изотонический раствор натрия хлорид можно вводить внутривенно и подкожно.
Для внутривенного введения капельница прогревается до 36-38 градусов.
Объем, который следует ввести зависит от количества потерянной организмом жидкости. Учитывается обязательно вес человека и его возраст:
- Средняя суточная доза – 500 мл, которую нужно вводить со скоростью 540 мл/ч. При сильной интоксикации объем вводимого лекарства в сутки может достигать 3000 мл.
- Объем 500 мл в экстренных случаях можно вводить со скоростью 70 капель в минуту.
Натрия хлорид используют с соблюдением принципов стерильности.
Чтобы в систему капельницы не попал воздух, система сначала наполняется раствором.
Нельзя поочередно стыковать контейнеры, так как воздух может попасть из первой упаковки.
Медикаменты можно добавлять во время инфузии или при помощи инъекции в конкретную область упаковки, предназначенную для этой процедуры.
В процессе введения натрия хлорид требуется контроль самочувствия больного, необходимо следить за его биологическими и клиническими показателями, уделять время оценке электролитов плазмы.
Побочные действия
Препарат хорошо переносится больными, однако при его избыточном вливании могут развиться следующие побочные эффекты:
- Ацидоз.
- Гипокалиемия.
- Гипергидратация.
Аналоги хлорида натрия
Производители могут выпускать раствор хлорида натрия под разными названиями.
В продаже можно найти следующие аналоги физраствора:
- Аква-риносоль – спрей.
- Аква-мастер — спрей для орошения.
- Назол – спрей.
- Буфус для инъекций.
- Ризосин для увлажнения слизистой носа.
- Салин для увлажнения носовых ходов.
Также производятся другие изотонические препараты, имеющие более физиологичный состав, чем физраствор.
Список растворов для капельниц, содержащих натрия хлорид в составе:
- Рингера.
- Рингера-Локка.
- Кребса-Рингера.
- Рингера-Тироде.
- Дисоль, Трисоль, Ацесоль, Хлосоль.

- Стерофундин изотонический.
Чем физраствор отличается от воды для инъекций и что лучше?
На сегодняшний день существует огромное количество заболеваний. Практически каждое лечится медикаментозно, но самое эффективное – это введение уколов, инъекций, либо капельниц. Но лекарства не вводят в организм в чистом виде, так как они представлены в порошковом виде и их обязательно нужно разбавлять физраствором или водой для инъекций. Необходимо разобраться в отличиях между этими аппаратами.
Физраствор и его характеристики
Когда вы решите приобрести этот препарат в аптеке, то увидите, что на упаковке не будет название физраствор, а написано
Поэтому многие называют его соляной раствор. Такой раствор даже разбавляют в домашних условиях, например, на 1 литр чистой прокипячённой воды добавляют 1 чайную ложку поваренной соли, хорошо размешивая до полного растворения. Но этот раствор используется для профилактики и лечения инфекционных заболеваний, промывка носа, горла, обработка ран, так как соль убивает разные виды бактерий.
Но этот раствор используется для профилактики и лечения инфекционных заболеваний, промывка носа, горла, обработка ран, так как соль убивает разные виды бактерий.
При серьезных заболеваниях, где происходит обезвоживание организма, например, после операции, инфекционных заболеваний, где главные симптомы: диарея, рвота, стерильная формула физиологического раствора вводится внутривенно при помощи капельницы
. Так как она помогает восстановиться организму после потери жидкости, так сказать позволяет организму «увлажниться».Применение воды для инъекций
Этот препарат относится к стерильному антибактериальному лекарственному средству. Состоит этот препарат из дистиллированной, тщательно очищенной воды. Он применяется для разведения или растворения лекарственных средств для внутривенного, внутримышечного или подкожного введения, согласно инструкции.
В чистом виде внутривенно этот препарат не вводят, так как это может привести к гемолизу, то есть разрушению эритроцитов, клетки крови, насыщающие наши легкие кислородом, а затем весь организм. При разбавлении медикамента, внимательно читайте инструкцию, так как данный растворитель может не подойти к некоторым видам лекарств.
При разбавлении медикамента, внимательно читайте инструкцию, так как данный растворитель может не подойти к некоторым видам лекарств.
Общие характеристики препаратов
Из вышесказанного, можно понять, что оба средства применяются для разбавления препаратов для инъекции
Чем же эти растворители отличаются друг от друга?
Самое главное отличие этих препаратов, это их состав. Физраствор в своём составе содержит растворённую соль, которая по концентрации соответствует плазме крови, а что касается воды для инъекций, то она представляет собой обычную дистиллированную воду.
При внутримышечном введении препарата, водный раствор вводится с более болезненными ощущениями. Когда речь идет не об инъекции, а об инфузии, то есть, человеку ставят капельницу и объем жидкости, что вводят в вену – большой, то в таком случае вода для инъекций не подходит и используют физиологический раствор. Поэтому вода для инъекций идет только в ампулах, а физраствор может идти и во флаконах.
Также физраствор используют в ингаляторах и в некоторых других лечебных и профилактических целях, чего нельзя сказать о его оппоненте. Самое главное отличие, и преимущество физраствора, его можно приготовить в домашних условиях, не для инъекций, конечно, но для промывания носа и рта, стерилизации отлично подходит.
Многие при выборе препарата для введения лекарства при помощи инъекции, все-таки выбирают физраствор, считая его более безопасным, к тому же он помогает организму в усвоении препарата. К тому же физраствор имеет противопоказания, в то время как вода для инъекций не имеет побочных свойств.
Определяемся с выбором
Изучив, состав и использование двух видов аппаратов, нужно определиться кому, когда и что подходит. Как выяснилось, физраствор имеет больше востребованности, так как его спектр функций шире. Этот препарат подходит и взрослым, и детям. Его применяют для лечения болезней:
- Бронхит.
- Воспаление легких.
- Бронхиальная астма.
- Бронхит и др.
Как упоминалось выше, это отличный антисептик, подходит для промывания рта, при зубных заболеваниях. Но у каждого препарата есть свои противопоказания. Людям, которые страдают от почечной недостаточности, гипернатриемия, проявляющаяся в постоянной жажде, нарушении водно-солевого баланса, то есть гипергидрация, нарушении кровообращения, нельзя применять физраствор. Но в любом случае лучше проконсультироваться с врачом.
Отлично подходит для промывания носа при вирусно-респираторных заболеваниях, но будьте осторожны в ведении, так как бывают случаи неправильного применения или количества, которое приводит к отиту. Эффективны инглаляции с физраствором, при помощи небулайзера, для которого тоже лучше купить препарат, чем делать самим. Физраствор не позволяет слизистой пересыхать, тем самым обеспечивает хорошую проходимость дыхательных путей, и не допускает осложнений. Обязательно, при применении изучите инструкцию, чтобы использовать правильную дозировку.
Имеется мнение, водный раствор, состоящий полностью из воды, лучше усваивается организмом. Но нужно учитывать рекомендации производителя, который знает, что и с чем лучше разбавлять. Его можно применять абсолютно всем, но только для разбавления инъекций.
Берегите свое здоровье, чтоб не сталкиваться с лечением, при помощи инъекций. Во всех случаях проконсультируйтесь с врачом, не занимайтесь самолечением.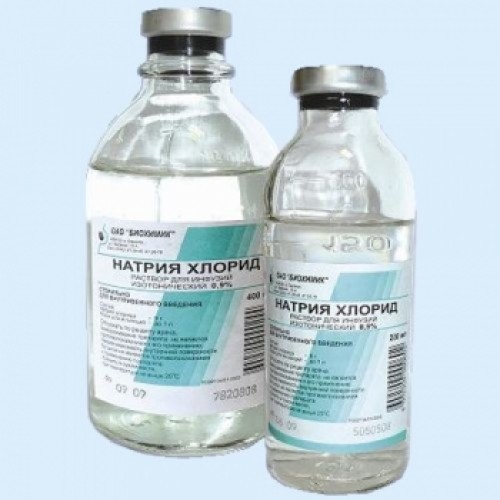 Обязательно читайте инструкции перед применением. А еще лучше, чтоб все-таки уколы вам вводили специалисты. Крепкого здоровья!
Обязательно читайте инструкции перед применением. А еще лучше, чтоб все-таки уколы вам вводили специалисты. Крепкого здоровья!
Хлорид натрия – это… Что такое Хлорид натрия?
| Хлорид натрия | |
| Общие | |
|---|---|
| Традиционные названия | обычная соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит [1] |
| Химическая формула | NaCl |
| Физические свойства | |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Термические свойства | |
| Температура плавления | 800,8 °C |
| Температура кипения | 1465 °C |
Молярная теплоёмкость (ст. усл.) усл.) | 50,8 Дж/(моль·К) |
| Удельная теплота испарения | 170,85 кДж/моль Дж/кг |
| Удельная теплота плавления | 28,68 кДж/моль Дж/кг |
| Химические свойства | |
| pKa | 6,7–7,3 |
| Растворимость в воде | 35,6 (0 °C) 35,9 (25 °C) 39,1 (100 °C) г/100 мл |
| Растворимость в метаноле | 14,9 г/100 мл |
| Растворимость в аммиаке | 21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,5442 (589 нм) |
| Структура | |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Классификация | |
Рег. номер CAS номер CAS | [7647-14-5] |
| Рег. номер PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | [Na+].[Cl-] |
| RTECS | VZ4725000 |
| Безопасность | |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 | |
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 10 15 тонн NaCl, то есть из каждой тысячи тонн морской воды можно получить в среднем 1,3 тонны хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, состоят из NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах теплых морей или на соляных озёрах, где на мелководье соленая вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решетку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г / см ³, а твёрдость по шкале Мооса — 2. Бесцветный, прозрачный минерал, со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и т. п.[4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (желтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д.[4]
Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д.[4]
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
При испарении морской воды при температуре 20 — 35 ° C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль с Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль с Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи
Залежи каменной соли найдены во всех геологических системах.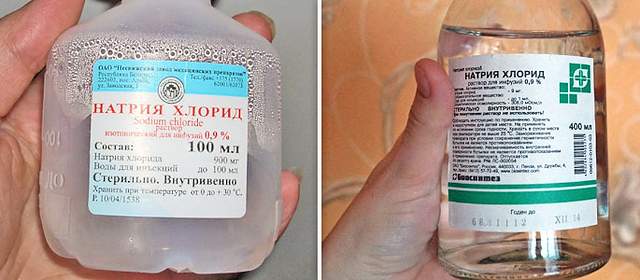 Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, о. Кулундинское, Эбейты и др. озера в Зап. Сибири.
Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, о. Кулундинское, Эбейты и др. озера в Зап. Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённую соль выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой желобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 новгородский князь Святослав определил налог на соляные варницы[6]:
| …на мори от чрена и от салгы по пузу… |
[7]
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
Добыча соли в южной части Мертвого моря, Израиль
Кристаллы каменной соли
Плантация морской соли в Дакаре
Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
Соль повареннаяВ пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % р-р) используют как вспомогательный осмотический диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
Гипертонические растворы (10 % р-р) используют как вспомогательный осмотический диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Наиболее распространены сульфоугли.
Регенерацию Nа-катионитовых фильтров осуществляют 6—8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
- CaR2 + 2NаСl = 2NаR + CaСl2.
- МgR2 + 2NаСl = 2NаR + МgСl2.
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl + 3 H2O → NaClO3 + 3 H2↑
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H +, образованных в результате электролитической диссоциации воды:
- H2O ⇆ H+ + OH−
- 2 H+ + 2 e− → H2↑
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl → Na+ + Cl−
- 2 Cl− − 2 e− → Cl2↑
- суммарная реакция:
- 2 NaCl + 2 H2O → 2 NaOH + Cl2↑ + H2↑
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор сжижается на жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na+ + e− → Na(Hg)
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2 Na(Hg) + 2 H2O → 2 NaOH + H2↑
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- 2 Na+ + 2 e− → 2 Na
- на аноде выделяется хлор (как побочный продукт):
- 2 Cl− − 2 e− → Cl2
- суммарная реакция:
- 2 Na+ + 2 Cl− → 2 Na + Cl2
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (800 ° C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления 580 ° C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (371 ° C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
- NaCl + H2SO4 → NaHSO4 + HCl↑
- NaCl + NaHSO4 → Na2SO4 + HCl↑
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идет почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления 800,8 С, кипения 1465 С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca 2 +, Mg 2 + и SO2−4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H 2 O можно выделить при температуре ниже +0,15 ° C[21].
Смесь измельченного льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород. С раствором нитрата серебра образует белый осадок хлорида серебра.
С раствором нитрата серебра образует белый осадок хлорида серебра.
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[22]:
- Na(тв) + 1/2Cl2(г) → NaCl(тв) + 410 кДж
- нейтрализация щелочи гидроксида натрия соляной кислотой[23]:
- NaОН + НCl → NaCl + Н2О
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы: NaCl → Na+ + Cl−, его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
Структура
Кристаллическая решётка хлорида натрия.Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, a = 0,563874 нм, d = 2,17 г/см³. Каждый из ионов Cl− окружен шестью ионами Na+ в октаедральний конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура с ионов Cl−, называемая гранецентрированной кубической решеткой. Ионы Na+ тоже образуют плотно упакованную кубическую решетку. Таким образом, кристалл состоит из двух подрешеток, сдвинутых друг относительно друга на полупериод. Такая же решетка характерна для многих других минералов.
Каждый из ионов Cl− окружен шестью ионами Na+ в октаедральний конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура с ионов Cl−, называемая гранецентрированной кубической решеткой. Ионы Na+ тоже образуют плотно упакованную кубическую решетку. Таким образом, кристалл состоит из двух подрешеток, сдвинутых друг относительно друга на полупериод. Такая же решетка характерна для многих других минералов.
В кристаллической решетке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов
См. также
Примечания
- ↑ Натрия хлорид на сайте Национального института стандартов и технологии (англ. National Institute of Standards and Technology) (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г.
 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218
688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218 - ↑ Пифагор. Золотой канон. Фигуры эзотерики. — М.: Изд-во Эксмо, 2003. — 448 с. (Антология мудрости).
- ↑ 1 2 3 4 Малая горная энциклопедия. В 3-х т. / Под ред. В. С. Белецкого . — Донецк: «Донбасс», 2004. — ISBN 966-7804-14-3
- ↑ УНИАН: Морская соль для красоты и здоровья кожи
- ↑ Российское законодательство Х-ХХ веков. Законодательство Древней Руси. т. 1. М, 1984. С. 224—225. (рус.)
- ↑ В переводе с поморской «говори» слово чрен (црен) означает четырёхугольный ящик, кованный из листового железа, а салга — котёл, в котором варили соль. Пузом в беломорских солеварнях называли мешок соли в два четверика, то есть, объёмом около 52 литров.
- ↑ Соль (PDF), Геологический обзор США на сайте Программы минеральных ресурсов (англ.)
- ↑ Энциклопедия здоровья
- ↑ Онлайн Энциклопедия кругосвет.
 Натрий
Натрий - ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 261
- ↑ Синтез хлората натрия (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 249
- ↑ 1 2 3 М. Л. Глинка Общая химия (Учебник), изд. 2-е изд., Перераб. и доп .. — С. 608, Киев: «Высшая школа», 1982.
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 254
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 231
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г.
 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219
688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219 - ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 250
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 257—258
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 215—216
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 234
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 255
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г.
 656 с.; 160 табл.; 391 рис. С. 191
656 с.; 160 табл.; 391 рис. С. 191
Ссылки
Что такое хлорид натрия и как он используется?
Что такое хлорид натрия?
Хлорид натрия (NaCl), также известный как соль, является важным соединением, используемым нашим организмом для:
- поглощения и транспортировки питательных веществ
- поддержания кровяного давления
- поддержания правильного баланса жидкости
- передачи нервных сигналов
- контракта и расслабить мышцы
Соль – неорганическое соединение, то есть не из живой материи. Он образуется, когда Na (натрий) и Cl (хлорид) объединяются в белые кристаллические кубики.
Вашему организму для функционирования необходима соль, но слишком мало или слишком много соли может нанести вред вашему здоровью.
Хотя соль часто используется для приготовления пищи, ее также можно найти в качестве ингредиента в пищевых продуктах или очищающих растворах. В медицинских случаях ваш врач или медсестра обычно вводят хлорид натрия в виде инъекции. Прочтите, чтобы узнать, почему и как соль играет важную роль в вашем организме.
Прочтите, чтобы узнать, почему и как соль играет важную роль в вашем организме.
Несмотря на то, что многие люди используют слова натрий и соль как синонимы, они разные.Натрий – это природный минерал и питательное вещество. Необработанные продукты, такие как свежие овощи, бобовые и фрукты, могут содержать натрий. Пищевая сода также содержит натрий.
Но от 75 до 90 процентов натрия, который мы получаем, поступает из соли, уже добавленной в наши продукты. Вес соли обычно представляет собой комбинацию 40 процентов натрия и 60 процентов хлорида.
Чаще всего соль используется в пищевых продуктах. Его применение включает:
- пищевая приправа
- действует как естественный консервант
- усиливает естественный цвет пищевых продуктов
- лечение или консервирование мяса
- создание рассола для маринования пищевых продуктов
Существует также множество домашних хозяйств. использование, например:
- очистка кастрюль и сковород
- предотвращение плесени
- удаление пятен и жира
- засолка дорог зимой для предотвращения обледенения
Когда ваш врач прописывает лечение солью, они будут использовать термин натрия хлорид. Хлорид натрия, смешанный с водой, образует солевой раствор, имеющий множество различных медицинских целей.
Хлорид натрия, смешанный с водой, образует солевой раствор, имеющий множество различных медицинских целей.
Медицинские применения солевого раствора включают:
Хотя соль и натрий разные, соль состоит на 40 процентов из натрия, и мы получаем большую часть нашего потребления натрия из соли. Многие компании и рестораны используют соль для консервирования, приправы и ароматизации еды. Поскольку одна чайная ложка соли содержит около 2300 миллиграммов (мг) натрия, дневную норму легко превысить.
По данным CDC, средний американец съедает более 3400 мг в день.Вы можете ограничить потребление натрия, употребляя необработанные продукты. Вам также может быть легче контролировать потребление натрия, готовя больше еды дома.
Американские диетические рекомендации рекомендуют американцам потреблять менее 2300 мг натрия в день.
Диета с низким содержанием натрия
Ваш врач может посоветовать придерживаться диеты с низким содержанием натрия, если у вас есть риск высокого кровяного давления или сердечных заболеваний. Если у вас сердечное заболевание, вам следует стараться потреблять менее 2000 мг натрия в день, хотя Американская кардиологическая ассоциация (AHA) рекомендует поддерживать его ниже 1500 мг.Исключение обработанных пищевых продуктов, таких как колбасы и готовые блюда, может облегчить поддержание этого количества.
Если у вас сердечное заболевание, вам следует стараться потреблять менее 2000 мг натрия в день, хотя Американская кардиологическая ассоциация (AHA) рекомендует поддерживать его ниже 1500 мг.Исключение обработанных пищевых продуктов, таких как колбасы и готовые блюда, может облегчить поддержание этого количества.
Десять замороженных блюд с низким содержанием натрия »
Всасывание и транспортировка питательных веществ
Натрий и хлорид играют важную роль в тонком кишечнике. Натрий помогает вашему организму усваивать:
- хлорид
- сахар
- вода
- аминокислот (строительные блоки белка)
Хлорид, когда он находится в форме соляной кислоты (водород и хлорид), также является компонентом желудочного сока. сок.Он помогает вашему организму переваривать и усваивать питательные вещества.
Сохранение энергии покоя
Натрий и калий – это электролиты в жидкости внутри и снаружи клеток. Баланс между этими частицами влияет на то, как ваши клетки поддерживают энергию вашего тела.
Это также то, как нервы посылают сигналы в мозг, сокращаются мышцы и функционирует сердце.
Поддержание артериального давления и гидратации
Ваши почки, мозг и надпочечники работают вместе, регулируя количество натрия в вашем организме.Химические сигналы стимулируют почки либо удерживать воду, чтобы она могла реабсорбироваться в кровоток, либо выводить излишки воды с мочой.
Когда в крови слишком много натрия, мозг дает почкам сигнал выпустить больше воды в кровообращение. Это приводит к увеличению объема крови и артериального давления. Уменьшение потребления натрия может привести к тому, что в кровоток попадет меньше воды. В результате снижается артериальное давление.
По большей части хлорид натрия не представляет опасности для здоровья, но в чрезмерных количествах он может вызвать раздражение:
Вы можете лечить раздражение, в зависимости от области, промывая пятно чистой водой или выходя на свежий воздух.Обратитесь за медицинской помощью, если раздражение не проходит.
Избыток соли
Хотя натрий необходим, он также присутствует в больших количествах почти во всем, что мы едим. Слишком большое количество соли связано с:
Побочные эффекты физиологических растворов
Физиологические растворы обычно вводятся внутривенно или через вену. Высокие концентрации солевых растворов могут вызывать побочные эффекты в виде покраснения или отека в месте инъекции.
Слишком мало натрия
Дефицит натрия обычно является признаком основного заболевания.Название этого состояния – гипонатриемия. Это может быть связано с:
Чрезмерное и постоянное потоотделение без надлежащей гидратации также является потенциальной причиной, особенно у людей, которые тренируются и участвуют в длительных соревнованиях на выносливость, таких как марафоны и триатлоны.
Примерно от 75 до 90 процентов нашего потребления натрия приходится на соль или хлорид натрия. Соль содержит важный минерал (натрий), который наш организм использует для таких функций, как поддержание кровяного давления и усвоение питательных веществ. Вы также можете использовать соль для приправы пищи, очистки предметов домашнего обихода и решения определенных медицинских проблем.
Вы также можете использовать соль для приправы пищи, очистки предметов домашнего обихода и решения определенных медицинских проблем.
Американские диетические рекомендации рекомендуют употреблять менее 2300 мг натрия в день. Вы можете сделать это, употребляя меньше обработанных продуктов, таких как мясное ассорти и расфасованные продукты, а также готовя еду дома.
Какие продукты имеют наименьшее количество натрия? »
Слишком большое количество соли может привести к серьезным проблемам со здоровьем, таким как высокое кровяное давление, болезни сердца и почек. Снижение потребления соли при одновременном увеличении количества получаемого калия может помочь снизить риск этих состояний.
Проконсультируйтесь с врачом, прежде чем добавлять в свой рацион больше хлорида натрия. Большинство людей превышают рекомендуемое количество, но люди, которые пьют слишком много воды, страдают стойкой диареей или участвуют в длительных соревнованиях на выносливость, могут иметь дефицит натрия. В этих случаях может помочь хорошая гидратация полости рта. В более тяжелых случаях медицинскому работнику может потребоваться введение физиологического раствора для внутривенного введения для восстановления гидратации и электролитов.
В этих случаях может помочь хорошая гидратация полости рта. В более тяжелых случаях медицинскому работнику может потребоваться введение физиологического раствора для внутривенного введения для восстановления гидратации и электролитов.
Вс. Физиологический раствор, использование, содержание, эффекты
Раствор Рингера с лактатом, или LR, представляет собой жидкость для внутривенного введения, которую вы можете получать при обезвоживании, хирургическом вмешательстве или приеме лекарств для внутривенного введения.Его также иногда называют лактатом Рингера или раствором лактата натрия.
Есть несколько причин, по которым вы можете получить эту жидкость для внутривенного вливания, если вам потребуется медицинская помощь.
Хотя физиологический раствор и раствор Рингера с лактатом имеют некоторые сходства, они также имеют различия. Это может сделать использование одного более подходящим, чем другой, в зависимости от ситуации.
Что у них общего
Физиологический раствор и раствор Рингера с лактатом – это две жидкости для внутривенного введения, обычно используемые в больницах и медицинских учреждениях.
Обе изотонические жидкости. Изотоничность означает, что жидкости имеют такое же осмотическое давление, что и кровь. Осмотическое давление – это измерение баланса растворенных веществ (таких как натрий, кальций и хлорид) и растворителей (например, воды).
Изотоничность также означает, что при внутривенном введении раствора Рингера с лактатом клетки не уменьшаются или не увеличиваются в размерах. Вместо этого раствор увеличит объем жидкости в вашем теле.
Чем они отличаются
Производители жидкостей добавляют немного другие компоненты в физиологический раствор по сравнению с лактатом Рингера.Различия в частицах означают, что лактат Рингера не сохраняется в организме так долго, как физиологический раствор. Это может помочь избежать перегрузки жидкостью.
Кроме того, лактат Рингера содержит добавку лактата натрия. Организм метаболизирует этот компонент до так называемого бикарбоната. Это «основа», которая помогает снизить кислотность организма.
По этой причине некоторые врачи используют лактат Рингера при лечении таких заболеваний, как сепсис, при котором организм становится очень кислым.
Некоторые исследования показывают, что лактат Рингера может быть предпочтительнее нормального физиологического раствора для восполнения потери жидкости у пациентов с травмами.
Кроме того, физиологический раствор имеет более высокое содержание хлоридов. Иногда это может вызвать сужение сосудов почек, что влияет на приток крови к почкам. Этот эффект обычно не вызывает беспокойства, если человек не получает большое количество физиологического раствора.
Lactated Ringer’s плохо смешивается с некоторыми растворами для внутривенного вливания. Вместо этого в аптеках смешивают физиологический раствор со следующими растворами для внутривенного введения:
- метилпреднизон
- нитроглицерин
- нитропруссид
- норэпинефрин
- пропанолол
Поскольку лактат Рингера содержит кальций, некоторые врачи не рекомендуют использовать его. переливание крови.Дополнительный кальций может связываться с консервантами, добавляемыми в кровь банками крови для хранения. Это потенциально увеличивает риск образования тромбов.
Это потенциально увеличивает риск образования тромбов.
Кстати, раствор Рингера с лактатом также немного отличается от того, что называют просто раствором Рингера. Раствор Рингера обычно содержит бикарбонат натрия вместо лактата натрия. Иногда раствор Рингера также содержит больше глюкозы (сахара), чем раствор Рингера с лактацией.
Раствор Рингера с лактатом содержит много тех же электролитов, что и кровь.
Согласно B. Braun Medical, одной из компаний, производящих препараты Рингера с лактацией, каждые 100 миллилитров их раствора содержат следующее:
- хлорид кальция: 0,02 грамма
- хлорид калия: 0,03 грамма
- хлорид натрия: 0,6 грамма
- лактат натрия: 0,31 грамма
- вода
Эти компоненты могут незначительно отличаться в зависимости от производителя.
Раствор Рингера с лактатом могут принимать и взрослые, и дети.Некоторые из причин, по которым человек может получить этот раствор для внутривенного введения, включают:
- для лечения обезвоживания
- для облегчения потока лекарств для внутривенного введения во время операции
- для восстановления баланса жидкости после значительной кровопотери или ожогов
- для сохранения вены открытый катетер для внутривенных вливаний
Раствор Рингера с лактатом часто является выбором для внутривенного введения, если у вас сепсис или инфекция, настолько серьезная, что кислотно-щелочной баланс вашего тела нарушен.
Врачи могут также использовать лактат Рингера в качестве ирригационного раствора.Раствор стерилен (при правильном хранении в нем нет бактерий). Поэтому его можно использовать для промывания раны.
Его также можно использовать во время операции для промывания мочевого пузыря или операционного поля. Это помогает смыть бактерии или сделать место операции более заметным.
Производители не рекомендуют людям пить раствор Рингера с лактатом. Он предназначен только для орошения или внутривенного введения.
Вы получаете раствор Рингера с лактатом внутривенно. Когда раствор попадает в вену, он попадает как внутрь клеток, так и наружу.В идеале раствор помогает поддерживать или достигать жидкостного баланса в вашем теле.
Давление слишком большого количества жидкости Рингера с лактатом может вызвать отек и опухоль. У некоторых людей есть заболевания, из-за которых их организм не может хорошо переносить лишнюю жидкость. Эти условия включают:
Если люди с этими заболеваниями получают лактацию Рингера (или любую другую жидкость для внутривенного вливания), медицинский работник должен внимательно следить за ними, чтобы убедиться, что они не получают слишком много жидкости.
Помимо перегрузки жидкостью, слишком большое количество раствора Рингера с лактатом может повлиять на уровень электролитов.Это включает натрий и калий. Поскольку в лактатом Рингера натрия меньше, чем в крови, уровень натрия может стать слишком низким, если вы потребляете слишком много.
Некоторые растворы для звонков с лактатом содержат декстрозу, один из видов глюкозы. Аллергические реакции могут возникнуть у людей, страдающих аллергией на кукурузу.
Доза для кормления грудью Рингера зависит от обстоятельств. Врач учтет такие факторы, как ваш возраст, ваш вес, общее состояние вашего здоровья и уровень гидратации.
Иногда врач может назначить внутривенное введение жидкости по ставке «KVO». Это означает «держать вену открытой» и обычно составляет около 30 миллилитров в час. Если вы сильно обезвожены, врач может назначить вливание жидкости с очень высокой скоростью, например 1000 миллилитров (1 литр).
Если вам нужно сделать капельницу, вы можете увидеть, что на сумке для капельницы написано «Лактат Рингера». Это проверенный временем вариант восполнения жидкости, который обычно назначают врачи. Если вы его получите, вас будут контролировать, чтобы убедиться, что вы не получили слишком много через капельницу.
Это проверенный временем вариант восполнения жидкости, который обычно назначают врачи. Если вы его получите, вас будут контролировать, чтобы убедиться, что вы не получили слишком много через капельницу.
НАТРИЯ ХЛОРИД | CAMEO Chemicals
Химический лист данных
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названияХимические идентификаторы
В Поля химического идентификатора включать общие идентификационные номера, NFPA алмаз Знаки опасности Министерства транспорта США и общие описание химического вещества. Информация в CAMEO Chemicals поступает из множества источники данных.| Номер CAS | Номер ООН / NA | Знак опасности DOT | USCG CHRIS Код |
|---|---|---|---|
| никто | данные недоступны | никто | |
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| никто | никто | ||
NFPA 704
данные недоступны
Общее описание
ФИЗИЧЕСКОЕ ОПИСАНИЕ: белое кристаллическое твердое вещество. Товарный сорт обычно содержит хлориды кальция и магния, которые впитывают влагу и вызывают спекание. (NTP, 1992)
Товарный сорт обычно содержит хлориды кальция и магния, которые впитывают влагу и вызывают спекание. (NTP, 1992)
Опасности
Оповещения о реактивности
никто
Реакции воздуха и воды
Вода.
Пожарная опасность
Литературные источники указывают, что это соединение негорючее. (NTP, 1992)
Опасность для здоровья
СИМПТОМЫ: Проглатывание этого соединения может вызвать тошноту, рвоту, диарею, мышечные подергивания, воспаление желудочно-кишечного тракта, обезвоживание и застойные явления (обезвоживание и застойные явления могут возникнуть в большинстве внутренних органов, особенно в мозговых оболочках и головном мозге).Смерть может наступить в результате дыхательной недостаточности, вызванной острой энцефалопатией.ОСТРАЯ / ХРОНИЧЕСКАЯ ОПАСНОСТЬ: Это соединение может вызывать раздражение глаз. При нагревании до разложения выделяет токсичные пары. (NTP, 1992)
Профиль реактивности
ХЛОРИД НАТРИЯ обычно не реагирует. При смешивании с концентрированной нелетучей кислотой, такой как серная кислота, выделяет газообразный хлористый водород.
При смешивании с концентрированной нелетучей кислотой, такой как серная кислота, выделяет газообразный хлористый водород.
Принадлежит к следующей реактивной группе (группам)
Потенциально несовместимые абсорбенты
Информация отсутствует.
Ответные рекомендации
В Поля рекомендаций ответа включать расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, противопожарное реагирование, защитная одежда и первая помощь. В информация в CAMEO Chemicals поступает из различных источники данных.Изоляция и эвакуация
Нет доступной информации.
Пожарная
Пожары, связанные с этим химическим веществом, можно контролировать с помощью сухих химикатов, двуокиси углерода, пены или галоновых огнетушителей.(NTP, 1992)
Без огня
НЕБОЛЬШИЕ РАЗЛИВЫ И УТЕЧКА: Если вы пролили это химическое вещество, вам следует смочить твердый разлившийся материал водой, а затем переложить увлажненный материал в подходящий контейнер. Используйте впитывающую бумагу, смоченную водой, чтобы собрать оставшийся материал. Поместите загрязненную одежду и впитывающую бумагу в паронепроницаемый полиэтиленовый пакет для последующей утилизации. Вымойте все загрязненные поверхности сильным мыльным раствором. Не входите в зараженную зону до тех пор, пока специалист по безопасности (или другое ответственное лицо) не убедится, что зона была должным образом очищена.
Используйте впитывающую бумагу, смоченную водой, чтобы собрать оставшийся материал. Поместите загрязненную одежду и впитывающую бумагу в паронепроницаемый полиэтиленовый пакет для последующей утилизации. Вымойте все загрязненные поверхности сильным мыльным раствором. Не входите в зараженную зону до тех пор, пока специалист по безопасности (или другое ответственное лицо) не убедится, что зона была должным образом очищена.МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ ХРАНЕНИИ: Храните этот материал в холодильнике. (NTP, 1992)
Защитная одежда
РЕКОМЕНДУЕМЫЙ РЕСПИРАТОР: При взвешивании и разбавлении чистого исследуемого химического вещества наденьте одобренный NIOSH респиратор для лица, оснащенный картриджем для органических паров / кислотных газов (специально для органических паров, HCl, кислых газов и SO2) с фильтром для пыли / тумана. (NTP, 1992)
Ткани для костюмов DuPont Tychem®
Легенда ткани Tychem®
Детали тестирования
Данные о проницаемости ткани были получены для DuPont независимыми
испытательные лаборатории с использованием ASTM F739, EN369, EN 374-3, EN ISO 6529
(методы A и B) или методы испытаний ASTM D6978.Нормализованное время прорыва
(время, при котором скорость проникновения равна 0,1 мкг / см2 / мин)
сообщается в минутах.
Все жидкие химикаты прошли испытания при температуре примерно от 20 ° C до
27 ° C, если не указано иное.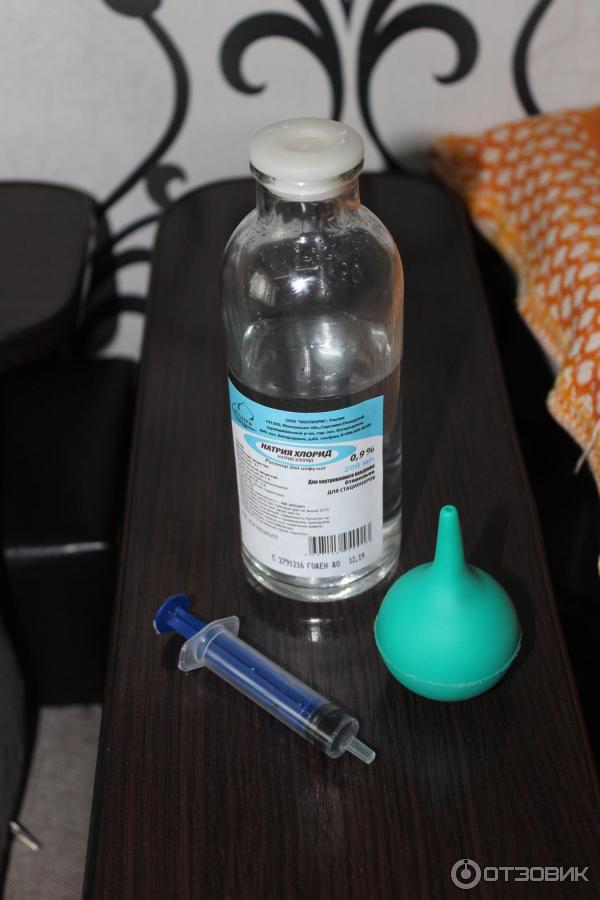 Другая температура может существенно повлиять на
время прорыва; скорость проникновения обычно увеличивается с
температура.
Все химические вещества имеют
были протестированы при концентрации более 95%, если не указано иное
заявил.Если не указано иное, проницаемость измерялась для отдельных химикатов.
Характеристики проницаемости смесей могут значительно отличаться.
от проницаемости отдельных химических веществ.
Боевые отравляющие вещества (люизит, зарин, зоман, сера
Горчица, табун и нервно-паралитический агент VX) были протестированы при 22 ° C и 50%
относительная влажность в соответствии с военным стандартом MIL-STD-282.
Другая температура может существенно повлиять на
время прорыва; скорость проникновения обычно увеличивается с
температура.
Все химические вещества имеют
были протестированы при концентрации более 95%, если не указано иное
заявил.Если не указано иное, проницаемость измерялась для отдельных химикатов.
Характеристики проницаемости смесей могут значительно отличаться.
от проницаемости отдельных химических веществ.
Боевые отравляющие вещества (люизит, зарин, зоман, сера
Горчица, табун и нервно-паралитический агент VX) были протестированы при 22 ° C и 50%
относительная влажность в соответствии с военным стандартом MIL-STD-282.
| Химическая промышленность | Номер CAS | Государство | QS | QC | SL | C3 | TF | TP | BR | RC | ТК | РФ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Хлорид натрия (9 г / л) | 7647-14-5 | Жидкость |


 Это состояние может быть вызвано токсической диспепсией, диареей, сильной или долго не прекращающейся рвотой, холерой, сильной экссудацией при обширном ожоговом поражении кожных покровов, гипохлоремией и гипонатриемией с обезвоживанием. Такая концентрация раствора соли используется при кишечной непроходимости как дезинтоксикационное средство; им промывают раны, глаза, полость носа. Также такой раствор используют для приготовления различных лекарственных веществ или увлажнения перевязочного материала;
Это состояние может быть вызвано токсической диспепсией, диареей, сильной или долго не прекращающейся рвотой, холерой, сильной экссудацией при обширном ожоговом поражении кожных покровов, гипохлоремией и гипонатриемией с обезвоживанием. Такая концентрация раствора соли используется при кишечной непроходимости как дезинтоксикационное средство; им промывают раны, глаза, полость носа. Также такой раствор используют для приготовления различных лекарственных веществ или увлажнения перевязочного материала;





 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218
688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218 Натрий
Натрий 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219
688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219 656 с.; 160 табл.; 391 рис. С. 191
656 с.; 160 табл.; 391 рис. С. 191