ЧТО СЛЕДУЕТ ЗНАТЬ О ПЕРЕСАДКЕ КОСТНОГО МОЗГА
В народе когда говорят «пересадка костного мозга», подразумевают пересадку стволовых клеток. В этом смысле костный мозг понимается как источник стволовых клеток. У взрослых источником стволовых клеток может выступать кровь. Также стволовые клетки извлекаются из пуповинной крови.
Профессор клиники Аджибадем Адана, детский гематолог-онколог Бюлент Антмен ответил на вопросы, касающиеся пересадки костного мозга.
При каких заболеваниях требуется пересадка костного мозга?– Первую группу составляют заболевания крови. На первом месте стоит лейкемия. При лейкемии, которая не поддается лечению, или рецидивирующей лейкемии, особенно при таких заболеваниях, как острый лимфобластный лейкоз, острый миелоидный лейкоз и хронический миелоидный лейкоз трансплантация костного мозга имеет важное значение. Хотя при диагнозе «острый лимфобластный лейкоз» пересадка может быть первым методом лечения.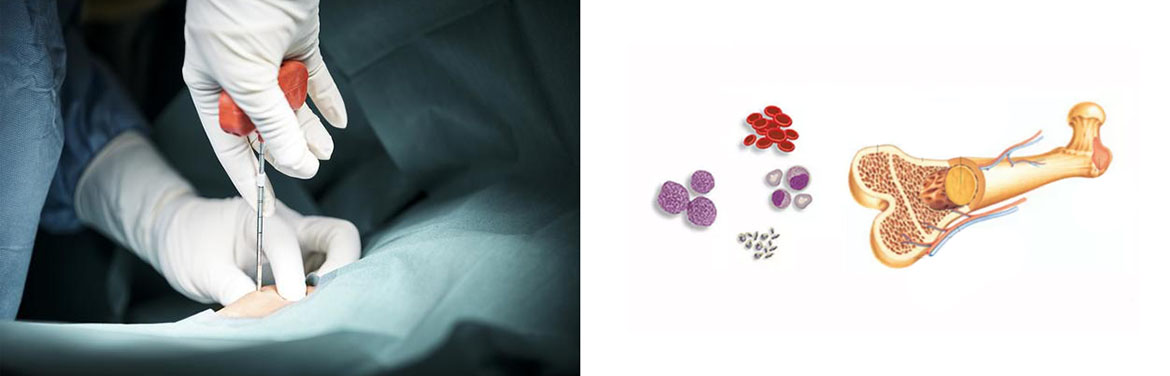
Следом за болезнями крови идут онкологические заболевания. Наблюдаемая у детей неходжкинская лимфома возглавляет этот перечень, следом идут болезни, не поддающиеся лечению другим образом или рецидивирующие, лимфома Ходжкина в случае рецидива. Для пациентов с такими диагнозами трансплантация костного мозга является единственным шансом на спасение.
Кто может быть донором костного мозга?– В донорстве костного мозга может использоваться пуповинная кровь, сохранившаяся в плаценте и пупочной вене после рождения ребенка.
Второй источник донорства – братья и сестры пациента, прочие родственники или неродственники. Это так называемая аллогенная трансплантация стволовых клеток, которая может быть как родственной, когда донором выступает кровный родственник пациента, чаще брат или сестра, так и не родственной, когда совместимый донор подбирается по соответствующим параметрам. При лечении некоторых заболеваний костного мозга используются клетки самого пациента. Этот метод лечения называется аутогенная трансплантацией. Хотя и не часто, но встречается и сингенная трансплантация – разновидность аллогенной трансплантации, при которой стволовые клетки пересаживаются от одного однояйцевого близнеца другому, поскольку их генетический материал идентичен. В Турции процент совместимости при пересадке костного мозга от родных братьев/сестер составляет 25 %, за рубежом этот показатель около 18-20 %. В Турции цифры несколько выше в связи с тем, что в стране высок уровень родственных браков.
– Вокруг трансплантации костного мозга существует много заблуждений относительно вреда для донора.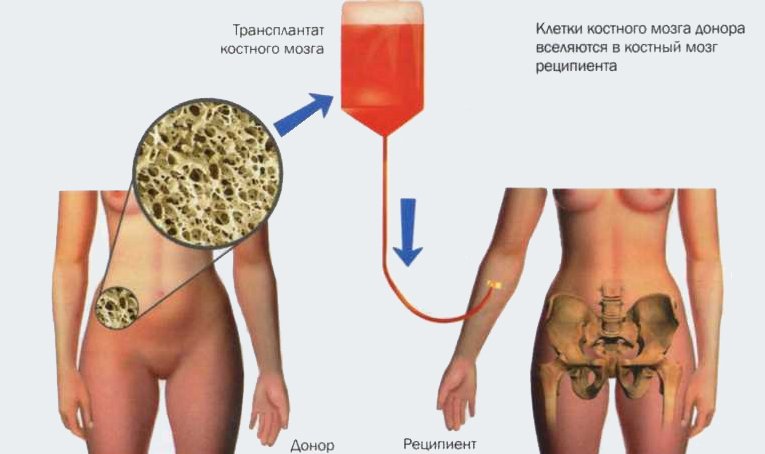 Также как и при пересадке печени или почек, подобная ошибочная информация приводит к тому, что люди не хотят выступать донорами. Однако процедура трансплантации не несет в себе никакого вреда. Тем не менее, дети возрастом до 2 лет и те, кто старше 60 лет, не рассматриваются в качестве донора костного мозга. Перед забором стволовых клеток проводятся анализы крови, при которых изучаются ее показатели. Для оценки общего состояния пациента, проводятся медицинские обследования, в ходе которых исследуется печень, почки и кровь.
Также как и при пересадке печени или почек, подобная ошибочная информация приводит к тому, что люди не хотят выступать донорами. Однако процедура трансплантации не несет в себе никакого вреда. Тем не менее, дети возрастом до 2 лет и те, кто старше 60 лет, не рассматриваются в качестве донора костного мозга. Перед забором стволовых клеток проводятся анализы крови, при которых изучаются ее показатели. Для оценки общего состояния пациента, проводятся медицинские обследования, в ходе которых исследуется печень, почки и кровь.
Аллогенная трансплантация проводится в операционной. Забор стволовых клеток осуществляется с помощью специальной иглы, которая вводится непосредственно в тазовую кость, где располагается основной резервуар костного мозга. Затем контейнер содержащей стволовые клетки доставляется в лабораторию для отбора стволовых клеток. Отбор стволовых клеток проводится на аппарате афереза. После этого оценивается количество живых клеток, на основании чего определяется, подходит ли отобранное количество для рецепиента. Если количество достаточное, то начинается подготовка к трансплантации. Количество костного мозга после забора у донора восстонавляется в течении 2-х недель.
Если количество достаточное, то начинается подготовка к трансплантации. Количество костного мозга после забора у донора восстонавляется в течении 2-х недель.
– Рецепиент также должен пройти подготовку к трансплантации. Как и во время подготовки почвы к выращиванию полезных культур выпалываются все сорняки, так же и перед пересадкой новых стволовых клеток, клетки собственного костного мозга пациента полностью разрушаются при помощи химиотерапии и лучевой терапией. Таким образом, освобождается место для новых клеток. Кроме того, во время подготовки Стволовые клетки, что были ранее взяты у донора, подаются по катетеру прямо в систему сердечно-сосудистого кровообращения. Запрограммированные природой клетки донора распределяются в костном мозге пациента и подобно семенам в плодородной почве, начинают образовывать новые дееспособные кровяные клетки.
Стволовые клетки, что были ранее взяты у донора, подаются по катетеру прямо в систему сердечно-сосудистого кровообращения. Запрограммированные природой клетки донора распределяются в костном мозге пациента и подобно семенам в плодородной почве, начинают образовывать новые дееспособные кровяные клетки.
– В случае если у пациента онкологическое заболевание крови, для подавления деффектных клеток больному проводят курс лечения ХТ благодоря, которой разрушаются не только раковые клетки пациента, но и здоровые клетки костного мозга. Только после такого рода лечения, становиться возможным пересадка здорового донорского костного мозга. После начинается период иммунносупрессивной терапии, направленная на подавление иммунной системы пациента, которая может считать пересаженные клетки чужеродными.
Однако, это делает человека беззащитным перед инфекциями из внешнего мира. Поэтому основные усилия направлены на то, чтобы пациент ничем не заразился.
На 14-й дней после трансплантации определяется, воспроизводятся пересаженные клетки или нет. Однако, до достижения определенного количества клеток крови в течение 30-40 дней пациент содержится в стерильной среде. Если количество клеток увеличилось, то процедура трансплантации считается успешной. За этот период происходит увеличение числа кровяных клеток, вырабатываются эритроциты, лейкоциты и тромбоциты, а также если никакой инфекции не обнаружено, пациент может использовать общую среду с другими пациентами в больнице и переводится из бокса в отделение. Пациент находиться в клинике в течение 45-60 дней. После лечения, если состояние пациента удовлетворительное, больной выписывается. Следует так же отметить, что в течении года после выписки, пациенту необходимо находиться под потоянным контролем врача для обеспечения защиты от инфекций и контроля его восстановления.
История 16 летней девочки из Аданы Х.Ф. с диагнозом лейкемия, которая выздоровела благодаря пересадке костного мозга от старшего брата.
с диагнозом лейкемия, которая выздоровела благодаря пересадке костного мозга от старшего брата.
Проф.Док. Бюлент Антмен знает эту пациентку в течение четырех лет. Отец на пенсии, мать домохозяйка, в семье 9 детей, Х.Ф. родилась шестой. Рассказывая о том, как началась ее болезнь, она говорит следующее: «В то время я училась в шестом классе. Был экзамен. У меня кружилась голова, тошнило. Я не смогла ответить на вопросы, хотела все выбросить из головы и уйти домой. Ушла из школы, с трудом добралась до дома. В аптеке купили лекарство от тошноты. Не помогало, пошли в больницу, оттуда отправили на обследование в Медицинский факультет университета Acibadem. Лечащим врачом стал доктор Бюлент Антмен…»
Поставили диагноз, начали лечение и, казалось, победили болезнь. Через определенные промежутки Х.Ф. сдавала анализ на общий объем костного мозга. В один из дней поступил звонок из больницы «Приходите, сделаем еще один тест», начался новый период лечения. Ее болезнь рецидивировала. Поэтому было принято решение о пересадке костного мозга.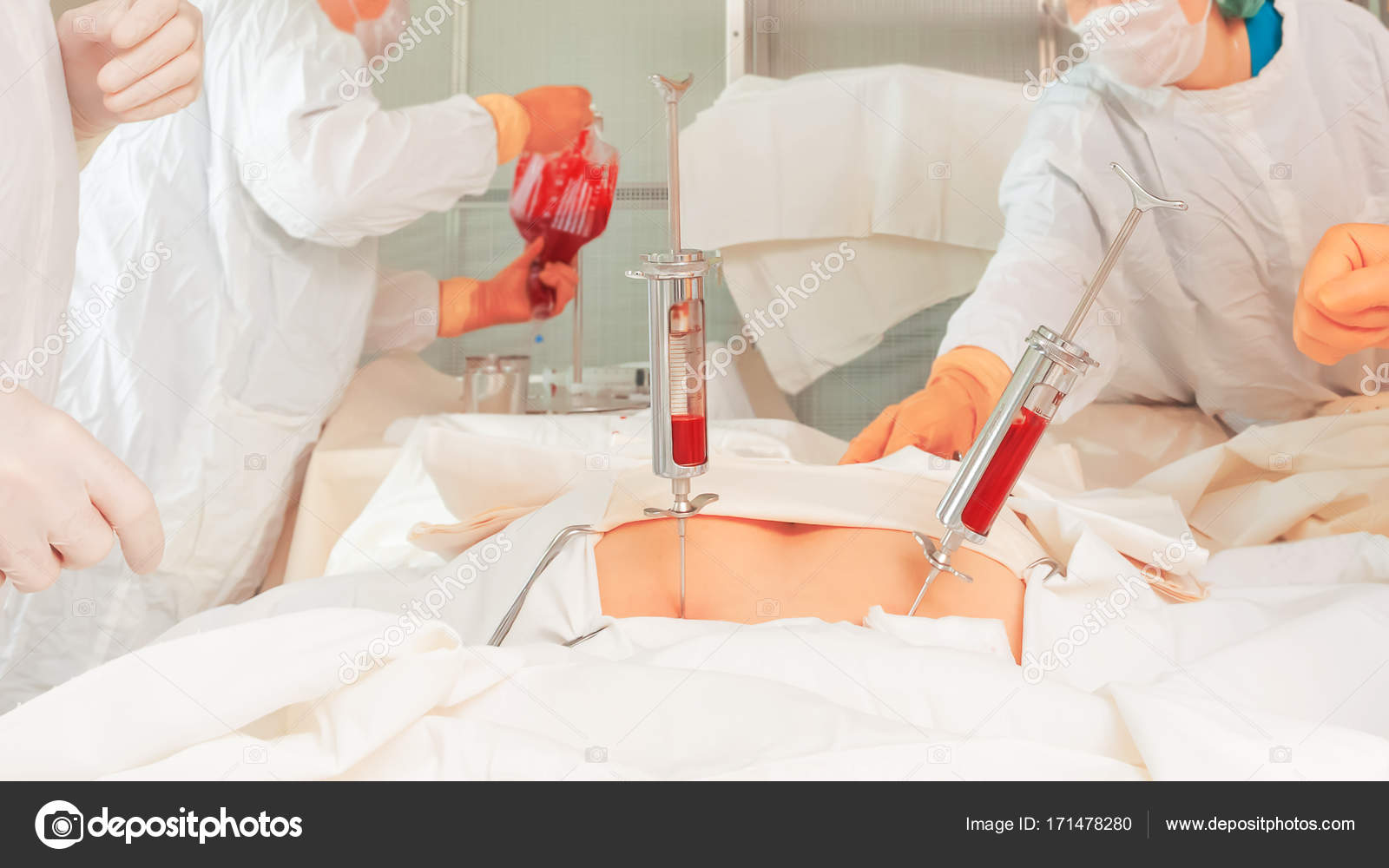
Доктор принял решение для первой попытки пересадки взять клетки у старшего брата, если будет отторжение, тогда у сестры. Первая попытка оказалась успешной.
Х.Ф. безостановочно рассказывает о своих планах после выздоровления: «Хочу пойти в школу. Поступлю в лицей. Я вижу своих друзей и волей-неволей расстраиваюсь. Вначале переживала из-за волос, но теперь не думаю об этом, как бы то ни было заново отрастут. Эта болезнь меня многому научила. Вместо того, чтобы жаловаться, пытаюсь смотреть на ситуацию с хорошей стороны. Хочу выучиться и получить профессию».
Трансплантация гемопоэтических клеток при лечении детей с онкологическими заболеваниями
Реакция «трансплантат против хозяина» (РТПХ) — это частое осложнение трансплантации с использованием донорских клеток. У 20–50% пациентов, которым выполняется трансплантация донорских клеток, развивается реакция «трансплантат против хозяина». РТПХ не возникает у пациентов, которым проводится трансплантация собственных клеток. РТПХ — это осложнение, которое может возникать после аллогенной трансплантации (от родственного или неродственного донора). Она развивается, когда лейкоциты донора распознают организм пациента как чужеродный. Эти лейкоциты атакуют ткани пациента так, как если бы они боролись с инфекцией.
У 20–50% пациентов, которым выполняется трансплантация донорских клеток, развивается реакция «трансплантат против хозяина». РТПХ не возникает у пациентов, которым проводится трансплантация собственных клеток. РТПХ — это осложнение, которое может возникать после аллогенной трансплантации (от родственного или неродственного донора). Она развивается, когда лейкоциты донора распознают организм пациента как чужеродный. Эти лейкоциты атакуют ткани пациента так, как если бы они боролись с инфекцией.
В большинстве случаев эта реакция имеет легкую или умеренную степень тяжести и со временем пропадает. Однако РТПХ может протекать тяжело и даже угрожать жизни.
РТПХ легче предотвратить, чем лечить. Меры профилактики, как правило, заключаются в назначении после трансплантации препаратов, которые снижают иммунную реакцию, таких как циклоспорин, такролимус, метотрексат, микофенолата мофетил или стероиды. Также перед введением донорских клеток из них могут извлекаться некоторые Т-лимфоциты.
Существует два типа РТПХ.
Острая
РТПХ классифицируется как острая, если она развивается в течение первых 100 дней после трансплантации. Заболевание, как правило, поражает печень, желудочно-кишечный тракт и кожу. К симптомам острой РТПХ относятся сыпь, диарея и пожелтение кожи и глаз вследствие повышенного уровня билирубина.
Хроническая
Хроническая РТПХ, как правило, развивается примерно спустя три месяца после трансплантации, хотя в некоторых случаях она может не проявляться в течение года или более. Она возникает у 10–40% пациентов.
Симптомы более разнообразны, чем при острой РТПХ, и напоминают некоторые аутоиммунные заболевания. Хроническая РТПХ может быть легкой, умеренной или тяжелой.
Симптомы включают:
- Сыпь и зуд
- Шелушение кожи
- Отторжение участков кожи
- Потемнение кожи
- Уплотнение кожи
- Образование рубцов, которые могут ограничивать движение соседних суставов, например на пальцах
- Выпадение волос
- Сухость и язвы во рту и пищеводе
- Сухость и покраснение глаз
- Сухость влагалища и других поверхностей
- Иссыхание и рубцевание легких
- Поражение или недостаточность печени
- Желтуху
Городская клиническая больница №31 – Пациентам в помощь.
 Гематологические заболевания. Часть VIII. Методы лечения (страница 5)
Гематологические заболевания. Часть VIII. Методы лечения (страница 5)Страница 5 из 5
Аутологичная трансплантация костного мозга
Метод также называют аутотрансплантацией стволовых клеток крови, высокодозной химиотерапией с поддержкой собственными столовыми клетками.
Химиотерапия – лечение препаратами, угнетающими рост опухолевых клеток. При этом очевидно, что чем выше доза препарата, тем лучше эффект, но и риск осложнений тоже значительно выше, т.к. под воздействие химиопрепарата попадают и нормальные клетки. Помимо противоопухолевого эффекта развивается снижение иммунитета, а это риск развития инфекционных осложнений. Решение этой проблемы особенно важно для пациентов с миеломной болезнью и рецидивами лимфом, где за счет повышения дозы лекарства можно вылечить пациента.
Но как сохранить иммунитет?
Ученые знают, что на иммунитет работают много групп клеток, у которых только один предшественник – материнская клетка, или стволовая клетка крови. Стволовые клетки в большинстве своем находятся внутри костей вместе с другими клетками костного мозга. Они живут там как в доме, где их защищают, питают и ухаживают за ними. Немного стволовых клеток циркулируют в крови.
Стволовые клетки в большинстве своем находятся внутри костей вместе с другими клетками костного мозга. Они живут там как в доме, где их защищают, питают и ухаживают за ними. Немного стволовых клеток циркулируют в крови.
Ученые быстро поняли, что бесполезно переносить в организм отдельные группы иммунных клеток, потому что их некому будет заменить, когда они проживут и проработают свой срок. А вот если ввести в организм стволовые клетки, то это даст возможность иммунитету быстрее прийти в норму и, следовательно, позволит уменьшить число инфекционных осложнений химиотерапии.
Нашли решение в конце 60-х годов, когда научились забирать и хранить стволовые клетки.
Как это делалось и делается? Расскажем об этом в самом общем виде.
Поначалу клетки забирали только напрямую из костного мозга под общим наркозом, делая несколько проколов в подвздошных костях на границе ягодицы и поясницы, отступив от позвоночника в сторону 10-15 см. В этом месте кость очень толстая, отсутствуют крупные нервные волокна, поэтому риск осложнений практически отсутствует. Сама процедура занимает около часа. После нее в течение нескольких дней пациента немного беспокоят умеренные боли, но они позволяют ему жить обычной жизнью. Позже научились брать клетки из крови, когда пациенту ставят в вену гибкую иглу (катетер), подключают специальный аппарат и в течение трех-четырех часов особый прибор «фильтрует» кровь, забирая и тут же возвращая ее. Пациент в это время чувствует себя нормально и может, например, смотреть телевизор, говорить по телефону. Правда, аппарат довольно громоздкий, поэтому трудно, к примеру, дойти до туалета. Процедура безопасна, а взятые из крови стволовые клетки быстро восстанавливаются.
Сама процедура занимает около часа. После нее в течение нескольких дней пациента немного беспокоят умеренные боли, но они позволяют ему жить обычной жизнью. Позже научились брать клетки из крови, когда пациенту ставят в вену гибкую иглу (катетер), подключают специальный аппарат и в течение трех-четырех часов особый прибор «фильтрует» кровь, забирая и тут же возвращая ее. Пациент в это время чувствует себя нормально и может, например, смотреть телевизор, говорить по телефону. Правда, аппарат довольно громоздкий, поэтому трудно, к примеру, дойти до туалета. Процедура безопасна, а взятые из крови стволовые клетки быстро восстанавливаются.
Заготовленные стволовые клетки смешивают с диметилсульфоксидом (этот раствор защищает клетки ото льда) и замораживают до нужного времени. Потом пациенту проводят короткий усиленный курс химиотерапии и в последний день размораживают и вводят стволовые клетки крови. “Вводят” – значит просто капают в вену, как обычный пакет с донорской кровью; дальше материнские клетки сами знают, как найти их дом. В связи с тем, что поначалу использовали только клетки, взятые из подвздошной кости (стволовые клетки костного мозга), эта медицинская технология и получила название «аутологичная трансплантация костного мозга» (аутоТКМ). Ауто – значит «свой», потому что больному пересаживают его собственные стволовые клетки.
В связи с тем, что поначалу использовали только клетки, взятые из подвздошной кости (стволовые клетки костного мозга), эта медицинская технология и получила название «аутологичная трансплантация костного мозга» (аутоТКМ). Ауто – значит «свой», потому что больному пересаживают его собственные стволовые клетки.
Когда были опубликованы первые результаты нового метода лечения, во многих странах стали открываться трансплантационные центры, и сейчас в мире ежегодно выполняется более 130000 аутоТКМ. Сотни тысяч людей по всему миру полностью вылечились и вернулись к нормальной жизни.
Напомним, что при аутоТКМ основным методом лечения является химиотерапия, а заготовленные заранее стволовые клетки помогают только уменьшить осложнения.
Слово “трансплантация” многих пугает. И пациенты часто спрашивают врачей: «Что может произойти со мной от химии или от инфекций, когда иммунитет будет слабым?». Все годы, пока существует аутоТКМ, количество тяжелых осложнений во время лечения падает, поскольку улучшается сама технология аутоТКМ, внедряются новые лекарства и методики.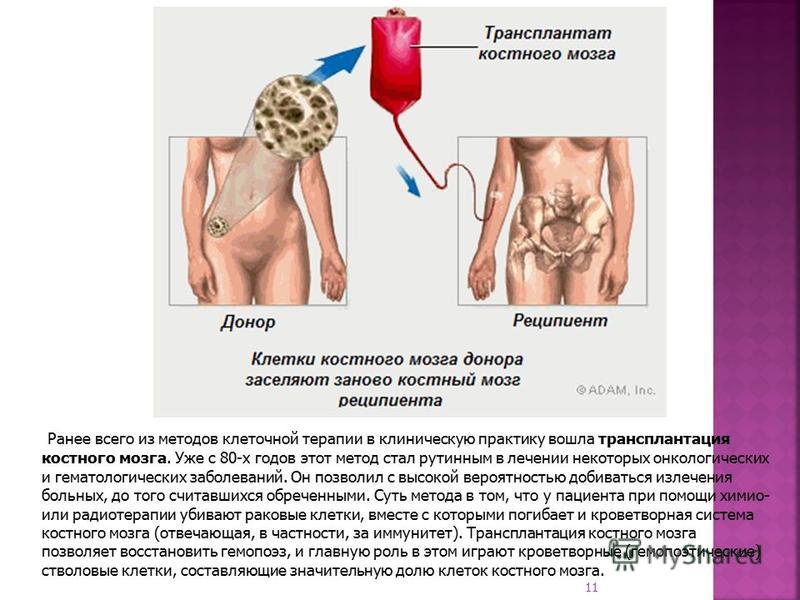 В последние десятилетия летальность, связанная с лечением, и в зарубежных, и в российских центрах держится прочно на 2-3 процентах. Для сравнения приведем пример: 2% – это летальность у пациентов, доставленных в больницы с обычным острым аппендицитом.
В последние десятилетия летальность, связанная с лечением, и в зарубежных, и в российских центрах держится прочно на 2-3 процентах. Для сравнения приведем пример: 2% – это летальность у пациентов, доставленных в больницы с обычным острым аппендицитом.
Кого же лечат с помощью аутоТКМ? На решение влияет вид заболевания и состояние пациента. При миеломной болезни, при некоторых лимфомах аутоТКМ делается сразу, чтобы закрепить результат первичной химиотерапии. При агрессивных лимфомах аутоТКМ является основным способом лечения рецидивов. Понятно, что такое лечение может быть опасно, поэтому после 65 лет аутоТКМ, обычно, не назначают. Но важен в данном случае всё-таки не возраст, а общее состояние пациента, и в более старшем возрасте аутоТКМ тоже иногда проводится.
Вероятность полного излечения при лимфомах зависит от того, какая это лимфома, и в общем составляет около 65%. При миеломной болезни выполнение аутоТКМ после первой успешной химиотерапии увеличивает длительность ремиссии вдвое.
Как долго пациент лежит в больнице?
Обычно около трех-четырех недель, из которых две-три недели – это период, когда восстанавливается иммунитет. После аутоТКМ пациенты могут быстро вернуться к повседневной жизни и вести привычный образ жизни.
Проводят ли аутоТКМ в Санкт-Петербурге?
Для жителей Санкт-Петербурга возможно проведение аутоТКМ в городской клинической больнице № 31.
Для жителей Ленинградской области – в Ленинградской областной клинической больнице.
Для всех граждан Российской Федерации возможно проведение аутоКТМ в НИИ детской онкологии, гематологии и трансплантологии им.Р.М.Горбачевой Первого Санкт-Петербургского Государственного медицинского университета им. акад. И.П.Павлова, НИИ онкологии им. Н.Н.Петрова, Северо-Западном медицинском исследовательском центре им. В.А. Алмазова.
НИИ ДОГиТ им. Р.М. Горбачевой ПСПбГМУ им.ак. И.П.Павлова по количеству трансплантаций является ведущим центром в России и входит в первую пятерку в Европе.
Пересадка костного мозга в Турции: клиники, цены, отзывы
Трансплантация костного мозга — на данный момент это самый эффективный метод лечения гематологических, онкологических и аутоиммунных заболеваний, когда пациенту после терапии, направленной на подавление собственного иммунитета, вводят предварительно подготовленный костный мозг. Мы говорим костный мозг, а подразумеваем пересадку стволовых клеток источником которых является либо костный мозг, либо кровь.
Необходима трансплантация костного мозга?
Заполните форму, через 10 мин. получите бесплатную консультацию о клиниках и докторах, выполняющих пересадку и стоимость
В каких случаях требуется трансплантация костного мозга
Зачастую пересадка костного мозга – это финальный этап лечения некоторых заболеваний, которому предшествует достаточно долгий период подготовки.
Данная процедура в большинстве случаем показана при следующих заболеваниях:
- Заболевания крови, лейкемия, острый лимфобластный лейкоз, острый миелоидный лейкоз и хронический миелоидный лейкоз апластическая анемия;
- нейробластома(читать больше),
- Болезнь Ходжкина(читать больше)
- другие онкозаболевания
Необходимость пересадки костного мозга обоснована тем, что при некоторых лимфомах и формах рака используется достаточно агрессивная химиотерапия, которая разрушает не только зараженные, но и здоровые клетки.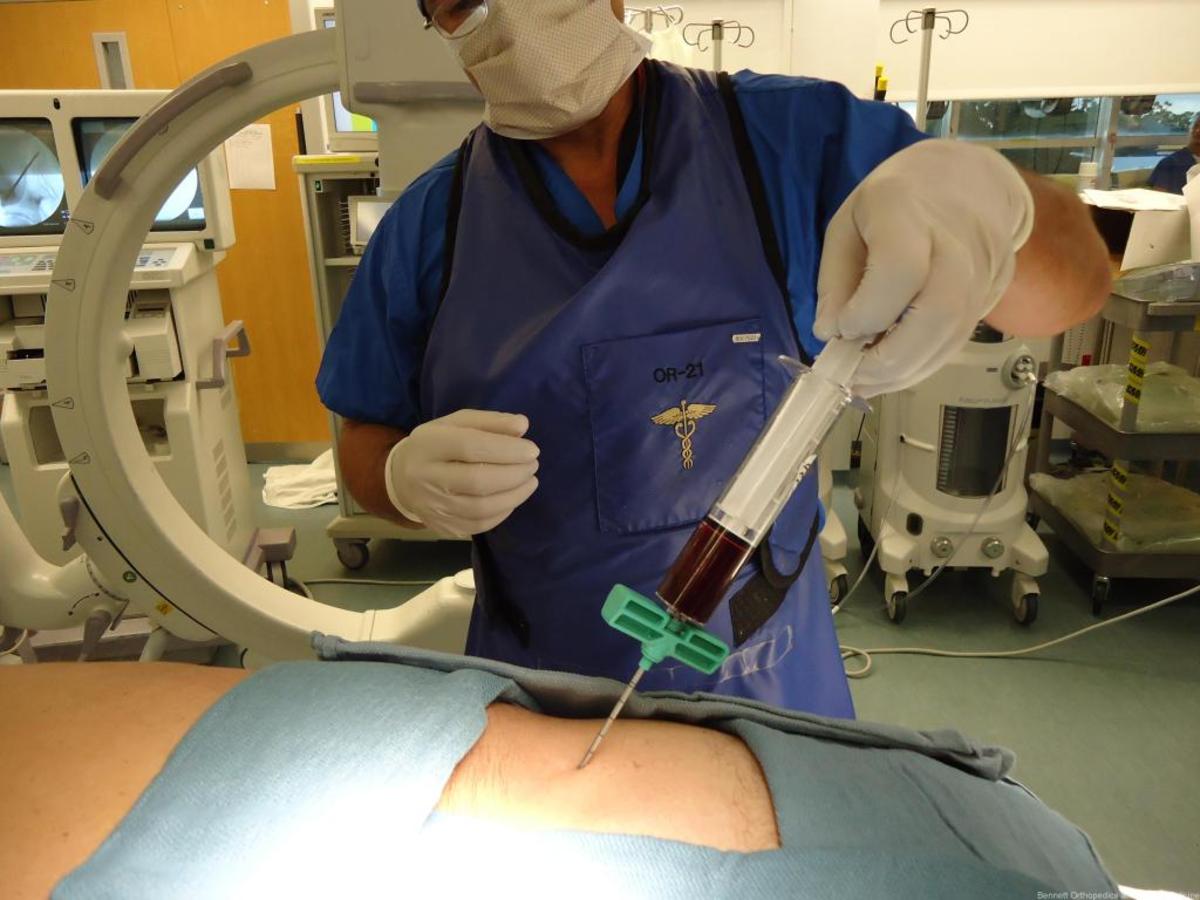
Именно пересадка в будущем дает врачам возможность использовать высокое облучение и химиотерапию для борьбы с раковыми клетками. Далее поврежденный костный мозг заменяется здоровым.
Во многих случаях эта процедура является единственно возможным вариантом лечения и выздоровления. Также очень важна скорость принятия решения о трансплантации, так как подготовительный этап иногда долог, а времени у пациентов есть немного.
Виды трансплантации костного мозга
Существует два вида трансплантации костного мозга:
- аутологичная трансплантация и
- аллогенная трансплантаци
Вид трансплантации определяется врачов в зависимости от показаний пациента.
Аутологичная трансплантация
Аутологичная трансплантация — пересадка своих собственных клеток. Перед проведением высокодозной химиотерапией собственные стволовые клетки собираются, замораживаются, а после вводятся пациенту.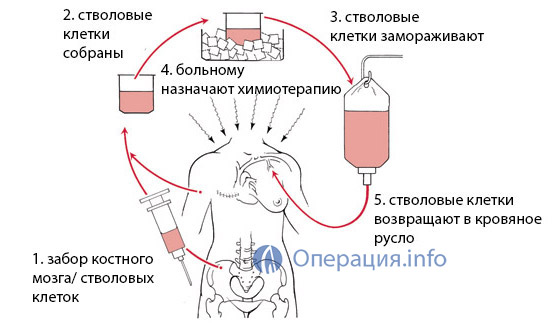 Это позволяет восстановить собственную иммунную систему и кроветворную систему в короткие сроки.
Это позволяет восстановить собственную иммунную систему и кроветворную систему в короткие сроки.
Костный мозг извлекают под общей анестезией несколькими проколами из подвздошной или бедренной кости. Из полученного материала извлекаются Т-лимфоциты, замораживаются для последующей трансплантации. В будущем данные клетки поступают в кровь уже обработанными и свободными от раковых клеток.
Визуально это процедура выглядит как переливание крови.
Данный способ показан, когда болезнь не затрагивает костный мозг: рак яичников, рак груди, лимфогранулематоз, неходжкинских лимфомы и опухоли головного мозга. Он может быть осуществлен, когда болезнь находится в стадии ремиссии. Также у пациента не должно быть заболеваний почек, печени, сердца и легких. Для этого проводится специальное обследование и лечение в кратчайшие сроки, если возможно. Наличие инфекционных заболеваний также делает данный вид пересадки невозможным. В противном случае риски осложнения возрастают
Аллогенная трансплантация
Первое, что вы должны сделать – перестать паниковать, взять себя в руки и начать бороться за свою жизнь. Лечение необходимо начинать максимально быстро. Времени на подумать нет. Чем дольше пациент думает – тем больше растет опухоль, и ее сложнее и дороже удалить.
В первую очередь, необходимо пройти все дополнительные анализы и провести диагностику. И сразу же обратиться к онкологу, который разработает план лечения, подберет максимально эффективные методы лечения для вашего случая и начнет лечение.
Лечение необходимо начинать максимально быстро. Времени на подумать нет. Чем дольше пациент думает – тем больше растет опухоль, и ее сложнее и дороже удалить.
В первую очередь, необходимо пройти все дополнительные анализы и провести диагностику. И сразу же обратиться к онкологу, который разработает план лечения, подберет максимально эффективные методы лечения для вашего случая и начнет лечение.
Какие бывают риски ?
При высоком варианте совместимости возникает необходимая реакция «трансплантат против опухоли» (graft-versus-tumor, GvT), когда донорские клетки воспринимают клетки опухоли как чужеродные и начинают процесс их разрушения. Но чем ниже процент тканевой совместимости, тем выше вероятность проявления реакции «трансплантат против хозяина» (graft-versus-host disease, GvHD), то есть отторжение пересаженных тканей.
Для предотвращения подобной реакции из донорской крови удаляют лимфоциты и после пересадки производят имуподавление. То есть пересадка с низким процентом совместимости хотя и от родственного донора сопряжена максимальным количеством осложнений.
То есть пересадка с низким процентом совместимости хотя и от родственного донора сопряжена максимальным количеством осложнений.
Статистически существует шанс 25-30%, что у пациента окажется родственный донор (брат или сестра) чей материал подходит для трансплантации. Если родственного донора найти невозможно, то клиники прибегает к поиску донора в международном регистре доноров костного мозга. И здесь мы говорим уже о следующем виде трансплантации
Трансплантация КМ от СНД (совместимого неродственного донора) — существует международный регистр доноров костного мозга, это база добровольных доноров, которых в мире насчитывается до 6 миллионов человек. Вероятность найти генетически подходящего человека достаточно высока. Она составляет около 40%.
Обычно поиск подходящего человека занимает не более получаса, но процесс с того момента, как установлена связь с донором и получено его согласие до момента самой трансплантации может занимать он нескольких недель до нескольких месяцев.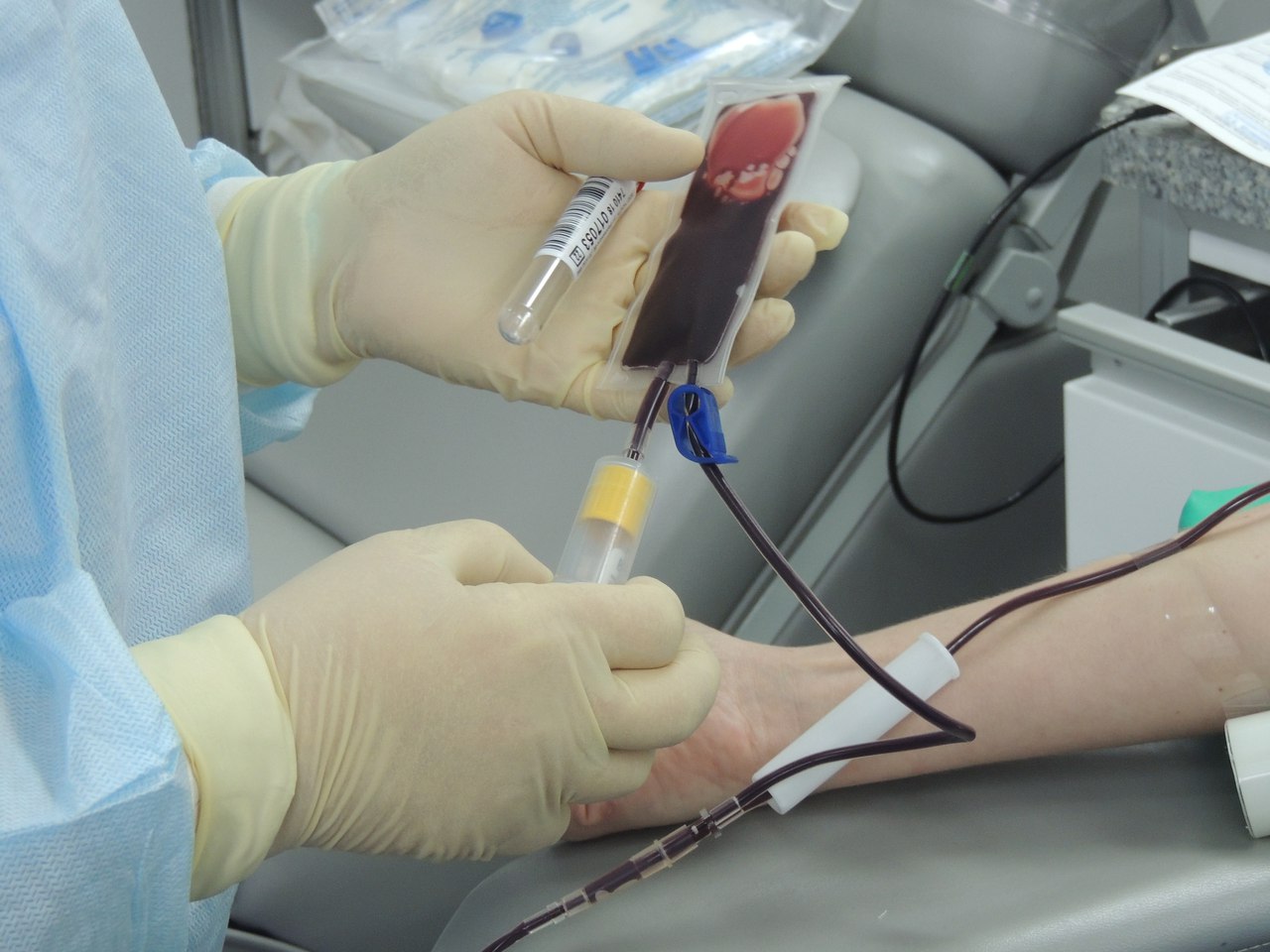
Подготовка к трансплантации костного мозга в Турции
Это звучит достаточно парадоксально, чтобы была возможность осуществить трансплантацию костного мозга, пациент должен быть «достаточно» здоровым. Стадия болезни, общее физическое состояние, возраст – эти факторы имеют важное значение при принятии решения, можно ли проводить пересадку пациенту. Так например, трансплантацию можно делать пациенту, который молод и в данный момент чувствует себя в целом не плохо. Аутологическая трансплантация возможна, если пациент старше 65 лет; аллогенная – до 50 лет. При пересадке стволовых клеток риск меньше, поэтому ее возможно делать и достаточно пожилым пациентам.
Процедура забора костного мозга у донора или же у самого пациента происходит в операционной под общим наркозом . Специальная игла вводится, в тазовую кость, где располагается основной резервуар костного мозга. Далее контейнер со стволовыми клетками доставляется в лабораторию. На аппарате афереза производится отбор стволовых клеток.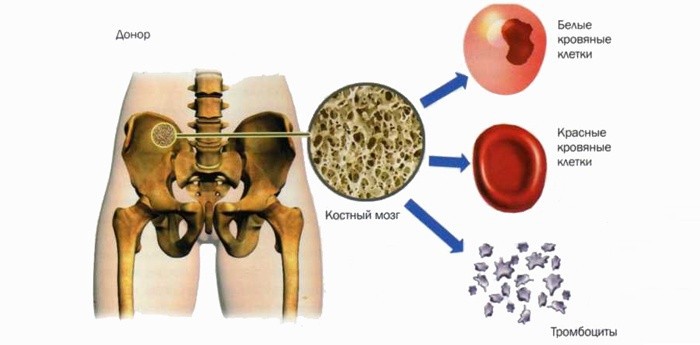 Если количество живых клеток достаточное, то начинается подготовка к трансплантации. Кстати, количество костного мозга у донора восстанавливается около 2‐х недель.
Если количество живых клеток достаточное, то начинается подготовка к трансплантации. Кстати, количество костного мозга у донора восстанавливается около 2‐х недель.
Пациент госпитализируется, далее в течение недели, как правило 7-8 дней проходит облучение или химиотерапию, что разрушает раковые клетки и его собственный костный мозг. Точная доза и состав препаратов зависят от заболевания и назначаются пациенту по мировым протоколам лечения.
Как проходит трансплантация костного мозга.
После того, как врач понимает, что пациент готов к трансплантации, его показатели здоровья достаточны, чтобы перенести данную процедуру, проводится пересадка костного мозга. Подобно переливанию крови, костный мозг вводится внутривенно. Специальный катетер вводится в крупную вену обычно под шеей и далее под кожей груди доходит к сердцу. Таким образом стволовые клетки направляются прямо в кровеносную систему. Клетки костного мозга распределяться в костном мозге пациента
Послеоперационный период
Наиболее критичными являются первые 2 недели, так как можно определить, воспроизводятся ли пересаженные клетки или нет. Так как химиотерапией убиваются собственные клетки и иммунитет пациента, в период после пересадки костного мозга особо важно содержать его практически в стерильной среде. 30-40 дней, когда происходит увеличение числа клеток, вырабатываются лейкоциты, эритроциты тромбоциты, пациент полностью огражден от окружающего мира. У него нет прямого контакта с другими пациентами. И только после истечения этого периода, когда никаких инфекций не обнаружено, и клетки начали воспроизводить сами себя, пациент переводится из специального бокса в обычное отделение. Данные меры безопасности критически важны, в этот период. Впоследствии еще около 40-60 дней пациент находится в отделении под постоянным контролем врачей и только после этого он может быть выписан.
Так как химиотерапией убиваются собственные клетки и иммунитет пациента, в период после пересадки костного мозга особо важно содержать его практически в стерильной среде. 30-40 дней, когда происходит увеличение числа клеток, вырабатываются лейкоциты, эритроциты тромбоциты, пациент полностью огражден от окружающего мира. У него нет прямого контакта с другими пациентами. И только после истечения этого периода, когда никаких инфекций не обнаружено, и клетки начали воспроизводить сами себя, пациент переводится из специального бокса в обычное отделение. Данные меры безопасности критически важны, в этот период. Впоследствии еще около 40-60 дней пациент находится в отделении под постоянным контролем врачей и только после этого он может быть выписан.
После выписки из больницы, пациент продолжает процесс восстановления дома. В случае, если он живет в другом городе, то он снимает жилье недалеко от госпиталя, так как несколько раз в неделю ему необходимо посещать своего лечащего врача, чтобы наблюдаться, получать лекарственные препараты, делать переливание крови по необходимости.
Обычно в течение 6 месяцев после трансплантации пациент еще не готов вернуться к своей привычной жизни, так как ощущается слабость, ему хочется спать и отдыхать. Посещение общественных мест противопоказано. Кинотеатры, супермаркеты-это места скопления людей, а значит вирусов. Поэтому, если пациент рискует выходить в такие места, то он должен строго ограничивать время посещения и пользоваться маской. Обычно необходимо около 1 года, пока пересаженный костный мозг начнет функционировать как собственный. При этом необходимо постоянно находиться в контакте с лечащей командой специалистов.
Цена трансплантации костного мозга
Ниже приведены очень усредненные цены на трансплантацию костного мозга в Турции:
- Аллогенная трансплантация от 40 000 долларов США
- Аутологичная трансплантация (от родственника) от 80 000 долларов США
- Аутологичная трансплантация от неродственного донора от 100 000 долларов США
Следует также отметить, что Турция входит в тройку лидеров по количеству и эффективности трансплантации костного мозга. Для сравнения, цена подобной трансплантации в Израиле от 100 до 160 тыс долларов в Германии от 150 000 долларов.
Для сравнения, цена подобной трансплантации в Израиле от 100 до 160 тыс долларов в Германии от 150 000 долларов.
Подобные операции не проводятся с некоторых странах. Например, в Украине нет подробной процедуры в силу разных причин. Поэтому существуют специальные государственные программы, когда государство оплачивает трансплантацию КМ для украинских граждан в клиниках Турции. Как попасть в подобные программы, мы также можем рассказать детально. Ведь очереди достаточно велики, а времени у пациентов недостаточно.
Если Вам показана трансплантация костного мозга, обращайтесь к нам. Мы поможем найти необходимых специалистов. А в случае граждан Украины, расскажем как попасть в государственную программу, когда данную процедуру оплачивает государство.
Пересадка костного мозга в Израиле – Виды и Методы
Центр пересадки костного мозга является частью отдела гематологии и онкологии Тель-Авивского медицинского центра Сураски-Ихилов.
Центр аффилирован с Европейским и Американским центрами трансплантаций.
Здесь, с использованием новейших методик и технологий, успешно осуществляются аутологичные и аллогенные трансплантации костного мозга. Мы проводим около 80 трансплантаций в год.
Пациентам, нуждающимся в пересадке, предоставляются оптимальные условия: опытный персонал, просторные палаты, максимально защищающие от инфекций и приспособленные к продолжительной госпитализации. Палаты оснащены спальным местом для родственника, ТВ, интернетом.
Каждому пациенту составляется индивидуальный протокол химиотерапии, на основе проведенных обследовании и рекомендаций врача, в предверии трансплантации.
Наш персонал обладает богатым опытом как в проведении самой процедуры трансплантации костного мозга, так и в разрешении возможных осложнений. В последнии годы процент успешно проведенных пересадок значительно увеличился. Сегодня процент пациентов, полностью излечившихся благодаря трансплантации исчисляется десятками процентов. Нам удалось вылечить пациентов, чьи шансы на выздоровление были крайне малы, но они полностью восстановились и вернулись к нормальной жизни.
Нам удалось вылечить пациентов, чьи шансы на выздоровление были крайне малы, но они полностью восстановились и вернулись к нормальной жизни.
Обратиться в отдел медицинского туризма больницы Ихилов можно несколькими способами: отправив заявку на почту [email protected] или оставить заявку на официальном сайте больницы Ихилов. После получения заявки врачи больницы проведут ревизию результатов диагностических исследований, проведенных на родине, и в течении 24, максимум 48 часов, дадут ответ, можем ли мы помочь пациенту в условиях пандемии и предоставят предварительный прайс-лист, чтобы заранее понимать стоимость обследования/лечения.
Это позволяет избежать ненужных проверок по приезде, а также существенно экономит время и деньги пациента, прибывшего на лечение.
Донорство гемопоэтических стволовых клеток – ФГБУ «НМИЦ гематологии» Минздрава России
Ежегодно в России почти 5 000 человек нуждаются в пересадке костного мозга. Ежегодно делается порядка 1,8 тыс. трансплантаций костного мозга, однако потребность в такой медицинской помощи существенно выше и в настоящее время ограничена недостаточным числом доноров костного мозга. В Национальном регистре доноров костного мозга свыше 44 тыс. потенциальных доноров.
Ежегодно делается порядка 1,8 тыс. трансплантаций костного мозга, однако потребность в такой медицинской помощи существенно выше и в настоящее время ограничена недостаточным числом доноров костного мозга. В Национальном регистре доноров костного мозга свыше 44 тыс. потенциальных доноров.
Что такое пересадка костного мозга?
Под пересадкой костного мозга понимается на самом деле трансплантация гемопоэтических стволовых клеток. Гемопоэтические (кроветворные) стволовые клетки образуются в костном мозге человека и являются родоначальниками всех клеток крови: лейкоцитов, эритроцитов и тромбоцитов.
Кто нуждается в пересадке костного мозга?
Для многих пациентов с онкологическими и гематологическими заболеваниями единственным шансом сохранить жизнь является пересадка гемопоэтических стволовых клеток. Это может спасти жизнь тысячам детей и взрослых больных раком, лейкозом, лимфомой или наследственными заболеваниями.
Кто может стать донором гемопоэтических клеток?
Любой здоровый гражданин РФ без хронических заболеваний в возрасте от 18 до 45 лет.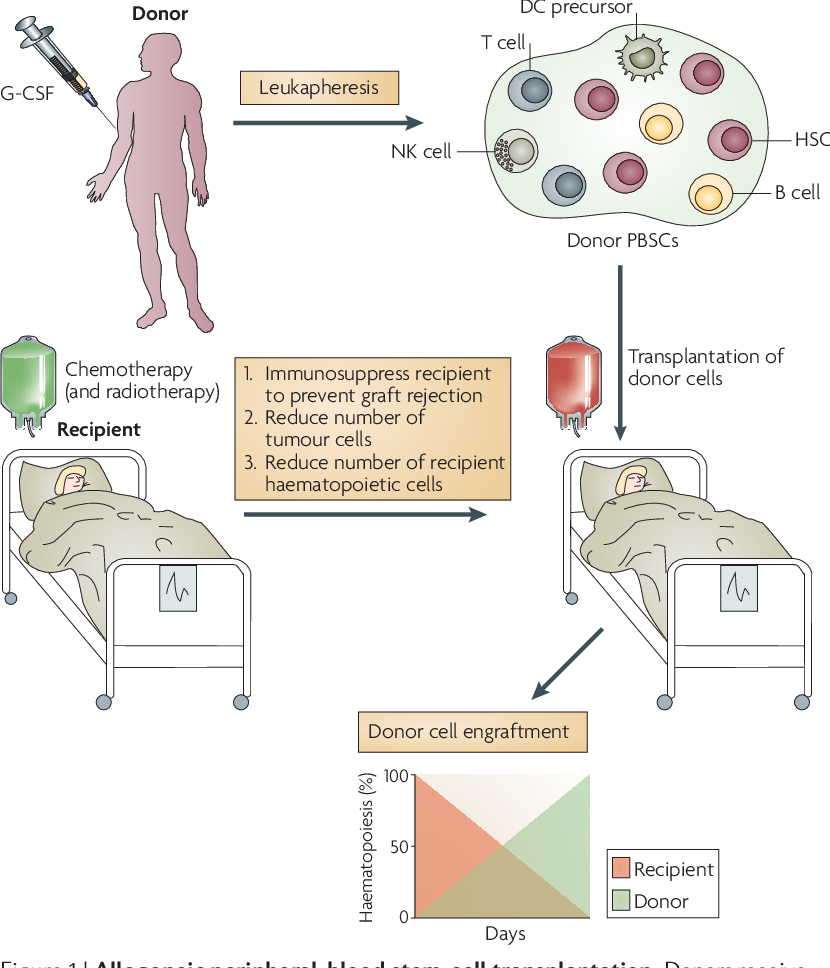
Немаловажным фактором для донорства костного мозга является возраст: чем моложе донор, тем выше концентрация гемопоэтических стволовых клеток в трансплантате и их «качество».
Как происходит типирование костного мозга?
Перед донорством гемопоэтических стволовых клеток нужно пройти типирование (определение HLA-генотипа) костного мозга. И если вы подойдете по типу какому-нибудь пациенту, то Вас пригласят на донорство гемопоэтических стволовых клеток.
Для определения HLA-генотипа (типирования) у вас возьмут 1 пробирку крови. Образец крови (до 10 мл — как при обычном анализе крови) человека, желающего стать донором гемопоэтических стволовых клеток, исследуют в специализированной лаборатории.
Информация о результатах типирования доноров, рекрутированных и HLA-типированных в ФГБУ НМИЦ гематологии Минздрава России, вносится в общероссийскую базу доноров — Национальный регистр доноров костного мозга.
Процедура типирования требует от донора лишь немного времени, не требует затрат и не отличается от обычного анализа крови.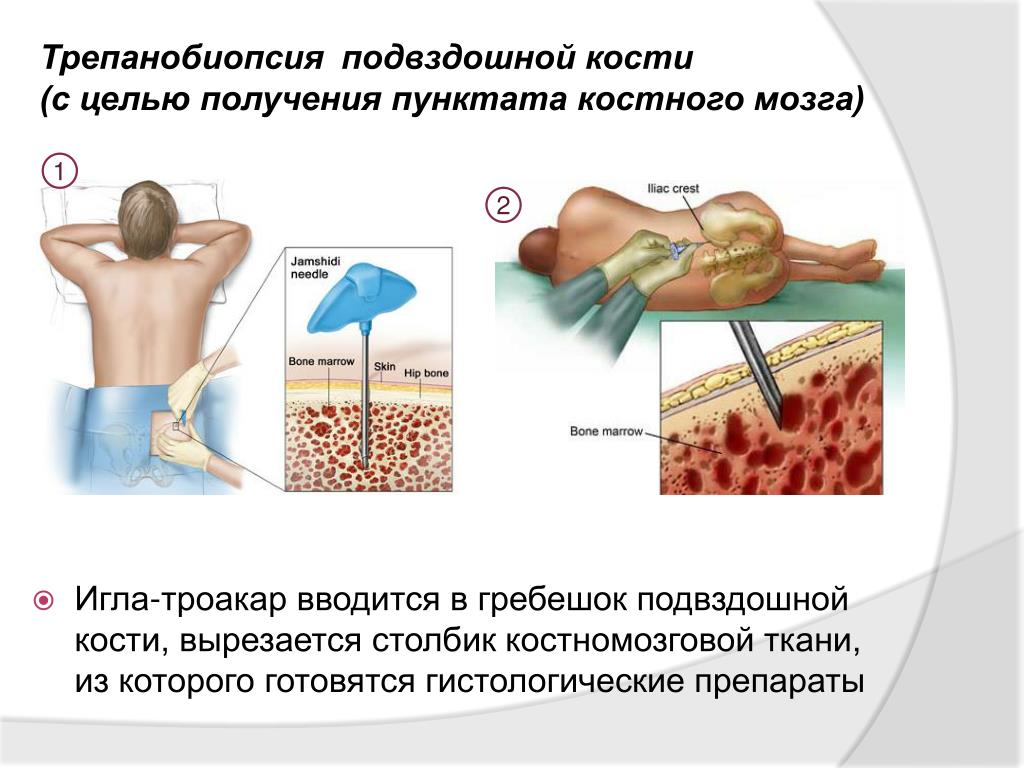
Что происходит после внесения данных в регистр?
При появлении пациента, которому необходимо выполнить трансплантацию костного мозга, его данные HLA-генотипа сравнивают с данными потенциальных доноров, имеющихся в регистре. В результате может быть подобран один или несколько «совместимых» доноров. Потенциальному донору сообщают об этом, и он принимает решение, становиться или нет реальным донором. Для потенциального донора вероятность стать донором реальным составляет не более 1%.
Как происходит процедура донации стволовых клеток?
Если же вы подошли по HLA-генотипу какому-нибудь больному и вам предстоит стать донором костного мозга, то не бойтесь! Получение стволовых клеток из периферической крови — простая, комфортная и безопасная для донора процедура.
У донора берут костный мозг одним из двух способов:
- шприцом из тазовой кости (процедура безболезненна под наркозом),
- с помощью медицинского препарата «выгоняют» клетки костного мозга в кровь и собирают их оттуда через периферическую вену.

Данная процедура напоминает аппаратный тромбоцитаферез (процедура донорства тромбоцитов), но более продолжительная по времени.
Донор отдает лишь малую часть своего костного мозга.
Потеря части стволовых клеток донором не ощущается, и их объем полностью восстанавливается в течение 7—10 дней.
5% стволовых клеток донора достаточно для восстановления кроветворения пациента. Пациенту переливают донорский костный мозг, он приживается и начинает производить кровь. Человек спасен!
Гемопоэтические (кроветворные) стволовые клетки, своевременно трансплантированные больному, способны восстановить его кроветворение и иммунитет, а также спасти ему жизнь.
Как стать потенциальным донором гемопоэтических стволовых клеток?
Если вы хотите стать донором ГСК, обратитесь к ведущему специалисту по работе с донорами: 2-й этаж донорского отделения, стойка «Информации для доноров», Александра или Алена.
Сдать пробирку 10 мл крови на определения HLA-генотипа (типирования) вы можете согласно расписанию.
Если в вашей компании готовы пройти типирование более 30 человек, то мы можем организовать к вам выезд. По дополнительным вопросам звоните с 9:00 до 22:00 по телефону: +7 (905) 568-57-60, Александра.
Мы очень ждем вас!
Трансплантация костного мозга: показания к операции и методы. Справка
Трансплантация костного мозга представляет собой процедуру, позволяющую проводить лечение рака очень высокими дозами прежде всего химиотерапевтических средств, но иногда и радиоактивного излучения. Поскольку такое лечение постоянно разрушает костный мозг, оно в принципе представляется неосуществимым, ведь организм утрачивает жизненно важную способность продуцировать клетки крови. Однако, если после лечения в организм вновь ввести здоровый костный мозг, возможны замена костного мозга и восстановление его способности к кроветворению. Поэтому пересадки костного мозга позволяют проводить терапию высокими дозами для излечения конкретного рака, когда более низкие дозы бессильны.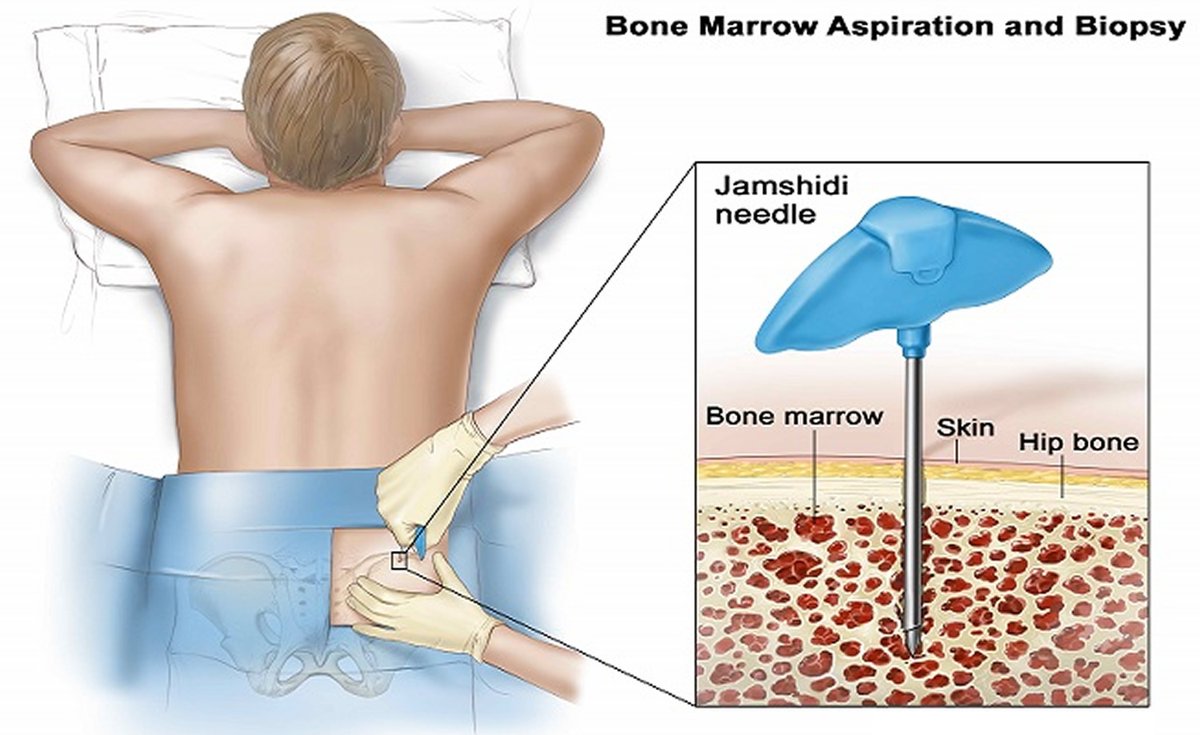
Существуют два вида трансплантации: аллогенная, при которой используется костный мозг другого человека, и аутологическая, предусматривающая использование костного мозга или стволовых клеток самого пациента. Аутологическая трансплантация не является таковой в истинном смысле слова и иногда называется поддерживающей пересадкой костного мозга или стволовых клеток. При аллогенной трансплантации донор должен быть совместим с больным по антигенам HLA.
Цель удаления костного мозга заключается в получении содержащихся в нем клеток предшественников (стволовых клеток), которые в процессе развития превращаются затем в различные компоненты крови. До начала любого интенсивного лечения костный мозг удаляют из бедренных костей пациента или донора, после чего замораживают и хранят до использования. Это называется извлечением. Позже, после завершения химиотерапии в сочетании с радиотерапией или без нее, костный мозг вводят обратно в организм капельным методом, подобно переливанию крови. Мозг циркулирует по организму с кровотоком и в конечном счете оседает в полостях костей, где начинается его рост и возобновляется процесс кроветворения.
Мозг циркулирует по организму с кровотоком и в конечном счете оседает в полостях костей, где начинается его рост и возобновляется процесс кроветворения.
Если все проходит удачно, мозг приживется, и пациент выздоравливает. Но две угрозы стоят на пути выздоровления. Первая это возможность отторжения организмом трансплантата. Чтобы этого не произошло, защитное сопротивление организма подавляется мощными медикаментами. Вторая же угроза в том, что в течение двух трех послеоперационных месяцев организм пациента практически лишен иммунной системы. Малейшее инфицирование может стать смертельным. Чтобы избежать заражения, пациент помещается в специальную палату с особыми мерами защиты, он изолируется от внешнего мира.
Даже после выхода из больницы за пациентом устанавливается тщательное наблюдение, и он должен посещать ее для регулярных проверок. На нормальное восстановление иммунной системы после трансплантации уходит около года, но если самочувствие пациента ухудшится, может возникнуть необходимость в повторной госпитализации.
болезней, поддающихся трансплантации | Be The Match
Пересадка костного мозга или пуповинной крови может быть лучшим вариантом лечения или единственным средством излечения для пациентов с лейкемией, лимфомой, серповидноклеточной анемией и многими другими заболеваниями. Поскольку наука о трансплантологии продолжает развиваться, новые болезни лечатся с помощью трансплантата.
Лейкемии и лимфомы, в том числе:
- Острый миелогенный лейкоз (ОМЛ) – наиболее распространенный тип острого лейкоза, в США ежегодно выявляется около 15 000 новых случаев.ОМЛ может поражать людей любого возраста, но чаще всего встречается у взрослых.
- Острый лимфобластный лейкоз (ОЛЛ). Ежегодно в США регистрируется около 6000 новых случаев ОЛЛ. Он может поражать людей любого возраста, но является наиболее распространенным типом лейкемии у детей младше 15 лет.
- Хронический лимфоцитарный лейкоз (ХЛЛ) – это заболевание, в основном заболевание взрослых, очень редко встречается у детей и молодых людей.
 Ежегодно в США диагностируется около 15 000 человек.
Ежегодно в США диагностируется около 15 000 человек. - Хронический миелогенный лейкоз (ХМЛ) – относительно распространенная форма лейкемии, от которой ежегодно страдают более 20 000 человек в Соединенных Штатах, при этом ежегодно регистрируется 6 000 новых случаев.Большинство случаев ХМЛ возникает у взрослых.
- Ювенильный миеломоноцитарный лейкоз
- Лимфома Ходжкина
- Неходжкинская лимфома (НХЛ). Ежегодно в США диагностируется НХЛ у 69 000 человек. Большинство из этих людей старше 60 лет.
Заболевания костного мозга и другие заболевания, при которых костный мозг не работает, в том числе:
- Тяжелая апластическая анемия – редкое заболевание, ежегодно диагностируемое 600-900 человек. Заболевание чаще появляется в странах Восточной Азии.Это может повлиять на людей любого возраста, но чаще всего встречается у молодых людей.
- Анемия Фанкони
- Пароксизмальная ночная гемоглобинурия (ПНГ)
- Чистая аплазия эритроцитов
- Амегакариоцитоз / врожденная тромбоцитопения
Унаследованные иммунные расстройства, в том числе
 Если их не лечить, они могут стать опасными для жизни в течение первого года жизни.В Соединенных Штатах примерно 1 из 100 000 детей рождается с ТКИД.
Если их не лечить, они могут стать опасными для жизни в течение первого года жизни.В Соединенных Штатах примерно 1 из 100 000 детей рождается с ТКИД.Гемоглобинопатии (заболевания с плохо функционирующими эритроцитами), в том числе:
- Большая бета-талассемия
- Серповидно-клеточная анемия (ВСС) – Серповидно-клеточная анемия является наследственным заболеванием красных кровяных телец.В Соединенных Штатах она поражает около 70 000–100 000 человек и наиболее распространена среди афроамериканцев и латиноамериканцев.
Унаследованные нарушения обмена веществ, в том числе:
- Болезнь Краббе (GLD) —GLD встречается очень редко. Ежегодно в США диагностируют только около 40 детей. Чаще всего появляется в первые месяцы жизни (рано).
 Существует также другая форма заболевания, которая проявляется только в более позднем детстве или даже в подростковом возрасте (с поздним началом).
Существует также другая форма заболевания, которая проявляется только в более позднем детстве или даже в подростковом возрасте (с поздним началом). - Синдром Гурлера (MPS-IH) – встречается примерно у 1 из каждых 100 000 рожденных детей.Если не лечить, дети, рожденные с этим заболеванием, обычно умирают в возрасте от 5 до 10 лет.
- Адренолейкодистрофия (ALD). И мальчики, и девочки могут родиться с ALD, но у мальчиков более вероятно появление симптомов. Один из 3 мальчиков, рожденных с ALD, имеет наиболее тяжелую форму – церебральную X-связанную ALD. Форма встречается редко, поражая примерно 1 из 20 000 человек во всем мире.
- Метахроматическая лейкодистрофия (МЛЛ) – МЛБ чаще всего возникает у младенцев и детей ясельного возраста, но также встречается у детей старшего возраста и взрослых.MLD встречается редко. Это происходит примерно у 1 из 40 000 – 160 000 человек во всем мире.
Миелодиспластические синдромы и миелопролиферативные нарушения. МДС – это группа заболеваний, поражающих костный мозг и кровь. Ежегодно в Соединенных Штатах Америки диагностируется МДС около 19 000 человек.
Ежегодно в Соединенных Штатах Америки диагностируется МДС около 19 000 человек.
Множественная миелома и другие заболевания плазматических клеток
Семейный эритрофагоцитарный лимфогистиоцитоз и другие гистиоцитарные нарушения
Некоторые другие злокачественные новообразования или раковые образования
Другие болезни, поддающиеся лечению трансплантацией костного мозга
Какие еще болезни можно лечить с помощью трансплантата?
Трансплантат может быть вариантом лечения:
- анемии Даймонда-Блэкфана
- Эссенциальный тромбоцитоз
- саркома Юинга
- Анемия Фанкони
- Зародышевый рак яичников 9000оцитосомия Гемофагоцитис7
- Гемофагоцитис70007 Гемофагоцитис70007 Гемофагоцитис70007 Гемофагоцитис70007 Гемофагоцитоз7
- Медуллобластома
- Миелофиброз
- Нейробластома
- Истинная полицитемия
- Рак яичка
- Талассемия
- Другие редкие заболевания
Другие болезни, не перечисленные здесь, также можно лечить с помощью трансплантата.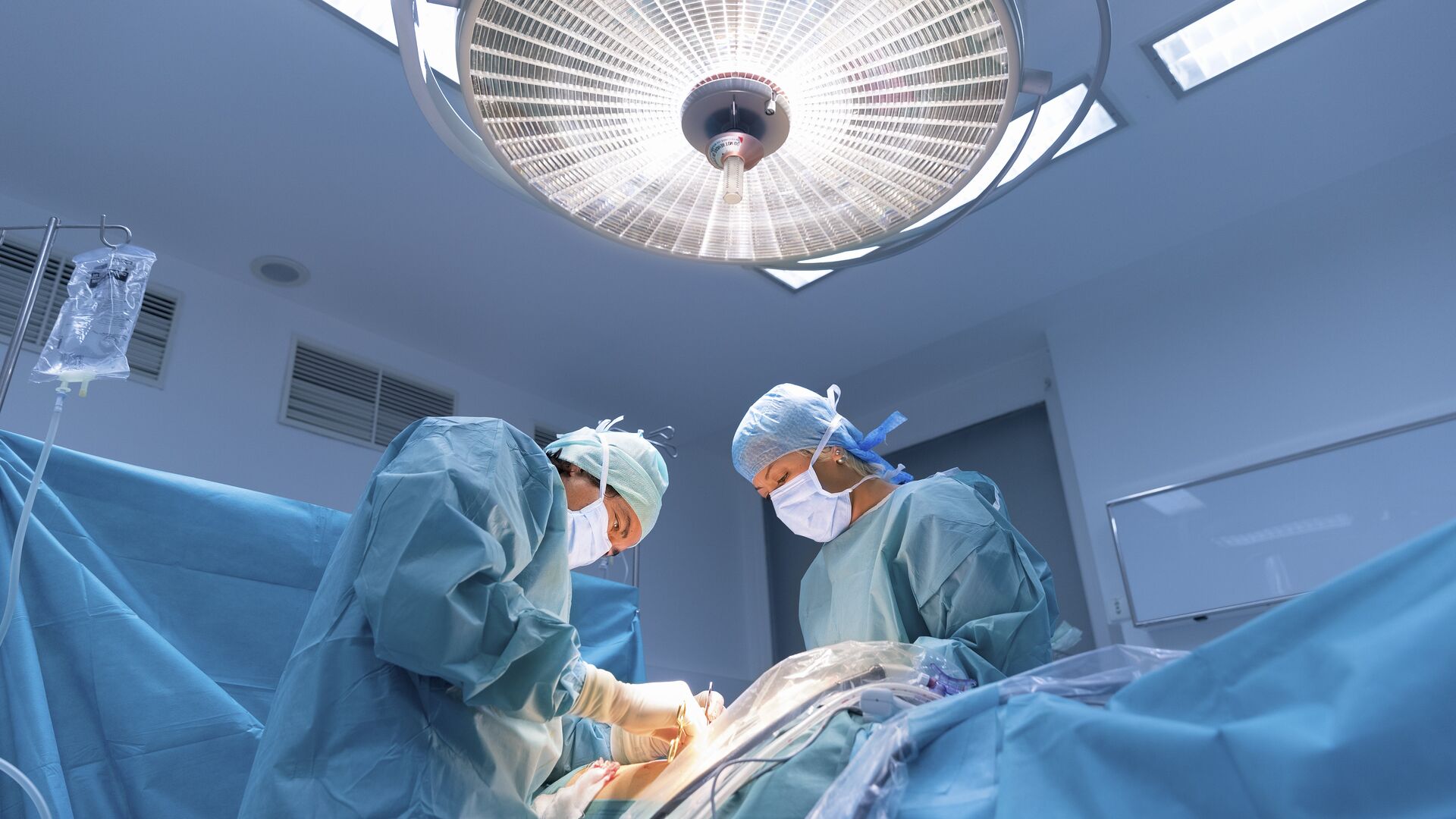 Здесь вы можете найти подробный список болезней, которые лечатся с помощью трансплантата.
Здесь вы можете найти подробный список болезней, которые лечатся с помощью трансплантата.
Обратитесь в ЦЕНТР ПОДДЕРЖКИ ПАЦИЕНТОВ
ТЕЛЕФОН: 1 (888) 999-6743 или (763) 406-3410
с понедельника по пятницу с 8:00 до 17:00. Центральное время
ЭЛЕКТРОННАЯ ПОЧТА: [email protected]
Все наши программы поддержки и образовательные ресурсы бесплатны.
Как трансплантация крови или костного мозга (BMT) работает при этих заболеваниях?
BMT заменяет нездоровый костный мозг здоровым костным мозгом от донора.Костный мозг вырабатывает кроветворные клетки. Вам нужны здоровые кроветворные клетки, чтобы производить все клетки вашей крови.
Существует 2 типа трансплантата:
- Аутологический трансплантат, при котором используются собственные кроветворные клетки пациента. Клетки собираются, хранятся и возвращаются после химиотерапии (химиотерапии) или облучения.
- Аллогенный трансплантат, при котором используются здоровые кроветворные клетки члена семьи, неродственного донора или пуповинная кровь.

Для обоих типов трансплантата вы получаете химиотерапию, с радиацией или без нее, чтобы убить нездоровые клетки.Затем заменяющие клетки вводятся вам через внутривенную (IV) линию. Клетки перемещаются внутрь ваших костей, чтобы вырабатывать здоровые клетки крови.
Весь процесс трансплантации, от начала химиотерапии или облучения до выписки из больницы, может длиться от нескольких недель до месяцев. Затем следует многомесячное выздоровление рядом с центром трансплантации и дома. Ваша бригада по трансплантации будет внимательно следить за вами, чтобы предотвратить и лечить любые побочные эффекты или осложнения.
Когда обращаться к врачу-трансплантологу
| Болезнь | Когда обращаться к врачу-трансплантологу |
| Анемия Даймонда-Блэкфана | |
| Эссенциальный тромбоцитоз |
|
| Саркома Юинга |
|
| Анемия Фанкони | |
| Зародышевый рак яичников |
|
| Гемофагоцитарный лимфогистиоцитоз (ГЛГ) | |
| Ювенильный миеломоноцитарный лейкоз (JMML) | |
| Медуллобластома |
|
| Миелофиброз |
|
| Нейробластома |
|
| Истинная полицитемия |
|
| Рак яичка |
|
| Талассемия |
|
Если вы не можете найти заболевание, указанное здесь, спросите своего врача, может ли вам подойти трансплантация. Вы также можете связаться с нашим Центром поддержки пациентов, чтобы узнать, подойдет ли вам трансплантация.
Вы также можете связаться с нашим Центром поддержки пациентов, чтобы узнать, подойдет ли вам трансплантация.
Обратитесь в Центр поддержки пациентов:
Звоните: 1 (888) 999-6743
с понедельника по пятницу с 8:00 до 17:00. Central Time
Электронная почта: [email protected]
Ваш первый визит к врачу-трансплантологу
Во время вашего первого визита врач-трансплантолог:
- Изучит вашу историю болезни.
- Поговорите с вами о вариантах лечения.
- Обсудите риски и преимущества трансплантации.
- Порекомендуйте вам лучшее время для трансплантации и подготовки к лечению
- Начните поиск донора, даже если вам не нужна немедленная трансплантация. Это может помочь вам сделать пересадку быстрее, если она понадобится позже.
Вопросы, которые следует задать своему врачу
Задавайте вопросы, чтобы вы понимали варианты лечения и могли принимать наиболее подходящие для вас решения.Вопросы, которые вы можете задать своему врачу, включают:
- Каковы шансы на излечение с помощью трансплантата? Без пересадки?
- Каковы риски ожидания или попытки другого лечения перед трансплантацией?
- Есть ли у меня (или моего ребенка) какие-либо факторы риска, которые могут повлиять на результаты трансплантации?
- Каковы возможные побочные эффекты трансплантата? Как их уменьшить?
- Как может со временем измениться качество моей жизни (или моего ребенка), с трансплантацией или без нее?
Узнать больше о планирование трансплантации
Последняя медицинская проверка завершена в марте 2017 г.
Трансплантация костного мозга: виды, процедуры и риски
Что такое трансплантация костного мозга?
Трансплантация костного мозга – это медицинская процедура, выполняемая для замены костного мозга, который был поврежден или разрушен болезнью, инфекцией или химиотерапией. Эта процедура включает в себя трансплантацию стволовых клеток крови, которые перемещаются в костный мозг, где производят новые клетки крови и способствуют росту нового костного мозга.
Костный мозг – это губчатая жировая ткань внутри ваших костей.Он создает следующие части крови:
- красных кровяных телец, которые переносят кислород и питательные вещества по всему телу
- лейкоцитов, которые борются с инфекцией
- тромбоцитов, которые отвечают за образование сгустков
Костный мозг также содержит незрелые кроветворные стволовые клетки, известные как гемопоэтические стволовые клетки или HSC. Большинство клеток уже дифференцированы и могут только копировать себя. Однако эти стволовые клетки неспециализированы, что означает, что они могут размножаться посредством деления клеток и либо оставаться стволовыми клетками, либо дифференцироваться и созревать во множество различных видов клеток крови.HSC, обнаруженные в костном мозге, будут производить новые клетки крови на протяжении всей вашей жизни.
Однако эти стволовые клетки неспециализированы, что означает, что они могут размножаться посредством деления клеток и либо оставаться стволовыми клетками, либо дифференцироваться и созревать во множество различных видов клеток крови.HSC, обнаруженные в костном мозге, будут производить новые клетки крови на протяжении всей вашей жизни.
Пересадка костного мозга заменяет поврежденные стволовые клетки здоровыми. Это помогает вашему организму вырабатывать достаточно белых кровяных телец, тромбоцитов или эритроцитов, чтобы избежать инфекций, нарушений свертываемости крови или анемии.
Здоровые стволовые клетки могут поступать от донора или от вашего собственного тела. В таких случаях стволовые клетки можно собирать или выращивать до начала химиотерапии или лучевой терапии.Эти здоровые клетки затем хранятся и используются при трансплантации.
Трансплантация костного мозга проводится, когда костный мозг человека недостаточно здоров для нормального функционирования. Это могло произойти из-за хронических инфекций, болезней или лечения рака.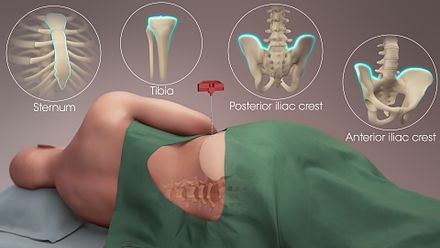 Некоторые причины для трансплантации костного мозга включают:
Некоторые причины для трансплантации костного мозга включают:
- апластическая анемия, которая представляет собой заболевание, при котором костный мозг перестает производить новые клетки крови
- раковые заболевания, поражающие костный мозг, такие как лейкемия, лимфома и множественная миелома
- поврежденный костный мозг из-за химиотерапии
- врожденная нейтропения, наследственное заболевание, вызывающее рецидивирующие инфекции
- серповидно-клеточная анемия, наследственное заболевание крови, вызывающее деформированные эритроциты
- талассемия, наследственное заболевание крови, при котором организм вырабатывает аномальная форма гемоглобина, неотъемлемая часть эритроцитов
Пересадка костного мозга считается серьезной медицинской процедурой и увеличивает риск:
- падения артериального давления
- головной боли
- тошноты
- боли
- одышка
- озноб
- лихорадка
абов Симптомы обычно недолговечны, но трансплантация костного мозга может вызвать осложнения. Ваши шансы на развитие этих осложнений зависят от нескольких факторов, включая:
Ваши шансы на развитие этих осложнений зависят от нескольких факторов, включая:
- ваш возраст
- ваше общее состояние здоровья
- заболевание, от которого вы лечитесь
- тип трансплантата, который вы получили
Осложнения могут быть легкими или очень серьезные, и они могут включать:
- болезнь трансплантат против хозяина (GVHD), которая представляет собой состояние, при котором донорские клетки атакуют ваше тело
- отказ трансплантата, который происходит, когда пересаженные клетки не начинают производить новые клетки по плану
- кровотечение в легких, головном мозге и других частях тела
- катаракта, которая характеризуется помутнением хрусталика глаза
- повреждение жизненно важных органов
- ранняя менопауза
- анемия, возникающая при организм не производит достаточно эритроцитов
- инфекции
- тошнота, диарея или рвота
- мукозит, состояние, которое вызывает воспаление и болезненность во рту, горле и желудке
Поговорите со своим врачом о любых проблемах, которые могут у вас возникнуть. Они могут помочь вам сопоставить риски и осложнения с потенциальными преимуществами этой процедуры.
Они могут помочь вам сопоставить риски и осложнения с потенциальными преимуществами этой процедуры.
Существует два основных типа трансплантации костного мозга. Используемый тип будет зависеть от причины, по которой вам нужна пересадка.
Аутологичные трансплантаты
Аутологичные трансплантаты предполагают использование собственных стволовых клеток человека. Обычно они включают сбор ваших клеток перед тем, как начать разрушающую клетки терапию, такую как химиотерапия или облучение. После завершения лечения ваши собственные клетки возвращаются в ваше тело.
Этот тип трансплантата доступен не всегда. Его можно использовать только в том случае, если у вас здоровый костный мозг. Однако это снижает риск некоторых серьезных осложнений, в том числе РТПХ.
Аллогенные трансплантаты
Аллогенные трансплантаты включают использование клеток от донора. Донор должен быть близким по генетике. Часто лучший выбор – совместимый родственник, но генетические совпадения также можно найти в реестре доноров.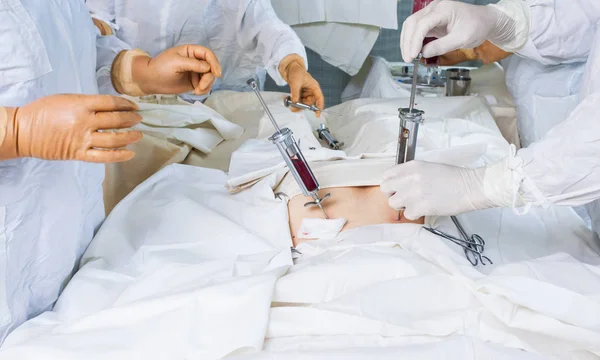
Аллогенная трансплантация необходима, если у вас есть заболевание, при котором повреждены клетки костного мозга.Однако у них выше риск определенных осложнений, таких как РТПХ. Вам также, вероятно, нужно будет прописать лекарств, чтобы подавить вашу иммунную систему, чтобы ваше тело не атаковало новые клетки . Это может сделать вас восприимчивым к болезням.
Успех аллогенной трансплантации зависит от того, насколько близко донорские клетки соответствуют вашим собственным.
Перед трансплантацией вы пройдете несколько тестов, чтобы определить, какой тип клеток костного мозга вам нужен.
Вы также можете пройти лучевую или химиотерапию, чтобы убить все раковые клетки или клетки костного мозга, прежде чем вы получите новые стволовые клетки.
Пересадка костного мозга занимает до недели. Таким образом, вы должны подготовиться к первому сеансу трансплантации. К ним могут относиться:
- жилье рядом с больницей для ваших близких
- страхование, оплата счетов и другие финансовые проблемы
- уход за детьми или домашними животными
- отпуск по болезни с работы
- упаковка одежды и других предметов первой необходимости
- организация поездок в больницу и обратно
Во время лечения ваша иммунная система будет ослаблена, что повлияет на ее способность бороться с инфекциями. Поэтому вы останетесь в специальном отделении больницы, предназначенном для людей, которым делают пересадку костного мозга. Это снижает риск контакта с чем-либо, что может вызвать инфекцию.
Поэтому вы останетесь в специальном отделении больницы, предназначенном для людей, которым делают пересадку костного мозга. Это снижает риск контакта с чем-либо, что может вызвать инфекцию.
Не стесняйтесь брать с собой список вопросов, которые нужно задать своему врачу. Вы можете записать ответы или пригласить друга послушать и сделать заметки. Важно, чтобы вы чувствовали себя комфортно и уверенно перед процедурой и чтобы на все ваши вопросы были даны подробные ответы.
В некоторых больницах есть консультанты, которые могут поговорить с пациентами.Процесс трансплантации может быть эмоционально утомительным. Разговор со специалистом может помочь вам в этом процессе.
Когда ваш врач решит, что вы готовы, вам сделают трансплантацию. Процедура похожа на переливание крови.
Если вам предстоит аллогенная трансплантация, у донора будут взяты клетки костного мозга за день или два до процедуры. Если используются ваши собственные клетки, они будут извлечены из банка стволовых клеток.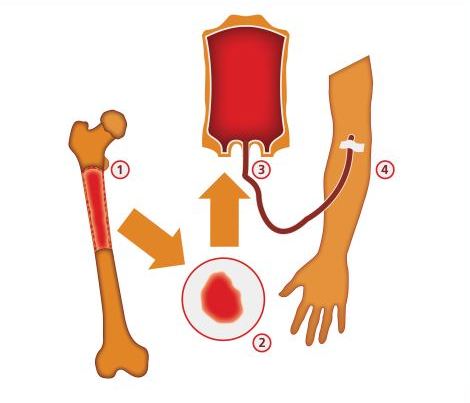
Ячейки собираются двумя способами.
Во время забора костного мозга клетки обеих тазобедренных костей собираются с помощью иглы. Во время этой процедуры вы находитесь под наркозом, а это значит, что вы будете спать без какой-либо боли.
Лейкаферез
Во время лейкафереза донору делают пять инъекций, чтобы помочь стволовым клеткам переместиться из костного мозга в кровоток. Затем кровь берется через внутривенную (IV) линию, и аппарат отделяет лейкоциты, содержащие стволовые клетки.
Игла, называемая центральным венозным катетером или портом, будет установлена в верхней правой части груди.Это позволяет жидкости, содержащей новые стволовые клетки, попадать прямо в ваше сердце. Затем стволовые клетки распространяются по всему телу. Они проходят через вашу кровь в костный мозг. Они там закрепятся и начнут расти.
Порт оставили на месте, потому что трансплантация костного мозга проводится в несколько сеансов в течение нескольких дней. Несколько сеансов дают новым стволовым клеткам лучший шанс интегрироваться в ваше тело. Этот процесс известен как приживление.
Этот процесс известен как приживление.
Через этот порт вы также будете получать кровь, жидкости и, возможно, питательные вещества.Вам могут понадобиться лекарства, чтобы бороться с инфекциями и способствовать росту нового костного мозга. Это зависит от того, насколько хорошо вы справляетесь с лечением.
В течение этого времени вы будете находиться под пристальным наблюдением на предмет возможных осложнений.
Успех трансплантации костного мозга в первую очередь зависит от того, насколько близко донор и реципиент генетически совпадают. Иногда бывает очень сложно найти подходящего партнера среди неродственных доноров.
Состояние вашего приживления будет регулярно контролироваться. Обычно она завершается через 10–28 дней после первичной трансплантации.Первый признак приживления – повышение количества лейкоцитов. Это показывает, что трансплантат начинает производить новые клетки крови.
Типичное время восстановления после трансплантации костного мозга составляет около трех месяцев. Однако полное выздоровление может занять до года. Выздоровление зависит от множества факторов, включая:
Однако полное выздоровление может занять до года. Выздоровление зависит от множества факторов, включая:
- состояние, которое лечат
- химиотерапия
- облучение
- соответствие донора
- место проведения трансплантации
Существует вероятность того, что некоторые из симптомов, которые вы испытываете после трансплантации, останутся с вами на всю оставшуюся жизнь.
Что такое трансплантация костного мозга (пересадка стволовых клеток)?
Трансплантация костного мозга – это лечение, при котором костный мозг заменяется здоровыми клетками. Замещающие клетки могут поступать как от вашего собственного тела, так и от донора.
Трансплантат костного мозга также называется трансплантацией стволовых клеток или, более конкретно, трансплантатом гемопоэтических стволовых клеток. Трансплантация может использоваться для лечения определенных типов рака, таких как лейкемия, миелома и лимфома, а также других заболеваний крови и иммунной системы, которые влияют на костный мозг.
Что такое стволовые клетки? Что такое костный мозг?
Стволовые клетки – это особые клетки, которые могут копировать себя и превращаться во множество различных типов клеток, которые нужны вашему организму. Есть несколько видов стволовых клеток, и они обнаруживаются в разных частях тела в разное время.
Рак и лечение рака могут повредить ваши гемопоэтические стволовые клетки. Гемопоэтические стволовые клетки – это стволовые клетки, которые превращаются в клетки крови.
Костный мозг – это мягкая губчатая ткань в организме, содержащая гемопоэтические стволовые клетки.Он находится в центре большинства костей. Гематопоэтические стволовые клетки также находятся в крови, которая движется по вашему телу.
При повреждении гемопоэтических стволовых клеток они не могут стать эритроцитами, лейкоцитами и тромбоцитами. Эти клетки крови очень важны, и у каждого из них своя работа:
Красные кровяные тельца переносят кислород по всему телу.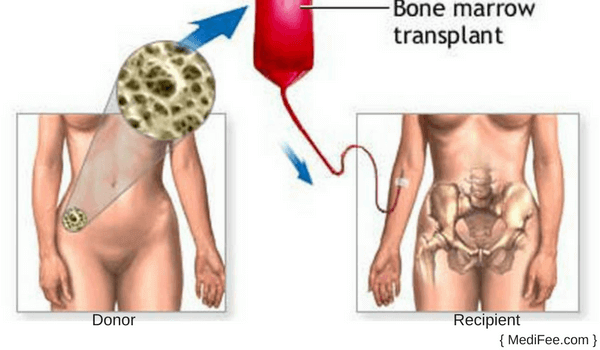 Они также переносят углекислый газ в легкие, чтобы его можно было выдохнуть.
Они также переносят углекислый газ в легкие, чтобы его можно было выдохнуть.
Лейкоциты являются частью вашей иммунной системы.Они борются с патогенами – вирусами и бактериями, вызывающими заболевание.
Тромбоциты образуют сгустки, останавливающие кровотечение.
Трансплантация костного мозга / стволовых клеток – это медицинская процедура, с помощью которой здоровые стволовые клетки трансплантируются в ваш костный мозг или кровь. Это восстанавливает способность вашего тела создавать необходимые ему эритроциты, лейкоциты и тромбоциты.
Какие бывают типы трансплантата?
Существуют разные типы трансплантации костного мозга / стволовых клеток.2 основных типа:
Аутологический трансплантат. Стволовые клетки для аутотрансплантации происходят из вашего собственного тела. Иногда для лечения рака используются высокие дозы интенсивной химиотерапии или лучевой терапии. Этот вид лечения может повредить ваши стволовые клетки и вашу иммунную систему. Вот почему врачи удаляют или спасают ваши стволовые клетки из крови или костного мозга до начала лечения рака.
Вот почему врачи удаляют или спасают ваши стволовые клетки из крови или костного мозга до начала лечения рака.
После химиотерапии стволовые клетки возвращаются в ваше тело, восстанавливая вашу иммунную систему и способность вашего тела вырабатывать клетки крови и бороться с инфекцией.Этот процесс также называется АВТО-трансплантацией или спасением стволовых клеток.
Аллогенный трансплантат. Стволовые клетки для аллогенной трансплантации поступают от другого человека, называемого донором. Донорские стволовые клетки вводятся пациенту после химиотерапии и / или лучевой терапии. Это также называется трансплантацией ALLO.
У многих людей наблюдается «эффект трансплантата против раковых клеток» во время трансплантации ALLO. Это когда новые стволовые клетки распознают и уничтожают раковые клетки, которые все еще находятся в организме.Это основной способ, которым трансплантаты ALLO работают при лечении рака.
Поиск «подходящего донора» – необходимый шаг для трансплантации ALLO. Партнер – это здоровый донор, чьи белки крови, называемые человеческими лейкоцитарными антигенами (HLA), очень похожи на ваши. Этот процесс называется HLA-типизацией. Братья и сестры от одних и тех же родителей часто лучше всего подходят, но другой член семьи или посторонний волонтер тоже могут подойти. Если белки вашего донора очень похожи на ваши, у вас меньше шансов получить серьезный побочный эффект, называемый болезнью трансплантата против хозяина (GVHD).В этом состоянии здоровые клетки трансплантата атакуют ваши клетки.
Партнер – это здоровый донор, чьи белки крови, называемые человеческими лейкоцитарными антигенами (HLA), очень похожи на ваши. Этот процесс называется HLA-типизацией. Братья и сестры от одних и тех же родителей часто лучше всего подходят, но другой член семьи или посторонний волонтер тоже могут подойти. Если белки вашего донора очень похожи на ваши, у вас меньше шансов получить серьезный побочный эффект, называемый болезнью трансплантата против хозяина (GVHD).В этом состоянии здоровые клетки трансплантата атакуют ваши клетки.
Если ваша медицинская бригада не может найти подходящего донора, есть другие варианты.
Пересадка пуповинной крови. В этом типе трансплантата используются стволовые клетки из пуповинной крови. Пуповина соединяет плод с матерью еще до рождения. После рождения малышу это не нужно. Онкологические центры по всему миру используют пуповинную кровь. Узнайте больше о трансплантации пуповинной крови.
Трансплантат родитель-ребенок и трансплантат несовпадения гаплотипов. Клетки от родителя, ребенка, брата или сестры не всегда идеально подходят для HLA-типа пациента, но они соответствуют 50%. Врачи чаще используют эти типы трансплантатов, чтобы расширить использование трансплантации в качестве эффективного метода лечения рака.
Клетки от родителя, ребенка, брата или сестры не всегда идеально подходят для HLA-типа пациента, но они соответствуют 50%. Врачи чаще используют эти типы трансплантатов, чтобы расширить использование трансплантации в качестве эффективного метода лечения рака.
Как работает трансплантация костного мозга / стволовых клеток?
Информация ниже расскажет вам об основных этапах трансплантации AUTO и ALLO. Как правило, каждый процесс включает в себя сбор замещающих стволовых клеток, лечение пациента для подготовки своего тела к трансплантации, фактический день трансплантации и затем период восстановления.
Часто в грудную клетку пациента может быть вставлена небольшая трубка, которая остается в процессе трансплантации. Он называется катетером. Ваша медицинская бригада может назначить вам химиотерапию, другие лекарства и переливание крови через катетер. Катетер значительно уменьшает количество игл, используемых в коже, так как пациенты будут нуждаться в регулярных анализах крови и других методах лечения во время трансплантации.
Обратите внимание, что трансплантация – это сложная медицинская процедура, и иногда определенные шаги могут происходить в другом порядке или по другому графику, чтобы персонализировать ваш конкретный уход.Спросите у своего врача, нужно ли вам находиться в больнице для разных этапов, и если да, то как долго. Всегда обсуждайте со своим лечащим врачом, чего ожидать до, во время и после трансплантации.
Как работает АВТОПЕРЕСАДКА?
Шаг 1. Сбор стволовых клеток. Этот шаг занимает несколько дней. Сначала вам сделают инъекции (уколы) лекарства для увеличения количества стволовых клеток. Затем ваша медицинская бригада собирает стволовые клетки через вену на руке или груди.Ячейки будут храниться до тех пор, пока они не понадобятся.
Шаг 2: Лечение перед трансплантацией. Этот шаг занимает от 5 до 10 дней. Вы получите большую дозу химиотерапии. Иногда пациенты проходят лучевую терапию.
Шаг 3. Возвращение стволовых клеток.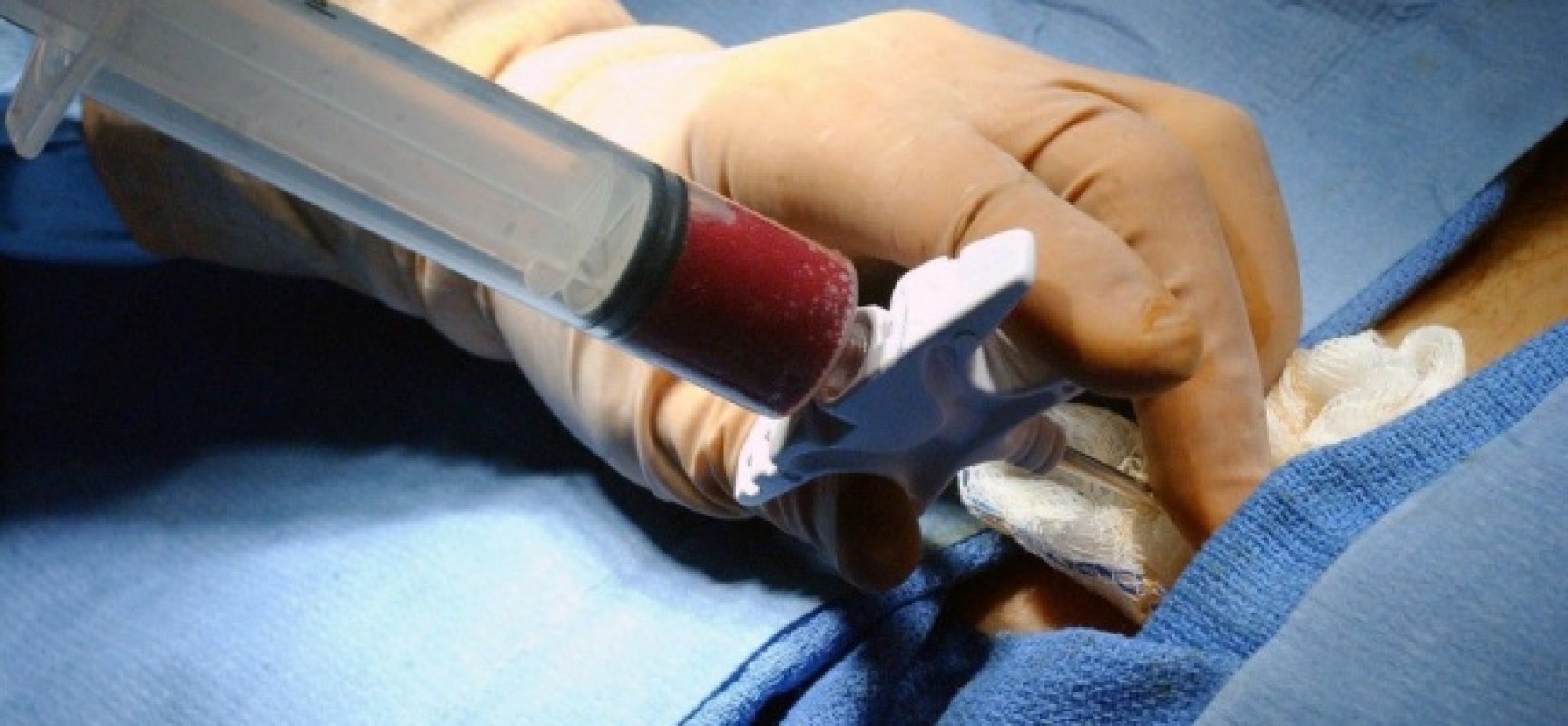 Этот шаг – ваш день трансплантации. На каждую дозу стволовых клеток уходит около 30 минут. Это называется настоем. Ваша медицинская бригада возвращает стволовые клетки в кровоток через катетер.У вас может быть более одной инфузии.
Этот шаг – ваш день трансплантации. На каждую дозу стволовых клеток уходит около 30 минут. Это называется настоем. Ваша медицинская бригада возвращает стволовые клетки в кровоток через катетер.У вас может быть более одной инфузии.
Шаг 4: Восстановление. Ваш врач будет внимательно следить за восстановлением и ростом ваших клеток, и вы будете принимать антибиотики, чтобы уменьшить инфекцию. Ваша медицинская бригада также будет лечить любые побочные эффекты. Подробнее о восстановлении после трансплантации костного мозга читайте ниже.
Как работает трансплантат ALLO?
Шаг 1: Идентификация донора. Соответствующий донор должен быть найден до начала процесса трансплантации ALLO.Ваш тип HLA будет определен с помощью анализа крови. Затем ваша медицинская бригада будет работать с вами для проведения HLA-тестирования потенциальных доноров в вашей семье и, при необходимости, для поиска добровольцев в реестре неродственных доноров.
Шаг 2: Забор стволовых клеток у донора. Ваша медицинская бригада соберет клетки либо из крови вашего донора, либо из костного мозга. Если клетки поступают из кровотока, ваш донор будет получать ежедневные инъекции (уколы) лекарства для увеличения количества лейкоцитов в крови в течение нескольких дней перед забором.Затем стволовые клетки собираются из их кровотока. Если клетки поступают из костного мозга, у вашего донора есть процедура, называемая забором костного мозга, в операционной больницы.
Шаг 3: Лечение перед трансплантацией. Этот шаг занимает от 5 до 7 дней. Вы пройдете курс химиотерапии с лучевой терапией или без нее, чтобы подготовить свое тело к приему донорских клеток.
Шаг 4: Получение донорских клеток. Этот шаг – ваш день трансплантации. Ваша медицинская бригада вводит или вводит донорские стволовые клетки в ваш кровоток через катетер.Получение донорских клеток обычно занимает менее часа.
Шаг 5: Восстановление. Во время первоначального выздоровления вы будете получать антибиотики для снижения риска заражения и другие лекарства, включая лекарства для предотвращения и / или лечения РТПХ. Ваша медицинская бригада также будет лечить любые побочные эффекты от трансплантации. Подробнее о восстановлении трансплантата костного мозга читайте ниже.
Как проходит восстановление после трансплантации костного мозга?
Восстановление после трансплантации костного мозга / стволовых клеток занимает много времени.Восстановление часто проходит в несколько этапов, начиная с интенсивного медицинского наблюдения после дня трансплантации. По мере того, как ваше долгосрочное выздоровление продвигается вперед, вы в конечном итоге перейдете на график регулярных медицинских осмотров в ближайшие месяцы и годы.
В начальный период восстановления важно следить за признаками инфекции. Интенсивное химиотерапевтическое лечение, которое вы получите перед трансплантацией, также повредит вашу иммунную систему. Это сделано для того, чтобы ваше тело могло принять трансплантат, не атакуя стволовые клетки.Требуется время, чтобы ваша иммунная система снова заработала после трансплантации. Это означает, что у вас больше шансов заразиться сразу после трансплантации.
Это сделано для того, чтобы ваше тело могло принять трансплантат, не атакуя стволовые клетки.Требуется время, чтобы ваша иммунная система снова заработала после трансплантации. Это означает, что у вас больше шансов заразиться сразу после трансплантации.
Чтобы снизить риск заражения, вам будут назначать антибиотики и другие лекарства. Если вам сделали трансплантацию ALLO, в ваши лекарства будут входить лекарства для профилактики и / или лечения РТПХ. Следуйте рекомендациям вашей медицинской бригады о том, как предотвратить заражение сразу после трансплантации.
Инфекция может развиться после трансплантации костного мозга, даже если вы будете очень осторожны.Ваш врач будет внимательно следить за вами на предмет признаков инфекции. Вам будут регулярно сдавать анализы крови и другие анализы, чтобы увидеть, как ваше тело и иммунная система реагируют на донорские клетки. Вы также можете сделать переливание крови через катетер.
Ваша медицинская бригада также разработает долгосрочный план восстановления, чтобы отслеживать поздние побочные эффекты, которые могут произойти через много месяцев после трансплантации.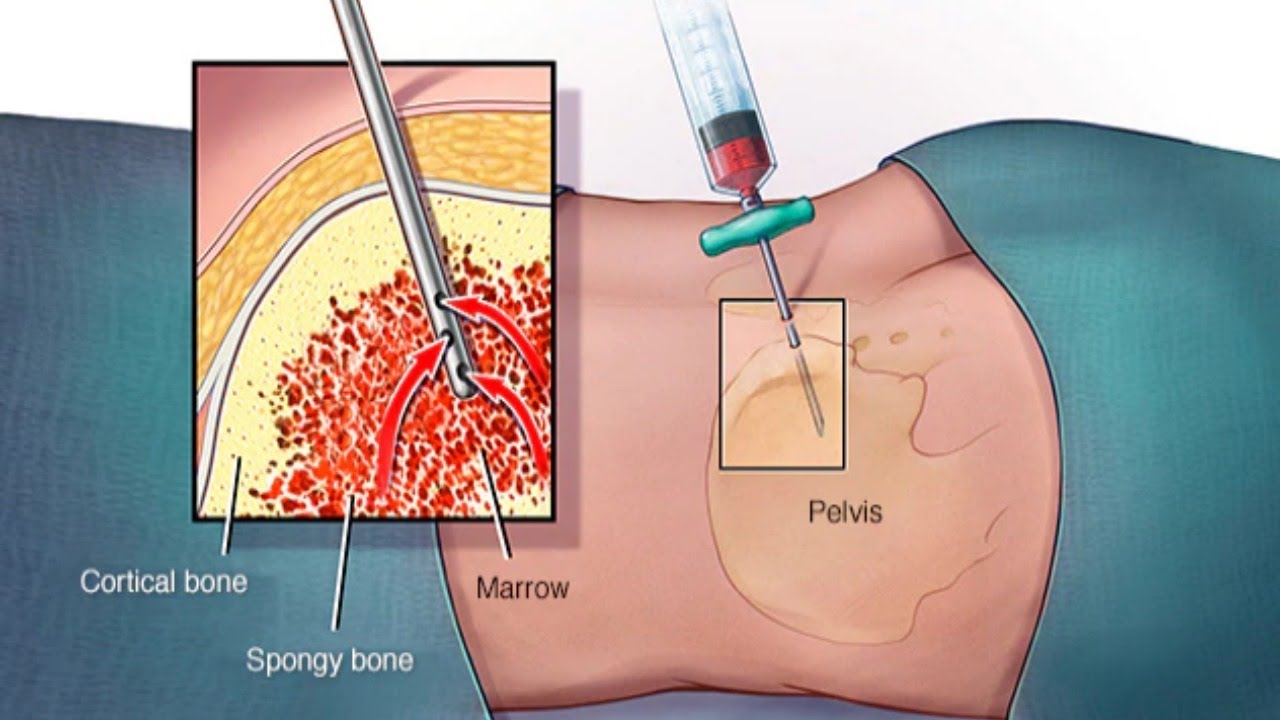 Узнайте больше о возможных побочных эффектах трансплантации костного мозга.
Узнайте больше о возможных побочных эффектах трансплантации костного мозга.
Что следует учитывать перед пересадкой
Ваш врач порекомендует вам лучший вариант трансплантации.Ваши варианты зависят от конкретного диагностированного заболевания, состояния вашего костного мозга, вашего возраста и общего состояния здоровья. Например, если у вас рак или другое заболевание костного мозга, вам, вероятно, сделают трансплантацию ALLO, потому что замещающие стволовые клетки должны поступать от здорового донора.
Перед трансплантацией вам может потребоваться поездка в центр, где проводится много операций по пересадке стволовых клеток. Вашему врачу, возможно, тоже придется пойти. В центре вы поговорите со специалистом по трансплантологии, пройдете медицинское обследование и проведете различные анализы.
Пересадка потребует много времени на получение медицинской помощи вдали от повседневной жизни. Лучше всего иметь с собой семейного опекуна. К тому же пересадка – это дорогостоящий медицинский процесс. Обсудите эти вопросы со своим лечащим врачом и своими близкими:
Обсудите эти вопросы со своим лечащим врачом и своими близкими:
Можете ли вы описать роль опекуна моей семьи в уходе за мной?
Как долго я и мой опекун будут вдали от работы и семейных обязанностей?
Нужно ли мне оставаться в больнице? Если да, то когда и как долго?
Будет ли моя страховка оплатить эту трансплантацию? Каково мое страховое покрытие для последующего лечения?
Как долго мне будут нужны медицинские анализы во время выздоровления?
Как узнать, подействовала ли трансплантат?
Успешная трансплантация может означать разные вещи для вас, вашей семьи и вашей медицинской бригады.Вот два способа узнать, хорошо ли сработала трансплантация.
Показатели крови вернулись к безопасному уровню. Анализ крови измеряет уровни эритроцитов, лейкоцитов и тромбоцитов в вашей крови. Сначала трансплантат делает эти цифры очень низкими в течение 1-2 недель. Это влияет на вашу иммунную систему и подвергает вас риску инфекций, кровотечений и усталости. Ваша медицинская бригада снизит эти риски, сделав переливание крови и тромбоцитов. Вы также будете принимать антибиотики, чтобы предотвратить инфекции.
Это влияет на вашу иммунную систему и подвергает вас риску инфекций, кровотечений и усталости. Ваша медицинская бригада снизит эти риски, сделав переливание крови и тромбоцитов. Вы также будете принимать антибиотики, чтобы предотвратить инфекции.
Когда новые стволовые клетки размножаются, они производят больше клеток крови. Тогда ваши показатели крови снова поднимутся. Это один из способов узнать, удалась ли трансплантация.
Ваш рак под контролем. Излечение рака часто является целью трансплантации костного мозга / стволовых клеток. Некоторые виды рака, например, лейкемии и лимфомы, могут излечиться. При других заболеваниях наилучшим результатом является ремиссия рака. Ремиссия – это отсутствие признаков или симптомов рака.
Как уже говорилось выше, после трансплантации вам необходимо регулярно посещать врача и сдавать анализы. Это необходимо для наблюдения за любыми признаками рака или осложнений после трансплантации, а также для оказания помощи при любых побочных эффектах, которые вы испытываете.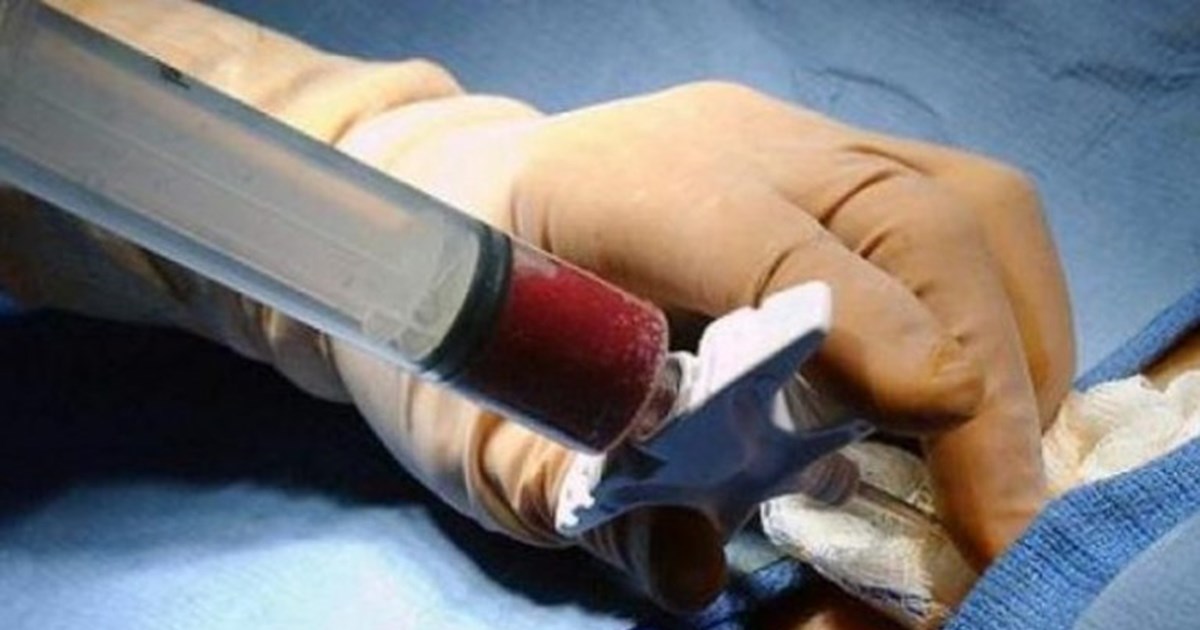 Последующий уход – важная часть вашего выздоровления.
Последующий уход – важная часть вашего выздоровления.
Вопросы, которые следует задать бригаде здравоохранения
Важно часто разговаривать со своим лечащим врачом до, во время и после трансплантации. Вам предлагается собирать информацию, задавать вопросы и тесно сотрудничать с вашей медицинской бригадой при принятии решений о вашем лечении и уходе.В дополнение к приведенному выше списку можно задать еще несколько вопросов. Обязательно задайте любой вопрос, который у вас на уме.
Какой тип трансплантата вы бы порекомендовали? Почему?
Если мне сделают трансплантат ALLO, как мы найдем донора? Каков шанс найти хороший матч?
Какое лечение я буду проходить перед трансплантацией?
Сколько времени займет мое предтрансплантационное лечение? Где будет проходить это лечение?
Вы можете описать, на что будет похож мой день трансплантации?
Как трансплантат повлияет на мою жизнь? Могу ли я работать, заниматься спортом и заниматься обычными делами?
Какие побочные эффекты могут возникнуть во время лечения или сразу после него?
Какие побочные эффекты могут появиться спустя годы?
Какие анализы мне понадобятся после трансплантации? Как часто?
С кем я могу поговорить, если меня беспокоит стоимость?
Как мы узнаем, сработала ли трансплантация?
Что делать, если трансплантат не работает? Что, если рак вернется?
Связанные ресурсы
Побочные эффекты трансплантата костного мозга (трансплантация стволовых клеток)
Аспирация и биопсия костного мозга
Донорство костного мозга – это просто и важно: вот почему
Пересадка костного мозга и пожилые люди: 3 важных вопроса
Дополнительная информация
Be the Match: О трансплантате
Be the Match: Национальная программа донорства костного мозга
Информационная сеть по трансплантации крови и костного мозга (BMT InfoNet)
Национальная ссылка по трансплантации костного мозга (nbmtLINK)
U. S. Департамент здравоохранения и социальных служб: узнайте о трансплантации как варианте лечения
S. Департамент здравоохранения и социальных служб: узнайте о трансплантации как варианте лечения
Побочные эффекты трансплантации костного мозга (трансплантация стволовых клеток)
Трансплантация костного мозга, также называемая трансплантацией стволовых клеток, представляет собой лечение, при котором костный мозг заменяется здоровыми клетками. Трансплантация применяется при некоторых видах рака и других заболеваниях костного мозга. Как и любое лечение рака, он может вызывать побочные эффекты. Они у всех разные. Они зависят от типа трансплантата, вашего общего состояния здоровья и других факторов.
Многие побочные эффекты проходят со временем, но некоторые могут быть постоянными. Перед тем, как начать процесс трансплантации, рекомендуется поговорить со своим лечащим врачом обо всех возможных побочных эффектах.
Устранение побочных эффектов – важная часть лечения и лечения рака. Этот вид ухода называется паллиативным или поддерживающим лечением. Поговорите со своим лечащим врачом о любых симптомах, которые испытываете вы или человек, за которым вы ухаживаете.
Каковы побочные эффекты аутотрансплантата?
Трансплантация аутологичных стволовых клеток также называется АУТО-трансплантацией или спасением стволовых клеток.При автоматической трансплантации в качестве замещающих клеток используются ваши собственные стволовые клетки. Врач вернет их вам после химиотерапии, с лучевой терапией или без нее. Многие побочные эффекты трансплантации AUTO аналогичны побочным эффектам химиотерапии и побочным эффектам лучевой терапии. Самый серьезный побочный эффект – повышенный риск заражения из-за низкого уровня лейкоцитов в вашем организме.
Инфекции
Химиотерапия и некоторые другие методы лечения ослабляют систему борьбы с инфекциями, называемую иммунной системой.Это особенно верно при лечении трансплантации костного мозга / стволовых клеток, потому что костный мозг является частью иммунной системы. Когда ваша иммунная система ослаблена, ваше тело не может защитить себя от микробов. Большинство этих микробов уже живут в вашем теле. Когда ваша иммунная система сильна, эти микробы не вызывают у вас болезни. Но после пересадки они могут вызвать инфекцию.
Когда ваша иммунная система сильна, эти микробы не вызывают у вас болезни. Но после пересадки они могут вызвать инфекцию.
К счастью, большинство этих инфекций довольно легко вылечить антибиотиками. Примерно через 2 недели после дня трансплантации клетки иммунной системы, называемые нейтрофилами, начнут восстанавливаться.Нейтрофилы не дают вам заболеть некоторыми обычными микробами.
У вас самый высокий риск инфекций в первые несколько недель после трансплантации. Однако вашей иммунной системе может потребоваться много времени для восстановления после трансплантации. Возможно, вам придется принимать лекарства для борьбы с инфекцией в течение года или более после трансплантации костного мозга / стволовых клеток. Ваша медицинская бригада обсудит с вами способы снизить риск заражения, приняв меры предосторожности во время вашего выздоровления. Узнайте больше об инфекциях как побочном эффекте лечения рака.
Другие немедленные побочные эффекты
Следующие побочные эффекты могут развиться сразу после применения высоких доз химиотерапии при АВТО трансплантации.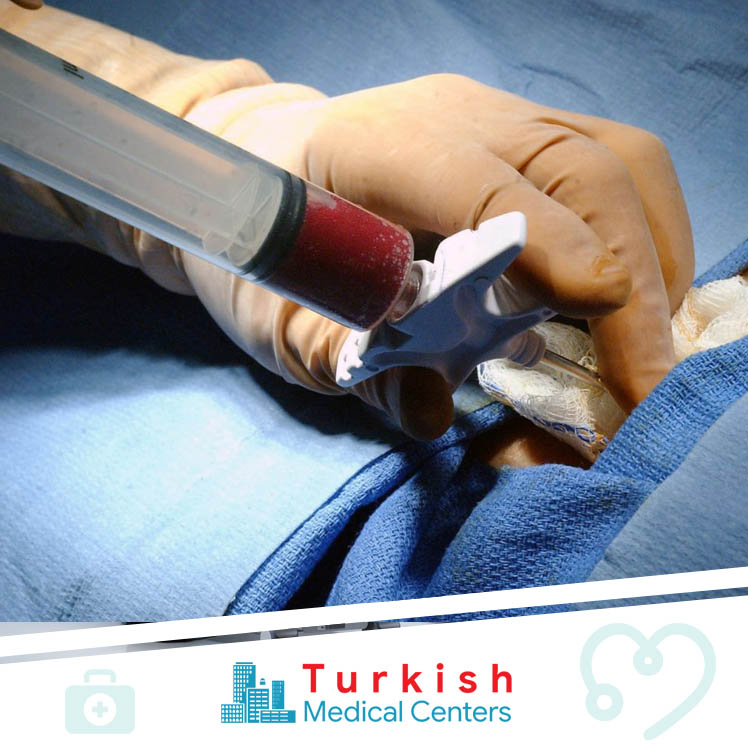
Долгосрочные побочные эффекты
Некоторые побочные эффекты при трансплантации возникают спустя месяцы или годы. Сюда могут входить:
Побочные эффекты от трансплантата ALLO
Аллогенный трансплантат также называют трансплантатом ALLO. При трансплантации ALLO замещающие клетки поступают от другого человека, называемого донором.Вам нужно пройти химиотерапию, а иногда и лучевую терапию, чтобы подготовить свое тело к приему здоровых донорских клеток. Побочные эффекты трансплантата ALLO также похожи на побочные эффекты химиотерапии и побочные эффекты лучевой терапии. Это включает в себя высокий риск инфекций. Кроме того, у вас могут возникнуть побочные эффекты от приема стволовых клеток другого человека, включая более высокий риск заражения и риск болезни «трансплантат против хозяина» (GVHD).
У многих людей наблюдается «эффект трансплантата против раковых клеток» наряду с РТПХ.Это потому, что новые стволовые клетки распознают и уничтожают раковые клетки, которые все еще находятся в организме.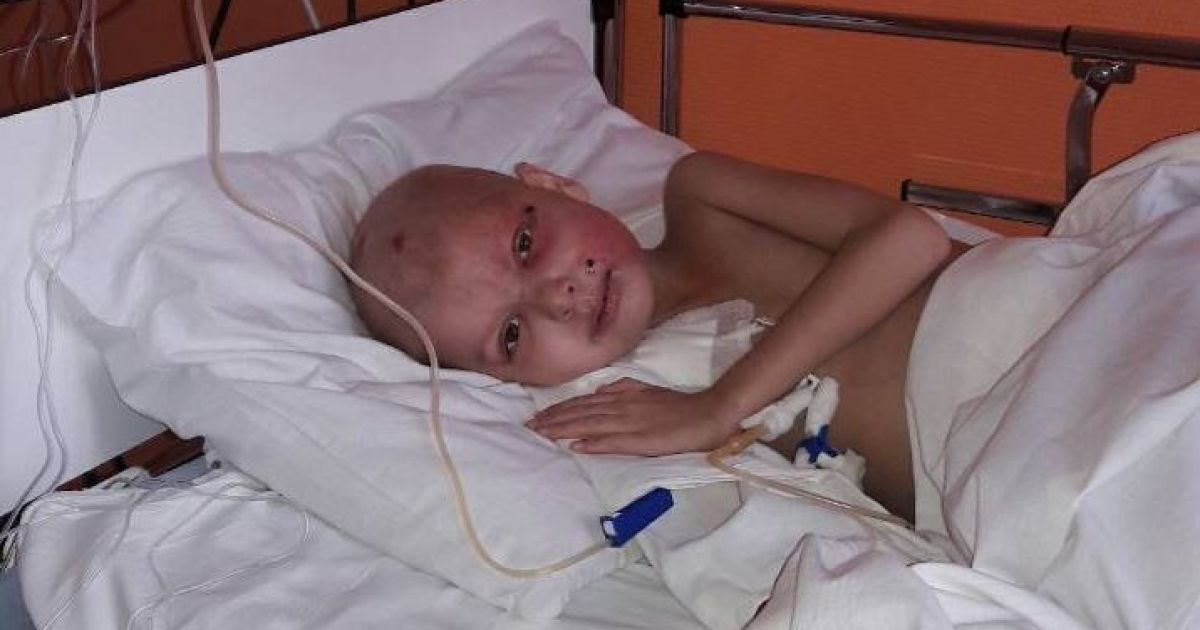 Это основной способ, которым трансплантаты ALLO работают для лечения рака, такого как лейкемия.
Это основной способ, которым трансплантаты ALLO работают для лечения рака, такого как лейкемия.
Инфекция
Когда вам сделают трансплантацию ALLO, ваш врач назначит вам химиотерапию, с лучевой терапией или без нее или без нее, или с другими лекарствами, чтобы иммунная система вашего организма не разрушала новые клетки. Эти методы лечения влияют на вашу иммунную систему и повышают риск заражения. Слабая иммунная система увеличивает вероятность заражения инфекциями.
Вы будете подвергаться наибольшему риску заражения в первые несколько недель после получения донорских клеток. Этот риск со временем уменьшится, но снижение риска инфицирования является важной частью долгосрочного выздоровления пациента.
Болезнь трансплантат против хозяина
РТПХ происходит, если донорские стволовые клетки атакуют ваш организм, вызывая воспаление. Даже если ваш донор был на 100% подходящим, вы все равно можете заразиться РТПХ. Ваша медицинская бригада может дать вам лекарство от РТПХ. Если вы все еще испытываете РТПХ, ваш врач назначит вам дополнительные лекарства для лечения этого состояния.В некоторых случаях РТПХ может быть опасной для жизни.
Если вы все еще испытываете РТПХ, ваш врач назначит вам дополнительные лекарства для лечения этого состояния.В некоторых случаях РТПХ может быть опасной для жизни.
Существует 2 типа РТПХ: острая и хроническая. Оба могут варьироваться от легкой до тяжелой.
Острая РТПХ
Эта форма РТПХ возникает довольно быстро, в первые 3 месяца после трансплантации ALLO. Часто поражает кожу, кишечник и печень. Это может вызвать сыпь, диарею и желтуху. Желтуха – это проблема с печенью, из-за которой ваша кожа и белки глаз выглядят желтыми.
Лечение РТПХ – это лекарство, блокирующее Т-лимфоциты.Т-клетки – это белые кровяные тельца, которые помогают иммунной системе бороться с инфекциями. Их блокирование не дает вашей пересаженной иммунной системе атаковать собственные клетки вашего тела.
Хроническая РТПХ
Хроническая РТПХ обычно развивается более чем через 3 месяца после трансплантации ALLO. Это может длиться несколько месяцев или всю оставшуюся жизнь.
Хроническая РТПХ может вызывать или не вызывать симптомы или нуждаться в лечении. Или вам может потребоваться лечение определенных проблем. Например, у вас могут быть сухие глаза и сухость во рту.Ваша печень может быть слегка раздражена. Или у вас могут быть другие заболевания, например, кожа теряет способность растягиваться. Это состояние называется склеродермией. Другие проблемы могут включать боли в суставах и мышцах, потерю веса, инфекции и затрудненное дыхание.
Хроническую РТПХ можно лечить препаратами, называемыми кортикостероидами. Если это не поможет, вы можете принять другие лекарства, чтобы снизить активность вашей иммунной системы.
Другие немедленные побочные эффекты
Следующие побочные эффекты могут развиться сразу после применения высоких доз химиотерапии при трансплантации ALLO.
Долгосрочные побочные эффекты
Некоторые побочные эффекты при трансплантации возникают спустя месяцы или годы. Сюда могут входить:
У вас может быть меньше долгосрочных побочных эффектов, если химиотерапия перед трансплантацией будет менее интенсивной. Люди, которые проходят менее мощную химиотерапию, обычно имеют меньше долгосрочных эффектов.
Люди, которые проходят менее мощную химиотерапию, обычно имеют меньше долгосрочных эффектов.
Поговорите со своим лечащим врачом о возможных побочных эффектах трансплантации стволовых клеток. Они могут помочь ответить на ваши вопросы и составить план борьбы с побочными эффектами.
Вопросы, которые следует задать бригаде здравоохранения
Важно часто обсуждать со своим лечащим врачом побочные эффекты до, во время и после трансплантации. Это поможет вам собрать информацию и принять решение о лечении и уходе. Вот несколько возможных вопросов.
Буду ли я сдавать анализы до начала процесса трансплантации, чтобы проверить мое общее состояние здоровья? Если да, то какие именно тесты?
Когда я могу начать испытывать побочные эффекты во время этого процесса?
Какие специфические побочные эффекты характерны для этого типа трансплантата? Как с ними справиться или избавиться от них?
Кому мне позвонить, если у меня возникнут побочные эффекты после трансплантации?
На какие признаки инфекции следует обращать внимание?
Какие меры предосторожности мне следует соблюдать для предотвращения заражения? Как долго?
О каких побочных эффектах я должен сразу сообщить моей медицинской бригаде?
Если мне сделают трансплантацию ALLO, буду ли я принимать какие-либо лекарства для предотвращения РТПХ?
Если мне сделают трансплантацию ALLO, на какие признаки РТПХ мне следует обратить внимание?
Какие тесты мне понадобятся позже? Как часто?
Каковы возможные отдаленные последствия трансплантации? Как с ними справиться или избавиться от них?
Как трансплантация повлияет на мою повседневную жизнь? Могу я работать? Могу ли я заниматься спортом и заниматься регулярно? Или, когда я могу возобновить эти действия во время восстановления?
Повлияет ли трансплантация на мою половую жизнь? Если да, то как и как долго?
Повлияет ли эта трансплантация на мою способность иметь ребенка в будущем? Если да, следует ли мне поговорить со специалистом по репродуктологии перед началом лечения?
Связанные ресурсы
Что такое трансплантация костного мозга (трансплантация стволовых клеток)?
Физические, эмоциональные и социальные последствия рака
Как справиться со страхом побочных эффектов, связанных с лечением
Выживание
Дополнительная информация
Be the Match: О трансплантате
Будь на высоте: жизнь после трансплантации
BMT InfoNet: основы трансплантации
Национальная ссылка по трансплантации костного мозга: публикации о побочных эффектах и выживаемости
Пересадка костного мозга при иммунодефиците и генетических нарушениях
Большинство первичных иммунодефицитов (ВЗОМТ) возникает в результате генетических мутаций, нарушающих формирование, функцию или регуляцию клеточного компонента иммунной системы.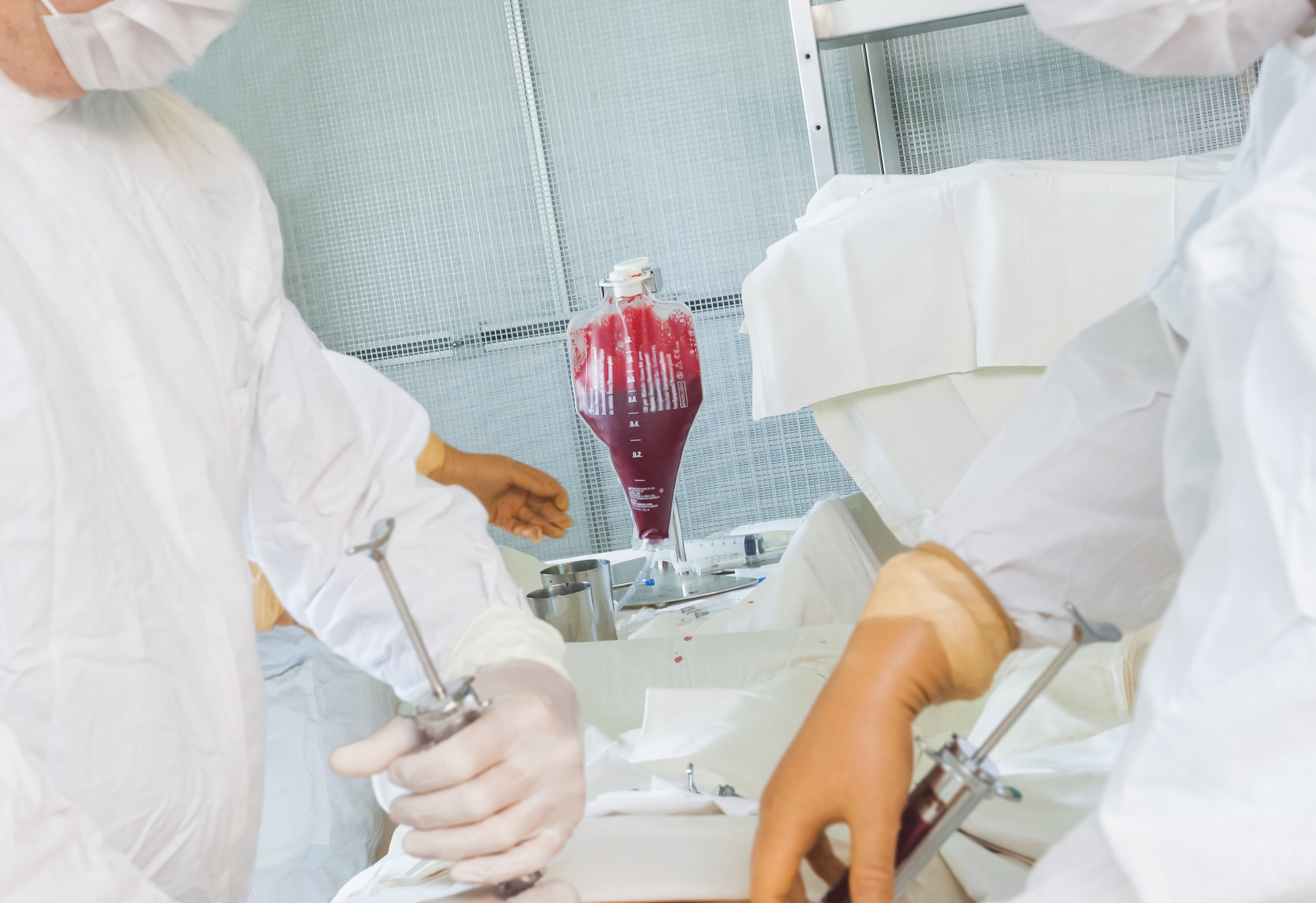 Поскольку иммунные клетки возникают из стволовых клеток костного мозга, трансплантация костного мозга является потенциально эффективным вариантом лечения этих состояний. Подходящий брат-донор оптимален, но не обязателен; Успешные трансплантации при иммунодефиците были выполнены с использованием костного мозга от гаплоидентичных доноров (родственников, у которых у пациента есть только один гаплотип HLA) и костного мозга или пуповинной крови от неродственных доноров.
Поскольку иммунные клетки возникают из стволовых клеток костного мозга, трансплантация костного мозга является потенциально эффективным вариантом лечения этих состояний. Подходящий брат-донор оптимален, но не обязателен; Успешные трансплантации при иммунодефиците были выполнены с использованием костного мозга от гаплоидентичных доноров (родственников, у которых у пациента есть только один гаплотип HLA) и костного мозга или пуповинной крови от неродственных доноров.
Большинство наследственных заболеваний иммунной системы связаны с потерей функции, поэтому, как правило, нет необходимости устранять гемопоэз хозяина для лечения этих заболеваний.Выбор времени имеет решающее значение для пациентов с тяжелым комбинированным иммунодефицитом (ТКИД), перенесших трансплантацию костного мозга (ТКМ), при этом пациенты, пересаженные новорожденным до развития серьезных инфекций, имеют значительно лучший прогноз. Это оправдание программ скрининга новорожденных для выявления этих редких заболеваний, которые возникают в результате широкого спектра генных дефектов. Крайне важно проводить скрининг новорожденных с семейным анамнезом наследственного иммунодефицита, и это важно учитывать тем, у кого в семейном анамнезе есть ранняя детская смерть.
Крайне важно проводить скрининг новорожденных с семейным анамнезом наследственного иммунодефицита, и это важно учитывать тем, у кого в семейном анамнезе есть ранняя детская смерть.
Ранняя диагностика ВЗОМТ имеет важное значение для предотвращения заражения приобретенными инфекциями, которые могут оказаться фатальными или ухудшить возможность лечения с помощью трансплантации костного мозга. Направление для оценки и идентификации потенциальных доноров BMT должно происходить во время диагностики ВЗОМТ.
Начало антимикробного надзора за конкретным заболеванием и эмпирическая профилактика (триметоприм-сульфаметоксазол, ВВИГ [внутривенный иммуноглобулин], G-CSF [гранулоцитарный колониестимулирующий фактор] имеют важное значение.Следует продолжать агрессивное лечение активных инфекций в перитрансплантационный период, включая поддержку, такую как переливание гранулоцитов, если показано.
Неспособность развиваться (FTT) является наиболее частым симптомом ТКИД, и, хотя он неспецифичен, всегда должен запускать скрининг на врожденный иммунодефицит.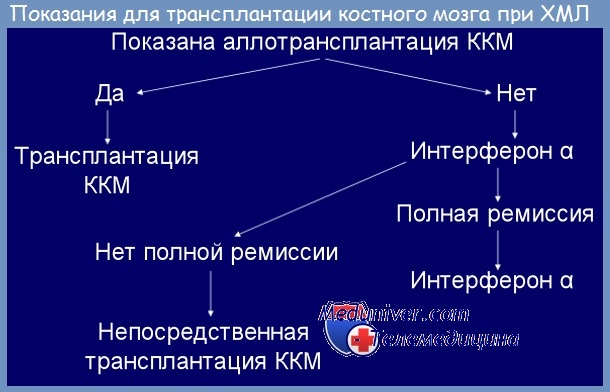
Хроническая диарея обычно сопровождает FTT и возникает в результате неспособности очистить организм от микроорганизмов, которые вызывают незначительные, самостоятельно купирующиеся инфекции у нормальных хозяев.
Пневмонит, хотя и менее распространенный, представляет собой поразительное открытие, позволяющее немедленно распознать иммунодефицит.
Стойкий молочница – это обычное проявление, которое может быть связано с другими причинами, такими как прием антибиотиков или гипергликемия, но может отражать дисфункцию Т-клеток.
Рецидивирующие бактериальные инфекции – это обычное неспецифическое проявление иммунодефицита, которое становится убедительным, если у пациента отсутствуют реактивные лимфатические узлы или ткань миндалин или если результаты общего анализа крови (общий анализ крови) отклоняются от нормы.
Болезнь трансплантат против хозяина может возникать у младенцев с ТКИН, которым не была проведена трансплантация костного мозга, из-за приживления материнских Т-клеток после переливания крови матери и плода. Характерная сыпь – очень поразительное открытие, за которым следует проводить биопсию кожи, анализ крови на химеризм Т-клеток и тесты иммунной функции.
Характерная сыпь – очень поразительное открытие, за которым следует проводить биопсию кожи, анализ крови на химеризм Т-клеток и тесты иммунной функции.
Тяжелая экзема является признаком иммунодисрегуляции, полиэндокринопатии и энтеропатии, Х-сцепленного синдрома (IPEX), синдрома Оменна и других дефектов иммунной регуляции.
Положительный семейный анамнез иммунодефицита, аутоиммунитета или смерти в раннем детстве должен вызывать подозрение, даже если симптомы неспецифичны.
Самые простые скрининговые тесты – это общий анализ крови с дифференциальным и иммуноглобулиновым профилем.
Общий анализ крови может выявить лимфопению при SCID, лимфоцитоз при аутоиммунном лимфопролиферативном синдроме (ALPS) или Х-сцепленный лимфопролиферативный синдром (XLP), тромбоцитопению при синдроме Вискотта-Олдрича (WAS), нейтропению при тяжелой врожденной нейтропении дефицит адгезии (LAD).
Профиль иммуноглобулина может выявить гипогаммаглобулинемию при SCID, низкий уровень Ig (иммуноглобулин) M и высокий уровень IgA при WAS или высокий уровень IgM без IgG при синдроме гипер-IgM.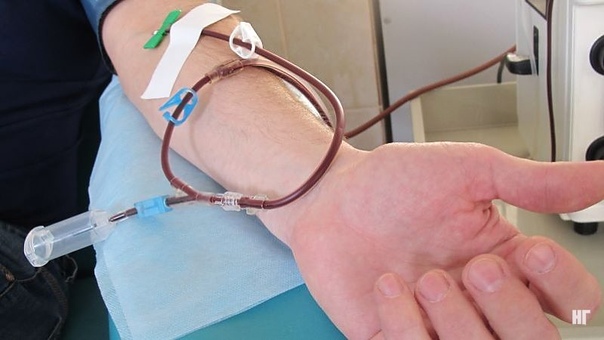
Проточная цитометрия важна для оценки Т-, В- и NK-клеток (естественных киллеров), а также субпопуляций Т-клеток. Функциональные анализы включают митоген и стимулированную антигеном пролиферацию лимфоцитов, оценку специфических ответов вакцины (включая ответы на неоантиген, такой как вирус фага), цитотоксичность NK и анализы окислительного взрыва NBT (нитросинего тетразолия). Может быть доступно генетическое тестирование для конкретных состояний, лечатся BMT. Гены, связанные с конкретными PID, показаны в таблице I.
Обнаружение материнских лимфоцитов в крови является патогномоничным для SCID.
Таблица I.
| Болезнь | Ген (ы) | Наследование | Клеточный фенотип | Особенности | Не-BMT Rx | Рекомендации по подготовительному режиму |
|---|---|---|---|---|---|---|
| Тяжелый комбинированный иммунодефицит | Общая гамма-цепь цитокинового рецептора (IL2RG) | XLR | Т-Б + НК- | |||
| JAK3 | AR | Т-Б + НК- | ||||
| IL7R | AR | Т-Б + НК + | ||||
| Аденозиндезаминаза (ADA) | AR | Т-Б-НК- | Замена ПЭГ-АДА | |||
| CD45 (PTPRC) | AR | Т-Б + НК- | ||||
| RAG1 / RAG2 | AR | Т-Б-НК + | ||||
| субъединицы Т-клеточного рецептора CD3D / CD3E / CD247 / CD3G | AR | Т-Б + НК + | ||||
| Артемида (DCLRE1C) | AR | Т-Б-НК + | Лимфома ВЭБ | Чувствительность к излучению | ||
| ДНК-лигаза IV (LIG4) | AR | Т-Б-НК + | Микроцефалия ВЭБ-лимфома T-ALL | Чувствительность к излучению | ||
| ДНК-PKcs (PRKDC) | AR | Т-Б-НК + | Чувствительность к излучению | |||
| Синдром Оменна | RAG1 / RAG2 / Гипоморфная мутация Artemis | AR | Переменная | Лимфаденопатия Аутоиммунитет | Некоторые радиационно-чувствительные | |
| Синдром перелома Неймегена | Нибрин (NBN) | AR | Снижение Т-лимфоцитов CD4 Гипогаммаглобулинемия | Птицеобразные фации B-лимфомы | Чувствительность к излучению | |
| Ретикулярная дисгенезия | Аденилаткиназа 2 (AK2) | AR | T-B-NK-нейтропения | |||
| Дефицит Cernunnos / X-хромосомной лимфопролиферативной болезни (XLF) | Фактор негомологичного соединения концов 1 (NHEJ1) | XLR | T-B-NK + повышенный IgM | Микроцефалия Иммунная цитопения | ||
| Дефицит пуриновой нуклеозидфосфорилазы (PNP) | PNP | AR | Т-Б +/- НК + | Неврологическая дегенерация Аутоиммунная гемолитическая анемия | ||
| Дефицит основного класса гистосовместимости II (MHC II) | CIITA RFXANK RFX5 RFXAP | AR | CD4 лимфопения | Склерозирующий холангит | ||
| Дефицит белка-70, ассоциированного с дзета-цепью (ZAP-70) | ЗАП70 | AR | CD8 лимфопения Гипопролиферация CD4 | |||
| Дефицит CD8 | TAP1 / TAP2 / TAPBP | AR | CD8 лимфопения | Гранулематозные поражения средней линии Васкулит | ||
| Дефекты активации запасных кальциевых каналов | СТИМ1 ОРАИ1 | AR | Т-лимфопения | Миопатия | ||
| Синдром ДиДжорджи | делеция 22q11 делеция 10p13-14 | Т-лимфопения | Аплазия тимуса Дефекты сердца Дисморфизм лица Гипопаратиреоз | |||
| Синдром Вискотта-Олдрича | БЫЛ WIPF1 | XLR AR | Тромбоцитопения | Экзема Аутоиммунная В-клеточная лимфома | ||
| Hyper IgM | CD40LG CD40 UNG AICDA | XLR AR | Нейтропения | Лейкоз Лимфома | ||
| Х-сцепленное лимфопролиферативное заболевание | XLP1 (Ш3D1A) XLP2 (XIAP) | XLR | Дефицит NKT-клеток | ВЭБ-индуцированный HLH | ||
| Иммунодисрегуляция, полиэндокринопатия и энтеропатия Х-сцепленная (IPEX) | FOXP3 | XLR | FoxP3 + регуляторная недостаточность CD4 Т-лимфоцитов | Экзема, диарея | Иммуносупрессия циклоспорином А или сиролимусом | |
| Дефицит CD25 | ИЛ2РА | AR | FoxP3 + регуляторная недостаточность CD4 Т-лимфоцитов | Аутоиммунитет | ||
| Недостаток основного модулятора NF-kappaB (NEMO) | ИКБКГ | XLR | Эктодермальная дисплазия Гипогидроз Гипотрихоз Гиподонтия | |||
| Иммунодефицит, центромерная нестабильность, синдром лицевого дисморфизма (ICF) | DNMT3B | AR | Т-Б-НК + | Лицевые аномалии Задержка роста Психомоторная задержка | ||
| Аутоиммунный лимфопролиферативный синдром (АЛПС) | FAS FASLG CASP8 CASP10 | AR | Лимфаденопатия В-клеточная лимфома | Иммуносупрессия сиролимусом | ||
| Семейный гемофагоцитарный лимфогистиоцитоз | Перфорин 1 (PRF1) UNC13D Синтаксин 11 (STX11) Синтаксин-связывающий белок 2 (STXBP2) | AR | HLH | Иммуносупрессия стероидом, этопозидом, циклоспорином А | ||
| Гипоплазия волос хряща | RMRP | AR | Карликовость с короткими конечностями Редкие волосы Недостаточность костного мозга | |||
| Синдром гипер-IgD | Мевалонаткиназа (MVK) | нашей эры | Синдром периодической лихорадки | |||
| Синдром гипер-IgE | STAT3 TYK2 DOCK8 | AD AR | Экзема Дефектное выпадение зубов Гиперэкстензия суставов Нарушения сосудов Аутоиммунитет Васкулит | |||
| Хроническая гранулематозная болезнь | CYBB CYBA NCF1 NCF2 NCF4 | XLR AR | Обструкция выходного отверстия желудка Неинфекционный колит Гидронефроз | |||
| Тяжелая врожденная нейтропения / циклическая нейтропения | ELANE HAX1 G6PC3 Болезнь накопления гликогена Ib (G6PT1) p14 GFI1 | AR AD | Нейтропения | Повышенный риск миелодиспластического синдрома и острого миелоидного лейкоза | Замена G-CSF | |
| Алмазный синдром Швахмана | SBDS | AR | Нейтропения | Внешнесекреторная недостаточность поджелудочной железы Недостаточность костного мозга Метафизная хондродисплазия | ||
| Дефицит адгезии лейкоцитов 1 | ITGB2 | AR | Нейтрофилия | |||
| Дефицит адгезии лейкоцитов 2 | GDP-транспортер фукозы 1 (SLC35C1) | AR | Нейтрофилия | Низкий рост Дисморфизм лица Умственная отсталость Фенотип по группе крови Бомбея | ||
| Дефицит адгезии лейкоцитов 3 | Киндлин-3 (KIND3) | AR | Нейтрофилия | Нарушение функции тромбоцитов | ||
| Синдром Чедиака-Хигаши | LYST | AR | Клеточные включения (гигантские лизосомы) | Серебристо-седые волосы Невропатия HLH | ||
| Синдром Грищелли, тип 2 | RAB27A | AR | Частичный альбинизм HLH | |||
| Дефицит передачи сигналов рецептора интерферона-γ (IFN-γR) | IFNGR1 IFNGR2 STAT1 IL12RB1 IL12B | AR или | нашей эрыПовышенная чувствительность к микобактериям |
Какие условия могут лежать в основе аномалии?
Какие наследственные аномалии иммунной системы являются показаниями для трансплантации?
Таблица I. Первичные иммунодефицитные состояния при трансплантации костного мозга, ген (ы), наследование, клеточный фенотип, особенности.
Первичные иммунодефицитные состояния при трансплантации костного мозга, ген (ы), наследование, клеточный фенотип, особенности.
Когда вам нужно пройти более агрессивные тесты?
При ТКИД, IPEX, семейном HLH (гемофагоцитарный лимфогистиоцитоз) и XLP (Х-сцепленное лимфопролиферативное заболевание) положительный семейный анамнез требует агрессивного скрининга, так что BMT может быть проведен до развития стойких инфекций или воспалительных состояний, которые повреждают орган. функция.
Характерное проявление в сочетании с аномальными скрининговыми тестами должно побудить к попытке поставить конкретный генетический диагноз. HLA-типирование и идентификация подходящего донора могут начаться немедленно в ответ на клиническую картину SCID, IPEX или HLH.
Какие исследования изображений (если таковые имеются) будут полезны?
КТ (компьютерная томография) грудной клетки может продемонстрировать отсутствие тимуса при синдроме ДиДжорджи. Пневмонит – частое проявление ТКИД.
Пневмонит – частое проявление ТКИД.
Какие методы лечения следует начать немедленно и при каких обстоятельствах – даже если первопричина не установлена?
При пневмоните эмпирическая терапия должна охватывать пневмонию, вызванную Pneumocystis jirovecii (PCP), цитомегаловирус (CMV), грипп, аденовирус и микоплазмы, в дополнение к стандартным бактериальным и грибковым патогенам, ожидающим результатов БАЛ (бронхоальвеолярный лаваж).
Для HLH может быть показано быстрое лечение глюкокортикоидами, ингибитором кальциневрина и этопозидом для стабилизации состояния пациента.
Какие другие методы лечения помогают уменьшить осложнения?
Эмпирическая антибиотикопрофилактика PCP снизила количество смертельных случаев P. jirovecii при WAS и Х-сцепленном гипер-IgM, замена ВВИГ снижает синопульмональные инфекции при гипер-IgM-синдроме, а лечение G-CSF резко снижает инфекцию в SCN.
Терапия пегилированной аденозиндезаминазой может позволить нормализовать иммунную функцию при ТКИД с дефицитом ADA (аденозиндезаминазы) в течение нескольких месяцев или лет.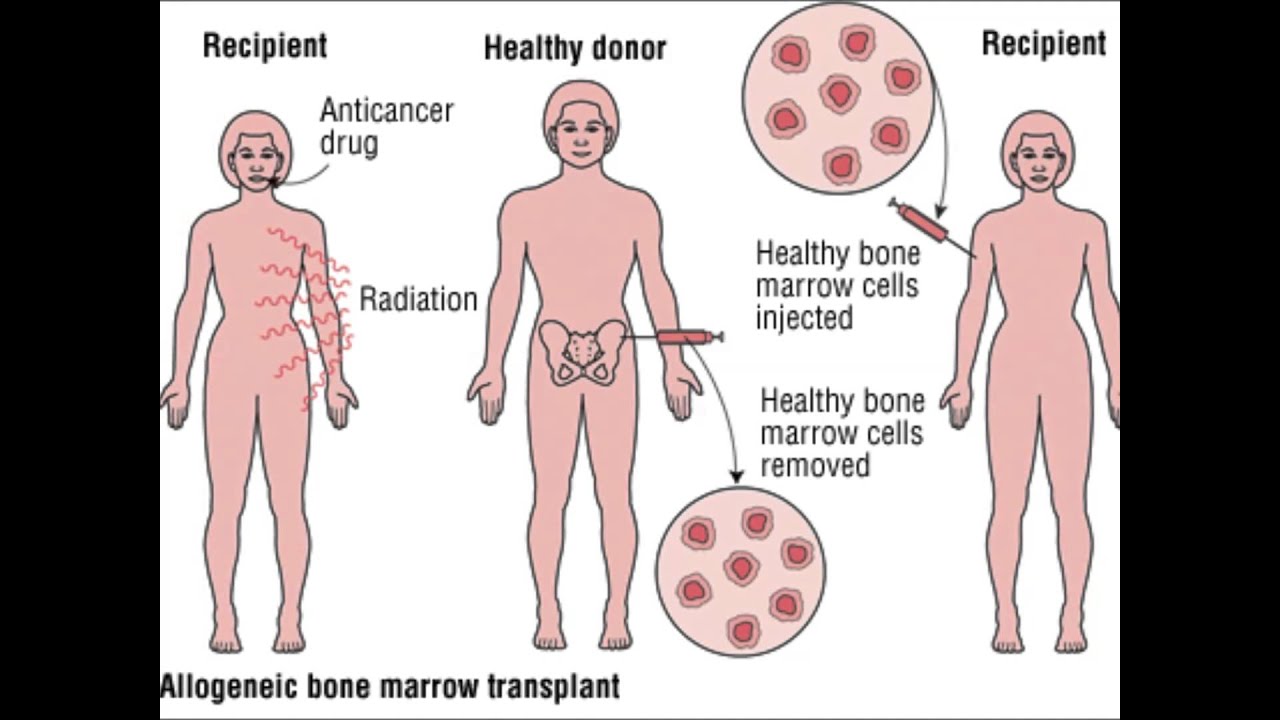 Переливание гранулоцитов может помочь в лечении тяжелых бактериальных или грибковых инфекций при таких состояниях, как LAD и SCN.
Переливание гранулоцитов может помочь в лечении тяжелых бактериальных или грибковых инфекций при таких состояниях, как LAD и SCN.
Когда лучше всего приступить к трансплантации костного мозга?
Лучшее время для лечения ВЗОМТ с помощью BMT зависит от конкретного заболевания, накопленных осложнений / заболеваемости и наличия подходящего донора. Раньше лучше при тяжелом комбинированном иммунодефиците (ТКИД). В одной серии из 166 пациентов младенцы, которым была произведена трансплантация в возрасте менее 3,5 месяцев, продемонстрировали общую выживаемость 94% по сравнению с 69% детей, перенесших трансплантацию в более старшем возрасте.Младенцы младшего возраста имели более устойчивое восстановление Т-клеток, о чем свидетельствует количество циркулирующих клеток CD3 + и CD45RA + и большее количество кругов удаления рецепторов Т-клеток (TREC), обнаруженных у недавних эмигрантов из тимуса. Анализ европейских трансплантатов на ТКИН аналогичным образом показал превосходную 10-летнюю выживаемость: 68%, если возраст менее 6 месяцев, по сравнению с 51%, если возраст более 12 месяцев на момент трансплантации.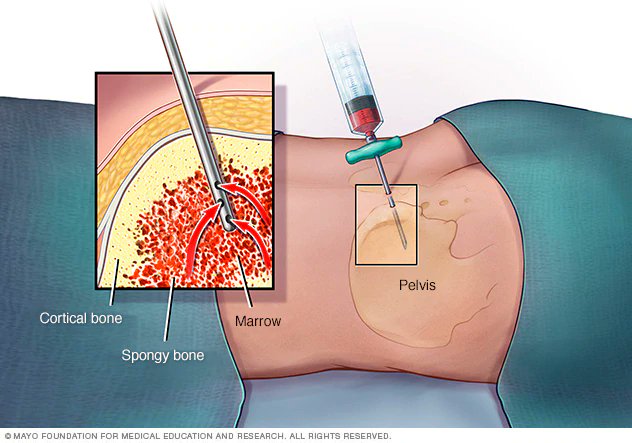 Последние данные о результатах лечения 240 пациентов, которым трансплантировали ТКИН в период с 2000 по 2009 год, подтверждают эти выводы, в отношении детей старше 3 лет.В течение 5 месяцев дела обстоят почти так же, как у младенцев, если у старших детей нет инфекции или инфекция разрешилась до ТКМ, с общей выживаемостью 90% и 82% соответственно. У детей старшего возраста с активной инфекцией дела обстоят намного хуже, выживаемость составляет лишь 50%.
Последние данные о результатах лечения 240 пациентов, которым трансплантировали ТКИН в период с 2000 по 2009 год, подтверждают эти выводы, в отношении детей старше 3 лет.В течение 5 месяцев дела обстоят почти так же, как у младенцев, если у старших детей нет инфекции или инфекция разрешилась до ТКМ, с общей выживаемостью 90% и 82% соответственно. У детей старшего возраста с активной инфекцией дела обстоят намного хуже, выживаемость составляет лишь 50%.
В этой взаимосвязи исхода и времени трансплантации подразумевается повышенный риск фатальных инфекционных осложнений у пожилых пациентов с BMT, в основном из-за распространенных вирусов, таких как цитомегаловирус, аденовирус, вирус Эпштейна-Барра, энтеровирус, парагрипп, ветряная оспа, HSV ( вирус простого герпеса) и RSV (респираторно-синцитиальный вирус человека) в порядке частоты.Напротив, у детей с своевременным неонатальным диагнозом ТКИН из-за семейного анамнеза наблюдалась существенно более низкая общая смертность (60% у пробандов, 10% у детей с второстепенным заболеванием), связанная с меньшим количеством инфекций до трансплантации. Это наблюдение предполагает, что неонатальная диагностика лимфопении путем скрининга карт Гатри с использованием количественной ПЦР (полимеразная цепная реакция) на TREC (круги удаления Т-клеточного рецептора) может помочь улучшить общую выживаемость при ТКИН и других заболеваниях с неонатальной лимфопенией, позволяя раннюю диагностику и трансплантация.Недавно были опубликованы первые данные об успехе скрининга новорожденных. В 11 штатах, которые первыми внедрили универсальный скрининг, было выявлено 52 случая, что привело к оценочной частоте SCID в 1 на 58 000 живорождений в США. Результаты выживаемости этих детей, выявленные в очень раннем возрасте с помощью всеобщего скрининга, составили 82%, что подтверждает мнение о том, что ранняя диагностика до инфицирования имеет решающее значение для наилучших результатов лечения.
Это наблюдение предполагает, что неонатальная диагностика лимфопении путем скрининга карт Гатри с использованием количественной ПЦР (полимеразная цепная реакция) на TREC (круги удаления Т-клеточного рецептора) может помочь улучшить общую выживаемость при ТКИН и других заболеваниях с неонатальной лимфопенией, позволяя раннюю диагностику и трансплантация.Недавно были опубликованы первые данные об успехе скрининга новорожденных. В 11 штатах, которые первыми внедрили универсальный скрининг, было выявлено 52 случая, что привело к оценочной частоте SCID в 1 на 58 000 живорождений в США. Результаты выживаемости этих детей, выявленные в очень раннем возрасте с помощью всеобщего скрининга, составили 82%, что подтверждает мнение о том, что ранняя диагностика до инфицирования имеет решающее значение для наилучших результатов лечения.
Для других ВЗОМТ, где поддерживающие меры могут лечить или отсрочить начало инфекции, трансплантация костного мозга может быть успешно отложена до тех пор, пока дети не станут старше. В качестве примеров: эмпирическая антибиотикопрофилактика PCP снизила количество летальных исходов P. jirovecii в WAS и X-сцепленном Hyper IgM; Замещение IvIg снижает синусно-легочные инфекции при синдроме гипер-IgM; и лечение G-CSF резко снижает инфекцию в SCN. Однако более долгосрочное наблюдение за данными реестра показало, что такие меры могут только отсрочить раннюю смертность в этих условиях до второго или третьего десятилетия. Более того, возможные осложнения основного ВЗОМТ значительно снижают шанс на успешное излечение путем трансплантации.
В качестве примеров: эмпирическая антибиотикопрофилактика PCP снизила количество летальных исходов P. jirovecii в WAS и X-сцепленном Hyper IgM; Замещение IvIg снижает синусно-легочные инфекции при синдроме гипер-IgM; и лечение G-CSF резко снижает инфекцию в SCN. Однако более долгосрочное наблюдение за данными реестра показало, что такие меры могут только отсрочить раннюю смертность в этих условиях до второго или третьего десятилетия. Более того, возможные осложнения основного ВЗОМТ значительно снижают шанс на успешное излечение путем трансплантации.
Другая подгруппа наследственных иммунных нарушений включает аутоиммунитет (IPEX, ALPS) или тяжелые воспалительные состояния, вызванные инфекцией (семейный HLH или HLH-подобные состояния, вызванные EBV и другими инфекциями при XLP или синдроме Чедиака-Хигаши). Эти воспалительные состояния могут вызывать необратимые, а иногда и фатальные повреждения органов-мишеней. Иммуносупрессивная терапия циклоспорином или сиролимусом может уменьшить симптомы у некоторых пациентов с IPEX или ALPS, а химиотерапия и стероиды могут вызвать временную ремиссию HLH и связанных с ним воспалительных состояний.
Хотя хроническая иммуносупрессивная терапия может быть временной, она явно увеличивает инфекционный риск и требует мониторинга и профилактики антибиотиками. Кроме того, рецидив HLH или ускоренная фаза XLP и Чедиака-Хигаши часто не реагирует на дальнейшую иммуномодуляцию химиотерапией.
При каждом из этих заболеваний результаты BMT лучше, если они выполняются в период хорошего контроля болезни. Поэтому важно, чтобы все дети с ВЗОМТ получили раннее направление в центр, знакомый с ТКМ, для лечения ВЗОМТ, чтобы обсудить варианты лечения и выполнить типирование HLA во время постановки диагноза.
Отбор донора и результаты трансплантации
Трансплантаты от HLA-идентичных доноров-братьев и сестер дали наилучшие результаты, но результаты с трансплантатами от альтернативных доноров улучшаются.
гаплоидентичных (обычно родительских) доноров успешно использовались при трансплантации ВЗОМТ после истощения Т-клеток костного мозга in vitro с коэффициентом от 10 -4 до 10 -5 . Хотя такой подход может нести повышенный риск отторжения трансплантата у пациентов с ВЗОМТ, не страдающих лимфопенией, доступность готового донора и возможность сбора второго продукта или донорских лимфоцитов для ускорения приживления трансплантата являются преимуществами для пациентов, не имеющих полностью подобранного родственного брата-донора.Основной недостаток этого подхода связан с задержкой восстановления иммунной системы Т-лимфоцитов после строгого истощения Т-лимфоцитов трансплантата, что приводит к увеличению смертности от оппортунистической инфекции. Альтернативы истощению Т-клеток in vivo с использованием Campath, антитимоцитарного глобулина или посттрансплантационного циклофосфамида обсуждаются ниже в разделе «Подготовительные схемы трансплантации».
Хотя такой подход может нести повышенный риск отторжения трансплантата у пациентов с ВЗОМТ, не страдающих лимфопенией, доступность готового донора и возможность сбора второго продукта или донорских лимфоцитов для ускорения приживления трансплантата являются преимуществами для пациентов, не имеющих полностью подобранного родственного брата-донора.Основной недостаток этого подхода связан с задержкой восстановления иммунной системы Т-лимфоцитов после строгого истощения Т-лимфоцитов трансплантата, что приводит к увеличению смертности от оппортунистической инфекции. Альтернативы истощению Т-клеток in vivo с использованием Campath, антитимоцитарного глобулина или посттрансплантационного циклофосфамида обсуждаются ниже в разделе «Подготовительные схемы трансплантации».
Еще одним средством преодоления нехватки полностью подобранного родственного или неродственного донора является использование неродственных трансплантатов пуповинной крови, соответствующих только четырем антигенам HLA-A и B и аллелям DRB1.
Препаративный режим трансплантата
Риски несостоятельности трансплантата и связанной с лечением смертности сильно зависят от основной иммунной функции хозяина, наличия оппортунистической инфекции во время трансплантации и наличия основного повреждения органа-мишени до ТКМ.
Для пациентов с ТКИН с минимальным иммунитетом, опосредованным Т-клетками, один из подходов к трансплантации – это инфузия трансплантата без какого-либо предварительного препаративного режима. Поскольку важной целью является пересадка таких пациентов в как можно более молодом возрасте, исключение токсичности химиотерапии и облучения для развития мозга, роста и функции гонад в этой восприимчивой возрастной группе является явным преимуществом этого подхода.Недостатком является несколько повышенная частота несостоятельности трансплантата и менее полное восстановление иммунитета, особенно в компартменте В-клеток, часто требующее пожизненной замены IgG.
Миелоаблативная ТКМ возможна для таких пациентов и приводит к более полному приживлению донора и лучшему восстановлению В- и Т-клеток за счет несколько большей смертности, связанной с трансплантацией. Тем не менее, с улучшенным сопоставлением HLA и агрессивным лечением острой GVHD (болезнь «трансплантат против хозяина») в недавней когорте из 41 пациента из Канады и Италии была достигнута общая длительная выживаемость до 80%.
Тем не менее, с улучшенным сопоставлением HLA и агрессивным лечением острой GVHD (болезнь «трансплантат против хозяина») в недавней когорте из 41 пациента из Канады и Италии была достигнута общая длительная выживаемость до 80%.
В усилиях по улучшению этих результатов для SCID и других PID было предпринято несколько подходов. Одним из них была разработка треосульфана, алкилирующего агента со сниженным риском печеночной веноокклюзионной болезни (VOD) после миелоаблативного препаративного дозирования, особенно при применении с флударабином.
Другой подход заключался в том, чтобы полностью избежать химиотерапии высокими дозами, используя иммуносупрессивные, но немиелоаблативные препаративные схемы, чтобы сократить продолжительность нейтропении и избежать токсичности для органов.Такие схемы могут включать антитимоцитарный глобулин или моноклональные антитела к истощению лимфоцитов хозяина, чтобы способствовать приживлению трансплантата. В зависимости от времени введения такие антитела могут сохраняться, а также истощать донорские Т-клетки, введенные в трансплантат, и тем самым способствовать предотвращению GVHD. Эти агенты обычно комбинируются с лимфоцитотоксическими дозами циклофосфамида, флударабина или мелфалана, а схемы лечения могут включать облучение всего тела в низких дозах.
Эти агенты обычно комбинируются с лимфоцитотоксическими дозами циклофосфамида, флударабина или мелфалана, а схемы лечения могут включать облучение всего тела в низких дозах.
Систематического сравнения этих подходов нет.В целом, немиелоаблативные препаративные схемы, по-видимому, имеют более высокую скорость отторжения трансплантата, а схемы, содержащие ATG (антитимоцитарный глобулин) и моноклональные антитела, могут приводить к замедленному восстановлению Т-клеток и более высокому уровню инфекции из-за истощения зрелых Т-клеток в прививать.
Альтернативный подход к ТКМ гаплоидентичного донора заключается в использовании немиелоаблативного препаративного режима и введении высоких доз циклофосфамида (50 мг / кг в дни +3 и +4) после инфузии неманипулятивного трансплантата.Этот подход приводит к истощению активированных аллореактивных Т-клеток при сохранении покоящихся неаллореактивных Т-клеток. Эта стратегия успешно использовалась как при гематологических злокачественных новообразованиях, так и при доброкачественных заболеваниях.
Что вы должны сказать пациенту и его семье о прогнозе?
На успех ТКМ при иммунодефиците влияют осложнения, связанные с основным диагнозом, такие как ранее существовавшая тяжелая инфекция или ранее существовавший аутоиммунитет от заболеваний, связанных с нарушением регуляции иммунитета, а риск отторжения трансплантата зависит от сохранения частичной иммунной функции хозяина в некоторых условиях.Когда пациенты с ТКИН не могут развиваться из-за персистирующей вирусной инфекции, только меньшинство выживает после ТКМ, но среди пациентов с ТКИД, трансплантированных в качестве новорожденных от подходящего родственного донора, выживают более 90%.
Патофизиология:
Большинство первичных иммунодефицитов (ВЗОМТ) возникает из-за генетических мутаций, которые приводят к дефектам генерации, функции или регуляции клеточного компонента иммунной системы.
Заболевания лимфоцитов возникают в результате дефектов передачи сигналов цитокинов, образования рецепторов антигена, передачи сигналов от рецепторов антигенов, костимулирующих путей, путей апоптоза и эффекторных цитотоксических механизмов.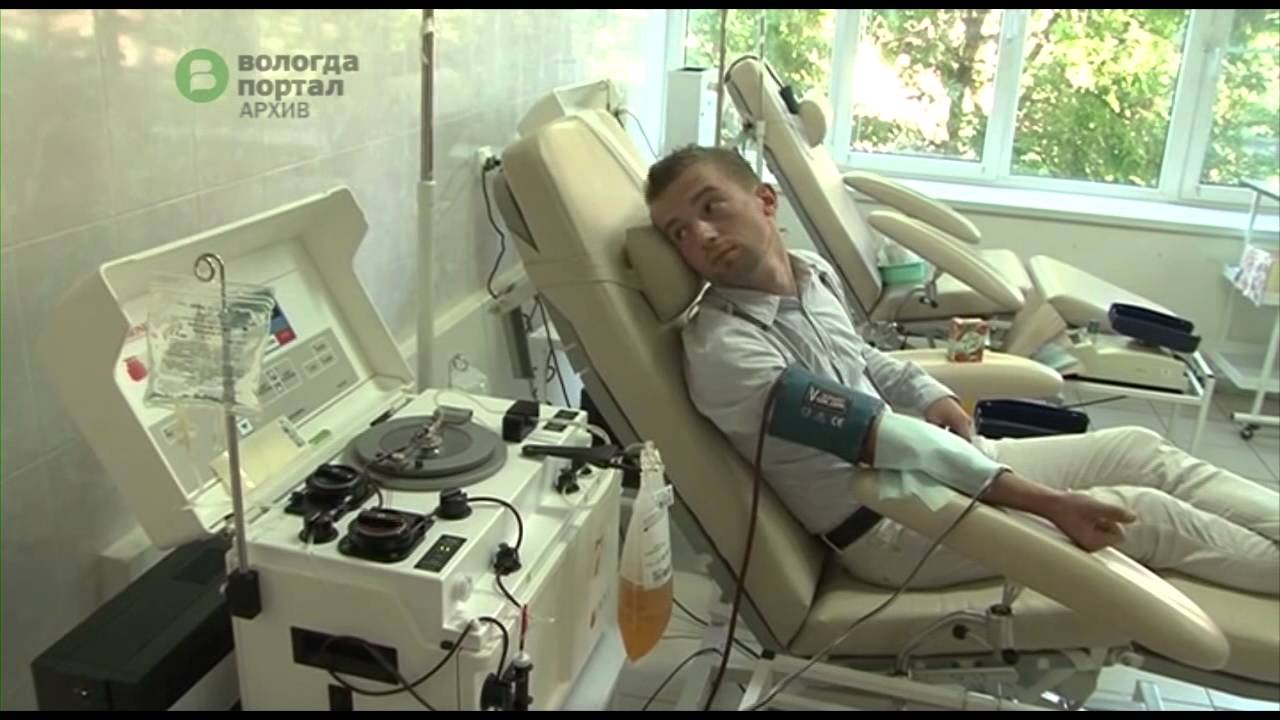
Нарушения гранулоцитов возникают в результате дефектов передачи сигналов цитокинов, транспорта и цитотоксических эффекторных механизмов.
Какие доказательства?
Бакли, Р. «Трансплантация гемопоэтических стволовых клеток при тяжелом комбинированном иммунодефиците человека: отдаленные результаты». Immunol Res. об. 49. 2011. С. 25–43. (Комплексный анализ результатов лечения 166 пациентов с ТКИН, которым была проведена трансплантация стволовых клеток в одном учреждении.)
Gennery, AR, Slatter, MA, Grandin, L, Taupin, P, Cant, AJ, Veys, P.«Трансплантация гемопоэтических стволовых клеток и долгосрочное выживание при первичных иммунодефицитах в Европе: вступая в новый век, делаем ли мы лучше?». J Allergy Clin Immunol. об. 126. 2010. С. 602-10. (Анализ результатов трансплантации при ТКИД и ВЗОМТ без ТКИД из Европейского реестра за 37 лет.)
Пай, С.Ю., Логан, Б.Р., Гриффит, Л.М., Бакли, Р.Х., Пэррот, Р. Э., Дворжак, С.С. «Результаты трансплантации при тяжелом комбинированном иммунодефиците, 2000-2009 гг.». N Engl J Med. об. 371. 2014. С. 434-46. (Комплексный мультиинституциональный анализ результатов современного лечения трансплантации при ТКИД.)
Э., Дворжак, С.С. «Результаты трансплантации при тяжелом комбинированном иммунодефиците, 2000-2009 гг.». N Engl J Med. об. 371. 2014. С. 434-46. (Комплексный мультиинституциональный анализ результатов современного лечения трансплантации при ТКИД.)
Бейкер, М.В., Лаессиг, Р.Х., Катчер, М.Л., Маршруты, Дж. М., Гроссман, В. Дж., Вербски, Дж. «Внедрение рутинного тестирования на тяжелый комбинированный иммунодефицит в рамках программы скрининга новорожденных в Висконсине». Public Health Rep. vol. 125 Приложение 2. 2010. С. 88–95. (Анализ затрат / выгод и эффективности скрининга новорожденных для ранней диагностики тяжелого комбинированного иммунодефицита.)
Кван, А., Абрахам, Р.С., Карриер, Р., Брауэр, А., Андрушевский, К., Эбботт, Дж. К.. «Скрининг новорожденных на тяжелый комбинированный иммунодефицит в 11 программах скрининга в США». JAMA. об. 312. 2014. С. 729–38. (Отчет о результатах всеобщего скрининга новорожденных на Т-клеточную лимфопению в США с оценкой частоты ТКИД.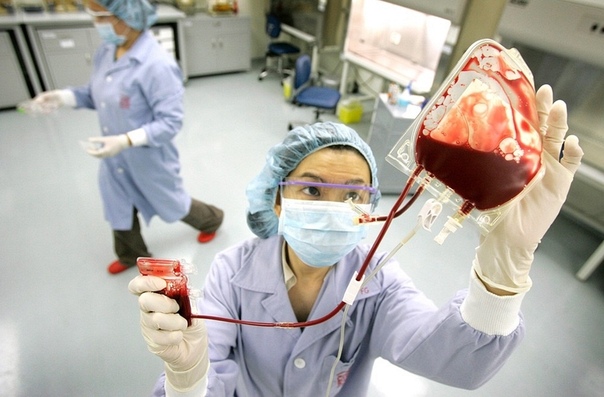 )
)
Тичи, Д.Т., Грейнер, Р., Сейф, А. «Лечение сиролимусом приводит к полному ответу у пациентов с аутоиммунным лимфопролиферативным синдромом». Br J Haematol. об. 145. 2009. С. 101-6. (Использование нового медицинского лечения с сиролимусом для контроля симптомов иммунодефицита от ALP. Такие подходы могут позволить большую гибкость в отношении сроков лечебной трансплантации, а также могут применяться к другим заболеваниям с иммунной дисрегуляцией, таким как IPEX.)
Хентер, Дж. И., Самуэльссон-Хорн, А., Арико, М. «Лечение гемофагоцитарного лимфогистиоцитоза с помощью иммунохимиотерапии HLH-94 и трансплантации костного мозга». Кровь. об. 100. 2002. pp. 2367–73. (Успешное излечение HLH с помощью химиотерапии с последующей BMT в популяции пациентов, которым традиционно сложно успешно провести трансплантацию из-за органной дисфункции из-за ВЗОМТ.)
Seidel, MG, Fritsch, G, Lion, T. «Избирательное приживление донорских CD4 + 25high FOXP3-позитивных Т-клеток при синдроме IPEX после трансплантации немиелоаблативных гемопоэтических стволовых клеток». Кровь. об. 113. 2009. С. 5689-91. (Отчет о случае, демонстрирующий, что приживления только регуляторных Т-клеток достаточно для лечения синдрома IPEX у людей.)
Кровь. об. 113. 2009. С. 5689-91. (Отчет о случае, демонстрирующий, что приживления только регуляторных Т-клеток достаточно для лечения синдрома IPEX у людей.)
Дворжак, С.С., Хассан, А, Слэттер, Массачусетс, Хениг, М., Ланкестер, А.С., Бакли, Р.Х. «Сравнение результатов трансплантации гемопоэтических стволовых клеток без кондиционирования химиотерапией с использованием подходящих родственных и неродственных доноров для лечения тяжелого комбинированного иммунодефицита». т. 134. 2014. С. 935-J Allergy Clin Immunol. (Анализ результатов трансплантации без кондиционирования для SCID, сравнивая сопоставленных родственных и неродственных доноров.)
Бхаттачарья, А, Слаттер, Массачусетс, Чепмен, CE.«Опыт единого центра трансплантации стволовых клеток пуповины при первичном иммунодефиците». Пересадка костного мозга. об. 36. 2005. С. 295-9. (Успешное использование трансплантата пуповинной крови для лечения различных ВЗОМТ.)
Грюнебаум Э., Ройфман СМ. «Трансплантация костного мозга с использованием HLA-сопоставимых неродственных доноров для пациентов, страдающих тяжелым комбинированным иммунодефицитом».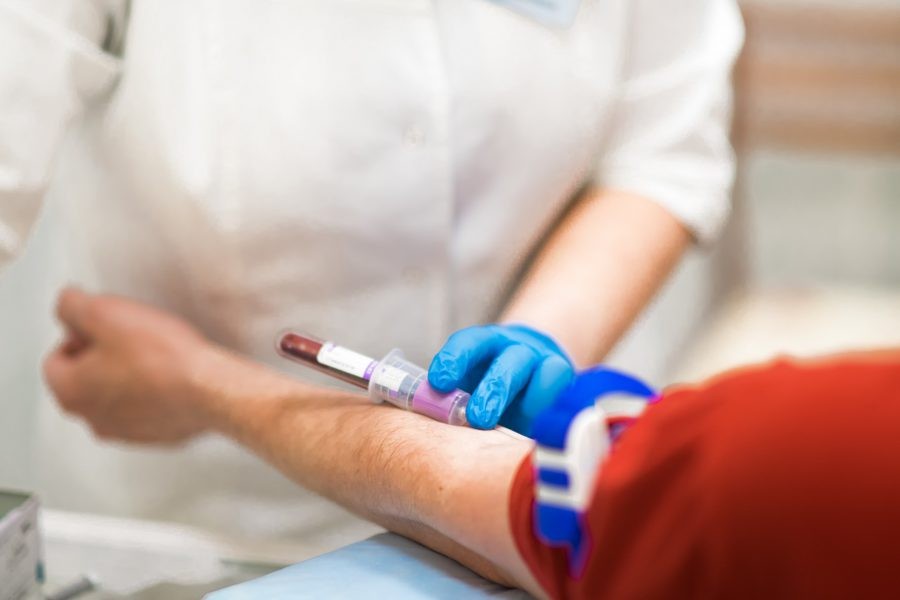 Immunol Allergy Clin North Am. об. 30. 2010. С. 63-73. (Успешная трансплантация совместимого неродственного донора (в отличие от гаплоидентичной трансплантации с истощением материнских Т-клеток) при тяжелом комбинированном иммунодефиците.)
Immunol Allergy Clin North Am. об. 30. 2010. С. 63-73. (Успешная трансплантация совместимого неродственного донора (в отличие от гаплоидентичной трансплантации с истощением материнских Т-клеток) при тяжелом комбинированном иммунодефиците.)
Слаттер, Массачусетс, Рао, К., Амролия, П. «Схемы кондиционирования на основе треосульфана для трансплантации гемопоэтических стволовых клеток у детей с первичным иммунодефицитом: опыт Соединенного Королевства». Кровь. об. 117. 2011. С. 4367-75. (Авторы описывают метод снижения заболеваемости и смертности, связанных с трансплантацией ПИД, с использованием нового алкилирующего агента треосульфана.)
Бродский, Р.А., Лузник, Л., Боланос-Мид, Дж., Леффелл, М.С., Джонс, Р.Дж., Фукс, Э.Дж. «Снижение интенсивности HLA-гаплоидентичного BMT с посттрансплантационным циклофосфамидом при доброкачественных гематологических заболеваниях». Пересадка костного мозга. об. 42. 2008. С. 523-7. (Этот автор демонстрирует эффективность высоких доз циклофосфамида после трансплантации в разрешении использования несовместимых (гаплоидентичных) доноров для BMT с благоприятными показателями приживления трансплантата и GVHD, расширяя пул потенциальных доноров для пациентов с иммунодефицитом, которым требуется трансплантация. )
)
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC.Лицензионный контент является собственностью DSM и защищен авторским правом.
О трансплантации | Стволовые клетки крови
Если у вас диагностировано серьезное заболевание, полезно узнать о нем и вариантах лечения. Это поможет вам поговорить с врачом и вместе составить план лечения.
Трансплантат костного мозга или трансплантат пуповинной крови (также называемый BMT) заменяет больные кроветворные клетки (также называемые стволовыми клетками крови) здоровыми клетками.
Заболевания, поддающиеся лечению с помощью трансплантации костного мозга или пуповинной крови
Болезни, которые можно лечить с помощью трансплантации костного мозга или пуповинной крови, включают:
- Лейкемии и лимфомы
- Множественная миелома и другие поражения плазматических клеток
- Тяжелая апластическая анемия и другие состояния недостаточности костного мозга
- Серповидно-клеточная анемия и талассемия
- Унаследованные нарушения иммунной системы, такие как тяжелый комбинированный иммунодефицит (ТКИД) и синдром Вискотта-Олдрича
- Наследственные нарушения обмена веществ, такие как синдром Гурлера и лейкодистрофии
- Миелодиспластические синдромы
Чтобы узнать о симптомах, диагностике и вариантах лечения этих и других заболеваний, см. Раздел «Информация о своем заболевании».
Раздел «Информация о своем заболевании».
Типы трансплантатов и используемых клеток
Ваш врач решит, какой тип трансплантации вам подходит:
- Аутологичная трансплантация использует клетки, собранные из вашего тела.
- В аллогенной трансплантации используются клетки, полученные от члена семьи, неродственного донора или единицы пуповинной крови.
Для аутотрансплантата здоровые клетки для трансплантата могут быть получены из 1 из 2 источников:
- Костный мозг
- Стволовые клетки периферической (циркулирующей) крови (PBSC)
Для аллогенного трансплантата здоровые клетки для трансплантата могут быть получены из 1 из 3 источников:
- Костный мозг
- Стволовые клетки периферической (циркулирующей) крови (PBSC)
- Пуповинная кровь, собираемая после рождения ребенка
Если вам нужна трансплантация, ваш врач выберет для вас лучший источник клеток. Ваш врач принимает это решение на основе вашего заболевания, других видов лечения, которые вы прошли, и вашего общего состояния здоровья.
Ваш врач принимает это решение на основе вашего заболевания, других видов лечения, которые вы прошли, и вашего общего состояния здоровья.
Процесс трансплантации
Пересадка костного мозга или пуповинной крови – это долгий процесс, состоящий из множества этапов.
1. Клетки собраны
Аутологичный трансплантат : Собственные кроветворные клетки собираются из циркулирующей крови (стволовые клетки периферической крови) или костного мозга. Большинство пациентов используют PBSC для аутотрансплантации. Но ваш врач решит, что лучше для вас.
- Сбор
- PBSC: Кроветворные клетки собирают из кровотока. Этот процесс называется аферезом. Перед аферезом вам делают прививки, чтобы увеличить количество кроветворных клеток в кровотоке. Во время афереза кровь удаляется из вашей вены через внутривенную (IV) линию, проходит через аппарат и снова вводится в вашу вену. Аппарат извлекает кроветворные клетки, которые будут использоваться для трансплантации.

- Сбор костного мозга: Кроветворные клетки собираются из тазовой или бедренной кости хирургическим путем.Вы получаете анестезию, чтобы чувствовать себя комфортно во время процесса. Врач с помощью специальной иглы удаляет кроветворные клетки из костного мозга.
Аллогенная трансплантация : Ваш врач будет искать донора костного мозга или единицу пуповинной крови, которая соответствует вашему типу HLA. HLA – лейкоцитарный антиген человека. Это маркер, который использует ваше тело, чтобы узнать, какие клетки принадлежат вашему телу, а какие нет.
Если в вашей семье нет донора, ваш врач будет искать неродственного донора или единицу пуповинной крови через регистр C.Программа трансплантации клеток У. Билла Янга, также называемая Be The Match Registry®. Реестр представляет собой список потенциальных доноров костного мозга и единиц донорской пуповинной крови.
NMDP / Be The Match имеет соглашения со своими глобальными партнерами о предоставлении доступа к более чем 35 миллионам потенциальных доноров костного мозга и почти 783 000 единицам пуповинной крови в рамках своей поисковой системы.
2. Ваше тело готово к пересадке
Прежде чем ваше тело сможет получить новые клетки, вы пройдете курс химиотерапии, с лучевой терапией или без нее.Лечение называется препаративным, или условным, режимом. Подготовительный режим разрушает больные клетки и освобождает место в вашем теле для новых клеток.
3. Вы получаете клетки (День трансплантации)
В день трансплантации клетки попадают в ваше тело через внутривенный (IV) катетер. Клетки перемещаются в пространство внутри ваших костей, где они растут и производят новые клетки крови. Они производят новые здоровые эритроциты, лейкоциты и тромбоциты.
4.Восстановление
Восстановление после трансплантации может длиться от нескольких недель до месяцев. Возможно, вам придется оставаться в больнице или рядом с центром трансплантации в течение первых 100 дней после трансплантации. Тогда вам может потребоваться больше времени для восстановления дома. На протяжении всего периода выздоровления врачи, медсестры и социальные работники внимательно следят за вами, чтобы предотвратить и лечить любые побочные эффекты или осложнения.
Для получения дополнительной информации о химиотерапии и лучевой терапии см. Процесс трансплантации.
Подробнее о процессе поиска, сопоставлении HLA и этапах трансплантации, таких как оценка вашего здоровья перед трансплантацией, подготовительный режим, получение новых клеток и выздоровление, см. В разделе Поиск донора
Когда ваш врач рекомендует пересадку
Ваш врач рекомендует лечение, основываясь на нескольких факторах, включая статус вашего заболевания и состояние вашего здоровья.Разные методы лечения лучше в разное время для каждой болезни.
Ваш врач также изучает ваше общее состояние здоровья и факторы риска. Эти вещи тоже могут измениться со временем.
При выборе метода лечения врач будет учитывать как состояние вашего заболевания, так и ваше текущее состояние здоровья. В целом пересадка работает лучше, когда:
- Заболевание в начальной стадии или в стадии ремиссии
- Заболевание проходит после химиотерапии
- Вы здоровы, и ваши органы работают нормально
Разговор с врачом
Если у вас есть заболевание, которое можно вылечить с помощью трансплантации костного мозга или пуповинной крови, поговорите со своим врачом. Задайте вопросы о своем заболевании, факторах риска и вариантах лечения. Каждый ваш вопрос важен.
Задайте вопросы о своем заболевании, факторах риска и вариантах лечения. Каждый ваш вопрос важен.
Вот некоторые вопросы, которые вы можете задать своему врачу о вариантах лечения:
- Какое лечение вы рекомендуете и почему?
- Цель – вылечить мою болезнь, остановить ее прогрессирование или контролировать симптомы?
- Какие еще возможные методы лечения?
- Будет ли трансплантация костного мозга или пуповинной крови вариантом на каком-то этапе моего лечения?
Вопросы, относящиеся к трансплантации костного мозга или пуповинной крови, могут включать:
- Когда вы рекомендуете пересадку?
- Когда вы начинаете поиск донора костного мозга или отделения пуповинной крови?
- Каковы риски ожидания или попытки сначала попробовать другие методы лечения?
- Как вы думаете, каковы шансы моей трансплантации?
Дополнительные вопросы и темы для обсуждения с врачом см .:
.


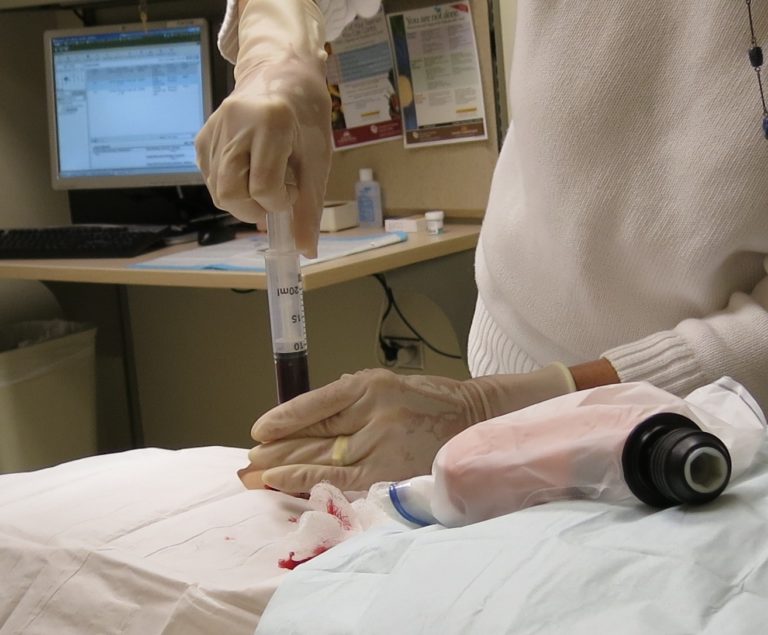 Ежегодно в США диагностируется около 15 000 человек.
Ежегодно в США диагностируется около 15 000 человек.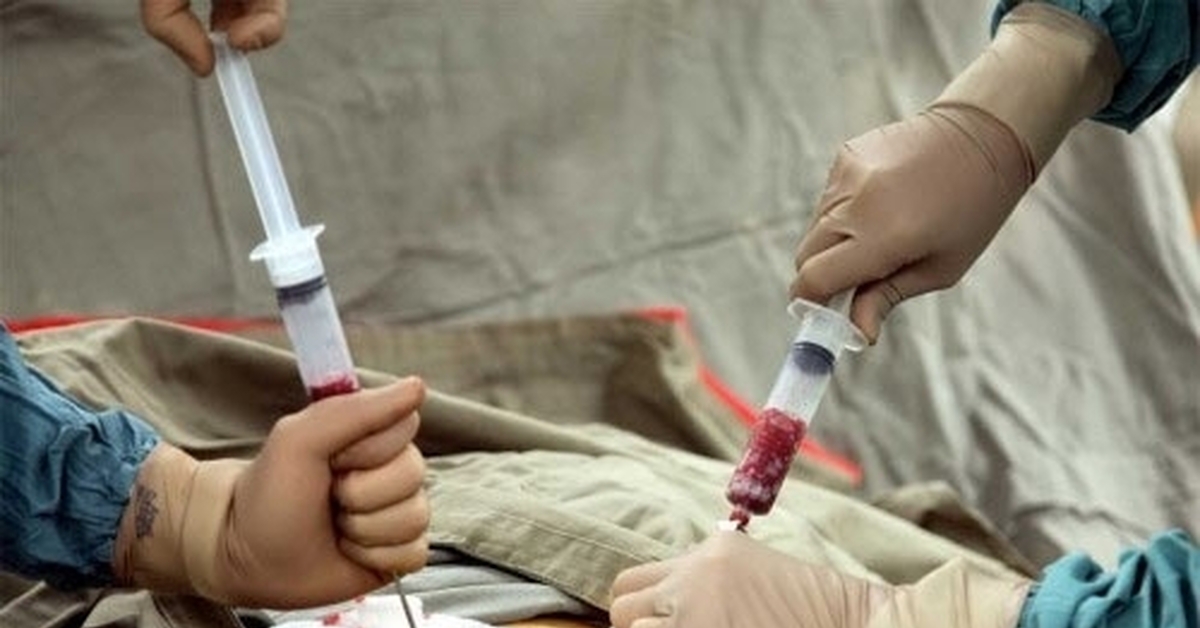 Существует также другая форма заболевания, которая проявляется только в более позднем детстве или даже в подростковом возрасте (с поздним началом).
Существует также другая форма заболевания, которая проявляется только в более позднем детстве или даже в подростковом возрасте (с поздним началом).
