признаки, особенности, вариант нормы и патологическое состояние
– продукт секреции клеток дыхательных путей, выделяемый в просвет трахеи и бронхов.
Основными функциями мокроты являются создание нормальной среды в дыхательных путях, защита поверхности эпителия трахеи и бронхов, удаление механических и инфекционных частиц, попадающих в дыхательные пути при вдохе.
Мокрота – в норме, если:
Она является жидкой, прозрачной, не имеет запаха. В норме мокрота поступает по бронхам и трахее в направлении вверх, ее движение обеспечивается функционированием специального реснитчатого эпителия дыхательных путей. После того, как мокрота с содержащимися в ней пылевыми частицами доходит до уровня глотки, она проглатывается и попадает в пищевод, а затем в желудок.
Мокрота более чем на 95% состоит из воды, 5% составляют протеины, углеводы и минеральные соли.
На что обратить внимание
У пациентов с заболеваниями дыхательных путей в мокроте может содержаться белок, кровь, полисахаридные компоненты, бактерии, вирусы, грибковые субстанции.

Мокрота служит важным диагностическим материалом для постановки диагноза при заболеваниях дыхательных путей. По внешнему виду, наличию или отсутствию гноя либо крови в мокроте, а также по данным микробиологического исследования, врач может сделать предположение о характере патологического процесса в дыхательных путях пациента. По виду, запаху, объему и составу мокроты заболевания легких можно разделить на инфекционные, травматические, онкологические, и т.д. В определенных случаях можно заподозрить наличие отека или даже некроза легких.
Исследование мокроты позволяет врачу определить дальнейшую диагностическую стратегию и выбрать правильные методы инструментальной и лабораторной диагностики. Помимо диангостики, характеристики мокроты у обследуемого больного помогают врачу предпринять неотложные мероприятия по организации антибиотикотерапии, кровоостанавливающей и противоотечной терапии. В ряде случаев быстрое начало лечения позволяет спасти жизнь пациенту.
Помимо диангостики, характеристики мокроты у обследуемого больного помогают врачу предпринять неотложные мероприятия по организации антибиотикотерапии, кровоостанавливающей и противоотечной терапии. В ряде случаев быстрое начало лечения позволяет спасти жизнь пациенту.
Во всех случаях, когда у пациента наблюдается изменение свойств мокроты, доктор должен определить причину состояния, которое привело к указанным изменениям. После того, как причина найдена, назначается этиотропное лечение, направленное на устранение причины заболевания. Кроме того, во всех случаях поводится неспецифическая терапия, с помощью которой нормализуется объем, вязкость и состав мокроты.
Виды мокроты
Ниже приводится список разновидностей мокроты и состояний / заболеваний, при которых подобная мокрота может встречаться :
– желтоватая мокрота с прожилками гноя – пневмония (воспаление легких)
– ржавая мокрота – крупозная пневмония
– ярко-красная мокрота с содержанием крови – некротический процесс (инфаркт) легких
– желто-коричневая мокрота – абсцесс легкого
– пенистая кровянистая мокрота – отек легких
– прозрачная мокрота и волоконцами крови – бронхогенный рак легких
– кровянистая мокрота – рак легкого
– мокрота со сладковатым неприятным запахом – гнойный бронхит
– мокрота со зловонным запахом – гангрена легкого
Лечение
Как правило, пациенты принимают препараты, разжижающие мокроту.
 Это важно для того, чтобы не допустить обструкции (перекрытия просвета) средних и мелких бронхов вязкой мокротой и выключения сегментов легких из процесса дыхания. Дополнительно назначаются отхаркивающие лекарства, стимулирующие работу реснитчатого эпителия, который проводит элиминацию (удаление) мокроты из дыхательных путей. Часто применяются фармакологические средства, снимающие спазм бронхиол. В большинстве случаев назначают антибиотикотерапию для подавления инфекционного процесса.
Это важно для того, чтобы не допустить обструкции (перекрытия просвета) средних и мелких бронхов вязкой мокротой и выключения сегментов легких из процесса дыхания. Дополнительно назначаются отхаркивающие лекарства, стимулирующие работу реснитчатого эпителия, который проводит элиминацию (удаление) мокроты из дыхательных путей. Часто применяются фармакологические средства, снимающие спазм бронхиол. В большинстве случаев назначают антибиотикотерапию для подавления инфекционного процесса.В серьезных ситуациях мокроту отсатывают специальным вакуумным аспиратором, а также проводят бронхоскопическую санацию бронхиального дерева.
Мокрота преследует людей, злоупотребляющих курением. Утренний “кашель курильщика”, сопровождающийся отделением вязкой слизистой мокроты – привычное дело для тех, кто курит более 5 сигарет в день на протяжении нескольких лет. У курящих людей имеет место хронический воспалительный процесс на слизистой оболочке трахеи и бронхов вследствие постоянного токсического воздействия на клетки эпителия компонентами сигаретного дыма.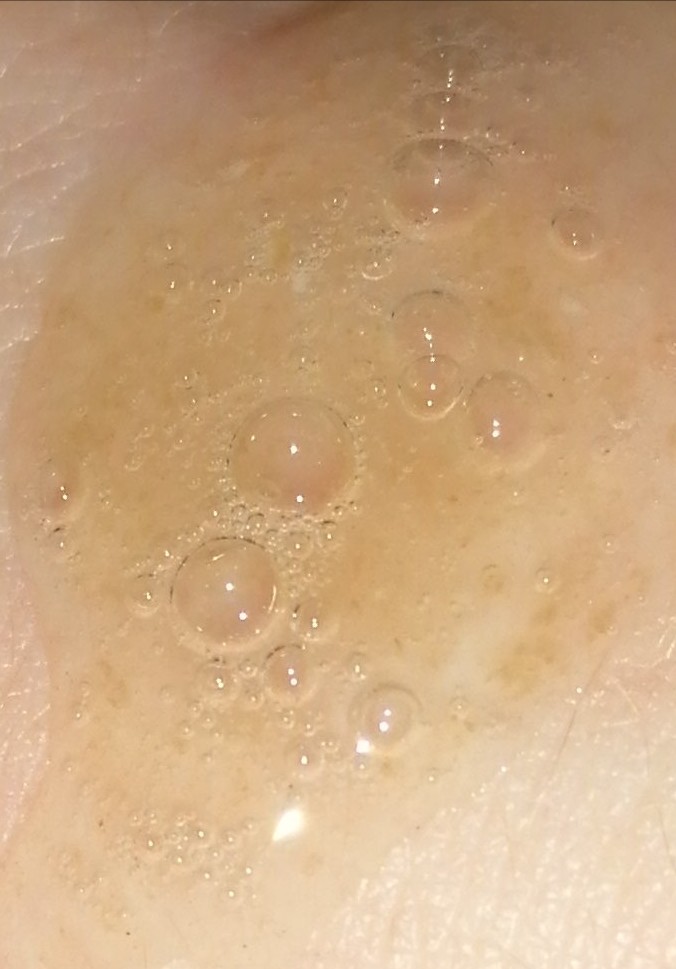
Воспаленная слизистая продуцирует мокроту в количествах, значительно превышающих нормальные показатели. К асептическому воспалению постепенно присоединяется хроническое бактериальное воспаление, вследствие чего отделяемая мокрота приобретает желто-зеленый или бурый цвет.
Отказ от курения позволяет перевести воспаление дыхательных путей в состояние ремиссии и прекратить возникновение утреннего кашля с мокротой.
Сдать анализ Mycobacterium tuberculosis(мокрота) – цена от 340 руб.
Туберкулез – специфическое инфекционное заболевание человека и животных, которое передаётся преимущественно воздушно-капельно. Риск заражения вырастает в связи с понижением иммунитета, вызванным ВИЧ/СПИДом, хроническими заболеванием почек, диабетом, беременностью, старением, пересадкой органов и связанным с этим приёмом подавляющих иммунитет препаратов. Кроме этого, более подвержены заболеванию дети до 5 лет после виража туберкулиновой пробы и те, кто имеет контакт с больными туберкулезом.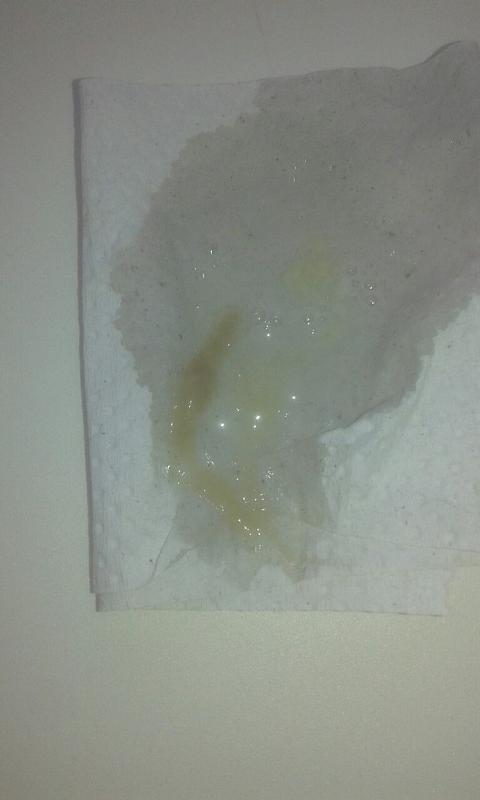 К самым уязвимым группам населения относятся бездомные, заключенные, наркоманы, а также пожилые люди.
К самым уязвимым группам населения относятся бездомные, заключенные, наркоманы, а также пожилые люди.Для данного исследования используется тест-система, основанная на выявлении геномной ДНК возбудителя туберкулеза с помощью полимеразной цепной реакции (ПЦР) В современной диагностике это один из самых быстрых, универсальных и высокочувствительных методов.
Диагностика туберкулеза легких (в частности, его внелегочных и генерализованных форм), и контроль за эффективностью терапииСимптоматика бактериемии в сочетании с туберкулезной инфекцией. (повышенная температура тела, потливость и пр.).
Наличие длительного контакта с больным туберкулезом
Гиперергическая реакция или вираж туберкулиновой пробы у детей
Наличие у пациента ВИЧ
Для получения достоверных результатов при исследовании методом ПЦР забор материала на выявление возбудителей инфекций:
- рекомендуется проводить до приема антибактериальных препаратов или не менее чем через 2 недели после последнего приема;
- рекомендуется проводить до начала противовирусной терапии или не менее чем через 2 недели после последнего приема ;
- рекомендуется проводить до приема противогрибковых препаратов или не менее чем через 2 недели после последнего приема;
- рекомендуется проводить до начала приема антибактериальных препаратов или не менее чем через 1 месяц после последнего приема антибактериальных препаратов для следующих инфекций .

Хламидия (Chlamydia trachomatis), Микоплазма (Mycoplasma genitalium), Уреаплазма (U.urealyticum / U.parvum), Микоплазма (Mycoplasma hominis), Гарднерелла (Gardnerella vaginalis), Возбудитель гонореи (Neisseria gonorrhoeae), Возбудитель трихомоноза (Trichomonas vaginalis).
Мазки из зева и носа берутся натощак (через 3-4 часа после последнего приема пищи).
Моча (только у мужчин) собирается в стеклянную или пластиковую посуду. Исследованию подлежит первая порция утренней мочи, в количестве 25-40 мл.
Соскоб из уретры рекомендуется сдавать через 2 часа после последнего мочеиспускания.
Внимание!
В соответствии с Федеральным законом ФЗ № 323 «Об основах защиты здоровья граждан в Российской Федерации» интерпретация результатов исследований, установление диагноза, назначение лечения, должны производиться врачом соответствующей специализации.
Телефон отделения: +7 (495) 695-56-95
Подготовка пациента к лабораторным исследованиям
Подготовка пациента к лабораторным исследованиям имеет большое значение для получения достоверных результатов анализов.
Взятие крови проводится с 8.00-10.00 ч. утра после 12 часового ночного голодания. Пациент перед сдачей крови не должен принимать пищу после ужина (19ч.), особенно для биохимических исследований крови.
За неделю до сдачи крови отменяются все препараты, содержащие железо и аскорбиновую кислоту.
Пациент за 3 дня до исследования крови не должен принимать: кофеин, теобромин, салицилаты, витамин С и мясные продукты.
понедельник – пятница с 8.00-10.00 ч.
Мочу собирают утром натощак, сразу после сна.Предварительно пациент должен удерживаться от мочеиспускания в течение 10-12 часов (при невозможности, пациент мочу в несколько приёмов и хранит собранную мочу в холодном месте). Собирают всю порцию утренней мочи в чистый пластиковый контейнер на 100мл. при свободном мочеиспускании. Перед сбором мочи проводят тщательный туалет половых органов.
Лежачих пациентов предварительно подмывают слабым раствором марганцовокислого калия. Мочу из судна, утки и горшка брать нельзя, так как на стенках сохранятся осадок фосфатов, способствующих, разложению свежей мочи. Если в лабораторию доставляется не вся собранная моча, то перед сливанием части ее необходимо тщательное взбалтывание, чтобы осадок, содержащий форменные элементы и кристаллы не был утрачен.Из длительно стоящего катетера мочу для исследования брать нельзя .Собирая мочу у лежачих пациентов, необходимо следить, чтобы сосуд был расположен выше промежности во избежание загрязнения из области анального отверстия.
Если в лабораторию доставляется не вся собранная моча, то перед сливанием части ее необходимо тщательное взбалтывание, чтобы осадок, содержащий форменные элементы и кристаллы не был утрачен.Из длительно стоящего катетера мочу для исследования брать нельзя .Собирая мочу у лежачих пациентов, необходимо следить, чтобы сосуд был расположен выше промежности во избежание загрязнения из области анального отверстия.
в лабораторию (понедельник-пятница) с 8.00 до10.00. в 99 кабинет в одноразовом пластиковом контейнере. Емкость возврату пациенту не подлежит, дезинфицируется и утилизируется.
На фоне обычной диеты (без сухоядения, усиленной водной нагрузки). Необходима отмена мочегонных средств. Сбор мочи: В 8 часов утра пациент мочится в унитаз. Далее до 8 часов утра следующего дня всю мочу пациент собирает в контейнер (банку) емкостью 2-3 литра.
В лабораторию (понедельник-пятница) с 8.00 до 10.00 часов в 99 кабинет.
Собирают на исследование утреннюю одноразовую порцию мочи в середине мочеиспускания, после тщательного туалета наружных половых органов.
Если у пациента в этот период менструация, посоветовать закрыть отверстие влагалища ватно-марлевым тампоном (для избежание попадания эритроцитов в мочу). Начать мочеиспускание в унитаз, затем в середине мочеиспускания собрать в чистый пластмассовый контейнер среднюю порцию мочи в количестве не менее 15-20 мл, затем мочеиспускание завершить в унитаз.
В лабораторию (понедельник-пятница) с 8.00 до 10.00 часов в 99 кабинет в одноразовом пластиковом контейнере. Емкость возврату пациенту не подлежит, дезинфицируется и утилизируется.
Желательно чтобы количество жидкости, выпитой во время исследования не превышало 1-1,5 литра. Обязательно учитывается количество выпитой жидкости за сутки жидкости.
В лабораторию. (Понедельник-пятница) С 8.00- 10.00 часов в 99 кабинет.
Собирается утренняя порция мочи в пластиковый контейнер. В течение 3 дней исследовать не менее 3-х порций мочи. В 1 день – 1-я, во 2 день 2-я порция, в 3-й 3-я порция.
Вторник, среда, пятница в лабораторию в 99 каб. с 8 до 10 часов в одноразовом пластиковом контейнере в закрытом виде. Готовность результата в течении 24 часов.
с 8 до 10 часов в одноразовом пластиковом контейнере в закрытом виде. Готовность результата в течении 24 часов.
Собирается утренняя порция мочи в пластиковый контейнер
Понедельник – пятница в лабораторию с 8 -10 часов в 99 каб, в закрытом пластиковом контейнере, емкость возврату не подлежит, дезинфицируется и утилизируется.
2.2. В/м и в/в введения лекарственных препаратов
2.3. Рентген, физиотерапевтические и эндоскопические процедуры,
2.4. Рекомендуется перед забором крови избегать стрессовых ситуаций.
В лаборатории – 101 кабинет, с 8.00-10.00ч. Понедельник-пятница.
Инструкция по подготовке пациента на тест толерантности к глюкозе
Подготовка пациента:
В течение 3-7 дней перед исследованием пациент:
- Находиться на обычной диете без ограничения и избытка жиров и углеводов. Не должен изменять привычного режима питания и мышечной нагрузки, получая диету, содержащую не менее 150,0 углеводов в сутки.
 Нежелателен приём: витамина С, никотиновой кислоты.
Нежелателен приём: витамина С, никотиновой кислоты. - В день предшествующий проведению теста, последний приём пищи не позднее 20 часов.
- Отменяются инъекции глюкозы, кофеина, адреналина.
Не рекомендуется перед исследованием:
- Физическая и умственная нагрузки
- В/м и в /в введение лекарственных препаратов
- Физиотерапевтические процедуры
- Рекомендовано избегать стрессовых ситуаций перед
- Сдачей крови.
- Строго запрещается курение, прием алкоголя в теч.12ч.
- Кровь на исследование берётся двукратно. Первое исследование берётся натощак в 8:00. в 101 каб.
- После взятия крови из пальца пациент в течении 3-5 минут выпивает 250-300 мл водного раствора глюкозы (для взрослого 75 гр.) (в лаборатории).
- Через 2 часа проводят повторное взятие крови после приёма глюкозы в 10:00час.в 100 кабинет.
Подготовка пациента:
В течение 3-7 дней перед исследованием пациент:
Находиться на обычной диете без ограничения и избытка жиров и углеводов. Не должен изменять привычного режима питания и мышечной нагрузки, получая диету, содержащую не менее 150,0 углеводов в сутки. Нежелателен приём: витамина С, никотиновой кислоты.
Не должен изменять привычного режима питания и мышечной нагрузки, получая диету, содержащую не менее 150,0 углеводов в сутки. Нежелателен приём: витамина С, никотиновой кислоты.
Не рекомендуется перед исследованием:
1. Физическая и умственная нагрузки
2. В/м и в /в введение лекарственных препаратов
3. Физиотерапевтические процедуры
4. Рекомендовано избегать стрессовых ситуаций перед сдачей крови.
5. Строго запрещается курение.
6. В зависимости от требований врача:
Первый вариант – Кровь на исследование берётся двукратно в этот же день. Первое исследование берётся натощак в 8:00ч. в 101 каб. с последующим приемом пищи- углеводный завтрак (2 чайные ложки сахара на стакан чая,бутерброт с белым хлебом). Через 2 часа проводят повторное взятие крови после приёма пищи в 10:00час.в 100 кабинете.
|
Инструкция по подготовке пациента и сбор
мокроты для исследования
|
1. Подготовка пациента
Подготовка пациента
- Особой подготовки не требует.
- Если пациент не выделяет мокроту, то накануне вечером и рано утром, в день сбора мокроты следует дать ему отхаркивающее средство или применять раздражающие ингаляции. Последнее провоцирует усиление секреции бронхов, кашель и отделение мокроты.
2. Сбор материала на общий анализ мокроты
- Собирается утром до приема пищи
- Гигиена полости рта (тщательно прополоскать ротовую полость и почистить зубы.)
• Собирается путем откашливания в одноразовый пластиковый контейнер.
3. Сбор материала на КУМ
( кислотоупорные микобактерии туберкулеза)
• В течение 2-3 дней исследовать не менее 3-х порций мокроты. В 1 день – 1 -я, 2-я порция.
Первая рано утром после гигиены полости рта. Вторая, перед выходом из дома в поликлинику
Вторая, перед выходом из дома в поликлинику
.Во 2 день – 3-я порция.
Выделение мокроты усиливается после нескольких глубоких вдохов..
Материал доставляют:
• Вторник, среда, пятница в лабораторию с 800 до 1000 ч. в 99к.
в закрытом пластиковом контейнере. Контейнер возврату пациенту не подлежит -дезинфицируется и утилизируется.
Готовность результата:
- на общий анализ мокроты:
на следующий день после приёма материала в 16-00 часов.
- НА КУМ -после сдачи 3-ех порций мокроты
Инструкция по подготовке к исследованию выделений
из женских половых органов
- Взятие материала проводится в день исследования медсестрой из смотрового кабинета 17 кабинет 1-й этаж.

- Нельзя брать материал во время менструального цикла.
- В течение 24 часов перед исследованием исключить использование раствора уксуса или Люголя, тампонов или спермицидов, спринцевания, введения во влагалище медикаментов, свечей, кремов, в том числе кремов для выполнения ультразвукового исследования
Материал доставляют: с 8.00-10.00ч понед.-пятниц. в 99 каб.
ИНСТРУКЦИЯ ПО ПОДГОТОВКЕ ПАЦИЕНТА
и СБОР КАЛА ДЛЯ ИССЛЕДОВАНИЯ
НА ЯЙЦА ГЕЛЬМИНТОВ.
Подготовка пациента:
Пациент находится на обычном водно-пищевом режиме.
- В течении 2 дней перед исследованием, не проводить очистительных клизм.
- Накануне исследования не вводить свечи, не употреблять внутрь касторовое (вазелиновое) масло
- За 2 суток до исследования отменить препараты, влияющие на перистальтику кишечника и окраску кала (слабительные, бария сульфат, препараты висмута, железа, активированный уголь)
Сбор материала:
Собирать кал лучше утренний.
- Непосредственно после дефекации взять из нескольких мест (исключая твёрдые участки и примесь мочи) кал, поместить в контейнер, закрыть крышечкой и в тёплом виде доставить в лабораторию.
- Если кал собран накануне, хранить его следует в прохладном месте не более 8 часов.
Материал доставляют:
- Понедельник, четверг в 99 кабинет, с 8.00-10.00 ч. в пластиковом контейнере.
ИНСТРУКЦИЯ ПО ПОДГОТОВКЕ ПАЦИЕНТА И СБОР КАЛА ДЛЯ ИССЛЕДОВАНИЯ НА КОПРОГРАММУ
Подготовка пациента:
Пациент находится на обычном водно-пищевом режиме.
- В течении 2 дней перед исследованием, не проводить очистительных клизм.
- Накануне исследования не вводить свечи, не употреблять внутрь касторовое (вазелиновое) масло
- За 2 суток до исследования отменить препараты, влияющие на перистальтику кишечника и окраску кала (слабительные, бария сульфат, препараты висмута, железа, активированный уголь)
Сбор материала:
Собирать кал лучше утренний.
- Непосредственно после дефекации взять из нескольких мест (исключая твёрдые участки и примесь мочи) кал, поместить в контейнер, закрыть крышечкой и в тёплом виде доставить в лабораторию.
- Если кал собран накануне, хранить его следует в прохладном месте не более 8 часов.
Материал доставляют:
- Понедельник, четверг в 99 кабинет, с 8.00-10.00 ч. в пластиковом контейнере
ИНСТРУКЦИЯ ПО ПОДГОТОВКЕ ПАЦИЕНТА И СБОР КАЛА ДЛЯ ИССЛЕДОВАНИЯ НА СКРЫТУЮ КРОВЬ.
Подготовка пациента:
В течении 3 дней перед исследованием, следует избегать пищи, содержащей пищевые продукты, которые наравне с кровью могут быть катализаторами в реакциях, направленных на её обнаружение (мясо, рыба, все виды зелёных овощей).
Сбор, доставка, приём материала
Аналогичны с исследованием на копрограмму
ИНСТРУКЦИЯ ПО ПОДГОТОВКЕ ПАЦИЕНТА НА ЗАБОР КРОВИ НА ОБЩЕКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ.
Выполняемые методики:
|
Развернутый анализ крови:
|
Общий анализ крови:
- Гемоглобин (HGB)
- Эритроциты (RBC)
- Скорость оседания эритроцитов (СОЭ)
- Лейкоциты (WBC)
• Лейкоцитарная формула
• Цветной показатель(MCH)
Кардиолипиновый антиген
Цветной показатель(MCH)
Кардиолипиновый антиген
Дополнительные исследования
- Ретикулоциты (Ret)
- Гематокритная величина (HCT)
Подготовка пациента.
- Кровь на исследование берется из пальца, из вены..
- Анализ проводится натощак
- В отдельных случаях допускается взятие крови после еды.
- Не рекомендуется перед исследованием:
– Физическая и умственная нагрузки”
– В/м и в/в введения лекарственных препаратов
– Rq – воздействие
– Физиотерапевтич. процедуры Время забора:
– В отделении КДЛ из пальца с 8.00-10.00ч , 101 кабинет
– понедельник-пятница
из вены в процедурном 65 кабинете .
Забор материала:
– Понедельник-пятница, 8.00-10.00ч ,101 кабинет.
-кровь берётся из пальца
В направлении обязательно указать:
|
– Возраст – Участок – КРАТКИЙ АНАМНЕЗ: > Место работы, место жительства. > Длительность и давность нахождения пациента в эпидемиологических |
– ФИО
ИНСТРУКЦИЯ ПО ЗАБОРУ КРОВИ ДЛЯ ОБНАРУЖЕНИЯ LE- КЛЕТОК (клетки красной волчанки)
Подготовка пациента.
- Кровь на исследование берется из вены в 65 кабинете.
- Анализ проводится натощак.
Забор материала:
Особенности: кровь берётся из вены 3 дня подряд, в количестве 10 мл в чистую сухую пробирку и доставляют в КДЛ с 8.00 до 10.00 часов
|
Инструкция по подготовке пациента и сбор
мокроты для исследования
|
1. Подготовка пациента
Подготовка пациента
- Особой подготовки не требует.
- Если пациент не выделяет мокроту, то накануне вечером и рано утром, в день сбора мокроты следует дать ему отхаркивающее средство или применять раздражающие ингаляции. Последнее провоцирует усиление секреции бронхов, кашель и отделение мокроты.
2. Сбор материала на общий анализ мокроты
- Собирается утром до приема пищи
- Гигиена полости рта (тщательно прополоскать ротовую полость и почистить зубы.)
• Собирается путем откашливания в одноразовый пластиковый контейнер.
3. Сбор материала на КУМ
( кислотоупорные микобактерии туберкулеза)
• В течение 2-3 дней исследовать не менее 3-х порций мокроты. В 1 день – 1 -я, 2-я порция.
Первая рано утром после гигиены полости рта. Вторая, перед выходом из дома в поликлинику
.Во 2 день – 3-я порция.
Выделение мокроты усиливается после нескольких глубоких вдохов..
Материал доставляют:
• Вторник, среда, пятница в лабораторию с 800 до 1000 ч. в 99к.
в закрытом пластиковом контейнере. Контейнер возврату пациенту не подлежит -дезинфицируется и утилизируется.
Готовность результата:
- на общий анализ мокроты:
на следующий день после приёма материала в 16-00 часов.
- НА КУМ -после сдачи 3-ех порций мокроты
Инструкция по подготовке к исследованию выделений
из женских половых органов
- Взятие материала проводится в день исследования медсестрой из смотрового кабинета 17 каб.

- Нельзя брать материал во время менструального цикла.
- В течение 24 часов перед исследованием исключить использование раствора уксуса или Люголя, тампонов или спермицидов, спринцевания, введения во влагалище медикаментов, свечей, кремов, в том числе кремов для выполнения ультразвукового исследования
Материал доставляют: с 8.00-10.00 ч. ежедневно в 99 каб.
ИНСТРУКЦИЯ ПО ПОДГОТОВКЕ ПАЦИЕНТА
и СБОР КАЛА ДЛЯ ИССЛЕДОВАНИЯ НА ЯЙЦА ГЕЛЬМИНТОВ.
Подготовка пациента:
Пациент находится на обычном водно-пищевом режиме.
- В течении 2 дней перед исследованием, не проводить очистительных клизм.
- Накануне исследования не вводить свечи, не употреблять внутрь касторовое (вазелиновое) масло
- За 2 суток до исследования отменить препараты, влияющие на перистальтику кишечника и окраску кала (слабительные, бария сульфат, препараты висмута, железа, активированный уголь)
Сбор материала:
Собирать кал лучше утренний.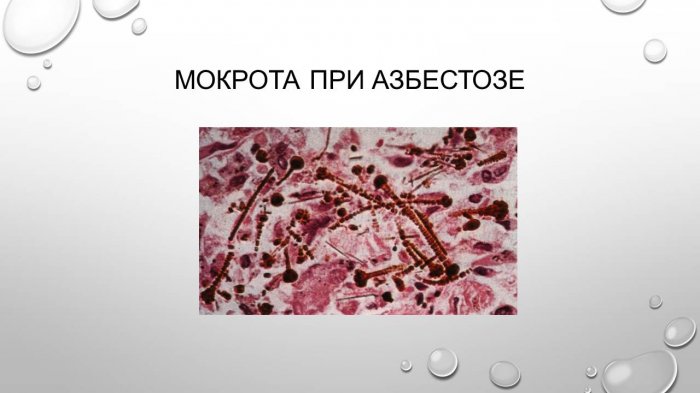
- Непосредственно после дефекации взять из нескольких мест (исключая твёрдые участки и примесь мочи) кал, поместить в контейнер, закрыть крышечкой и в тёплом виде доставить в лабораторию.
- Если кал собран накануне, хранить его следует в прохладном месте не более 8 часов.
Материал доставляют:
- Понедельник, четверг в 99 кабинет.
- С 8.00-10.00 ч.
ИНСТРУКЦИЯ ПО ПОДГОТОВКЕ ПАЦИЕНТА И СБОР КАЛА ДЛЯ ИССЛЕДОВАНИЯ НА КОПРОГРАММУ.
Подготовка, сбор, доставка, приём материала:
- Аналогичны с исследованием на яйца гельминтов
ИНСТРУКЦИЯ ПО ПОДГОТОВКЕ ПАЦИЕНТА И СБОР КАЛА ДЛЯ ИССЛЕДОВАНИЯ НА СКРЫТУЮ КРОВЬ.
Подготовка пациента:
В течении 3 дней перед исследованием, следует избегать пищи, содержащей пищевые продукты, которые наравне с кровью могут быть катализаторами в реакциях, направленных на её обнаружение (мясо, рыба, все виды зелёных овощей).
Сбор, доставка, приём материала и выдача результатов:
Аналогичны с исследованием на яйца гельминтов.
Правила приема анализов
1. Моча принимается ежедневно.
2. Кал принимается в закрытом виде понедельник, четверг.
Согласно Санитарно-эпидемиологическим правилам СП 1.3.2322-08 от 24.01.2008 г. №4 “Безопасность работы с микроорганизмами III-IV групп патогенности и возбудителями паразитарных болезней” емкость после анализов дезинфицируется, утилизируется и возврату пациентам не подлежит.
3. Мокрота согласно “Приложению №10 к приказу МЗ России от 21.03.2003 г. №109 ” принимается в закрытом пластиковом контейнере. Дни приема: вторник, среда, пятница.
Контейнер дезинфицируется, утилизируется и возврату пациентам не подлежит.
Кабинет №99
Прием анализов:
мочи, кала, мокроты
с 08.00-10.00 часов
1. Моча принимается ежедневно.
2. Кал принимается в закрытом виде понедельник, четверг.
3. Мокрота принимается в закрытом пластиковом контейнере вторник, среда, пятница.
Консультации специалистов
| Ультразвуковые исследования
| Лучевая диагностика
| Лабораторные исследования
|
Памятка для населения о коронавирусе нового типа 2019-nCoV
30 января 2020 г.
Возможность завоза в Россию обнаруженного в Китае нового типа коронавируса 2019-nCoV нельзя исключить полностью. Однако вероятность его распространения по стране оценивается как низкая, сообщили ТАСС в пресс-службе Роспотребнадзора.
По информации Роспотребнадзора, главная опасность нового коронавируса в том, что он вызывает смертельное для человека заболевание». Вирус распространился за пределы Китая — в Южную Корею, Японию и Таиланд. Пекин официально подтвердил, что 2019-nCoV передается от человека к человеку, в связи с чем возникает необходимость проведения профилактических и противоэпидемических мероприятий при выявлении и госпитализации пациентов с подозрением на заболевание, вызванное новым типом коронавируса2019-nCoV (госпитализация в боксы при любой степени тяжести при указании нахождения в Китае, работа в масках, перчатках, смена защитной одежды при переходе к пациентам с другими заболеваниями).
Клинические проявления заболевания.
Коронавирусы – семейство из более чем 30 вирусов, разделенных на два подсемейства. Впервые были выделены в 1965 году. Поражают людей, домашних животных, птиц, свиней, крупный рогатый скот.
Впервые были выделены в 1965 году. Поражают людей, домашних животных, птиц, свиней, крупный рогатый скот.
В настоящее время известны только 6 коронавирусов, которые заражают людей. Четыре из них, как правило, вызывают симптомы обычной простуды. Два других, коронавирус Тяжелого острого респираторного синдрома (ТОРС) и коронавирус Ближневосточного респираторного синдрома (БВРС), вызывают серьезные заболевания дыхательных путей, которые могут закончиться летальным исходом.
Коронавирус способен провоцировать поражение дыхательной системы, желудочно-кишечного тракта, нервной системы.
К основным симптомам нового коронавируса специалисты относят температуру, утомление и кашель с небольшой мокротой. В дальнейшем у заболевших может проявиться одышка. Согласно лабораторным тестам, у больных на ранних стадиях уровень лейкоцитов был в норме или понижен, а лимфоцитов – снижался, у некоторых отмечалось повышенное количество ферментов печени и мышц.
На ранней стадии болезни более чем у 90% больных была температура, примерно у 80% – сухой кашель, у более чем 20% – сдавленность в груди, около 20% больных имели одышку, около 15% – диспноэ, около 80% – нормальный или сниженный уровень лейкоцитов, и у всех больных рентгенограмма показывала пневмонию.
При посещении неблагополучных по заболеванию территорий или при уходе за больным для защиты органов дыхания использовать медицинские маски только промышленного производства с высокой эффективностью бактерицидной фильтрации защиты от биологических жидкостей. Маски должны плотно прилегать к лицу, исключать боковую протечку воздуха и иметь полосу обтюрации.
При оставлении больного на дому рекомендована временная или барьерная (до выздоровления) изоляция заболевшего в пределах квартиры.
Лиц, проживающих в гостиницах и общежитиях, с клиническими проявлениями ОРИ, изолируют до момента осмотра врачом, при необходимости госпитализируют.
Места временной изоляции заболевших должны быть обеспечены необходимыми средствами, ограничивающими возможность распространения вируса от заболевшего:
спиртосодержащие антисептики для поддержания гигиены рук;
одноразовые носовые платочки для удаления носовой слизи;
полиэтиленовые мешки для утилизации использованных предметов;
медицинские маски фабричного производства;
технические средства и оборудование для влажной уборки помещений;
моющие и дезинфицирующие средства, в том числе средства для обеззараживания воздуха.
Инструкции по правилам сбора биологического материала для микробиологических исследований
Общие требования
- Проведение исследования и сбора материала до начала лечения антибиотиками, антисептиками, противогрибковыми препаратами.
- Использование расходных материалов (контейнеров, пробирок, флаконов с питательными средами и
транспортных систем в пробирках, сухих стерильных тампонов, направительных бланков), выдаваемых
лабораторией ИНВИТРО.
- Правильное хранение выданных транспортных сред (в холодильнике) и согревание до комнатной температуры
перед использованием (примерно 30 минут).
- Правильный выбор транспортной среды для каждого вида исследования. Информацию об используемых
транспортных средах и других расходных материалах смотрите в разделе «Описание тестов».
- Обязательная маркировка пробирок, контейнеров, флаконов и транспортных сред с указанием Фамилии И.
 О.,
даты рождения, даты и времени взятия материала и локализации, откуда получен образец.
О.,
даты рождения, даты и времени взятия материала и локализации, откуда получен образец. - При оформлении направительного бланка заполнение всех граф, с указанием локализации материала и номера теста. Информация на бланке и материале должны совпадать, иначе материал в работу не будет браться.
- Соблюдение сроков и режима хранения проб, полученных для исследований.
Информация для гастроэнтерологов
ПРАВИЛА СБОРА КАЛА ПРИ ИССЛЕДОВАНИИ МИКРОФЛОРЫ КИШЕЧНИКА (ДИСБАКТЕРИОЗ)- Все обследуемые пациенты за 1-3 дня до взятия пробы должны находиться на диете, исключающей приём продуктов, усиливающих процессы брожения в кишечнике и молочно-кислые продукты, также алкоголь, антибиотики и бактерийные препараты (содержащие бифидобактерии, лактобактерии, кишечные палочки и т.д.).
- Материалом служит кал после естественной дефекации, который собирают в чистый одноразовый контейнер с
завинчивающейся крышкой и ложечкой.

- Не рекомендуется собирать кал из унитаза.
- Собирают кал на чистую поверхность, в качестве которой может быть использован чистый новый лист (пакет) из полиэтилена или бумаги (этот способ является предпочтительным).
- При использовании судна, его предварительно хорошо промывают с мылом и губкой, ополаскивают многократно
водопроводной водой, а потом обдают кипятком и остужают.
- Кал берут преимущественно из средней порции специальной ложечкой, вмонтированной в крышку стерильного контейнера, в количестве не более 1/3 от объема контейнера. Не наполняйте контейнер доверху. Тщательно закройте крышку.
- Срок и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Для правильной оценки результатов рекомендуется проведение 2-3-кратных исследований с интервалом 1-2 дня.
- Взятие проб кала должно осуществляться на ранних этапах болезни, пока патогенные микробы содержатся в
материале в большом количестве.

- Для сбора кала пациенту выдается контейнер с крышкой и ложечкой.
- Если пациент собирает кал дома, ему нужно выдать инструкцию (см. выше), где изложены правила сбора и предупредить о том, что материал должен быть доставлен в лабораторию, как можно быстрее.
- Если кал собирается в условиях медицинского центра и доставка не может быть осуществлена в кратчайший
срок, для сохранности материала используют транспортную систему со средой Cary Blair. Тампон погружают в
фекалии поочередно в нескольких местах, после чего он погружается в пробирку с транспортной средой. Нет
необходимости переносить кусочки кала.
- Если кал собираются исследовать только на золотистый стафилококк или грибы, то в качестве транспортной
среды может быть использована среда Эймс с углем.
- При исследовании кала на ротавирус и Clostridium difficile жидкий кал доставляется только в контейнере,
а не на тампоне.

- Хранение кала уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Кал в стерильном контейнере с момента его получения до переноса в транспортную среду может храниться при комнатной температуре не более 2-х часов.
- Перед взятием мазка проводится тщательный туалет с мылом и водой области вокруг анального отверстия для снижения контаминации пробы.
- Осторожно вводят тампон на 2,5 см вглубь анального сфинктера и аккуратно вращают его в течение 10
секунд для получения материала с анальных складок, после чего помещают в пробирку с транспортной средой
Cary Blair.
- Если цель исследования посев на гонорею, мазок берут аналогичным образом в транспортную среду Эймс с
углем.
- Хранение материала, в зависимости от вида исследования, уточняйте у менеджеров Независимой лаборатории
ИНВИТРО.

- Желчь собирают при зондировании в процедурном кабинете отдельно по порциям А, В и С в три стерильные пробирки с плотно закрывающимися крышками.
- Полученные порции желчи желательно доставить в лабораторию не позднее 1-2 ч от момента взятия.
- При невозможности доставить материал в указанный срок, допускается хранение.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Материал собирается рано утром, до еды, пока пациент еще в постели.
- Вводят назо-гастральный зонд через нос в желудок.
- Желудок промывают 25-50 мл охлажденной дистиллированной водой.
- Далее жидкость отсасывается и помещается в стерильный контейнер. Крышку плотно закрывают.
- Аккуратно, следуя правилам, удаляют зонд.

- Материал может храниться не более 2-х часов при комнатной температуре и не более 24-х часов при 2-8С.
- 1-2% раствором йода дезинфицируют кожу в области манипуляции.
- Посредством чрезкожной пункции (или во время операции) жидкость набирается в шприц.
- Важно набрать большой объем жидкости (сколько возможно)! Полученную жидкость помещают в стерильный контейнер с крышкой. Крышку плотно закрывают.
- Допустимо использовать для транспорта и культивирования флаконы для гемокультур, тогда соблюдают те же
правила, что и при взятии крови (в этом случае следует заказать исследование № 438).
- Материал хранят в тепле и доставляют в лабораторию силами заказчика при температуре 35С.
- Перед сцеживанием молока тщательно помойте руки и молочные железы с мылом, обработайте соски и
околососковую область ватными тампонами, смоченными 70% спиртом (каждая железа обрабатывается отдельным
тампоном).

- Сцедите первые 5-10 мл в отдельную посуду (т.к. эта порция молока не пригодна для исследования), последующие 4-5 мл сцедите в стерильный контейнер с красной крышкой, старайтесь при этом не касаться краёв контейнера телом.
- Молоко из каждой железы собирайте в отдельный контейнер. После сцеживания плотно закройте крышку, стараясь не дотрагиваться краев контейнера руками.
- Промаркируйте каждый контейнер, указав фамилию, инициалы, дату рождения, на каждом контейнере необходимо указать: «правая молочная железа» или «левая молочная железа».
- Молоко до отправки в лабораторию должно храниться в холодильнике не более 24-х часов.
Информация для гинекологов
ПРАВИЛА ВЗЯТИЯ МАЗКОВ У ЖЕНЩИН ДЛЯ МИКРОСКОПИЧЕСКОГО (БАКТЕРИОСКОПИЧЕСКОГО) ИССЛЕДОВАНИЯ
- Используйте только новые стекла с матовым краем, которые выдает лаборатория ИНВИТРО (или, если у вас в
нужный момент не оказалось наших стекол, вы можете использовать свои, но обязательно новые, проверьте,
чтоб они были чистыми).

- Перед тем, как взять мазок очень важно убрать из влагалища избыток выделений и слизи сухой стерильной марлевой салфеткой (т.к. там содержатся разрушенные клетки и лейкоциты, детрит и мертвые микробные клетки). При несоблюдении этого требования описанная нами микроскопическая картина введёт вас в заблуждение, т.к. ядра эпителиальных клеток и детрит встречаются при таком патологическом состоянии, как цитолитический вагиноз, которого на самом деле может и не быть, а часть микробов не удастся правильно идентифицировать, в связи с тем, что они потеряют способность правильно воспринимать красители.
- Нанесите мазок в центре стекла и распределите материал равномерно тонким слоем.
- Маркируйте стекло на противоположной от мазка стороне.
- Отметьте на стекле локализацию каждого мазка, если их наносится на стекло более одного (например “С”,
“V”, “U”).

- На матовом крае простым карандашом укажите ФИО пациента, дату рождения.
- Дайте мазку хорошо высохнуть прежде, чем упаковать перед отправкой.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Перед сбором мочи подготовьте 6 – 10 чистых ватных шариков, сосуд с теплым мыльным раствором (пользуйтесь обычным туалетным мылом), сосуд с теплой кипяченой водой и контейнер для сбора мочи (крышку контейнера приоткройте так, чтобы ее можно было снять одной рукой).
- Вымойте руки с мылом.
- Удобно расположитесь на унитазе и разведите колени как можно шире.
- Вымойте область наружных половых органов, последовательно меняя 4 ватных шарика, смоченных в мыльном
растворе. Каждым шариком необходимо провести по направлению от лобка к заднему проходу только один раз,
стараясь проникать во все складки.

- Промойте намыленный участок с помощью двух и более ватных шариков, смоченных в теплой кипяченой воде. Каждым шариком необходимо провести по направлению от лобка к заднему проходу только один раз, стараясь проникать во все складки.
- Во избежание попадания в мочу выделений из влагалища, во время сбора мочи женщинам, живущим половой жизнью, рекомендуется ввести во влагалище тампон.
- Снимите крышку с контейнера и возьмите его в руку, стараясь не касаться краев. Приготовьтесь собрать
мочу.
- Удерживая половые губы разведенными, выпустите немного мочи в унитаз, приостановите мочеиспускание, а
затем, подставив контейнер под струю мочи, наполните его до половины объема. Постарайтесь не прикасаться
контейнером к телу.
- Открутить крышку пробирки «Уро-тампон» и извлечь аппликатор с губкой.

- Опустить губчатый тампон в образец мочи на 5 секунд, пока губка полностью не пропитается мочой (вар.1)
или непосредственно помочиться на тампон (вар. 2).
- Вернуть аппликатор с тампоном в пробирку и плотно ее закрыть.
- Произвести маркировку пробы на этикетке, находящейся на пробирке. Внимание! Губку, находящуюся в пробирке не отжимать.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Перед взятием мазка на посев проводится туалет наружных половых органов для снижения контаминации пробы с помощью стерильных салфеток и дистиллированной воды.
- Материал собирают не ранее, чем через 2 часа после мочеиспускания.
- Для стимуляции выделений нежно массируют уретру, отделяемое собирают стерильным тампоном, входящим в
состав транспортной среды Эймс с углем.

- Если отделяемое получить не удается, в уретру вводят стерильный тампон на глубину 1-2 см, аккуратно
вращают его в течение 10 сек., вынимают, помещают в транспортную среду Эймс с углем.
- Для исследования на микоплазмы транспортной средой является флакончик с бульоном светло-желтого цвета, на трихомонады флакончик с транспортной средой для трихомонад. Для сбора материала используют сухой тампон без среды, находящийся в индивидуальной стерильной упаковке.
- Материал хранится, помещенный в транспортную среду, в зависимости от вида исследования, сроки и условия
хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Материал берут стерильным тампоном, входящим в состав транспортной системы Эймс с углем.
- При воспалении бартолиниевых желез производят их пункцию.
 При вскрытии абсцесса железы гной берут
стерильным тампоном, входящим в состав транспортной системы Эймс с углем, после чего его погружают в
пробирку со средой.
При вскрытии абсцесса железы гной берут
стерильным тампоном, входящим в состав транспортной системы Эймс с углем, после чего его погружают в
пробирку со средой. - Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Материал берут до проведения мануальных исследований.
- Зеркало и подъемник вводят во влагалище, стерильной салфеткой убирают избыток выделений и слизи. Материал собирают из заднего свода или с патологически измененных участков стерильным тампоном, входящим в состав транспортной системы со средой Эймс с углем.
- При исследовании на уреа/микоплазмы для сбора материала используют сухой тампон, находящийся в индивидуальной стерильной упаковке. После того, как материал получен, его суспендируют во флаконе для микоплазм.
- При посеве на трихомонады для сбора материала используют сухой тампон, находящийся в индивидуальной
стерильной упаковке.
 После того, как материал получен, его суспендируют во флаконе с транспортной средой
для трихомонад.
После того, как материал получен, его суспендируют во флаконе с транспортной средой
для трихомонад. - Хранение материала, в зависимости от вида исследования, уточняйте у менеджеров Независимой лаборатории
ИНВИТРО.
- Обнажают шейку матки с помощью зеркал и влагалищную ее часть и убирают избыток выделений и слизи стерильной марлевой салфеткой или ватным шариком, смоченными стерильным физиологическим раствором или дистиллированной водой. Далее вытирают салфеткой избыток влаги.
- Тонкий стерильный тампон (входящий в состав транспортной системы) аккуратно вводят в цервикальный канал и вращают 10 сек., не касаясь стенок влагалища.
- Для посева можно использовать соскоб слизистой, полученный при диагностическом выскабливании стенок
цервикального канала. В этом случае материал переносится на тампон и погружается в пробирку с
транспортной средой Эймс с углем.

- При исследовании на уреа/микоплазмы и трихомонады материал берут так же, как описано выше.
- Хранение материала, в зависимости от вида исследования, уточняйте у менеджеров Независимой лаборатории
ИНВИТРО.
- Используют специальные инструменты типа шприца-аспиратора, имеющего на зонде покрытие.
- При введении зонда в полость матки раскрывают наружную оболочку зонда и набирают в шприц содержимое матки.
- Закрывают наружную оболочку и выводят зонд из матки.
- Материал из шприца помещают на тампон и погружают в транспортную среду Эймс с углем.
- Хранение материала, в зависимости от вида исследования, уточняйте у менеджеров Независимой лаборатории
ИНВИТРО.
Информация для урологов
ПРАВИЛА ВЗЯТИЯ МАЗКОВ У МУЖЧИН ДЛЯ МИКРОСКОПИЧЕСКОГО (БАКТЕРИОСКОПИЧЕСКОГО) ИССЛЕДОВАНИЯ
- Используйте только новые стекла с матовым краем, которые выдает лаборатория ИНВИТРО (или, если в нужный
момент у вас не оказалось наших стекол, вы можете использовать свои, но обязательно новые и чистые).

- Перед тем, как взять мазок из уретры очень важно провести гигиеническую обработку кожи головки полового члена с помощью мыла и воды для уменьшения контаминации мазка посторонней флорой. После обработки осушить головку полового члена с помощью стерильной марлевой салфетки.
- С помощью специальных инструментов, используемых в вашем медицинском центре, соберите отделяемое уретры, нанесите мазок в центре стекла и распределите материал равномерно тонким слоем.
- Если исследуется секрет простаты, мазок наносится на стекло, распределяется равномерно тонким слоем.
- Обязательно дайте мазку хорошо высохнуть прежде, чем упаковывать перед отправкой.
- На матовом крае простым карандашом укажите ФИО пациента, дату рождения.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.

Для анализов №440, №444
- Вымойте руки с мылом.
- Отведите назад крайнюю плоть (если она не обрезана), головку полового члена вымойте с мылом теплой
кипяченой водой, просушите с помощью чистой салфетки.
- Подготовьте контейнер, приоткрыв крышку контейнера так, чтобы ее можно было снять одной рукой. Не
дотрагивайтесь руками до внутренних стенок контейнера и крышки.
- Выпустите небольшое количество мочи в унитаз. Приостановите мочеиспускание.
- Удерживая крайнюю плоть в отведенном положении, направьте струю мочи в контейнер и наполните его до
половины объема, при этом старайтесь не касаться краев контейнера. Если целью исследования является
выявление уреа/микоплазм, то объем мочи должен быть не менее 40-50 мл (это почти полный контейнер).

- Тщательно закройте контейнер крышкой.
- Хранение материала уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Вымойте руки с мылом.
- Отведите назад крайнюю плоть (если она не обрезана), головку полового члена вымойте с мылом теплой кипяченой водой, просушите с помощью чистой салфетки.
- Подготовьте контейнер, приоткрыв крышку контейнера так, чтобы ее можно было снять одной рукой. Не дотрагивайтесь руками до внутренних стенок контейнера и крышки.
- Выпустите небольшое количество мочи в унитаз. Приостановите мочеиспускание.
- Удерживая крайнюю плоть в отведенном положении, направьте струю мочи в контейнер и наполните его до
половины объема, при этом старайтесь не касаться краев контейнера. Объем мочи должен быть не менее 1/3
контейнера.

- Открутить крышку пробирки «Уро-тампон» и извлечь аппликатор с губкой.
- Опустить губчатый тампон в образец мочи на 5 секунд, пока губка полностью не пропитается мочой (вар.1)
или непосредственно помочиться на тампон (вар. 2).
- Вернуть аппликатор с тампоном в пробирку и плотно ее закрыть.
- Произвести маркировку пробы на этикетке, находящейся на пробирке. Внимание! Губку, находящуюся в
пробирке не отжимать.
- Хранение материала уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Материал собирают не ранее, чем через 2-3 часа после мочеиспускания.
- Перед взятием мазка из уретры, кожу обрабатывают салфеткой, смоченной стерильным физиологическим
раствором или дистиллированной водой. Высушивают стерильной салфеткой.

- В уретру на глубину 2-4 см аккуратно вводят стерильный тампон на тонком аппликаторе, входящий в состав
транспортной системы Эймс с углём. Нежно, но интенсивно вращают им внутри в течение 10 сек., после чего
тампон помещают в пробирку со средой.
- Если проводится исследование на уреа/микоплазмы или трихомонады, для сбора материала используется тампон без среды, находящийся в индивидуальной стерильной упаковке. Клетки и слизь с тампона тщательно суспендируют в соответствующий флакон с жидкой средой (просьба, не путать флаконы для трихомонад и микоплазм).
- Хранение материала, в зависимости от вида исследования, уточняйте у менеджеров Независимой лаборатории
ИНВИТРО.
- Перед сбором материала проводят тщательный туалет наружных половых органов с помощью мыла и кипяченой
воды.

- Проводят ручной массаж простаты через прямую кишку.
- Материал собирают в стерильную пробирку, а затем используют транспортную систему со средой Эймс с углем. Пропитайте жидкостью стерильный тампон и поместите его в пробирку с транспортной средой.
- Если проводится исследование на уреа/микоплазмы, собранный материал в количестве 0,5 мл (несколько капель) помещается во флакончик с транспортной средой для микоплазм.
- При посеве на трихомонады секрет простаты сначала собирается в стерильный контейнер с крышкой, а затем
аккуратно переливается во флакончик с транспортной средой для трихомонад в количестве 0,5-1,0 мл. Можно
сразу собрать секрет простаты во флакончик.
- Хранение материала, в зависимости от вида исследования, уточняйте у менеджеров Независимой лаборатории
ИНВИТРО.
- Очищают поверхность язвы тампоном, смоченным физиологическим раствором, корочки удаляют.

- Производят соскоб язвы до появления серозной жидкости.
- Стерильной салфеткой удаляют жидкость и органические наслоения. (Следует избегать кровоточивости).
- Надавливают у основания язвы до появления серозной жидкости.
- Аспирируют выделившуюся жидкость шприцом с тонкой иглой.
- Материал из шприца переносят на тампон, который потом погружают в пробирку со средой Эймс с углем.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Перед сбором материала тщательно вымойте руки с мылом, а затем проведите туалет наружных половых органов также с мылом и водой. Головку полового члена и крайнюю плоть высушите стерильной салфеткой.
- Подготовьте контейнер, крышку контейнера приоткройте так, чтобы ее можно было снять одной рукой.
 Не
дотрагивайтесь руками до внутренних стенок контейнера и крышки.
Не
дотрагивайтесь руками до внутренних стенок контейнера и крышки. - Материал получают путем мастурбации и собирают в стерильный контейнер. Если объем полученной спермы
очень мал, можно использовать транспортную систему со средой Эймс с углем. Для этого пропитайте
жидкостью стерильный тампон, входящий в состав транспортной системы и поместите его в пробирку со
средой. Возможна доставка материала в контейнере.
- Обратите внимание на то, чтобы крышка на контейнере была хорошо закрыта (во избежание вытекания материала).
- Если проводится исследование на уреа/микоплазмы, собранный материал в количестве 0,5 мл (несколько капель) помещается во флакончик с транспортной средой для микоплазм.
- Хранение материала, в зависимости от вида исследования, уточняйте у менеджеров Независимой лаборатории
ИНВИТРО.
 При культуральном исследовании на влагалищную трихомонаду предпочтительней исследовать секрет
простаты, который собирают в стерильную пробирку и переносят во флакон со средой для транспортировки и
культивирования трихомонад. Хранение и доставка осуществляется силами заказчика при температуре 35С в
наиболее короткие сроки. При исследовании на гонорею материал хранится и доставляется заказчиком
самостоятельно в наиболее короткие сроки при температуре 35С. Срок хранения материала в транспортной
среде не более 5-6 часов.
При культуральном исследовании на влагалищную трихомонаду предпочтительней исследовать секрет
простаты, который собирают в стерильную пробирку и переносят во флакон со средой для транспортировки и
культивирования трихомонад. Хранение и доставка осуществляется силами заказчика при температуре 35С в
наиболее короткие сроки. При исследовании на гонорею материал хранится и доставляется заказчиком
самостоятельно в наиболее короткие сроки при температуре 35С. Срок хранения материала в транспортной
среде не более 5-6 часов.
Информация для отоларингологов
МАЗКИ ИЗ ЗЕВА
Материал не следует брать при воспаленном надгортаннике, так как может возникнуть обструкция дыхательных путей.
- Мазок берут натощак или через 2-3 ч после еды и питья.
- Обратите внимание на то, что перед манипуляциями не надо полоскать рот.
- Аккуратно прижимают язык шпателем, стерильным тампоном от транспортной системы Эймс с углем проводят
между дужками миндалин, по язычку и задней стенке глотки, не касаясь губ, щек и языка.
 При наличии
гнойных наложений мазок желательно брать на границе здоровых и пораженных тканей (т.к. именно там
находится наибольшее количество микробов).
При наличии
гнойных наложений мазок желательно брать на границе здоровых и пораженных тканей (т.к. именно там
находится наибольшее количество микробов). - Тампон погружают в пробирку с транспортной средой.
- Сроки и режимы хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Для обоих носовых ходов используется один тампон с транспортной средой Эймс.
- Перед взятием мазков не надо промывать носовые ходы.
- Вводят тампон в носовой ход на глубину 2-2,5 см на уровне носовой раковины.
- Прижать тампон крылом носа к носовой перегородке и вращательными движениями тампона собирают материал со слизистой носа.
- Аналогичным образом берут материал в другом носовом ходе.
- Тампон погрузить в пробирку с транспортной средой.

- Сроки и режимы хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Материал берется натощак или через 2-3 часа после еды или питья.
- Обратите внимание на то, что перед манипуляциями не надо полоскать рот.
- Для взятия материала предпочтительно использовать транспортную среду с тампоном на алюминиевом аппликаторе, т.к. его можно изогнуть под углом 120˚, что необходимо для достижения области ротоглотки. Вскрыть упаковку с транспортной средой со стороны крышек, достать пробирку, аппликатор изогнуть, не вынимая его из стерильной упаковки. Руками к аппликатору не прикасаться. Держать за крышку.
- Пациента усаживают на стул против источника света. После фиксации языка деревянным шпателем тампон
заводят за корень языка вниз и проводят стерильным тампоном по задней поверхности ротоглотки.
 При
выполнении данной процедуры стараться не прикасаться к языку и слизистым щек.
При
выполнении данной процедуры стараться не прикасаться к языку и слизистым щек. - Тампон погрузить в пробирку с транспортной средой.
- Сроки и режимы хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Материал берется натощак или через 2-3 часа после еды или питья.
- Обратите внимание на то, что перед манипуляциями не надо полоскать рот.
- Для взятия материала предпочтительно использовать транспортную среду с тампоном на алюминиевом аппликаторе, т.к. его можно изогнуть под углом 120˚, что необходимо для достижения области носоглотки. Вскрыть упаковку с транспортной средой со стороны крышек, достать пробирку, аппликатор изогнуть, не вынимая его из стерильной упаковки. Руками к аппликатору не прикасаться. Держать за крышку.
- Пациента усаживают на стул против источника света. После фиксации языка деревянным шпателем тампон
заводят под мягкое нёбо за маленький язычок вверх и проводят стерильным тампоном по передней поверхности
носоглотки. При выполнении данной процедуры стараться не прикасаться к языку или слизистым щек.
- Тампон погрузить в пробирку с транспортной средой.
- Сроки и режимы хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Производят пункцию верхнечелюстной пазухи, соблюдая правила асептики.
- Далее содержимое аспирационного шприца переносят на стерильный тампон, входящий в состав транспортной
системы Эймс с углем (можно небольшое количество жидкости добавить в пробирку с транспортной средой).
- Сроки и режимы хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Очищают наружный слуховой проход слабым раствором антисептика.
- Если барабанная перепонка не нарушена, ушной канал промывают мыльным раствором, ополаскивают, высушивают, и, используя аспирационную технику, набирают жидкость в шприц. Далее аспират из шприца переносят на стерильный тампон, входящий в состав транспортной системы Эймс с углем (можно небольшое количество жидкости добавить в пробирку с транспортной средой).
- При прободении барабанной перепонки экссудат собирают стерильным тампоном, входящим в состав
транспортной системы Эймс с углем, используя слуховое зеркало.
- После взятия материала тампон погружают в пробирку со средой.
- Сроки и режимы хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Обрабатывают кожу 70% спиртом и промывают физиологическим раствором.
- При помощи влажного (смоченного стерильным физиологическим раствором) тампона из ушного канала удаляют соринки и корки.
- Материал из очага берут стерильным тампоном, входящим в состав транспортной системы Эймс с углем,
интенсивно вращая им в наружном слуховом проходе (но осторожно, чтоб не повредить барабанную перепонку).
- После взятия материала тампон погружают в пробирку со средой.
- Сроки и режимы хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
Информация для пульмонологов
ПРАВИЛА СБОРА МОКРОТЫ
- Исследованию подлежит утренняя мокрота, выделяющаяся во время приступа кашля.
- Перед откашливанием необходимо почистить зубы и прополоскать рот кипяченой водой с целью механического
удаления остатков пищи, слущенного эпителия и микрофлоры ротовой полости. Следите за тем, чтобы в
контейнер не попала слюна и носоглоточная слизь (особенно при насморке!).
- Выделившуюся мокроту собирают в стерильный контейнер с красной крышкой.
- Крышку плотно закрывают, чтобы материал не вытек.
- Если мокрота отделяется плохо, накануне пациенту дают отхаркивающие средства.
- Для микроскопического исследования мазок на стекле делать не надо, мокроту присылают в контейнере.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Исследуют при отсутствии мокроты или невозможности ее выделить естественным путем.
- Гортанным шприцем в трахею вводят не более 5 мл стерильного физиологического раствора с последующим его
отсасыванием в стерильную пробирку с желтой крышкой.
- Бронхиальные смывы, в том числе вблизи очага воспаления, могут быть сделаны с помощью бронхоскопа.
- Смывную жидкость помещают в стерильный контейнер с крышкой. Крышку плотно закрывают.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Кожу перед пункцией обрабатывают 2% раствором йода, а затем 70% этиловым спиртом.
- Делают прокол и собирают жидкость в стерильную пробирку с соблюдением правил асептики.
- Во время получения материала участвуют двое, один пунктирует, другой открывает крышку пробирки в нужный момент, стараясь не прикасаться руками к верхнему краю пробирки и внутренней поверхности крышки.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
Информация для окулистов
ОТДЕЛЯЕМОЕ КОНЬЮНКТИВЫ
- Материал для посева забирается утром до умывания.
- При наличии обильного гнойного отделяемого используют стерильный тампон, входящий в состав транспортной системы Эймс с углем. Гной собирают с внутренней поверхности нижнего века движением от наружного к внутреннему углу глазной щели.
- Необходимо следить, чтобы при моргании ресницы не касались тампона (придерживать веки руками).
- При скудном отделяемом тампон предварительно смачивают стерильным физиологическим раствором или
стерильной дистиллированной водой. Избыток влаги отжимают о внутреннюю поверхность ёмкости, далее
собирают материал, как описано в пункте 1.
- Хранение тампона, помещенного в транспортную среду, уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- В каждый глаз закапывается местный анестетик.
- При помощи стерильной лопаточки делают соскоб с язвы или другого образования.
- Если больной применяет контактные линзы, необходимо исследовать их внутреннюю поверхность.
- Из полученного материала делают мазок на стекле для микроскопического исследования, для этого
используют тампон без транспортной среды в индивидуальной стерильной упаковке.
- На посев берут мазок тампоном, входящим в состав транспортной системы со средой Эймс с углем.
- Хранение тампона, помещенного в транспортную среду, уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
Информация для хирургов
ОТДЕЛЯЕМОЕ ПОВЕРХНОСТНЫХ РАН
- Поверхность кожи вокруг раны обрабатывают ватным тампоном, смоченным 70% этиловым спиртом или другим антисептиком.
- После высыхания дезинфектанта, стерильной марлевой салфеткой удаляют детрит, некротические массы, гной.
- Отделяемое из раны для посева берут с помощью тампона, входящего в состав транспортной системы Эймс с углем, для микроскопического исследования – с помощью тампона без среды, находящегося в индивидуальной стерильной упаковке. Материал на тампон собирают круговыми вращательными движениями от центра к периферии пораженного участка в течение 5-10 секунд (во время взятия материала не касаются окружающих рану тканей, кожи и слизистых) и погружают в пробирку с транспортной средой.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Удалите поверхностный экссудат салфеткой, смоченной стерильным физиологическим раствором или 70%
спиртом.
- После дезинфекции поверхности раны и высыхания дезинфектанта врач с помощью шприца и иглы берет аспират
из глубины раны. Если имеется везикула, берется жидкость и клетки у основания дефекта.
- Если первоначально аспират взять не удалось, подкожно вводят стерильный физиологический раствор и повторно пытаются взять аспират.
- Далее аспират помещают в стерильную пробирку.
- Стерильный тампон от транспортной системы пропитывают полученной жидкостью и погружают в пробирку со
средой.
- При взятии материала во время операции отсылают вместе с аспиратом и кусочек ткани, образующей стенку абсцесса. Его можно поместить с помощью этого же тампона вглубь транспортной среды в ту же пробирку.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Поверхность кожи над местом наибольшего воспаления обрабатывают салфеткой, смоченной стерильным
физиологическим раствором или 70% спиртом.
- С помощью иглы и шприца аспирируют содержимое из мягких тканей, далее через эту же иглу набирают в
шприц небольшое количество стерильного физиологического раствора.
- Жидкостью из шприца пропитывают тампон, который погружают в транспортную среду Эймс с углем, часть жидкости (несколько капель) можно добавить в пробирку.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Поверхность пролежня (язвы) и кожу вокруг обрабатывают стерильным физиологическим раствором.
- Материал получают путем энергичного надавливания тампоном на дно язвы. Поверхностный экссудат для исследования непригоден.
- Тампон с полученным материалом помещают в транспортную среду Эймс с углем.
- Сроки и режим хранения уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Перед процедурой взятия крови выньте флаконы для гемокультур из холодильника.
- Для взрослых и детей (весом > 40 кг) используют 2 флакона на один анализ с оранжевой и серой
пластиковыми крышками.
- Для детей раннего возраста, чей вес менее 40 кг – 1 флакон с розовой крышкой (педиатрический).
- Флаконы должны быть согреты до комнатной температуры. Для ускорения процесса можно поместить флаконы в
ёмкость с тёплой (но не горячей) водой.
- Перед взятием крови отломить у флаконов пластиковые крышки и для дезинфекции обработать поверхность
внутренних крышек салфеткой, смоченной 70% этиловым спиртом в течение 1 минуты.
- Кожу над пунктируемой веной тщательно обрабатывают 70% этиловым спиртом, затем 1-2% настойкой йода 30
сек.
- После высыхания обработанного участка, не прикасаясь руками к обработанной поверхности, производят
венепункцию.
- Для взятия крови используется та же технология, что и при взятии крови в пробирку (в нашем случае,
узкое и длинное горлышко флакона вставляется в холдер вместо пробирки и прокалывается резиновая крышка).
- Флаконы, как и пробирки, имеют отрицательное давление, поэтому кровь набирается до тех пор, пока
давление не станет равным атмосферному, что соответствует ~ 10 мл. В педиатрическом флаконе
отрицательное давление соответствует объёму 3-5 мл.
- Флаконы должны быть промаркированы с указанием фамилии, инициалов, даты рождения и даты взятия материала.
- После завершения процедуры йод удаляют с кожи салфеткой с 70% этиловым спиртом и область прокола
закрывают лейкопластырем. Попросите пациента подержать руку согнутой в локтевом сгибе для того, чтоб
предотвратить образование гематомы. В случаях остро возникшего сепсиса следует проводить 2-3-кратные
исследования с интервалом 30-60 мин. Кровь на исследование рекомендовано брать во время подъема
температуры, а не на высоте лихорадки.
Информация для стоматологов
СОДЕРЖИМОЕ ИЗ ЗУБО-ДЕСНЕВОГО КАРМАНА
- Осторожно промойте десневой карман и прилегающую поверхность зуба стерильным физиологическим раствором, удалив слюну, остатки пищи и зубной налёт.
- Осторожно удалите с помощью инструментов участок воспаленной ткани и, соблюдая правила асептики,
перенесите его в пробирку с питательным бульоном. Энергично перемешайте содержимое с помощью тампона,
входящего в транспортную систему со средой Эймс с углем так, чтобы он хорошо пропитался жидкостью. Далее
тампон поместите в пробирку со средой.
- Если получить биоптат не удается, то энергично потрите стерильным бумажным или другим подходящим по размеру аппликатором (или зубной нитью) в десневом кармане. Стерильными ножницами отрежьте исследуемый край аппликатора над открытой пробиркой с бульоном, так чтобы он попал в неё. Далее действуйте, как описано выше. Для исследования непригоден весь аппликатор, т.к. часть его контаминирована посторонней флорой с перчаток персонала.
- Правила хранения собранного материала уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Производят пункцию верхнечелюстной пазухи.
- Далее содержимое аспирационного шприца переносят на стерильный тампон, входящий в состав транспортной
системы Эймс с углем.
- Правила хранения собранного материала уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Удалите поверхностный экcсудат салфеткой, смоченной стерильным физиологическим раствором.
- Удалите жидкость из глубины.
- Энергично прикасаясь, соберите тампоном исследуемый материал или удалите кусочек с приподнятого края
абсцесса.
- Поместите тампон в пробирку с транспортной средой.
- Правила хранения собранного материала уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Обработайте поверхность кожи (слизистой) салфеткой, смоченной 70% спиртом, высушите стерильной марлевой
салфеткой.
- Проколите стенку абсцесса с помощью иглы и шприца и наберите содержимое, соблюдая правила асептики,
перенесите на тампон, входящий в состав транспортной системы Эймс с углем.
- Далее поместите тампон в транспортную среду.
- Правила хранения собранного материала уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Промойте поверхность слизистой над местом наибольшего воспаления салфеткой, смоченной стерильным физиологическим раствором.
- С помощью иглы и шприца попробуйте аспирировать содержимое из мягких тканей, далее наберите в шприц через эту же иглу небольшое количество стерильного физиологического раствора.
- Перенесите жидкость из шприца в стерильную сухую пробирку.
- Вскройте упаковку с транспортной средой Эймс, пропитайте тампон собранной в пробирку жидкостью и поместите его в пробирку со средой.
- Правила хранения собранного материала уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
- Обработайте поверхность стерильным физиологическим раствором.
- Если получить биоптат невозможно, энергично потрите тампоном, входящим в состав транспортной системы
Эймс, о дно язвы.
- Поместите тампон или биоптат в транспортную среду.
- Поверхностный экссудат для исследования не пригоден.
- Правила хранения собранного материала уточняйте у менеджеров Независимой лаборатории ИНВИТРО.
Рак легких / Торакальная хирургия
Анатомическое строение легких
Причины и факторы риска
У подавляющего большинства пациентов, в 85-90%, рак легкого связан с курением, причем не только с активным, но и с пассивным. Также к факторам риска можно отнести:
• Облучение (проводимая ранее лучевая терапия по поводу других опухолей внутригрудной локализации)
• Хронические болезни органов дыхательной системы
• Работа на вредных производствах
• Высокая загазованность воздуха
Рост рака легких
Первая стадия
Опухоль не более 3-5 см, метастазы отсутствуют.
Вторая стадия
Опухоль от 5 до 7 см, лимфоузлы не затрагиваются, но возможно прорастание в ткани, окружающие легкое.
Третья стадия
Опухоль увеличивает свои размеры и прорастает в соседние органы. Обнаруживаются метастазы.
Четвертая стадия
Опухоль растет в размерах, затрагивая все новые органы, диагностируются отдаленные метастазы.
Симптомы рака легких
На ранних стадиях заболевание нередко протекает бессимптомно. По мере роста опухоли могут появляться:
• Кашель: сухой, надсадный. При закупорке бронхов растущей опухолью может сопровождаться мокротой.
• Кровохарканье: красная мокрота или прожилки алой крови в ней
• Одышка
• Боль в грудной клетке на стороне поражения
Диагностика рака легких
Так как заболевание нередко долгое время протекает скрыто, без выраженной симптоматики, обнаруживают его случайно при профилактическом обследовании, выполнении флюорографии или диагностике других заболеваний.
Подтверждается диагноз с помощью:
• Рентгенографии
• Компьютерной томографии, которая в дальнейшем также используется для контроля за результатами лечения
• Фибробронхоскопии – исследования, позволяющего изучить состояние органов дыхания, обнаружить локализацию опухоли и определить ее размеры, а также провести биопсию – забор кусочка патологической ткани для последующего гистологического исследования. Благодаря изучению клеток опухоли под микроскопом можно определить природу новообразования и подобрать тактику лечения
• Определения опухолевых маркеров для дифференциальной диагностики вида и оценки эффективности проводимого лечения
Лечение рака легких
На сегодняшний момент в арсенале онколога есть консервативные и оперативные методы лечения рака легкого. Схема терапии составляется для каждого пациента подбирается индивидуально в зависимости от локализации опухоли, ее размеров и наличия/отсутствия метастаз.
Основным методом лечения рака легкого является хирургический. Он может осуществляться одним из трех подходов:
• Открытая операция с большим разрезом грудной клетки
• Лапароскопия — с помощью специальных эндоскопических инструментов через небольшие разрезы
• Высокотехнологичная операция с использованием хирургического робота da Vinci
Как работает робот Да Винчи
Работа хирургического робота da Vinci полностью контролируется опытным хирургом через разрезы около 1 см в грудой клетке. Видеокамера-эндоскопа транслирует врачу подробное 3D изображение органа, что помогает ему тщательно продумывать свои действия. Хирург использует особые оперирующие инструменты: они имеют всего 8 мм в диаметре и 7 степеней свободы движения благодаря технологии “EndoWrist”, что позволяет им совершать больший объем движений, чем человеческое запястье. Координация работы инструментов внутри грудной полости осуществляется с помощью специальных джойстиков.
Проведение операции с использованием робота da Vinci требует высокой квалификации хирурга и специальных навыков.
За последнее десятилетие c помощью хирургического робота da Vinci успешно проведено более 7 000 000 операций по всему миру.
Преимущества операции с da Vinci
Хирургическое лечение рака легкого с помощью робота da Vinci помогает:
• Уменьшить повреждение здоровых тканей в ходе операции1
• Снизить интенсивность боли и дискомфорта в постоперационный период2
• Свести к минимуму кровопотерю и необходимость в переливании крови
• Минимизировать риск инфицирования и других осложнений3-7
• Избежать больших разрезов и заметных постоперационных шрамов и рубцов
• Ускорить реабилитационный период3, 7-15
• Быстро вернуться к привычной активности3, 7-15
• Получить высокий результат от проведенного лечения
При раке легкого роботизированная система позволяет выполнять анатомические резекции в полном объеме, не уступающем отрытым операциям, делая эти вмешательства еще более безопасными для пациента.
Как и в отношении любой операции, никто не может гарантировать наличие перечисленных преимуществ в каждом случае, поскольку каждый случай уникален. Пациенты должны обсуждать соответствующие хирургические риски со своими врачами.
Подробнее о хирургических рисках
Причины, диагностика и время обращения к врачу
Кровохарканье в мокроте или слизи при кашле или слюнотечении называется кровохарканьем. Хотя кровь может вызывать беспокойство, обычно это не повод для беспокойства, особенно у молодых или здоровых людей.
Кровь в мокроте – обычное явление при многих легких респираторных заболеваниях, включая инфекции верхних дыхательных путей, бронхит и астму.
Может настораживать откашливание значительного количества крови в мокроте или частое обнаружение крови в слизи.В тяжелых случаях это может быть связано с заболеванием легких или желудка.
В этой статье мы обсудим причины и методы лечения крови в мокроте.
Кровь в мокроте обычно поступает из легких, но также может поступать из желудка или пищеварительного тракта.
Ряд факторов может привести к образованию крови в мокроте. Также кровь может поступать из разных частей тела.
Кровь обычно поступает из легких, но реже она может поступать из желудка или пищеварительного тракта.Если кровь поступает из пищеварительного тракта, медицинский термин – гематемезис.
- Из легких (кровохарканье). Если кровь ярко-красная, пенистая и иногда смешанная со слизью, вероятно, это происходит из легких и может возникнуть в результате постоянного кашля или легочной инфекции.
- Из пищеварительного тракта (гематемезис). Если кровь темная и со следами еды, вероятно, она произошла из желудка или другого места в пищеварительном тракте. Это может быть признаком более серьезного состояния.
Возможные причины появления крови в мокроте:
- Бронхит. Хронический бронхит часто возникает за появлением крови. Состояние включает стойкое или повторяющееся воспаление дыхательных путей, а также кашель и выделение мокроты.
- Бронхоэктазия. Это описывает постоянное увеличение частей дыхательных путей легких. Часто возникает при инфекции, одышке и хрипах.
- Продолжительный или сильный кашель. Это может вызвать раздражение верхних дыхательных путей и разрыв кровеносных сосудов.
- Сильное кровотечение из носа. Многие факторы могут вызвать кровотечение из носа.
- Употребление наркотиков. Наркотики, такие как кокаин, при вдыхании через ноздри могут раздражать верхние дыхательные пути.
- Антикоагулянты. Эти лекарства предотвращают свертывание крови. Примеры включают варфарин, ривароксабан, дабигатран и апиксабан.
- Хроническая обструктивная болезнь легких (ХОБЛ). ХОБЛ – это постоянное препятствие оттоку воздуха из легких. Обычно это вызывает затрудненное дыхание, кашель, выделение мокроты и хрипы.
- Пневмония. Эта и другие легочные инфекции могут вызывать кровянистую мокроту. Пневмония характеризуется воспалением легочной ткани, как правило, из-за бактериальной инфекции. Люди с пневмонией, как правило, испытывают боль в груди при дыхании или кашле, утомляемость, жар, потоотделение и озноб. Пожилые люди также могут испытывать замешательство.
- Тромбоэмболия легочной артерии. Это относится к сгустку крови в одной артерии легкого. Обычно это вызывает боль в груди и внезапную одышку.
- Отек легких. Это описывает жидкость в легких. Отек легких чаще всего встречается у людей с сердечными заболеваниями. Это вызывает розовую и пенистую мокроту, а также сильную одышку, иногда с болью в груди.
- Рак легких. У человека больше шансов заболеть раком легких, если он старше 40 лет и курит табак.Это может вызвать не проходящий кашель, одышку, боль в груди, а иногда и боль в костях или головную боль.
- Рак шеи. Обычно это начинается в горле, гортани или дыхательном горле. Это может вызвать отек или незаживающую боль, постоянную боль в горле и красное или белое пятно во рту.
- Муковисцидоз. Это наследственное заболевание серьезно повреждает легкие. Обычно это вызывает затрудненное дыхание и постоянный кашель с густой слизью.
- Гранулематоз с полиангиитом. Это описывает воспаление кровеносных сосудов в носовых пазухах, легких и почках. Обычно это вызывает насморк, кровотечение из носа, одышку, хрипы и лихорадку.
- Туберкулез. Бактерия вызывает эту тяжелую инфекцию легких, которая может вызывать жар, потоотделение, боль в груди, боль при дыхании или кашле, а также постоянный кашель.
- Суженные клапаны сердца. Сужение митрального клапана сердца, называемое стенозом митрального клапана, может вызвать одышку, особенно при физической нагрузке или в положении лежа.Другие симптомы включают опухшие ступни или ноги, учащенное сердцебиение или усталость, особенно при повышенной физической активности.
- Тяжелая травма. Травма грудной клетки может вызвать появление крови в мокроте.
Человек, кашляющий кровью в больших количествах или через частые промежутки времени, должен посетить врача.
Обратитесь к врачу или обратитесь за неотложной помощью, если при кашле выделяется много крови или кровь через частые промежутки времени.
Если кровь темная и появляется на кусках еды, немедленно обратитесь в больницу.Это может указывать на серьезную проблему, возникшую в пищеварительном тракте.
Также обратитесь к врачу, если кровь в мокроте сопровождается одним из следующих симптомов:
- потеря аппетита
- необъяснимая потеря веса
- кровь в моче или стуле
- боль в груди, головокружение, лихорадка или свет – головокружение
- ухудшение одышки
Чтобы определить, вызывает ли какое-либо заболевание кровь в мокроте, врач обычно изучает историю болезни и проводит физический осмотр.
Во время обследования врач может попросить человека покашлять, и он может проверить нос и рот на предмет кровотечения. Врач также может взять образцы мокроты и крови для анализа.
В некоторых случаях необходимы дополнительные обследования. Они могут включать рентген грудной клетки, компьютерную томографию или бронхоскопию, при которой камера на конце трубки вводится в дыхательные пути.
Стероиды могут помочь, если воспалительное состояние вызывает кровотечение.
Лечение направлено на остановку кровотечения и устранение основной причины.
Возможное лечение:
- Стероиды. Стероиды могут помочь, когда за кровотечением стоит воспалительное состояние.
- Антибиотики. Антибиотики применяются при пневмонии или туберкулезе.
- Бронхоскопия. Это дает возможность внимательно изучить возможные источники кровотечения. Инструмент, называемый эндоскопом, вводится в дыхательные пути через нос или рот.На конец можно прикрепить инструменты. Некоторые предназначены для остановки кровотечения, а другие, например, могут удалять сгусток крови.
- Эмболизация. Если за кровь в мокроте отвечает крупный кровеносный сосуд, врач может порекомендовать процедуру, называемую эмболизацией. В сосуд вводят катетер, идентифицируют источник кровотечения и используют металлическую спираль, химическое вещество или фрагмент желатиновой губки для его закрытия.
- Переливание продуктов крови. Переливание элементов крови, таких как плазма, факторы свертывания или тромбоциты, может потребоваться, если проблемы со свертыванием или чрезмерно жидкая кровь являются причиной появления крови в мокроте.
- Химиотерапия или лучевая терапия. Их можно использовать для лечения рака легких.
- Хирургия. Это может потребоваться для удаления поврежденной или раковой части легкого. Хирургическое вмешательство обычно считается крайней мерой и только вариантом, когда кровотечение серьезное или постоянное.
Кровь в мокроте, особенно в небольших количествах, обычно не вызывает беспокойства. Однако у людей с респираторными заболеваниями в анамнезе или курящих часто требуется дальнейшая оценка.
Респираторные инфекции, другие заболевания легких и, реже, проблемы с пищеварительным трактом могут вызывать появление крови. Некоторые причины легкие и разрешаются сами по себе. В остальных случаях необходимо медицинское вмешательство.
При сильном или частом кашле с кровью следует обратиться к врачу.
Прочтите статью на испанском языке.
Причины, диагностика и время обращения к врачу
Кровохарканье в мокроте или слизи, когда человек кашляет или плюется, называется кровохарканьем.Хотя кровь может вызывать беспокойство, обычно это не повод для беспокойства, особенно у молодых или здоровых людей.
Кровь в мокроте – обычное явление при многих легких респираторных заболеваниях, включая инфекции верхних дыхательных путей, бронхит и астму.
Может настораживать откашливание значительного количества крови в мокроте или частое обнаружение крови в слизи. В тяжелых случаях это может быть связано с заболеванием легких или желудка.
В этой статье мы обсудим причины и методы лечения крови в мокроте.
Кровь в мокроте обычно поступает из легких, но также может поступать из желудка или пищеварительного тракта.
Ряд факторов может привести к образованию крови в мокроте. Также кровь может поступать из разных частей тела.
Кровь обычно поступает из легких, но реже она может поступать из желудка или пищеварительного тракта. Если кровь поступает из пищеварительного тракта, медицинский термин – гематемезис.
- Из легких (кровохарканье). Если кровь ярко-красная, пенистая и иногда смешанная со слизью, вероятно, это происходит из легких и может возникнуть в результате постоянного кашля или легочной инфекции.
- Из пищеварительного тракта (гематемезис). Если кровь темная и со следами еды, вероятно, она произошла из желудка или другого места в пищеварительном тракте. Это может быть признаком более серьезного состояния.
Возможные причины появления крови в мокроте:
- Бронхит. Хронический бронхит часто возникает за появлением крови. Состояние включает стойкое или повторяющееся воспаление дыхательных путей, а также кашель и выделение мокроты.
- Бронхоэктазия. Это описывает постоянное увеличение частей дыхательных путей легких. Часто возникает при инфекции, одышке и хрипах.
- Продолжительный или сильный кашель. Это может вызвать раздражение верхних дыхательных путей и разрыв кровеносных сосудов.
- Сильное кровотечение из носа. Многие факторы могут вызвать кровотечение из носа.
- Употребление наркотиков. Наркотики, такие как кокаин, при вдыхании через ноздри могут раздражать верхние дыхательные пути.
- Антикоагулянты. Эти лекарства предотвращают свертывание крови. Примеры включают варфарин, ривароксабан, дабигатран и апиксабан.
- Хроническая обструктивная болезнь легких (ХОБЛ). ХОБЛ – это постоянное препятствие оттоку воздуха из легких.Обычно это вызывает затрудненное дыхание, кашель, выделение мокроты и хрипы.
- Пневмония. Эта и другие легочные инфекции могут вызывать кровянистую мокроту. Пневмония характеризуется воспалением легочной ткани, как правило, из-за бактериальной инфекции. Люди с пневмонией, как правило, испытывают боль в груди при дыхании или кашле, утомляемость, жар, потоотделение и озноб. Пожилые люди также могут испытывать замешательство.
- Тромбоэмболия легочной артерии. Это относится к сгустку крови в одной артерии легкого.Обычно это вызывает боль в груди и внезапную одышку.
- Отек легких. Это описывает жидкость в легких. Отек легких чаще всего встречается у людей с сердечными заболеваниями. Это вызывает розовую и пенистую мокроту, а также сильную одышку, иногда с болью в груди.
- Рак легких. У человека больше шансов заболеть раком легких, если он старше 40 лет и курит табак. Это может вызвать не проходящий кашель, одышку, боль в груди, а иногда и боль в костях или головную боль.
- Рак шеи. Обычно это начинается в горле, гортани или дыхательном горле. Это может вызвать отек или незаживающую боль, постоянную боль в горле и красное или белое пятно во рту.
- Муковисцидоз. Это наследственное заболевание серьезно повреждает легкие. Обычно это вызывает затрудненное дыхание и постоянный кашель с густой слизью.
- Гранулематоз с полиангиитом. Это описывает воспаление кровеносных сосудов в носовых пазухах, легких и почках.Обычно это вызывает насморк, кровотечение из носа, одышку, хрипы и лихорадку.
- Туберкулез. Бактерия вызывает эту тяжелую инфекцию легких, которая может вызывать жар, потоотделение, боль в груди, боль при дыхании или кашле, а также постоянный кашель.
- Суженные клапаны сердца. Сужение митрального клапана сердца, называемое стенозом митрального клапана, может вызвать одышку, особенно при физической нагрузке или в положении лежа. Другие симптомы включают опухшие ступни или ноги, учащенное сердцебиение или усталость, особенно при повышенной физической активности.
- Тяжелая травма. Травма грудной клетки может вызвать появление крови в мокроте.
Человек, кашляющий кровью в больших количествах или через частые промежутки времени, должен посетить врача.
Обратитесь к врачу или обратитесь за неотложной помощью, если при кашле выделяется много крови или кровь через частые промежутки времени.
Если кровь темная и появляется на кусках еды, немедленно обратитесь в больницу. Это может указывать на серьезную проблему, возникшую в пищеварительном тракте.
Также обратитесь к врачу, если кровь в мокроте сопровождается одним из следующих симптомов:
- потеря аппетита
- необъяснимая потеря веса
- кровь в моче или стуле
- боль в груди, головокружение, лихорадка или свет – головокружение
- ухудшение одышки
Чтобы определить, вызывает ли какое-либо заболевание кровь в мокроте, врач обычно изучает историю болезни и проводит физический осмотр.
Во время обследования врач может попросить человека покашлять, и он может проверить нос и рот на предмет кровотечения. Врач также может взять образцы мокроты и крови для анализа.
В некоторых случаях необходимы дополнительные обследования. Они могут включать рентген грудной клетки, компьютерную томографию или бронхоскопию, при которой камера на конце трубки вводится в дыхательные пути.
Стероиды могут помочь, если воспалительное состояние вызывает кровотечение.
Лечение направлено на остановку кровотечения и устранение основной причины.
Возможное лечение:
- Стероиды. Стероиды могут помочь, когда за кровотечением стоит воспалительное состояние.
- Антибиотики. Антибиотики применяются при пневмонии или туберкулезе.
- Бронхоскопия. Это дает возможность внимательно изучить возможные источники кровотечения. Инструмент, называемый эндоскопом, вводится в дыхательные пути через нос или рот.На конец можно прикрепить инструменты. Некоторые предназначены для остановки кровотечения, а другие, например, могут удалять сгусток крови.
- Эмболизация. Если за кровь в мокроте отвечает крупный кровеносный сосуд, врач может порекомендовать процедуру, называемую эмболизацией. В сосуд вводят катетер, идентифицируют источник кровотечения и используют металлическую спираль, химическое вещество или фрагмент желатиновой губки для его закрытия.
- Переливание продуктов крови. Переливание элементов крови, таких как плазма, факторы свертывания или тромбоциты, может потребоваться, если проблемы со свертыванием или чрезмерно жидкая кровь являются причиной появления крови в мокроте.
- Химиотерапия или лучевая терапия. Их можно использовать для лечения рака легких.
- Хирургия. Это может потребоваться для удаления поврежденной или раковой части легкого. Хирургическое вмешательство обычно считается крайней мерой и только вариантом, когда кровотечение серьезное или постоянное.
Кровь в мокроте, особенно в небольших количествах, обычно не вызывает беспокойства. Однако у людей с респираторными заболеваниями в анамнезе или курящих часто требуется дальнейшая оценка.
Респираторные инфекции, другие заболевания легких и, реже, проблемы с пищеварительным трактом могут вызывать появление крови. Некоторые причины легкие и разрешаются сами по себе. В остальных случаях необходимо медицинское вмешательство.
При сильном или частом кашле с кровью следует обратиться к врачу.
Прочтите статью на испанском языке.
MyHealth2st | Слизь – все, что вам нужно знать о слизи в легких
Что такое мокрота? Слизь – это своего рода слизь, выделяемая железами в легких.Обычно мокрота привлекает и собирает инородные частицы и мусор в легких, чтобы их можно было выбросить в горло. Обычно мокрота затем переваривается в желудке, но иногда может происходить кашель. Различные заболевания или состояния могут изменить количество мокроты, вырабатываемой в легких, а также ее текстуру и цвет.
Диагностика мокроты
В зависимости от причины избыточного образования мокроты цвет мокроты может различаться. Цвета варьируются от прозрачного до белого, зеленого, желтого, коричневого.розовый и красный. Цвет мокроты может указывать на то, что может вызвать избыточное производство.
Симптомы мокроты
Мокрота обычно является симптомом чего-то другого, но влажный кашель является обычным признаком того, что у вас выделяется больше мокроты, чем обычно.
Причины мокроты
Различные цвета мокроты могут быть использованы для потенциальной идентификации основной причины. Цвета и причины мокроты включают:
- Прозрачный – аллергический ринит, бронхит и пневмония
- Белый – бронхит, хроническая обструктивная болезнь легких (ХОБЛ), застойная сердечная недостаточность, жизненно важные или бактериальные инфекции (простуда, грипп, COVID-19 )
- Зеленый / желтый – бронхит, пневмония, синусит и другие вирусные инфекции (включая COVID-19)
- Коричневый: бронхит, пневмония, курение
- Розовый / красный – розовая или красная мокрота указывает на наличие крови в легких и Вам следует немедленно обратиться за медицинской помощью, так как это может быть признаком многих серьезных заболеваний, включая застойную сердечную недостаточность, рак легких, пневмонию, легочную эмболию и туберкулез.
Текстура мокроты также может указывать на болезнь: более густая мокрота обычно является признаком прогрессирования инфекции, а пенистая или «слизистая» мокрота часто является признаком легочных проблем.
Если вы кашляете всеми цветами радуги, самый простой и быстрый способ записаться на прием к врачу – это сделать это онлайн с помощью MyHealth2st. Платформа бронирования MyHealth2st доступна круглосуточно и без выходных, поэтому вам никогда не придется ждать рабочего дня, чтобы записаться на прием к следующему врачу.
Самостоятельное лечение мокроты
Ощущение «мокроты» во время болезни является обычным явлением, и его можно контролировать с помощью безрецептурных лекарств, таких как отхаркивающие средства – лекарства, которые помогают откашлять мокроту.
Обратитесь к врачу, если:
Если ваша мокрота прозрачная, желтая или зеленая, вы обычно можете подождать несколько дней, чтобы увидеть, исчезнет ли она, не беспокоясь о посещении врача. Если мокрота сохраняется более недели или около того, вы можете обратиться к врачу за рецептурными лекарствами от кашля или антибиотиками.
Если ваша мокрота коричневая, розовая или красная, вам следует немедленно обратиться к врачу.
Автор
Дэниел Уилкс
Дэниел Уилкс работал со словами почти всю свою трудовую жизнь, будучи журналистом, продюсером контента, подкастером, драматургом и даже автором комиксов. После получения степени бакалавра театрального искусства по специальности «Написание сценариев и драматургия», Дэниел получил степень магистра профессионального письма в Технологическом университете Сиднея.С того времени Дэниел написал и отредактировал ряд журналов и веб-сайтов, посвященных технологиям, играм и поп-культуре, по самым разным темам, от обзоров фильмов и музыки до расследований, в которых подробно рассказывается о корпоративных преступлениях.
Семейная история проблем с психическим здоровьем и других проблем со здоровьем, с которыми столкнулась его большая семья, побудила Дэниела оставить техническую журналистику и начать карьеру, помогая людям лучше понимать свое здоровье, чтобы они могли более легко получить доступ к необходимой помощи.Дэниел присоединился к команде MyHealth2st в начале пандемии коронавируса, когда людям как никогда нужен легкий доступ к здравоохранению и точная медицинская информация.
Подробнее у этого автора
Какие характеристики мокроты указывают на бактериальную пневмонию?
Клавдий I, Бараф LJ. Неотложные состояния педиатрии, связанные с лихорадкой. Emerg Med Clin North Am . 2010 г., 28 (1): 67-84, vii-viii. [Медлайн].
Хуссейн А.Н., Кумар В.Легкое. В: Кумар В., Аббас А.К., Фаусто Н., ред. Роббинс и Котран: патологические основы болезни . 7-е изд. Филадельфия, Пенсильвания: Эльзевьер Сондерс; 2005. 711-72.
[Директива] Манделл Л.А., Вундеринк Р.Г., Анзуето А., Бартлетт Дж. Г., Кэмпбелл Г. Д., Дин Н. К. и др. Общество инфекционных болезней Америки / Американское торакальное общество согласовали руководящие принципы ведения внебольничной пневмонии у взрослых. Клин Инфекция Дис . 2007 г. 1. 44 Приложение 2: S27-72.[Медлайн].
Медицинский словарь Стедмана . 27 изд. Балтимор, Мэриленд: Липпинкотт, Уильямс и Уилкинс; 2003.
Brundage JF, Шэнкс GD. Смертность от бактериальной пневмонии во время пандемии гриппа 1918-19 гг. Emerg Infect Dis . 2008 14 августа (8): 1193-9. [Медлайн]. [Полный текст].
Anand N, Kollef MH. Алфавитный указатель пневмонии: CAP, HAP, HCAP, NHAP и VAP. Semin Respir Crit Care Med .2009 30 февраля (1): 3-9. [Медлайн].
Эль Солх AA. Пневмония, перенесенная в домах престарелых. Semin Respir Crit Care Med . 2009 30 февраля (1): 16-25. [Медлайн].
Kuti JL, Shore E, Palter M, Nicolau DP. Проведение эмпирической антибактериальной терапии респираторно-ассоциированной пневмонии в отделении интенсивной терапии: руководство по применению рекомендаций. Semin Respir Crit Care Med . 2009 30 февраля (1): 102-15. [Медлайн].
Чако Р., Раджан А., Лайонел П., Тилагавати М., Ядав Б., Премкумар Дж.Методы деконтаминации полости рта и пневмония, связанная с вентилятором. руб. J Nurs . 2017 июн 8. 26 (11): 594-599. [Медлайн].
Bouglé A, Foucrier A, Dupont H, Montravers P, Ouattara A, Kalfon P и др. Влияние продолжительности приема антибиотиков на клинические события у пациентов с вентилятор-ассоциированной пневмонией Pseudomonas aeruginosa: протокол исследования для рандомизированного контролируемого исследования. Испытания . 2017 23 января. 18 (1): 37. [Медлайн]. [Полный текст].
Kollef MH, Ricard JD, Roux D и др.Рандомизированное испытание системы ингаляции амикацина фосфомицина для дополнительной терапии грамотрицательной пневмонии, связанной с вентилятором: испытание IASIS. Сундук . 2017 июн 151 (6): 1239-1246. [Медлайн].
Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB и др. Краткое резюме: Ведение взрослых с внутрибольничной пневмонией и пневмонией, связанной с искусственной вентиляцией легких: Руководство по клинической практике, 2016 г., Американское общество инфекционных болезней и Американское торакальное общество. Клин Инфекция Дис . 2016 Сентябрь 1. 63 (5): 575-82. [Медлайн].
Chalmers JD, Rother C, Salih W., Ewig S. Пневмония, связанная со здравоохранением, не позволяет точно идентифицировать потенциально устойчивые патогены: систематический обзор и метаанализ. Клин Инфекция Дис . 2014 Февраль 58 (3): 330-9. [Медлайн].
Eggimann P, Pittet D. Инфекционный контроль в отделении интенсивной терапии. Сундук . 2001 декабрь 120 (6): 2059-93. [Медлайн].
Гейнес Р., Эдвардс-младший.Обзор нозокомиальных инфекций, вызванных грамотрицательными палочками. Клин Инфекция Дис . 2005 15 сентября. 41 (6): 848-54. [Медлайн].
Пелег А.Ю., Хупер округ Колумбия. Внутрибольничные инфекции, вызванные грамотрицательными бактериями. N Engl J Med . 2010 13 мая. 362 (19): 1804-13. [Медлайн].
Марик ЧП. Аспирационный пневмонит и аспирационная пневмония. N Engl J Med . 2001 г., 1. 344 (9): 665-71. [Медлайн].
Mizgerd JP.Острая инфекция нижних дыхательных путей. N Engl J Med . 2008 14 февраля. 358 (7): 716-27. [Медлайн]. [Полный текст].
Рубин Ю.Б., Янофф EN. Пневмолизин: многофункциональный фактор вирулентности пневмококков. Лаборатория Дж. Клин Мед . 1998, январь, 131 (1): 21-7. [Медлайн].
Садикот РТ, Блэквелл Т.С., Кристман Дж. В., Принц А.С. Взаимодействие патоген-хозяин при пневмонии, вызванной Pseudomonas aeruginosa. Am J Respir Crit Care Med . 2005 1 июн.171 (11): 1209-23. [Медлайн]. [Полный текст].
McCullers JA. Понимание взаимодействия вируса гриппа и пневмококка. Clin Microbiol Ред. . 2006 июл.19 (3): 571-82. [Медлайн]. [Полный текст].
Morens DM, Taubenberger JK, Fauci AS. Преобладающая роль бактериальной пневмонии как причины смерти при пандемическом гриппе: последствия для готовности к пандемическому гриппу. J Заразить Dis . 2008, 1 октября 198 (7): 962-70.[Медлайн]. [Полный текст].
Форжи С, Марри Т.Дж. Атипичная пневмония, связанная со здоровьем. Semin Respir Crit Care Med . 2009 30 февраля (1): 67-85. [Медлайн].
Центры по контролю и профилактике заболеваний. Пневмония. Доступно на http://www.cdc.gov/Features/Pneumonia/. Доступ: 13 января 2011 г.
Restrepo MI, Anzueto A. Роль грамотрицательных бактерий в пневмонии, связанной с оказанием медицинской помощи. Semin Respir Crit Care Med .2009 Февраль 30 (1): 61-6. [Медлайн].
Бактериальные коинфекции в образцах легочной ткани от смертельных случаев пандемического гриппа A (h2N1) 2009 г. – США, май-август 2009 г. MMWR Morb Mortal Wkly Rep . 2009 окт. 2. 58 (38): 1071-4. [Медлайн].
Пандемический грипп A (h2N1), 2009 г. у беременных, нуждающихся в интенсивной терапии – Нью-Йорк, 2009 г. MMWR Morb Mortal Wkly Rep . 2010 26 марта. 59 (11): 321-6. [Медлайн].
Деннис Д.Т., Инглесби Т.В., Хендерсон Д.А., Бартлетт Дж. Г., Ашер М.С., Эйцен Э. и др.Туляремия как биологическое оружие: управление медициной и общественным здравоохранением. ЯМА . 6 июня 2001 г. 285 (21): 2763-73. [Медлайн].
Rello J, Ollendorf DA, Oster G, Vera-Llonch M, Bellm L, Redman R и др. Эпидемиология и исходы вентилятор-ассоциированной пневмонии в большой базе данных США. Сундук . 2002 Декабрь 122 (6): 2115-21. [Медлайн].
Американская ассоциация легких. Тенденции заболеваемости и смертности от пневмонии и гриппа.Сентябрь 2008 г. Американская ассоциация легких. Доступно на http://bit.ly/gwYJAE. Доступ: 13 января 2011 г.
Kung HC, Hoyert DL, Xu JQ, Murphy SL, и отдел статистики естественного движения населения. Смертность: окончательные данные за 2005 г. Национальные отчеты о статистике естественного движения населения. Хяттсвилл, Мэриленд: Национальный центр статистики здравоохранения, апрель 2008 г .: 56 (10). http://www.cdc.gov. Доступно на http://bit.ly/i3ATH5. Доступ: 13 января 2011 г.
Mufson MA, Stanek RJ. Бактериемическая пневмококковая пневмония в одном американском городе: 20-летнее продольное исследование, 1978–1997. Am J Med . 1999 26 июля. 107 (1А): 34С-43С. [Медлайн].
Cillóniz C, Ewig S, Polverino E, Marcos MA, Esquinas C, Gabarrús A, et al. Микробная этиология внебольничной пневмонии и ее отношение к степени тяжести. Торакс . 2011 Апрель 66 (4): 340-6. [Медлайн].
van der Poll T, Opal SM. Патогенез, лечение и профилактика пневмококковой пневмонии. Ланцет . 2009 31 октября. 374 (9700): 1543-56. [Медлайн].
Slovis BS, Brigham KL. Сесил Основы медицины. : Андреоли Т., Карпентер С.К., Григгс Р.К., Лоскальцо Дж. Подход к пациенту с респираторным заболеванием . 6-е изд. WB Saunders Co: Филадельфия, Пенсильвания; 2004. 177-80.
Brown SM, Jones BE, Jephson AR, Dean NC. Подтверждение рекомендаций Общества по инфекционным заболеваниям Америки / Американского торакального общества 2007 г. по тяжелой внебольничной пневмонии. Crit Care Med .2009 Декабрь 37 (12): 3010-6. [Медлайн]. [Полный текст].
Фанг В.Ф., Ян К.Й., Ву К.Л., Ю.С.Дж., Чен С.В., Ту CY и др. Применение и сравнение показателей оценки для прогнозирования исходов у пациентов с пневмонией, связанной с оказанием медицинской помощи. Центр внимания . 2011 19 января 15 (1): R32. [Медлайн].
Lim WS, van der Eerden MM, Laing R, Boersma WG, Karalus N, Town GI, et al. Определение степени тяжести внебольничной пневмонии при поступлении в больницу: международное исследование и валидация. Торакс . 2003 май. 58 (5): 377-82. [Медлайн]. [Полный текст].
Fine MJ, Auble TE, Yealy DM, Hanusa BH, Weissfeld LA, Singer DE, et al. Правило прогноза для выявления пациентов с внебольничной пневмонией из группы низкого риска. N Engl J Med . 1997 23 января. 336 (4): 243-50. [Медлайн].
Агентство медицинских исследований и качества. Калькулятор индекса тяжести пневмонии. Доступно на http://pda.ahrq.gov/clinic/psi/psicalc.asp.Доступ: 13 января 2011 г.
Sligl WI, Majumdar SR, Marrie TJ. Сортировка тяжелой пневмонии: какова «оценка» по правилам предсказания ?. Crit Care Med . 2009 Декабрь 37 (12): 3166-8. [Медлайн].
Phua J, см. KC, Chan YH, Widjaja LS, Aung NW, Ngerng WJ, et al. Подтверждение и клиническое значение малых критериев IDSA / ATS для тяжелой внебольничной пневмонии. Торакс . 2009 Июль 64 (7): 598-603. [Медлайн].
Bloos F, Marshall JC, Dellinger RP и др.Многонациональное обсервационное исследование прокальцитонина у пациентов интенсивной терапии с пневмонией, требующих искусственной вентиляции легких: многоцентровое обсервационное исследование. Центр внимания . 2011 7 марта. 15 (2): R88. [Медлайн].
Кнаус В.А., Дрейпер Е.А., Вагнер Д.П., Циммерман Дж. Э. APACHE II: система классификации степени тяжести заболевания. Crit Care Med . 1985, 13 октября (10): 818-29. [Медлайн].
Le Gall JR, Lemeshow S, Saulnier F. Новая упрощенная оценка острой физиологии (SAPS II) на основе многоцентрового исследования в Европе / Северной Америке. ЯМА . 1993 22-29 декабря. 270 (24): 2957-63. [Медлайн].
Винсент Дж. Л., Морено Р., Такала Дж., Уиллаттс С., Де Мендонса А., Брюнинг Х и др. Шкала SOFA (оценка отказа органов, связанных с сепсисом) для описания дисфункции / отказа органа. От имени Рабочей группы по проблемам, связанным с сепсисом Европейского общества интенсивной терапии. Центр интенсивной терапии . 1996 22 июля (7): 707-10. [Медлайн].
El-Solh AA, Alhajhusain A, Abou Jaoude P, Drinka P.Достоверность оценок степени тяжести у госпитализированных пациентов с пневмонией, приобретенной на дому. Сундук . 2010 декабрь 138 (6): 1371-6. [Медлайн].
España PP, Capelastegui A, Gorordo I, Esteban C, Oribe M, Ortega M, et al. Разработка и проверка правила клинического прогноза тяжелой внебольничной пневмонии. Am J Respir Crit Care Med . 2006 декабрь 1. 174 (11): 1249-56. [Медлайн].
Rello J, Rodriguez A, Lisboa T, Gallego M, Lujan M, Wunderink R.Шкала PIRO для внебольничной пневмонии: новое правило прогноза для оценки степени тяжести внебольничной пневмонии у пациентов отделения интенсивной терапии. Crit Care Med . 2009 Февраль 37 (2): 456-62. [Медлайн].
Чарльз П.Г., Вулф Р., Уитби М., Файн М.Дж., Фуллер А.Дж., Стирлинг Р. и др. SMART-COP: инструмент для прогнозирования потребности в интенсивной респираторной или вазопрессорной поддержке при внебольничной пневмонии. Клин Инфекция Дис . 2008 г. 1. 47 (3): 375-84.[Медлайн].
Легкий RW. Клиническая практика. Плевральный выпот. N Engl J Med . 2002, 20 июня. 346 (25): 1971-7. [Медлайн].
Bafadhel M, Clark TW, Reid C, Medina MJ, Batham S, Barer MR, et al. Прокальцитонин и С-реактивный белок у госпитализированных взрослых пациентов с внебольничной пневмонией, обострением астмы и хронической обструктивной болезнью легких. Сундук . 28 октября 2010 г. [Medline].
Skerrett SJ.Диагностическое тестирование внебольничной пневмонии. Clin Chest Med . 1999 Сентябрь 20 (3): 531-48. [Медлайн].
Смит ПР. Какие диагностические тесты необходимы при внебольничной пневмонии ?. Мед Клин Норт Ам . 2001 ноябрь 85 (6): 1381-96. [Медлайн].
Ketai L, Jordan K, Marom EM. Визуализирующая инфекция. Clin Chest Med . 2008 29 марта (1): 77-105, vi. [Медлайн].
Купер М.С., Стюарт П.М.Кортикостероидная недостаточность у тяжелобольных. N Engl J Med . 2003 20 февраля. 348 (8): 727-34. [Медлайн].
Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B и др. Ранняя целенаправленная терапия в лечении тяжелого сепсиса и септического шока. N Engl J Med . 2001, 8 ноября. 345 (19): 1368-77. [Медлайн].
Кан Я., Квон С.И., Юн Х.И., Ли Дж.Х., Ли CT. Роль С-реактивного белка и прокальцитонина в дифференциации туберкулеза от бактериальной внебольничной пневмонии. Корейский J Intern Med . 2009 24 декабря (4): 337-42. [Медлайн]. [Полный текст].
Pirracchio R, Mateo J, Raskine L, Rigon MR, Lukaszewicz AC, Mebazaa A, et al. Могут ли бактериологические образцы верхних дыхательных путей, полученные в отделении интенсивной терапии, служить ориентиром для эмпирической антибиотикотерапии при ИВЛ-ассоциированной пневмонии? Crit Care Med . 2009 Сентябрь 37 (9): 2559-63. [Медлайн].
Gharib AM, Stern EJ. Радиология пневмонии. Мед Клин Норт Ам .2001 ноябрь 85 (6): 1461-91, x. [Медлайн].
Tarver RD, Teague SD, Heitkamp DE, Conces DJ Jr. Радиология внебольничной пневмонии. Радиол Клин Норт Ам . 2005 Май. 43 (3): 497-512, viii. [Медлайн].
Gotway MB, Reddy GP, Webb WR, Elicker BM, Leung JW. КТ легкого высокого разрешения: паттерны болезней и дифференциальные диагнозы. Радиол Клин Норт Ам . 2005 Май. 43 (3): 513-42, viii. [Медлайн].
[Рекомендации] Деллинджер Р.П., Леви М.М., Карлет Дж. М. и др.Кампания по выживанию при сепсисе: международные рекомендации по ведению тяжелого сепсиса и септического шока: 2008 г. Intensive Care Med . 2008, январь, 34 (1): 17-60. [Медлайн]. [Полный текст].
Семенюк Р.А., Мид М.О., Алонсо-Коэльо П., Бриэль М., Эванев Н., Прасад М. и др. Кортикостероидная терапия для пациентов, госпитализированных с внебольничной пневмонией: систематический обзор и метаанализ. Энн Интерн Мед. 2015 Октябрь 6. 163 (7): 519-28. [Медлайн].
Арнольд Ф.В., ЛаДжой А.С., Брок Г.Н., Пейрани П., Релло Дж., Менендес Р. и др.Улучшение результатов у пожилых пациентов с внебольничной пневмонией путем соблюдения национальных рекомендаций: результаты международного когортного исследования организации внебольничной пневмонии. Arch Intern Med . 2009 14 сентября. 169 (16): 1515-24. [Медлайн].
МакКейб С., Киршнер С., Чжан Х., Дейли Дж., Фисман Д.Н. Согласованная с рекомендациями терапия и снижение смертности и продолжительности пребывания взрослых с внебольничной пневмонией: игра по правилам. Arch Intern Med .2009 14 сентября. 169 (16): 1525-31. [Медлайн].
[Рекомендации] Центры услуг Medicare и Medicaid, Объединенная комиссия. Руководство по техническим условиям для национальных больничных мер качества стационарных пациентов. V. 2.6b. Ручная загрузка получена в апреле 2009 г.
Kalil AC, Murthy MH, Hermsen ED, Neto FK, Sun J, Rupp ME. Линезолид по сравнению с ванкомицином или тейкопланином при нозокомиальной пневмонии: систематический обзор и метаанализ. Crit Care Med .2010 Сентябрь 38 (9): 1802-8. [Медлайн].
Лам AP, Wunderink RG. Роль MRSA при пневмонии, связанной с оказанием медицинской помощи. Semin Respir Crit Care Med . 2009 30 февраля (1): 52-60. [Медлайн].
Центры по контролю и профилактике заболеваний. Грипп h2N1: обновленные оценки CDC случаев гриппа h2N1 в 2009 г., госпитализаций и смертей в США с апреля 2009 г. по 10 апреля 2010 г. Доступно по адресу http://www.cdc.gov/h2n1flu/estimates_2009_h2n1.htm. Доступ: 1 июня 2010 г.
Sullivan SJ, Jacobson RM, Dowdle WR, Poland GA. Грипп h2N1 2009 г. Mayo Clin Proc . 2010 январь 85 (1): 64-76. [Медлайн]. [Полный текст].
1. Филлипс Д. ACIP изменяет интервал вакцинации от пневмококка у пожилых людей из группы низкого риска. Medscape Medical News. WebMD Inc . 4 сентября 2015 г. Доступно по адресу http://www.medscape.com/viewarticle/850564.
Кобаяши М., Беннетт Н.М., Гирке Р., Альмендарес О., Мур М.Р., Уитни К.Г. и др.Интервалы между вакцинами против PCV13 и PPSV23: Рекомендации Консультативного комитета по практике иммунизации (ACIP). MMWR Morb Mortal Wkly Rep . 2015 4 сентября. 64 (34): 944-7. [Медлайн].
Центры по контролю и профилактике заболеваний. Использование пневмококковой конъюгированной вакцины 13-Valent и пневмококковой полисахаридной вакцины 23-Valent для взрослых с иммунодефицитными состояниями: рекомендации Консультативного комитета по практике иммунизации (ACIP). MMWR Morb Mortal Wkly Rep . 2012 Октябрь 12, 61: 816-9. [Медлайн].
Tomczyk S, Bennett NM, Stoecker C, Gierke R, Moore MR, Whitney CG, et al. Использование пневмококковой конъюгированной вакцины 13-Valent и пневмококковой полисахаридной вакцины 23-Valent среди взрослых в возрасте 65 лет: рекомендации Консультативного комитета по практике иммунизации (ACIP). MMWR Morb Mortal Wkly Rep . 2014 сентябрь 19, 63 (37): 822-5. [Медлайн]. [Полный текст].
Bonten M, Bolkenbaas M, Huijts S, et al.Испытание иммунизации взрослых от внебольничной пневмонии (CAPiTA). № аннотации 0541. Пневмония 2014; 3: 95. Доступно по адресу https://pneumonia.org.au/public/journals/22/PublicFolder/ABSTRACTBOOKMASTERforwebupdated20-3-14.pdf.
Tang KL, Eurich DT, Minhas-Sandhu JK, Marrie TJ, Majumdar SR. Частота, корреляты и результаты рентгенографии грудной клетки нового диагноза рака легкого у 3398 пациентов с пневмонией. Arch Intern Med . 11 июля 2011 г. 171 (13): 1193-8. [Медлайн].
FDA запрашивает упакованные в рамку предупреждения о фторхинолоновых противомикробных препаратах: стремится усилить предупреждения, касающиеся повышенного риска тендинита и разрыва сухожилий [пресс-релиз]. Сильвер-Спринг, Мэриленд: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США; 8 июля 2008 г. FDA. Доступно на http://bit.ly/fkBFeA. Доступ: 14 января 2011 г.
Kollef M, et al. ASPECT-NP: рандомизированное двойное слепое исследование III фазы, в котором сравнивали эффективность и безопасность цефтолозана / тазобактама и меропенема у пациентов с вентилируемой нозокомиальной пневмонией (ВНП).Представлен на Европейском конгрессе клинической микробиологии и инфекционных заболеваний (ECCMID) 2019 г. (P1917). Амстердам, Нидерланды. 13-16 апреля 2019 г.
Исследование мокроты – обзор
Фиброоптическая бронхоскопия
Хотя исследование мокроты всегда должно быть включено в начальную оценку пациентов с пневмонией, оно может быть неадекватным для предположительного диагноза, особенно у пациента с ослабленным иммунитетом или пациента на ИВЛ. которым существует более широкий спектр потенциальных патогенов.Волоконно-оптическая бронхоскопия позволяет собирать культуры нижних дыхательных путей с помощью защищенных щеточных катетеров и выполнения бронхоальвеолярного лаважа (БАЛ) или трансбронхиальной биопсии или их обоих. 105 BAL, при котором сегмент легкого промывается стерильной жидкостью, отбирает образцы приблизительно 100 миллионов альвеол и, следовательно, исследует сегмент легкого большего размера, чем защищенная кисточка для образцов или трансбронхиальная биопсия.
Использование защищенного щеточного катетера и количественное культивирование материала, полученного в результате процедуры, минимизировали проблему контаминации ротоглотки и помогли дифференцировать колонизацию от истинной инфекции.Приблизительно от 10 6 до 10 8 организмов на миллилитр присутствует в легочной ткани, пораженной пневмонией. С учетом разбавления образцов количество бактерий от более 10 3 до 10 4 использовалось в качестве контрольной точки для определения клинической значимости изолята. При проспективном исследовании на ранних этапах ВП бронхоскопия выявила диагноз примерно у 50% пациентов. 106
Было показано, что бронхоскопия с защищенной щеткой для образцов имеет чувствительность от 82% до 100% и всего лишь 36% со специфичностью от 60% до 77% и минимальной для диагностики 50% бактериальной пневмонии. 107-109 Различия в критериях исключения и включения, разные определения пневмонии, а также принятие или отклонение пациентов с недавней сменой антибиотиков могут объяснить разные результаты. 110 Использование антибиотиков значительно снижает диагностическую ценность процедуры. Большинство видов бактерий, первоначально обнаруженных с помощью щетки для образцов с защитой, невозможно обнаружить после 72 часов антибиотикотерапии, а большинство обнаруженных организмов устойчивы к применяемым антибиотикам.Они могут не иметь никакого отношения к инфекции. Однако у пациента с продолжающейся пневмонией, несмотря на терапию антибиотиками, бронхоскопия с защищенной щеткой для образцов должна выявить устойчивые организмы, которые могут играть роль в инфекции. 107 BAL также использовался для диагностики атипичных пневмоний, в том числе вызванных Legionella, видов и M. pneumoniae.
Ложноотрицательные результаты наблюдаются у 30–40% пациентов, что может отражать тот факт, что количество бактерий может отличаться в 50 раз в областях инфицированного легкого по сравнению с неинфицированными соседними областями, что делает место отбора проб важным рассмотрение.Другие возможные объяснения включают предшествующее использование антибиотиков, проблемы с техникой и, в некоторых случаях, раннюю стадию пневмонии, при которой количество бактерий еще недостаточно велико, чтобы достичь критической точки процедуры.
Бронхоскопия с БАЛ особенно ценится для пациентов с ослабленным иммунитетом, включая пациентов со СПИДом. У пациентов со СПИДом диагностическая эффективность Pneumocystis пневмонии составляет от 89% до 98%. 111 Отличные результаты были также отмечены при обнаружении цитомегаловируса у пациентов со СПИДом, а также у реципиентов костного мозга и трансплантатов твердых органов, хотя обнаружение этого агента само по себе не доказывает, что он является причиной пневмонии. 112 Высокая степень иммуносупрессии у этих групп пациентов позволяет процветать высоким уровням патогенов, что упрощает их обнаружение.
БАЛ также оказался полезным для диагностики легочных M. tuberculosis и грибковых инфекций. Культура материала БАЛ имеет чувствительность приблизительно 85% к M. tuberculosis, даже в условиях отрицательного посева образцов откашливаемой мокроты и желудочного аспирата. 113 При использовании строгих диагностических определений чувствительность и специфичность ПЦР и анализа галактоманнана в БАЛ для инвазивного легочного аспергиллеза составляют 77% и 93%. 114 Бронхоскопия с окрашиванием калькофлюором и посевом грибков также может быть полезной при диагностике легочного гистоплазмоза, криптококкоза и кокцидиоидомикоза. 105,115,116
И бронхоскопия, и БАЛ широко используются у пациентов с вентилятор-ассоциированной пневмонией (ВАП). 117 «Бактериологическая стратегия», рекомендованная в руководстве IDSA / ATS по ВАП, рекомендовала бронхоскопию, БАЛ или эндобронхиальную аспирацию для установления наличия или отсутствия легочной инфекции, а также для определения специфической этиологии. 77 Проспективное многоцентровое исследование показало, что использование бронхоскопии с БАЛ и количественным посевом не улучшило клинических исходов по сравнению с неколичественным посевом эндотрахеального секрета. 118
Бронхоскопия сопряжена с риском. Это может вызвать дыхательную недостаточность и необходимость искусственной вентиляции легких у пациентов с гипоксемией. Существует риск кровотечения как при использовании защищенных щеточных катетеров, так и при трансбронхиальной биопсии, а также при меньшем риске пневмоторакса.У пациентов с грамотрицательной пневмонией после процедуры может следовать сепсисоподобная картина с повышенной температурой и пониженным средним артериальным давлением. Его обычно не следует рассматривать у пациентов с ВП, за исключением случаев, когда инфекция является тяжелой или неизлечимой или не наблюдается явной неудачи антибактериальной терапии, что свидетельствует о скрытом процессе, например о незначительном препятствующем поражении или инородном теле, не обнаруженном на диагностической визуализации. 105
Кровохарканье как первая презентация COVID-19: отчет о болезни | BMC Pulmonary Medicine
Весной 2020 года в приемное отделение региональной больницы обратился 58-летний мужчина с умеренной хронической обструктивной болезнью легких (ХОБЛ) с умеренным кровохарканьем с острым началом.Он не сообщил о лихорадке, ознобе, боли в груди или обострении одышки. Недавние обширные диагностические исследования непреднамеренной потери веса дали отрицательный результат на рак. Пациент курил уже 30 пачок в год. Он часто использовал никотиносодержащие электронные сигареты (электронные сигареты) и иногда курил марихуану за несколько месяцев до госпитализации. Он не сообщил никакой другой соответствующей истории болезни. Он работал библиотекарем и жил с женой в сельской местности. За три недели до поступления он очистил высохший пруд с рыбой.Его лекарства включали ингаляционный формотерол, который он использовал только по мере необходимости, и иногда ибупрофен.
При поступлении температура пациента составляла 36,2 ° C, артериальное давление 163/79 мм рт. Ст., Частота сердечных сокращений 95 ударов в минуту и сатурация кислорода по данным пульсоксиметрии 87% в окружающем воздухе. Он выглядел комфортно, без признаков респираторной недостаточности. Легкие при аускультации чистые, сердечный ритм ровный, шумов нет.
Лабораторный анализ показал нормальное количество лейкоцитов и С-реактивного белка (СРБ), а также уровень гемоглобина 13.2 г / дл (нормальный диапазон от 13,2 до 16,8). D-димеры не были повышены. Почечная функция и билирубин были в норме, как и уровни ферментов печени. Антинейтрофильные цитоплазматические антитела (ANCA), направленные против протеиназы 3 (PR3-ANCA) и миелопероксидазы (MPO-ANCA), были отрицательными, так же как и антитела против клубочковой базальной мембраны, антинуклеарные и антифосфолипидные антитела. Анализ газов артериальной крови показал умеренную гипоксемию с парциальным давлением кислорода (P a O2) 60 мм рт. Ст. (Референтный диапазон 83–108 мм рт. референсный диапазон 35–45 мм рт. ст.), что приводит к повышенному альвеолярно-артериальному градиенту 43.5 мм рт. Ст. (Эталонный расчетный возрастной градиент 17 мм рт. Ст.).
При компьютерной томографии (КТ) ангиографии грудной клетки в нижних долях наблюдались центрально распределенные помутнения матового стекла, что свидетельствует о диффузном альвеолярном кровотечении (ДАГ), а также о центрилобулярной эмфиземе в верхних долях (рис. 1). Признаков тромбоэмболии легочной артерии не было.
Рис.1КТ показывает помутнения центрального матового стекла в нижних долях, что свидетельствует о DAH
В соответствии с институциональными рекомендациями во время текущей пандемии COVID-19, образцы носоглоточного мазка (NPS) были получены и протестированы в течение двух дней подряд SARS-CoV-2 с использованием полимеразной цепной реакции в реальном времени (ОТ-ПЦР), которая неоднократно давала отрицательный результат.
Гибкая бронхоскопия, выполненная на третьи сутки, выявила многочисленные кровянистые выделения без признаков активного кровотечения. После очистки секрета бронхиальное дерево выглядело нормальным без структурных аномалий. Образцы БАЛ были получены на культуру и патологию. Чтобы изучить возможность повреждения легких, связанного с употреблением электронных сигарет или электронных сигарет (EVALI), а также недавнего употребления марихуаны, ацетат витамина Е был протестирован в жидкости БАЛ, но результаты оказались отрицательными.
Удивительно, но SARS-CoV-2 был обнаружен в жидкости БАЛ с помощью ОТ-ПЦР.Основываясь на текущих данных того времени и в соответствии с национальными руководящими принципами, пациенту начали принимать гидроксихлорохин (400 мг два раза в день в первый день, затем 200 мг два раза в день в день 2-5) вместе с амоксициллином / клавулановой кислотой и азитромицин (QTc 429 мс до начала лечения). Ремдесивир, тоцилизумаб и плазма выздоравливающих не были доступны в то время, за исключением клинических испытаний и программ неотложной медицинской помощи, на которые пациент не соответствовал.
На четвертый день пациент был переведен в отделение интенсивной терапии респираторных заболеваний COVID-19 нашей больницы.При поступлении в наш центр у пациента была легкая респираторная недостаточность. Его температура была 38,0 ° C, артериальное давление 107/67 мм рт.ст., частота сердечных сокращений 106 ударов в минуту и сатурация кислорода по данным пульсоксиметрии 92%, при этом он получал дополнительный кислород через носовую канюлю со скоростью потока два литра в минуту. Легкие при аускультации чистые. Дальнейшее медицинское обследование прошло нормально. Количество лейкоцитов составляло 6070 / мкл (контрольный диапазон, 3650–9700 / мкл), с числом лимфоцитов 730 / мкл (контрольный диапазон, 1133–3105 / мкл).Количество тромбоцитов составляло 137 000 / мкл (референсный диапазон 149 000-319 000 / мкл), уровень гемоглобина 10,1 г / дл (референтный диапазон 12,9-17,3 г / дл), уровень ферритина 462 мкг / л (пиковое значение: 608 мкг. / Л на 10-й день) (референсный диапазон 20–280 мкг / л), общий уровень билирубина 2,1 г / дл (референтный диапазон 0,2–1,3 г / дл), уровень аспартатаминотрансферазы 335 Ед / л (референтный диапазон, 0–37 Ед / л), уровень аланинаминотрансферазы 360 Ед / л (контрольный диапазон, 7–40 Ед / л) и С-реактивный белок 12,1 г / л (контрольный диапазон, <5 г / л).Почечная функция была нормальной, как и скрининг коагуляции с уровнем протромбина (PT) 79% (референсный диапазон от 70 до 120), активированным частичным тромбопластиновым временем (aPTT) 36 с (референтный диапазон от 28,9 до 38,1) и D -димеры 880 нг / мл (нормальный диапазон <270 нг / мл). Тесты на антигены Legionella pneumophila серогруппы 1 и Streptococcus pneumoniae в моче были отрицательными, как и серологические исследования лептоспироза. Лёгочная гипертензия была исключена трансторакальной эхокардиографией.
На пятый день госпитализации у пациента развилось внезапное массивное кровохарканье, и сатурация кислорода упала до 82%, несмотря на то, что пациент получал 15 л дополнительного кислорода в минуту через маску без повторного дыхания с резервуаром. Была проведена срочная интубация и начаты непрерывные инфузии пропофола, ремифентанила и норадреналина. Была проведена новая КТ-ангиография грудной клетки, которая выявила альвеолярное кровотечение, более заметное в левом легком. Гибкая бронхоскопия, проведенная в отделении интенсивной терапии, выявила тромб, закупоривающий левый главный бронх.После манипуляции и ретракции сгустка кровотечение возобновилось и, по-видимому, началось из левой верхней доли. Применяли местный физиологический раствор со льдом и адреналин. Из-за постоянного кровотечения была выполнена бронхиальная артериография, которая показала воспалительный румянец, возникающий из левой бронхиальной артерии и из левой ветви правой бронхиальной артерии, которые были успешно эмболизированы.
Пациент был экстубирован на следующий день и полностью выздоровел. Последующая КТ грудной клетки через две недели показала полное разрешение помутнений матового стекла (рис.2). Учитывая тот факт, что никакой другой этиологии не было обнаружено, COVID-19 считался основной причиной кровохарканья у этого пациента.
Рис. 2Последующая компьютерная томография грудной клетки, показывающая полное разрешение помутнений матового стекла
Нейроэндокринная опухоль легкого: симптомы и признаки
НА ЭТОЙ СТРАНИЦЕ: Вы узнаете больше об изменениях тела и других вещах, которые может сигнализировать о проблеме, которая может потребовать медицинской помощи. Используйте меню для просмотра других страниц.
СЕТЬ легких на ранних стадиях часто не вызывает никаких симптомов.Этот тип опухоли обычно обнаруживается хирургом во время несвязанной операции или при визуализации другого состояния. Люди с НЭО в легких могут испытывать следующие симптомы или признаки. Также описаны признаки и симптомы карциноидного синдрома и карциноидного криза, которые являются состояниями, которые может вызвать НЭО легких. Однако причиной симптома может быть другое заболевание, не являющееся НЭО в легких.
Если вас беспокоят какие-либо изменения, которые вы испытываете, поговорите со своим врачом.В дополнение к другим вопросам врач спросит, как долго и как часто вы испытываете этот симптом (ы). Это поможет выяснить причину проблемы, которая называется диагностикой.
Симптомы легкого NET
Есть 2 способа, которыми НЭО в легких может вызывать симптомы. Опухоль может блокировать дыхательные пути, вызывая кашель или одышку. Или гормоны, выделяемые опухолью, могут вызвать карциноидный синдром (см. Ниже). НЕТИ легкого с гораздо меньшей вероятностью вызывает карциноидный синдром, чем НЭО желудочно-кишечного тракта.
Люди с НЭО в легких могут испытывать следующие симптомы или признаки:
Кашель с кровянистой мокротой или мокротой или без нее
Свистящее дыхание
Постобструктивная пневмония, когда опухоль, блокирующая большой проход воздуха, вызывает инфекцию
Боль в груди
Карциноидный синдром
Карциноидный синдром
Карциноидный синдром является классическим примером функционального НЭО и чаще всего встречается у людей с НЭО тонкого кишечника.При карциноидном синдроме серотонин вырабатывается опухолью и может вызывать симптомы. Серотонин наиболее легко и надежно измеряется в моче, когда он превращается в 5-гидроксииндолуксусную кислоту (5-HIAA), и это измеряется при 24-часовом сборе мочи. Не у всех людей с НЭО развивается карциноидный синдром.
Люди с карциноидным синдромом могут испытывать 1 или несколько из следующих симптомов или признаков. Важно отметить, что одних этих симптомов недостаточно для диагностики карциноидного синдрома.Для постановки диагноза также необходимы анализы крови или мочи для определения подозреваемых гормонов.
Покраснение лица, то есть покраснение и ощущение тепла на лице
потеет
Диарея
Одышка
Свистящее дыхание или симптомы астмы
Слабость
Учащенное сердцебиение
Шумы в сердце
Повышенное артериальное давление и значительные колебания артериального давления
Карциноидная болезнь сердца, которая представляет собой рубцевание сердечных клапанов
Карциноидный синдром может повредить сердце, поэтому важно уменьшить его симптомы.Стресс, физические нагрузки и употребление алкоголя могут усугубить эти симптомы. Некоторые продукты могут также вызывать симптомы карциноидного синдрома, в том числе продукты с высоким содержанием:
Амины, такие как выдержанные сыры, дрожжевые экстракты, тофу, квашеная капуста, копченая рыба и мясо
Серотонин, например грецкие орехи, орехи пекан, бананы, бананы и помидоры
Карциноидный кризис
Карциноидный криз – это термин, используемый, когда пациенты испытывают серьезные внезапные симптомы карциноидного синдрома, обычно во время сильного стресса, такого как операция.Карциноидный криз в первую очередь включает серьезные колебания артериального давления и частоты сердечных сокращений. Карциноидный криз – наиболее серьезное и опасное для жизни осложнение карциноидного синдрома. Карциноидный криз можно предотвратить и успешно вылечить с помощью октреотида (сандостатина), лекарства, которое помогает контролировать выработку гормонов, или ланреотида (соматулин-депо).
Лечение симптомов карциноидного синдрома
Если диагностирована НЭО в легких, облегчение симптомов остается важной частью медицинской помощи и лечения.Это может называться паллиативной или поддерживающей терапией. Часто его начинают сразу после постановки диагноза и продолжают на протяжении всего лечения.
Ниже приводится информация о том, как можно управлять некоторыми симптомами НЭО легких. Обязательно регулярно обсуждайте со своим лечащим врачом симптомы, которые вы испытываете, включая любые новые симптомы или изменение симптомов.
Промывка лица. Избегайте стрессов. Спросите своего врача о конкретных веществах и продуктах, включая алкоголь, которые могут вызвать покраснение лица, связанное с карциноидным синдромом, чтобы вы могли их избегать.
Хрипы. В зависимости от того, что вызывает хрипы, могут помочь бронходилататоры. Бронходилататор – это лекарство, которое расслабляет мышцы легких и облегчает дыхание.
Диарея. У людей с NET может быть много причин диареи. Если ваша диарея вызвана карциноидным синдромом, могут помочь аналоги соматостатина и телотристат этил (Ксермело). Спросите своего врача о конкретных рекомендациях.
Проблемы с сердцем. Немедленно сообщите врачу, если вы считаете, что у вас проблемы с сердцем, поскольку карциноидный синдром может повредить сердечные клапаны.
Узнайте больше об управлении распространенными симптомами рака и побочными эффектами лечения.
Следующий раздел в этом руководстве – Диагностика . В нем объясняется, какие тесты могут потребоваться, чтобы узнать больше о причине симптомов. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
.
 Нежелателен приём: витамина С, никотиновой кислоты.
Нежелателен приём: витамина С, никотиновой кислоты.
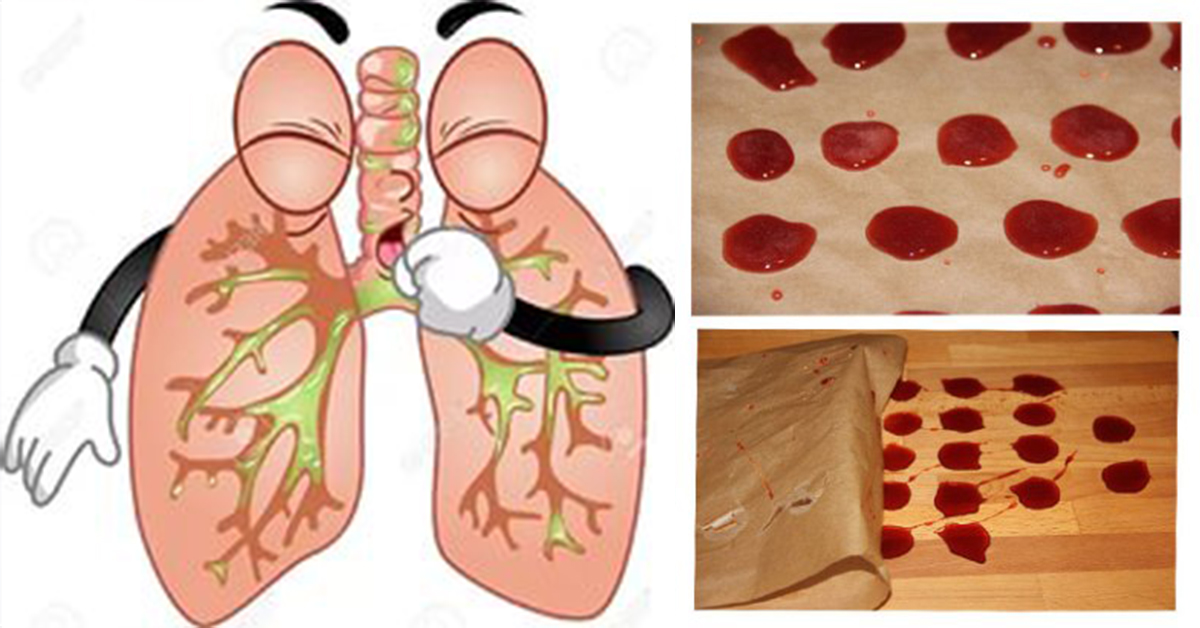
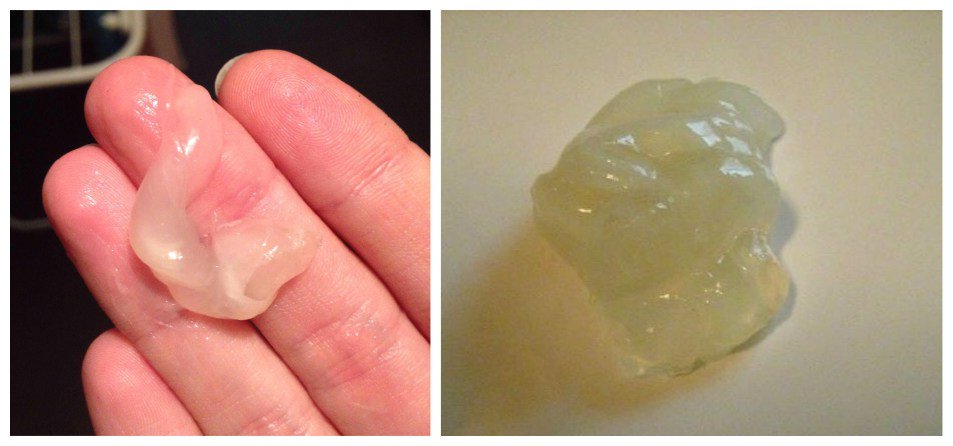

 О.,
даты рождения, даты и времени взятия материала и локализации, откуда получен образец.
О.,
даты рождения, даты и времени взятия материала и локализации, откуда получен образец.







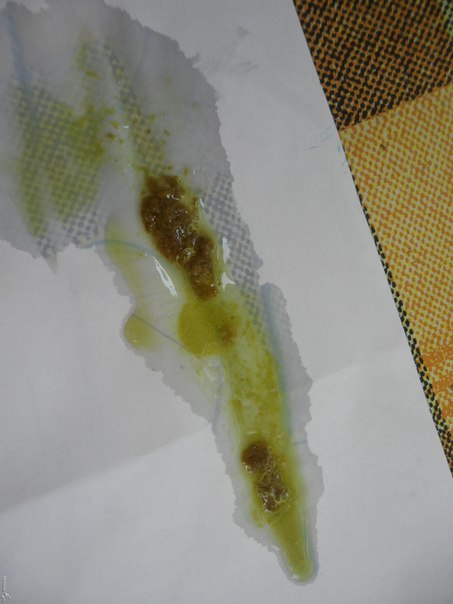

 При вскрытии абсцесса железы гной берут
стерильным тампоном, входящим в состав транспортной системы Эймс с углем, после чего его погружают в
пробирку со средой.
При вскрытии абсцесса железы гной берут
стерильным тампоном, входящим в состав транспортной системы Эймс с углем, после чего его погружают в
пробирку со средой.




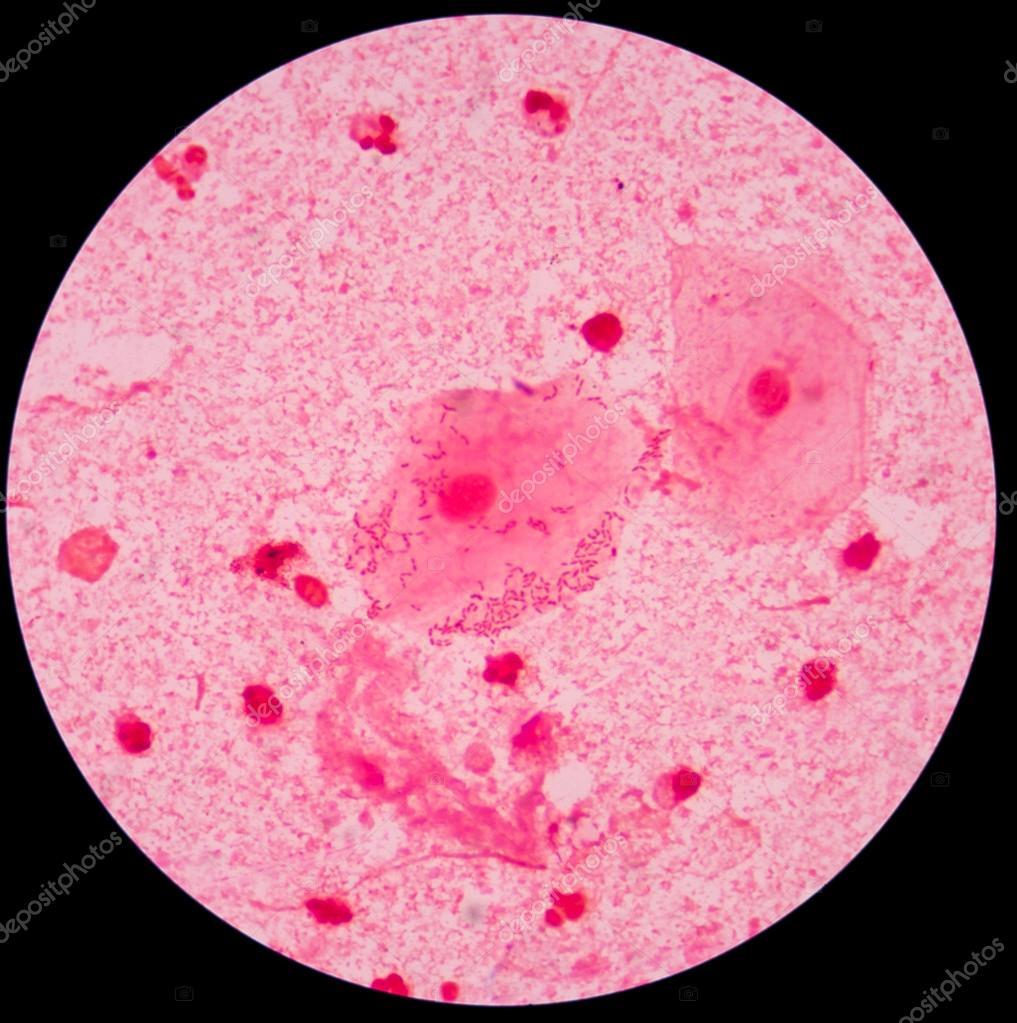

 Не
дотрагивайтесь руками до внутренних стенок контейнера и крышки.
Не
дотрагивайтесь руками до внутренних стенок контейнера и крышки. При наличии
гнойных наложений мазок желательно брать на границе здоровых и пораженных тканей (т.к. именно там
находится наибольшее количество микробов).
При наличии
гнойных наложений мазок желательно брать на границе здоровых и пораженных тканей (т.к. именно там
находится наибольшее количество микробов). 
 При
выполнении данной процедуры стараться не прикасаться к языку и слизистым щек.
При
выполнении данной процедуры стараться не прикасаться к языку и слизистым щек.