Неспецифические воспалительные заболевания дыхательных путей :: АЦМД
Диагноз «неспецифическое воспалительное заболевание» встречается довольно часто, можно сказать: «на слуху». Что же кроется под этим обозначением? Какие заболевания входят в группу НПВЗ?
Бронхит
наиболее часто встречаемый воспалительный процесс в бронхах с острым или хроническим течением.
Причинами развития бронхита могут вирусная или бактериальная инфекция, хронический воспалительный процесс верхних дыхательных путей (носоглотка, гортань, трахея, ППН), загрязненный воздух (пыль, сажа, химические вещества).
В основе заболевания лежит нарушение дренажной функции бронхов, изменение количеств секрета в них, нарушение эвакуации и перистальтики, заполнения бронхов слизью.
Клинически проявляется кашлем с большим количеством мокроты разного, в зависимости от этиологии, характера, повышением температуры тела, отдышкой, интоксикацией.
Диагностика: на рентгенограммах высокого качества можно определить расширение бронхов, утолщение их стенок, Y-образные расширенные разветвления, на СКТ-сканах можно выявить наполненные и обтурированные слизью бронхи, и, как следствие, ателектаз долек. Только при помощи спиральной компьютерной томографии можно выявить ограниченные участки повышенной прозрачности и вздутия, буллезную эмфизему, расширение корней легких за счет увеличения калибра легочных артерий, в которых повышается давление. При хроническом бронхите отмечается уменьшение средних и мелких разветвлений лёгочной артерии. В острые периоды может наблюдаться увеличение лимфоузлов средостения, которые можно выявить и дифференцировать только при помощи СКТ.
Только при помощи спиральной компьютерной томографии можно выявить ограниченные участки повышенной прозрачности и вздутия, буллезную эмфизему, расширение корней легких за счет увеличения калибра легочных артерий, в которых повышается давление. При хроническом бронхите отмечается уменьшение средних и мелких разветвлений лёгочной артерии. В острые периоды может наблюдаться увеличение лимфоузлов средостения, которые можно выявить и дифференцировать только при помощи СКТ.
Бронхиальная астма
это хроническое рецидивирующее аллергическое заболевание, которое характеризуется периодическими возникновениями отдышки, вызванной спазмом бронхов, гиперсекрецией и отеком слизистой оболочки.
По этиологии принято считать «виноватыми» бактериальные аллергены окружающей среды, пыль, холод, запахи, инфекционно-аллергические агенты (микроорганизмы и продукты их жизнедеятельности).
Клинически бронхиальная астма проявляется приступами отдышки, которые могут продолжаться до 3-7 суток: вздох короткий, сильный и глубокий, выдох – медленный судорожный, сопровождается свистящими хрипами. Лицо у больного одутловатое, бледное. Во время приступа отходит большое количество вязкой мокроты.
Лицо у больного одутловатое, бледное. Во время приступа отходит большое количество вязкой мокроты.
Диагностика: на рентген-снимках можно диагностировать эмфизему, зазубренность контура диафрагмы, низкое стояние куполов диафрагмы. При хроническом течении формируются устойчивые изменения в виде бочковидной деформации грудной клетки, фиброзной деформация легочного рисунка, распространенной эмфиземы легких, расширения артериальных сосудов в области корней легких. При помощи спиральной компьютерной томографии (СКТ) можно отчетливо дифференцировать утолщенные стенки бронхов, расширенные просветы бронхиального дерева, различные виды эмфиземы легких, изменение сосудистого рисунка, с преобладанием и усилением в прикорневых отделах, ослаблением в кортикальных.
Фиброзирующие альвеолиты
К этой группе относятся различные нозологические формы, которые возникают вследствие проникновения в организм повреждающих агентов, вызывающих идиопатические, аллергические или токсические альвеолиты. Данная группа заболеваний распространена среди работников сельского хозяйства, в текстильной, швейной, химической и фармацевтической промышленности.
Данная группа заболеваний распространена среди работников сельского хозяйства, в текстильной, швейной, химической и фармацевтической промышленности.
Заболевания характеризуются тремя взаимосвязанными процессами: отек, воспаление, фиброз.
Клинически у больных отмечается развитие отдышки кашель, повышение температуры тела, боль в грудной клетке, постепенная потеря веса. Течение может быть острым (6мес-2 года) и хроническим (6-8 лет) с периодическими рецидивами.
Диагностика: на рентген снимках отмечается усиление и сетчатая деформация легочного рисунка, нечеткая очерченность сосудов и бронхов, местами определяются участки вздутия и коллапса легких, далее присоединяются грубые фиброзные изменения легких и плевры, которая визуализируется в виде перибронхиальной, периваскулярной фиброзной тяжистости, множественные пузыревидные вздутия в кортикальных отделах легких (сотовое легкое). На ранних стадиях при помощи спиральной компьютерной томографии (СКТ) можно определить степень и протяженность фиброзно-кистозных дегенеративных изменений легочной паренхимы и мелкие очаги в периферических отделах легких.
Пневмония
принадлежит к наиболее распространенным заболеваниям легких. Патологический процесс локализуется в бронхах, бронхиолах, альвеолярной паренхиме, соединительной ткани. Различают первичную и вторичную пневмонию. Чаще всего причиной развития первичной пневмонии является бактериальная инфекция. Патологическими агентами может быть пневмококк, стафилококк, палочка Фридлендера, синегнойная и кишечная палочки, прочее. На ряду с бактериальной пневмонией также существует и опасность возникновения вирусной пневмонии (гриппозная, аденовирусная, орнитозная), рикетсиозной пневмонии, паразитарной, грибковой и других видов. Вторичная пневмония развивается в следствие имеющихся инфекционных заболеваний (коклюш, корь, тиф, сифилис) или при наличие гнойных очагов (фурункул, абсцесс, остеомиелит).
Клинически пневмония чаще всего возникает неожиданно, на фоне повышения температуры тела до 39 градусов, сопровождается головной болью, болью в груди, которая усиливается во время дыхания, кашля.
Диагностика: на рентген-снимке определяется частичная локализованная или разлитая (зависит от формы пневмонии) тень, возможны варианты с наличием множественных диссеминированных очагов. При помощи спиральной компьютерной томографии (СКТ) можно точно выявить и локализовать даже мелкие, «невидимые» при рентген-исследовании очаги, определить состояние плевры, наличие жидкости в плевральной полости, СКТ позволяет детально оценить прилегающие отделы неизмененной легочной паренхимы, состояние бронхов, лимфоузлов средостения и прочее.
Если резюмироватьКак мы видим, различных заболеваний, этиологических факторов и нюансов внешних проявлений масса, относительно общее одно – диагностика. Чаще всего пациенты с жалобами на патологию органов дыхания направляются на рентген диагностику или СКТ, так как при помощи совокупности этих методов можно действительно наиболее детально и точно распознать болезнь даже на ранних стадиях, провести дифференциальную диагностику и назначить необходимое лечение.
Высококачественная цифровая рентгенография и спиральная компьютерная томография в АЦМД.
Статью подготовили специалисты отделения лучевой диагностики АЦМД-МЕДОКС
Визуализация болезней бронхов (часть 2)
Стенограмма второй части видеолекции профессора Игоря Евгеньевича Тюрина о визуализации болезней бронхов изображении из второй передачи цикла лучевая диагностика для терапевтов.
Игорь Евгеньевич Тюрин, профессор, доктор медицинских наук:
– Поскольку обструктивные болезни сами по себе считаются фактором риска для развития многих социально значимых, важных, скрыто протекающих болезней, то рентгенологическое исследование для таких пациентов имеет определенное значение и для выявления злокачественной опухоли, туберкулеза. Он у такой категории пациентов может выявляться несколько чаще, чем в общей группе пациентов.
Какие изменения мы можем выявлять при рентгенографии, при КТ. Я попробовал разделить эти патологические состояния на несколько составных частей для того, чтобы это было более системно, понятно, методично, с точки зрения восприятия иногда достаточно сложных рентгеновских и томографических симптомов.
Я попробовал разделить эти патологические состояния на несколько составных частей для того, чтобы это было более системно, понятно, методично, с точки зрения восприятия иногда достаточно сложных рентгеновских и томографических симптомов.
Изменения при рентгенографии. Признаки бронхита, бронхиальной обструкции и эмфиземы.
К сожалению, когда речь идет об обычном рентгеновском исследовании или даже компьютерно-томографическом исследовании, рентгенологи и лечащие врачи относительно редко дифференцируют эти симптомы, клинические рентгенологические проявления друг от друга. Хотя проявления даже при обычном рентгеновском исследовании совершенно различные. Мы должны уметь находить эти признаки даже на обычном рентгеновском снимке, чтобы точно характеризовать патологический процесс.
Что такое изменения при рентгенографии в виде признаков хронического бронхита. Именно хронического бронхита, потому что острое воспаление слизистой оболочки бронхов, как правило, не находит никакого отражения при рентгенологическом и томографическом исследовании.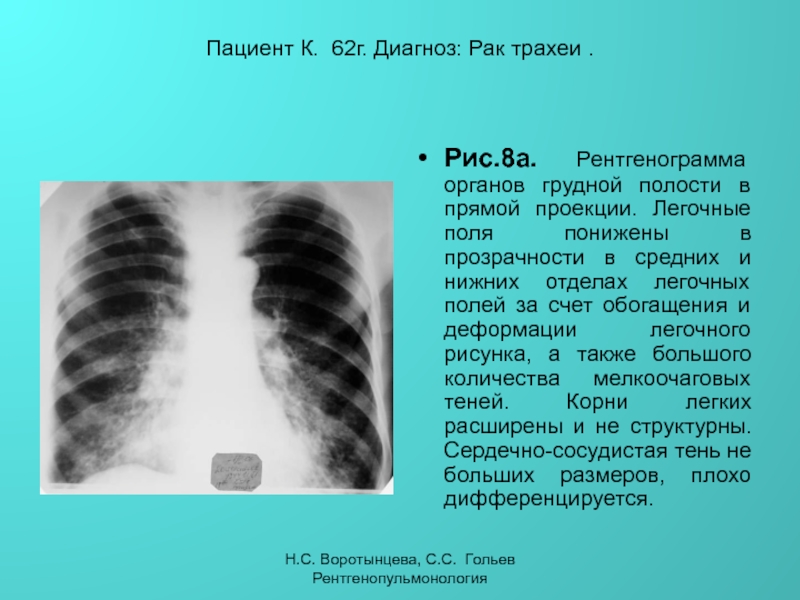
Обычные признаки, такие как усиление и деформация легочного рисунка, рентгенологи добавляют в свои протоколы за счет интерстициального компонента. Утолщение стенок бронхов, которое мы можем увидеть на рентгеновских снимках и на томограммах, определяют как перибронхиальные муфты. Одновременно с этим периваскулярные муфты.
Расширение бронхов возможно. Но при обычных рентгеновских исследованиях, в отличие от томографических исследований, мы видим расширенные бронхи значительно реже и не так уверенно, как при КТ.
Если вернуться к обычному рентгеновскому исследованию, то у больных с обструктивными болезнями эти изменения крупных бронхов мы видим в прикорневой области. Это связано с утолщением стенок бронхов.
(Демонстрация слайда).
Стрелками здесь указаны перибронхиальные муфты, то есть утолщение стенок бронхов, которое мы можем видеть в продольном или поперечном сечении.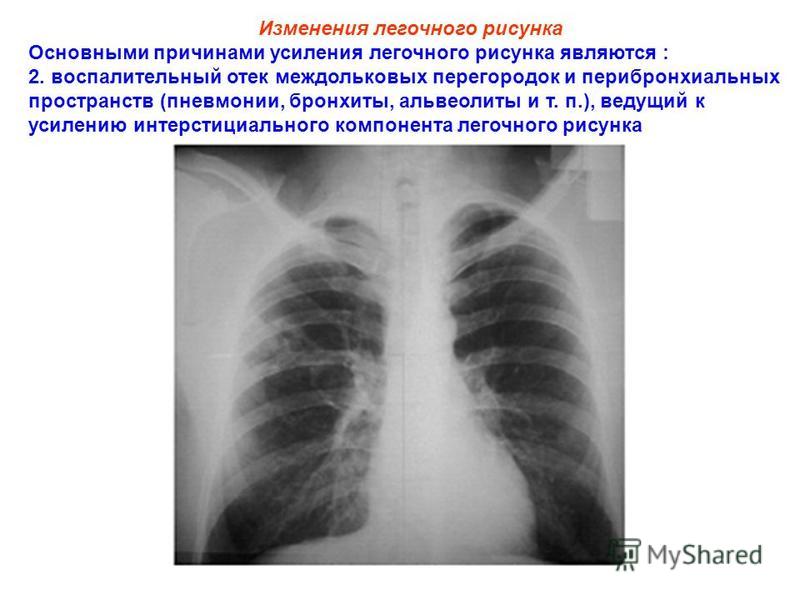 Оно достаточно точно и адекватно отражает степень выраженности хронического воспалительного процесса в самих бронхах. Плюс к этому – изменение легочного рисунка за счет легочного интерстиция, который мы можем наблюдать у таких пациентов.
Оно достаточно точно и адекватно отражает степень выраженности хронического воспалительного процесса в самих бронхах. Плюс к этому – изменение легочного рисунка за счет легочного интерстиция, который мы можем наблюдать у таких пациентов.
03:22
Но на что мне бы хотелось обратить внимание. Мы к этому будем возвращаться сегодня не раз. Эти изменения сразу же на основании одного рентгеновского снимка нельзя интерпретировать как необратимые изменения, как проявления пневмосклероза, какого-то конкретного морфологического типа изменений в легочной ткани.
Чаще всего мы наблюдаем таких пациентов при обострении болезни, когда речь идет не столько и не только о склеротических изменениях в стенках бронхов или в перибронхиальной легочной ткани, сколько об отеках стенок бронхов, приходящих изменениях. Фактически эта картина, напоминающая интерстициальный отек с перибронхиальными изменениями.
Как только эти острые симптомы уходят и пациенты возвращаются в свое стабильное состояние, рентгенологическая картина очень часто тоже свидетельствует об исчезновении значительной части этих признаков, которые иногда не совсем корректно характеризуются как необратимые изменения.
При обычном рентгеновском исследовании относительно редко видим признаки расширения бронхов, бронхоэктазы, кистозные полости с относительно толстыми стенками. Иногда мы в них даже видим уровни жидкости (при обострении).
Это выраженные изменения, которые могут наблюдаться в далеко зашедших стадиях. Их нужно дифференцировать с другими заболеваниями, которые могут приводить к формированию бронхоэктазов помимо обструктивной болезни легких.
Принципиально важно, что на рентгеновских снимках мы видим достаточно четко признаки бронхиальной обструкции. Это:
– уплощение диафрагмы;
– ограничение ее подвижности;
– вертикальное расположение сердца;
– увеличение ретростернального пространства;
– признаки легочной артериальной гипертензии, которые могут возникать у такого рода пациента.
05:14
Уплощение диафрагмы и ограничение ее подвижности не случайно написаны в первых двух строчках.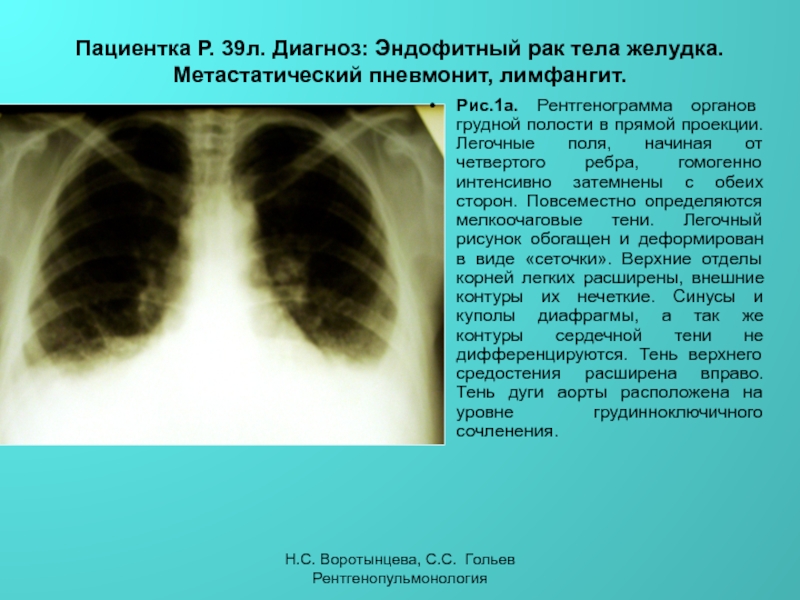 Давно известно и хорошо доказано, что это два наиболее важных, достоверных, точных признака, которые характеризуют нарушение прохождения воздуха через мелкие бронхи и увеличение остаточного объема в легких.
Давно известно и хорошо доказано, что это два наиболее важных, достоверных, точных признака, которые характеризуют нарушение прохождения воздуха через мелкие бронхи и увеличение остаточного объема в легких.
Когда мы интерпретируем или рассматриваем рентгеновские снимки грудной полости, то, прежде всего, мы внимание обращаем не на степень прозрачности легочной ткани, которая исключительно вариабельно зависит от возраста, от конституции, от физических условий выполнения рентгеновского снимка, сколько на положение средостения, диафрагмы, на ретростернальное пространство.
Уплощение диафрагмы и изменение конфигурации грудной клетки – это и есть два важнейших рентгенологических признака, которые позволяют нам говорить о формировании, о наличии обструктивных изменений в легочной ткани. Раньше для этой цели гораздо чаще использовалось рентгеноскопическое исследование. Рентгенологи могли оценивать подвижность диафрагмы, ограничение этой подвижности у больных с обструктивными болезнями.
Сейчас это делается значительно реже. Но мы хорошо это видим. Увеличение ретростернального пространства и уплощение купола диафрагмы, которая должна иметь куполообразную форму как основная дыхательная мышца. Это два важнейших признака наличия бронхиальной обструкции у такого рода пациентов.
Там, где эти изменения достигают значительной степени выраженности, мы видим не только изменения конфигурации грудной клетки, которая приобретает типичную пучкообразную форму. Не только плоскую или даже вогнутую в сторону брюшной полости диафрагму, но и те признаки, о которых рентгенологи упоминают в своих протоколах.
Это повышение воздушности легочной ткани, обеднение легочного рисунка, который практически неразличим на фоне исключительно высокого содержания воздуха в легочной ткани. Классический пример такого обструктивного заболевания при рентгеновском исследовании.
07:40
Эти изменения прослеживаются в динамике, если мы наблюдаем таких пациентов достаточно долгое время.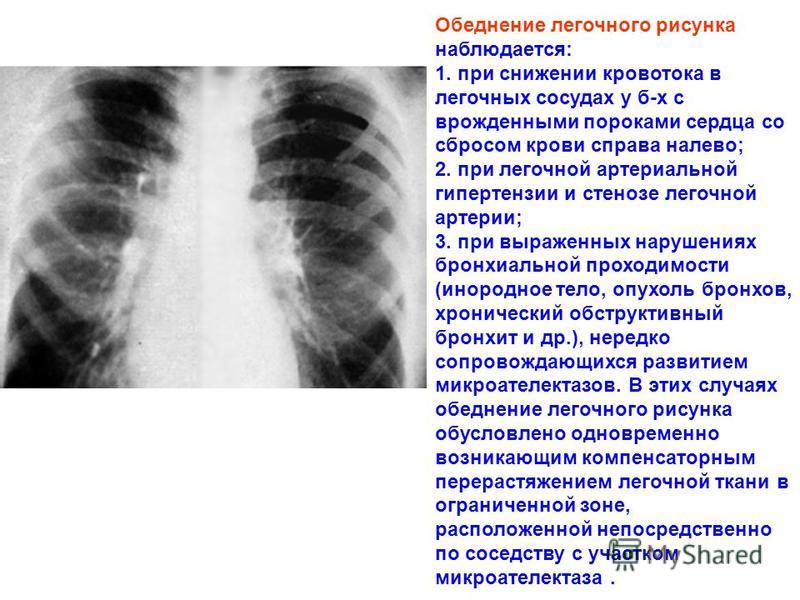
Сомнительные признаки (я бы так их обозначил). Я специально обращаю ваше внимание на это, потому что в протоколах нередко эти признаки обозначаются как характерные проявления именно обструктивного состояния или проявления эмфиземы.
Это не совсем верно, потому что и повышение воздушности легочной ткани, и низкое расположение диафрагмы, которую мы видим на снимках в прямой проекции, и расширение межреберных промежутков – это признаки, которые в очень существенной степени зависят от конституции, от многих других технологических факторов. Не всегда корректно отражают состояние легочной ткани.
Какие признаки характеризуют эти же изменения при КТ. Все то, что мы сейчас говорили для обычного рентгеновского исследования, можем наблюдать и при КТ. Но плюс к этому наблюдаем еще несколько очень важных и интересных признаков, о которых сегодня будем говорить более подробно.
Это экспираторные воздушные ловушки, деформация трахеи, которая видна и при рентгеновском исследовании, но точно и отчетливо выявляется и при КТ. Это экспираторный коллапс бронхов. В некоторых случаях это симптом мозаичной плотности, который характеризует плотность и неравномерную воздушность легочной ткани.
Воздушные ловушки – классический признак бронхиальной обструкции, который выявляется при КТ.
(Демонстрация слайда).
У этого пациента при исследовании на выдохе нижние доли легких оказываются такими же воздушными как на вдохе. Верхние закономерно повышают свою плотность, или воздушность их уменьшается в силу того, что объем воздуха в альвеолах на выдохе становится меньше.
Такие крупные воздушные ловушки, которые занимают доли легкого или несколько сегментов или сегмент легкого, действительно имеют большое диагностическое значение и позволяют судить о характере патологического процесса.
10:03
Они выявляются при высокоразрешающей КТ, на высоте глубокого задержанного выдоха и возникают при задержке прохождения воздуха по мелким бронхам. Различаются по объему. Клиническое значение имеют только относительно крупные изменения (сегментарные, долевые воздушные ловушки).
Различаются по объему. Клиническое значение имеют только относительно крупные изменения (сегментарные, долевые воздушные ловушки).
Мелкие участки повышения воздушности при исследовании на выдохе могут наблюдаться и у совершенно здоровых людей без каких-либо заболеваний в этой области.
Саблевидная трахея или трахея по типу сабельных ножен – рентгенологический синдром бронхиальной обструкции, когда трахея сдавливается увеличенными в объеме легкими с двух сторон сагиттальной плоскости и приобретает своеобразную форму. В прямой проекции или во фронтальной она имеет небольшие размеры, узкая. В боковой проекции сагиттальной плоскости достаточно широкие размеры.
Экспираторный коллапс бронхов тоже может быть проявлением бронхиальной обструкции и создавать очень интересную клиническую картину, не совсем характерную для обычной клинической картины обструктивной болезни легких.
Мы это хорошо видим при КТ на выдохе. Бронхи, сегментарные и субсегментарные, хорошо видимые при исследовании на вдохе, оказываются спавшимися и практически неразличимыми на фоне легочной ткани при исследовании на выдохе. Это замедляет выход воздуха из легочной ткани и создает соответствующую клиническую симптоматику.
Это замедляет выход воздуха из легочной ткани и создает соответствующую клиническую симптоматику.
11:36
Эмфизема как одно из важнейших проявлений обструктивной болезни легких и хронической обструктивной болезни легких. Стандартное, традиционное, существующее уже много лет, определение. Патологическое необратимое увеличение воздухосодержащих пространств легкого в результате разрушения легочной ткани при отсутствии воспалительных изменений.
Принципиально важно в этом определении, что важно для лучевой диагностики, для томографических исследований, для оценки данных рентгеновских исследований. Эмфизема – это необратимое патологическое состояние, которое сопровождается выраженными морфологическими изменениями в легочной ткани. Это увеличение количества воздуха в легочной ткани, связанное с разрушением легочной ткани.
Этим принципиально эмфизема отличается от множества других функциональных нарушений, которые могут возникать в легочной ткани. Функциональных изменений в результате гипервентиляции, увеличения объема легочной ткани, при которых никаких нарушений структуры легочной ткани не возникает.
Функциональных изменений в результате гипервентиляции, увеличения объема легочной ткани, при которых никаких нарушений структуры легочной ткани не возникает.
Задача рентгенологического исследования и КТ заключается именно в том, чтобы попытаться выявить эти морфологические признаки, определить их локализацию, степень выраженности. На этом основании определить или предложить какой-то характер возможных лечебных мероприятий.
Виды эмфиземы всем хорошо знакомы. Она различается по характеру изменений в легочной ткани. Локализоваться она может в верхних и нижних долях, иметь диффузное распределение.
С точки зрения морфологических изменений на хорошо известных схемах патологии мелких дыхательных путей и легочной ткани хорошо видно, почему нормальные дыхательные пути и прилежащие к ним воздухосодержащие пространства, расширяясь, формируют панацинарную, центриацинарную и дистальную ацинарную эмфизему.
13:39
Эти изменения, если мы говорим о рентгенографических исследованиях, выявить не так просто. При рентгенологическом исследовании мы должны определить морфологические изменения в легочной ткани. Не функциональные, связанные с повышением количества воздуха, остающегося в легочной ткани, а именно морфологические.
При рентгенологическом исследовании мы должны определить морфологические изменения в легочной ткани. Не функциональные, связанные с повышением количества воздуха, остающегося в легочной ткани, а именно морфологические.
В разграничении двух этих патологических состояний обычная рентгенография не очень точно имеет. Мы можем обнаружить прямые рентгенологические признаки эмфиземы. Это локальное обеднение легочного рисунка (васкулярные зоны). Это нарушение архитектоники легочного рисунка (оттеснение, раздвигание, смещение сосудов, какие-то отдельные участки за счет формирования отдельных полостей).
Прямая визуализация стенок булл, которые мы можем обнаружить на рентгеновских снимках. Это будет прямым показанием для утверждения наличия эмфиземы как патологического состояния.
(Демонстрация слайда).
Это один из примеров того, что далеко не всегда просто сориентироваться в характере изменения легочной ткани и надежно и точно утверждать, что здесь действительно есть эмфизема. Признаки эмфиземы, увеличения объема легких у этой пациентки выражены совсем не так, как у прошлых пациентов.
Признаки эмфиземы, увеличения объема легких у этой пациентки выражены совсем не так, как у прошлых пациентов.
Тем не менее, если посмотреть на снимок в боковой проекции на верхнюю часть легочного поля, то обращает на себя внимание не совсем обычный легочный рисунок – нечто подобное полостям, которые формируются в этой части легкого.
Если вернуться к КТ, то в левом легком практически вся верхняя доля замещена большим количеством воздушных полостей с тонкими стенками. Между ними находится компримированная сдавленная легочная ткань. Эта картина и есть причина патологических изменений, которые есть на рентгеновском снимке.
Выявление таких васкулярных зон или участков, лишенных легочного рисунка, или самих стенок воздушных полостей, которые иногда мы можем увидеть у таких пациентов, помогает нам правильно оценить характер патологических изменений.
Но когда мы видим такую картину, когда практически все правое легкое замещено огромными воздушными полостями, сохранившаяся легочная ткань смещена в сторону средостения, а большую часть правого легкого и всю верхнюю долю левого легкого занимают огромные воздушные полости, в этом случае заключение рентгенолога о наличии эмфиземы является корректным, строгим и совершенно объективным.
16:27
К чему нужно относиться критически. Когда мы не видим подобного рода прямых признаков эмфиземы, то говорить о наличии эмфиземы только на основании деформации легочного рисунка или каких-то аскеологических особенностей легочного рисунка (особенно при флюорографических исследованиях) – это элемент гипердиагностики или рентгенологического штампа. Его вряд ли разумно использовать в протоколах, в описаниях рентгенологических исследований.
Типы эмфиземы, которые мы можем увидеть при КТ – центриацинарная, панацинарная и дистально ацинарная эмфизема.
(Демонстрация слайда).
Так они выглядят при КТ. В чем преимущество этой технологии. В том, что мы можем найти прямые морфологические признаки этого состояния в тех ситуациях, когда это практически невозможно при обычном рентгенологическом исследовании.
Особенно это касается небольших центрилобулярных или центриацинарных изменений, когда в легочной ткани формируются небольшие воздухосодержащие полости, граничащие с легочной тканью.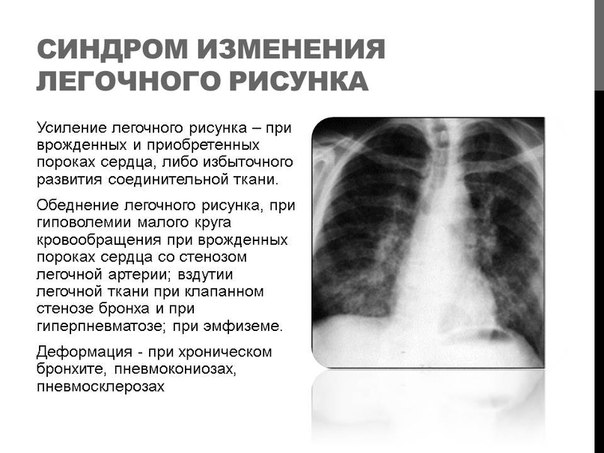 Их можно увидеть только при КТ, если речь идет о прижизненном исследовании легких. В сравнении с морфологическими исследованиями (неразборчиво, 17:42) здесь очень велика.
Их можно увидеть только при КТ, если речь идет о прижизненном исследовании легких. В сравнении с морфологическими исследованиями (неразборчиво, 17:42) здесь очень велика.
Центрилобулярная эмфизема – это обычное патологическое состояние, которое возникает у значительной части людей, злоупотребляющих курением, у большинства пациентов, страдающих хронической обструктивной болезнью легких, которую мы наблюдаем практически у всех пациентов в 3-ей и 4-ой стадии этого заболевания.
Оно характеризуется преобладанием изменений в верхних долях легких, иногда в 6-х бронхолегочных сегментах, и формированием в легочной ткани относительно небольших воздушных полостей, стенками которой может являться либо сама легочная ткань, либо междольковые перегородки.
Эта преимущественная локализация в верхних долях легкого без выраженной субплевральной локализации, является типичной картиной для такого рода пациентов. Она уверенно выявляется при КТ. Хотя совершенно неочевидна при обычных рентгеновских исследованиях.
18:43
Панлобулярная эмфизема – гораздо более редкое состояние. Оно характеризуется диффузным расширением ацинусов и слиянием внутридольковых структур в единое воздушное пространство. Это состояние нередко может наблюдаться при диффузных формах эмфиземы, при дефиците ?-антитрипсина.
Врожденная патология, особенно, если речь идет о молодых людях. Особенно в тех случаях, когда у этих молодых людей нет очевидной клинической симптоматики для обструктивной болезни легких, и нет причин для ее развития.
В этом случае выполнение томографического исследования и обнаружение подобной компьютерно-томографической картины, когда мы видим преобладание этих изменений (повышение воздушности, разрушение легочной ткани, формирование внутрилегочных полостей преимущественно в нижних отделах легких), наводит на мысль о возможном характере эмфиземы у этих пациентов и заставляет выполнить необходимый объем дополнительных исследований.
Самое знакомое патологическое состояние – это парасептальная или буллезная эмфизема. Воздушные полости локализуются вдоль висцеральной плевры, особенно вдоль медиастинальной плевры, реберной плевры. Этот вид эмфиземы является и нередко служит причиной для формирования спонтанного пневмоторакса. Именно в этом клиническое значение такого типа эмфиземы.
Воздушные полости локализуются вдоль висцеральной плевры, особенно вдоль медиастинальной плевры, реберной плевры. Этот вид эмфиземы является и нередко служит причиной для формирования спонтанного пневмоторакса. Именно в этом клиническое значение такого типа эмфиземы.
Для пациентов со спонтанным пневмотораксом выполнение КТ после расправления легочной ткани является принципиально важным, чтобы можно было определить дальнейшую тактику, ход лечения пациента.
Буллезная эмфизема – состояние, которое можно практически всегда увидеть при обычном рентгеновском исследовании. Оно характеризуется очевидными изменениями при КТ. Здесь компьютерно-томографические исследования выполняются не столько для диагностики этого состояния, а в большинстве случаев тем пациентам, которым планируется выполнение операции по уменьшению объема легких, чтобы оценить точную локализацию булл и возможный вид хирургического вмешательства для пациента.
21:00
Такие буллы могут приводить к сдавлению, компрессии легочной ткани.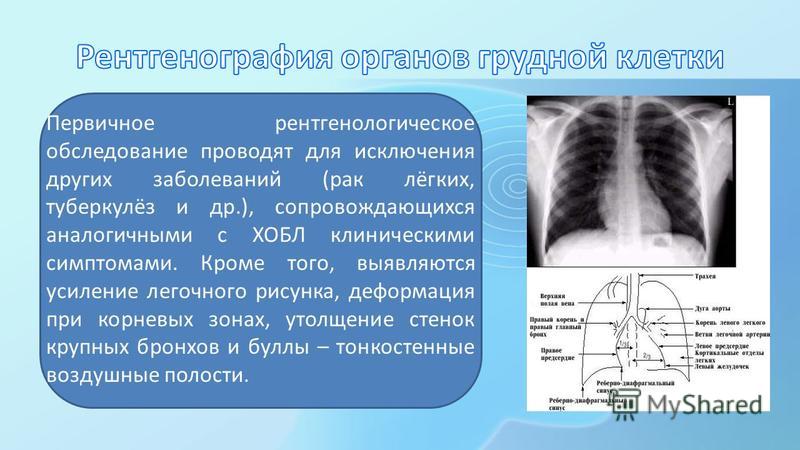 Это хорошо видно по состоянию нижней доли правого легкого у этого пациента. Как следствие, удаление хирургической резекции этих булл приводит к расправлению легочной ткани. Во многих случаях улучшает качество жизни такого пациента.
Это хорошо видно по состоянию нижней доли правого легкого у этого пациента. Как следствие, удаление хирургической резекции этих булл приводит к расправлению легочной ткани. Во многих случаях улучшает качество жизни такого пациента.
КТ, в отличие от обычного рентгеновского исследования, которое направлено в большей степени на выявление функциональных изменений, признаков бронхиальной обструкции, является очень точным, достоверным инструментом определения фенотипов хронической обструктивной болезни легких и вообще изменений в легочной ткани, которые возникают у больных с любым обструктивным заболеванием легких.
Клиническая картина у этих пациентов может существенно различаться. Морфологические изменения в легочной ткани у них тоже могут быть совершенно разными. В зависимости от того, преобладают ли у этого пациента изменения в бронхиальном дереве (в средних, в мелких бронхах) или в легочной ткани в виде развития эмфиземы и различных видов воздушных полостей этой локализации.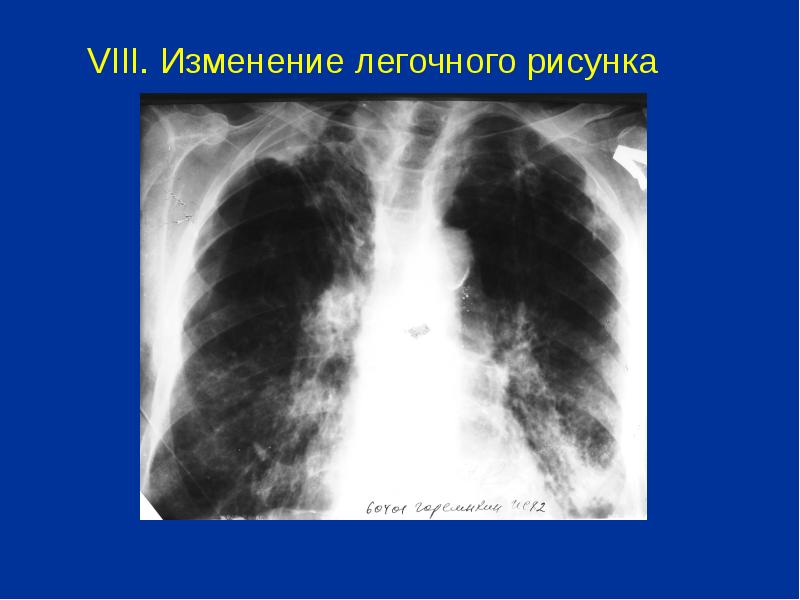
Решение анатомических вопросов, разграничение типов обструктивной болезни легких, КТ имеют принципиально важное значение в дифференциальной диагностике.
В качестве заключения, краткого обзора того, что мы видим на рентгеновских снимках, на КТ у больных с бронхиальной обструкцией, еще раз повторю. У большинства больных наличие эмфиземы и бронхиальной обструкции можно уверенно предположить по данным обычной обзорной рентгенографии.
На сегодняшний день это является первоначальной методикой, исследованием, предназначенным для таких пациентов.
Для чего нужна высокоразрешающая КТ. Имеется ли в виду обычное пошаговое исследование или многосрезовая КТ. Она позволяет выявить эмфизему, уточнить характер изменения в легочной ткани, тип эмфиземы, дать ей количественную характеристику.
К этому добавим, что многослойная КТ сегодня – это очень точный мощный инструмент для оценки вообще бронхиального дерева. Не только у этой категории пациентов, но и у пациентов с другими патологическими процессами в легочной ткани (бронхоэктазы, бронхиолиты).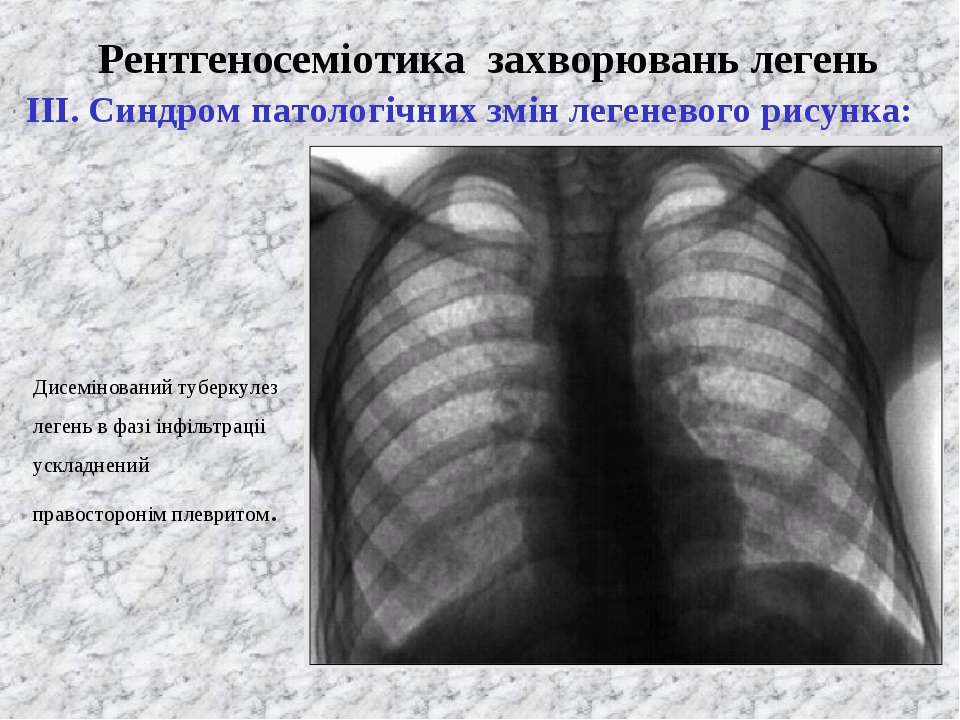
Об этом Ирина Александровна будет в подробностях говорить. На этом я закончу.
Флюорография в Выборгском районе
Согласно неутешительной статистике, в нашей стране каждый час от туберкулеза умирает один человек. Эти тревожные данные в очередной раз доказывают необходимость проведения плановой флюорографии. ФЛГ способно определить это заболевание еще на стадии бессимптомного протекания болезни, а значит предотвратить осложнения и сделать лечение наиболее эффективным.
Флюорографический метод исследования обнаруживает не только такие грозные заболевания, как туберкулез и рак, но и наличие самых разных отклонений, что позволяет быстро поставить диагноз и назначить лечение.
Возможные отклонения от нормы на флюорографическом снимке
Фиброз. По сути, это реакция организма на некоторые воспалительные процессы. Заболевание характеризуется тем, что соединительные ткани начинают разрастаться, «стремясь» отделить здоровые ткани от очага воспаления.
 Процесс приводит к уплотнению тканей и их рубцеванию. Чаще всего встречается фиброз легких, печени и молочной железы. Основными симптомами являются одышка, боль в сердце, потеря веса, поверхностное дыхание и другие.
Процесс приводит к уплотнению тканей и их рубцеванию. Чаще всего встречается фиброз легких, печени и молочной железы. Основными симптомами являются одышка, боль в сердце, потеря веса, поверхностное дыхание и другие.Уплотнение или расширение корней легких. Корни легких — это комплекс, соединяющий легкие с другими органами. Сюда относятся легочная вена, главный бронх, легочная и бронхиальные артерии. Недуг свидетельствует о таких серьезных хронических отклонениях в легких, как пневмония, хроническая стадия бронхита и др.
Усиление легочного рисунка. Сосуды в легких образуют определенный «рисунок». Если происходит его усиление, это свидетельствует о возможном заболевании сердца, сердечной недостаточности. Чаще проявляется после перенесенных осложнений гриппа и простуды и свидетельствует о бронхите или пневмонии.
Кальциноз аорты. На стенках аорты накапливаются нерастворимые соли, образуя плотные бляшки. В первую очередь, это опасно закупоркой сосудов.
 Более того, бляшки приводят к «ломкости» сосудов. Причиной отклонения становится избыток кальция.
Более того, бляшки приводят к «ломкости» сосудов. Причиной отклонения становится избыток кальция.
Кроме этого, флюорография может определить наличие кист, костные изменения, спайки и еще ряд заболеваний или отклонений органов грудной клетки.
Важность флюорографии трудно переоценить. Это быстрый, точный и безопасный метод исследования. Рекомендованный период между ФЛГ составляет один год, однако людям, состоящим в зоне риска или находящимся на лечение ФЛГ может назначаться значительно чаще.
Где можно сделать флюорографию в Выборгском районе?
Быстро, без длительного ожидания результатов, вы можете сделать флюорографию в Выборгском в районе, обратившись в филиал сети «Медкомиссия №1». ФЛГ по нашему направлению проводится в шаговой доступности, без очередей и занимает буквально несколько минут. Для проведения исследования достаточно только паспорта.
Важно: ФЛГ-диагностика по направлению из центра «Медкомиссия №1» доступна также и жителям других районов города.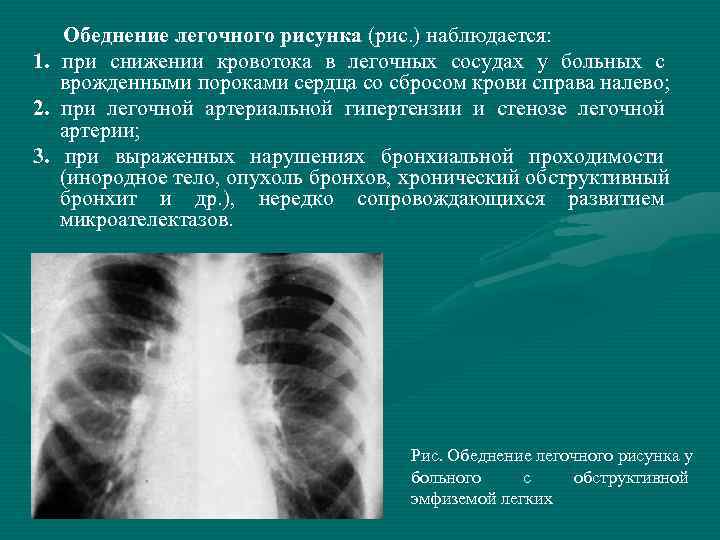
Выборгский филиал открыт по адресу:
Санкт-Петербург, пр. Просвещения, д. 50.
Часы работы: ПН-ПТ: с 9 до 19 СБ-ВС: с 10 до 18, перерыв с 14 до 14:30.
Телефон +7 (812) 380-82-54
Подробнее о клинике в Выборгском в районе >>>
Ждем вас!
Что показывает рентген грудной клетки у взрослого
Рентгенография как метод диагностики широко известна и является базовым обследованием ряда заболеваний. В этой статье вы найдете информацию о том, что показывает рентген грудной клетки у взрослого. А также ответы на частые вопросы об этом обследовании. Итак, рентген органов грудной клетки показывает патологии легких, бронхов, сердца, перелом ребер, повреждения позвоночника в грудном отделе. Врач назначает обследование грудной клетки при подозрении на следующие заболевания: туберкулез, пневмония, бронхит, онкология дыхательных путей, порок сердца, заболевание сердечной мышцы.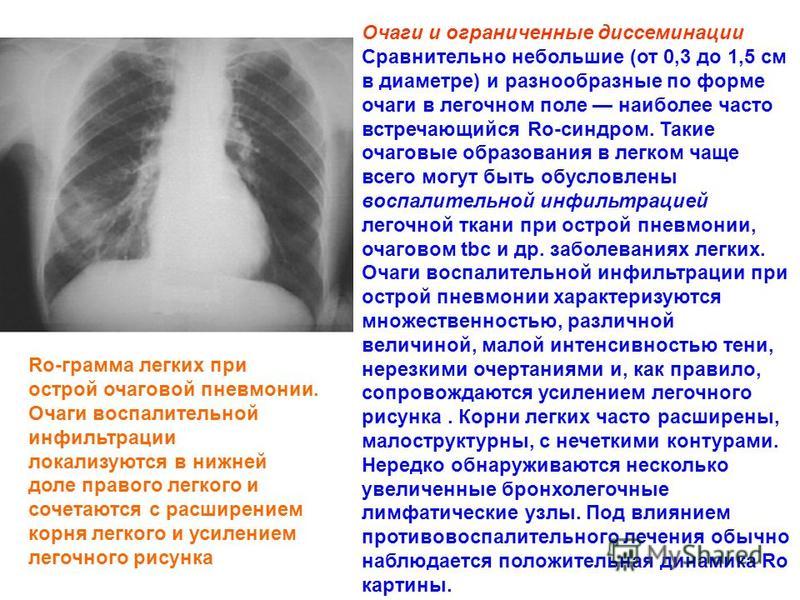 А также диагностика эффективна при оценке травматических повреждений грудной клетки.
А также диагностика эффективна при оценке травматических повреждений грудной клетки.
Если вас беспокоит какая-то проблема со здоровьем, запишитесь на диагностику. Успех лечения зависит от правильно поставленного диагноза.
Что можно увидеть на рентгене ОГК?
В обзор снимка попадают органы дыхания (легкие, трахеи, бронхи), диафрагма, мышцы, лимфоузлы, сердце и кости (ребра, позвоночный столб, лопатки, ключица, грудина). Обследование делается по назначению врача и поэтому рентгенолог усиливает внимание на ту область, в которой необходимо подтверждение или опровержение предполагаемого диагноза.
Процедура может быть проведена двумя способами. Динамическая оценка состояния органов дыхания называется рентгеноскопия. Проведение подразумевает смену положения больного (прямая и боковая проекция) и фиксирование данных во время дыхания. Статический режим – это обычная рентгенография, означает что снимок должен быть выполнен во время задержки дыхания и полной неподвижности. Как делают рентген грудной клетки представляют себе все, кто проходил процедуру флюорографии. Манипуляции идентичны. Пациент заходит в комнату где установлено оборудование, раздевается по пояс, снимает все украшения. Лаборант помогает надеть специальный фартук для защиты репродуктивных органов. Далее пациента ставят к экрану в необходимом положении. Как только аппаратура будет настроена, рентгенолог просит больного глубоко вдохнуть и задержать дыхание на время фиксирования изображения. Если необходимо исследование в двух проекциях, больного поворачивают к экрану боком и просят завести руку за голову. Многим непонятно что показывает при онкологии рентгенография? Или что видно на рентгене при бронхите? Как можно на черно-белом изображении различить что означают затемнения. Опытные врачи умеют дифференцировать патологии. Значение имеет участок, где обнаружен очаг, уплотнение ткани, усиление лёгочного рисунка. Часто при кашле, одышке, температуре и хрипах в лёгких, рентгенографию назначают, чтобы определить пневмонию у больного или бронхит.
Как делают рентген грудной клетки представляют себе все, кто проходил процедуру флюорографии. Манипуляции идентичны. Пациент заходит в комнату где установлено оборудование, раздевается по пояс, снимает все украшения. Лаборант помогает надеть специальный фартук для защиты репродуктивных органов. Далее пациента ставят к экрану в необходимом положении. Как только аппаратура будет настроена, рентгенолог просит больного глубоко вдохнуть и задержать дыхание на время фиксирования изображения. Если необходимо исследование в двух проекциях, больного поворачивают к экрану боком и просят завести руку за голову. Многим непонятно что показывает при онкологии рентгенография? Или что видно на рентгене при бронхите? Как можно на черно-белом изображении различить что означают затемнения. Опытные врачи умеют дифференцировать патологии. Значение имеет участок, где обнаружен очаг, уплотнение ткани, усиление лёгочного рисунка. Часто при кашле, одышке, температуре и хрипах в лёгких, рентгенографию назначают, чтобы определить пневмонию у больного или бронхит. При онкологии в описании снимка будет указана точная локализация опухоли, размер, объем и контуры образования. Иногда для уточнения каких-либо показателей врач может назначить компьютерную томографию или МРТ.
При онкологии в описании снимка будет указана точная локализация опухоли, размер, объем и контуры образования. Иногда для уточнения каких-либо показателей врач может назначить компьютерную томографию или МРТ.
К любому обследованию необходима подготовка, особенно часто пациенты уточняют можно ли есть перед рентгеном грудной клетки? К этой процедуре подготовка не нужна и прием пищи никак не влияет на результат диагностики. Противопоказанием к исследованию является беременность, возраст до 16 лет. При этом противопоказания считаются условными и в экстренном случае допустимы. Рентген грудной клетки при грудном вскармливании разрешен и проводится при необходимости. Так как данную диагностику часто сравнивают с флюорографией, то возникают вопросы о сроке действия снимка и о том, как часто можно делать рентген грудной клетки. Проводить исследование можно столько раз сколько будет необходимо по мнению лечащего доктора. Возможно даже несколько раз в месяц. Доза облучения менее вредна для организма чем не поставленный своевременно диагноз.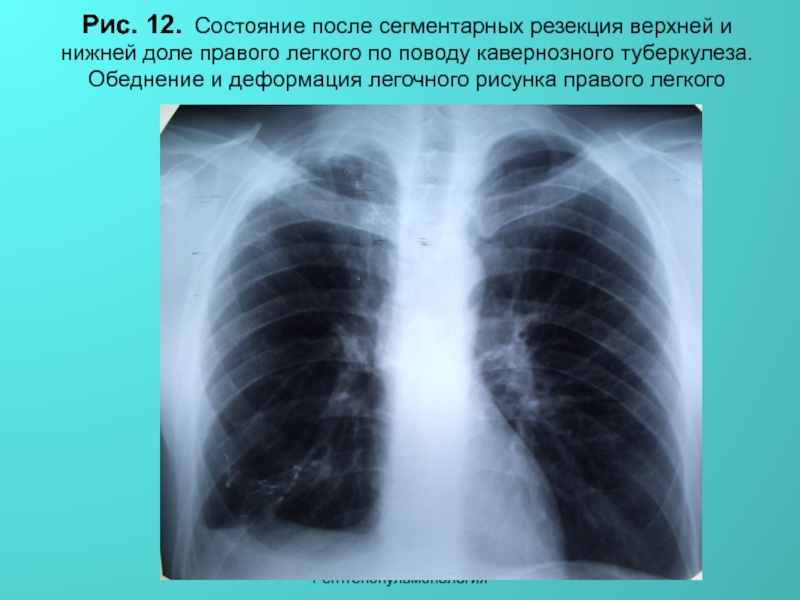
Сколько действителен рентген грудной клетки? Если речь о профилактическом снимке, то достаточно делать обзорный снимок один раз в год. В случае жалоб пациента, направить на диагностику может любой доктор, заподозривший корень болезни в области грудной клетки. Например, терапевт, онколог, кардиолог, хирург, травматолог или пульмонолог.
Данная статья размещена исключительно в познавательных целях, не заменяет приема у врача и не может быть использована для самодиагностики.
10 января 2019
Интерстициальная болезнь легких с высоким уровнем анти-Jo-1 антител у больной полимиозитом | Бондаренко И.Б., Корнев Б.М., Насонов Е.Л.
ММА имени И.М. Сеченова
Поражения органов дыхания при диффузных заболеваниях соединительной ткани, в частности с преимущественным поражением скелетной мускулатуры (дерматомиозите -ДМ и полимиозите – ПМ), встречаются нередко – в 45-50% случаев [1,2]. Развивающиеся при этом изменения со стороны органов дыхания весьма разнообразны: слабость дыхательных мышц и диафрагмы может приводить к вялости дыхательных экскурсий, нарушению мукоцилиарного клиренса, гиповентиляции, дыхательной недостаточности.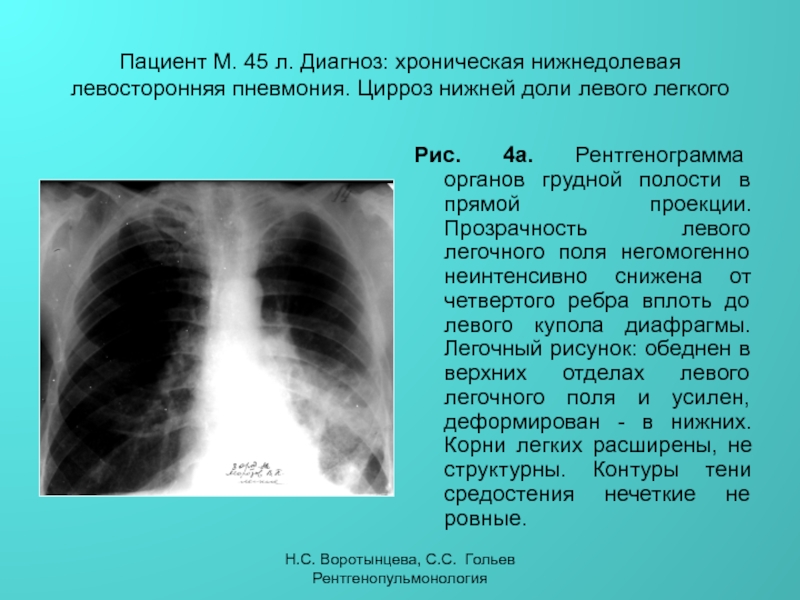 Нарушение глотания вследствие слабости мышц глотки способствует развитию аспирационных пневмоний и т.д. В последние годы описывается поражение легочного интерстиция, протекающего чаще всего по типу фиброзирующего альвеолита. Большинство авторов включают подобные формы в так называемую интерстициальную болезнь легких (ИБЛ), куда входят около 130 заболеваний известной и неизвестной природы [3]. Данные о частоте ИБЛ при ПМ/ДМ колеблются от 9 до 63%, причем некоторые авторы и эту цифру считают “заниженной” [4]. Начиная с 1984 г. появляются отдельные сообщения о том, что у больных, страдающих миозитом и ИБЛ, формируется своеобразный клинико-иммунологический синдром, получивший название антисинтетазного синдрома [4]. Для последнего характерны сочетания миозита с ИБЛ, артритом, нередко с синдромом Рейно, наличие высокого титра антисинтетазных антител в сыворотке крови. Трудности диагностики подобного состояния связаны с тем, что поражения легких иногда опережают клинику ПМ/ДМ, или при развернутой картине ПМ прогрессирующая одышка расценивается только как проявление миозита, поражение суставов и синдром Рейно присоединяются позже.
Нарушение глотания вследствие слабости мышц глотки способствует развитию аспирационных пневмоний и т.д. В последние годы описывается поражение легочного интерстиция, протекающего чаще всего по типу фиброзирующего альвеолита. Большинство авторов включают подобные формы в так называемую интерстициальную болезнь легких (ИБЛ), куда входят около 130 заболеваний известной и неизвестной природы [3]. Данные о частоте ИБЛ при ПМ/ДМ колеблются от 9 до 63%, причем некоторые авторы и эту цифру считают “заниженной” [4]. Начиная с 1984 г. появляются отдельные сообщения о том, что у больных, страдающих миозитом и ИБЛ, формируется своеобразный клинико-иммунологический синдром, получивший название антисинтетазного синдрома [4]. Для последнего характерны сочетания миозита с ИБЛ, артритом, нередко с синдромом Рейно, наличие высокого титра антисинтетазных антител в сыворотке крови. Трудности диагностики подобного состояния связаны с тем, что поражения легких иногда опережают клинику ПМ/ДМ, или при развернутой картине ПМ прогрессирующая одышка расценивается только как проявление миозита, поражение суставов и синдром Рейно присоединяются позже. Вместе с тем своевременная диагностика и правильное лечение ИБЛ в этих случаях определяют прогноз болезни.
Вместе с тем своевременная диагностика и правильное лечение ИБЛ в этих случаях определяют прогноз болезни.
Больная X., 51 г., инвалид II группы, поступила с жалобами на выраженную одышку при минимальной физической нагрузке и в покое, небольшой сухой кашель по утрам и в течение дня, средней степени выраженности слабость проксимальных мышц тазового пояса (с трудом встает со стула, поднимается по ступеням), умеренную слабость проксимальных мышц плечевого пояса, поперхивание при еде, нарушение осанки, боли в суставах и в левой половине грудной клетки.
Из анамнеза известно, что больна с лета 1992 г., когда после нервного стресса появились средней степени слабость проксимальных мышц тазового пояса, умеренная дисфагия. Обследована в центре по изучению миастении, где определены нормальные цифры креатинфосфокиназы (КФК) и миопатическая, полифазная электромиограмма; получала витаминотерапию. Через 1,5 мес мышечная слабость исчезла. Через год, после повторного стресса возобновились прежние жалобы, тяжесть поражения мышц прогрессировала, и в ноябре 1993 г. больная была уже обездвижена. При обследовании обнаружены повышенные цифры КФК, при биопсии мышц левой голени – некроз мышечных волокон и их лимфогистиоцитарная инфильтрация. Диагностирован ПМ и начато лечение преднизолоном 70 мг/сут с хорошим эффектом, уже в течение 1-й недели уменьшилась мышечная слабость. При медленном снижении дозы преднизолона через 2 мес до – 15 мг/сут наступило обострение ПМ, дозировка была увеличена до 60 мг/сут. С начала февраля 1994 г. появилась одышка при ходьбе, медленном подъеме по лестнице, а через месяц – при разговоре и иногда в покое. Число дыханий (ЧД) 22 в 1 мин, число сердечных сокращений (ЧСС) 105 в 1 мин в покое. Обращали на себя внимание ригидность грудной клетки при сжатии, высокое стояние диафрагмы (слева на уровне 4, справа – 5 ребра), уменьшение экскурсии диафрагмы до 2 см. Над легкими определялось равномерное притупление перкуторного тона над средними и нижними легочными полями. Выслушивалось ослабленное везикулярное дыхание (укорочение фазы вдоха и выдоха).
больная была уже обездвижена. При обследовании обнаружены повышенные цифры КФК, при биопсии мышц левой голени – некроз мышечных волокон и их лимфогистиоцитарная инфильтрация. Диагностирован ПМ и начато лечение преднизолоном 70 мг/сут с хорошим эффектом, уже в течение 1-й недели уменьшилась мышечная слабость. При медленном снижении дозы преднизолона через 2 мес до – 15 мг/сут наступило обострение ПМ, дозировка была увеличена до 60 мг/сут. С начала февраля 1994 г. появилась одышка при ходьбе, медленном подъеме по лестнице, а через месяц – при разговоре и иногда в покое. Число дыханий (ЧД) 22 в 1 мин, число сердечных сокращений (ЧСС) 105 в 1 мин в покое. Обращали на себя внимание ригидность грудной клетки при сжатии, высокое стояние диафрагмы (слева на уровне 4, справа – 5 ребра), уменьшение экскурсии диафрагмы до 2 см. Над легкими определялось равномерное притупление перкуторного тона над средними и нижними легочными полями. Выслушивалось ослабленное везикулярное дыхание (укорочение фазы вдоха и выдоха).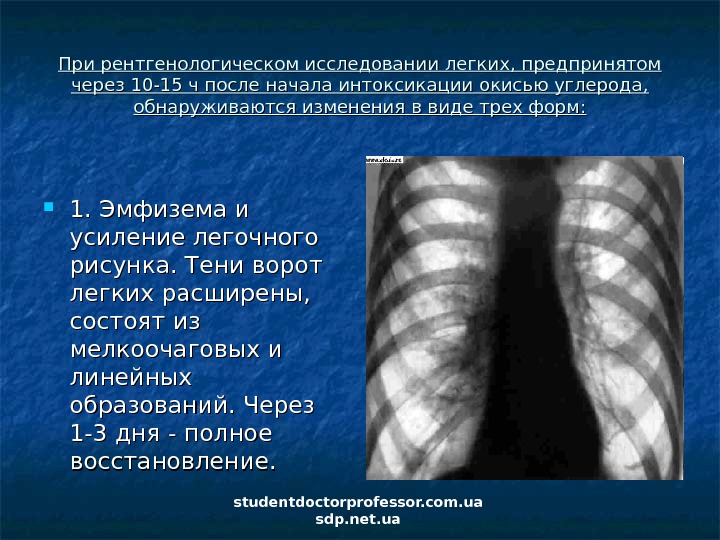 С обеих сторон по задней и среднеподмышечной линиям в нижних отделах и между лопатками выслушивалась нежная крепитация (“fine crackles”). При рентгенографии органов грудной клетки: очаговые и инфильтративные изменения не определялись, легочный рисунок усилен по смешанному типу в базальных отделах, местами отмечена ячеистая деформация, в средних отделах – сетчатая деформация легочного рисунка. Корни легких расширены, структурны, над диафрагмой видны линейные тени (дисковидные ателектазы). Купол диафрагмы с обеих сторон расположен высоко, на уровне третьего ребра, правый купол деформирован плевродиафрагмальными спайками. Сердце погружено в диафрагму, слегка расширено в поперечнике.
С обеих сторон по задней и среднеподмышечной линиям в нижних отделах и между лопатками выслушивалась нежная крепитация (“fine crackles”). При рентгенографии органов грудной клетки: очаговые и инфильтративные изменения не определялись, легочный рисунок усилен по смешанному типу в базальных отделах, местами отмечена ячеистая деформация, в средних отделах – сетчатая деформация легочного рисунка. Корни легких расширены, структурны, над диафрагмой видны линейные тени (дисковидные ателектазы). Купол диафрагмы с обеих сторон расположен высоко, на уровне третьего ребра, правый купол деформирован плевродиафрагмальными спайками. Сердце погружено в диафрагму, слегка расширено в поперечнике.
При ретроспективной оценке рентгенограмм больной 1993 г. (архивные данные) сделано заключение об уменьшении объема легочных полей и понижении прозрачности легких по типу “матового стекла”, а также о наличии нежной сетчатой деформации легочного рисунка в нижних и средних отделах.
При исследовании функции внешнего дыхания обнаружены резкие нарушения вентиляции легких по рестриктивному типу: ЖЕЛ – 43%, OOB1 – 40%, тест Тиффно – 80% – имеет тенденцию к “искусственному увеличению” за счет резкого снижения ЖЕЛ, вследствие чего форсированный выдох заканчивается быстрее, чем за 1 с. МОС25 снижена незначительно, МОС50 и МОС75 снижены значительно. Проба с бронхолитиками отрицательная. Диффузионная способность легких резко снижена, определяется выраженная гипоксемия (Р02 – 55,6 мм рт. ст., N – до 80 мм рт. ст.), насыщение О2 – 89% (снижена).
МОС25 снижена незначительно, МОС50 и МОС75 снижены значительно. Проба с бронхолитиками отрицательная. Диффузионная способность легких резко снижена, определяется выраженная гипоксемия (Р02 – 55,6 мм рт. ст., N – до 80 мм рт. ст.), насыщение О2 – 89% (снижена).
Полученные изменения были расценены как характерные для симптомокомплекса фиброзирующего альвеолита у больной с ПМ, что и было подтверждено консультацией в НИИ пульмонологии Минздрава РФ (г. Москва), рекомендовано продолжение терапии глюкокортикостероидами (ГКС) и назначение цитостатиков. В дальнейшем больная получала ГКС, что позволило стабилизировать течение полимиозита, с 1997 г. отмечено прогрессирование ИБЛ, в 1999 г. к лечению был добавлен хлорамбуцил в дозе 5 мг/сут.
При поступлении (1999 г.) – состояние средней тяжести, выраженная “утиная походка”, из-за чего при ходьбе пользуется палкой для устойчивости. Умеренный акроцианоз лица, губ, кончиков пальцев. Изменение концевых фаланг пальцев верхних и нижних конечностей по типу “пальцев Гиппократа”. Увеличена масса тела, плотные отеки голеней. Снижена мышечная сила в мышцах тазового пояса. Периферические лимфатические узлы не увеличены. Суставы не изменены, движения в крупных суставах верхних и нижних конечностей болезненны, объем движений несколько ограничен. Частота сердечных сокращений в покое 96 в 1 мин. АД – 130/90 мм рт. ст., ЧД – 22-24 в 1 мин. Грудная клетка ригидная при пальпации. Перкуторный звук над легкими равномерно притуплен. Границы легочных краев справа и слева на уровне III ребра. Подвижность легочных краев – 1 см. Выслушивается ослабленное везикулярное дыхание, над средними и нижними отделами – крепитация по типу “треска целлофана”. Увеличена граница сердца влево на 1,5 см кнаружи от левой среднеключичной линии. Определяется акцент II тона над легочной артерией. Живот мягкий, безболезненный. Размеры печени по Курлову 9х11х12 см.
Изменение концевых фаланг пальцев верхних и нижних конечностей по типу “пальцев Гиппократа”. Увеличена масса тела, плотные отеки голеней. Снижена мышечная сила в мышцах тазового пояса. Периферические лимфатические узлы не увеличены. Суставы не изменены, движения в крупных суставах верхних и нижних конечностей болезненны, объем движений несколько ограничен. Частота сердечных сокращений в покое 96 в 1 мин. АД – 130/90 мм рт. ст., ЧД – 22-24 в 1 мин. Грудная клетка ригидная при пальпации. Перкуторный звук над легкими равномерно притуплен. Границы легочных краев справа и слева на уровне III ребра. Подвижность легочных краев – 1 см. Выслушивается ослабленное везикулярное дыхание, над средними и нижними отделами – крепитация по типу “треска целлофана”. Увеличена граница сердца влево на 1,5 см кнаружи от левой среднеключичной линии. Определяется акцент II тона над легочной артерией. Живот мягкий, безболезненный. Размеры печени по Курлову 9х11х12 см.
В клинических анализах крови в динамике: Нb 120–140 г/л, эр. 4,0–5,0х1012/л, рц. 2–10%, тр. 180–320х103, л. 4–9х109/л, п. 1–6%, с. 47–72%, э. 0,5–5%, мон. 3–11%, СОЭ 2–10 мм/ч.
4,0–5,0х1012/л, рц. 2–10%, тр. 180–320х103, л. 4–9х109/л, п. 1–6%, с. 47–72%, э. 0,5–5%, мон. 3–11%, СОЭ 2–10 мм/ч.
Биохимический анализ крови: глюкоза – 4,1 ммоль/л, билирубин общий – 6,7 мкмоль/л, прям.–0, непрям. – 6,7 мкмоль/л, AсАT – 21 ммоль/л, АлАТ – 15 ммоль/л, креатинин – 39 ммоль/л, фибриноген – 2,22 г/л, Са общ. – 2,16 ммоль/л, холестерин – 5,7 ммоль/л, КФК – 89 Ед/л, щелочная фосфатаза – 47 Ед/л, общий белок 60 г/л.
Белковые фракции: альб. – 52,98%, a1 – 6,06%, a2 – 12,25%, b – 13,77%, g – 14,94%.
Иммунологический анализ крови: СРБ – слабоположительный, РФ – отр., антитела к ДНК – 42 Ед (N -до 30 ед), ЦИК 45 Ед (N – 54–151 Ед, 52–146%), АНФ – отр., IgG –10,8 мг/мл, IgА – 1,14 мг/мл, IgМ – 1,4 мг/мл, криопрец. – отр.
Общий анализ мочи – без изменений.
ЭКГ – синусовая тахикардия, ЧСС 98 в 1 мин, отклонение эл. оси вправо, ротация сердца вокруг продольной оси правым желудочком вперед, нарушение внутрижелудочковой проводимости в системе правой ножки пучка Гиса, выраженные изменения миокарда желудочков (наиболее вероятно связанные с метаболическими нарушениями).
При ультразвуковом исследовании органов брюшной полости определяется стеатоз печени, в правой почке конкремент 5 мм.
ЭХОКГ: умеренно выраженная динамическая дисфункция левого желудочка.Правые отделы нерезко расширены, толщина миокарда правого желудочка – на верхней границе нормы, показатели сократительной способности снижены. Расчетное среднее давление в легочной артерии 32-34 мм рт. ст. (легочная гипертензия II степени).
Рентгенологическое исследование: на рентгенограммах органов грудной клетки определяется высокое стояние диафрагмы – купол диафрагмы с обеих сторон расположен на уровне II межреберья, слегка уплощен, деформирован плевродиафрагмальными спайками. Распространенные изменения в легких, в виде тяжистой деформации легочного рисунка в средних и нижних отделах, ячеистой деформации легочного рисунка в прикорневых и базальных отделах, больше слева. Справа под диафрагмой определяются дисковидные ателектазы. Корни легких широкие, нечеткие. Сердце погружено в диафрагму, правая сторона нечеткая, аорта уплотнена, развернута. Заключение: рентгенологическая картина легких характерна для ИБЛ по типу фиброзирующего альвеолита, стадия “сотового легкого”. По сравнению с исследованиями 1994-1996 гг. – отрицательная динамика.
Сердце погружено в диафрагму, правая сторона нечеткая, аорта уплотнена, развернута. Заключение: рентгенологическая картина легких характерна для ИБЛ по типу фиброзирующего альвеолита, стадия “сотового легкого”. По сравнению с исследованиями 1994-1996 гг. – отрицательная динамика.
Для уточнения характера и активности альвеолита произведена фибробронхоскопия и исследование бронхоальвеолярного лаважа (БАЛ). При фибробронхоскопии определяется нормальная слизистая трахеи и главных бронхов, нерезко выраженный катаральный эндобронхит в области сегментарных бронхов нижней доли слева. Цитологическое исследование БАЛ – цитоз 0,09х106, макрофаги 70,2%, лимфоциты 22,6%, нейтрофильные лейкоциты 7,2%. В мазке преобладают макрофаги с базофильной цитоплазмой, единичные из них – двуядерные, лимфоциты малые и средние, много разрушающегося эпителия. Заключение: в эндопульмональной цитограмме умеренно повышено содержание лимфоцитов и нейтрофилов. Выявленные цитологические изменения могут быть расценены как проявление лимфоцитарного альвеолита; результат возможной гиперплазии эпителия с усилением миграции лимфоцитов в бронхоальвеолярное пространство.
При исследовании функции внешнего дыхания сохраняются резкие изменения вентиляции по рестриктивному типу: ЖЕЛ 42%, снижена общая емкость легких (ОЕЛ 74%Д), остаточный объем легких не изменен. DLCO 43%, рН крови 7,4, Р02 52 мм рт. ст., рС02 43 мм рт. ст., О2 Sat 88% (резко снижена).
У больной обнаружен высокий титр анти-Jo-1 антител (антител к гистидил-тРНК-синтетазе) – 30 UE/ml (резко повышены).
На основании приведенных данных сформулирован диагноз: Полимиозит хронического течения, слабость проксимальных мышц тазового пояса. Ожирение II степени.
Стероидный диабет. Интерстициальная болезнь легких по типу фиброзирующего альвеолита, стадия “сотового легкого”, прогрессирующее течение. Резкие рестриктивные нарушения функции внешнего дыхания. Легочная гипертензия II. Дыхательная недостаточность III. Декомпенсированное легочное сердце. Недостаточность кровообращения II.
Лечение: глюкокортикоиды (ГКС) (преднизолон) 20 мг/сут и хлорамбуцил 5 мг/сут в течение 4 мес под контролем уровня лейкоцитов, тромбоцитов, эритроцитов; спиронолактон 3 таблетки в сутки, верапамил 40 мг х 3 раза в сутки, гликлазид 3 таблетки в сутки, колекальциферол 1 таблетка в сутки, инозин 1 таблетка х 3 раза в сутки. В стационаре – длительная кислородотерапия (5-6 ч в сутки). В результате проведенной терапии состояние больной стабилизировалось.
В стационаре – длительная кислородотерапия (5-6 ч в сутки). В результате проведенной терапии состояние больной стабилизировалось.
Обсуждение
Особенностью наблюдения является медленно прогрессирующая (по скорости течения) ИБЛ у больной с ПМ в первые 3 года болезни, в течение которых пациентка получала курсы ГКС. Рентгенологические изменения (1993 г.) несколько опережали типичную клинику фиброзирующего альвеолита (1994 г.). Однако в дальнейшем, в период с 1996 по 1999 г., течение ИБЛ отличалось проградиентностью (морфологически – интерстициальное и внутриальвеолярное аутоиммунное воспаление с исходом в интерстициальный фиброз) и развитием дыхательной недостаточности III. Именно к 1999 г. (7-й год болезни) поражения органов дыхания стали определять преимущественную тяжесть заболевания, так как течение миозита удалось стабилизировать ранее. Выявление высокого титра анти-Jo-1 антител, определяемых с 1998 г., наряду с артралгиями, клиникой ИБЛ, возникшей у больной с ПМ, позволяют отнести этот случай к “антисинтетазному синдрому”.
В настоящее время сложилось представление о ПМ и ДМ, как о гетерогенной группе диффузных болезней соединительной ткани, приблизительно у 30% пациентов подтверждается аутоиммунная природа заболевания (у них обнаруживаются антитела к ядерным и цитоплазматическим антигенам). В сравнительно немногочисленных работах описывается синдром, при котором имеется сочетание ПМ или ДМ с интерстициальной болезнью легких, артритом (артралгиями), синдромом Рейно и своеобразными иммунологическими изменениями, а именно: наличием антител к аминоацилсинтетазам. Функция последних заключается в катализе процесса связывания отдельных аминокислот с соответствующей транпортной рибонуклеиновой кислотой (тРНК). Наиболее часто (от 28 до 79%) обнаруживаются антитела к гистидил-тРНК синтетазе, которые называются aнти-Jo-1 антителами по имени пациента John P., страдавшего ПМ и фиброзирующим альвеолитом, у которого эти антитела были обнаружены впервые в 1984 г. [2]. Другие антитела к синтетазам (анти-PL–7, анти-РL-12, анти-ОJ, aнти-EJ и т. д.) встречаются значительно реже, однако клиническая симптоматика сходна с клиническими проявлениями заболевания у пациентов с наличием анти-Jo-1 антител, поэтому был предложен указанный выше объединяющий термин “антисинтетазный синдром”.
д.) встречаются значительно реже, однако клиническая симптоматика сходна с клиническими проявлениями заболевания у пациентов с наличием анти-Jo-1 антител, поэтому был предложен указанный выше объединяющий термин “антисинтетазный синдром”.
Для больных, страдающих “антисинтетазным синдромом”, наряду с типичной клиникой миозита характерным является наличие поражения легочной ткани (чаще по типу фиброзирующего альвеолита, реже – организующейся пневмонии, острого дистресс-синдрома, капиллярита с диффузными геморрагиями в альвеолы), артрита, синдрома Рейно, наблюдается сезонность обострении (преимущественно – весной), неполный ответ на проводимую стероидную терапию, обострение миозита и ИБЛ при попытке снизить дозу ГКС, прогредиентность течения, высокая летальность, наличие антисинтетазных антител (чаще – анти-Jo-1 антител).
Следует подчеркнуть, что существует описание ИБЛ, ассоциированной с высоким титром aнти-Jo-1 антител, как первого проявления системного аутоиммунного заболевания [5,6]; поражения мышц, артриты, синдром Рейно присоединяются позже (эти формы ИБЛ плохо поддаются кортикостероидной терапии и дают высокую летальность, связанную с тяжелой дыхательной недостаточностью).
Большинство авторов считают, что сочетанное лечение подобных больных ГКС и цитостатиками (метотрексат, циклоспорин А, азатиоприн, циклофосфамид, хлорамбуцил – в данном случае) позволяет снизить дозы ГКС и избежать осложнений. Такое лечение является абсолютно показанным в период обострения фиброзирующего альвеолита, о чем в большинстве случаев можно судить только на основании исследования БАЛ и определения титра антисинтетазных антител.
В заключение следует подчеркнуть, что своевременная длительная ГКС терапия, а также назначение хлорамбуцила в описанном случае способствовали стабилизации состояния данной пациентки.
Литература:
1. Насонов Е.Л., Самсонов М.Ю., Штутман В.З. Идиопатические воспалительные миопатии//Клин ревматология 1996; 4: 10-3.
2. Dickey В.F., Myers A.R. Pulmonary disease in polymyositis/dermatomyositis // Seminars in arthritis and Rheumatism 1984; 14: 1: 60-76.
3. Чучалин А.Г., Авдеева О.Е., Черняев А.Л., Лебедин Ю.С. Идиопатический фиброзирующий альвеолит//Пульмонология 1999; 1: 10-23.
Чучалин А.Г., Авдеева О.Е., Черняев А.Л., Лебедин Ю.С. Идиопатический фиброзирующий альвеолит//Пульмонология 1999; 1: 10-23.
4. Genth Е., Kaufmann S., Mierau R. Das Anti (Aminoacyl-tRNA-) Synthetase-Syndrom// Akt Rheumatol 1993; 18: 113-9.
5. Santy A., Rochat Th., Schoch 0.D., Hamacher J. Pulmonary fibrosis with predominant CDg lymphocytic alveolitis and anti-Jo-1 antibodies // Eur Respir J – 1997 ; 10 : 2907-12.
6. Targoff J.N., Amett F.С. Clinical manifestation in patients with antibody to PL-12 antigen // Am J Med 1990; 88: 241-51.
.
Легочный рисунок – Большая Энциклопедия Нефти и Газа, статья, страница 1
Легочный рисунок
Cтраница 1
Легочный рисунок может быть неизмененным, усиленным, ослабленным, обедненным, деформированным. При наличии пневмоторакса крупных кистах – отсутствует. [1]
Нормальный легочный рисунок представлен линейными тенями с древовидным типом ветвления. Ширина постепенно убывает от центра к периферии, каждая линейная тень последовательно делится на две меньшей ширины ( дихотомически) и заканчивается У-образным разветвлением на расстоянии 1 5 – 2 см от костальной плевры и 4 см от купола плевры. Контуры их четкие на всем протяжении.
[2]
Ширина постепенно убывает от центра к периферии, каждая линейная тень последовательно делится на две меньшей ширины ( дихотомически) и заканчивается У-образным разветвлением на расстоянии 1 5 – 2 см от костальной плевры и 4 см от купола плевры. Контуры их четкие на всем протяжении.
[2]
Рентгенографически определяется подчеркнутый легочный рисунок, особенно справа внизу. Неврологически – отчетливый горизонтальный нистагм. Из-за непрерывной рвоты произведено внутривенное вливание. Для снятия кашля и болей применен дилаудид-атропин. [3]
При деформации легочного рисунка нарушена дихотоиичность деления сосудистых теней, отмечается их непропорциональное расширение, прерывистость, изломанность линейных теней, петлистость. Контуры сосудов утрачивают четкость. [4]
Позднее наступает усиление легочного рисунка, которое отмечается преимущественно в средних и верхних отделах. [5]
[5]
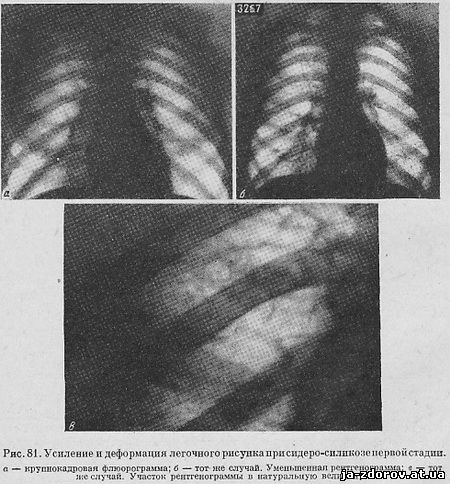
По общему характеру изменений легочного рисунка различают узелковую интерстициальную ( диффузно-склероти-ческую) и смешанную формы силикотического фиброза. По выраженности и обилию этих изменений выделяют так называемые стадии заболевания. [6]
По общему характеру изменений легочного рисунка различают узелковую, интерстициальную ( диффузно-склеротй-ческую) и смешанную формы силикотического фиброза. Принято выделять три стадии заболевания. [7]
Кольцевидные просветления в структуре легочного рисунка обусловлены просветами бронхов в ортоградноК проекции. Они иней вид правильной окружности и располагается рядом с сосудами. Диаметр просвета бронха в ортоградной проекции равен диаметру соответствующего сосуда. Эти теня обусловлены развитием соединительной ткани по ходу бронхов или сосудов. [8]
На рентгеновском снимке определяется диффузное усиление и деформация легочного рисунка с многочисленными мелкоочаговыми уплотнениями, достигающими 2 мм в диаметре и занимающими оба легочных поля вначале лишь в средних отделах, а позднее на всем протяжении, соответственно I или II стадии пневмокониоза. Тенденции к слиянию узелковых образований, к переходу в III стадию, а тем более к образованию опухолевидных теней никогда не наблюдается, даже при работе в замкнутых помещениях и при особенно неблагоприятных условиях труда.
[9]
Тенденции к слиянию узелковых образований, к переходу в III стадию, а тем более к образованию опухолевидных теней никогда не наблюдается, даже при работе в замкнутых помещениях и при особенно неблагоприятных условиях труда.
[9]
Сосуды, идущие в ортоградной проекции в структуре легочного рисунка, образуют овальные Или круглые очаговоподобные тени. [10]
При диссеминированном туберкулезе отмечается усиление и сетчатая деформация легочного рисунка в верхних отделах легочных полей и обеднение его в нижних. [11]
Рентгенологическая картина в зависимости от стадии заболевания характеризуется усилением легочного рисунка, расширением ворот легких и немногочисленными узелковыми образованиями в средних отделах с обеих сторон. В случаях выраженного поражения легочной ткани отмечается распространенный диффузный фиброз с симметричным расположением многочисленных узелков в средних и нижних отделах легких и эмфизема. [12]
[12]
Обычно рентгенологически различают три стадии асбестоза: I-тонкая сетчатость легочного рисунка и мелкая пятнистость в средних и нижних отделах; II – более грубый сетчатый рисунок, более грубая пятнистость, расплывчатость гилюсов, усиление бронхососудистого рисунка; III ( наиболее, тяжелая) – крупная пятнистость, уменьшение прозрачности в базальных и средних отделах, эмфизема в верхних долях, трудно различимые контуры сердца из-за уплотнения легочной ткани, увеличение сердца ( вправо), утолщение плевры и перикарда; часты бронхоэктазии. [13]
Обычно рентгенологически различают три стадии асбестоза: I – тонкая сетчатость легочного рисунка и мелкая пятнистость в средних п нижних отделах1 II – более грубый сетчатый рисунок, более грубая пятнистость, расплывчатость гилюсов, усиление бронхососудистого рисунка; III ( наиболее тяжелая) – крупная пятнистость, уменьшение прозрачности в базадьных и средних отделах, эмфизема в верхних долях, трудно различимые контуры сердца из-за уплотнения легочной ткани, увеличение сердца ( вправо), утолщение плевры и перикарда; часты бронхоэктазии. В отличие от силикоза – фиброз диффузный, эмфизема в верхних долях легких, фиброзные изменения преимущественно в средних и нижних долях.
[14]
В отличие от силикоза – фиброз диффузный, эмфизема в верхних долях легких, фиброзные изменения преимущественно в средних и нижних долях.
[14]
Обычно рентгенологически различают три стадии асбестоза: Т – тонкая сетчатость легочного рисунка и мелкая пятнистость в средних и нижних отделах; II – более грубый сетчатый рисунок, более грубая пятнистость, расплывчатость гилюсов, усиление бронхососудйстого рисунка; III ( наиболее тяжелая) – крупная пятнистость, уменьшение прозрачности в базальных и средних отделах, эмфизема в верхних долях, трудно различимые контуры сердца из-за уплотнения легочной ткани, увеличение сердца ( вправо), утолщение плевры и перикарда; часты бронхоэктазии. В отличие от силикоза – фиброз диффузный, эмфизема в верхних долях легких, фиброзные изменения преимущественно в средних и нижних долях. [15]
Страницы: 1 2 3 4
Значение рентгенологического метода при исследовании легких у пациентов с ингаляционной травмой Текст научной статьи по специальности «Клиническая медицина»
https://doi. org/10.23934/2223-9022-2019-8-3-279-287 | (сс)ТТ*Я
org/10.23934/2223-9022-2019-8-3-279-287 | (сс)ТТ*Я
Значение рентгенологического метода при исследовании легких у пациентов с ингаляционной травмой
ЭА. Береснева, Т.Г. Спиридонова*, ЕА. Жиркова, М.В. Баринова, Т.И. Семенова, П.А. Брыгин,
О.А.Забавская, Е.П. Соколова, ЕА.Лапшина,А.С. Орлов
Отделение лучевой диагностики
ГБУЗ «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского ДЗМ» Российская Федерация, 129090, Москва, Б. Сухаревская площадь, д. 3
* Контактная информация: Спиридонова Тамара Георгиевна, доктор медицинских наук, научный консультант отделения острых термических поражений НИИ СП им. Н.В. Склифосовского. Email: [email protected]
АКТУАЛЬНОСТЬ
ЦЕЛЬ ИССЛЕДОВАНИЯ
МАТЕРИАЛ И МЕТОДЫ
РЕЗУЛЬТАТЫ
ЗАКЛЮЧЕНИЕ
Ключевые слова:
Ссылка для цитирования
Конфликт интересов Благодарности
Ингаляционная травма (ИТ) – комбинированное поражение дыхательных путей, паренхимы легких и центральной нервной системы. Наиболее полно в литературе описаны изменения слизистой оболочки при термохимическом ожоге дыхательных путей (ОДП) в результате ингаляции продуктов горения, в то время как поражение паренхимы легких при ИТ практически не изучено.
Наиболее полно в литературе описаны изменения слизистой оболочки при термохимическом ожоге дыхательных путей (ОДП) в результате ингаляции продуктов горения, в то время как поражение паренхимы легких при ИТ практически не изучено.
Определить возможности и значение рентгенологического метода при исследовании легких у пациентов с ИТ.
Обследованы 184 пострадавших с ИТ, из них с 1-й степенью ОДП – 53, со 2-й – 92, с 3-й -39 больных. Использованы методы: рентгенологический, рентгеновская компьютерная томография (РКТ) грудной клетки, ультразвуковое исследование грудной клетки, изучение функции внешнего дыхания (ФВД), морфологическое исследование легких, статистические методы.
При рентгенологическом исследовании у большинства пациентов с ИТ выявлены изменения в периферических отделах обоих легких по типу ячеистой деформации легочного рисунка с образованием фигур, напоминающих «тутовую ягоду» или «гроздь винограда». Изучение ФВД обнаружило признаки снижения вентиляции легких и обструктивные изменения в бронхиолах. При РКТ у отдельных больных в периферических отделах легких выявлены множественные локальные участки пониженной плотности без видимых стенок, соответствующие альвеолам при задержке в них воздуха. При гистологическом исследовании периферических отделов легких обнаружены округлые воздушные образования – значительно расширенные альвеолы. Такие изменения связаны с нарушением выдоха вследствие сужения респираторных бронхиол.
Изучение ФВД обнаружило признаки снижения вентиляции легких и обструктивные изменения в бронхиолах. При РКТ у отдельных больных в периферических отделах легких выявлены множественные локальные участки пониженной плотности без видимых стенок, соответствующие альвеолам при задержке в них воздуха. При гистологическом исследовании периферических отделов легких обнаружены округлые воздушные образования – значительно расширенные альвеолы. Такие изменения связаны с нарушением выдоха вследствие сужения респираторных бронхиол.
Рентгенологический метод позволяет выявить признаки повреждения паренхимы легких у пациентов с ИТ. С помощью статистической оценки нами показано, что наличие ячеистой деформации легочного рисунка при ИТ является объективным признаком, подтвержденным коэффициентом каппы Коэна (0,6±0,14; 95% ДИ [0,32-0,88]).
изолированная ингаляционная травма, рентгенография легких, ячеистая деформация легочного рисунка, рентгеновская компьютерная томография, ожог дыхательных путей, функция внешнего дыхания, морфологическое исследование периферических отделов легких
Береснева Э. А., Спиридонова Т.Г., Жиркова Е.А., Баринова М.В., Семенова Т.И., Брыгин П.А. и др. Значение рентгенологического метода при исследовании легких у пациентов с ингаляционной травмой. Журнал им. Н.В. Склифосовского Неотложная медицинская помощь. 2019;8(3):279-287. https://doi.org/10.23934/2223-9022-2019-8-3-279-287
А., Спиридонова Т.Г., Жиркова Е.А., Баринова М.В., Семенова Т.И., Брыгин П.А. и др. Значение рентгенологического метода при исследовании легких у пациентов с ингаляционной травмой. Журнал им. Н.В. Склифосовского Неотложная медицинская помощь. 2019;8(3):279-287. https://doi.org/10.23934/2223-9022-2019-8-3-279-287
Авторы заявляют об отсутствии конфликта интересов
Исследование не имеет спонсорской поддержки
БС — бронхоскопия
ДИ — доверительный интервал
ИВЛ — искусственная вентиляция легких
ИИТ — изолированная ингаляционная травма
ИТ — ингаляционная травма
ОДП — ожог дыхательных путей
п. т. — поверхность тела
т. — поверхность тела
ВВЕДЕНИЕ
Ингаляционная травма (ИТ) — одна из сложных проблем в комбустиологии. По данным различных авторов, при пожарах ИТ получают 20-33% пострадавших, из которых 30-50% погибают [1-3]. В США регистрируется ежегодно более 20 000 пострадавших с ИТ [4]. В ожоговый центр НИИ СП им. Н.В. Склифосовского
РКТ — рентгеновская компьютерная томография
ТБД — трахеобронхиальное дерево
ТКФ — точный критерий Фишера
УЗИ — ультразвуковое исследование
ФВД — функция внешнего дыхания
ХОБЛ — хроническая обструктивная болезнь легких
ЯДЛР — ячеистая деформация легочного рисунка
в 2014-2017 гг. в среднем ежегодно госпитализировали 730 пострадавших, из которых около 20% составляли пациенты с изолированной ИТ (ИИТ).
в среднем ежегодно госпитализировали 730 пострадавших, из которых около 20% составляли пациенты с изолированной ИТ (ИИТ).
При пожарах в закрытых помещениях на организм пострадавшего воздействует комплекс физических и химических факторов [5]. Понятие ИТ включает
поражение слизистой оболочки трахеобронхиального дерева (ТБД) — собственно ожог дыхательных путей (ОДП), поражение паренхимы легких и действие системных ядов. Авторы отмечают, что не существует корреляции между бронхоскопической оценкой состояния ТБД, клиническим течением и исходом ИТ [6, 7]. Тяжелые клинические проявления развиваются при разрушении сурфактанта альвеол и воздействии системных ядов [5]. Отсутствие стандарта диагностических критериев комплексной оценки степени тяжести ИТ является серьезной проблемой лечения и прогноза заболевания [8, 9].
В эксперименте на овцах при ИТ выявлены значительное увеличение бронхиального кровотока, отек легких, обструкция ТБД твердыми частичками копоти, нейтрофилами, эпителиальными клетками, слизью, что приводит к гипоксии и ателектазам [10].
Ингаляционная травма может быть как изолированной, так и в комбинации с ожогами кожного покрова различной площади и степени тяжести, что взаимно отягощает состояние пациента, увеличивая летальность в 2 раза [11].
Основным и надежным методом диагностики ОДП является бронхоскопия (БС). В НИИ СП им. Н.В. Склифосовского на базе ожогового центра была разработана и применяется с 1990 г. эндоскопическая классификация ОДП, основанная на степени тяжести поражения слизистой оболочки ТБД. Классификация выделяет 4 степени: 1-я степень — катаральная форма, 2-я — эрозивная, 3-я — язвенная, 4-я — некротическая [12].
Эндоскопические и морфологические (биопсий-ный материал) сопоставления ИТ различной степени тяжести позволили изучить течение ОДП при традиционном способе лечения и эндобронхиальной лазерной терапии [13].
Работа, проведенная W. Y. Lin et al. в 1997 г., с использованием сцинтиграфии легких с радиоаэрозолем 99mTc-DTPA показала, что неоднородное распределение препарата соответствовало более тяжелому поражению. Авторы пришли к заключению, что данный метод обеспечивает объективную оценку степени тяжести ингаляционного повреждения легких [14].
Y. Lin et al. в 1997 г., с использованием сцинтиграфии легких с радиоаэрозолем 99mTc-DTPA показала, что неоднородное распределение препарата соответствовало более тяжелому поражению. Авторы пришли к заключению, что данный метод обеспечивает объективную оценку степени тяжести ингаляционного повреждения легких [14].
В последние годы за рубежом с целью диагностики ОДП наряду с БС используется рентгеновская компьютерная томография (РКТ) органов грудной клетки. Исследования показали корреляцию между увеличением (>3 мм) толщины стенки бронха (измеренной на расстоянии 2 см от бифуркации трахеи), развитием пневмонии и временем нахождения на искусственной вентиляции легких (ИВЛ). Авторы доказали высокую чувствительность и специфичность метода РКТ при ингаляционном поражении, выявив, что утолщение стенки бронха приводит к уменьшению воздушного потока [15, 16].
Таким образом, ранняя прижизненная диагностика повреждений паренхимы легких является актуальной научно-клинической проблемой. Некоторые авторы описывают рентгенологические признаки изменения легких при ИТ как уплотнение бронхиальной стенки, подглоточный отек и отек легких, как «пятнистую неоднородную структуру» [17-19]. Высказывались предположения, что рентгенологический метод исследования легких при ИТ является низкочувствительным, поскольку почти половина больных, нуждающихся в ИВЛ, имеют нормальные рентгенограммы легких
Некоторые авторы описывают рентгенологические признаки изменения легких при ИТ как уплотнение бронхиальной стенки, подглоточный отек и отек легких, как «пятнистую неоднородную структуру» [17-19]. Высказывались предположения, что рентгенологический метод исследования легких при ИТ является низкочувствительным, поскольку почти половина больных, нуждающихся в ИВЛ, имеют нормальные рентгенограммы легких
[14, 20]. Такой консервативный подход объясняет практически полное отсутствие отечественных и зарубежных публикаций по рентгеновскому исследованию легких при ИТ.
В 2013 г. профессор Э.А. Береснева впервые обратила внимание на наличие характерных изменений на рентгенограммах большинства больных с ИИТ в виде ячеистой деформации легочного рисунка (ЯДЛР). Обнаруженные изменения были положены в основу данного исследования.
цель исследования: определить возможности и значение рентгенологического метода при исследовании легких у пациентов с ИТ.
МАТЕРИАЛ И МЕТОДЫ
Проведен ретроспективный анализ историй болезни 184 пациентов с ИТ, находившихся на лечении в ожоговом центре НИИ СП им. Н.В. Склифосовского с 2014 по 2017 г. Критерием включения пациентов в исследование была ИТ. Диагноз ИТ ставили клинически на основании анамнеза и осмотра (нахождение в задымленном помещении, закопченость полости рта и носовых ходов, кашель и першение в горле, рассеянные хрипы в легких, одышка). Степень тяжести ОДП определяли при первичной БС при поступлении.
Статистический анализ данных проводили с помощью пакета программы Statistica 13 (StatSoft, Inc., США). Описательная статистика количественных признаков представлена медианами и квартилями в формате Me (LO; UO). Независимые группы сравнивали с применением точного критерия Фишера (ТКФ). Пороговый уровень значимости p принят равным 0,05. С целью подтверждения вновь выявленного симптома ЯДЛР независимую оценку рентгенограмм проводили два врача-рентгенолога (эксперта). Каждый эксперт подтверждал или отрицал наличие ЯДЛР на рентгенограмме. Результаты статистически оценивали посредством коэффициента каппы Коэна с расчетом стандартной ошибки и 95% доверительного интервала (ДИ), позволяющего судить о случайном или неслучайном совпадении заключений [21].
Среди 184 пациентов ОДП 1-й степени выявлен у 53 больных, 2-й степени — у 92, 3-й — у 39 больных. У 49 пациентов (26,6%) имели место поверхностные ожоги кожи I степени (по МКБ-10) на площади от 0,1 до 10% поверхности тела (п.т.), медиана 4,0 (2,0; 5,0)% п.т. Умерли 38 больных.
Возраст пациентов составил от 16 до 95 лет. В табл. 1 представлены медианы возраста больных с различной степенью тяжести ОДП. Таблица 1
Характеристика больных по возрасту при разной степени тяжести ожога дыхательных путей
Table 1
Characterization of patients by age with varying degrees of airways burn
Степень ожога Число наблюдений, n Показатели возраста, лет
Me (LQ; UO)» Минимум Максимум
1-я 53 42 (30; 67) 20 85
2-я 92 57,5 (40; 72,5) 21 95
3-я 39 58 (41; 80) 16 90
Всего: 184 54 (35; 73) 16 95
Примечания: * Медиана (25; 75 квартили)
Распределение больных по полу при различной степени тяжести ОДП приведено в табл. 2.
Таблица 2
Характеристика больных по полу при ожоге дыхательных путей разной степени
Table 2
Characteristics of patients by gender in the presence of varying degrees of airways burns
Пол Степень ожога Всего:
1-я 2-я 3-я
Женщины Мужчины Всего больных: 23 (43,4%) 30 (56,6%) 53 46 (50,0%) 46 (50,0%) 92 16 (41,0%) 23 (59,0%) 39 85 (46,2%) 99 (53,8%) 184
У 112 больных (60,9%) диагностировали отравление продуктами неполного сгорания разных материалов, в том числе угарным газом, что отражено в табл. 3. Клинически это проявлялось нарушением сознания (вплоть до комы). У части больных лабораторно определялось повышенное содержание карбоксигемогло-бина в крови от 8 до 27%, медиана — 21 (16,2; 24,9)%. Таблица 3
Распределение больных с ожогом дыхательных путей в зависимости от отравления продуктами горения
Table 3
Distribution of patients with airways burns depending on poisoning by combustion products
Отравление Степень ожога Всего
продуктами горения 1-я 2-я 3-я
Да 25 (47,2%) 61 (66,3%) 26 (66,7%) 112 (60,9%)
Нет 28 (52,8%) 31 (33,7%) 13 (33,3%) 72 (39,1%)
Всего больных 53 92 39 184
Среди 184 пациентов у 121 (65,8%) не было явлений дыхательной недостаточности, а у 63 (34,2%) в связи с дыхательной недостаточностью потребовалась ИВЛ (табл. 4).
Таблица 4
Распределение больных с ожогом дыхательных путей в зависимости от типа дыхания
Table 4
Distribution of patients with AB, depending on the type of breathing
Тип дыхания Степень ожога Всего
1-я 2-я 3-я
Самостоятельное 51 (96,2%) 63 (68,5%) 7 (17,9%) 121 (65,8%)
Искусственная вентиляция легких 2 (3,8%) 29 (31,5%) 32 (82,1%) 63 (34,2%)
Всего 53 92 39 184
Всем пострадавшим в первые сутки поступления в ожоговый центр проводили рентгенологическое исследование органов грудной клетки для изучения состояния легких. Для этого использовали передвижные рентгеновские аппараты, выполняли прямые задние снимки.
РКТ-исследования 10 больным проведены на спиральном компьютерном томографе Aquilion Prime (80/0,5) фирмы Toshiba. Зона сканирования — с уровня яремной вырезки до нижних отделов реберно-диа-фрагмальных синусов, ширина поля — с захватом мягких тканей, коллимация слоя 0,5-1 мм, интервал реконструкции — 1-3 мм. Напряжение — 120 кВт, экспозиция — 120-140 mA (применяли функцию автоматической регулировки). Предварительный анализ результатов спиральной РКТ проводили на рабочей консоли. Полученные изображения подвергали качес-
твенному (положение, форма, контуры, структура) и количественному анализу (размеры в мм, объем в см3, плотность в единицах Хаунсфилда (ед.Н)). Затем на рабочей станции осуществляли постпроцессорную обработку изображений с построением многоплоскостных реформаций.
Функцию внешнего дыхания (ФВД) определяли методом спирометрии. Исследование выполнено 25 больным с ИИТ и включало измерение жизненной емкости легких и скоростных показателей дыхания. Для исследования использовали компьютерный цифровой спирометр, состоящий из датчика потока воздуха и электронного устройства, преобразующего показания датчика в цифровую форму.
УЗИ плевральных полостей и легкого выполняли пациентам при поступлении и в динамике на приборах Logiq P6 с использованием конвексного датчика 2-5 МГц и линейного датчика 7 МГц. Исследование выполняли по стандартной методике, описанной Б.Е. Шаховым, Д.В. Сафоновым [22] в положении пациента сидя и с модификацией в положении пациента лежа на спине (при возможности — на боку) [23], в зависимости от тяжести состояния пострадавшего. При осмотре оценивали разобщение листков плевры, наличие и характер содержимого плевральной полости, толщину листков плевры, паренхиму легкого из всех доступных точек по межреберьям. Каждому пациенту было выполнено от 2 до 4 УЗИ плевральной полости.
Гистологическое исследование аутопсийного материала периферических отделов легких выполнено у 35 из 38 умерших. Использовали общеизвестные методики: окраску гематоксилином и эозином, пикрофукси-ном по Ван-Гизону. Фибрин исследовали с помощью окраски MSB.
РЕЗУЛЬТАТЫ
При анализе рентгенограмм больных с ИТ при поступлении обращали на себя внимание изменения легочного рисунка по ячеистому типу, выраженные в разной степени. Эти изменения заключались в исчезновении четкого сосудистого рисунка и появлении либо множественных участков просветления округлой формы почти одинаковых размеров (0,3-0,4 см), тесно расположенных, напоминающих гроздь винограда (рис. 1), либо занимающих все легочное поле, как в верхних, так и в нижних отделах. В периферических отделах легких, больше справа, фигуры были похожи на «тутовые ягоды». Корни легких при этом были неизмененными. Диафрагма определялась в обычном положении, признаки свободной жидкости в плевральных полостях отсутствовали. При выявлении других изменений в легких (венозного полнокровия, гиповентиляции, пневмонии и т.д.) ЯДЛР проявлялась более четко.
Рентгенограммы 184 больных оценивали два врача-рентгенолога. Первый эксперт выявил наличие ЯДЛР у 179, а ее отсутствие — у 5 больных. Второй эксперт выявил наличие ЯДЛР у 171, а ее отсутствие — у 13 больных. Общее число согласованных независимых диагностических заключений экспертов составило: положительные — 171, отрицательные — 5. Чтобы исключить случайное совпадение заключений врачей, нами был рассчитан коэффициент каппы Коэна, который составил 0,6±0,14 (95% ДИ [0,32-0,88]). Полученный результат свидетельствует о том, что сов-
Рис. 1. Рентгенограммы больных с различной степенью тяжести изолированной ингаляционной травмы. Отчетливо определяется ячеистая деформация легочного рисунка. Ожоги дыхательных путей: А —1-й степени; В — 2-й степени; С — 3-й степени
Fig. 1. X-ray images of patients with varying severity of IT. The network deformation of the pulmonary pattern is clearly defined. А — AB of 1 degree; В — AB of 2 degree; С — AB of 3 degree
падения заключений двух независимых врачей-экспертов объективны.
Для исключения влияния ограниченных поверхностных ожогов кожи на возникновение ЯДЛР при ИТ мы сравнили частоту ее выявления у больных с ИИТ и больных с ИТ и ограниченными поверхностными ожогами кожи. ЯДЛР была обнаружена у всех 49 больных с ИТ и ожогами кожи и у 130 больных из 135 с ИИТ. Статистический анализ не выявил значимой разницы между ними (p=0,327; ТКФ).
Проведенный попарный статистический анализ частоты выявления ЯДЛР у больных с разной степенью тяжести ОДП (табл. 5) показал, что не было статистически значимой разницы частоты выявления ячеистой деформации между группами (p=0,757, p=0,615 и p=0,443 соответственно; ТКФ).
Нами показано, что выраженность ЯДЛР при ОДП разной степени тяжести была различной, что представлено в табл. 6.
Как видно из табл. 6, при ОДП 1-й степени хорошо выраженная ячеистая деформация выявлена у 34 больных из 53 (64,1%), при ОДП 2-й степени — у 68 больных из 92 (73,9%), при ОДП 3-й степени — у 36 из 39 больных (92,3%).
Таким образом, исследование показало, что существует прямая зависимость степени тяжести повреждения слизистой оболочки ТБД и паренхиматозного повреждения легочной ткани, проявляющегося в виде ЯДЛР, что демонстрирует рис. 2.
При морфологическом исследовании легких 35 умерших обнаружены изменения, подтверждающие клинические и рентгенологические данные, свидетельствующие о нарушении выдоха и скоплении воздуха в альвеолах (М.В. Баринова). Морфологические исследования периферических отделов легких выявили поражение респираторных бронхиол в виде деск-вамативного бронхиолита с сужением их просвета и значительно растянутые стенки альвеол (рис. 3). Эти воздушные образования отличались от воздушных кист множественностью, тесным расположением, отсутствием выстилки или капсулы. При морфологи-
Таблица 5
Сравнение наличия ячеистой деформации легочного рисунка при ожоге дыхательных путей разной степени тяжести
Table 5
Comparison of network deformation of pulmonary pattern in AB of varying degrees of severity
Сравниваемые степени ожога P
дыхательных путей (точный критерий Фишера)
1-я и 2-я 0,757
1-я и 3-я 0,615
2-я и 3-я 0,443
Таблица 6
Степень выраженности ячеистой деформации легочного рисунка при ожоге дыхательных путей разной степени тяжести
Table 6
The degree of severity of network deformation of the pulmonary pattern in the presence of AB of varying severity
Степень ожога
Число Степень выраженности ячеистой деформации больных, n
Хорошо
Слабо
Отсутствует
n % n % n %
1 53 34 64,1 18 34,0 1 1,9
2 92 68 73,9 20 21,7 4 4,4
3 39 36 92,3 3 7,7 0 0
Всего больных 184 138 75,0 41 22,3 5 2,7
Количество больных (%) с ЯДЛР 100 90 80 70 60 50 40 30 20 10 0
92,3
I Хорошо выражена i Слабо выражена
3 Степень ОДП
Рис. 2. Зависимость степени тяжести ожога дыхательных путей (ОДП) и выраженности ячеистой деформации легочного рисунка (ЯДЛР)
Fig. 2. The dependence of the AB severity and the significance of network deformation of pulmonary pattern
1
2
Рис. 3. Морфологические изменения в легком. На фоне воспалительной инфильтрации определяются множественные вздутые альвеолы как признак нарушения выдоха. А — ожог дыхательных путей 1-й степени. В альвеолах выраженная лейкоцитарная реакция со вздутыми альвеолами. Окраска гематоксилином и эозином, увеличение х 200; В — ожог дыхательных путей 2-й степени. Лейкоцитарный экссудат и участки отека со вздутыми альвеолами. Окраска гематоксилином и эозином, увеличение х 120; С — ожог дыхательных путей 3-й степени. Множественные вздутые альвеолы различных размеров в легочной ткани. Окраска гематоксилином и эозином, увеличение х 100
Fig. 3. The morphological changes in the lung. Against the background of inflammatory infiltration, multiple overinflated alveoli are determined as a sign of exhalation disturbance. А — AB of 1 degree. The marked white blood cells reaction with overinflated alveoli. Hematoxylin and eosin stain, magnification x200; В — AB of 2 degree. White blood cells exudate and areas of edema with overinflated alveoli. Hematoxylin and eosin stain, magnification x120; С — AB of 3 degree. Multiple overinflated alveoli of various sizes in the lung tissue. Stained with hematoxylin and eosin, magnification x100
Рис. 4. Рентгеновская компьютерная томография органов грудной клетки. А — центрилобулярная эмфизема у пациента с ингаляционной травмой; В — фронтальная реконструкция. В обоих легких, преимущественно в верхних долях — в центре вторичных легочных долек определяются множественные локальные участки пониженной плотности без видимых стенок, четко отграниченные от неизмененной легочной паренхимы. Количество сосудов и их диаметр в этих участках уменьшены. Стрелками показаны утолщенные стенки сегментарных бронхов; С — аксиальный срез. Компьютерная томография органов грудной клетки. Стрелками показаны утолщенные стенки сегментарных бронхов
Fig. 4. CT of the chest. А — Centrilobular emphysema in a patient with inhalation trauma; В — Frontal reconstruction. Multiple local areas of reduced density without visible walls are defined, clearly delimited from the unchanged pulmonary parenchyma in both lungs, mainly in the upper lobes, in the center of the secondary pulmonary lobules. The number of vessels and their diameter in these areas are reduced. Arrows indicate the thickened walls of the segmental bronchi; С — Axial slice. Computed tomography of the chest. Arrows indicate the thickened walls of the segmental bronchi
ческом исследовании центральных участков легких подобные изменения не обнаружены.
При изучении ФВД у 25 больных с ИИТ при 1-й степени ОДП функциональных нарушений дыхательной системы не выявлено; при 2-3-й степени ОДП отмечено снижение вентиляции легких, признаки обструкции бронхиол в совокупности с рестриктивными нарушениями.
При УЗИ периферических участков легких у 4 больных с ИТ и выраженной ЯДЛР выявлены В-линии, которые не являются специфичными и определяются при других заболеваниях (тромбоэмболия легочной артерии, отек легких, а также при проведении ИВЛ). Обнаружена умеренная неоднородность более глубоких слоев легочной паренхимы (3-5-7 см).
При анализе РКТ у 10 больных с ИТ выраженные изменения обнаружены у одного больного, преимущественно в верхних долях обоих легких, по типу цен-трилобулярной эмфиземы (рис. 4 А) с изменениями вокруг терминальных бронхиол, в центрах вторичных легочных долек, в виде множественных локальных участков пониженной плотности, четко отграниченных от неизмененной легочной ткани. Необходимо отметить, что пациент не имел анамнеза курильщика, не страдал хронической обструктивной болезнью легких (ХОБЛ). У этого же, а также у 4 других больных выявлены признаки утолщения стенок крупных и
средних бронхов, приводящих к уменьшению воздушного потока (рис. 4 В, С).
ОБСУЖДЕНИЕ
Проблема диагностики и лечения поражения слизистой оболочки ТБД при ИТ изучена в эксперименте и клинике [5, 10, 24]. Однако до настоящего времени значительные трудности представляет диагностика поражения конечной структурно-функциональной единицы легких (ацинуса) при ИТ. Несмотря на то, что многие авторы считают рентгенологический метод оценки легких при ИТ низкочувствительным [15, 20], проведенное нами комплексное диагностическое исследование легких показало, что ИТ сопровождается значительными рентгенологическими изменениями периферических отделов легких. Эти изменения характеризуются появлением ЯДЛР с образованием множества воздушных полостей, кучно расположенных, выявляющихся в периферических отделах по всем легочным полям у пострадавших с ИТ. Тесное расположение воздушных полостей в ряде случаев создают фигуры, напоминающие «гроздь винограда» или «тутовую ягоду». Мы не встретили ни в отечественной, ни в зарубежной литературе результатов рентгенологических исследований при ИТ, которые свидетельствуют о задержке воздуха в раздутых альвеолах в результате нарушения выдоха. Нами выявлена
прямая зависимость между степенью тяжести ОДП и выраженностью ЯДЛР.
Исследование параметров респираторной механики при помощи графического мониторинга аппарата ИВЛ позволило выявить повышение сопротивления дыхательных путей (РЕЕР=16±3 см вод.ст). При помощи маневра «задержка на выдохе» были выявлены признаки «воздушной ловушки» или autoPEEP (8±3 см вод. ст). Полученные данные подтвердили предполагаемое нарушение выдоха и задержку воздуха в раздутых альвеолах, что и является основой ЯДЛР с образованием воздушных фигур типа «грозди винограда» или «тутовой ягоды» [25].
Наши исследования показали, что информативным методом диагностики респираторных нарушений у больных, находящихся на самостоятельном дыхании, является определение параметров ФВД. Метод позволил выявить признаки обструктивных и рестрик-тивных нарушений, создающих условия для задержки воздуха в альвеолах, что также подтвердило результаты рентгенологического исследования. Подобных сведений в источниках литературы мы не встретили. В работе F.W. Endorf и R.L. Gamelli сообщается о сравнительном исследовании двух групп больных с ИТ 0-1-й степени и 2-3-4-й степени с определением следующих параметров: режим вентиляции, дыхательный объем, пиковое давление на вдохе, среднее давление в дыхательных путях и комплайнс. В результатах исследования приведены только цифровые данные комплайнса, которые статистически не различаются в сравниваемых двух группах, как и остальные показатели, значения которых не приведены [26].
Мы не получили убедительных данных относительно деформации легочного рисунка при РКТ легких, что может быть обусловлено ограниченным числом наблюдений и требует дальнейших исследований. У отдельных больных были обнаружены утолщения стенок крупных бронхов, приводящих к уменьшению воздушного потока, и появление участков центрилобуляр-ной эмфиземы. Полученные нами данные согласуются с результатами зарубежных исследований [15, 16].
ЛИТЕРАТУРА
1. Dries DJ. Management of burn injuries — recent developments in resuscitation, infection control and outcomes research. Scand J Trauma Resusc EmergMed. 2009;17(1):14. PMID: 19284591 https://doi. org/10.1186/1757-7241-17-14
2. Mgahed M, El-Helbawy R, Omar A, El-Meselhy H, Abd El-Halim R. Early detection of pneumonia as a risk factor for mortality in burn patients in Menoufiya University Hospitals, Egypt. Ann Burns Fire Disasters. 2013;26(3):128-135. PMID: 24563638
3. Hussain A, Dunn K. Burn related mortality in Greater Manchester: 11-year review of Regional Coronial Department Data. Burns. 2014;41(2):225-234. PMID: 25468472 https://doi.org/10.1016/j.burns.2014.10.008
4. Yamamoto Y, Sousse LE, Enkhbaatar P. y-tocopherol nebulization decreases oxidative stress, arginase activity, and collagen deposition after burn and smoke inhalation in the ovine model. Shock. 2012;38(6):671-676. PMID: 23160521 https://doi.org/10.1097/SHK.0b013e3182758759
5. Siemers F, Mailänder P. Inhalationstrauma, Kohlenmonooxid- und Cyanidintoxikation. NotfallRettungsmed. 2010;13(1):17-22. https://doi. org/10.1007/s10049-009-1250-x
6. Sutton T, Lenk I, Conrad P, Halerz M, Mosier M. Severity of Inhalation Injury is Predictive of Alterations in Gas Exchange and Worsened Clinical Outcomes. J Burn Care Res. 2017;12. PMID: 28570316 https:// doi.org/10.1097/BCR.0000000000000574
7. Walker PF, Buehner MF, Wood LA, Boyer NL, Driscoll IR, Lundy JB, et al. Diagnosis and management of inhalation injury: an updated review. Crit Care. 2015;19:351. PMID: 26507130 https://doi.org/10.1186/s13054-015-1077-4
8. Reske A, Bak Z, Samuelsson A, Morales O, Seiwerts M, Sjöberg F. Computed tomography — a possible aid in the diagnosis of smoke inhalation injury? Acta Anaesthesiol Scand. 2005;49(2):257-260. PMID: 15715631 https://doi.org/10.1111/j.1399-6576.2004.00592.x
Изучение эхосемиотики легких у отдельных больных с ИТ не выявило признаков поражения паренхимы легких, что также требует дальнейших исследований [22].
Гистологические исследования периферических участков легких умерших с ИТ подтвердили рентгенологические находки: наличие воздушных округлого вида шаров, которые могут быть расценены как вздувшиеся альвеолы вследствие задержки в них воздуха в результате обструкции бронхиол. Гистологически похожие воздушные кистоподобные структуры описаны при острых отравлениях психотропными лекарственными средствами у лиц пожилого и старческого возраста [27], вот почему утверждать о специфичности ЯДЛР при ИИТ не представляется возможным.
ЗАКЛЮЧЕНИЕ
С помощью статистической оценки нами показано, что выявление ячеистой деформации легочного рисунка при ингаляционной травме не является случайным, это подтверждает коэффициент каппы Коэна (0,6±0,14; 95% ДИ [0,32-0,88]). Рентгенологический метод исследования легких позволяет выявить ячеистую деформацию легочного рисунка различной степени выраженности у большинства пострадавших с ингаляционной травмой. На частоту возникновения ячеистой деформации у больных с ингаляционной травмой не влияло наличие поверхностных ожогов кожи площадью до 10% поверхности тела. Ячеистая деформация связана с паренхиматозным повреждением легких и обусловлена развитием десквамативного бронхиолита с задержкой воздуха и перерастяжением альвеол в результате нарушения выдоха. В представленном исследовании ячеистая деформация паренхимы легочной ткани, и связанное с ней нарушение дыхания подтверждаются результатами изучения функции внешнего дыхания и аутопсийного материала периферических отделов легких. Выявлена прямая зависимость между степенью тяжести ожога дыхательных путей и повреждением паренхимы легочной ткани.
9. Palmieri TL, Warner P, Mlcak RP, Sheridan R, Kagan RJ, Herndon DN, et al. Inhalation injury in children: a 10 year experience at Shriners Hospitals for Children. J Burn Care Res. 2009;30(1):206-208. PMID: 19060756 https://doi.org/10.1097/BCR.0b013e3181923ea4
10. Murakami K, Traber DL. Pathophysiological basis of smoke inhalation injury. News Physiol Sci. 2003;18:125-129. PMID: 12750450
11. Edelman DA, Khan N, Kempf K, White MT. Pneumonia after inhalation injury. J Burn Care Res. 2007;28(2):241-246. PMID: 17351439 https:// doi.org/10.1097/BCR.0B013E318031D049
12. Синев Ю.В., Скрипаль А.Ю., Герасимова Л.И., Логинов Л.П., Прохоров А.Ю. Фибробронхоскопия при термоингаляционных поражениях дыхательных путей. Хирургия. Журнал им. Н.И. Пирогова. 1988;(8):100-104.
13. Галанкина И.Е., Дементьева И.В., Смирнов С.В., Пинчук Т.П., Майоров Г. А., Брыгин П.А. Эндоскопическая и морфологическая оценка эффективности эндобронхиальной лазерной терапии при ингаляционной травме. Российский медицинский журнал. 2005;(1):19-23.
14. Lin WY, Kao CH, Wang SJ. Detection of acute inhalation injury in fire victims by means of technetium-99m DTPA radioaerosol inhalation lung scintigraphy. Eur JNucl Med. 1997;24(2):125-129. PMID: 9021108
15. Yamamura H, Kaga S, Kaneda K, Mizobata Y. Chest computed tomography performed on admission helps predict the severity of smoke-inhalation injury. Crit Care. 2013;17(3):R95. PMID: 23706091 https://doi.org/10.1186/cc12740
16. Yamamura H, Morioka T, Hagawa N, Yamamoto T, Mizobata Y. Computed tomographic assessment of airflow obstruction in smoke inhalation injury: Relationship with the development of pneumonia and injury severity. Burns. 2015;41(7):1428-1434. PMID: 26187056 https://doi. org/10.1016/j.burns.2015.06.008
17. Teixidor HS, Rubin E, Novick GS, Alonso DR. Smoke inhalation: radiologic manifestations. Radiology. 1983;149(2):383-387. PMID: 6622680 https://doi.org/10.1148/radiology.149.2.6622680
18. Peitzman AB, Shires GT 3rd, Teixidor HS, Curreri PW, Shires GT. Smoke inhalation injury: evaluation of radiographic manifestations and pulmonary dysfunction. J Trauma. 1989;29(9):1232-1238; discussion 1238-1239. PMID: 2671399 https://doi.org/ 10.1097/00005373198909000-00008
19. Lee MJ, O’Connell DJ. The plain chest radiograph after acute smoke inhalation. Clin Radiol. 1988;39(1):33-37. PMID: 3338239 https://doi. org/10.1016/s0009-9260(88)80334-9
20. Wittram C, Kenny JB. The admission chest radiograph after acute inhalation injury and burns. Br J Radiol. 1994;67(800):751-754. PMID: 8087478 https://doi.org/10.1259/0007-1285-67-800-751
21. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. Москва: Медиа-Сфера; 2003.
22. Шахов Б.Е., Сафонов Д.В. Трансторакальное ультразвуковое исследование лёгких и плевры. Н. Новгород: Изд-во НГМА; 2002.
23. Соколова Е.П., Трофимова Е.Ю., Даниелян Ш.Н. Эхосемиотика повреждений лёгкого при закрытой травме груди. Ультразвуковая и функциональная диагностика. 2015;(3):66-73.
REFERENCES
1. Dries DJ. Management of burn injuries — recent developments in resuscitation, infection control and outcomes research. Scand J Trauma Resusc EmergMed. 2009;17(1):14. PMID: 19284591 https://doi. org/10.1186/1757-7241-17-14
2. Mgahed M, El-Helbawy R, Omar A, El-Meselhy H, Abd El-Halim R. Early detection of pneumonia as a risk factor for mortality in burn patients in Menoufiya University Hospitals, Egypt. Ann Burns Fire Disasters. 2013;26(3):128-135. PMID: 24563638
3. Hussain A, Dunn K. Burn related mortality in Greater Manchester: 11-year review of Regional Coronial Department Data. Burns. 2014;41(2):225-234. PMID: 25468472 https://doi.org/10.1016/j.burns.2014.10.008
4. Yamamoto Y, Sousse LE, Enkhbaatar P. y-tocopherol nebulization decreases oxidative stress, arginase activity, and collagen deposition after burn and smoke inhalation in the ovine model. Shock. 2012;38(6):671-676. PMID: 23160521 https://doi.org/10.1097/SHK.0b013e3182758759
5. Siemers F, Mailänder P. Inhalationstrauma, Kohlenmonooxid- und Cyanidintoxikation. NotfallRettungsmed. 2010;13(1):17-22. https://doi. org/10.1007/s10049-009-1250-x
6. Sutton T, Lenk I, Conrad P, Halerz M, Mosier M. Severity of Inhalation Injury is Predictive of Alterations in Gas Exchange and Worsened Clinical Outcomes. J Burn Care Res. 2017;12. PMID: 28570316 https:// doi.org/10.1097/BCR.0000000000000574
7. Walker PF, Buehner MF, Wood LA, Boyer NL, Driscoll IR, Lundy JB, et al. Diagnosis and management of inhalation injury: an updated review. Crit Care. 2015;19:351. PMID: 26507130 https://doi.org/10.1186/s13054-015-1077-4
8. Reske A, Bak Z, Samuelsson A, Morales O, Seiwerts M, Sjöberg F. Computed tomography – a possible aid in the diagnosis of smoke inhalation injury? Acta Anaesthesiol Scand. 2005;49(2):257-260. PMID: 15715631 https://doi.org/10.1111/j.1399-6576.2004.00592.x
9. Palmieri TL, Warner P, Mlcak RP, Sheridan R, Kagan RJ, Herndon DN, et al. Inhalation injury in children: a 10 year experience at Shriners Hospitals for Children. J Burn Care Res. 2009;30(1):206-208. PMID: 19060756 https://doi.org/10.1097/BCR.0b013e3181923ea4
10. Murakami K, Traber DL. Pathophysiological basis of smoke inhalation injury. News Physiol Sci. 2003;18:125-129. PMID: 12750450
11. Edelman DA, Khan N, Kempf K, White MT. Pneumonia after inhalation injury. J Burn Care Res. 2007;28(2):241-246. PMID: 17351439 https:// doi.org/10.1097/BCR.0B013E318031D049
12. Sinev YuV, Skripal’ AYu, Gerasimova LI, Loginov LP, Prokhorov AYu. Fibrobronkhoskopiya pri termoingalyatsionykh porazheniyakh dykhatel’nykh putey. Pirogov Russian Journal of Surgery. 1988;(8):100-104. (in Russ.)
13. Galankina IE, Dementyeva IV, Smirnov SV, Pinchuk TP, Maiorov GA, Brygin PA. Endoscopic and morphological evaluation of the efficiency of endobronchial laser therapy in inhalation trauma. Russian Medical Journal. 2005;(1):19-23. (in Russ.)
14. Lin WY, Kao CH, Wang SJ. Detection of acute inhalation injury in fire victims by means of technetium-99m DTPA radioaerosol inhalation lung scintigraphy. Eur JNucl Med. 1997;24(2):125-129. PMID: 9021108
24. Макаров А.В., Миронов А.В, Галанкина И.Е., Смирнов С.В., Пономарев И.Н., Боровкова Н.В. Влияние ранней санационной фиброброн-хоскопии с аппликацией коллагена 1-го типа человека на сроки эпителизации повреждений слизистой оболочки трахеи и бронхов у пациентов с ингаляционной травмой. Неотложная медицинская помощь. Журнал им. Н.В. Склифосовского. 2018;7(2):111-116.
25. Береснева Э.А., Смирнов С.В., Шевякова С.В., Брыгин П.А., Полякова И.Н., Клычникова Е.В. Значение рентгенологического и лабораторных исследований у пострадавших от воздействия огня и продуктов горения при пожаре (в баре «Хромая лошадь», Пермь, 2009 г.). Проблемы безопасности и чрезвычайных ситуаций. 2012;(1):17-33.
26. Endorf FW, Gamelli RL. Inhalation injury, pulmonary perturbations, and fluid resuscitation. J Burn Care Res. 2007;28(1):80-83. PMID: 17211205 https://doi.org/10.1097/BCR.0B013E31802C889F
27. Зимина Л.Н., Баринова М.В., Полозов М.А, Михайлова Г.В., Розум-ный П.А., Сахаров Г.Ю., и др. Анализ летальности при острых отравлениях психотропными лекарственными средствами у лиц пожилого и старческого возраста в НИИ скорой помощи им. Н.В. Склифосовского за 2013-2015 гг. Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь». 2017;(4):318-323.
15. Yamamura H, Kaga S, Kaneda K, Mizobata Y. Chest computed tomography performed on admission helps predict the severity of smoke-inhalation injury. Crit Care. 2013;17(3):R95. PMID: 23706091 https://doi.org/10.1186/cc12740
16. Yamamura H, Morioka T, Hagawa N, Yamamoto T, Mizobata Y. Computed tomographic assessment of airflow obstruction in smoke inhalation injury: Relationship with the development of pneumonia and injury severity. Burns. 2015;41(7):1428-1434. PMID: 26187056 https://doi. org/10.1016/j.burns.2015.06.008
17. Teixidor HS, Rubin E, Novick GS, Alonso DR. Smoke inhalation: radiologic manifestations. Radiology. 1983;149(2):383-387. PMID: 6622680 https://doi.org/10.1148/radiology.149.2.6622680
18. Peitzman AB, Shires GT 3rd, Teixidor HS, Curreri PW, Shires GT. Smoke inhalation injury: evaluation of radiographic manifestations and pulmonary dysfunction. J Trauma. 1989;29(9):1232-1238; discussion 1238-1239. PMID: 2671399 https://doi.org/ 10.1097/00005373198909000-00008
19. Lee MJ, O’Connell DJ. The plain chest radiograph after acute smoke inhalation. Clin Radiol. 1988;39(1):33-37. PMID: 3338239 https://doi. org/10.1016/s0009-9260(88)80334-9
20. Wittram C, Kenny JB. The admission chest radiograph after acute inhalation injury and burns. Br J Radiol. 1994;67(800):751-754. PMID: 8087478 https://doi.org/10.1259/0007-1285-67-800-751
21. Rebrova O.Yu. Statisticheskiy analiz meditsinskikh dannykh. Primenenie paketa prikladnykh programm STATISTICA. Moscow: MediaSfera Publ.; 2003. (in Russ.)
22. Shakhov BE, Safonov DV. Transtorakal’noe ul’trazvukovoe issledovanie legkikh i plevry. N. Novgorod: Izd-vo NGMA Publ.; 2002. (in Russ.)
23. Sokolova EP, Trofimova EYu, Danielyan ShN. Ultrasound Lung Injury Pattern in Case of Blunt Thoracic Trauma. Ultrasound & Functional Diagnostics. 2015;(3):66-73. (in Russ.)
24. Makarov AV, Mironov AV, Galankina IY, Smirnov SV, Ponomaryov IN, Borovkova NV. The Effect of Early Fibrobronchoscopic Sanitation with Human Collagen Type 1 on Epithelization of Damaged Tracheal and Bronchial Mucosa in Patients With Inhalation Injury. Russian Sklifosovsky Journal “Emergency Medical Care”. 2018;7(2):111-116. (In Russ.) https://doi.org/10.23934/2223-9022-2018-7-2-111-116
25. Beresneva EA, Smirnov SV, Sheviakova SV, Brygin PA, Poliakova IN, Klychnikova EV. The Value of X-Ray and Laboratory Investigations in the Casualties Suffered from the Exposure to the Flame and Combustion Products during the Fire (in the “Lame Horse” Nightclub, Perm, 2009). Safety and Emergencies Problems. 2012;(1):17-33. (in Russ.)
26. Endorf FW, Gamelli RL. Inhalation injury, pulmonary perturbations, and fluid resuscitation. J Burn Care Res. 2007;28(1):80-83. PMID: 17211205 https://doi.org/10.1097/BCR.0B013E31802C889F
27. Zimina LN, Barinova MV, Polozov MA, Mikhailova GV, Rozumny PA, Sakharov GY, at al. Evaluation of Lethality Caused by Acute Poisoning with Psychoactive Drugs in Elderly and Senile Patients in N.V. Sklifosovsky Research Institute for Emergency Medicine during 2013-2015. Russian Sklifosovsky Journal “Emergency Medical Care”. 2017;6(4):318-323. (In Russ.) https://doi.org/10.23934/2223-9022-2017-6-4-318-323
ИНФОРМАЦИЯ ОБ АВТОРАХ Береснева Эра Арсеньевна
Спиридонова Тамара Георгиевна
Жиркова Елена Александровна
Баринова Мария Васильевна
Семенова Татьяна Ивановна
Брыгин Павел Александрович
Забавская Ольга Александровна
Соколова Екатерина Павловна
Лапшина Екатерина Александровна Орлов Александр Сергеевич
доктор медицинских наук, профессор, научный консультант отделения лучевой диагностики ГБУЗ «НИИ им. Н.В. Склифосовского ДЗМ», https://orcid.org/0000-0002-7251-1112
доктор медицинских наук, научный консультант отделения острых термических поражений ГБУЗ «НИИ им. Н.В. Склифосовского ДЗМ», https://orcid.org/0000-0001-7070-8512
кандидат медицинских наук, научный сотрудник отделения острых термических поражений ГБУЗ «НИИ им. Н.В. Склифосовского ДЗМ», https://orcid.org/0000-0002-9862-0229
кандидат биологических наук, научный сотрудник лаборатории электронной микроскопии ГБУЗ «НИИ им. Н.В. Склифосовского ДЗМ», https://orcid.org/0000-0002-7774-0803
заведующая кабинетом функциональной диагностики лаборатории клинической физиологии ГБУЗ «НИИ им. Н.В. Склифосовского ДЗМ», https://orcid.org/0000-0002-5680-4222
кандидат медицинских наук, заведующий отделением реанимации и интенсивной терапии для ожоговых больных ГБУЗ «НИИ им.. org/0000-0001-6893-7973
кандидат медицинских наук, научный сотрудник отделения ультразвуковых методов исследования и мини-инвазивных методов лечения с использованием ультразвука ГБУЗ «НИИ им. Н.В. Склифосовского ДЗМ», https://orcid.org/0000-0002-0446-8781
врач-рентгенолог отделения лучевой диагностики ГБУЗ «НИИ им. Н.В. Склифосовского ДЗМ», https://orcid.org/0000-0002-6565-115X
врач-терапевт отделения острых термических поражений ГБУЗ «НИИ им. Н.В. Склифосовского ДЗМ», https://orcid.org/0000-0002-0489-8482
Received on 22.03.2019 Accepted on 19.04.2019
Поступила в редакцию 22.03.2019 Принята к печати 19.04.2019
The Importance of X-Ray in Examination of Lungs in Patients with Inhalation Trauma
E.A. Beresneva, T.G. Spiridonova*, E.A. Zhirkova, M.V. Barinova, T.I. Semenova, P.A. Brygin, O.A. Zabavskaya, E.P. Sokolova, EA. Lapshina, A.S. Orlov
Department of Radiation Diagnostics
N.V. Sklifosovsky research Institute for Emergency Medicine of the Moscow Health Department 3 Bolshaya Sukharevskaya Square, Moscow 129090, Russian Federation
* Contacts: Tamara G. Spiridonova, Doctor of Medical Sciences, Scientific Consultant of the Department of Acute Thermal Lesions, N.V. Sklifosovsky Research Institute for Emergency Medicine of the Moscow Health Department. Email: [email protected]. ru
relevance
Inhalation trauma (IT) is a combined injury of the respiratory tract, lung parenchyma and the central nervous system. Alterations of a mucous membrane during thermochemical airway burn as a result of inhalation of combustion products is most fully described in the literature, while the lesion of pulmonary parenchyma hasn’t been studied.
the aim of the study
To determine the capabilities and significance of the X-ray method in the study of lungs in patients with IT.
material and methods
We examined 184 victims with IT, of which 53 patients had airways burn of the 1st degree, 92 patients had airways burn of the 2nd degree, and 39 patients had airways burn of the 3rd degree. Methods used: X-ray, chest X-ray computed tomography, ultrasound of the chest, study of the function of external respiration, morphological examination of lungs, statistical methods.
results
X-ray studies in patients with IT revealed changes in peripheral parts of both lungs like network deformation of pulmonary pattern to forms resembling “mulberries” or “a bunch of grapes”. A study of the function of external respiration revealed signs of decreased lung ventilation and obstructive changes in bronchioles. The X-ray computed tomography of peripheral regions of the lungs in some patients revealed multiple local areas of reduced density with no visible walls corresponding to alveoli holding the air. Histological examination of the peripheral parts of the lungs found round air formations and significantly expanded alveoli. These changes are associated with exhalation disorders due to the constriction of respiratory bronchioles.
conclusion
The X-ray method allows to detect signs of damage to the pulmonary parenchyma in patients with IT. Using a statistical evaluation, we showed that the presence of network deformation of the pulmonary pattern under the conditions of IT is an objective feature, confirmed with Cohen’s kappa coefficient (0.6±0.14; 95% CI [0.32-0.88]).
Keywords isolated inhalation trauma, X-ray of the lungs, X-ray computed tomography, network deformation of pulmonary pattern, airway burn, function of external respiration, morphological examination of the peripheral parts of the lungs
For citation Beresneva EA, Spiridonova TG, Zhirkova EA, Barinova MV, Semenova TI, Brygin PA, et al. The Importance of X-Ray in Examination of Lungs in Patients with Inhalation Trauma. Russian Sklifosovsky Journal of Emergency Medical Care. 2019;8(3):279-287. DOI: 10.23934/2223-9022-2019-8-3-279-287 (in Russ.) Conflict of interes Authors declare lack of the conflicts of interests Acknowledgment The study had no sponsorship
Affiliations
Era A. Beresneva
Tamara G. Spiridonova Elena A. Zhirkova Maria V. Barinova Tatyana I. Semenova Pavel A. Brygin
Olga A. Zabavskaya
Ekaterina P. Sokolova
Ekaterina A. Lapshina Aleksandr S. Orlov
Doctor of Medical Sciences, Professor, Scientific Consultant of the Department of Radiation Diagnostics, N.V. Sklifosovsky Research Institute for Emergency Medicine of the Moscow Health Department, https://orcid.org/0000-0002-7251-1112
Doctor of Medical Sciences, Scientific Consultant of the Department of Acute Thermal Lesions, N.V Sklifosovsky Research Institute for Emergency Medicine of the Moscow Health Department, https://orcid.org/0000-0001-7070-8512
Candidate of Medical Sciences, Researcher of the Department of Acute Thermal Lesions, N.V Sklifosovsky Research Institute for Emergency Medicine of the Moscow Health Department, https://orcid.org/0000-0002-9862-0229
Candidate of Biological Sciences, Researcher of the Laboratory of Electron Microscopy, N.V Sklifosovsky Research Institute for Emergency Medicine of the Moscow Health Department, https://orcid.org/0000-0002-7774-0803
Head of the Functional Diagnostics Room of the Laboratory of Clinical Physiology, N.V. Sklifosovsky Research Institute for Emergency Medicine of the Moscow Health Department, https://orcid.org/0000-0002-5680-4222
Candidate of Medical Sciences, Head of the Department of Resuscitation and Intensive Care for Burn Patients, N.V Sklifosovsky Research Institute for Emergency Medicine of the Moscow Health Department, https://orcid.org/0000-0002-8511-9646
Candidate of Medical Sciences, Senior Researcher of the Department of Computed and Magnetic Resonance Imaging, N.V Sklifosovsky Research Institute for Emergency Medicine of the Moscow Health Department, https://orcid.org/0000-0001-6893-7973
Candidate of Medical Sciences, Researcher of the Department of Ultrasound Research Methods and Minimally Invasive Treatment Methods with Ultrasound, N.V Sklifosovsky Research Institute for Emergency Medicine of the Moscow Health Department, https://orcid.org/0000-0002-0446-8781
Radiologist of the Department of Diagnostic Radiology, N.V. Sklifosovsky Research Institute for Emergency Medicine of the Moscow Health Department, https://orcid.org/0000-0002-6565-115X
General Practitioner of the Department for Acute Thermal Lesions, N.V. Sklifosovsky Research Institute for Emergency Medicine of the Moscow Health Department, https://orcid.org/0000-0002-0489-8482
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку “Назад” и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Понимание ILD | Программа лечения интерстициальных заболеваний легких
Часто задаваемые вопросы о кислороде
- Q. Почему некоторым пациентам с ILD необходимо использовать дополнительный кислород?
- А.Задача легких – переносить вдыхаемый кислород в кровоток, а также удалять (выдыхать) углекислый газ из кровотока и легких. Перенос этих газов происходит прямо в интерстициальном пространстве, «стенке» между воздушным сосудом (альвеолами) и кровеносным сосудом (капилляром). При ILD вокруг этой области между воздушным сосудом и кровеносным сосудом (альвеолярно-капиллярная мембрана) может образовываться воспаление и / или рубцовая ткань, и эта область становится утолщенной. Эти изменения в интерстиции замедляют перемещение кислорода из воздушных мешков в кровоток, особенно в периоды физической активности.Когда уровень кислорода в крови падает, у многих людей возникает одышка, что ограничивает их повседневную деятельность. Нормальный уровень кислорода 96-98% измеряется пульсоксиметром на кончике пальца или на лбу. Как правило, уровень кислорода должен поддерживаться выше 88-90% по данным пульсоксиметра.
Q. Как узнать, нужен ли мне кислород?
A. Кислород не назначается на основании того, как вы себя чувствуете, а вместо этого назначается путем определения уровня кислорода в различных условиях отдыха, напряжения, а иногда и во время сна.Если результаты тестирования показывают, что у вас уровень кислорода ниже 89%, вам могут назначить дополнительный кислород. Уровень кислорода можно проверить с помощью теста с шестиминутной ходьбой или оксиметрии с физической нагрузкой:
1. Тест на шестиминутную ходьбу: Во время этой формальной процедуры тестирования терапевт даст вам инструкции пройти, чтобы преодолеть как можно большее расстояние за шесть минут. Они будут проверять уровень кислорода перед тем, как вы начнете, либо во время ходьбы, либо сразу после остановки. Если у вас уровень кислорода ниже 89%, вы соответствуете национальным критериям (Medicare) по использованию кислорода при физической активности.
2. Титрование кислорода: это более неформальный тест, который не только проверяет, не падает ли уровень кислорода во время ходьбы, но и определяет, сколько кислорода (какой расход или количество литров) вам нужно («рецепт кислорода» ), чтобы поддерживать уровень выше 88%. Если вы обесцвечиваетесь ниже 89% при ходьбе во время этого теста без использования кислорода, терапевт проверит ваш уровень кислорода при использовании кислорода со скоростью 2 литра в минуту (л / мин), и если ваши цифры не выше 88%, он будет ходить с вами. снова с использованием кислорода увеличили до 4 л / мин.Тестирование будет продолжаться до тех пор, пока не будет определен правильный литровый поток кислорода, который поддерживает ваше насыщение на уровне 88-90% или выше. Это будет ваш рецепт на кислород, который вы будете использовать при физической нагрузке (ходьба, работа по дому, душ и т. Д.).
3. Если у вас уровень кислорода ниже 89% в состоянии покоя, вам также будет прописан кислород в состоянии покоя.
4. Ваш врач может также попросить провести ночной оксиметрический тест, чтобы проверить, не происходит ли обесцвечивание во время сна.
- В. Когда мне следует использовать кислород?
- А.У вас должен быть специальный «рецепт на кислород» от врача на использование кислорода во время отдыха, физических упражнений и / или сна. Если вы не знаете, сколько кислорода использовать или когда использовать, поговорите со своим лечащим врачом, чтобы уточнить, какие настройки расхода или количества литров вам следует использовать для отдыха, упражнений и сна. Если вы обесцвечиваете только с помощью напряжения, вы будете использовать его только с упражнениями. Если у вас всегда низкий уровень кислорода, даже когда вы сидите спокойно, то ваш врач может прописать кислород, который нужно носить круглосуточно.
- Q. Как я могу проверить уровень кислорода дома?
- A. Вы можете контролировать уровень кислорода дома с помощью пульсоксиметра, который можно приобрести в Интернете или в аптеке без рецепта. К сожалению, страховка их не покрывает.
- Q. Какие типы кислородного оборудования я буду использовать?
- A. Важно быть проинформированным о различных вариантах кислородного оборудования для использования дома и когда вы находитесь вне дома – вы можете просмотреть дополнительные ресурсы здесь, а также обсудить это со своим врачом и поставщиком кислорода.Также очень полезно поговорить с другими пациентами, которые используют дополнительный кислород, чтобы увидеть, что им подходит, и узнать, как они используют различные типы оборудования. Некоторые кислородные компании (называемые поставщиками медицинского оборудования длительного пользования) предлагают различные типы оборудования, поэтому вам может потребоваться немного «поискать», если у вас есть особые потребности, например, если вы работаете и будете нуждаться в кислороде весь день. в офисе, или если вы часто путешествуете, или если в вашем доме много ступеней лестницы.
- Q. Каковы преимущества использования кислорода?
- A. Физиологические преимущества использования дополнительного кислорода (улучшенная выживаемость, профилактика легочной гипотензии, меньшее количество госпитализаций) не были хорошо изучены у пациентов с ILD. Существуют исторические (1980) данные, подтверждающие пользу кислорода для пациентов с тяжелой эмфиземой, но у нас нет таких же данных для пациентов с ILD. Некоторые исследования у пациентов с ILD документально подтвердили повышенный уровень активности и меньшую одышку, однако сообщаемые преимущества использования кислорода сильно различаются среди пациентов с ILD.Некоторые не сообщают о значительном улучшении одышки при использовании дополнительного кислорода, в то время как другие пациенты сообщают, что использование кислорода при физической нагрузке позволяет им больше тренироваться, предотвращает учащенное сердцебиение, уменьшает кашель и позволяет им выйти из дома. чаще и вести более активный образ жизни. Если врач прописал вам кислород, важно обсудить, чего вы должны разумно ожидать, а также назначить повторный прием после начала использования кислорода для повторной оценки.
- Участие в группе поддержки ILD поможет вам приспособиться к жизни с кислородом, поскольку вы можете поговорить с другими, кто использует кислород, чтобы получить их советы и опыт. Мы рекомендуем пациентам следовать инструкциям их врачей по использованию кислорода, но только после тщательного обсуждения между вами и вашим врачом ожиданий в отношении его пользы. При каждом посещении следует проверять, как вы используете кислород.
- Q. Что делать, если мне прописали кислород, но я решил не использовать его?
- А.Некоторые пациенты с незначительным снижением уровня кислорода могут не чувствовать одышку или обнаруживать, что они могут быть более активными при использовании кислорода. Для других использование кислорода может привести к значительному улучшению способности выполнять упражнения и выходить из дома, работать и путешествовать. Если ваш врач порекомендует кислород на основе результатов вашего тестирования, а вы решите не использовать его, важно продолжать наблюдение за вашей медицинской бригадой и регулярно проходить повторное тестирование (каждые 3-6 месяцев). Ваш врач может также назначить эхокардиограмму, чтобы оценить функцию вашего сердца и выяснить, не вызывает ли низкий уровень кислорода некоторое напряжение правых отделов сердца и легочную гипертензию.Если у вас низкий уровень кислорода в состоянии покоя, особенно важно использовать кислород в соответствии с предписаниями, поскольку невыполнение этого требования может вызвать большую нагрузку на ваше сердце.
- Q. Как узнать, достаточно ли я получаю кислорода?
- A. Пациенты должны стараться поддерживать уровень насыщения кислородом выше 88-90% в течение дня и ночи. Пульсоксиметры Finger (продаются без рецепта во многих аптеках) позволяют контролировать уровень кислорода дома или в дороге.Точно так же, как пациенты с диабетом проверяют уровень сахара в крови в течение дня и корректируют дозу инсулина для оптимизации уровня сахара в крови, пациенты с ILD должны точно так же контролировать уровень кислорода в крови в соответствии с указаниями своих медицинских работников. После того, как вы проверили свой уровень с помощью различных упражнений, вам не нужно проверять его так часто, но только если вы чувствуете изменение своих симптомов.
Визуализация острого респираторного дистресс-синдрома
Введение
Острый респираторный дистресс-синдром (ОРДС) – это тяжелая форма острого повреждения легких (ОПЛ), при которой риск смерти составляет до 50%. 1 Патологически ОРДС характеризуется диффузным альвеолярным повреждением, которое создается аномальной альвеолярно-капиллярной проницаемостью, что приводит к притоку белка и жидкости в альвеолы и интерстициальные пространства. Этот процесс вызван повреждением альвеол, вторичным по отношению к одному (или нескольким) из многих провоцирующих поражений, включая сепсис и токсические травмы при дыхании. Последующее отложение фибрина и образование коллагена может привести к фиброзу легких.
ARDS и ALI существуют в одном и том же спектре клинических признаков, патофизиологии и рентгенологических проявлений.Термин ARDS зарезервирован для наиболее тяжелой части этого спектра, когда P aO 2 / F IO 2 составляет <200 мм рт. Ст., В отличие от <300 мм рт. В этом смысле все пациенты с ОРДС имеют ОПЗ, но не все пациенты с ОРДС. 2 Однако для определения как ОРДС, так и ОПЛ необходимо наличие двусторонних инфильтратов на рентгенограмме грудной клетки. 2
Таким образом, визуализация играет важную роль в диагностике ОРДС, а также может дать ключ к пониманию этиологии и хронического характера заболевания.В начале этой статьи следует подчеркнуть, что радиологические признаки сами по себе неспецифичны, и корреляция с клиническими данными является обязательной. Например, этиология ОРДС может быть классифицирована как прямая (легочный ОРДС) или косвенная (нелегочный ОРДС), и эти категории, в свою очередь, могут иметь различные радиологические проявления. Однако в клинической практике сложные пациенты с ОРДС часто имеют комбинацию легочных и нелегочных патологий, и точную причину трудно определить только радиологическими методами. 3 Помимо постановки диагноза, визуализация играет важную роль в мониторинге ОРДС и в выявлении клинических осложнений. Также все чаще демонстрируется, что он предоставляет прогностическую информацию. В этой статье будет рассмотрена роль визуализации (в основном компьютерной томографии [КТ]) в диагностике и ведении пациентов с ОРДС.
Обычная рентгенография грудной клетки
Простая рентгенограмма грудной клетки – это ценный тест, который может подтвердить диагноз, подтвердить положение трубок и линий, контролировать прогрессирование легочной болезни и обнаружить осложнения при ОРДС.Простые рентгенологические проявления ОРДС варьируются в зависимости от стадии заболевания, но эти особенности обычно стереотипны независимо от причины. Несмотря на значительное совпадение, рентгенологические стадии болезни в целом коррелируют с гистопатологическими стадиями, описанными ниже.
Экссудативная или острая фаза (1–7 дней)
Обычно имеется скрытый рентгенологический период в первые 24 часа после первичного инсульта, вызывающего ОРДС, и рентгенограмма грудной клетки часто бывает нормальной. 4 Исключение составляют случаи, когда ОРДС вызван прямым повреждением легких (например, пневмония), и в этом случае может наблюдаться уплотнение. В последующие 24–72 часа наблюдается быстрое ухудшение. Повреждение эндотелия приводит к повышенной проницаемости капилляров и притоку богатой белком жидкости в альвеолярное пространство и интерстиций, что способствует отеку легких. Воздушное пространство и интерстициальные помутнения на рентгенограмме грудной клетки при ОРДС преимущественно двусторонние и симметричные. 5 Кардиогенный отек легких является основным рентгенографическим дифференциальным диагнозом, но без временных изменений; отсутствие кардиомегалии, перегородок или плевральной жидкости; а также наличие периферических помутнений альвеол в пользу ОРДС. На практике ОРДС и кардиогенный отек легких могут сосуществовать, и попытка провести различие между ними часто бывает затруднительно, используя только рентгенографию грудной клетки.
Пролиферативная или промежуточная фаза (8–14 дней)
После быстрого развития рентгенологических изменений в острой фазе ОРДС внешний вид обычно стабилизируется и остается неизменным в течение переменного периода времени (рис.1). Во время промежуточной фазы на рентгенограмме грудной клетки могут развиться диффузные грубые ретикулярные помутнения, хотя это не означает необратимого фиброза, поскольку помутнения могут исчезнуть. Важно знать об этом стабильном периоде в рентгенологических проявлениях болезни, поскольку новые помутнения воздушного пространства, вероятно, будут представлять собой инфекцию или другие осложнения, выходящие за рамки естественного течения ОРДС.
Рис. 1.A: Рентгенограмма грудной клетки пациента с ОРДС показывает двусторонние инфильтраты.Имеется двустороннее уплотнение и правый плевральный выпот. B: Рентгенограмма грудной клетки того же пациента показывает стойкие двусторонние инфильтраты через 7 дней.
Фиброзная или поздняя фаза (> 15 дней)
Если пациент выживает в острой фазе ОРДС, большинство рентгенографических отклонений начинают исчезать на поздней стадии. Скорость и продолжительность выздоровления различны и зависят от различных факторов, включая сопутствующие заболевания. Действительно, рентгенограмма грудной клетки в заключительной фазе может варьироваться от полностью нормальных до широко распространенных грубых ретикулярных помутнений. 4
Компьютерная томография в ARDS
С тех пор, как впервые были описаны признаки КТ при ОРДС, 6 использование КТ при ОРДС стало широко распространенным как в клинических, так и в исследовательских целях. КТ оказалась полезной не только как инструмент подтверждения и решения проблем, но и новые исследования показали потенциал для классификации и прогнозирования ОРДС. Конечно, преимущества компьютерной томографии в клинических условиях следует сопоставлять с практическими аспектами и рисками, связанными с транспортировкой пациента из отделения интенсивной терапии в отделение радиологии.
Ранняя стадия
Классический вид острой фазы ОРДС на КТ – помутнение, которое демонстрирует передне-задний градиент плотности в легком с плотной консолидацией в наиболее зависимых областях, сливающейся с фоном широко распространенного ослабления матового стекла, а затем нормального или гиперэкспандированного легкого в независимых регионах (рис. 2). Помутнение матового стекла на КТ – неспецифический признак, который отражает общее снижение содержания воздуха в пораженном легком.В случае острого ОРДС это, вероятно, связано с отеком и белком в интерстиции и альвеолах. Другой важной наблюдаемой особенностью при остром ОРДС является расширение бронхов в областях помутнения матового стекла (рис. 3). Хотя это может быть индикатором развития раннего фиброза (так называемого тракционного бронхоэктаза), этот признак нельзя рассматривать как убедительное доказательство фиброза, потому что обращение вспять дилатации бронхов на более поздних стадиях ОРДС – хорошо известное явление. 7
Рис. 2.Компьютерная томограмма пациента с ОРДС показывает двустороннюю плотную зависимую консолидацию с участками помутнения матового стекла и нормальным легким в независимом легком.
Рис. 3.Компьютерная томограмма при ОРДС показывает двустороннюю ретикуляцию и помутнение матового стекла с участками расширения бронхов в верхних долях. В острой фазе ОРДС расширение бронхов может указывать на фиброз или может быть обратимым. Также обратите внимание на пневмомедиастинум, идентифицированный компьютерной томограммой.
Теория неоднородности внешнего вида при ОРДС заключается в том, что увеличенный вес вышележащего легкого вызывает компрессионный ателектаз в задней части, который вызывает плотное помутнение. Теория подтверждается тем фактом, что при изменении положения пациента с ОРДС с лежа на спине на лежание градиент плотности соответственно быстро перераспределяется. 8
В независимых частях легкое может иметь нормальное ослабление или даже меньше, если у пациента выполняется искусственная вентиляция легких.Выявление плотной консолидации в независимых областях легкого всегда должно предупреждать клинициста о возможности инфекционной консолидации либо от уже существующей пневмонии (которая могла быть преждевременным состоянием при ОРДС), либо от новой пневмонии, связанной с вентиляцией (рис. 4).
Рис. 4.Компьютерная томограмма средних зон пациента с ОРДС показывает двустороннее помутнение матового стекла. Обратите внимание на наличие независимой консолидации в правой нижней доле, что повышает вероятность заражения.Пищеводный стент является случайным.
Поздняя фаза и появление у длительно переживших ОРДС
После острой фазы КТ видимость различна. Хотя может произойти полное разрешение аномалий, более типичными проявлениями КТ на поздних стадиях являются грубый ретикулярный узор и помутнение матового стекла в передней (независимой) части легких. 9,10 Выводы о значении явлений у выживших после ОРДС всегда ограничиваются отсутствием сопутствующей гистопатологии у большинства пациентов.Тем не менее, в этом случае, вероятно, что помутнения матового стекла представляют собой области тонкого фиброза, которые слишком малы, чтобы их можно было разрешить на КТ. Также можно предположить, что фиброз развивается у этих пациентов как следствие баротравмы, вторичной по отношению к механической вентиляции в независимом легком, с консолидацией и ателектазом, обеспечивающими относительную защиту более зависимым областям.
В более позднем исследовании также сообщается о менее классическом распределении болезни у выживших после ОРДС.Masclans et al. 11 обнаружили, что 76% пациентов имели аномалии на КТ высокого разрешения через 6 месяцев наблюдения, которые, как правило, представляли собой области ретикулярного помутнения и матового стекла. Однако у большинства пациентов заболевание было диффузным, и лишь примерно у трети из них наблюдались более классические исключительно передние изменения. У меньшего числа (18%) также были выявлены исключительно задние аномалии. Исследование также подтвердило вывод о том, что заболевание дыхательных путей (предположительно означающее тракционные бронхоэктазы) было обычным явлением, что снова указывает на основной фиброз легких у этих пациентов.
Кисты легких разного размера и буллы также являются признаком более поздних стадий ОРДС и, вероятно, развиваются в результате длительной вентиляции. 12 (рис. 5). Однако известно, что легочные кисты возникают вторично по отношению к пневмонии и не обязательно связаны с эпизодом длительной вентиляции. 10
Рис. 5.A: Компьютерная томограмма показывает двустороннюю зависимую консолидацию у пациента с ОРДС, а также помутнение матового стекла в независимом легком.B: Контрольная компьютерная томограмма через 1 год показывает разрешение консолидации и помутнение матового стекла с образованием кисты в передней части левого легкого.
Небольшие, но существенные различия были описаны при последующем наблюдении между разными группами пациентов с ОРДС. Более высокие уровни фиброза легких выявляются на КТ у пациентов, которые проводили наибольшее время на ИВЛ и имели самые высокие значения ПДКВ. 9 Кроме того, строго разделив пациентов на группы с легочным и нелегочным ОРДС, было показано, что у выживших с легочным ОРДС с большей вероятностью будет фиброз легких на КТ. 13 Было высказано предположение, что это связано с тем, что пациенты с легочным ОРДС менее чувствительны к рекрутированию альвеол и, следовательно, более склонны к повреждению легких, вызванному вентилятором.
CT при ОРДС: может ли он определить этиологию?
Этиология ОРДС может иметь значение для клинического ведения, потому что искусственная вентиляция легких у пациентов с ОРДС и внелегочными формами может различаться. Податливость легких ниже у пациентов с легочным ОРДС, а увеличение ПДКВ имеет тенденцию еще больше снижать податливость легких.И наоборот, при внелегочном ОРДС повышение ПДКВ может иметь желаемый эффект, так как имеет тенденцию к увеличению эластичности легких. 14
Имея это в виду, можно было бы использовать в клинической практике, если бы КТ могла определить, является ли причина ОРДС внутрилегочной или внелегочной. Исследования показали, что типичная картина КТ (симметричное помутнение матового стекла с переднезадним градиентом от плотной консолидации до нормально аэрируемого легкого) чаще ассоциируется с внелегочным ОРДС. 15,16 При ОРДС в легких распределение изменений в легких с большей вероятностью будет асимметричным, со смешанной картиной помутнения матового стекла, независимой плотной консолидации и паренхиматозных кист. 15,16 Считается, что другие признаки, такие как плевральный выпот и воздушные бронхограммы, одинаково характерны для обоих типов ОРДС. 16
Однако вопрос о том, достаточно ли сильны эти ассоциации, чтобы надежно использовать КТ для определения причины ОРДС. В клинической практике часто бывает трудно приписать одну причину ОРДС.Таким образом, КТ нельзя регулярно рекомендовать как метод определения причины ОРДС, а скорее как инструмент для подтверждения диагноза и его осложнений.
КТ в ОРДС: инструмент для выявления осложнений
КТ не требуется для выполнения диагностических критериев ОРДС, но, учитывая диффузное помутнение, которое характерно для этого состояния, рентгенограмма грудной клетки может быть ограничена с точки зрения выявления осложнений, и именно здесь может быть выполнено поперечное сечение с помощью КТ. помощи.
У пациента с ОРДС, состояние которого ухудшается, КТ может выявить различные связанные с вентиляцией осложнения и очаги инфекции, которые могут быть не видны на переднезадней рентгенограмме грудной клетки в положении лежа на спине в отделении интенсивной терапии. Последствия механической вентиляции легких, которые легче обнаружить при КТ, включают пневмонию, абсцессы, пневмоторакс, пневмомедиастинум и интерстициальную эмфизему легких. Также можно определить положение эндотрахеальной трубки и определить коллапс легкого из-за неправильного положения.
CT при ОРДС: можно ли использовать его для прямой вентиляции?
Основой управления ОРДС является искусственная вентиляция легких. Эта спасающая жизнь терапия также является инвазивной и может вызвать баротравму и долгосрочное повреждение легких. Вербовка – это термин, обозначающий количество ранее разрушенных ацинусов, которые можно надуть при заданном давлении. Увеличение ПДКВ задействует больше легких в конце спектра с более высоким давлением. Однако повышенное давление вентиляции может вызвать баротравму легкого, которую можно было бы успешно вентилировать при более низком давлении.Это означает, что существует компромисс между привлечением большего количества ацинусов для газообмена и причинением связанного с вентилятором повреждения легких. На КТ легко идентифицировать коллапс легкого, а в случае ОРДС это, вероятно, зависимое легкое, спавшееся из-за увеличенного веса вышележащего легкого. Gattinoni et al. –17– предложили выполнить ограниченную КТ легких с использованием всего 2–3 срезов на вдохе, выдохе и с разными значениями PEEP в качестве средства управления настройками аппарата ИВЛ.Получая КТ-изображения при различных настройках аппарата ИВЛ, можно оценить потенциал рекрутмента, определив степень ателектатического легкого и его реакцию на вентиляцию. Кроме того, даже с этими ограниченными секциями КТ может предоставить возможность отличить ателектатическое легкое от областей консолидации, которые не поддаются рекрутменту. 18
КТ как средство прогнозирования при ОРДС
Ограниченные исследования изучали, могут ли результаты КТ при раннем ОРДС предсказать долгосрочный исход у людей.Итикадо и др. Измерили степень заболевания с помощью КТ-исследований, проведенных в течение одной недели после начала ОРДС, и обнаружили, что наличие фиброза (на которое указывают помутнение матового стекла, тяговые бронхоэктазы и соты) было сильным независимым предиктором смертности. 19 В другом исследовании также было обнаружено, что наличие тракционных бронхоэктазов является предиктором неблагоприятного исхода наряду с заболеванием, поражающим более 80% легких, и признаками повышенного давления в правом отделе сердца (дилатация легочной артерии и увеличенный правый желудочек) . 20 Это исследование также показало, что пациенты с чисто консолидированной картиной болезни на ранних стадиях имеют больше шансов на выживание. Смысл этого наблюдения заключается в том, что, поскольку консолидация не является маркером фиброзных изменений, для этой группы пациентов существует более благоприятный исход, что косвенно подтверждает вывод о том, что ранний фиброз при ОРДС связан с более высоким риском смерти.
результатов КТ при пневмонии, вызванной новым коронавирусом (COVID-19), при первичной презентации
Предпосылки .COVID-19 впервые разразился в Китае и быстро распространился по миру. Цели . Описать особенности компьютерной томографии пневмонии COVID-19 и поделиться нашим опытом при первоначальной диагностике. Пациенты и методы . Были собраны данные от 53 пациентов (31 мужчина, 22 женщины; средний возраст 53 года; возрастной диапазон 16-83 года) с подтвержденной пневмонией COVID-19. Их полные клинические данные были рассмотрены, а их КТ-характеристики были записаны и проанализированы. Результаты . Среднее время между началом заболевания и первичной компьютерной томографией составляло шесть дней (диапазон от 1 до 42 дней).Всего 399 сегментов были вовлечены и распределены с двух сторон (левое легкое: 186 сегментов [46,6%], правое легкое: 213 сегментов [53,4%]) и периферически (38 [71,7%] пациентов). Чаще всего участвовали множественные доли (45 [84,9%]) и двусторонние нижние доли (левая нижняя доля: 104 [26,1%], правая нижняя доля: 107 [26,8%], всего: 211 [52,9%]). Основные результаты исследования – матовое стекло с уплотнением (24 [45,3%]) и матовое стекло (28 [52,8%]). Другие находки были сумасшедшими (14 [26.4%]), бронхоэктазы (12 [22,6%]), ателектаз (7 [13,2%]), паренхиматозные тяжи (6 [11,3%]), воздушная бронхограмма (6 [11,3%]), межлобулярное утолщение (5 [9,4%]). ]), ретикулярный узор (1 [1,9%]) и плевральный выпот (1 [1,9%]). Выводы . У большинства пациентов с пневмонией COVID-19 при первичном обращении были обнаружены отклонения на КТ-изображениях грудной клетки. Функции визуализации в сочетании с историей облучения пациента и появлением симптомов могут облегчить идентификацию подозреваемого пациента для дальнейшего обследования.
1. Введение
В декабре 2019 года в Ухане (столице провинции Хубэй в центральном Китае) вспыхнула эпидемия новой коронавирусной инфекции. Первоначально считалось, что инфицированные люди имеют прямую связь с оптовым рынком морепродуктов Хуанань. С 31 декабря 2019 г. по 3 января 2020 г. в ВОЗ поступили сообщения о 44 пациентах с пневмонией неустановленной этиологии [1]. Когда эта инфекция разразилась во время весенних праздников, она быстро распространилась по всем провинциям Китая, и впоследствии случаи были обнаружены в 26 странах мира [2].По состоянию на 25 марта -го числа 2020 года во всем мире зарегистрировано 372 757 подтвержденных случаев заболевания и 16 231 смертельный исход [3].
7 января 2020 года Уханьский институт вирусологии Китайской академии наук выделил новый тип коронавируса (SARS-CoV-2). SARS-CoV-2 был определен китайскими властями как возбудитель вируса 7 января 2020 года. Этот новый коронавирус ранее не обнаруживался у людей и 13 января 2020 года ВОЗ предварительно назвал новый коронавирус 2019 года (2019-nCoV). , и был официально назван COVID-19 11 февраля 2020 г. [4].
COVID-19 приводит к респираторным инфекциям, аналогичным инфекциям SARS и MERS, вызывая пневмонию, тяжелый острый респираторный синдром, почечную недостаточность и даже смерть. Данные свидетельствуют о том, что SARS-CoV-2 обычно менее патогенен, чем SARS-CoV, и гораздо менее патогенен, чем MERS-CoV [5]. Из-за того, что ранее зарегистрированные случаи смещены в сторону более тяжелых случаев на ранних стадиях эпидемии, уровень смертности был относительно высоким [5]. Но реальный риск смертности может быть намного ниже, и сообщалось, что уровень смертности от пневмонии составляет около 3% [5].Патологические находки COVID-19 показали, что он очень похож на те, которые наблюдаются при коронавирусных инфекциях SARS и MERS [2].
КТ – важный инструмент для выявления инфицированных пациентов и полезен для последующей оценки лечения. Хотя в литературе описаны признаки КТ пневмонии COVID-19, ни один из них не исключил пациентов с основными заболеваниями легких (такими как ХОБЛ, туберкулез легких и интерстициальное заболевание легких) в своих исследованиях.Эти заболевания могут иметь те же особенности и закономерности, что и вызванные пневмонией COVID-19. Здесь мы стремимся проанализировать и обсудить особенности КТ пневмонии COVID-19 у пациентов без тяжелого основного легочного заболевания и поделиться своим опытом в диагностике КТ.
2. Материалы и методы
Клинические данные и изображения пациентов, использованные в этом исследовании, были одобрены наблюдательным советом нашего учреждения, и конфиденциальность пациентов была хорошо защищена. Информированное согласие было отклонено наблюдательным советом этого ретроспективного исследования.
2.1. Пациенты
В период с декабря 2019 года по 20 февраля 2020 года 185 пациентов, инфицированных COVID-19, были подтверждены в Первом колледже клинической медицины, Китайском университете Трех ущелий и Центральной народной больнице Ичан. Некоторые пациенты () были исключены по следующим причинам: (а) артефакты дыхательных движений на КТ-изображениях, (б) неполные клинические данные и / или данные изображений, (в) тяжелое основное заболевание легких (включая тяжелый интерстициальный фиброз легких, тяжелую хроническую обструктивную легочную ткань). заболевание, пневмокониоз и туберкулез легких) и (d) первичная или вторичная опухоль легких.После отбора в наше исследование были включены 53 подходящих пациента (31 мужчина, средний возраст: годы, диапазон: 16-83 года) (рис. 1).
2.2. Обзор КТ-сканирований и изображений грудной клетки
Всем пациентам при первичном обращении было выполнено неулучшенное компьютерное сканирование грудной клетки (UCT, United Imaging, Шанхай, Китай; Ingenuity Flex, Philips, Нидерланды). Параметры сканирования были следующими: положение лежа, толщина: 2 мм или 5 мм, интервал: 5 мм, напряжение трубки: 130 кВ, ток трубки: 233 мА, сканирование во время вдоха и 1 секунда на сканирование.
Все данные изображений были переданы в системы архивирования и передачи изображений (PACS, United Imaging, Шанхай, Китай) и независимо проанализированы двумя радиологами (C.X. и J.L.) с более чем 10-летним опытом интерпретации изображений КТ грудной клетки. Были зарегистрированы и проанализированы местоположение, распределение, морфология, особенности компьютерной томографии и паттерны поражений. Разногласия разрешались консенсусом.
Характеристики КТ-изображения были записаны следующим образом: (а) расположение поражения (сегмент), (б) морфология (пятнистая, узловая и линейная), (в) распределение (одиночное или множественное, периферическое или / и центральное), ( г) тип (матовое стекло, уплотнение и линейное непрозрачность), (д) рисунок (сетка, паренхиматозные полосы, сумасшедшая дорожка и межлобулярное утолщение), (е) ателектаз, (ж) кавитация, (з) плевральный выпот , (i) внутригрудная лимфаденопатия или лимфаденопатия средостения, (j) бронхоэктазы, и (k) воздушная бронхограмма.Непрозрачность матового стекла определялась как повышенная мутность в легких, которая не затемняла бронхиальную и сосудистую архитектуру. Консолидацию определяли как однородно увеличенное помутнение в легком без четких границ сосудов и бронхов. Периферическое распространение определялось как поражение, расположенное на внешней трети легкого; в противном случае он был определен как центральный. Были отмечены другие отклонения, если таковые были.
2.3. Диагностические критерии
Мы использовали протоколы диагностики и лечения пневмонии COVID-19 (6 -е издание ), опубликованные Национальной комиссией здравоохранения Китайской Народной Республики [6].Подозрительные случаи включали любой из критериев эпидемиологии и любые два критерия клинических проявлений или любые три клинических проявления с неопределенным эпидемиологическим анамнезом. Эпидемиология и клинические проявления:
2.3.1. Эпидемиология
(1) История поездок в Ухань или проживания в нем или контакты с пациентами с респираторными симптомами и / или лихорадкой из Ухани в течение 14 дней до начала заболевания (2) Тесный контакт с пациентами с пневмонией, подтвержденными COVID-19 (3 ) Кластерная вспышка (внебольничная или внутрибольничная) пневмонии COVID-19
2.3.2. Клинические проявления
(1) Лихорадка и / или респираторные симптомы (2) КТ-признаки вирусной пневмонии (3) Нормальный уровень общих лейкоцитов или лейкопения и лимфоцитопения на ранней стадии. Подтвержденные случаи были диагностированы с помощью флуоресцентной полимеразной цепной реакции в реальном времени (ОТ-ПЦР) или высокой степени сходства с SARS-CoV-2 с помощью секвенирования следующего поколения
3. Результаты
Пятьдесят три пациента, инфицированных COVID-19 ( В наше исследование был включен 31 мужчина, средний возраст: годы, диапазон: 16-83 года, средняя температура: []).Семь пациентов (13,2%) (включая трех бессимптомных пациентов) имели историю воздействия, в то время как 46 пациентов (86,8%) (включая двух бессимптомных пациентов) не имели четкой истории воздействия. Начальные симптомы и заболеваемость были перечислены в таблице 1. Основными начавшимися симптомами были лихорадка (66,0%), кашель (39,6%), утомляемость (18,9%), миалгия (15,1%) и мокрота (15,1%). Среднее время между началом и начальной компьютерной томографией составляло шесть дней, диапазон от 1 до 42 дней. У всех пациентов была подтверждена инфекция COVID-19 с помощью ОТ-ПЦР.
| ||||||||||||||||||||||||||||||||||||||||||||||||
Из 53 пациентов 3 пациента показали нормальные результаты (5,7%) на первом КТ грудной клетки, но их второе КТ показало аномальные изменения (рис. 2).После анализа исходных данных компьютерной томографии было обнаружено 399 вовлеченных сегментов, в том числе 186 сегментов (46,6%) в левых долях и 213 сегментов (53,4%) в правых долях. В правой верхней доле 22 очага (5,5%) локализовались в переднем сегменте, 30 (7,5%) в заднем сегменте и 18 (4,5%) в апикальном сегменте. В правой средней доле 14 очагов (3,5%) были обнаружены в медиальном сегменте и 22 (5,5%) в латеральном сегменте. В правой нижней доле в медиальном базальном сегменте было обнаружено 8 очагов (2%), 18 (4.5%) в переднем базальном сегменте, 30 (7,5%) в латеральном базальном сегменте, 16 (4%) в верхнем сегменте и 35 (8,8%) в заднем базальном сегменте. В левой верхней доле было 22 поражения (5,5%) в верхнезаднем сегменте, 24 (6,0%) в переднем сегменте и 36 (9%) в лингвальном сегменте (включая верхний и нижний сегменты). В левой нижней доле было 11 поражений (2,8%) в медиальном базальном сегменте, 24 (6%) в переднем базальном сегменте, 24 (6%) в латеральном базальном сегменте, 17 (4.3%) в верхнем сегменте и 28 (7%) в заднем базальном сегменте (таблица 2).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Множественные доли были вовлечены у 45 пациентов (84,9%), а двустороннее распределение было обнаружено у 45 пациентов (84,9%). Восемь пациентов (15.1%) затрагивал одну долю, и из этих пациентов у 3 (5,7%) было одно поражение, включающее один сегмент (два расположены в заднем сегменте правой верхней доли и один – в переднем базальном сегменте левой нижней доли. ). Двусторонние нижние доли были наиболее часто пораженными (левая нижняя доля: 104 [26,1%], правая нижняя доля: 107 [26,8%] и общая нижняя доля: 211 [52,9%]). Из пораженных нижних долей передний базальный сегмент (слева: 24 [6%], справа: 18 [4,5%]), латеральный базальный сегмент (слева: 24 [6%], справа: 30 [7.5%]) и задний базальный сегмент (слева: 28 [7%], справа: 35 [8,8%]) были наиболее часто пораженными сегментами. Поражения, распределенные в периферической зоне, наблюдались у 38 пациентов (71,7%), а 15 поражений (28,3%) были обнаружены как в периферической, так и в центральной зоне поражения.
Двадцать четыре (45,3%) пациента показали непрозрачность матового стекла с консолидацией (Рисунок 2), 28 пациентов (52,8%) продемонстрировали чистое матовое стекло (Рисунок 3), и только у 1 пациента (1,9%) наблюдалась чистая консолидация (Рисунок 4).
Из 53 пациентов у 48 (90,6%) были обнаружены очаги морфологии (рис. 4), а у 11 пациентов (20,8%) были узловые (рис. 5). Сумасшедший рисунок мощения (Рисунок 6) был продемонстрирован у 14 пациентов (26,4%), паренхиматозные связки (Рисунок 7) у 6 пациентов (11,3%), воздушная бронхограмма (Рисунок 4) у 6 пациентов (11,3%), межлобулярное утолщение ( Рисунок 6) у 5 пациентов (9,4%), ретикулярный рисунок (Рисунок 8) у 1 (1,9%) пациента и плевральный выпот у 1 (1,9%) пациента. Бронхоэктазия обнаружена у 12 (22.6%) пациенты. Из 12 пациентов у троих наблюдались тракционные бронхоэктазы. Не было никаких доказательств внутригрудной лимфаденопатии или кавитации средостения (таблица 3).
| |||||||||||||||||||||||||||||||||||||||||||||||||
4. Обсуждение острой вирусной инфекции у людей
-1, вызванной новой острой вирусной инфекцией. респираторный синдром коронавируса 2 (SARS-CoV-2) в семействе Coronaviridae. Два штамма коронавируса, SARS и MERS, возникли в Китае и на Ближнем Востоке в 2002 и 2017 годах соответственно, что вызвало всемирное предупреждение ВОЗ.На этот раз COVID-19 вспыхнул в Китае и снова насторожил мир. Большинство пациентов с пневмонией COVID-19 имеют аномальные изменения на КТ-изображениях грудной клетки при первоначальном КТ-сканировании, но были ли эти изменения существующими до заражения, неизвестно, потому что пациенты с тяжелым основным заболеванием легких не были исключены в предыдущих исследованиях. В настоящем исследовании мы исключили пациентов с тяжелыми основными легочными заболеваниями, чтобы минимизировать возможности наложения. КТ – важный инструмент для выявления пациентов, инфицированных SARS-CoV-2.Непрозрачность матового стекла с консолидацией или без нее в сочетании с двусторонним, многодолевым и периферическим поражением легких было основным признаком и распространением пневмонии COVID-19.
Предыдущие исследования показали, что какой хозяин восприимчив к инфекции SARS-CoV, в основном определяется сродством между ангиотензинпревращающим ферментом 2 хозяина (ACE2) и вирусным рецепторсвязывающим доменом (RBD) [7]. Недавние исследования показывают, что последовательность генома SARS-CoV-2 очень похожа на последовательность генома SARS-CoV, но отличается от MERS-Cov [8–10].Эти данные указывают на следующее: (1) ACE2 используется в качестве рецептора SARS-CoV-2, который похож на SARS-CoV; (2) SARS-CoV-2 может инфицировать человеческую клетку; и (3) SARS-CoV-2 может передаваться от человека к человеку [7].
ACE2 экспрессируется в эпителии дыхательных путей человека, паренхиме легких и желудочно-кишечном тракте, которые являются основными местами репликации вируса [11, 12]. Симптомы нижних дыхательных путей (включая лихорадку, кашель и одышку) являются основными симптомами начала и сходны с симптомами, вызванными SARS-CoV [7, 13].О диарее также сообщалось в литературе [14], и в нашей группе был один пациент (1,9%). Pan et al. сообщили, что инфицированные люди могут быть заразными еще до появления симптомов [15]. В нашей группе 5 пациентов (9,4%) не имели симптомов при первичном обращении, но были подтверждены тестом на вирусную нуклеиновую кислоту. Это предполагает, что клинические симптомы не являются важными компонентами для идентификации или диагностики.
Наблюдалась небольшая склонность к мужчинам (мужчины: 31 [58,5%]) и пожилому возрасту (> 60 лет к 30 [56.6%] пациентов) в нашей когорте, и это аналогично предыдущим результатам [16]. Однако другие исследования не выявили явных половых предпочтений [17, 18]. Это можно объяснить разными демографическими особенностями и небольшим размером нашей группы.
Рентгенограммы грудной клетки менее чувствительны, чем компьютерная томография, при обнаружении небольших поражений; таким образом, компьютерная томография является первым выбором для первоначальной идентификации [19]. Большинство типов пневмонии COVID-19 имеют аномальные рентгенографические изменения при первоначальном проявлении, а характеристики и паттерны КТ аналогичны таковым при вирусной пневмонии.Пациенты с симптомами без рентгенологических изменений были описаны в литературе [18, 20], и эти пациенты также встречаются в нашей группе (3 [5,7%]), что позволяет предположить, что существует инкубационный период (1-14 дней) до положительного результата. результаты компьютерной томографии. Отрицательные результаты компьютерной томографии не могли исключить инфицированных пациентов.
Многодолевое, мультисегментное поражение и поражение периферических зон было очень распространенным явлением в нашем исследовании. Chung et al. сообщили, что из 21 пациента с пневмонией COVID-19 у 20 было несколько пораженных долей, а из 18 пациентов с помутнением легких – у 16 (88.9%) имели двустороннее распределение [20]. Ши и др. сообщили, что 79% пациентов имели двустороннее поражение легких и 54% пациентов имели периферическое распределение [17]. В нашей когорте вовлечение 399 сегментов (левая доля: 186 [46,6%] сегментов, правая доля: 213 [53,4%] сегментов) при начальной компьютерной томографии распределялась двусторонне. Наиболее часто поражаются нижние доли (особенно передний базальный сегмент, латеральный базальный сегмент и задний базальный сегмент). Это может быть связано с анатомическим строением трахеи и бронхов – бронх нижних долей относительно прямой, и вирус легче проникает в нижние доли [17].Здесь 46 (86,8%) наших случаев демонстрируют множественное поражение долей с преобладанием нижней доли. Только у 8 пациентов (13,2%) были инфицированы отдельные доли, а из 8 пациентов у 3 пациентов был один сегмент. Наше исследование показывает, что распределение поражений предпочтительно затрагивает периферическую зону, что аналогично радиологическому исследованию с SARS и MERS [21, 22]. Это может быть связано со способностью вируса достигать конечных бронхиол и альвеол. Обширное двустороннее поражение легких, такое как SARS-CoV, может соответствовать высокой начальной вирусной нагрузке [15, 23].
Помутнение матового стекла с уплотнением или без него – основные признаки заболевания. Эти признаки сильно указывают на острую интерстициальную пневмонию заболевания и согласуются с гистопатологическими данными о том, что пневмония COVID-19 поражает как паренхиму, так и интерстициальную ткань легких [2]. Эти особенности также можно найти в SARS и MERS. Чистая непрозрачность консолидации при первичной компьютерной томографии встречается редко.
Другие находки включают утолщение межлобулярной и внутрилобулярной перегородки, сумасшедший узор, ретикулярный узор, воздушную бронхограмму, ателектаз и бронхоэктаз.Когда возникает воспалительная реакция, макрофаги легких находятся в интерстиции легких, и альвеолы играют решающую роль в инициировании и поддержании воспаления [23]. Гистопатологический отчет о пневмонии COVID-19 показал, что в легочной ткани наблюдается отек легких с образованием гиалиновой мембраны, а лимфоциты преобладают над инфильтрацией интерстициальных мононуклеарных воспалительных и альвеолярных повреждений клеточными фибромиксоидными экссудатами [2]. Эти особенности аналогичны характеристикам SARS и MERS [24, 25].Эти патологические находки согласуются с особенностями внешнего вида матового стекла, консолидации, утолщения межлобулярной и внутрилобулярной перегородки и сумасшедшего рисунка мощения. Изначально сообщалось о сумасшедшем укладке дорожек у пациентов с альвеолярным протеинозом. Эта закономерность также может быть обнаружена при других легочных заболеваниях (таких как обычная интерстициальная пневмония, отек легких и респираторный дистресс-синдром взрослых), которые влияют как на интерстициальный, так и на воздушное пространство [26, 27]. Ретикулярный узор связан с внутрилобулярными линиями или утолщением межлобулярной перегородки, что указывает на интерстициальные изменения (интерстициальное воспаление или фиброз).
Паренхиматозные тяжи обнаружены у 6 (11,3%) пациентов. Это отражает фиброз и искажение архитектуры легких [26]. Фиброз может проявляться на поздней стадии ТОРС или быть следствием стероидной терапии [28]. Паренхиматозные полосы, обнаруженные на ранних КТ-изображениях, свидетельствовали о существовании устаревших ранее поражений. Если альвеолярный коллапс, то на КТ-изображениях можно было увидеть сегментарный ателектаз с толстой паренхиматозной полосой, указывающей на ворот.
Воздушная бронхограмма видна в очагах матового стекла и уплотнениях, что указывает на отсутствие препятствий в проксимальных отделах дыхательных путей.Бронхоэктазия связана с расширением бронхиол, что свидетельствует о фиброзных изменениях в очаге поражения. Плевральный выпот и лимфаденопатия описаны в литературе [17], но они являются редкими признаками SARS и MERS; только у 1 пациента в нашей когорте был плевральный выпот. Трудно сказать, были ли эти изменения вызваны инфекцией SARS-CoV-2, потому что сопутствующие пациенты не были исключены в других исследованиях, а также нельзя исключить ятрогенные причины. Никаких свидетельств кавитации не наблюдалось, и результат аналогичен недавней литературе и пневмонии SARS и MERS [20, 27, 29].
Примечательно, что из 5 бессимптомных инфицированных пациентов 3 пациента имели четкую историю контакта. Таким образом, эпидемиологическое обследование пациента очень важно при первоначальном выявлении подозреваемого пациента. Если будет получен четкий анамнез облучения, то пациента следует поместить в карантин для дальнейшего обследования. В отличие от пациентов в городе Ухань, у большинства наших пациентов нет четкого анамнеза. Таким образом, во время вспышки следует изолировать пациента с симптомами респираторной инфекции нижних дыхательных путей для проведения компьютерной томографии грудной клетки и тестирования нуклеиновых кислот.Может быть проведено повторное компьютерное сканирование и тестирование на нуклеиновую кислоту, поскольку отрицательный результат как компьютерной томографии, так и тестирования нуклеиновых кислот может быть получен в начальный момент времени.
По нашему опыту, история заражения является наиболее важным ключом к идентификации лиц с высоким риском. Клинический диагноз должен сочетаться с симптомами пациента, изменениями КТ и историей воздействия. Ни один из этих компонентов не может использоваться только для диагностики COVID-19. Хотя у пациента в анамнезе может отсутствовать симптоматика и получены отрицательные результаты результатов компьютерной томографии и теста на вирусную нуклеиновую кислоту при первичном обращении, потенциальную инфекцию нельзя полностью исключить, и необходимо выполнить повторную компьютерную томографию и тест РНК на коронавирус.
У нашего исследования было несколько ограничений. Во-первых, у нас была небольшая когорта, мы провели одноцентровое исследование и исключили сопутствующих пациентов. Это может привести к смещению выбора. Во-вторых, некоторым нашим пациентам сделали компьютерную томографию толщиной 5 мм. Это может упустить из виду тонкие изменения в поражении.
В заключение, инфекция COVID-19 кажется клинически легче, чем SARS или MERS с точки зрения тяжести и летальности, но сильнее с точки зрения передачи. История заражения чрезвычайно важна для выявления групп высокого риска для карантина и дальнейшего обследования, даже если они протекают бессимптомно.КТ грудной клетки помогает идентифицировать подозреваемого пациента, даже если во время инкубационного периода могут быть получены отрицательные результаты. Если признаки соответствуют вирусной пневмонии, то следует провести тест на вирусную нуклеиновую кислоту, и этих пациентов следует госпитализировать для изолированного наблюдения и дальнейшего обследования. Непрозрачность матового стекла и уплотнение с множественным, двусторонним и нижнедолевым распределением являются основными особенностями пневмонии COVID-19 при первоначальном компьютерном сканировании. К другим результатам КТ относятся сумасшедшие тротуары, бронхоэктазы, воздушная бронхограмма и ателектаз, которые аналогичны признакам, обнаруженным при SARS и MERS, и эти особенности и закономерности неспецифичны для диагностики пневмонии COVID-19.Тест на вирусную нуклеиновую кислоту является золотым стандартом для подтверждения, но он имеет высокую специфичность для выявления инфекции COVID-19 и относительно низкую чувствительность. Таким образом, отрицательные результаты не исключают группу высокого риска; следует провести повторное тестирование нуклеиновых кислот.
Сокращения
| COVID-19: | Коронавирусная болезнь 2019 | ||||||||||||
| SARS: | Тяжелый респираторный синдром взрослого | ||||||||||||
| SARS-CoV: | |||||||||||||
Тяжелый респираторный синдром взрослого
Доступность данныхДанные могут быть доступны по запросу по электронной почте. Этическое одобрениеПолучено одобрение институционального наблюдательного совета. Конфликты интересовАвторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, описанную в этой статье. Вклад авторовЦзюнь Чжоу является гарантом целостности всего исследования; Чао Сян и Джи Лу разработали концепцию и разработали это исследование; Чао Сян и Чангжу Чай провели литературное исследование; Ли Гуань собрал случаи пневмонии COVID-19 и записал клинические и рентгенографические данные пациента; Ченг Ян выполнил трехмерную реконструкцию; Чао Сян и Цзи Лу проанализировали стандартные изображения компьютерной томографии и 3DVR и составили рукописи; и Цзюнь Чжоу редактировали рукопись.Чао Сян и Цзи Лу внесли равный вклад в эту работу. КТ грудной клетки при подозрении на легочные осложнения онкологической терапии: как я рассматриваю и сообщаю | Визуализация ракаВ некоторых клинических условиях КТ грудной клетки показана даже при наличии нормальной высококачественной рентгенограммы грудной клетки в двух проекциях. У пациентов с тяжелой нейтропенией (<1000 нейтрофильных гранулоцитов / мкл) обычный ответ на микроорганизмы, вызывающие легочную инфекцию, нейтрофилов, мигрирующих к месту инфекции, вызывающих воспалительный инфильтрат, состоящий из жидкости, нейтрофилов, макрофагов и лимфоцитов, может быть невозможным. из-за отсутствия клеточных элементов. В этой ситуации визуализация направлена не на демонстрацию реакции хозяина на инфекцию (т. Е. Воспалительную инфильтрацию в виде уплотнения или помутнения матового стекла), а скорее на локальные эффекты самого возбудителя, такие как локальное кровотечение или окклюзия сосудов из-за инвазии организм. Пациенты с длительной (> 5 дней) нейтропенией особенно восприимчивы к грибковой инфекции (аспергиллы, кандида и т. Д.), А противогрибковая терапия связана со значительной токсичностью.Поэтому рекомендуется выполнять КТ грудной клетки даже при нормальной рентгенограмме грудной клетки, особенно если эмпирическая антибактериальная терапия не приводит к исчезновению симптомов (рис. 4). Другой специфической ситуацией, в которой рентгенография грудной клетки может оказаться недостаточной для демонстрации значительного легочного заболевания, является пневмоцистная пневмония (PCP) . На ранних стадиях инфекции этот организм вызывает диффузное матовое стекло, которое невозможно обнаружить даже при высококачественной рентгенографии грудной клетки в двух проекциях.Единственным, но явно неспецифическим признаком рентгенографии грудной клетки может быть уменьшение глубины вдоха по сравнению с предыдущими снимками грудной клетки из-за снижения эластичности легочной паренхимы. Таким образом, у пациентов с подозрением на PCP КТ грудной клетки может быть полезной для демонстрации типичной картины помутнения матового стекла, сохраняя периферию легких без связанной лимфаденопатии или плеврального выпота (рис. 6). Техника КТВнутривенное контрастное веществоЕсли обнаружение и / или классификация легочной патологии является единственным показанием для визуализации, обычно бывает достаточно КТ без усиления. Внутривенное введение контрастного вещества с задержкой, достаточной для улучшения мягких тканей (40–70 с), может быть выполнено, если требуется оценка средостения, хилы, плевральной полости или грудной стенки (стадия опухоли, инфекция мягких тканей и т. Д.) Пациентам, у которых дифференциальный диагноз включает тромбоэмболию легочной артерии (одышка, плевритная боль в груди и т. Д.), Может потребоваться внутривенная инъекция контрастного вещества с задержкой, соответствующей КТ-ангиографии легких. Рекомендации по дозировкеПоскольку многих онкологических больных лечат с целью излечения, и эти пациенты обычно проходят несколько визуализационных исследований с участием радиационного облучения, потенциал снижения дозы необходимо учитывать в каждом отдельном исследовании, особенно при КТ. В дополнение к стандартным подходам, таким как итеративная реконструкция, является обязательным адаптация дозы облучения к индивидуальной клинической ситуации: Например, у пациента с тяжелой одышкой, у которого дифференциальный диагноз включает легочную инфекцию, токсичность и тромбоэмболию легочной артерии. может быть рассмотрен протокол с усиленным контрастом с пониженным напряжением (например, 80 кВ). Неулучшенный трансформатор тока обычно может выполняться со значительно уменьшенным током трубки (20–40 мАс).Ограничение КТ с низкой дозой в обнаружении тонких различий в плотности, в частности матового стекла, можно преодолеть, используя более узкое окно для легких, чем обычно (ширина окна 1000 единиц Хаунсфилда (HU) вместо 1500 HU). Получение и реконструкция изображенияМетодом выбора является многодетекторная спиральная компьютерная томография, если возможно, во время приостановленного вдоха. Реконструкция изображения должна выполняться в аксиальной плоскости с толщиной среза 3–5 мм в алгоритмах реконструкции легких и мягких тканей. Аксиальные изображения при минимальной доступной толщине среза (например, 1 мм) следует реконструировать в ядре с высоким разрешением, чтобы обеспечить максимальное пространственное разрешение и высококачественные мультипланарные корональные и сагиттальные преобразования. В нашем учреждении стандартная отчетность составляется на основе 5 наборов изображений, а именно осевых изображений 3-5 мм в мягких тканях и окнах легких, аксиальных изображений тонких срезов мм и коронарных и сагиттальных реформах в окне легких (Таблица 2) . Таблица 2 Стандартное восстановление изображения и отображениеВ присутствии пациента со значительной одышкой и нормальной КТ грудной клетки при приостановленном вдохе дополнительные изображения, полученные в конце выдоха, могут быть полезны для обнаружения заболевания мелких дыхательных путей, которое может проявляться только в виде захвата воздуха на изображениях выдоха.Заболевание мелких дыхательных путей может быть вызвано инфекцией или токсичностью онкологических препаратов. Отображение изображенийНа рабочей станции для составления отчетов изображения обычно отображаются одновременно с 4 изображениями:
Для анализа морфологии легких, особенно узловых, ретикулярных и линейных, просматриваются осевые (иногда сагиттальные и корональные) изображения 1-2 мм в окнах легких. В редких случаях проекционные изображения максимальной интенсивности реконструируются для лучшего определения микронодульного рисунка. ИнтерпретацияАдекватность исследованияПоскольку пациенты с легочными заболеваниями, даже если их правильно проинструктировали, могут быть не в состоянии задерживать дыхание в конце вдоха, степень вдоха является первым аспектом анализа. Надежным признаком хорошего вдоха является яйцевидная (выпуклая) форма грудной трахеи. Во время выдоха задняя перепончатая часть трахеи (parsmbranacea) плоская или даже вогнутая. В случаях плохого вдоха видимое помутнение легкого матового стекла может быть только следствием экспираторных эффектов. В этих случаях «матовое стекло» обычно наблюдается в задних отделах долей легких с вентродорсальным градиентом плотности и не может быть ошибочно принято за истинную патологию. В этих случаях может оказаться целесообразным попытаться повторить исследование с лучшим вдохом. Анализ рентгенологических изображенийМорфологияДиффузная патология легких, обнаруживаемая при КТ, обычно подразделяется на 4 категории.Этот подход также полезен при подозрении на легочные осложнения онкологической терапии. Консолидация / матовое стеклоПри диффузной легочной инфильтрации существует два разных морфологических типа: плотность, которая затемняет легочные сосуды и стенки бронхов в настройках легочного окна, называется «консолидацией», тогда как менее выраженная степень повышенной плотности, которая не скрывает легочные сосуды и стенки бронхов называют «матовым стеклом». При уплотнении воздух в периферических дыхательных путях, бронхиолах и альвеолах полностью замещается твердым веществом, таким как гной, кровотечение, опухолевые клетки и т. Д., в то время как плотность матового стекла обусловлена частичной заменой воздуха независимо от типа вещества. Узловой узорЕсли присутствует диффузный узловой узор, дифференциация проводится между тремя основными типами легочных узелков в зависимости от точного расположения узелков относительно вторичного легочного узелка, наименьшего анатомического звена легкого:
Линейный, ретикулярный узорЛинейный или ретикулярный узор обычно вызывается накоплением субстрата в меж- и внутрилобулярных перегородках. Обнаружение не является специфическим, поскольку субстрат может представлять собой жидкость (интерстициальный отек), воспалительный экссудат (интерстициальная пневмония) или опухоль (лимфангиитный карциноматоз: LAC). Распределение может помочь отличить отек, который обычно симметричен с преобладанием дорсального и базального отделов, от интерстициальной пневмонии и LAC, которые обычно асимметричны или даже односторонние. Временной график при последующем наблюдении также может помочь в дифференциации: интерстициальный характер отека может быстро меняться (<24 ч), при инфекциях изменения менее быстрые (дни), тогда как результаты LAC остаются относительно постоянными в течение нескольких дней или недель. Пониженное затуханиеЭта функция обобщает эмфизему, легочные кисты и воздушную ловушку. Эмфизема и кисты легких обычно не являются осложнениями онкологической терапии. Бронхиолит, проявляющийся захватом воздуха (см. Выше: КТ выдоха), может быть вызван вирусной и бактериальной инфекцией или токсичностью лекарства (например,г. метотрексат). Некоторая легкая степень захвата воздуха наблюдается также при нормальных легочных и других легочных заболеваниях. РаспространениеРаспределение патологических данных в легких может быть полезно для дифференциации различных состояний. Преобладание апикальной и базовой локализации, а также периферическая и центральная локализация помогают различать различные заболевания со схожими морфологическими изменениями. Тот факт, что аномалии могут пересекать анатомические границы и в то же время ограничиваться известным или предполагаемым портом облучения, является почти патогномоничным для лучевого пневмонита. Анализ отдельного случаяВ качестве первого шага необходимо оценить степень вдоха, проверив, выглядит ли трахея яйцевидной формой с выпуклой перепонкой pars, указывающей на соответствующую степень вдоха, или плоский ли задний аспект или даже вогнутая, указывающая на сканирование выдоха. Если это так, от видимой плотности матового стекла, возможно, придется отказаться, особенно при наблюдении в задних отделах каждой доли легкого (см. Выше). Во-вторых, необходимо проверить, какой из морфологических паттернов легочной патологии является преобладающим, поскольку в большинстве патологических состояний наблюдается смесь различных патологий. Уплотнение / матовое стеклоПри повышенном диффузном затухании, проявляющемся либо в виде непрозрачности матового стекла, либо в виде уплотнения (см. Выше), дополнительные аспекты могут помочь предположить этиологию. Преобладающее уплотнение с некоторыми матовыми стеклами и узелками с воздушным пространством (центрилобулярными). указывает на бактериальную пневмонию. Смесь упрочнения и матового стекла в сочетании с узловым и / или сетчатым рисунком обычно наблюдается при вирусной пневмонии. Фокусные области консолидации, окруженные «ореолом» из матового стекла. – типичная находка при ангиоинвазивном аспергиллезе в соответствующих клинических условиях (тяжелая нейтропения и лихорадка, не поддающаяся лечению антибактериальной терапией). Окрашенное стекло или уплотнение в области легкого, подвергшейся лучевой терапии с соответствующей дозой и временным интервалом, свидетельствует о лучевом пневмоните Преобладающее или чистое матовое стекло с диффузным, двусторонним и центральным расположением типично для пневмоцистной пневмонии (PCP). Преобладающее матовое стекло с преобладанием верхней доли предполагает острый гиперчувствительный пневмонит как одно из проявлений лекарственного заболевания легких. Подострая стадия характеризуется комбинацией матового стекла и узелков в воздушном пространстве . Линейный или сетчатый узорДвусторонний симметричный линейный и ретикулярный узор , обычно с небольшим количеством матового стекла и преобладанием зависимой части легкого, указывает на интерстициальный отек.Обычно это связано с внелегочными проявлениями правожелудочковой недостаточности, такими как двусторонний плевральный выпот (обычно справа> слева), асцит, растяжение ВПВ и НПВ и отек стенки желчного пузыря. Сочетание линейного / сетчатого рисунка с матовым стеклом, консолидации и / или узлового рисунка типично для вирусной пневмонии. Линейный / ретикулярный узор, часто с узловатым видом утолщенных перегородок. с асимметричным или односторонним распределением с утолщением бронховаскулярных пучков или без него, встречается при лимфангиитном распространении опухоли. Преобладающий ретикулярный паттерн с базальным и периферическим распределением в сочетании с матовым стеклом обнаруживается при лекарственном заболевании легких с паттерном NSIP (неспецифическая интерстициальная пневмония). Узорчатый узорЦентрилобулярные узелки возникают либо из-за воспаления (бронхиолит / васкулит), либо из-за распространения опухоли вдоль альвеолярных перегородок (аденокарцинома с преимущественным лепидным ростом (ранее: бронхиолоальвеолярная карционома). Бронхиолит может быть вызван инфекцией (вирусный, бактериальный, туберкулезный бронхиолит) или может быть вызван лекарственными препаратами, например. г. метотрексат). Васкулит в этом случае может быть вызван лекарством. Случайная картина узлового заболевания обычно происходит из-за гематогенного распространения инфекции (кандидоз, туберкулез) или опухоли (легочные метастазы). В то время как инфицированные узелки обычно имеют одинаковый размер, случайное распределение легочных узелков разного размера предполагает наличие метастазов.Рост узелков, продемонстрированный при последующем наблюдении или при обзоре предыдущих исследований КТ, с большой вероятностью указывает на злокачественность (метастазы), тогда как новые узелки могут представлять как метастазы, так и инфекцию. Перилимфатическая узловатая форма обнаруживается при лимфангиитном карциноматозе или не связанных заболеваниях, таких как саркоидоз или силикоз / пневмокониоз угольных рабочих. Эта картина также может быть связана с доброкачественными внутрилегочными лимфатическими узлами. При лимфангиитном карциноматозе обычно наблюдается комбинация с линейным / ретикулярным рисунком и утолщением бронховаскулярных пучков.Распределение в основном асимметричное или даже одностороннее. Лимфаденопатия и (часто односторонний) плевральный выпот являются обычными явлениями. При саркоидозе часто встречается комбинация с линейным / ретикулярным паттерном и утолщением бронховаскулярных пучков в симметричном распределении с центральным преобладанием. Двусторонняя внутригрудная лимфаденопатия, а также средостенная лимфаденопатия также распространены, тогда как плевральный выпот очень редко при саркоидозе. При силикозе узелковая структура обнаруживается в верхней доле и преобладает в центре, очень часто встречается связь с внутригрудной и средостенной лимфаденопатией (более длительная с периферической кальцификацией (лимфатические узлы яичной скорлупы)).Плевральный выпот встречается редко. Несколько более крупных узелков , часто с кавитацией и нечеткими краями, обычно обнаруживаются в септических эмболах, вызванных бактериальной инфекцией венозной системы (центральная линия, порт-катетер, септический тромбоз) или правых отделов сердца / эндокардита). Внелегочные данныеПлевральный выпотДвусторонний плевральный выпот – частое проявление (справа) сердечной недостаточности, почечной недостаточности или гипергидратации, которые могут быть вызваны терапией (кардиотоксические препараты, нефротоксические препараты, большое количество жидкости во время химиотерапии).В этом случае количество плеврального выпота в правой части обычно больше, чем в левой плевральной полости. Существует связь с другими признаками правожелудочковой недостаточности, такими как перикардиальный выпот, асцит, дилатация ВПВ, НПВ и печеночных вен, а также отек стенки желчного пузыря. Односторонний плевральный выпот обычно возникает не из-за перечисленных выше течений, а из-за карциноматоза плевры или плевральной инфекции. Диффузное утолщение плевры с контрастным усилением или без него («признак разделения плевры») может быть обнаружено при инфекции, хроническом неинфицированном выпоте или карциноматозе плевры.Узловое утолщение плевры почти патогномонично для распространения опухоли плевры (карциноматоз, лимфоматоз, саркоматоз). Это может быть связано с лимфангитическим карциноматозом и лимфаденопатией. ЛимфаденопатияСлегка увеличенные лимфатические узлы обычно обнаруживаются при сердечной недостаточности, но также при лекарственном заболевании легких, лучевом пневмоните и многих других не связанных состояниях. Более выраженная лимфаденопатия обнаруживается при бактериальной и вирусной пневмонии с локализацией увеличенных лимфатических узлов в зависимости от лимфатического дренажа инфицированной доли или сегмента легкого. наиболее выраженное увеличение лимфатических узлов , если обнаружено при злокачественной лимфаденопатии. Лимфатические узлы диаметром> 3 см обычно злокачественные (злокачественная лимфома, метастазы в лимфатические узлы). Лимфаденопатия с усилением обода типична для туберкулезного лимфаденита, который может протекать без легочных проявлений туберкулеза. Лимфаденопатия редко встречается при пневмоцистной пневмонии (PcP) или грибковой инфекции (кандида, аспергиллез). Лимфаденопатия, вызванная не связанными с ней заболеваниями, такими как коллагеновые сосудистые заболевания и т. Д., Обычно протекает в легкой форме. Проявления опухолиПри интерпретации результатов исследования легких необходимо наблюдать внелегочные проявления опухоли. Хотя это возможно, маловероятно, что новая или прогрессирующая легочная патология представляет собой злокачественное заболевание, такое как (LAC или метастазы), когда другие опухолевые проявления (метастазы в подмышечные лимфатические узлы, метастазы в печень, скелетные метастазы) реагируют на терапию. Составление отчетаОтчет, разумеется, должен включать клинический вопрос, чтобы ответить на него в заключении. Следует описать методику исследования, в частности, было ли КТ-исследование выполнено с внутривенным введением контрастного вещества или без него. Следует указать качество исследования (вдох, артефакты дыхания), чтобы показать потенциальные ограничения исследования. Следует описать морфологию легочной и внелегочной патологии, чтобы можно было провести переоценку в случае выявления новых аспектов клинического контекста. Случайные находки, которые неизвестны, являются редкостью при визуализации онкологических больных для выявления возможных осложнений терапии, поскольку обычно доступны предыдущие визуализации (обследования стадий). Диагностика и лечение диффузных интерстициальных заболеваний легкихОпределение Диффузное интерстициальное заболевание легких (DILD) – это категория, состоящая из ряда патологий со схожими клиническими, радиологическими и функциональными проявлениями функции легких, при которых основные патологические изменения затрагивают интерстициальные альвеолярные структуры.Фактически, термин DILD не описывает должным образом лежащий в основе патогенетический механизм этих клинических проявлений, потому что они очень часто поражают не только интерстициальные альвеолярные структуры, но также мелкие дыхательные пути и легочную сосудистую сеть.1,2 Этиология и классификация Этиология DILD чрезвычайно разнообразна. В настоящее время известно более 150 различных причин, хотя выявление возбудителя возможно только примерно в 35% случаев. Классификация этих образований была недавно изменена после публикации согласованного заявления, подготовленного совместно Американским торакальным обществом (ATS) и Европейским респираторным обществом (ERS) (Таблица 1).3,4 Можно выделить три группы DILD. Первая группа (идиопатические интерстициальные пневмонии) включает набор клинико-патологических образований, гистологическое определение которых привлекает большое внимание в последние годы. Вторая группа включает ЛЗВ с известными причинами и те, которые связаны с другими четко определенными заболеваниями. В эту группу входят легочные проявления коллагеновых заболеваний, гистология которых часто неотличима от идиопатических интерстициальных пневмоний.В эту группу также входят лекарственно-индуцированные ЛБЗ и ЛБЗ, вызванные органическими и неорганическими агентами (внешний аллергический альвеолит [ЕАА] и пневмокониоз соответственно), а также заболевания, связанные с наследственными заболеваниями. Третья группа состоит из подмножества заболеваний, которые, хотя и являются идиопатическими, имеют четко определенные клинические и гистологические признаки. Эпидемиология Эпидемиологические данные по DILD немногочисленны. Заболеваемость и распространенность, сообщаемые в литературе, сильно различаются, поскольку используемые эпидемиологические методы различаются от одного исследования к другому.Более того, после недавних изменений в классификации DILD невозможно получить точную информацию о частоте и распространенности новых клинических проявлений, таких как неспецифическая интерстициальная пневмония (NSIP). Более того, большинство реестров DILD составлено на основе обследований, предназначенных исключительно для пульмонологических отделений, поэтому они не включают заболевания, диагностированные другими отделениями или типами больниц. Однако общепризнано, что наиболее распространенными ЛПЗ являются идиопатический фиброз легких (IPF) и саркоидоз, за которыми следуют ЕАА и болезни, связанные с коллагеновой болезнью.5 Методы диагностики История болезни В одной трети случаев ЛЗЗ диагноз может быть поставлен исключительно на основании точного анамнеза 6,7 – Возраст и пол. У пациентов в возрасте от 20 до 40 наиболее частыми заболеваниями являются саркоидоз, гистиоцитоз X, лимфангиолейомиоматоз (ЛАМ) и ЛЗЗ, связанные с заболеваниями коллагена. ИЛФ обычно диагностируется у пациентов старше 50 лет. ЛАМ встречается практически только у женщин. DILD, связанный с болезнью коллагена, чаще встречается у женщин. – Семейная история. Это может предоставить очень полезную информацию. Пациенты с ИЛФ могут иметь члена семьи, который также страдает этим заболеванием (семейный фиброз легких). Альвеолярный микролитиаз, туберозный склероз, нейрофиброматоз и саркоидоз – другие примеры клинических состояний с наследственным анамнезом, которые связаны с ЛБЗ. – Употребление табака. Некоторые DILD в первую очередь поражают курильщиков. К ним относятся десквамативная интерстициальная пневмония (DIP), интерстициальное заболевание легких, связанное с респираторным бронхиолитом (RB-ILD), и гистиоцитоз X.Противоположное верно для саркоидоза и EAA, которые чаще встречаются у некурящих, чем у курильщиков. – Род занятий и предыстория работы. EAA вызывается воздействием органических агентов, а пневмокониоз – воздействием неорганической пыли. Должен быть записан полный профессиональный анамнез с подробным описанием трудовой деятельности и любого возможного воздействия неорганической пыли. Следует указать дату и продолжительность любого воздействия. Все виды трудовой деятельности должны регистрироваться в хронологическом порядке. – История лекарств.Наркотики – нередкая причина ЛБЗ. Следовательно, следует отметить все лекарства, принимаемые пациентом в настоящее время и в прошлом, включая подробную информацию о дозе и продолжительности лечения. – Лучевая терапия. Лучевая терапия грудной клетки в анамнезе может быть причиной DILD. – Системные болезни. Выявите и исследуйте возможные симптомы системных заболеваний (коллагеноз, саркоидоз), которые могут быть связаны с DILD. Клинические признаки и симптомы Наиболее частыми симптомами являются одышка при физической нагрузке и кашель.Наиболее заметным симптомом является прогрессирующая одышка при нагрузке, которая часто связана с отклонениями на рентгенограмме грудной клетки. Однако пациенты с нормальными рентгенограммами грудной клетки могут жаловаться на одышку, в то время как в других случаях заболевание может быть обнаружено у бессимптомных пациентов на рентгенограмме грудной клетки, сделанной по какой-либо другой причине. Появление одышки обычно постепенное, но прогрессирующее и в течение некоторого времени может быть единственным симптомом. В результате пациенты, как правило, обращаются к врачу через несколько недель или месяцев после начала заболевания, что задерживает диагностику и лечение.У большинства пациентов наблюдается сухой кашель. Кровохарканье редко, но иногда возникает у пациентов с ЛАМ. У пациентов с пневмокониозом угольных рабочих может наблюдаться меланоптиз. Следующие заболевания могут вызывать острые или подострые респираторные симптомы, иногда связанные с лихорадкой и другими системными симптомами: NSIP, острая интерстициальная пневмония (AIP), EAA, лекарственный пневмонит, криптогенная организующая пневмония (COP) и легочные эозинофилии. Субстернальная или плевритная боль в груди встречается редко. Острая плевритная боль, вызванная пневмотораксом, может быть признаком гистиоцитоза X или LAM.1,2,7 Самая полезная информация, полученная при физикальном обследовании, – это наличие потрескивания и ударов пальцами, хотя эти признаки присутствуют не у всех DILD. Свистящее дыхание может указывать на EAA или легочную эозинофилию. Помимо этих общих характеристик, каждая форма DILD имеет свои собственные клинические особенности (см. Конкретные характеристики различных форм DILD). По мере прогрессирования ЛВЗЛ может развиться легочная гипертензия, которая приведет к хроническому легочному сердцу (отеку, гепатомегалии и вздутию яремных вен). Также важно искать наличие внелегочных признаков и симптомов, которые могут указывать на любое из разнообразных заболеваний, связанных с ЛБЗ (таблица 2). Анализы крови Результаты анализов крови представляют интерес для диагностики некоторых ЛЗЗ (Таблица 3) .1,2,7 У пациентов с саркоидозом иногда повышаются значения сывороточного ангиотензинпревращающего фермента. Этот параметр использовался в качестве маркера активности у таких пациентов, но с спорными результатами.8 В свете этого и с учетом того, что уровни ангиотензинпревращающего фермента могут быть повышены при других DILD, этот тест следует использовать с осторожностью при диагностике. из DILD. Радиографическая визуализация Рентгенография грудной клетки по-прежнему является незаменимым инструментом при первоначальной рентгенологической оценке и последующем мониторинге пациентов с ЛЗЗ по разным причинам: а) 90% пациентов с ЛЗЗ имеют рентгенологические отклонения на момент постановки диагноза; б) распределение интерстициального рисунка и связанных с ним признаков является полезной диагностической информацией, и в) сравнение серийных рентгенограмм полезно для наблюдения за течением заболевания. Рентгенологические особенности, связанные с DILD: матовое стекло; сетчатые, мелкоузловые и ретикулонодулярные узоры; и соты.Обычно они распространяются на оба гемиторакаса диффузно и сопровождаются уменьшением размеров полей легких. Альвеолярный паттерн указывает на следующие DILD: AIP, NSIP, DIP, COP, лимфоидную интерстициальную пневмонию (LIP), альвеолярный протеиноз, EAA и легочные эозинофилии. Распределение помутнений в легких и наличие других рентгенологических аномалий может указывать на конкретный диагноз6 (Таблица 4). Компьютерная аксиальная томография грудной клетки – более чувствительный инструмент, чем рентгенография грудной клетки, при исследовании аномалий легочного интерстиция.При любом исследовании DILD всегда следует получать компьютерную томографию высокого разрешения (HRCT). Этот метод визуализации облегчает обнаружение заболевания у пациентов с нормальной рентгенограммой грудной клетки. Это также полезно для оценки степени и природы паренхиматозных поражений, потому что сетчатые узоры указывают на фиброз и паттерны воспаления в виде матового стекла. Однако, когда образцы матового стекла обнаруживаются в сочетании с сетчатыми узорами, они могут указывать на конгломератные массы, а не на воспаление.При IPF, гистиоцитоз X, асбестоз и LAM, результаты HRCT считаются диагностическими критериями. При других клинических проявлениях (COP, EAA, саркоидоз, альвеолярный протеиноз) результаты HRCT помогают в постановке диагноза. HRCT сканирование также следует использовать для определения правильного места для трансбронхиальной и хирургической биопсии и бронхоальвеолярного лаважа (БАЛ). Нормальный HRCT не исключает диагноз DILD.1,2,7 Клиническая ценность магнитно-резонансной томографии, несмотря на возможности, которые она предлагает при исследовании грудной клетки, все еще остается чисто умозрительной.Рентгенография костей может быть полезна при диагностике коллагеновой болезни, саркоидоза и гистиоцитоза X. Сцинтиграфия легких с использованием галлия-67 (67Ga) бесполезна для диагностики ЛЗЗ из-за отсутствия специфичности и чувствительности. Визуализация галлия всего тела с использованием 67Ga полезна в нескольких редких случаях трудно диагностируемого саркоидоза, так как выявляет 2 признака, типичных для этого заболевания: а) лямбда (двусторонняя внутригрудная лимфаденопатия и правосторонняя паратрахеальная лимфаденопатия) и б) панда (поглощение в слезных и околоушных железах).Хотя некоторые авторы доказали полезность сцинтиграфии с использованием 99Tc-DTPA (диэтилентриаминпентаацетат) для оценки проницаемости эпителия и эволюции DILD, имеющихся данных слишком мало, чтобы рекомендовать его использование. Тестирование функции легких Тестирование функции легких – это ключевой инструмент в постановке диагноза, определении прогноза, а также в мониторинге течения заболевания и реакции пациента на лечение. В 15% случаев нарушение функции легких является первым симптомом ЛБЗ.Тем не менее, нормальный результат теста на функцию легких не исключает возможности ЛБЗ. Существует корреляция между степенью функционального нарушения и степенью разрушения паренхимы легких, хотя эти тесты не предоставляют никаких доказательств того, вызвано ли нарушение альвеолитом или фиброзом. При форсированной спирометрии функциональный паттерн характеризуется рестриктивным дефектом. Следующие DILD могут быть связаны с обструктивным дыхательным паттерном: EAA, саркоидоз, гистиоцитоз X, эозинофильная пневмония и LAM.Общая емкость легких и различные подразделения объема легких уменьшаются. При ЛИЗ, связанной с эмфиземой легких, форсированная жизненная емкость легких (ФЖЕЛ) и объемы легких в норме. Дифференцирующая способность легких по окиси углерода (DLCO) снижается (это один из наиболее чувствительных индикаторов DILD). KCO (коэффициент передачи DLCO / альвеолярного объема) обычно нормальный или умеренно низкий. Газометрия артериальной крови показывает увеличение P (A-a) O2 (альвеолярно-артериальный градиент кислорода) при умеренной гипокапнии.Артериальная гипоксемия проявляется только на поздних стадиях заболевания, а гиперкапния – на последних. Тесты с физической нагрузкой показывают низкую толерантность к физической нагрузке из-за одышки, связанной с гипоксемией, вызванной упражнениями. Роль теста с физической нагрузкой в диагностике ЛЗЗ ограничивается выявлением заболевания у пациентов с одышкой с нормальной рентгенограммой грудной клетки и функцией легких.7 Хотя имеется лишь ограниченный опыт, тест с 6-минутной ходьбой оказался полезным для оценки течение болезни.1,2,9,10 Бронхоальвеолярный лаваж Клеточный и иммуноцитохимический анализ БАЛ очень полезен при диагностической оценке ЛЗЗ. Биохимический анализ и измерение иммуноглобулинов не дают никаких полезных данных. Однако минералогический анализ полезен при диагностике пневмокониоза. Эффективность серийного БАЛ не показала никакой пользы для определения прогноза или мониторинга реакции на лечение. БАЛ может исключить необходимость биопсии легкого при некоторых DILD.В большинстве случаев, однако, роль БАЛ в этом процессе будет заключаться в том, чтобы направлять диагноз, поддерживать предварительный диагноз или предлагать альтернативу.11 Роль БАЛ при ЛАБ показана в таблице 5. Биопсия легкого Гистологический анализ паренхимы легкого, во многих случаях, необходимо для постановки окончательного и конкретного диагноза ЛЗЗ.1,2,6,7 Трансбронхиальная биопсия, выполненная с помощью фибробронхоскопа, может подтвердить диагноз при следующих типах ЛЗЗ: саркоидоз, EAA .гистиоцитоз X, амилоидоз, LAM, альвеолярный протеиноз, COP, легочная эозинофилия и некоторые типы пневмокониоза. Однако они бесполезны при диагностике идиопатических интерстициальных пневмоний (кроме COP). Тот факт, что паренхима легких находится в норме, не исключает возможности ЛБЗ. Хирургическая биопсия легкого с использованием мини-торакотомии или видеоторакоскопа показана во всех случаях, когда конкретный диагноз ЛЗЗ не был получен с помощью методов исследования, описанных выше.Преимущества видео-торакоскопии – это более короткое время операции, меньше послеоперационных осложнений и более короткая продолжительность пребывания в больнице. Решение о проведении биопсии следует оценивать в индивидуальном порядке, поскольку его целесообразность будет зависеть от клинического состояния пациента и от ценности возможных преимуществ в диагностике и лечении. Участки биопсии следует заранее определять на основании результатов КТВР. Образцы следует брать как минимум из 2 разных участков, одно с патологическим макроскопическим видом, а другое с нормальным макроскопическим видом. Транспаретальную игольчатую биопсию использовать нельзя из-за небольшого размера образца легкого, полученного с помощью этого метода, и высокой частоты вторичного пневмоторакса. Диагностический процесс Диагностический процесс DILD показан на рисунке. Этот процесс начинается со сбора анамнеза, за которым следует физический осмотр и рентгенография грудной клетки. Необходимые анализы крови будут зависеть от дифференциального диагноза. Следующим шагом является исследование респираторной функции (спирометрия, объем легких, перенос угарного газа и артериальная газометрия).Тест с физической нагрузкой и тест на 6-минутную ходьбу не обязательно выполнять во всех случаях ЛПИ. В качестве общего руководства эти тесты показаны при IPF и хронических формах DILD, которые не поддаются начальному лечению. Решение о проведении других обследований (например, осмотра глаз и электрокардиограммы) будет зависеть от клинической картины и результатов рентгенографии грудной клетки и анализов крови. По возможности перед фибробронхоскопией следует проводить КТВР.Если диагноз не установлен, по возможности следует использовать хирургическую биопсию легкого. Рисунок. Диагностический процесс при диффузном интерстициальном заболевании легких. HRCT указывает на компьютерную томографию высокого разрешения. Дифференциальный диагноз Дифференциальный диагноз должен быть выставлен, когда клинические признаки и рентгенологическая картина являются общими для нескольких клинических проявлений.1,2 – Сердечная недостаточность. Отек легких может вызвать двусторонний интерстициальный узор.Сердечную недостаточность следует подозревать у пациентов с сердечными заболеваниями в анамнезе, а также при наличии кардиомегалии, линий Керли В, плеврального выпота или преимущественно перихилярных инфильтратов на рентгенограмме грудной клетки. – Бронхоэктазы. Хотя интерстициальный паттерн на рентгенограмме грудной клетки является одним из признаков бронхоэктаза, клинические проявления и результаты КТР позволяют дифференцировать этот диагноз и ДЗЗ. – Пневмония. Клиническую картину и рентгенологические данные в некоторых случаях пневмонии можно спутать с острыми случаями ЕАА. – Карциноматозный лимфангит. Рентгенограмма грудной клетки показывает двусторонний интерстициальный узор с линиями Керли B. Окончательный диагноз может быть подтвержден результатами БАЛ и трансбронхиальной биопсии. – Легочные инфильтраты у пациентов с иммунодефицитом. Легочные инфильтраты у пациентов с пониженным иммунитетом, в первую очередь вызванные условно-патогенными микроорганизмами, дают интерстициальные паттерны на рентгенограммах грудной клетки. Наличие в анамнезе пониженного иммунитета и микробиологический анализ БАЛ обычно подтверждают диагноз. – Диффузное легочное кровотечение. Такое кровоизлияние дает диффузные альвеолярные или альвеолоинтерстициальные паттерны на рентгенограмме грудной клетки. Клинические признаки (анемия, кровохарканье), результаты БАЛ (наличие геморрагической жидкости и / или гемосидерофагов) и наличие иммунологических аномалий (нейтрофильные антицитоплазматические антитела, антинуклеарные антитела, базальные антимембранные антитела) обычно достаточны для дифференциации этих случаев от DILD. – Липоидная пневмония.В редких случаях липоидная пневмония вызывает двусторонние интерстициальные инфильтраты. Диагноз обычно подтверждается данными о БАЛ (окрашивание липидных вакуолей в альвеолярных макрофагах) и результатами трансбронхиальной или хирургической биопсии легкого. – Милиарный туберкулез и милиарная болезнь, вызываемая Bacillus Calmette-Guérin. Милиарный рисунок на рентгенограмме наблюдается у 6% больных туберкулезом. Гематогенное распространение Bacillus Calmette-Guérin наблюдается у пациентов с раком мочевого пузыря, которые получают местное лечение, содержащее Bacillus Calmette-Guérin, и демонстрируют милиарный рисунок на рентгенограммах грудной клетки. Осложнения Осложнения чаще развиваются у пациентов, получающих длительное лечение кортикостероидами и / или иммуносупрессивной терапией, а также у пациентов с IPF или другими формами DILD, которые прогрессируют до фиброза легких. 12 – Дыхательная недостаточность. Дыхательная недостаточность – причина смерти в 40% случаев. На запущенных стадиях заболевания у большого количества пациентов наблюдается хроническая дыхательная недостаточность. Пациенты с IPF или другими формами DILD, прогрессировавшими до фиброза легких, могут иметь клиническую картину, характеризующуюся одышкой, лихорадкой и быстро прогрессирующей острой дыхательной недостаточностью.Рентгенограммы грудной клетки выявляют альвеолярные узоры, а на снимках HRCT видны обширные помутнения матового стекла. В 30-40% случаев обострение заболевания вызвано респираторными инфекциями. Однако в большинстве случаев выявить обостряющую причину невозможно, а острую дыхательную недостаточность связывают с быстрым прогрессированием заболевания. Исследование биопсии легких выявляет диффузное альвеолярное повреждение или организуемую пневмонию в дополнение к аномалиям, типичным для основного заболевания.Около 90% пациентов умирают, и ни искусственная вентиляция легких, ни лечение высокими дозами кортикостероидов не показали какого-либо положительного эффекта.13 – Респираторные инфекции. Тяговые бронхоэктазы, нарушение цилиарного просвета и лечение кортикостероидами или иммунодепрессантами – все это делает пациентов восприимчивыми к респираторной инфекции, вызванной обычными или условно-патогенными микроорганизмами. В этом отношении следует отметить рост заболеваемости туберкулезом легких у пациентов с ИЛФ и силикозом. – Легочная гипертензия. На поздних стадиях IPF и других DILD, которые прогрессируют до фиброза, легочная гипертензия и легочное сердце развиваются у 70% пациентов и являются причиной смерти в 30% случаев. – Рак легких. Как при ИЛФ, так и при асбестозе высока заболеваемость раком легких. Характеристики и частота гистологических типов рака, связанных с этими DILD, аналогичны таковым в популяции в целом. – Легочная тромбоэмболия.Легочная тромбоэмболия является причиной смерти от 3% до 7% пациентов с ЛЗЗ. Предрасполагающими факторами являются отсутствие активности из-за одышки, сердечная недостаточность правых органов и наличие сопутствующего рака легких. – Пневмоторакс. Пневмоторакс встречается редко и встречается только в 3,6% случаев. Сопровождается быстрым клиническим ухудшением состояния и дыхательной недостаточностью. Обычно это не решается дренажем грудной клетки из-за жесткости паренхимы легкого, которая препятствует повторному расширению легкого. – Мицетома. Мицетома – это осложнение, которое может возникнуть у пациентов с саркоидозом, у которых есть деструктивные фиброзные поражения легких. Лечение Основными целями лечения являются предотвращение контакта с возбудителем, подавление воспалительного компонента заболевания (альвеолита) и лечение осложнений. Первая задача достижима только тогда, когда известна этиология заболевания. Устранение альвеолита является единственным терапевтическим методом лечения идиопатической ЛЗЗ, поскольку в настоящее время отсутствуют антифибротические препараты с доказанной эффективностью.Используемые препараты – кортикостероиды и иммунодепрессанты. Показания и продолжительность лечения различаются в зависимости от формы ЛДЗ (см. Раздел «Специфические характеристики различных форм диффузного интерстициального заболевания легких»). Пациентам с вторичной легочной гипертензией может быть полезна кислородная терапия и вазодилататоры. Илопрост (аналог простагландина I2) может быть эффективным средством лечения. Недавнее исследование показало, что силденафил вызывает расширение сосудов легких и улучшает газообмен.Однако рекомендованной стратегии нет.1,2,7,14 Трансплантация легких Трансплантация легких – это последний вариант лечения ЛЗЗ, которые прогрессируют до фиброза и вызывают дыхательную недостаточность. Кандидаты на трансплантацию должны соответствовать общим критериям приемлемости, применимым к любому виду трансплантации легких, и не должны иметь противопоказаний (таблицы 6 и 7) .15,16 Существует более 120 типов DILD, прогрессирующих до фиброза, и поэтому очень сложно определить окно трансплантации (идеальный момент для трансплантации для каждого пациента, ни слишком рано, ни так поздно, чтобы выбор времени ставил под угрозу жизнеспособность операции).Нет никаких протоколов, которые суммировали бы показания к трансплантации легкого в случае этой очень разнородной группы фиброзных заболеваний.17 Для пациентов с IPF принятые показания для оценки возможности трансплантации легкого включают прогрессирующую одышку, несмотря на соответствующую иммуносупрессивную терапию, и стойкую гипоксемия в покое или при физической нагрузке, которая обычно связана со снижением ФЖЕЛ примерно на 60–70% от прогнозируемого значения и DLCO менее чем на 50–60% от прогнозируемого.18 Однако эти критерии могут быть неприменимы к другим типам легочного фиброза, потому что не существует надежных теоретических прогностических моделей. Более того, у нас нет никаких данных о больших группах пациентов, которые можно было бы использовать для демонстрации того, что такая трансплантация повысит выживаемость, как было продемонстрировано в случае IPF.19 Одним из аспектов DILD, который следует учитывать, является возможность рецидива заболевания после трансплантации. О рецидивах сообщалось в случаях DIP, альвеолярного протеиноза, LAM и саркоидоза.Имеется небольшой опыт рецидивов этих заболеваний и их клинических последствий. В случае саркоидоза рецидив имеет мало клинических последствий, и нет никаких доказательств того, что он увеличивает риск отторжения трансплантата.20 Одиночное легкое является предпочтительным типом трансплантата для пациентов с DILD. Двустороннюю трансплантацию легких следует рассматривать только в тех случаях, когда есть некоторые сомнения в поведении оставшегося легкого. Сердечно-легочная трансплантация показана только молодым пациентам с рефрактерной сердечной недостаточностью справа, что очень редко. Мониторинг течения заболевания и реакции пациента на лечение Что касается вопроса о мониторинге течения болезни и реакции пациента на лечение, ERS и ATS выпустили согласованные заявления, определяющие критерии саркоидоза и IPF, который может использоваться в общем случае для других DILD. В качестве общего руководства рекомендуется следующее (Таблица 8): Ежеквартальное обследование: – Оценка симптомов (в частности, одышки, с использованием утвержденных шкал).Вопросникам качества жизни уделялось мало внимания в связи с DILD. Предварительные исследования показывают, что наиболее полезными из них являются WHOQOL-100 (Качество жизни Всемирной организации здравоохранения) и SF-36 (Краткая анкета из 36 пунктов) 21. – Рентгенограмма грудной клетки. – Тест функции легких (форсированная спирометрия, объемы легких, DLCO и артериальная газометрия в покое). Ежегодный осмотр: – HRCT. – Нагрузочные испытания. Несмотря на то, что они предоставляют очень ценную информацию, тесты с физической нагрузкой обычно не используются для контроля реакции на лечение.По опыту нескольких авторов, эти тесты могут быть выполнены только в 30-40% случаев22. Консенсус ATS / ERS заключается в том, что увеличение PaO2 более чем на 4 мм рт. Ст. Во время упражнений свидетельствует об улучшении, и что повышение P (Aa) O2 более чем на 4 мм рт. ст. указывает на ухудшение.3 Опыт с тестом с 6-минутной ходьбой скуден, хотя его использование рекомендуется.9,10 Ухудшение функции легких, клиническое состояние, или рентгенографические данные у пациентов с ЛБЗ указывают на прогрессирование заболевания или отсутствие ответа на лечение, хотя такие результаты также могут указывать на наличие осложнений (см. раздел «Осложнения»). Специфические характеристики различных форм DILD Идиопатический фиброз легких IPF – это форма DILD, характеризующаяся наличием обычной интерстициальной пневмонии (UIP) при гистологическом исследовании паренхимы легких. По оценкам, распространенность этого заболевания составляет 20 случаев на 100 000 у мужчин и 13 случаев на 100 000 у женщин, что делает его наиболее распространенной формой ЛЗЗ. Его этиология неизвестна, хотя вполне вероятно, что IPF является следствием действия внешних агентов у людей с генетической предрасположенностью.23,24 Клинические особенности. Возраст пациента на момент проявления болезни обычно превышает 50 лет. Начало незаметное, проявляется в виде прогрессирующей одышки и сухого кашля. Наличие конституциональных симптомов должно заставить врачей подозревать альтернативный диагноз. При медицинском осмотре трещины на липучках обнаруживаются в 90% случаев, а удары пальцами – в 20–50% случаев. Анализы крови могут выявить отклонения в маркерах воспаления (С-реактивный белок, скорость глобулярного оседания, гамма-глобулины).Положительные антиядерные антитела или ревматоидный фактор встречаются в 10–20% случаев, хотя титры низкие. Семейный фиброз легких – это форма фиброза легких, поражающая 2 или более членов одной семьи. Характеристики заболевания аналогичны характеристикам несемейной формы, хотя заболевание обычно диагностируется в более молодом возрасте.25 Рентгенография грудной клетки выявляет ретикулярные помутнения, иногда связанные с сотами, с базальным и двусторонним распределением.Альвеолярные узоры встречаются редко, и их наличие должно насторожить врача о возможности альтернативного диагноза. HRCT выявляет ряд характерных отклонений, которые считаются диагностическими критериями. Их диагностическая чувствительность оценивается в 90%. Эти аномалии следующие: сетчатые узоры, нерегулярное утолщение перегородки, тракционные бронхоэктазы и бибазилярные, субплевральные и симметричные соты. Результаты КТВР не считаются диагностическими при наличии паренхиматозных микронузел, небольших бронховаскулярных узелков или обширного помутнения матового стекла.Отклонения от нормы HRCT коррелируют с функциональными аномалиями. 22 Аномалии, обычно обнаруживаемые при БАЛ, представляют собой нейтрофилию, иногда в сочетании с умеренной эозинофилией. Лимфоцитоз не является характерным признаком ИЛФ, и у пациентов с количеством лимфоцитов более 15% или количеством эозинофилов более 20% следует исключить другие возможные альтернативные диагнозы4 Диагноз. Окончательный диагноз IPF требует наличия гистологической картины UIP. Был установлен набор критериев, позволяющих диагностировать с чувствительностью более 90%, когда образцы биопсии легких недоступны (Таблица 9).3,4 Диагноз IPF клинико-патологический. Следует подчеркнуть, что простое обнаружение картины ПВП при гистологическом исследовании паренхимы легкого не является синонимом диагноза ИПФ. Этот гистологический паттерн также может быть связан с другими клиническими проявлениями (Таблица 10). Прогноз. У этого заболевания плохой прогноз. Около 50% пациентов умирают в течение 3-5 лет после постановки диагноза26. Лечение. Не найдено терапии, изменяющей прогноз этого заболевания.Единственная терапевтическая стратегия, которая показала свою эффективность для некоторого увеличения выживаемости, – это комбинированное лечение кортикостероидами и азатиоприном. ATS / ERS установили руководящие принципы относительно терапевтического режима, который следует использовать (Таблица 11) .3 Это принимает форму терапии кортикостероидами, вводимой в комбинации с циклофосфамидом или азатиоприном. Азатиоприн используется чаще, чем циклофосфамид, поскольку он вызывает меньше побочных эффектов. Когда кортикостероиды противопоказаны, пациента можно лечить азатиоприном или циклофосфамидом.Колхицин, антифибротический агент, может быть альтернативой для пациентов с плохой переносимостью кортикостероидов или иммуносупрессивной терапии. Рекомендуемая доза составляет от 0,6 до 1,2 мг в сутки. Продолжительность лечения зависит от течения заболевания, но рекомендуется сохранение первоначального режима не менее 6 месяцев. Если будет установлено, что состояние пациента улучшилось или стабилизировалось, следует продолжить тот же режим. Если состояние пациента ухудшилось после 6-12 месяцев лечения, следует рассмотреть возможность трансплантации легкого.Некоторые пациенты остаются стабильными в течение длительного времени без лечения. Это пациенты с небольшими или незначительными симптомами и лишь незначительными функциональными нарушениями легких. В таких случаях, пока не станут доступны эффективные антифибротические фармацевтические препараты, врач может решить не начинать лечение до тех пор, пока не будут отмечены клинические или функциональные изменения, указывающие на прогрессирование заболевания27. Недавнее исследование продемонстрировало значительное улучшение функции легких у небольшой группы пациентов. лечится интерфероном γ-1b.28 В настоящее время проводятся исследования для подтверждения эффективности этого препарата, и предварительные результаты показали увеличение продолжительности жизни. 0 Неспецифическая интерстициальная пневмония Это клинико-патологическое образование, впервые описанное в 1994 году, которое включает группу интерстициальных легких. расстройства, которые проявляются патологическими отклонениями, не характерными для других форм идиопатической интерстициальной пневмонии. Еще несколько лет назад NSIP входил в общий термин IPF, хотя теперь известно, что это полностью дифференцированная сущность.4,29 Клинические особенности. Начало болезни коварное или подострое, с кашлем и одышкой при физической нагрузке. Приблизительно у 50% пациентов наблюдаются конституциональные симптомы, а у 30% – удары пальцами. НПВП может быть идиопатическим (60% случаев) или вызванным лекарством, или он может быть связан с коллагеновой болезнью, EAA или острым респираторным дистресс-синдромом в анамнезе. Рентгенография грудной клетки и КТВР выявляют неспецифические, недиагностические характеристики. Это симметричные и базальные помутнения матового стекла, иногда связанные с сетчатыми узорами.Соты – редкость. Иногда результаты HRCT в NSIP могут быть идентичны результатам, связанным с IPF. Результаты БАЛ различны и не являются диагностическими. В некоторых случаях паттерны как UIP, так и NSIP наблюдались у одних и тех же пациентов, что побудило некоторых авторов рассматривать NSIP как предшественник UIP. Две подгруппы расстройств NSIP были определены в соответствии с патологическими данными: Группа I, в основном с воспалением; и группа II, преимущественно с фиброзом.23 Диагноз.Это следует установить с помощью хирургической биопсии легкого. Прогноз. Это зависит от степени воспаления, наблюдаемого в образцах биопсии. В любом случае прогноз для пациентов с NSIP более благоприятен, чем прогноз для пациентов с IPF.29 Лечение. Пероральные кортикостероиды (преднизон или аналог) в дозе 1 мг / кг веса (максимум 80 мг) в течение одного месяца. Затем дозу снижают на 10 мг каждые 15 дней до 20 мг. Эта доза сохраняется в течение 2 недель, после чего она снижается до 5-10 мг через день, режим сохраняется до клинического разрешения и стабилизации параметров дыхательной функции.Если пациент не отвечает на лечение кортикостероидами, азатиоприн добавляется с использованием режима дозирования, рекомендованного для IPF.3 Криптогенная организующая пневмония Согласованное заявление ATS / ERS рекомендует использовать термин криптогенная организующая пневмония (COP), а не термин классический термин облитерирующий бронхиолит, организующий пневмонию (БОП) по двум причинам: во-первых, организующаяся пневмония является основной патологической характеристикой заболевания; и, во-вторых, облитерирующий бронхиолит присутствует не во всех случаях.Кроме того, термин COP позволяет избежать путаницы с заболеваниями дыхательных путей (облитерирующий констриктивный бронхиолит) .4 Клинические особенности. Начало болезни подострое с прогрессирующим кашлем и одышкой, часто связанное с лихорадкой (что приводит к путанице с респираторными инфекциями), астенией и умеренной потерей веса. В некоторых случаях начало острое с тяжелой дыхательной недостаточностью. КС может быть идиопатическим или быть связанным с коллагенозом, инфекциями, приемом лекарств или лучевой терапией. Рентгенография грудной клетки показывает изображения односторонних или двусторонних областей консолидации, иногда мигрирующих и повторяющихся.В некоторых случаях присутствует узловой или мелкий ретикуло-узловой узор. Результаты HRCT (области консолидации воздушного пространства с субплевральным или перибронхиальным распределением) являются полезным руководством для диагностики. БАЛ выявляет выраженный лимфоцитоз, часто связанный с умеренной нейтрофилией и / или эозинофилией, вместе со сниженным соотношением CD4 + / CD8 + Т-лимфоцитов.4 Диагноз. Диагностика COP требует последовательной клинической и рентгенологической картины и гистологического доказательства организации пневмонии в образцах трансбронхиальной или хирургической биопсии.В этом контексте отклонения БАЛ могут помочь подтвердить диагноз. 4 Прогноз. Прогноз благоприятный, поскольку после лечения кортикостероидами состояние пациента обычно улучшается. Однако в некоторых случаях может развиться фиброз. Лечение. Пероральные кортикостероиды в режиме дозирования, используемом для NSIP. Рецидив заболевания возникает у 50–60% пациентов, обычно через 6–12 месяцев после начала лечения, когда доза кортикостероидов обычно снижается до 10 мг или меньше.В таких случаях дозу следует увеличить до 20–30 мг / сут. Рецидив обычно не влияет на долгосрочный прогноз.30 Если пациент не отвечает на лечение или ему требуется длительное лечение кортикостероидами, может быть добавлен азатиоприн в той же схеме дозировки, что и при IPF. Однако опыта действия этого препарата при КС нет. Острая интерстициальная пневмония Это клинико-патологическое заболевание, характеризующееся наличием диффузного альвеолярного поражения в паренхиме легкого.Диффузное альвеолярное поражение – гистопатологическая картина, характерная для острого респираторного дистресс-синдрома. Это может быть вызвано инфекциями, вдыханием токсичных продуктов, приемом лекарств, лучевой терапией и болезнью коллагена. Термин AIP следует использовать исключительно в случаях идиопатического острого респираторного дистресс-синдрома. Вероятно, что случаи, описанные как болезнь Хаммана-Рича, на самом деле были AIP. Термин AIP не следует использовать в случаях диффузного поражения альвеол, связанного с обострениями IPF.4,31 Клинические особенности. Заболевание развивается остро и иногда связано с гриппоподобным синдромом, который прогрессирует до острой дыхательной недостаточности, требующей искусственной вентиляции легких. Рентгенография грудной клетки выявляет двусторонние альвеолярные инфильтраты. HRCT демонстрирует образцы матового стекла и области консолидации, которые были связаны с экссудативной фазой диффузного альвеолярного повреждения. В пролиферативной и фиброзной фазах становятся очевидными тракционные бронхоэктазы и соты. 32 Прогноз.Прогноз при АИП плохой. Через два месяца после постановки диагноза выживаемость пациентов составляет 50%. Было высказано предположение, что в случаях экссудативной фазы болезни прогноз лучше. У выживших пациентов может наблюдаться полное выздоровление, рецидив или развитие хронической ЛЛБЗ.31,33 Диагноз. Это должно быть установлено хирургической биопсией легкого. Лечение. Хотя никаких контролируемых испытаний не проводилось, было показано, что лечение высокими дозами кортикостероидов (100–250 мг / сут метилпреднизолона внутривенно) эффективно при экссудативной стадии заболевания.31 Интерстициальное заболевание легких, ассоциированное с респираторным бронхиолитом RB-ILD – очень редкое клинико-патологическое заболевание, характеризующееся, как следует из названия, респираторным бронхиолитом, связанным с DILD. Респираторный бронхиолит, поражение, вызванное курением, характеризуется накоплением пигментных макрофагов в бронхиолах. В некоторых случаях поражения распространяются на альвеолы, вызывая RB-ILD. Заболевание поражает курильщиков с экспозицией 30 пачек лет и более. RB-ILD может представлять собой начальную стадию DIP (см. «Десквамативная интерстициальная пневмония»).4 Клинические особенности. Клинические признаки такие же, как у DILD, хотя симптомы не очень очевидны. Рентгенограммы грудной клетки и КТВР показывают утолщение стенок бронхов и матового стекла или небольшие ретикулонодулярные узоры. Жидкость БАЛ содержит гиперпигментированные макрофаги. Диагностика. Это должно быть установлено хирургической биопсией легкого. Прогноз. Заболевание протекает благоприятно, побочных эффектов нет. Лечение. Отказ от курения или уменьшение количества выкуриваемых сигарет в день излечивает болезнь.Если симптомы и / или рентгенологические нарушения или нарушения функции легких сохраняются, кортикостероиды следует вводить в соответствии с режимом дозирования, указанным в NSIP.4 Десквамативная интерстициальная пневмония Это состояние, характеризующееся внутриальвеолярным скоплением макрофагов. Считается, что это более поздняя стадия РБ-ILD из-за сходной патологии и связи с курением сигарет. Еще несколько лет назад DIP считался представителем воспалительной стадии IPF, но было продемонстрировано, что нет никакой связи между этими двумя заболеваниями.4,23 Клинические особенности. Начало болезни коварное или подострое и характеризуется кашлем и одышкой при физической нагрузке, но без конституциональных симптомов. В некоторых случаях заболевание может прогрессировать до тяжелой дыхательной недостаточности. Клубы возникают у 50% пациентов. DIP редко встречается вместе с другими заболеваниями. Описаны случаи, связанные с заболеваниями коллагена, хотя, поскольку во всех этих случаях были курильщики, возможно, причиной DIP был табак, а не коллагеноз.Рентгенограмма грудной клетки и сканирование HRCT не являются диагностическими и выявляют диффузные помутнения матового стекла, иногда связанные с ретикулярными линиями. Как и в случае RB-ILD, жидкость БАЛ содержит гиперпигментированные макрофаги с различными отклонениями в их клеточной форме. Диагностика. Это устанавливается с помощью хирургической биопсии легкого. Прогноз. Прогноз благоприятный, улучшение или излечение достигается путем прекращения курения и лечения кортикостероидами.4 Лечение.Пациенты должны бросить курить и получать кортикостероиды в режиме дозирования, рекомендованном для НПВП. Лимфоидная интерстициальная пневмония (LIP) LIP – это заболевание, характеризующееся интерстициальными лимфоидными инфильтратами в паренхиме легких. Ранее это считалось легочным лимфопролиферативным заболеванием, предшественником легочной лимфомы. Однако сейчас было продемонстрировано, что LIP ассоциируется с лимфомами только в редких случаях4,23 Клинические особенности.Начало болезни подострое, с кашлем, одышкой при физической нагрузке и сопутствующими конституциональными симптомами (артралгии, лихорадка и потеря веса). Анализы крови часто выявляют анемию и гипергаммаглобулинемию. LIP обычно ассоциируется с другими заболеваниями, такими как заболевания коллагена, аутоиммунные нарушения (болезнь Хашимото, миастения, злокачественная анемия, первичный билиарный цирроз) и иммунодефицитные состояния (агамма-глобулинемия). Рентгенограмма грудной клетки и КТР не являются диагностическими и выявляют помутнения матового стекла, хотя также могут встречаться ретикулярные и узловые узоры.БАЛ не является диагностическим и выявляет лимфоцитоз. Диагностика. Диагноз устанавливается на основании хирургической биопсии легкого. Прогноз. Семьдесят процентов пациентов реагируют на лечение кортикостероидами. У 20–30% пациентов болезнь прогрессирует до фиброза легких. 4 Лечение. Назначение кортикостероидов в режимах дозирования, рекомендованных для НПВП. Саркоидоз Саркоидоз – системное гранулематозное заболевание неизвестной этиологии, которое обычно поражает легкие и грудные лимфатические узлы, реже кожу и глаза, а иногда и другие органы.34,35 Саркоидоз, вероятно, является результатом воздействия факторов окружающей среды, которые вызывают иммунологический ответ у генетически предрасположенных людей. Заболеваемость трудно оценить, поскольку заболевание часто протекает бессимптомно и зависит от географического района и этнической группы. Заболеваемость в Испании оценивается примерно в 1,36 случая на 100 000 жителей36 Клинические особенности. Это заболевание встречается в основном у взрослых до 40 лет. Проявления сильно варьируются и могут быть острыми, подострыми или хроническими.Пациенты могут протекать бессимптомно (30% случаев) или иметь клинические признаки, которые являются системными и / или связаны с пораженным органом. Прототипом острого саркоидоза является синдром Лёфгрена, который проявляется в форме лихорадки, артралгии (в основном в лодыжках), узловатой эритемы и симметричной двусторонней внутригрудной лимфаденопатии с правой паратрахеальной аденопатией или без нее. Другой, менее распространенной формой острого проявления является синдром Хеерфордта (передний увеит, паротит, паралич лицевого нерва и лихорадка).Хронический саркоидоз, часто рецидивирующий, характеризуется симптомами, связанными с пораженными органами, особенно органами дыхания. 34,35 Клинические признаки и их частота показаны в Таблице 12. Два наиболее характерных результата рентгенографии грудной клетки (внутригрудная лимфаденопатия и легочная лимфаденопатия). инфильтраты) служат в качестве основы для определения стадии заболевания (таблица 13) .37 HRCT сканирование – полезный инструмент для постановки диагноза, поскольку они подтверждают наличие увеличенных узлов и легочных инфильтратов.Характерными признаками являются мелкие узелковые и ретикулонодулярные узоры, распространенные в основном в перибронховаскулярных и субплевральных областях. БАЛ выявляет лимфоцитоз и увеличение соотношения CD4 + / CD8 + Т-лимфоцитов. Отношение CD4 + / CD8 + больше 3,5 очень характерно для саркоидоза и имеет специфичность 94%. 37 Сканирование легкого с использованием галлия-67 бесполезно для оценки болезни. Визуализация галлия всего тела может быть полезна в нескольких очень специфических и трудно диагностируемых случаях. Диагностика.Диагноз саркоидоз устанавливается путем исключения. Это всегда требует: а) совместимой клинической и рентгенологической картины; б) наличие саркоидных гранулем в гистологических образцах; и c) исключение других заболеваний, способных вызывать аналогичную клиническую или гистологическую картину, в частности других гранулематозных заболеваний (Таблица 14) .37 Трансбронхиальная биопсия является наиболее полезным методом для демонстрации гранулем из-за ее высокой чувствительности (80% -90%). ). Решение о том, какие другие органы следует провести биопсию, будет зависеть от того, какие органы поражены.Когда гистологический диагноз не может быть установлен, диагноз с высокой вероятностью приемлем в следующих ситуациях: а) синдром Лёфгрена и б) совместимая клиническая и рентгенологическая картина вместе с соотношением CD4 / CD8 3,5 или выше в БАЛ. Тест Квейма больше не используется очень часто из-за сложности получения стандартизованного антигена. Это связано с плохой стандартизацией и тем, что антиген является потенциальным переносчиком болезней. Ответ на отложенные тесты кожной гиперчувствительности снижается в периоды, когда заболевание активно, так что эти тесты могут служить неинвазивным методом наблюдения за прогрессом заболевания.8 Прогноз. Это вариабельно, поскольку болезнь может исчезнуть спонтанно или в результате лечения. В случае синдрома Лёфгрена спонтанная ремиссия наступает в 85% случаев. Прогноз при легочном саркоидозе связан с рентгенографической стадией (стадия I, ремиссия в 85% случаев в течение 2 лет после постановки диагноза; стадия II в 40-70% случаев; стадия III в 10-20% случаев. и IV стадия – в 0% случаев). Прогноз хуже для пациентов старше 40 лет, чернокожих пациентов и пациентов с симптомами, которые сохраняются более 6 месяцев, или когда поражено более 3 органов, или имеется сопутствующая ознобенная волчанка.При внелегочных проявлениях прогноз зависит от степени поражения органа и реакции пациента на лечение. Желательно следить за развитием всех пациентов в течение 3 лет после ремиссии заболевания или окончания лечения, так как рецидив наблюдается в 10% случаев.37,38 Лечение. Лечение саркоидоза является спорным из-за изменчивости исходных клинических признаков, их тяжести и прогрессии, а потому, что болезнь может спонтанная ремиссия. Первоначальное лечение принимает форму кортикостероидной терапии. Нет единого мнения о начале, продолжительности, дозировке или показаниях. Тем не менее, более или менее единообразные схемы могут быть составлены на основе результатов контролируемых и открытых исследований, которые были проведены. 39-41 Показания к нему хорошо определены в случае тяжелого внелегочного саркоидоза, в основном в случае сердечного и легочного саркоидоза. неврологические, глазные, печеночные, мышечные и кожные поражения, а также при гиперкальциемии. При легочном саркоидозе кортикостероиды эффективны в краткосрочной и среднесрочной перспективе, но не было представлено никаких доказательств того, что они изменяют течение болезни. 39 Лечение не показано на стадии I из-за высокой частоты спонтанной ремиссии. На стадиях II и III лечение начинают, если у пациента появляются симптомы и / или функциональные нарушения легких. При отсутствии симптомов или функциональных аномалий лечение следует начинать через 6 месяцев после постановки диагноза, если интерстициальные инфильтраты сохраняются или есть признаки прогрессирования заболевания.На IV стадии следует лечить всех пациентов. Начальная доза составляет 40 мг / сут преднизона или эквивалентной дозы другого кортикостероида, принимаемых перорально в течение 1 месяца, после чего доза постепенно снижается (см. Лечение NSIP). Рекомендуемая продолжительность лечения – не менее 12 месяцев. При IV стадии начальная рекомендуемая доза составляет 1 мг / кг. В случае рецидива может потребоваться изменить или перезапустить схему лечения и сохранить эффективную дозу. Некоторым пациентам требуется лечение поддерживающей дозой кортикоидов в течение многих лет (42-45 Ингаляционные кортикостероиды не являются подходящей заменой пероральных препаратов.Однако они показаны в случаях с гиперреактивностью бронхов и в качестве поддерживающего лечения для пациентов с легким саркоидозом легких, первоначально получавших пероральные кортикоиды. 39 В случаях хронического легочного саркоидоза и тяжелого внелегочного саркоидоза использовались другие препараты, такие как противомалярийные средства (лечение первой линии при тяжелом кожном и назальном саркоидозе и гиперкальциемии) и иммунодепрессанты, особенно метотрексат и азатиоприн. Однако опыт применения этих методов лечения невелик. Иммунодепрессанты использовались отдельно для лечения хронического кортикоид-устойчивого саркоидоза, но в основном они используются в комбинации с кортикоидами для снижения дозы последних. Азатиоприн рекомендуется в качестве первого выбора, а метотрексат – в качестве второго выбора. Другие препараты, которые иногда использовались, – это талидомид и антитела против фактора некроза опухолей альфа.42-45 Рекомендуемые дозы этих препаратов показаны в таблице 15. Болезни коллагена Некоторые пациенты с заболеваниями коллагена (ревматоидный артрит, системный склероз, дерматомиозит / полимиозит, системная красная волчанка, синдром Шегрена, заболевание соединительной ткани) могут проявляться DILD в течение болезни.DILD, ассоциированный с коллагеновыми заболеваниями, представляет собой идиопатическую интерстициальную пневмонию, в основном UIP и NSIP46-50 (Таблица 16). Клинические особенности. Клинические, рентгенологические и функциональные проявления, а также данные о БАЛ аналогичны таковым при идиопатической интерстициальной пневмонии без сопутствующего коллагеноза. Хотя субклинический альвеолит при БАЛ является относительно обычным явлением, клиническое и прогностическое значение этого неясно. У пациентов с дерматомиозитами / полимиозитами, системной волчанкой или склерозом сопутствующее поражение дыхательных мышц встречается относительно часто.Особый интерес представляет антисинтетазный или синдром Jo-1. Это характеризуется наличием антител против Jo-1 у пациентов с полимиозитом / дерматомиозитом. Подсчитано, что антитела против Jo-1 обнаруживаются у 30% пациентов с дерматомиозитом. Наличие этого антитела связано с лучшим ответом на лечение.51 Пациенты с системным склерозом часто имеют положительный титр антител Scl-70.46 Диагноз. Диагностические критерии такие же, как и при идиопатической интерстициальной пневмонии без сопутствующего коллагеноза.4,23 Прогноз. Исторически считалось, что прогноз был более благоприятным для DILD, когда он был связан с заболеваниями коллагена. Однако в результате новой классификации идиопатических интерстициальных пневмоний несколько больниц проанализировали гистопатологические характеристики случаев ЛБЗ, связанных с коллагенозом, и отметили, что многие случаи, зарегистрированные как НВП, на самом деле были NSIP. Это могло объяснить лучший прогноз в таких случаях. Это относится к системному склерозу, поскольку было продемонстрировано, что 80% случаев ЛБЗ, связанной с этойазой, были NSIP.52 Лечение. Лечение такое же, как и в случае идиопатической интерстициальной пневмонии, не связанной с коллагенозом, за исключением пациентов, страдающих дерматомиозитом или системным склерозом. В случае дерматомиозита добавление циклоспорина оказалось эффективным у пациентов, состояние которых не отвечало на кортикостероиды и иммуносупрессивную терапию, в основном, когда антитела против Jo-1 были положительными.53 При системном склерозе с альвеолитом (диагностирован на на основе результатов КТВР), комбинированное введение циклофосфамида и кортикостероидов оказалось эффективным.Кортикостероиды вводятся перорально (см. Лечение NSIP), а циклофосфамид болюсно в дозировке 750 мг / м² / месяц в течение 6 месяцев, а затем 750 мг / м² / ежеквартально в течение 1 года. Если наблюдается улучшение или сохраняется альвеолит, рекомендуется продолжить лечение еще на год.54 Внешний аллергический альвеолит EAA, также известная как пневмонит гиперчувствительности, представляет собой форму ЛЗП, вызванную вдыханием органических агентов, хотя и неорганических. вещества (изоцианаты) также могут вызывать это заболевание.Поскольку количество органических продуктов, которые люди могут вдыхать, очень велико, причин EAA становится все больше. Наиболее распространенными формами EAA являются легкие птицы и фермера. В Испании диагностируют и другие типы: аспартоз, перламутровое легкое, альвеолит, вызванный кондиционером, легкое с ультразвуковым увлажнителем, легкое для чистки колбас, субероз, изоцианатное легкое, соевое легкое и легкое Candida.55-57 Клинические особенности. Начало острой формы этого заболевания обычно происходит через 2-8 часов после контакта с источником антигена и проявляется в форме одышки, кашля, лихорадки, астении, стеснения в груди, боли в суставах и мышцах, озноба и потливости.Рентгенография грудной клетки характеризуется тонким милиарным или альвеолярным узором, а КТВР выявляет пятнистые помутнения матового стекла с участками гиперлюценции и мелкими узловыми узорами. Симптомы исчезают самопроизвольно, если избегать контакта с антигеном. Подострая форма возникает после продолжительных, но не массивных ингаляций возбудителя. Клиническая картина помимо респираторных симптомов характеризуется астенией, похуданием, общим недомоганием и повышенным недомоганием. Рентгенография грудной клетки и результаты КТР аналогичны таковым при острой форме.Клинические признаки хронической формы либо аналогичны таковым при IPF, либо состоят из кашля и мокроты (клиническая картина аналогична хронической обструктивной болезни легких). Результаты БАЛ включают очень выраженный лимфоцитоз, мастоцитоз и пониженное соотношение CD4 + / CD8 + Т-лимфоцитов, хотя нейтрофилы и лимфоциты CD4 могут преобладать сразу после воздействия. Трансбронхиальная биопсия позволяет выявить гистологические изменения, характерные для данного заболевания.55,56 Диагноз.В случаях с характерными клиническими признаками и временным контактом с подозреваемым источником антигена диагноз может быть установлен с некоторой уверенностью. Самопроизвольное улучшение после избежания контакта с причинным антигеном и положительные результаты тестов на специфический IgG (с использованием преципитинов или иммуноферментного анализа) помогут установить диагноз. Внутрикожные тесты немедленной реакции с использованием конкретного экстракта и показаний через 15 минут после инъекции могут имитировать контакт с антигеном и служить тестом, который может различать простой контакт и болезнь.58 Тесты с бронхиальной нагрузкой показаны в трудно диагностируемых случаях и считаются «золотым стандартом» в диагностике EAA. Тестирование с бронхиальным заражением включает предварительную подготовку экстракта антигена, а тесты функции легких должны подтверждать значения FVC и DLCO выше 60% от прогнозируемых. Тест считается положительным, если выполняется любой из 3 критериев, указанных в Таблице 17.59 Если результат теста отрицательный, его повторяют на следующий день с более высокой концентрацией.Если отрицательный результат сохраняется, тест можно повторить в течение 2 дней. Пациент также может подвергаться непосредственному воздействию источника антигена в течение 5 дней. В попытке максимально стандартизировать диагноз ЭАА был предложен ряд критериев (Таблица 18) .60 Диагноз подтверждается, если выполняются 4 основных критерия и по крайней мере 2 второстепенных критерия. Прогноз. Когда болезнь диагностируется на ранней стадии и избегается контакта с антигеном, прогноз хороший, и в большинстве случаев результатом является полное излечение.В 10–20% случаев заболевание прогрессирует до фиброза легких или хронической обструкции дыхательных путей (хронические формы). Лечение. Это состоит в том, чтобы избегать контакта с антигеном. При сохранении клинических признаков и рентгенологических нарушений или нарушений функции легких обычно назначают кортикостероиды (см. Дозировку, рекомендованную для лечения НПВП), хотя нет никаких доказательств того, что прием этих препаратов изменяет долгосрочный прогноз. Радиотерапия Паренхима легких всегда реагирует на облучение при облучении, но симптомы возникают только у 5–15% пациентов.Появление ЛЗЗ зависит от нескольких факторов: индивидуальной восприимчивости, объема легкого, попадающего в поле облучения, используемой дозы облучения, предшествующего анамнеза заболевания легких и сопутствующей терапии определенными цитостатическими препаратами.61 Клинические особенности. Выделяют 3 клинические формы этого заболевания: пневмонит, фиброз и организующая пневмония. Радиационно-индуцированный пневмонит обычно появляется через 3-6 месяцев после облучения, достигая максимальной интенсивности обычно через 4-6 недель.Для него патологически характерно наличие диффузного альвеолярного поражения. Рентгенография грудной клетки выявляет пятнистые или сливающиеся альвеолярные узоры, которые обычно совпадают с полем облучения, но могут выходить за пределы этой области и даже могут быть противоположными. Помимо респираторных симптомов, пациенты могут испытывать боль в груди и недомогании. Рентгенография грудной клетки и КТВР выявляют сетчатый или сотовый рисунок, иногда с тракционным бронхоэктазом. Описаны случаи организации пневмонии после облучения легких, в основном в случае лечения рака груди, который может поражать легкие, противоположные облучению.61 Диагностика. Диагноз радиационно-индуцированного пневмонита и фиброза устанавливается на основании предшествующего анамнеза лучевой терапии и клинической и рентгенологической картины, соответствующей этому диагнозу. Диагностические критерии организующей пневмонии, вызванной облучением, такие же, как и для идиопатической формы. Прогноз. В случае пневмонита при хорошем ответе на лечение прогноз благоприятный. Прогноз при фиброзе изменчив. Хотя большинство пациентов страдают лишь незначительно или умеренно, это состояние иногда может прогрессировать до дыхательной недостаточности.Прогноз при организации пневмонии такой же, как и при идиопатическом КС. Лечение. Кортикостероиды в дозировке, используемой для NSIP, показаны при пневмоните (см. Лечение NSIP). Однако эффективность кортикоидной терапии при лечении фиброза не доказана. Лечение вызванной радиацией организующейся пневмонии такое же, как и при идиопатической COP.61 Лекарства Лекарства, потенциально способные вызвать ЛЗЗ, многочисленны. К ним относятся химиотерапевтические средства, антиаритмические средства, антибиотики, противосудорожные средства, противовоспалительные средства и запрещенные препараты.Составление исчерпывающего списка таких препаратов не является целью данного руководства, поэтому мы отсылаем заинтересованных читателей к URL-адресу в Интернете http://www.pneumotox.com. Большая часть литературы посвящена отдельным клиническим случаям или коротким сериям случаев, поэтому эпидемиология четко не определена. Более того, не существует четко определенных критериев, позволяющих установить, вызвана ли данная клинико-патологическая картина лекарственным средством. Для большинства лекарств не было выявлено факторов, предрасполагающих пациентов к токсичности для легких, что делает такие реакции идиосинкразическими.Наряду с другими факторами, благоприятствующими легочной токсичности, являются более высокая накопленная доза, тип заболевания, которое лечат, и одновременное лечение химиотерапевтическими агентами, лучевой терапией или высокими концентрациями кислорода.62 Клинические особенности. Лекарственные препараты могут вызывать различные формы ЛЗВ: UIP, диффузное поражение альвеол, организующуюся пневмонию, LIP, DIP, NSIP, легочную эозинофилию и острый гиперчувствительный пневмонит. Клинические и рентгенологические признаки каждой формы лекарственно-индуцированной ЛЗП аналогичны таковым идиопатической формы того же заболевания.Результаты БАЛ выявляют изменчивые профили клеток, а соотношение CD4 + / CD8 + Т-лимфоцитов часто снижается. Диагностика. Диагноз устанавливается на основании предшествующего анамнеза употребления наркотиков в сочетании с клинической и рентгенологической картиной, соответствующей ЛЗЗ. Можно также заподозрить ЛБП, вызванную лекарственными препаратами, поскольку клинические признаки исчезли при прекращении лечения определенным препаратом и снова появились при возобновлении лечения. Прогноз. Это зависит от формы ДИЛД, вызванной препаратом. Лечение. Прерывание лечения подозреваемым препаратом. При сохранении клинических, рентгенологических нарушений и / или нарушений функции легких показано лечение кортикостероидами (см. Лечение NSIP). Лимфангиолейомиоматоз ЛАМ – необычное мультисистемное заболевание неизвестной причины. Он обнаруживается почти исключительно у женщин детородного возраста, поэтому вполне вероятно, что гормональные факторы вмешиваются в его патогенез. ЛАМ характеризуется аномальной пролиферацией гладкомышечных клеток и может поражать, помимо легких (гладкие перибронхиолярные, периваскулярные и перилимфатические мышцы), другие органы, такие как почки, перитонеальные лимфатические сосуды, печень, матка и поджелудочная железа.63-66 Клинические особенности. Помимо симптомов, типичных для ЛБЗ, другими признаками этого заболевания являются: рецидивирующий пневмоторакс (69%), хилоторакс (23%), кровохарканье (20%), реже асцит, перикардиальный плевральный выпот, хилоптиз и хилурия. Часто наблюдается ассоциация (60% случаев) с ангиолипомами почек. В 25% случаев ЛАМ связана с туберозным склерозом, наследственным заболеванием, характеризующимся мультиорганным гамартоматозом.67,68 На ранних стадиях заболевания рентгенография грудной клетки и КТВ выявляют микронодулярные псевдомилиарные помутнения и линии Керли B.На более поздних стадиях появляются изображения тонкостенных кист, преимущественно в базальных зонах. В соответствующем клиническом контексте изображения HRCT очень указывают на диагноз. Диагностика. Это устанавливается с помощью трансбронхиальной или хирургической биопсии легкого. Моноклональные антитела HMB-45 избирательно окрашивают мышечную пролиферацию LAM даже в образцах трансбронхиальной биопсии.63 Прогноз. Большинство случаев прогрессируют до диффузной микрокистозной деструкции легких, что приводит к тяжелой дыхательной недостаточности.В некоторых случаях при гормональном лечении наблюдалось улучшение или стабилизация. Лечение. Были использованы различные виды гормонального лечения с разными результатами, но ни в одном случае они не привели к излечению. Наилучшие результаты были получены при внутримышечном введении медроксипрогестерона ацетата в дозировке 400-800 мг / мес в течение 1 года. Если улучшения не наблюдается, рекомендуется двусторонняя овариэктомия. Лечение тамоксифеном не рекомендуется, потому что это лекарство было связано с обострением заболевания.63 Гистиоцитоз X Гистиоцитоз клеток Лангерганса – мультисистемная патологическая сущность с различными клиническими профилями в зависимости от возраста пациента и протяженности области, пораженной пролиферацией клеток Лангерганса, характерной для данного заболевания. Гистиоцитоз из клеток Лангерганса – это группа заболеваний, которая включает острую форму заболевания, которая поражает младенцев (болезнь Леттерера-Сиве), мультифокальную эозинофильную гранулему, которая поражает детей немного старшего возраста (болезнь Ханда-Шюллера-Кристиана), и гистиоцитоз X (также называется эозинофильной гранулемой или гранулематозом клеток Лангерганса), которая у взрослого человека обычно локализуется в легких.Курение вовлечено в патогенез гистоцитоза X, потому что это заболевание редко встречается у некурящих, а в легких курильщиков содержится больше клеток Лангерганса, чем у некурящих.69,70 Клинические особенности. Заболевание поражает молодых курильщиков и проявляется в виде кашля и прогрессирующей одышки при физической нагрузке. У половины больных на ранних стадиях отсутствуют симптомы. Пневмоторакс встречается часто (25% случаев) и может быть первым симптомом. Сопутствующие признаки могут включать бессимптомный несимптомный диабет (28% случаев) и кистозные поражения костей черепа, длинных костей, ребер и таза.Рентгенография грудной клетки выявляет интерстициальные инфильтраты с небольшими воздушными кистами преимущественно в апикальном распределении. HRCT четко выявляет заполненные воздухом кисты с четко очерченными стенками, и его результаты помогают установить диагноз.69–71 Недавние исследования показали, что сцинтиграфия рецепторов соматостатина может быть высокочувствительным методом для выявления активности заболевания и мониторинга реакции на лечение. Диагностика. Это установлено с использованием результатов КТВР, трансбронхиальной биопсии и БАЛ (CD1 + клетки> 5% клеток макрофагального клона).Если есть сомнения, следует провести хирургическую биопсию легкого. Диагностическим признаком является наличие гранул Бирбека, видимых под электронным микроскопом в БАЛ и при трансбронхиальной биопсии. Антитело S-100 также использовалось в образцах биопсии легких для диагностики этого состояния.69,70 Прогноз. Прогноз варьируется, поскольку заболевание может спонтанно исчезнуть, оставаться стабильным или прогрессировать до фиброза легких. Функциональные и рентгенологические отклонения и симптомы могут улучшиться, если пациент бросит курить.69,70,73 Лечение. Это заключается в отказе от курения. Кортикостероиды в дозировках, рекомендованных для других ЛПЗ (см. Лечение НПВП), могут быть эффективны на начальных стадиях заболевания. Никакие контролируемые испытания не изучали эффективность каких-либо других препаратов.70,72 Альвеолярный протеиноз Это редкое клиническое явление. Заболеваемость оценивается в 1 случай на 2 000 000 жителей. Для него характерно отложение в альвеолах компонентов ПАВ.Описаны три клинические формы: врожденная, первичная или идиопатическая и вторичная. Патогенез неизвестен, хотя недавние исследования указали на нарушения гомеостаза сурфактанта в результате ингибирования действия фактора стимуляции колоний гранулоцитов-макрофагов (GM-CSF) в первичной форме заболевания и генетических мутаций. в врожденной форме.74 Клинические особенности. Заболевание обычно диагностируется у пациентов в возрасте от 20 до 50 лет, хотя случаи были зарегистрированы у новорожденных и пожилых пациентов.Первичный альвеолярный протеиноз – наиболее частая форма (90% случаев). Вторичный альвеолярный протеиноз связан с определенными гематологическими нарушениями (миелоидный лейкоз, лимфома, анемия Фанкони, моноклональная гаммапатия IgG), воздействием неорганической пыли (силикат, алюминий и титан), лекарств (бусульфан, хлорамбуцил) и инфицированием вирусом иммунодефицита человека. . Связь с инфекциями (Nocardia asteroides, Mycobacterium tuberculosis и другими условно-патогенными микроорганизмами) может быть причиной или следствием заболевания. Заболевание обычно проявляется кашлем и одышкой при физической нагрузке. Примерно у 30% пациентов симптомы отсутствуют. Лихорадка указывает на наличие суперинфекции, хотя продолжительная субфебрильная температура может быть выражением самого заболевания. В 30% случаев пациенты обращаются с цифровыми клубами. Уровни лактатдегидрогеназы в сыворотке часто повышены. На простой рентгенограмме грудной клетки могут быть видны двусторонние и симметричные альвеолярные инфильтраты, более выраженные в перихилярных зонах (крылья бабочки), но они могут быть преимущественно периферическими или базальными и, в некоторых случаях, являются единственной находкой у бессимптомных пациентов.ВРКТ может выявить помутнения матового стекла, уплотнение воздушного пространства с утолщением межлобулярных перегородок (что приводит к «сумасшедшей дорожке») 74. Диагноз. Диагноз может быть установлен на основании данных БАЛ и трансбронхиальной биопсии. Жидкость, полученная из БАЛ, имеет молочный вид. Анализ показывает материал, который является PAS-положительным и отрицательным по альциановому синему, с высокой концентрацией общих фосфолипидов (фосфатидилглицерин) и наличием пластинчатых тел, видимых при электронном микроскопическом исследовании.Обнаружение сывороточных аутоантител против GM-CSF полезно в серологической диагностике идиопатического альвеолярного протеиноза благодаря его высокой чувствительности и специфичности.74 Прогноз. Это переменно. В 25% случаев заболевание проходит самопроизвольно, хотя может прогрессировать до дыхательной недостаточности. Основными факторами, определяющими течение заболевания, являются легочные инфекции, вызванные условно-патогенными микроорганизмами.74 Лечение. Он состоит из серийных лечебных БАЛ, которые показаны в случаях прогрессирующего заболевания.75,76 Недавно некоторые авторы сообщили о случаях лечения с помощью GM-CSF с хорошими результатами.77 Альвеолярный микролитиаз Альвеолярный микролитиаз – редкое заболевание неизвестной этиологии, характеризующееся наличием кальцифицированных тел (микролитов) внутри альвеолярного отростка. пробелы. Тот факт, что в литературе описано всего около 300 случаев, свидетельствует об очень низкой распространенности этого расстройства. Около 60% случаев представляют собой выраженные семейные отношения, особенно у монозиготных близнецов, что предполагает рецессивную аутосомную передачу.78,79 Клинические особенности. Это заболевание чаще встречается в третьем, четвертом и пятом десятилетиях жизни, хотя зарегистрированы случаи у младенцев и пожилых людей. Около 70% пациентов на момент постановки диагноза не имеют симптомов. Рентгенограмма грудной клетки и результаты КТВР являются характерными и выявляют диффузную двустороннюю картину микронодулей (1-5 мм). Облитерация границ сердца и диафрагмы в сочетании с увеличением линейной радиопрозрачности между паренхимой и грудной клеткой (так называемая черная плевральная линия) считается характерной чертой этого заболевания.80 Диагностика. Это устанавливается на основании рентгенологических данных и результатов трансбронхиальной или хирургической биопсии легкого.79 Прогноз. Течение болезни вариабельное. Было описано столько же случаев с течением более 30 лет без клинического ухудшения, сколько случаев прогрессировало до фиброза легких и дыхательной недостаточности.78,79 Лечение. Специфического лечения этого заболевания нет. Легочные эозинофилии Это клинический синдром, охватывающий различные процессы, которые приводят к периферической эозинофилии и легочным инфильтратам с эозинофилией.81 Таблица 19 показывает причины легочной эозинофилии. Наиболее частая причина – хроническая эозинофильная пневмония. Паразитами, наиболее часто связанными с легочной эозинофилией, являются токсокары и аскариды. Некоторые препараты вызывают легочную эозинофилию, информацию о которых можно найти в Интернете по адресу www.pneumotox.com. На этом веб-сайте периодически обновляется информация о воздействии этих препаратов на легкие. Кроме того, некоторые клинические проявления могут быть связаны с легочной эозинофилией, хотя это бывает редко и не является одной из основных характеристик клинической картины.Эти состояния включают некоторые инфекционные заболевания (гистоплазмоз, кокцидиоидомикоз) и новообразования (болезнь Ходжкина). Клинические особенности. Клиническая картина легочных эозинофилий характеризуется симптомами, типичными для DILD – лихорадкой, астенией, потерей веса и ночным потоотделением, что объясняет, почему ее иногда путают с легочными инфекциями. Характерными признаками рентгенографии грудной клетки являются изменения и рецидивирующие периферические альвеолярные инфильтраты, распределенные преимущественно в верхних полях легких.ВРКТ может помочь в диагностике в случаях с атипичными результатами рентгенографии грудной клетки. Периферическая эозинофилия присутствует в 85% случаев. Когда заболевание активно, эозинофилия всегда присутствует в ЖБАЛ, обычно составляя более 40% от общего числа клеток. Острая эозинофильная пневмония – это кратковременное острое лихорадочное заболевание, характеризующееся дыхательной недостаточностью, которая обычно требует искусственной вентиляции легких. Рентгенография грудной клетки показывает двусторонние альвеолярные инфильтраты. 81 Диагноз. Диагноз устанавливается на основании сопоставимой клинической и рентгенологической картины, эозинофилии в периферической крови и БАЛ или на основании трансбронхиальной биопсии.Всегда следует исключать аллергический бронхолегочный аспергиллез, лекарственные заболевания, васкулит и паразитоз. Диагностические критерии аллергического бронхолегочного аспергиллеза различны в Великобритании и США. Обычно используемые критерии показаны в Таблице 20 вместе с критериями Розенберга и др. 82,83. Розенберг и др. 83 включают положительные результаты теста на преципитин против Aspergillus, проксимальных бронхоэктазов и повышенный уровень IgE в сыворотке среди основных критериев. Чтобы исключить возможность заражения паразитами, следует проводить 3 измерения паразитов в кале, 1 раз в 15 дней, чтобы перекрыть проход через кишечник во время цикла паразита. Прогноз. Это зависит от этиологии. Легочные эозинофилии, вызванные лекарствами и гельминтами, постепенно излечиваются после того, как возбудитель был устранен. Рецидив клинических признаков и симптомов обычен в случае бронхолегочного аспергиллеза, а в некоторых случаях болезнь вызывает необратимую обструкцию дыхательных путей. В 50% случаев у пациентов с хронической эозинофильной пневмонией наблюдается рецидив после прекращения лечения кортикостероидами. Прогноз при острой эозинофильной пневмонии благоприятный, рецидивы редки.Легочные инфильтраты обычно исчезают в течение 48-72 часов после приема кортикостероидов.81,84 Лечение. Пероральные кортикостероиды в дозировке 0,5-1 мг / кг в сутки. Дозу постепенно уменьшают в зависимости от течения заболевания. Лечение, как правило, следует продолжать от 6 до 12 месяцев, и иногда требуется низкая доза в течение нескольких лет. Лечение острой эозинофильной пневмонии заключается в высоких дозах метилпреднизолона (1-2 мг / кг каждые 6 часов в течение 2-3 дней) с последующим введением более низких доз (0.5 мг / кг в течение 2 недель) и постепенное снижение дозы до завершения лечения. 81,84 Пневмокониоз Это ЛЗЗ, вызванная вдыханием частиц неорганической пыли. Общей характеристикой всех форм болезни является латентный период – обычно более 20 лет – между воздействием и появлением симптомов или диагностики. Также интересно отметить, что существует прямая зависимость между степенью воздействия (включая как интенсивность, так и продолжительность) и количеством пыли, осевшей в легких.В таблице 21 перечислены неорганические агенты, которые чаще всего вызывают пневмокониоз при вдыхании. 85-87 Результаты гистологии легких варьируются от образования силикотических узелков в случае силикоза до интерстициального фиброза в случае асбеста и простого отложения. частиц железа в легких при сидерозе. Во многих случаях человек, подвергшийся воздействию, вдыхает пыль, содержащую диоксид кремния и силикаты в различных пропорциях, или пыль, загрязненную волокнами асбеста, что объясняет вариабельность гистологических данных, а также клинических и радиологических проявлений смешанных форм заболевания. Клинические особенности. Клиническая картина такая же, как и при других формах ЛБЗ. Рентгенография грудной клетки – это рекомендуемый метод выявления пневмонокониоза. Он использовался в качестве метода проверки при проверках на рабочем месте, особенно в случае шахтеров. Существует соглашение о прочтении и классификации рентгенологических отклонений в легких. Международное бюро труда (МОТ) опубликовало свои последние рекомендации по чтению изображений грудной клетки в 1980 году.Они охватывают обнаружение узловых и интерстициальных поражений легких, а также аппендикс на предмет поражения плевры. Радиологи и пневмологи, которые читают рентгенограммы и классифицируют их в соответствии с рекомендациями МОТ, должны пройти предварительную подготовку. Однако с момента появления HRCT эта классификационная система использовалась реже.87 HRCT грудной клетки позволяет лучше определить поражения плевры и легочные пневмокониотические поражения размером менее 2 мм. Это рекомендуемая процедура, когда результаты рентгенографии грудной клетки не являются диагностическими или при подозрении на сопутствующие заболевания, такие как туберкулез, неоплазия легких или эмфизема. Диагностика. Это основано на наличии клинической картины и рентгенологических результатов, согласующихся с этим диагнозом, в сочетании с предшествующей историей воздействия потенциально причинных неорганических агентов. В некоторых случаях история болезни, клинические признаки и рентгенологические результаты недостаточны для постановки окончательного диагноза. В таких случаях может потребоваться гистологическое исследование легкого. Минералогическое исследование образцов легких иногда необходимо для демонстрации наличия легочного отложения неорганического агента.Рекомендуется выполнять этот анализ на хирургических образцах, поскольку образцы трансбронхиальной биопсии не репрезентативны для легкого в целом. Поскольку определенное количество неорганических отложений в легких существует в общей популяции, минералогический анализ должен быть количественно оценен и сравнен с предсказанными значениями для соответствующей популяции. Анализ с использованием оптической микроскопии и микроскопии в поляризованном свете позволяет обнаруживать элементы с двойным лучепреломлением, такие как асбестовые тела, силикаты, не содержащие волокон, и кремнезем.Однако большинство частиц или волокон размером менее 5 мкм не видны, и определить их природу с помощью химического анализа невозможно. Количественная оценка отложений неорганической пыли в легких требует разрушения органического материала путем сжигания или химического расщепления, а также идентификации частиц волокна с помощью электронной микроскопии и аналитических методов (методы, выходящие за рамки большинства больниц, специализирующихся на респираторной медицине в Испании). Самый доступный метод – это энергодисперсионный анализ рентгеновских лучей (EDAX).Результат выражается в количестве неорганических элементов на грамм сухого легкого. В случае асбеста воздействие может быть подтверждено с помощью BAL.87 Считается, что присутствие 1 или более асбестовых тел на миллилитр указывает на воздействие этого агента на рабочем месте11 Обработка. Когда болезнь уже началась, эффективного лечения не существует. Исключением является бериллиоз, который может улучшиться после лечения кортикостероидами. Другие диффузные интерстициальные болезни легких Воспалительные заболевания кишечника.Язвенный колит и болезнь Крона, в очень редких случаях, связаны с определенными DILD (COP, NSIP, UIP, DIP, легочная эозинофилия). Иногда эти DILD вызваны лекарствами, которые принимает пациент (сульфасалазин или мелфалан). Болезнь Уиппла может быть связана с DILD, а рентгенографические характеристики подобны таковым саркоидоза (внутригрудная лимфаденопатия и интерситуциональный паттерн) .88 Амилоидоз. Амилоидоз может вызывать форму DILD без особых характеристик.Прогноз плохой, поскольку болезнь прогрессирует всего за несколько лет и эффективного лечения не существует.1 Благодарности Доктор Дж. Феррер (Госпиталь Валль д’Эброн, Барселона) сотрудничал в секции пневмокониоза. Доктор К. Альмонасид (Госпиталь Ла Принсеса, Мадрид) сотрудничал с разделом по диагностическим методам. Доктор Х. Гаудо (Госпиталь Рамон-и-Кахаль, Мадрид) сотрудничал с отделом лимфангиолейомиоматоза. Д-р Дж. Фонт и д-р Р. Сервера (Servicio de Enfermedades Autoinmunes y Sistémicas, Hospital Clínic, Барселона) совместно разработали терапевтические схемы лечения ЛДЗ, связанной с системным склерозом. Для переписки: д-р А. Шаубет. Рукопись получена 18 марта 2003 г. Принята к публикации 18 марта 2003 г. Сравнительные диагностические характеристики аускультации, рентгенографии грудной клетки и ультразвукового исследования легких при остром респираторном дистресс-синдроме | АнестезиологияНажмите на ссылки ниже, чтобы получить доступ ко всем ArticlePlus для этой статьи. Обратите внимание, что файлы ArticlePlus могут запускать приложение для просмотра вне вашего веб-браузера. У постели больного, точная оценка патологических состояний легких и легочной аэрации у тяжелобольных пациентов, находящихся на ИВЛ по поводу острого респираторного дистресс-синдрома (ОРДС), остается проблематичной. Аускультация, которая является первым этапом клинической оценки, может быть существенно изменена за счет внутригрудной передачи звуков, издаваемых аппаратом искусственной вентиляции легких.Технические ограничения снижают качество прикроватной рентгенографии грудной клетки, которая, тем не менее, остается ежедневным эталоном для визуализации легких. Эти ограничения включают в себя движения грудной клетки, вращение пациента, положение лежа на спине с кассетой с рентгеновской пленкой, расположенной кзади от грудной клетки, и рентгеновский луч, исходящий спереди на более коротком расстоянии, чем рекомендуется, и не по касательной к вершине гемидиафрагмы. . Все эти различные факторы способствуют низкому качеству рентгеновских снимков и ошибочной оценке плеврального выпота, альвеолярной консолидации, интерстициальной маркировки, средостения и размеров сердца.Даже при тщательном контроле факторов воздействия рентгенографические изображения остаются неоптимальными более чем в одной трети случаев 1–5 и плохо коррелируют с изображениями компьютерной томографии легких. 6 Хотя обычно считается, что ультразвуковое исследование имеет ограниченное применение при заболеваниях легких, его применение все шире применяется в отделениях интенсивной терапии. 4,7–13 Целью этого проспективного исследования было оценить, может ли УЗИ легких быть альтернативой прикроватной рентгенографии грудной клетки для оценки наличия и степени альвеолярной консолидации, альвеолярно-интерстициального синдрома и плеврального выпота у вентилируемых пациентов с ОРДС.Аускультация, прикроватная рентгенография грудной клетки и ультрасонография легких сравнивались с торакальной компьютерной томографией (КТ). Аускультация была выполнена тем же исследователем (J-J.R.) Непосредственно перед транспортировкой к сканеру компьютерной томографии. Систематически исследовали двенадцать отделов легких: верхнюю и нижнюю части передней, боковой и задней частей левой и правой грудных стенок в положении пациента лежа на спине.Аускультация проводилась во время приливной вентиляции с использованием режима вентиляции, выбранного в соответствии с оптимизированной терапевтической стратегией. Каждая аускультация была классифицирована по категориям, соответствующим определениям, предложенным Лаудоном и Мерфи 19, и с использованием терминологии, рекомендованной Американским торакальным обществом. 20 Нормальная аускультация определялась как наличие нормальных везикулярных звуков в каждой исследуемой области.Аускультация, предполагающая плевральный выпот, определялась как устранение нормальных везикулярных звуков в одной или нескольких областях. Аускультация, указывающая на альвеолярную консолидацию, определялась как присутствие в одной или нескольких областях бронхиальных дыхательных звуков, преобладающих во время фазы вдоха и характеризующихся полым или трубчатым тембром. При аускультации предполагалось наличие альвеолярно-интерстициального синдрома как наличие в одной или нескольких областях мелких трещин во время фазы вдоха. Степень повреждения легких оценивалась как количество областей, в которых аускультация позволяла предположить альвеолярную консолидацию и / или альвеолярно-интерстициальный синдром. При тех же настройках вентиляции и с пациентом в положении лежа на спине перед компьютерной томографией были получены портативные рентгенограммы передних зубов с использованием AMX4 (General Electric, Кавасаки, Япония) с высоким напряжением (120–130 кВ), снятых независимым радиологом. не зная об УЗИ и КТ.Время экспозиции, расстояние фокусировки до пленки и степень экспозиции были стандартизированы для каждого пациента, чтобы получить наилучшее качество рентгенографии. Паренхима легкого была разделена на 12 областей цефалокаудальной средне-подмышечной линией и поперечной прикорневой линией. Верхние области легких были определены как области легких, очерченные верхушкой, средней подмышечной линией, средостенной линией и линией корней. Верхняя и нижняя боковые области легких определялись как области легких, очерченные внешней границей грудной стенки, средней подмышечной линией и верхушкой (верхняя) или диафрагмой (нижняя).Верхняя и нижняя задняя области легких определялись как области легких с рентгенологическими признаками, стирающими границу средостения («силуэтный знак»), и очерчивались средостением, средней подмышечной линией, линией корней и верхушкой (верхняя) или диафрагмой (нижняя). Плевральный выпот, альвеолярная консолидация и альвеолярно-интерстициальный синдром были определены в соответствии с критериями, установленными для пациентов с ОРДС 5,21 и с использованием терминологии, рекомендованной Номенклатурным комитетом Общества Флейшнера.Плевральный выпот определяли как присутствие в нижних отделах легких однородного помутнения, в котором были видны бронховаскулярные метки с притуплением купола диафрагмы и / или утолщением плевральной поверхности латерально. Сероватое помутнение на всем протяжении гемиторакса с видимыми отметинами на легких также считалось признаком плеврального выпота. Альвеолярная консолидация определялась как наличие в нижних отделах легких однородной непрозрачности, характеризующейся стиранием теней кровеносных сосудов и наличием воздушных бронхограмм.Альвеолярно-интерстициальный синдром определялся как присутствие в одной или нескольких областях легких одного или нескольких из следующих рентгенологических образований: перегородки, представляющие утолщенные межлобулярные перегородки, ретикулонодулярный узор и пятнистые и плохо определяемые помутнения воздушного пространства с воздушными бронхограммами и периферическим распределением. . Степень повреждения легких оценивалась как количество областей легких с рентгенологическими признаками, указывающими на альвеолярную консолидацию или альвеолярно-интерстициальный синдром. Ультрасонография легких была выполнена непосредственно перед компьютерной томографией с теми же параметрами вентиляции одним оператором (D.L.) с помощью Hitachi-405 (Hitachi Medical Corporation, Токио, Япония) и микроконвексного зонда 5 МГц и длиной 9 см. 12 легочных участков грудной стенки, которые были исследованы путем аускультации, также были исследованы с помощью ультразвукового исследования легких. Для данной области интересов было проанализировано несколько сайтов.Дополнительная информация об этой процедуре доступна на сайте анестезиологии http://www.anesthesiology.org. Если ультразвуковое отклонение было обнаружено в одном или нескольких участках, то рассматриваемая область считалась характеризующейся этим отклонением. Данная область интереса может быть охарактеризована несколькими ультразвуковыми отклонениями. При исследовании переднебоковых частей грудной клетки пациент находился в положении лежа на спине, а задние – в положении пациента на боку.Ультразвуковое исследование легких также проводилось для контрольной группы из 10 здоровых субъектов, чтобы определить нормальный ультразвуковой образец легких. УЗИ легких одновременно были разделены на четыре категории в соответствии с ранее описанными критериями. 7–9,12,23–26 Линия плевры определялась как горизонтальная гиперэхогенная линия, видимая на 0,5 см ниже линии ребер. Горизонтальные линии, отходящие от плевральной линии и параллельно ей, были названы A линиями ; вертикальные линии, отходящие от плевральной линии и перпендикулярные ей, назывались линиями B или хвостами комет , если они доходили до края экрана; а три или более кометных хвоста, видимых на замороженном изображении, были названы легкими ракетами .27. Нормальный образец был определен со здоровыми добровольцами и определялся как наличие в каждой области легкого скольжения легких с помощью линий A. 8 Один хвост кометы, присутствующий в передней части легкого, или несколько хвостов кометы, ограниченные латерально десятым или одиннадцатым межреберьем, были обнаружены у одной трети здоровых добровольцев и считались нормальными. 9 Плевральный выпот определяли как зависимое скопление, ограниченное диафрагмой и плеврой 23–25 (рис. 1) с инспираторным движением висцеральной плевры от глубины к поверхностям 12 (рис.1б). В случае обильного выпота было видно консолидированное ателектатическое легкое, плавающее в плевральном выпоте. Альвеолярная консолидация определялась как присутствие в одной или нескольких областях легкого тканевого узора 7, размеры которого оставались неизменными на протяжении дыхательного цикла. Он содержал часто гиперэхогенные точечные изображения, характерные для воздушных бронхограмм 26 (рис. 1b). Альвеолярно-интерстициальный синдром определялся как наличие более двух линий В в данной области легкого.Линии B, расположенные на расстоянии 7 мм друг от друга, соответствуют утолщенным междольковым перегородкам, а линии B, расположенные на расстоянии 3 мм или менее, соответствуют областям матового стекла (рис. 1d и f). В дополнительной серии пациентов с острым повреждением легких, находящихся на ИВЛ, 288 областей легких, определенных, как указано выше, были исследованы с помощью УЗИ легких двумя из трех исследователей (I.G., Belaïd Bouhemad, M.D. и / или J-J.R.), Не видя друг друга. Каждая из 12 исследуемых областей легких пациента была отнесена к одной или нескольким из четырех категорий, определенных выше.Дополнительная информация о семиологии УЗИ легких доступна на веб-сайте анестезиологии http://www.anesthesiology.org. Рис. 1. Компьютерная томография и ультразвуковое исследование легких, соответственно, плеврального выпота, альвеолярной консолидации и альвеолярно-интерстициального синдрома. ( a, b ) Сбор жидкости ( E ), ограниченный диафрагмой ( Диаметр ) и париетальной и висцеральной плеврой, окружающей консолидированную нижнюю долю ( LL ), содержащую гиперэхогенные точечные структуры (воздушная бронхограмма; стрелки ) ).( c, d ) Артефакты длинного хвоста кометы, возникающие из-за линии плевры (, т. Е. , линии B) и нескольких ракет в легких на расстоянии 3 мм или меньше, и представляют области матового стекла (линия плевры; стрелки ) ). ( e, f ) Множественные артефакты хвоста кометы (четыре линии B) на расстоянии 7 мм, характерные для утолщенных междольковых перегородок. Схема напоминает ракету при взлете, отсюда и практический термин , легкие ракеты . Фиг.1. Компьютерная томография и ультразвуковое исследование легких соответственно плеврального выпота, альвеолярной консолидации и альвеолярно-интерстициального синдрома. ( a, b ) Сбор жидкости ( E ), ограниченный диафрагмой ( Диаметр ) и париетальной и висцеральной плеврой, окружающей консолидированную нижнюю долю ( LL ), содержащую гиперэхогенные точечные структуры (воздушная бронхограмма; стрелки ) ). ( c, d ) Артефакты длинного хвоста кометы, возникающие из плевральной линии ( i.е. , линии B) и множественные легочные ракеты на расстоянии 3 мм или менее, представляющие области матового стекла (плевральная линия; стрелки ). ( e, f ) Множественные артефакты хвоста кометы (четыре линии B) на расстоянии 7 мм, характерные для утолщенных междольковых перегородок. Схема напоминает ракету при взлете, отсюда и практический термин , легкие ракеты . Степень повреждения легких оценивалась как количество областей легких, в которых УЗИ легких показало наличие альвеолярно-интерстициального синдрома или альвеолярной консолидации. Как описано ранее, 18 каждого пациента были доставлены в радиологическое отделение двумя врачами с использованием соответствующего кардиореспираторного мониторинга. Когда пациент находился в положении лежа на спине, сканирование легких выполнялось от верхушки до диафрагмы с помощью Tomoscan SR 7000 (Philips, Эйндховен, Нидерланды). Все изображения наблюдались и фотографировались при ширине окна 1600 HU и уровне -600 единиц Хаунсфилда.Экспозиции проводились при 120 кВ и 250 мА. Величина шага составляла 1. Каждому пациенту вводили 80 мл контрастного вещества, чтобы отличить плевральный выпот от альвеолярного уплотнения. Оценка включала тонкие и спиральные КТ-срезы, полученные в конце выдоха, с PEEP, выбранным лечащим врачом. КТ-исследование тонких срезов состояло из серии 1,5-миллиметровых срезов с 20-миллиметровым интервалом пересечения, выбранных с помощью скаутского обзора грудной клетки в течение 15-секундного периода апноэ.Для спиральной КТ непрерывные осевые секции толщиной 10 мм были реконструированы по объемным данным, как описано ранее. 28 У восьми пациентов КТ-срезы были записаны на оптический диск для компьютерного анализа объемов легких с использованием проверенного программного обеспечения. 29 Для интерпретации результатов КТ был назначен независимый радиолог (ПК). 12 областей легких, которые были исследованы с помощью аускультации, рентгенографии грудной клетки и ультрасонографии легких, были проанализированы с помощью КТ: были определены правая и левая передняя, латеральная и задняя верхние области легких, а также правая и левая передняя, латеральная и задняя нижние области легких. с использованием тех же анатомических ориентиров (верхушка, средняя подмышечная линия, внешний предел грудной клетки, граница средостения и диафрагма). Плевральный выпот, альвеолярная консолидация и альвеолярно-интерстициальный синдром были определены в соответствии с рекомендациями Общества Флейшнера. 30 Плевральный выпот был определен как гомогенное и периферическое помутнение без каких-либо воздушных бронхограмм и характеризовалось ослаблением CT ниже, чем ослабление CT соседних альвеолярных консолидаций (рис. 1a). Альвеолярная консолидация определялась как ослабление, затемняющее границы сосудов и дыхательных путей, связанное с воздушной бронхограммой (рис.1а). Альвеолярно-интерстициальный синдром определялся как наличие одной или нескольких из следующих особенностей: матового стекла, проявляющегося как области мутного повышенного ослабления легких, не связанного с затемнением нижележащих сосудов, сетка из бесчисленных переплетающихся линий теней, предполагающих сетку, и утолщение перегородки, проявляющееся аномальным расширением межлобулярных перегородок, примыкающих к висцеральной плевральной поверхности (рис. 1, c и e). Степень повреждения легкого определялась как процент объема легких, который плохо или плохо вентилируется 31, и количественно оценивался у восьми пациентов с использованием специально разработанного программного обеспечения компьютерной томографии (Lungview; Institut National des Télécommunications, Эври, Франция).29 Тридцать два пациента с ОРДС были проспективно включены в исследование. Средний возраст пациентов составил 58 ± 15 лет. Средняя задержка между началом ОРДС и исследованием составила 5,4 ± 4 дня. Исходной этиологией были обширное хирургическое вмешательство (n = 19), множественная травма (n = 5) и соматическое заболевание (n = 8). У 27 пациентов ОРДС был вызван первичным поражением легких (бронхопневмония – 18; ушиб легкого – 4; аспирационная пневмония – 4; жировая эмболия – 1), а у пяти пациентов – вторичным поражением легкого. легкое (септический шок – 3; и повреждение легких, осложняющее искусственное кровообращение – 2).На момент включения в исследование средний балл 33 тяжести повреждения легкого составлял 2,6 ± 0,8, а средний балл тяжести ОРДС 6 составлял 11 ± 6. Пациенты имели среднее значение Pao 2 166 ± 80 мм рт.ст. (доля вдыхаемого кислорода, 1; ПДКВ отсутствует). , средний легочный шунт 43 ± 13%, среднее давление в легочной артерии 29 ± 7 мм рт. , среднее давление легочного клина 13 ± 3 мм рт. Ст. И средняя статическая податливость дыхания 53 ± 20 мл / см H 2 O.Используя средний дыхательный объем 8 ± 2 мл / кг, среднее значение Paco 2 составило 43 ± 9 мм рт. Летальность составила 42%. После оптимизации диагностической и терапевтической стратегии было применено ПДКВ 12 ± 5 см H 2 O со средним дыхательным объемом 6,7 ± 1 мл / кг. Согласно критериям компьютерной томографии, из 384 исследованных областей легких у 26% был плевральный выпот, у 31% – альвеолярная консолидация и у 48% – альвеолярно-интерстициальный синдром.Как показано в таблице 1, аускультация и прикроватная рентгенография грудной клетки были менее точными, чем ультразвуковое исследование легких, для диагностики плеврального выпота, альвеолярной консолидации и альвеолярно-интерстициального синдрома в 384 исследованных областях легких. Таблица 1. Чувствительность и специфичность аускультации, рентгенографии грудной клетки и ультрасонографии легких для диагностики плеврального выпота, альвеолярной консолидации и альвеолярно-интерстициального синдрома в 384 областях легких у 32 тяжелобольных пациентов с ОРДС Прикроватная рентгенография грудной клетки была плохим показателем степени повреждения легких по сравнению с ультразвуковым исследованием легких.Процент повреждения легких, измеренный с помощью КТ ( y ; процент от общего объема легких либо плохо, либо без аэрации), значимо коррелировал со степенью повреждения легких, измеренной с помощью УЗИ легких ( x ; процент областей легких с ультразвуком) паттерн, указывающий на альвеолярно-интерстициальный синдром или альвеолярную консолидацию): y = 1,3 x + 73 (ρ = 0,76; P = 0,003). При оценке альвеолярной консолидации и альвеолярно-интерстициального синдрома с помощью прикроватной фронтальной рентгенографии грудной клетки корреляция не достигла статистической значимости ( y = 1.02 х + 32; r = 0,45; P = 0,3). У 32 пациентов 384 области легких были проанализированы с помощью аускультации, ультразвукового исследования легких и компьютерной томографии. Только 52% областей легких, проанализированных при аускультации, совпадали с соответствующими областями КТ легких, тогда как 83% областей легких, проанализированных с помощью УЗИ легких, соответствовали соответствующим областям легких КТ. Для пациентов с ОРДС ультразвуковое исследование легких лучше аускультации и прикроватной рентгенографии грудной клетки для диагностики плеврального выпота, альвеолярной консолидации и альвеолярно-интерстициального синдрома, а также для оценки степени повреждения легких. Обычно ультразвук не передается через анатомические структуры, заполненные газом, и паренхима легкого не видна за пределами плевры. В поврежденном легком, которое характеризуется заметным увеличением ткани, простирающейся к периферии легкого, 18 артефактов, возникающих на границе раздела газ-ткань, обнаруживаются при УЗИ легких как хвосты кометы. Корреляции с компьютерной томографией показали, что легкие ракеты (несколько кометных хвостов с интервалом 7 мм) соответствуют утолщенным альвеолярным перегородкам, тогда как легкие ракеты с интервалами 3 мм или меньше соответствуют зонам ослабления в матовом стекле.9,10,27 Когда потеря аэрации является значительной и приводит к альвеолярной консолидации рядом с плеврой, легкое становится видимым как тканевая структура с гиперэхогенными артефактами, возникающими в результате воздушных бронхограмм. 7 Было показано, что ультрасонография легких очень чувствительна и специфична для выявления плеврального выпота, 12,23–25 и может помочь при торакоцентезе. 12 Недавно Tsubo et al. 13 продемонстрировали, что реаэрацию гиперплотной левой нижней доли, вызванную ПДКВ, можно оценить с помощью чреспищеводного ультразвукового исследования.Когда для пациентов с ОРДС и неаэрированными нижними долями использовалось ПДКВ 15 см H 2 O, эти исследователи обнаружили, что ультразвуковая плотность «исчезла». Рисунок 6 в их статье показывает, что весьма вероятно, что при ПДКВ 15 см H 2 O тканевой узор, указывающий на консолидацию легких, был заменен множественными хвостами кометы. Другими словами, граница раздела газ-ткань наблюдалась после PEEP, что свидетельствует о частичной реаэрации левой нижней доли. Полная реаэрация легких привела бы к появлению горизонтальных линий А, параллельных плевральной линии.Исходя из этих результатов и нашего клинического опыта, УЗИ легких может быть очень ценным инструментом для оценки набора легких у постели больного в результате PEEP. Для подтверждения этой возможности необходимы дальнейшие исследования. Ультрасонография легких также чувствительна и специфична для диагностики пневмоторакса, 8–10 максиллярного синусита 34 и многих других заболеваний у тяжелобольных пациентов. 35,36 По сравнению с КТ, которая обеспечивает прямую визуализацию морфологии легких, УЗИ легких выявляет артефакты, вызванные повреждением легких, и поэтому менее наглядно.Однако его основные преимущества заключаются в предотвращении радиационного облучения, а также в транспортировке за пределы отделения интенсивной терапии, а также в меньших затратах и простоте повторения. Кроме того, он позволяет точно диагностировать плевральный выпот, альвеолярную консолидацию и альвеолярно-интерстициальный синдром не только при ОРДС, но и при многих других типах повреждений легких. 7,24,25,27CT требует транспортировки пациента в отделение радиологии и обучения врачей, знакомых с механической вентиляцией легких и комплексным мониторингом сердечно-сосудистой системы.Для улучшения качества изображений внутривенная инъекция контрастного вещества полезна, но может нанести вред поврежденному легкому. 37 Доза облучения, полученная пациентом при компьютерной томографии всей грудной клетки с использованием 10-миллиметровой коллимации, остается высокой, что эквивалентно 20-30 рентгенографии грудной клетки. 38 Стоимость одного компьютерного исследования составляет примерно 690 долларов. Кроме того, КТ не следует повторять часто, и она доступна не везде для пациентов в критическом состоянии. В соответствии с рекомендациями Американского колледжа радиологии 39 мы выполняем ежедневную рентгенографию грудной клетки для пациентов, находящихся на ИВЛ, которые не соответствуют критериям ОРДС для выявления плеврального выпота, альвеолярной консолидации и альвеолярно-интерстициального синдрома.Поскольку дополнительные рентгенограммы грудной клетки также получаются для оценки адекватного расположения устройств для мониторинга и лечения, в нашем отделении получается в среднем 1,2 рентгенограммы грудной клетки на пациента в день. Поскольку мы принимаем 240 пациентов в год со средней продолжительностью искусственной вентиляции легких 15 дней, каждый год делается около 4300 рентгенограмм грудной клетки, что составляет 222 271 доллар США. Если систематическое использование УЗИ легких в отделении интенсивной терапии приведет к сокращению количества рентгенограмм на 50% и, согласно цене одной сонограммы (≈ 51 460 долларов США), можно будет сэкономить 59 673 доллара в первый год и 111 172 доллара в последующие годы . Ультрасонография легких имеет некоторые недостатки. Для пациентов с ожирением и пациентов с множественными травмами и подкожной эмфиземой визуализация паренхимы легких может быть затруднена. Адекватная интерпретация результатов ультразвукового исследования легких требует специальной подготовки и некоторого опыта. Однако, поскольку ультразвуковые аномалии хорошо определены и легко распознаются, зависимость от оператора минимальна, что продемонстрировано высоким соглашением между наблюдателями, обнаруженным в текущем исследовании.Три врача, участвовавшие в оценке воспроизводимости результатов между наблюдателями, прошли двухмесячный тренинг (проводил Д.Л.). Поскольку один и тот же зонд обслуживает нескольких пациентов, он может быть переносчиком или распространять устойчивые патогены в отделении интенсивной терапии и требует специальных процедур дезактивации. Наконец, что не менее важно, УЗИ легких позволяет выявить неправильное положение трубки, а прикроватная рентгенография грудной клетки остается эталоном для проверки адекватного положения постоянных катетеров.Наконец, эти ограничения должны быть сбалансированы с преимуществами ультразвукового исследования легких, которое оказывает прямое диагностическое и терапевтическое воздействие на более чем две трети тяжелобольных пациентов. 4 В заключение, рутинное использование ультразвукового исследования легких для пациентов с ОРДС в критическом состоянии могло бы уменьшить показания для прикроватной рентгенографии грудной клетки и КТ грудной клетки. В результате стоимость ухода за пациентом в отделении интенсивной терапии должна снизиться, и в то же время должна стать доступной более точная информация о наличии и степени плеврального выпота, альвеолярной консолидации и альвеолярно-интерстициального синдрома.Ультрасонография легких может открыть новую эру респираторного мониторинга в отделении интенсивной терапии. Авторы благодарят Вероник Коннан (секретарь) и Жаклин Гардиллу (секретарь отделения анестезиологии больницы Питье-Сальпетриер) за их прекрасную секретарскую помощь, а также Белэида Бухемада, доктора медицины (отделение анестезиологии, больница Питье-Сальпетриер), за участие в оценке воспроизводимости УЗИ легких. . |

 Процесс приводит к уплотнению тканей и их рубцеванию. Чаще всего встречается фиброз легких, печени и молочной железы. Основными симптомами являются одышка, боль в сердце, потеря веса, поверхностное дыхание и другие.
Процесс приводит к уплотнению тканей и их рубцеванию. Чаще всего встречается фиброз легких, печени и молочной железы. Основными симптомами являются одышка, боль в сердце, потеря веса, поверхностное дыхание и другие. Более того, бляшки приводят к «ломкости» сосудов. Причиной отклонения становится избыток кальция.
Более того, бляшки приводят к «ломкости» сосудов. Причиной отклонения становится избыток кальция.