МРТ предстательной железы в Москве Рэмси Диагностика
МРТ предстательной железы позволяет визуализировать и отличать друг от друга различные виды тканей, получая от снимков подробные данные.
Врачи центров «Рэмси Диагностика» рекомендуют провериться заранее, так как чем раньше и точнее будет выявлен диагноз, тем больше шансов добиться положительного эффекта при лечение.
Что включает в себя исследование
Мультипараметрическая МРТ предстательной железы – в Рэмси Диагностика, это комплекс программ:
- Т1-ВИ и Т2-ВИ – последовательности, позволяющие оценить анатомию железы, выявить патологические участки в её структуре (опухоли, рубцовые и воспалительные изменения)
- Диффузионно-взвешенное исследование (ДВИ) –чувствительно к участкам воспаления и мелким опухолевым очагам
- Построение карт измеряемого коэффициента диффузии (ИКД) выявляет истинные участки ограничения диффузии молекул воды, что наблюдается при опухолевых поражениях
- Динамическое контрастное усиление выявляет участки с патологическим накоплением контрастного парамагнитного вещества
Что показывает
Специалисты проводя обследование, первоначально по снимкам оценивают состояние яичек. Так как они окружены семью оболочками, дифференцировать различные элементы образований довольно сложно.
МРТ предстательной железы предоставляет детализированные снимки, способные показать:
- Придатки яичек
- Семенные канатики
- Сосудистые семенных канатиков
Вследствие, специфики методики выполнения томография дает изучить перемены – биохимии тканей, позволяет судить о наличии любых патологических изменений.
Когда назначается МРТ предстательной железы
Чаще всего магнитно-резонансная томография простаты назначается по указаниям врача, если:
- боль и жжение при мочеиспускании и после него
- частые позывы и прерывистое мочеиспускание
- боли в области паха
- импотенция
- есть подозрение на рак
- поиск рецидивов
- оценка ответов на проводимое лечение
- предполагаемое новообразование простаты
- определение стадии болезни
Как подготовиться
Предварительной подготовке к МРТ предстательной железы – не требуется, кроме слабо-наполненного мочевого пузыря (не мочиться) за 1,5 – 2 часа до диагностики.
При исследовании простаты врач-радиолог может дать указание о диете накануне.
Перед процедурой рекомендуется избавиться от всех металлических предметов.
Как проходит, сколько времени занимает процедура
В МДЦ «Рэмси Диагностика» любой желающий может пройти обследование предстательной железы на аппарате Optima MR360 Advance производства компании General Electric (США), позволяющего получить качественные изображения в 2D или 3D проекциях.
Исследование можно провести в любое удобное время для пациента – 24 часа в сутки 7 дней в неделю.
По времени, процедура занимает 40 минут.
Крайне важно, для постановки точного диагноза, во время диагностики лежать в томографе неподвижно, чтобы изображение получилось четким и не расплывчатым.
При необходимости во время проведения томографии пациент общается с оператором. После окончания следует некоторое время спокойно посидеть, а затем подняться на ноги и размять затекшие мышцы, в результате неподвижного лежания.
Противопоказания
МРТ предстательной железы не рекомендуют назначать при наличии в организме металлических частиц и инородных тел из металлов.
Противопоказан пациентам с почечной недостаточностью, если во время диагностики предполагается вводить в вену контраст.
Проведение бесполезно при болевых синдромах и гиперкинезах, так как на протяжении всего обследования пациент должен находиться неподвижно.
Заболевание толстой кишки, при котором невозможно поместить в зону катушку для проведения МРТ.
Относительным ограничением является клаустрофобия и повышенная тревожность. В таких случаях врачи назначают успокаивающие препараты.
В чем отличие от других – исследований
В отличие от МРТ малого таза, где оцениваются все органы, при мультипараметрическом исследовании акцент делается на предстательную железу все сканы ориентируются одинаково перпендикулярно оси железы, что позволяет сопоставлять МР-сигнал от очага на всех последовательностях.
При дифференциальной диагностике рубцовых, воспалительных, опухолевых изменений крайне важно, чтобы очаг был одинаково отсканирован на всех последовательностях, это позволяет дать более точную оценку и избежать ненужных биопсий или, наоборот, сориентировать врача, проводящего биопсию на подозрительный очаг.
Преимущества перед КТ
При диагностике на начальных стадиях патологий КТ практически бессильно в отличие от МРТ. При этом магнитно-резонансную томографию можно производить хоть каждый день, что важно при динамических наблюдениях за развитием заболевания или ходом выздоровления.
Вредно ли делать диагностику
На сегодняшний день МРТ – один из самых безопасных и эффективных методик. Во время воздействия магнитного поля, никакого ущерба организму нанесено быть не может.
Процедура с контрастированием
Чаще всего МРТ предстательной железы проводят с контрастированием, так как основными показаниям к томографии простаты является диагностика рака.
Пациенту в вену вводят препарат на основе гадолиния, в малых дозах средство является абсолютно безвредным и уже через несколько часов полностью выводитсяиз организма.
Благодаря накоплению препарата, область распространения опухоли четко маркируется на снимках, и выглядят более контрастно.
В некоторых случаях, без использования контрастного вещества, практически не возможно увидеть высокодифференцированные формы рака.
Скидки, льготы
В стоимость диагностики входит:
- Обследование на томографе Optima MR360 Advance, ведущего мирового производителя General Electric (США)
- Подробное исчерпывающее заключения, сделанное на основании снимков высококвалифицированным врачом-радиологом
- Круглосуточный доступ в личный кабинет, для просмотра всех своих исследований и заключений
- Внутренний контроль качества исследований
- 100% гарантия качества снимков
Подробную информацию о ценах можно узнать в разделе «Стоимость услуг»
Ознакомиться с льготами и проходящими акциями на страницах: «Акции и скидки», «Скидки и льготы»
На МРТ предстательной железы
МРТ предстательной железы, простаты в СПб по оптимальной цене
МРТ предстательной железы позволяет визуализировать и отличать друг от друга различные виды тканей, получая от снимков подробные данные.
Врачи диагностических центров «Рэмси Диагностика» рекомендуют провериться заранее, так как чем раньше и точнее будет выявлен диагноз, тем больше шансов добиться положительного эффекта при лечение заболевания.
Что включает в себя МРТ предстательной железы
Мультипараметрическая – комплекс программ, который включает в себя:
- Т1-ВИ и Т2-ВИ – последовательности, позволяющие оценить анатомию железы, выявить патологические участки в её структуре (опухоли, рубцовые и воспалительные изменения)
- Диффузионно-взвешенное исследование (ДВИ) – чувствительно к участкам воспаления и мелким опухолевым очагам
- Построение карт измеряемого коэффициента диффузии (ИКД) выявляет истинные участки ограничения диффузии молекул воды, что наблюдается при опухолевых поражениях
- Динамическое контрастное усиление позволяет выявить участки с патологическим накоплением контрастного парамагнитного вещества
Что показывает диагностика
Специалисты проводя обследование, первоначально по снимкам оценивают состояние яичек. Так как они окружены семью оболочками, дифференцировать различные элементы образований довольно сложно.
МРТ предстательной железы предоставляет детализированные снимки, способные показать:
- Придатки яичек
- Семенные канатики
- Сосудистые семенных канатиков
Вследствие, специфики методики выполнения процедуры дает изучить перемены – биохимии тканей. Результат исследований позволяет судить о наличии любых патологических изменениях.
Когда назначается
Чаще всего томография простаты назначается по указаниям врача, если:
- боль и жжение при мочеиспускании и после него
- прерывистое мочеиспускание
- частые позывы к мочеиспусканию
- боли в области паха
- импотенция
- есть подозрение на рак
- поиск рецидивов
- оценка ответов на проводимое лечение
- предполагаемое новообразование простаты
- определение стадии болезни
Как подготовиться к обследованию
Предварительной подготовки не требуется, кроме слабо-наполненного мочевого пузыря (не мочиться) за 1,5 – 2 часа до обследования.
При исследовании простаты врач-радиолог может дать указание о диете накануне исследования.
Перед процедурой рекомендуется избавиться от всех металлических предметов.
Как проходит процедура и сколько времени занимает диагносткиа
В МДЦ «Рэмси Диагностика» любой желающий может пройти обследование на аппарате Optima MR360 Advance производства компании General Electric (США), позволяющего получить качественные изображения в 2D или 3D проекциях.
Исследование проводится в любое удобное время для пациента – 24 часа в сутки 7 дней в неделю.
По времени, весь процесс занимает 40 минут.
Крайне важно, для постановки точного диагноза, во время процедуры лежать в томографе неподвижно, чтобы изображение получилось четким и не расплывчатым.
При необходимости во время диагностики пациент общается с оператором. После окончания обследования следует некоторое время спокойно посидеть, а затем подняться на ноги и размять затекшие мышцы, в результате неподвижного лежания.
Противопоказания к прохождению
МРТ предстательной железы не рекомендуют назначать при наличии в организме металлических частиц и инородных тел из металлов.
Противопоказан пациентам с почечной недостаточностью, если во время исследования предполагается вводить в вену контраст.
Проведение бесполезно при болевых синдромах и гиперкинезах, так как на протяжении всего обследования пациент должен находиться неподвижно.
Заболевание толстой кишки, при котором невозможно поместить в зону катушку для проведения МРТ.
Относительным ограничением является клаустрофобия и повышенная тревожность. В таких случаях врачи назначают пациентам успокаивающие препараты.
В чем отличие от других МРТ – исследований
В отличие от томографии малого таза, где оцениваются все органы, при мультипараметрическом исследовании акцент делается на предстательную железу все сканы ориентируются одинаково перпендикулярно оси железы, что позволяет сопоставлять МР-сигнал от очага на всех последовательностях.
При дифференциальной диагностике рубцовых, воспалительных, опухолевых изменений крайне важно, чтобы очаг был одинаково отсканирован на всех последовательностях, это позволяет дать более точную оценку и избежать ненужных биопсий или, наоборот, сориентировать врача, проводящего биопсию на подозрительный очаг.
Преимущества МРТ перед КТ
При диагностике на начальных стадиях патологий компьютерная томография практически бессильна в отличие от магнитно-резонансного исследования. При этом МР-обследование можно производить каждый день, что важно при динамических наблюдениях за развитием заболевания или ходом выздоровления.
Вредно ли проводить процедуру
На сегодняшний день магнитно-резонансное исследование – одно из самых безопасных и эффективных методик. Во время воздействия магнитного поля, никакого ущерба организму нанесено быть не может.
Диагностика с применением контрастного вещества
Чаще всего МРТ предстательной железы проводят с контрастированием, так как основными показаниям к изучению простаты является диагностика рака.
Пациенту в вену вводят препарат на основе гадолиния, в малых дозах средство является абсолютно безвредным и уже через несколько часов полностью выводится из организма.
Благодаря накоплению препарата, область распространения опухоли четко маркируется на снимках, и выглядит более контрастно.
В некоторых случаях, без использования контрастного препарата, практически не возможно увидеть высокодифференцированные формы рака.
Cкидки, льготы
В стоимость диагностики входит:
- Обследование на томографе Optima MR360 Advance, ведущего мирового производителя General Electric (США)
- Подробное исчерпывающее заключения, сделанное на основании снимков высококвалифицированным врачом-радиологом
- Круглосуточный доступ в личный кабинет, для просмотра всех своих исследований и заключений
- Внутренний контроль качества исследований
- 100% гарантия качества снимков
Подробную информацию о ценах можно узнать в разделе «Стоимость услуг»
Ознакомиться с льготами и проходящими акциями на страницах: «Акции и скидки», «Скидки и льготы»
На МРТ исследование предстательной железы
МРТ простаты в Екатеринбурге – Новая Больница
Уважаемые пациенты!
В связи со сложившейся эпидобстановкой, связанной с COVID-19, перед прохождением КТ легких (органов грудной клетки) обязательно прохождение через приемно-смотровой бокс (согласно прайса) на предмет отсутствия признаков ОРВИ, допуска на исследование. В осмотр входит аускультация легких. осмотр зева, измерение температуры, пульсоксиметрия, заполнение опросника и выдача допуска на исследование. Мы делаем КТ и рентген пазух носа и органов грудной клетки по направлению врача, кроме направления для исключения пневмонии.
В осмотр входит аускультация легких. осмотр зева, измерение температуры, пульсоксиметрия, заполнение опросника и выдача допуска на исследование. Мы делаем КТ и рентген пазух носа и органов грудной клетки по направлению врача, кроме направления для исключения пневмонии.
МРТ простаты – это метод получения послойных изображений предстательной железы и окружающих тканей с использованием магнитного поля высокой напряженности. Обследование проводится для диагностики патологических изменений в органе, включая доброкачественные и злокачественные новообразования.
Что показывает МР-томография простаты у мужчин:
- воспалительные процессы;
- кистозные образования;
- камни в протоках желез предстательной железы;
- доброкачественную гиперплазию;
- новообразования
Какой метод выбрать: УЗИ, ТРУЗИ, биопсию или стандартную МРТ-диагностику?
Метод МРТ назначается преимущественно для выявления и исследования опухоли простаты. Другие диагностические процедуры определяют злокачественное новообразование только при его размерах более 1 см. МРТ, совместно с взятием образцов для гистологического исследования – наиболее точный метод диагностики злокачественных новообразований простаты.Особенности проведения томографии
Перед исследованием мужчине необходимо снять все металлические предметы, включая наручные часы. Запрещается брать с собой мобильный телефон и банковские карты.Этапы проведения МРТ простаты включают:
- Пациента укладывают на выдвижной стол томографа.
- Работающий аппарат издает громкий гул, поэтому пациенту предлагают использовать специальные наушники или беруши.
- Внутривенно вводится контрастное вещество.
- Пациент может связаться с мед. персоналом с пульта, который дают ему в руки.

МРТ огранов малого таза: противопоказания
Запрещено выполнять томографию при наличии любых несъемных электронных имплантов, магнитных металлических элементов в организме, постоперационных клипс на сосудах.Зубные протезы, современные металлические конструкции, стенты противопоказаниям к проведению МРТ не являются.
Подготовка к процедуре
Подготовка к томографии заключается в соблюдении диеты: за несколько дней исключаются продукты, вызывающие повышенное газообразование. Обследование выполняется при умеренно наполненном мочевом пузыре.Альтернативные методы диагностики
Существуют другие способы визуализации органов малого таза: УЗИ, КТ. Они востребованы и необходимы, но менее информативны. Альтернатива может быть назначена при наличии противопоказаний для МРТ.В заключении отметим, что магнитно-резонансная томография – это незаменимый, высокоинформативный метод диагностики патологии органов малого таза. Методика позволяет выявлять мельчайшие изменения в яичниках, матке без диагностической лапароскопии.
Если Вам нужно качественное исследование, обращайтесь в МО «Новая больница»!
Сделать МРТ предстательной железы (простаты) в Санкт-Петербурге – цены и адреса
Что показывает МРТ простаты у мужчин?
- МРТ предстательной железы – это «золотой стандарт» диагностики рака простаты. Зачастую, при подозрении на злокачественное новообразование, проводят МРТ простаты с контрастированием. Метод позволяет определить границы и размеры опухоли, что важно для разработки тактики лечения.
- В сложных случаях для наиболее точной диагностики проводится мультипараметрическая МРТ простаты. Также показаниями к проведению МРТ обследованию предстательной железы у мужчин являются доброкачественная гиперплазия предстательной железы или аденома, признаки простатита, абсцесс. В ряде случаев данное обследование сочетается с МРТ мочевого пузыря.
Подготовка к процедуре
Особой подготовки к МРТ исследованию простаты не требуется за исключением случаев, когда в целях улучшения визуализации за час до процедуры пациенту необходимо выпить литр воды.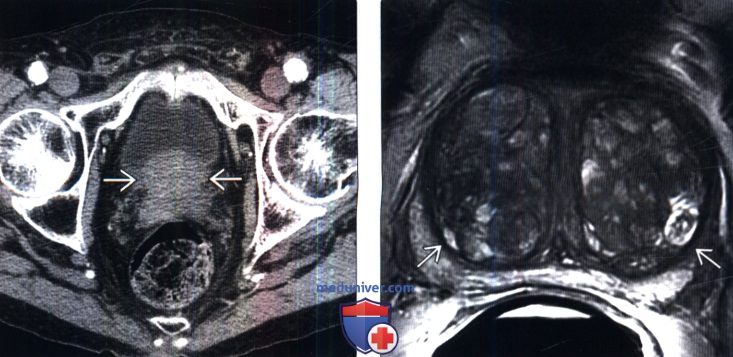 Диета как правило тоже не требуется, если только не предполагается использование ректальной катушки при проведении процедуры. Более детальные требования при подготовке к МРТ предстательной железы должен предоставить врач в зависимости от целей обследования.
Диета как правило тоже не требуется, если только не предполагается использование ректальной катушки при проведении процедуры. Более детальные требования при подготовке к МРТ предстательной железы должен предоставить врач в зависимости от целей обследования.
Как выполняется МРТ?
Исследование занимает обычно не более получаса. В течение этого времени пациент неподвижно лежит на кушетке внутри цилиндра, на внутренней поверхности которого расположены датчики, осуществляющие сканирование. Изображения отправляются на компьютер, где обрабатываются специальной программой.
Где сделать МРТ простаты?
Для того чтобы вам было проще выбрать медицинское учреждение, в которое можно обратиться для выполнения МРТ простаты, мы собрали всю информацию о клиниках, включая расположение, уровень цен, составили их рейтинг.
МРТ простаты с контрастом или без абсолютно безопасна, при этом позволяет получать послойные изображения простаты высокой детализации, что дает возможность диагностировать практически любые заболевания предстательной железы у мужчин – от простатита и аденомы до сложных форм рака.
Цена на МРТ предстательной железы с контрастированием в Москве будет выше, чем диагностика без использования контраста.
Магнитно-резонансная томография (МРТ) простаты
Бесплатно подберем клинику или диагностический центр.Магнитно-резонансная томография (МРТ) является неинвазивным медицинским диагностическим методом, с помощью которого возможно диагностировать и лечить различные заболевания.
МРТ использует мощное магнитное поле, частотные радиоимпульсы и компьютерную обработку полученных данных, что позволяет получить детальные изображения органов, мягких тканей, костей и практически всех внутренних структур тела.
Изображения могут быть визуализированы на мониторе компьютера, передаваться в электронном виде, распечатаны или скопированы на цифровой носитель. МРТ не использует ионизирующее излучение (рентгеновские лучи).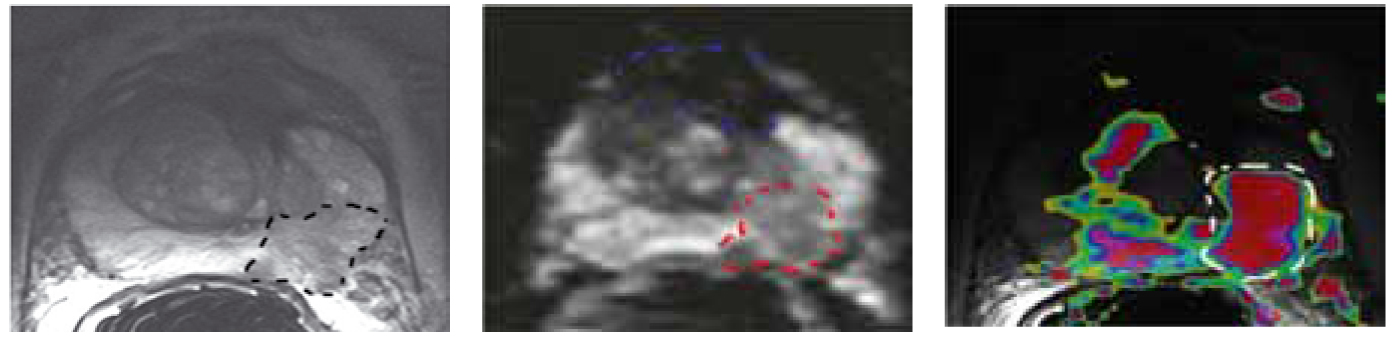
Предстательная железа входит в состав органов мужской репродуктивной системы. Она расположена в передней части прямой кишки и под мочевым пузырем, а также огибает начальную часть уретры. Простата производит жидкость необходимую для того ,чтобы сперма была полноценной . УЗИ и МРТ являются наиболее часто используемыми методами визуализации предстательной железы ( простаты).
Показания для МРТ предстательной железы
Чаще всего, показанием для МРТ предстательной железы является диагностика рака простаты. МРТ простаты обычно используется для оценки степени рака предстательной железы, определения того, является рак ограниченным в пределах железы или имеется распространение за пределы предстательной железы.
Иногда МРТ предстательной железы используется для диагностики других заболеваний простаты, в том числе:
- Инфекции (простатит, абсцесс простаты)
- Увеличение простаты (аденома)
- Врожденные дефекты (аномалии)
- Послеоперационные осложнения на органах таза
Подготовка к МРТ простаты
МРТ простаты, как правило, проводится с использованием специального трансректального датчика, который вводится в прямую кишку, но возможно проведение исследования и без такого датчика. Прямая кишка находится внутри таза, непосредственно за предстательной железой. Размещение трансректального датчика (катушки) в прямую кишку, близко к простате, помогает генерировать более детальные изображения предстательной железы и окружающих структур, а также позволяет выполнить магнитного резонансную (МР) спектроскопию, которая может помочь получить дополнительную информацию о химическом контенте клеток, образующих предстательную железа. Кроме того, МРТ простаты может оценивать движение молекул воды (так называемый диффузии воды) и кровоток (изображение перфузии) в пределах простаты, чтобы помочь дифференцировать нормальную ткань простаты от патологической ткани.
Как правило, при других исследованиях не требуются ограничения в еде перед исследованием МРТ.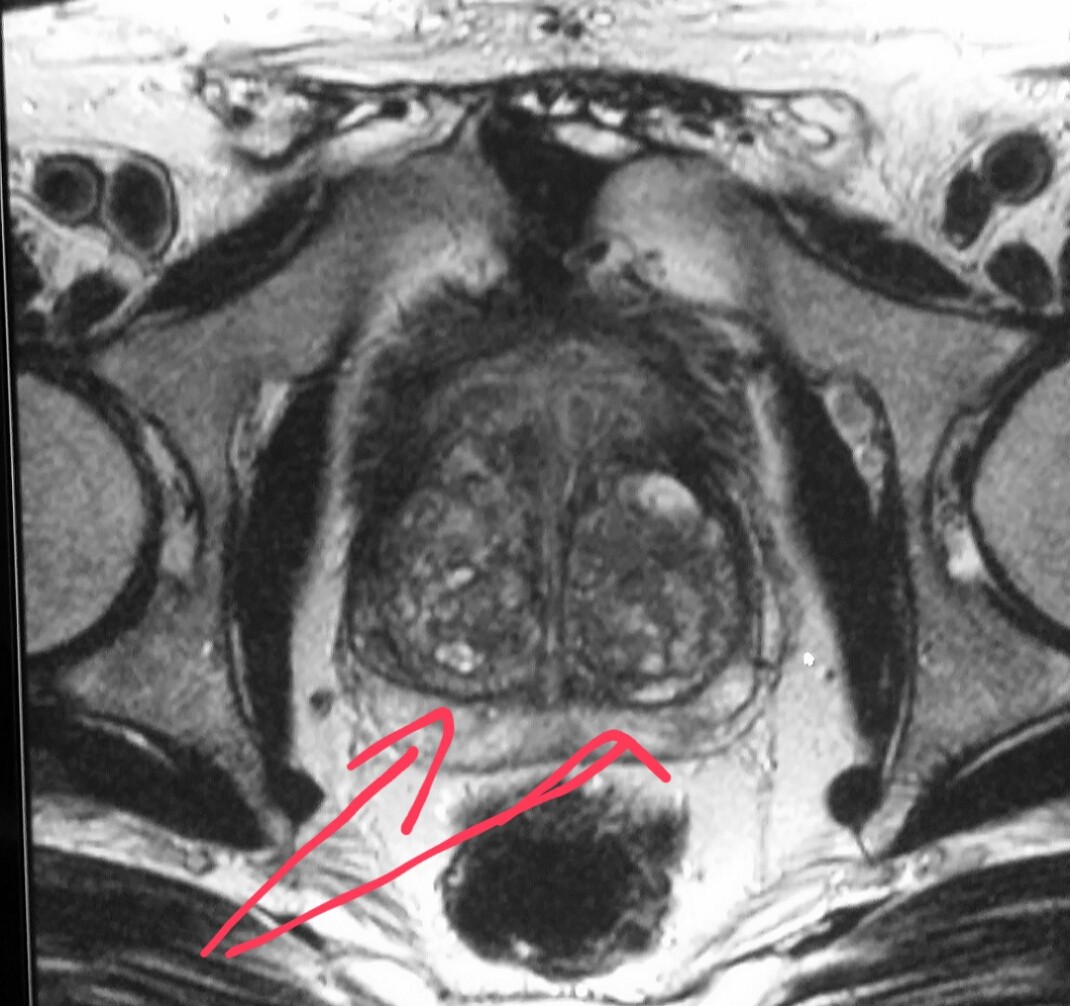 Если же проводится МРТ простаты, тем более, с применением датчика, то необходимо ограничить прием тяжелой пищи с клетчаткой за 12 часов до исследования и если исследование проводится с использованием трансректального датчика необходимо также очистить прямую кишку с помощью клизмы перед исследованием.
Если же проводится МРТ простаты, тем более, с применением датчика, то необходимо ограничить прием тяжелой пищи с клетчаткой за 12 часов до исследования и если исследование проводится с использованием трансректального датчика необходимо также очистить прямую кишку с помощью клизмы перед исследованием.
Пациент может использовать специальную одноразовую одежду или находиться во время процедуры в своей одежде, если она свободная и не имеет металлической фурнитуры. том. Если планируется введение контраста, то лаборанту МРТ необходима информация о наличии аллергии на контрастное вещество или бронхиальной астмы. Контрастное вещество, которое наиболее часто используется для МРТ исследований, содержит металлическое вещество (гадолиний). И хотя гадолиний очень редко приводит к осложнениям, в отличие от контраста с содержанием йода (который применяется при КТ исследованиях), тем не менее, его введение нежелательно при наличии серьезных соматических заболеваний, особенно хронических заболеваний почек. При наличии клаустрофобии МРТ исследование рекомендуется проводить на аппаратах открытого типа.
Все объекты с содержанием металла должны быть удалены до проведения МРТ. Это такие предметы как:
- Ювелирные изделия, часы, кредитные карты и слуховые аппараты, которые могут быть повреждены
- Булавки, шпильки, металлические молнии и аналогичные металлические предметы, которые могут привести к искажению изображения МРТ
- Съемные зубные протезы с наличием в составе металла
- Ручки, карманные ножи и очки
- Пирсинг на теле
Проведение МРТ противопоказано при наличии у пациента имплантов или имплантированных электронных устройств:
- Кохлеарные имплантаты
- Некоторые виды клипсов, используемых на аневризмах головного мозга
- Некоторые виды металлических спиралей, размещенные в пределах кровеносных сосудов (стенты)
- Искусственные клапаны сердца
- Имплантированные инфузионные помпы
- Имплантированные электронные устройства, в том числе дефибриллятор, кардиостимулятор.

- Эндопротезы суставов (с содержанием металла)
- Имплантированные стимуляторы нервов
- Металлические штифты, винты, пластины, стенты или хирургические скобы
- Металлические части в теле человека (например, пули или осколки), так как мощное магнитное поле может привести к смещению металлических объектов и повреждению тканей. И поэтому, в таких случаях необходимо до МРТ исследования провести рентгенографию.
Сопровождающие детей родители также должны убрать все металлические предметы и сообщить наличие в теле объектов с содержанием металла.
Процедура выполнения МРТ простаты
Традиционный аппарат МРТ (закрытого типа) представляет собой большую цилиндрическую трубку окруженную магнитом. Пациент во время исследования лежит на подвижном столе, который двигается в центр магнита. Существуют также МРТ аппараты открытого типа, где магнит не полностью окружает пациента, а открыт по бокам. Исследования на аппаратах открытого типа (а они преимущественно низкопольные) полезны для исследования пациентов с клаустрофобией или с большим весом. В последнее время появились аппарата открытого типа с высоким полем ( 1 и более Тесла), которые позволяют получить качественное изображение, в отличие от основных моделей открытых МРТ, где магнитное поле низкое и изображение менее качественное. При МРТ исследования простаты с использованием эндоректальной катушки, медсестра или врач размещает катушку в одноразовую манжету, смазывают и вставляют в прямую кишку. После вставки манжета, которая окружает катушку, надувается, что позволяет удерживать ее в прямой кишке во время исследования. Когда исследование завершено, манжету сдувают и катушку удаляют из прямой кишки. Во время выполнения процедуры МРТ пациент должен лежать неподвижно в течение определенного времени (в среднем 25-30 минут). При исследовании с контрастом длительность исследования будет больше. МР-спектроскопия, которая дает возможность получить дополнительную информацию о клеточных химических веществах может быть проведена при необходимости во время МРТ исследования и может добавить около 15 минут к времени исследования.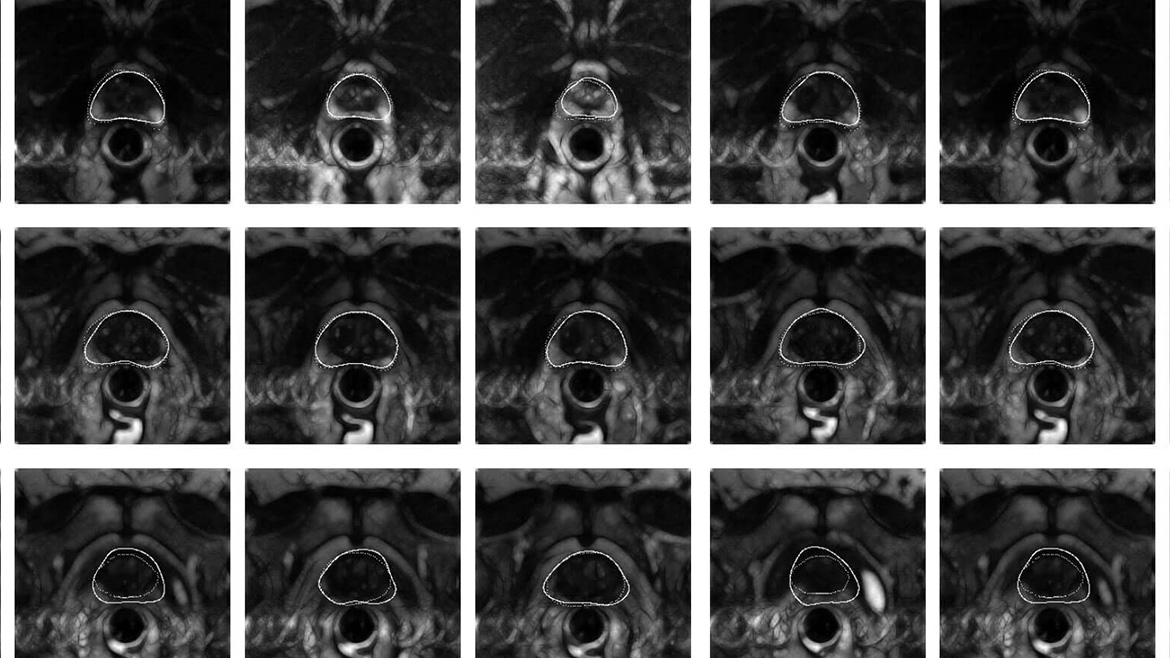 Процедура МРТ абсолютно безболезненна и, тем не менее, некоторые пациенты могут ощущать чувство тепла в области, где проводится исследование, что является нормальной реакцией тканей на магнитное поле. В ходе введения эндоректальной катушки также пациент может почувствовать давление в прямой кишке, аналогичное таковому при пальцевом ректальном исследовании. Как правило, пациент находится один в аппаратной МРТ во время исследования, но между врачом рентгенологом и пациентом есть двухсторонняя аудиосвязь и врач видит пациента. После прохождения процедуры МРТ пациенту не требуется время на адаптацию. После проведения МРТ могут потребоваться дополнительные обследования для уточнения диагноза ( например, сцинтиграфия)
Процедура МРТ абсолютно безболезненна и, тем не менее, некоторые пациенты могут ощущать чувство тепла в области, где проводится исследование, что является нормальной реакцией тканей на магнитное поле. В ходе введения эндоректальной катушки также пациент может почувствовать давление в прямой кишке, аналогичное таковому при пальцевом ректальном исследовании. Как правило, пациент находится один в аппаратной МРТ во время исследования, но между врачом рентгенологом и пациентом есть двухсторонняя аудиосвязь и врач видит пациента. После прохождения процедуры МРТ пациенту не требуется время на адаптацию. После проведения МРТ могут потребоваться дополнительные обследования для уточнения диагноза ( например, сцинтиграфия)
Преимущества и риски
Преимущества
- МРТ является неинвазивным методом визуализации, который не подвергает организм воздействию ионизирующего излучения
- Изображения мягкотканых структур организма, в том числе простаты и других органов малого таза более четкие и подробные, чем при использовании других методов визуализации. Эта деталь делает МРТ ценным инструментом для ранней диагностики и оценки степени развития опухолей, таких как рак простаты
- МРТ оказался ценным в диагностике широкого спектра заболеваний, включая рак, доброкачественные заболевания, таких как доброкачественная гиперплазия предстательной железы и инфекции
- МР-спектроскопия помогает анализировать химический состав простаты, что может быть полезным в раннем выявлении рака предстательной железы
- МРТ исследование позволяет диагностировать аномалии, которые могут быть не видны из-за костей при использовании других методов визуализации
- Контрастный материал, используемый в МРТ исследовании, гораздо реже вызывает аллергическую реакцию, чем контрастных материалы на основе йода, используемые при рентгенологических методах исследований
Риски
МРТ не представляет практически никакой опасности для обычного пациента, когда соблюдаются соответствующие правила техники безопасности.
- Несмотря на то, что сильное магнитное поле не является вредным сам по себе, имплантированные медицинские устройства, с содержанием металла, могут работать некорректно или испортиться во время МРТ исследования
- Существует очень незначительный риск аллергической реакции, если проводится исследование с контрастным веществом. Такие реакции обычно мягкие и легко купируются с помощью лекарств
- Нефрогенный системный фиброз в настоящее время является признанным, но редким, осложнением МРТ исследования с контрастом и считается, что это осложнение вызвано вследствие инъекций высоких доз гадолиния пациентам с очень плохой функции почек. Тщательная оценка функции почек до введения контраста с гадолинием сводит к минимуму риск этого очень редкого осложнения
Ограничения для МРТ простаты
Высокое качество изображения удается добиться только в том случае, если пациент способен оставаться совершенно неподвижным во время проведения МРТ исследования.
При больших размерах пациент может не поместиться в МРТ аппарат. Наличие имплантата или металлических предметов может ухудшить качество изображения.
МРТ не всегда может выявить различия между тканью рака и воспалительным процессом или наличие продуктов крови в предстательной железе, которые иногда остаются после биопсии простаты. Для того чтобы избежать диагностических ошибок.
Задать вопрос
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ В ДИАГНОСТИКЕ ЗАБОЛЕВАНИЙ И НОВООБРАЗОВАНИЙ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | Байков
1. Китаев СВ. Диагностика рака предстательной железы: современное состояние вопроса. Определение стадии рака предстательной железы. Ч. 3 (Обзор литературы). Медицинская визуализация. 2009;(1):89-93. [Kitaev SV. Diagnosis of a prostate cancer. Pt. III: prostate cancer staging (Review article). Med Visualisation. 2009;(1):89-93 (in Russ.)].
2009;(1):89-93 (in Russ.)].
2. Китаев СВ, Павленко КА, Кочин АВ. Значение динамической МРТ с гадодиамидом для ранней диагностики рака предстательной железы. Медицинская визуализация. 2007;(5):91-97. [Kitaev SV, Pavlenko KA, Kochin AV. The importance of dynamic MRI with omniscan for early diagnostics of a prostate cancer. Med Visualisation. 2007;(5):91-97 (in Russ.)].
3. Ахвердиева ГИ, Санай ЭБ, Панов ВО, Губский ИЛ, Тюрин ИЕ, Долгушин БИ, и др. Мультипараметрическая МРТ в диагностике рака предстательной железы. Российский электронный журнал лучевой диагностики. 2013;3(4):109-19. [Akhverdieva GI, Sanay EB, Panov VO, Gubskiy IL, Tyurin IE, Dolgushin BI, et al. Multiparametric MRI in diagnosis of prostate cancer Russ Electron J Radiol. 2013;3(4):109-19 (in Russ.)].
4. Давыдов МИ. Статистика злокачественных новообразований в России и странах СНГ в 2004 г. Вестн РОНЦ им. Н.Н. Блохина РАМН. 2006;17(3):132. [Davydov MI. Statistics of malignant neoplasms in Russian Federation and CIS for 2004. J N N Blokhin Rus Cancer Res. Center RAMS. 2006;17(3):132 (in Russ.)].
5. Чиссова ВИ, Старинский ВВ, Петрова ГВ. Злокачественные новообразования в России в 2011 году (заболеваемость и смертность).М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России;2013. 289.
6. Ахвердиева ГИ, Панов ВО, Тюрин ИЕ, Долгушин БИ, Матвеев ВБ, Камолов БШ, и др. Мультипараметрическая магнитно-резонансная томография в диагностике локального рецидива рака предстательной железы после радикальной простатэктомии. Онкоурология. 2015;11(4):72-79. [Akhverdiyeva GI, Panov VO, Tyurin IE, Dolgushin BI, Matveev VB, Kamalov BSh, et al. Multiparametric magnetic resonance imaging in the diagnosis of local recurrence of prostate cancer in patients after radical prostatectomy. Cancer Urol. 2015;11(4):72-79 (in Russ.)].
Multiparametric magnetic resonance imaging in the diagnosis of local recurrence of prostate cancer in patients after radical prostatectomy. Cancer Urol. 2015;11(4):72-79 (in Russ.)].
7. Ахвердиева ГИ, Санай ЭБ, Панов ВО, Тюрин ИЕ, Матвеев ВБ, Шимановский НЛ. Роль искусственного контрастирования при МРТ диагностике рака предстательной железы (обзор литературы). Медицинская визуализация. 2012;(1):92-101. [Ahverdieva GI, Sanaii EB, Panov VO, Turin IE, Matveev VB, Shimanovskii NL. Contrast enhancement in MRIdiagnostics of prostate cancer. Med Visualisation. 2012;(1):92-101 (in Russ.)].
8. Мухомор АИ, Ахвердиева ГИ, Санай ЭБ, Панов ВО, Абдуллаев РЯ, Губский ИЛ, и др. Комплексное трансректальное ультразвуковое исследование с цветовым допплеровским кодированием, допплерографией и соноэластографией в выявлении рака предстательной железы. Онкоурология. 2013;(2):4252. [Mukhomor АI, Hagverdiyeva GI, Sanay EB, Panov VO, Abdullaiev RYa, Gubskii IL, et al. Complex transrectal US with color flow mapping, Doppler sonography and sonoelastografiey in prostate cancer evaluation. Cancer Urol. 2013;(2):42-52 (in Russ.)].
9. Москаленко ЕА, Петров СБ, Толкач ЮВ, Мищенко АВ. Современный подход к диагностике рака предстательной железы с использованием магнитно-резонансной спектроскопии (клиническое исследование). Онкоурология. 2011;(1):25-30. [Moskalenko EA, Petrov SB, Tolkach YuV, Mishchenko AV. Current approaches to diagnosing prostate cancer, by applying magnetic resonance spectroscopy (a clinical study). Cancer Urol. 2011;(1):25-30 (in Russ.)].
10. Труфанов ГЕ, Тютина ЛА. Магнитно-резонансная спектроскопия: руководство для врачей. СПб.:ЭЛБИ-СПб;2008.
11. Afaq A, Batura D, Bomanji J. New frontiers in prostate cancer imaging: clinical utility of prostatespecific membrane antigen positron emission tomography. Int Urol Nephrol. 2017;49(5):803-10. DOI: 10.1007/s11255-017-1541-y.
Afaq A, Batura D, Bomanji J. New frontiers in prostate cancer imaging: clinical utility of prostatespecific membrane antigen positron emission tomography. Int Urol Nephrol. 2017;49(5):803-10. DOI: 10.1007/s11255-017-1541-y.
12. Li HL, Xia JG, Xie SW, Guo YF, Xin M, Li FH. Prostate cancer: a comparison of the diagnostic performance of transrectal ultrasound versus contrast enhanced transrectal ultrasound in different clinical characteristics Int J Clin Exp Med. 2015;8(11):21428-34. PubMed ID: 26885087.
13. Fuchsjager M, Akin O, Shukla-Dave A, Pucar D, Hricak H. The role of MRI and MRSI in diagnosis, treatment selection, and post-treatment follow-up for prostate cancer. Clin Adv Hematol Oncol. 2009;7:193202. PMID: 19398944.
14. Jung AJ, Coakley FV, Shinohara K, Carroll PR, Kurhanewicz J, Cowan JE, Westphalen AC. Local staging of prostate cancer: comparative accuracy of T2-weighted endorectal MR imaging and transrectal ultrasound. Clin Imag. 2012;36(5):547-552. DOI: 10.1016/j.clinimag.2011.11.028.
МРТ предстательной железы: процедура, стоимость и специалисты
Определение: что такое МРТ предстательной железы?
Магнитно-резонансная томография , также известная как МРТ или ЯМР-томография, является методом визуализации, используемым в медицине для отображения структуры и функций тканей и органов. Специалистами по проведению МРТ являются рентгенологи и радиологи. В качестве более нового метода появилась возможность исследования простаты с использованием магнитно-резонансной томографии. Предстательная железа проверяется на предмет изменения качества ткани, структуры и размера органа.
Рак предстательной железы (рак простаты) является наиболее распространенным видом онкологии у мужчин в Германии, составляя 25,4 % всех диагностированных раковых заболеваний. Каждый год в Германии данная опухоль выявляется у около 60 000 мужчин. В среднем пациенты заболевают в возрасте 69 лет. Благодаря более точной диагностике в настоящее время заболевание распознается на более ранних стадиях и, следовательно, легче поддается лечению. Мужчины, у которых в семье были случаи заболевания (брат, отец), в частности, более чем в два раза чаще подвержены раку простаты.
Каждый год в Германии данная опухоль выявляется у около 60 000 мужчин. В среднем пациенты заболевают в возрасте 69 лет. Благодаря более точной диагностике в настоящее время заболевание распознается на более ранних стадиях и, следовательно, легче поддается лечению. Мужчины, у которых в семье были случаи заболевания (брат, отец), в частности, более чем в два раза чаще подвержены раку простаты.
С 45 лет рекомендуются регулярные обследования для раннего выявления путем определения значения ПСА, а также пальпаторное ректальное исследование. Показатель ПСА (простатический специфический антиген), особенно в случае его изменения или очень высоких значений, может говорить о процессах роста и перестройки предстательной железы и, таким образом, указывать на злокачественное перерождение ткани простаты.
Во время МРТ-обследования создаются послойные изображения тела. Они в основном выполняются за счет использования большого магнитного поля, которое воздействует на организм. Из-за своего различного состава отдельные клетки и ткани по-разному реагируют на это поле (содержание воды, плотность и т. д.), что позволяет разграничивать разные области ткани. Существуют несколько форм МРТ, которые отличаются, например, по их так называемому взвешиванию (например, T1-, T2-, PD-взвешенные (по протонной плотности) изображения). В зависимости от типа исследуемого органа или ткани, вид взвешенности является решающим при оценке изображения.
Показания: когда используется магнитно-резонансная томография простаты?
Если существует высокая степень подозрения на рак предстательной железы, несмотря на отрицательную биопсию, для подтверждения диагноза может использоваться МРТ. Как более новый метод МРТ предстательной железы уже показывает хорошие результаты в отношении своей диагностической достоверности. При T2-взвешенной МРТ опухоль предстательной железы представляет собой четко очерченную темную область с относительно яркой окружающей зоной.
В предположительных очагах рака, обнаруженных при МРТ, выполняется целенаправленная биопсия, поскольку диагноз рака предстательной железы подтверждается гистологическим исследованием ткани.
В дополнение к целевой биопсии, должна выполняться систематическая биопсия. При ней из предстательной железы по стандартной схеме делают 10–12 пункцией ткани под местной анестезией. Образец ткани имеет решающее значение для оценки опухолевого заболевания и дальнейших этапов терапии.
Типы МРТ предстательной железы
МРТ простаты проводится как так называемое многопараметрическое исследование. МРТ предстательной железы состоит из 3 различных последовательностей магнитно-резонансного сканирования. Они включают в себя:
- T2-взвешенная МРТ-последовательность для оценки структуры органа (предстательной железы, семенных пузырьков, окружающих органов). Этот этап исследования можно использовать для оценки того, есть ли уже рост, выходящий за пределы органа, или другие метастазы (опухолевые очаги) в окружающей области.
- Диффузионно-взвешенная последовательность для оценки плотности клеток: опухолевая ткань изменяется из-за роста количества клеток в одном и том же пространстве (плотность клеток). Этот этап имеет решающее значение для выявления и определения степени рака предстательной железы.
- Последовательность МРТ с динамическим контрастированием (МРТ с динамическим контрастным усилением, DCE) для визуализации ткани с увеличенным кровотоком или образованием нового сосуда (предположительно опухоль). В этом исследовании вводится контрастное вещество, содержащее гадолиний. Увеличенный кровоток характерен для опухолей, но также может возникать при воспалении ( простатите ) или доброкачественной гиперплазии предстательной железы.
В сочетании эти последовательности предоставляют точную информацию о местонахождении и распространении возможной опухоли без необходимости проникновения в организм извне и воздействия на него радиоактивным излучением.
Процедура и продолжительность: как проходит МРТ-исследование предстательной железы?
Продолжительность МРТ-сканирования зависит от исследуемой области тела, клинического вопроса и используемого устройства. Чем выше желаемое разрешение детализации, тем дольше время исследования. МРТ простаты обычно занимает чуть менее 30 минут. Часто делается две серии снимков: сначала без контрастного вещества, затем с ним.
Чем выше желаемое разрешение детализации, тем дольше время исследования. МРТ простаты обычно занимает чуть менее 30 минут. Часто делается две серии снимков: сначала без контрастного вещества, затем с ним.
Недавние разработки обещают значительно сократить время исследования путем параллельной записи МР-сигнала с помощью многочисленных приемных катушек, так что в крайних случаях время записи может занимать менее одной секунды.
Преимущества МРТ предстательной железы
МРТ предстательной железы стало золотым стандартом для первичной диагностики или дальнейшего наблюдения (активного мониторинга) рака предстательной железы. В случае отрицательной биопсии и в то же время большой вероятности наличия опухоли, в том числе из-за высоких значений ПСА, следует проводить визуализацию с использованием МРТ.
МРТ-обследование имеет большое преимущество, заключающееся в отсутствии радиации и хорошей визуализации тканей. Поскольку технология продолжает совершенствоваться и радиологи приобретают опыт, достоверность прогнозов будет только повышаться.
Текущие исследования (см. источник «Медицинский журнал Новой Англии») показывают, что МРТ предстательной железы превосходит предыдущие исследования с использованием значений ПСА, результаты пальпации и систематической биопсии в выявлении заметных изменений. МРТ позволяет диагностировать рак предстательной железы с вероятностью приблизительно 80 %.
Благодаря отсутствию радиационного воздействия, МРТ также можно использовать для последующего контроля после терапии.
Недостатки МРТ предстательной железы
Нелеченный рак предстательной железы обычно протекает довольно медленно, поэтому от терапии выигрывают только мужчины с предполагаемой продолжительностью жизни более 10–15 лет. Раннее обнаружение с помощью МРТ может иногда выявлять опухоли, которые, вероятно, никогда бы себя и не проявили.
Кроме этого, заключение на основе МРТ с пометкой «без видимых изменений» несет остаточный риск для небольших опухолей, поэтому следует проводить контроль на основе ПСА и систематическую биопсию, даже если результаты МРТ отрицательные.
МРТ предстательной железы оказалась примерно эквивалентной трансректальному ультразвуковому исследованию, но при этом ее проведение намного более сложное и дорогое. Кроме того, расходы на МРТ предстательной железы еще не покрываются государственными страховыми компаниями.
Помимо этого, если пациент не в состоянии лежать без движения в течение длительного времени (около 30 минут), качество изображения может ухудшиться.
Несмотря на постоянно совершенствующуюся технологию, в магнитно-резонансной томографии предстательной железы также существуют ошибки. Приблизительно 10 % опухолей простаты не распознаются как таковые при обследовании МРТ, и примерно 10 % пациентов классифицируются как ошибочно положительные (с подозрением на раковое заболевание), и, следовательно, проводится излишняя биопсия.
Поскольку при МРТ также обычно используются контрастные агенты, могут возникать аллергические реакции, включая анафилактический шок с остановкой сердечно-сосудистой системы. Если существует повышенный риск аллергии или были ее случаи, необходимо незамедлительно сообщить нашим специалистам!
МРТ предстательной железы: расходы и покрытие медицинского страхования
Согласно текущему положению, расходы на такое обширное обследование не покрываются государственными страховыми компаниями. Частные медицинские страховые компании обычно возмещают полную сумму. Стоимость обследования составляет около 400 евро. Если у вас есть какие-либо вопросы, не стесняйтесь обращаться к нашим специалистам с многолетним опытом!
Какие врачи и клиники являются специалистами по проведению МРТ предстательной железы?
Специалистами по проведению МРТ предстательной железы являются следующие врачи:
- Проф. д-р мед. наук Кристоф М. Бамбергер (Гамбург)
- Д-р мед. наук Беат Порчеллини (Цюрих)
Источники :
- Дополнение: Перспективы в онкологии, многопараметрическая МРТ предстательной железы: преимущества и недостатки, Dtsch Arztebl 2018; 115 (47), DOI: 10.
 3238 / PersOnko.2018.11.23.01, Шлеммер, Хайнц-Петер
3238 / PersOnko.2018.11.23.01, Шлеммер, Хайнц-Петер - https://www.die-radiologie.de/kompetenzzonen/prostatadiagnostik.html
- Междисциплинарные рекомендации по качеству S3 для раннего выявления, диагностики и терапии различных стадий рака предстательной железы: версия 5.1 – май 2019 г.
- https://de.wikipedia.org/wiki/Prostatakrebs#Magnetresonanztomographie
- https://de.wikipedia.org/wiki/Magnetresonanztomographie
- https://www.nejm.org/doi/pdf/10.1056/NEJMoa1801993
Визуализация – Условия простаты
Тест визуализации использует звуковые волны, радиоактивные частицы или магнитные поля для создания изображения. Эти изображения позволяют врачу увидеть изменения в организме, которые могут быть вызваны раком. Визуализация – важный компонент в лечении рака простаты. Многие методы лечения зависят от локализации рака в предстательной железе, чтобы надлежащим образом нацелить лечение на раковые клетки, сохраняя при этом здоровые ткани. Визуализация особенно важна для лечения запущенного заболевания, поскольку быстрое обнаружение рака, распространившегося за пределы простаты (метастазов), позволяет пациентам начать лечение раньше и увеличивает шансы на то, что пациенты получат лечение в рамках оптимального терапевтического окна.Существует множество типов изображений, используемых для обнаружения и диагностики рака простаты, наиболее распространенные методы визуализации обсуждаются ниже:
Трансректальное ультразвуковое исследование (ТРУЗИ):
В этом методе используется небольшой зонд, вводимый в прямую кишку для передачи звуковых волн. простата. Эхо звуковых волн от простаты преобразуется компьютером в изображение. ТРУЗИ часто используется для измерения размера простаты, а также в качестве ориентира при биопсии и некоторых видах лечения.
Компьютерная томография (КТ):
При КТ рентгеновские лучи используются для создания подробного трехмерного изображения поперечного сечения внутренней части тела.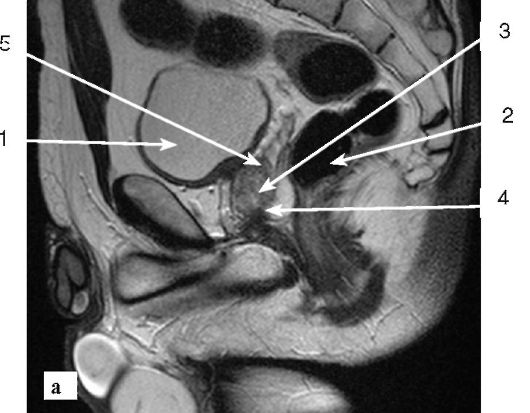 Компьютерная томография может использоваться для точного определения местоположения опухоли в предстательной железе, оценки степени рака и оценки того, поддается ли заболевание лечению. В некоторых случаях технология компьютерной томографии используется для точного определения курса лечения рака во время процедуры.
Компьютерная томография может использоваться для точного определения местоположения опухоли в предстательной железе, оценки степени рака и оценки того, поддается ли заболевание лечению. В некоторых случаях технология компьютерной томографии используется для точного определения курса лечения рака во время процедуры.
Магнитно-резонансная томография (МРТ):
МРТ использует магнитное поле и радиоволны для создания четкого изображения простаты. МРТ можно использовать для обнаружения пораженных тканей в организме и точного определения раковых клеток.МРТ также можно использовать, чтобы увидеть, распространился ли рак за пределы простаты на близлежащие ткани. МРТ-изображения помогают врачам спланировать лечение, например хирургическое вмешательство или лучевую терапию.
Позитронно-эмиссионная томография (ПЭТ):
При ПЭТ используется небольшое количество радиоактивного материала, называемого радиоактивным индикатором, и специальная камера, чтобы видеть простату изнутри. Специально разработанный радиоактивный индикатор вводится пациенту и поглощается клетками простаты, радиоактивный индикатор излучает небольшое количество энергии, которое может улавливаться ПЭТ-сканером и использоваться для создания детального изображения.Этот тип визуализации также может выявить аномальные функции клеток простаты, которые указывают на рак. ПЭТ-сканирование обычно выполняется в сочетании с компьютерной томографией или МРТ.
Интернет-научные публикации
Введение
Из-за превосходного контраста мягких тканей магнитно-резонансная томография (МРТ) является предпочтительной для визуализации таза. В частности, при визуализации предстательной железы, помимо трансректального УЗИ (ТРУЗИ), предпочтение отдается обследованию (1).Компьютерная томография (КТ) для диагностической визуализации простаты изучалась на заре использования этого метода в конце 70-х и 80-х годах, но в последние годы ей уделялось мало внимания в международной медицинской литературе (2-7). Тем не менее, знание особенностей визуализации заболевания предстательной железы на КТ важно для радиолога по ряду причин. Простата отображается при КТ брюшной полости / таза, выполняемых по широкому кругу показаний, например, стадия рака, острый живот или переломы.При этих обследованиях (случайных) патологий простаты нельзя упускать. МРТ противопоказана некоторым пациентам и в глобальном масштабе не везде легко доступна. Таким образом, пациенты с подозрительными находками при цифровом обследовании или ультразвуковом исследовании могут нуждаться в дополнительной визуализации с помощью компьютерной томографии. В этом обзоре дается обзор нормальной анатомии и общих результатов визуализации при заболеваниях предстательной железы. Ограничения и возможные последствия технических усовершенствований для мультиспиральной компьютерной томографии (МС-КТ) рассматриваются.
Нормальная анатомия
Нормальная предстательная железа имеет каштановый вид. В классическом учебнике анатомии Генри Грея нормальный размер около 3,8 x 2,5 x 3,2 см (поперечный диаметр x сагиттальный диаметр x высота) (8). Обычно нормальным считается объем менее 30 мл, измеренный с помощью ТРУЗИ. Это можно вычислить по формуле 0,52 x длина x ширина x высота. Некоторые более ранние исследования планирования лучевой терапии показали, что КТ может завышать объем по сравнению с ТРУЗИ до 50% (9).Это объясняется ограниченным контрастом мягких тканей, так что дифференциация самой железы от стенки мочевого пузыря, а иногда и от мышц, поднимающих задний проход, оказывается затруднительной.
Рисунок 1
Рис. 1. Простата у двух молодых пациентов с нормальной анатомией. Слева четко изображены сосудисто-нервные узлы в пределах ректопростатического угла. С правой стороны можно увидеть мышцы, поднимающие задний проход, иногда дифференциация бывает непростой и может привести к завышению размера железы.
При детальном анатомическом исследовании можно обнаружить четыре различных зоны. С помощью визуализации можно отобразить две из них: меньшую центральную и большую периферическую зону, содержащую до 70% объема железы. Зональная анатомия имеет важное значение, поскольку большинство видов рака возникает в периферической зоне. Используя настроенные параметры окна, эту зональную анатомию также можно наблюдать с помощью компьютерной томографии. Центральная зона является гиподенсированной со значениями между 40-60 ед. Хаунсфилда (HU), а периферическая зона – гиподенсированной с 10-25 HU (5).
Рисунок 2
Рисунок 2: Регулируя настройку окна, можно различать центральную и периферийную зоны.
Процент пациентов, у которых могут быть изображены различные зоны, значительно варьируется в литературе. Мировиц и др. и Rossen et al. может дифференцировать зональную анатомию после внутривенного введения. контрастные вещества у 24% и 75% пациентов (10, 11). Dhawan et al. сообщили о возможной дифференциации зональной анатомии у 57% здоровых добровольцев независимо от того, использовались ли контрастные вещества (5).Эти исследования описывают лучшее изображение зональной анатомии у пожилых мужчин, это также было показано на МРТ (12). Все вышеупомянутые исследования проводились до эпохи МС-КТ, поэтому неизвестно, может ли лучшее пространственное разрешение с помощью современных сканеров помочь в демонстрации зональной анатомии у большего числа пациентов. Важными анатомическими структурами при злокачественных заболеваниях являются сосудисто-нервные пучки, ректопростатический угол и семенные пузырьки.
Расчеты
Кальцификации простаты – частая находка при визуализации.Их заболеваемость увеличивается с возрастом. Например, в ультразвуковом исследовании кальцификаты были обнаружены у 23,1% мужчин в возрасте от 20 до 29 лет и у 83% мужчин в возрасте от 60 до 69 лет (13). Клиническое значение камней простаты неясно, и большинство авторов интерпретируют эти кальцификатины как возрастное явление. Сообщалось о связи крупных камней с симптомами нижних мочевых путей у мужчин среднего возраста и синдромом хронической тазовой боли у молодых мужчин (14, 15). Похоже, что у некоторых пациентов кальцификаты могут указывать на длительные воспалительные изменения слабой степени, тогда как для большинства пациентов они являются случайной находкой, не имеющей дальнейшего клинического значения.
Доброкачественная гиперплазия предстательной железы
Доброкачественная гиперплазия предстательной железы часто встречается у пожилых мужчин. При увеличении центральных частей простаты у пациентов развиваются так называемые «симптомы нижних мочевыводящих путей», такие как слабая струя, чувство неполного опорожнения и никтурия (16). Увеличение простаты в некоторой степени является нормальным процессом старения, и не у всех пациентов с увеличенной простатой развиваются синдромы нижних мочевыводящих путей, т.е. корреляция с клиническими симптомами является обязательной (16).Как описано выше, объем более 30 мл считается увеличенным. Интересно, что было показано, что скорость роста у мужчин с симптомами со стороны нижних мочевыводящих путей или без них одинакова и составляет около 1,7% в год, у мужчин с симптомами увеличение железы начинается только в более раннем возрасте (17). Увеличение простаты – частая находка на КТ, но следует иметь в виду проблему переоценки предстательной железы, как описано выше (9). В повседневной практике часто проводят ориентировочные измерения в осевой плоскости с увеличением поперечного диаметра более 4.5 см считается патологическим. Рост центральных частей желез может уменьшить периферическую зону, и иногда обнаруживается неоднородность железы. Выпячивание простаты в мочевой пузырь может быть обнаружено при увеличении и, по-видимому, коррелирует с тяжестью симптомов (18).
Рисунок 3
Рис. 3. Выступ увеличенной простаты в мочевой пузырь при ДГПЖ.
Сообщалось о массивном увеличении простаты весом более 1 кг, в этом случае КТ показала большую массу, заполняющую весь таз (19).Также могут быть обнаружены вторичные признаки, такие как утолщение стенки мочевого пузыря. Если медикаментозное лечение не помогает, рассматривается возможность трансуретральной резекции простаты (ТУР-П). Типичная визуализация после ТУР-П – увеличение первой части уретры при гипертрофической простате.
Рисунок 4
Рис. 4. После ТУРП-П наблюдаются типичные увеличенные проксимальные части уретры в увеличенной железе. Фотография была сделана с компьютерной томографии, показывающей заполнение мочевого пузыря контрастным веществом.
Воспаление
Острый простатит характеризуется острыми клиническими синдромами, такими как боль, лихорадка, озноб и дизурия. Несмотря на клинические данные, визуализация может быть скрытой. Острый очаговый, а также хронический простатит на снимках может напоминать карциному. В исследовании Прандо и Уоллеса, исследующего пациентов со спиральной КТ, поглощение фокального контрастного вещества при простатите было неотличимо от такового при карциноме (6).Это известный феномен МРТ, без дополнительных клинических данных дифференциация карциномы или очагового воспаления кажется невозможной (20). Формирование абсцесса можно легко увидеть как область гиподензии в увеличенной железе после внутривенного введения. контрастные вещества (21).
Рисунок 5
Рис. 5: Центральная гиподность, вызванная абсцессом предстательной железы у молодого мужчины.
Простата является наименее пораженной мочеполовой структурой при туберкулезе, но может проявляться образованием абсцесса.Тонкий обзор других проявлений туберкулеза обычно помогает при дифференциальной диагностике, но был опубликован случай одиночного поражения простаты при туберкулезе (22). КТ обычно выполняется при острой брюшной полости, поэтому радиологи должны включать простатит в свой дифференциальный диагноз для мужчин, которым проводится визуализация для выявления острой тазовой боли и признаков воспаления.
Рак предстательной железы
Рак предстательной железы – наиболее распространенное злокачественное новообразование у мужчин.Скрининг простатоспецифического антигена (ПСА) приводит к резкому снижению стадии вновь диагностированного рака простаты. В западных странах большинство раковых заболеваний предстательной железы в настоящее время имеют стадию Т1 или Т2, то есть опухоль все еще находится в капсуле простаты (1). КТ-сканирование включено в действующие рекомендации по лечению рака простаты только у пациентов с высокими значениями ПСА и локальным распространенным заболеванием (Т3 или выше). Основная цель КТ – определение узлового статуса (23). Как и все морфологические изображения, это зависит от оценки размера узлов, т.е.е. диаметром более 1 см. Это приводит к проблемам с чувствительностью, поскольку более мелкие лимфатические узлы также могут содержать злокачественные клетки. Сообщенная в литературе чувствительность к стадии лимфатических узлов широко варьируется от 25 до 85% (1)
Рисунок 6
Рис. 6. Метастазы в забрюшинные лимфатические узлы у пациента с раком простаты.
В первые дни было опубликовано несколько публикаций, касающихся Т-стадии рака простаты, с разными результатами.Triller et al сообщили о 77 пациентах. Примерно у 50% пациентов с подозрением на клиническую стадию Т2 КТ показала экстракапсулярное расширение, а с другой стороны, у 20% клинических опухолей Т3 стадия понижена после КТ (2). Giri et al. сообщили о 25 пациентах, у 28% которых после КТ изменилась стадия рака по сравнению с клиническим обследованием (3).
Рисунок 7
Рис. 7. Большая карцинома предстательной железы с расширением за капсулу простаты, закрывающим правый ректопростатический угол.Обратите внимание на увеличенный региональный лимфатический узел.
В исследовании Platt et al. общая точность компьютерной томографии при Т-стадии составила всего 67%. Инвазия перипростатической жировой ткани показала чувствительность 75%, тогда как инвазия семенных пузырьков показала чувствительность только 33% (4).
Рисунок 8
Рисунок 8: Рак простаты с инвазией семенных пузырьков.
После внедрения ТРУЗИ и МРТ в клиническую практику в одном из первых сравнительных исследований КТ показала себя значительно хуже, чем ТРУЗИ и МРТ (24).С современными сканерами 1,5 Тесла можно достичь чувствительности от 77% до 91% при использовании T2-взвешенного изображения, а при использовании динамического контрастного T1-взвешенного изображения чувствительность еще больше увеличивается (25). Учитывая низкую чувствительность, компьютерная томография считается ненадежной для рака T1 или T2 (1). Интересно, что после внедрения спиральной компьютерной томографии в клиническую практику опубликовано только три исследования на английском языке, посвященных раку простаты (5, 6, 7). Прандо и Уоллес использовали протокол с усилением контраста и 3.Толщина среза 5 мм у пациентов с преимущественно раком T1 и T2. Области очагового поглощения контрастного вещества считались патологическими. У 23 из 25 обследованных больных раком выявлены отклонения от нормы на КТ (88%). При прямом сравнении с эндоректальным УЗИ в 43% случаев мелкие очаги рака, подтвержденные биопсией, были пропущены, тем не менее, у этих пациентов были патологические данные КТ. Интересно, что почти 10% усиливающих поражений не были злокачественными. При более высоких значениях ПСА усиление очагов злокачественных новообразований увеличивалось (6).Аналогичные результаты были получены Dhawan et al. Они использовали срез толщиной 5 мм и сочетание как улучшенного, так и неулучшенного сканирования и сообщили о нарушенной зональной патологии у 83% пациентов с раком простаты (5). Кажется, что КТ выявляет патологические изменения у большинства пациентов с раком простаты на ранних стадиях, но точная локализация множественных небольших очагов злокачественного новообразования проблематична.
Рисунок 9
Рис. 9: Усиление контрастности карциноматозной ткани в периферической зоне у пациента с карциномой простаты.
В этих двух исследованиях использовались сканеры одного среза. Ives et al. изучили перфузию карциномы простаты у 10 пациентов с помощью 16-срезового КТ-сканера и сопоставили ее с общей патологией. В отличие от вышеупомянутого исследования, они обнаружили видимые контрастные поражения только у 10% своих пациентов с раком простаты. Параметры перфузии КТ показали лучшие результаты и выявили отклонения у 50% их пациентов, они могли быть связаны с плохой дифференциацией и большей опухолью. тома (7).Недавно было опубликовано несколько статей китайских исследователей, изучающих рак простаты с помощью МС-КТ, но, к сожалению, на английском языке опубликованы только отрывки. Два из этих исследований кажутся особенно интересными. Лю и др. использовали компьютерную томографию перфузии и сообщили о различиях в параметрах перфузии (кривой временной плотности и времени пика) между ДГПЖ и раком простаты (26). С использованием 16-срезового компьютерного томографа и многоплоскостных преобразований Ye et al. сообщили об улучшенном анатомическом изображении рака простаты (27).Неясно, приведет ли это к большей точности определения стадии T при раке простаты, но недавно это было показано для рака прямой кишки (28). Эти результаты кажутся предварительными и должны быть воспроизведены в более крупных сериях, т.е. необходимы дополнительные исследования с использованием современных сканеров MS-CT. Интересно, что МС-КТ показала многообещающие результаты у пациентов с раком груди, еще одной областью медицинской визуализации, где КТ, как считается, значительно уступает МРТ (29). Чувствительность к рецидивирующему раку простаты после радикальной простатэктомии была низкой при использовании инкрементального или односрезового спирального компьютерного томографа (30).Метастазы в кости являются обычным явлением и достоверно показаны; в этом случае КТ является обследованием выбора, если есть вопросы о стабильности пораженных костей.
Рисунок 10
Рис. 10: Типичный остеобластический метастаз в кости при раке простаты.
После операции или интервенционного лечения такие осложнения, как гематома, перфорация или уринома, можно легко диагностировать с помощью компьютерной томографии.
Заключение
Несмотря на недостаток контрастирования мягких тканей по сравнению с МРТ или ТРУЗИ, патологии простаты можно увидеть на КТ.Радиологи, сообщающие о КТ брюшной полости и таза, должны знать об этих результатах. У некоторых пациентов и при определенных условиях компьютерная томография может помочь в диагностике заболевания предстательной железы. Необходимы дополнительные исследования возможного улучшения диагностической визуализации простаты с использованием современных МС-КТ сканеров с субмиллиметровой толщиной среза и высококачественными преобразованиями, чтобы убедиться, что мы используем весь потенциал наших сканеров.
Список литературы
1. Hricak H, Choyke PL, Eberhardt SC, Leibel SA, Scardino PT.Визуализация рака простаты: мультидисциплинарная перспектива. Радиология 2007; 243: 28-53.2. Триллер Дж., Фукс В.А. [Компьютерная томография рака простаты.] Rofo 1982; 137: 669-674.
3. Гири П.Г., Уолш Дж. У., Хазра Т. А., Текстер Дж. Х., Кунц У. Роль компьютерной томографии в оценке и лечении рака простаты. Int J Radiat Oncol Biol Phys 1982; 8: 283–287.
4. Платт Дж. Ф., Бри Р. Л., Шваб Р. Е.. Точность КТ в постановке рака простаты. AJR 1987; 149: 315-318.
5. Дхаван С., Готи Р., Аггарвал Б., Дода СС. Компьютерная томография при раке простаты. Indian J Radiol Imaging 2005; 15: 199-201.
6. Прандо А., Уоллес С. Спиральная компьютерная томография рака простаты: ранний клинический опыт. AJR 2000; 175: 343-346.
7. Ives PE, Burke MA, Edmonds PR, Gomella LG, Halpern EJ. Количественная компьютерная томография перфузии рака простаты: корреляция с общей патологией. Клинический рак простаты 2005; 4: 109–112.
8. Грей Х. Анатомия, описательная и хирургическая.15-е издание, 1901 г., страницы 1009-1010, Running Press Book Publishers, 1974, Филадельфия, США.
9. Hoffelt SC, Marshall LM, Garzotto M, Hung A, Holland J, Beer TM. Сравнение компьютерной томографии с трансректальным ультразвуком. Измеренный объем простаты при нелеченном раке простаты. Int J Radiat Oncol Biol Phys 2003; 57: 29-32.
10. Мировиц С.А., Хаммерманн AM. КТ-изображение зональной анатомии предстательной железы. J Comput Assist Tomogr 1992; 16: 439–441.
11. Россен Б., Нильсен МБ, Скривер Е.Б. КТ-демонстрация зональной анатомии предстательной железы во время инфузии динамического контрастного вещества.Acta Radiol 1994; 35: 400-401.
12. Аллен К.С., Крессел Х.Й., Аргер Ф.Х., Поллак Х.М. Возрастные изменения простаты: оценка с помощью МРТ. AJR 1989; 152: 77-81.
13. Zackrisson B, Hugosson J, Aus G. Трансректальная ультразвуковая анатомия простаты и семенных пузырьков у здоровых мужчин. Сканд Дж Урол Нефрол 2000; 34: 175–180
14. Ким В.Б., Ду С.В., Ян В.Дж., Сон Ю.С. Влияние камней простаты на симптомы со стороны нижних мочевыводящих путей у мужчин среднего возраста. Урология 2011; 78: 447–449.
15.Geramoutsos I, Gyftopoulos K, Perimenis P, Thanou V, Liagka D, Siamblis D, Barbalias G. Клиническая корреляция простатического литиаза с синдромами хронической тазовой боли у молодых людей. Европейская урология 2004; 45: 333–338.
16. Эдвардс JL. Диагностика и лечение доброкачественной гиперплазии простаты. Am Fam Physician 2008; 77: 1403–1410.
17. Aarnick RG, De la Rosette JJMCH, Huynen AL, Giesen RJB, Debruyne FMJ, Wikjstra H. Стандартизированная оценка для повышения диагностической ценности объема простаты; Часть 1: морфометрия у пациентов с симптомами нижних мочевыводящих путей.Простата 1996; 29: 317–326.
18. Reis LO, Barreiro GC, Baracat J, Prudente A, D’Ancona CA. Внутрипузырное протрузирование простаты как метод прогнозирования обструкции выходного отверстия мочевого пузыря. Int Braz J Urol 2008; 34: 627-633.
19. Толлей Д.А., Инглиш П.Дж., Григор К.М. Массивная доброкачественная гиперплазия предстательной железы. Журнал королевского медицинского общества. 1987: 80: 777–778.
20. Иконен С., Кивисаари Л., Тервахартиала П., Вехмас Т., Таари К., Раннико С. МРТ простаты. Точность дифференциации рака от других заболеваний предстательной железы.Acta Radiol 2001; 42: 348-354.
21. Торнхилл Б.А., Морхаус Х.Т., Коулман П., Хоффман-Третин, Дж. Абцесс предстательной железы: результаты КТ и сонографии. AJR 1987; 148: 899–900.
22. Саенс-Абад Д., Летона-Карбахо С., де Бенито-Аревало Ю.Л., Саниоакин-Конде С., Руис-Руис Ф.Дж. Туберкулез предстательной железы: история болезни. Sao Paulo Med J 2008; 126: 227-228.
23. Равиццини Г., Туркбей Б., Курдзил К., Чойк П.Л. Новые горизонты в визуализации рака простаты. Eur J Radiol 2009; 70: 212–226.
24. Фридман А.С., Сейдмон Э.Дж., Радецкий П.Д., Лев-Тоафф А., Кэролайн Д.Ф.Относительные достоинства МРТ, трансректальной эндосонографии и КТ в диагностике и стадировании рака простаты. Урология 1988; 31: 530-537.
25. Пинто Ф., Тотаро А., Каларко А., Сакко Е., Вольпе А., Рачоппи М., Д’Аддесси А., Гулино Дж., Басси П. Визуализация в диагностике рака простаты: роли в настоящем и перспективы на будущее. Урол Инт 2011; 86: 373–382.
26. Лю Дж, Ван Х, Ниу Кью, Лу Х, Ван Б. [Сравнение характеристик многофазного сканирования МСКТ между доброкачественной гиперплазией предстательной железы и раком простаты].Международный журнал медицинской радиологии, 2009. Доступ через www.en.cnki.com.cn/Article_en/CJFDTOTAL-GWLC200
27. Йе С., Ли Х, Юэ П. [Многоплоскостная реконструкция 16-срезовой спиральной компьютерной томографии в диагностике рака простаты]. Chongqing Medicine 2009. Доступ через www.en.cnki.com.cn/Article_en/CJFDTOTAL-CQYX200914041.htm
28. Мацуока Х., Накамура А., Масаки Т., Сугияма М., Такахара Т., Хачия Дж., Атоми Ю. Предоперационная стадия с помощью компьютерной томографии с несколькими детекторами у пациентов с карциномой прямой кишки.Am J Surg 2002; 184: 131–135.
29. Ямада Т., Мори Н., Ватанабе М., Кимидзима И., Окумото Т., Сейдж К., Такахаши С. Радиологическая патологическая корреляция протоковой карциномы in situ. Радиография 2010; 30: 1183–1198.
30. Krämer S, Görich J, Gottfried HW, Riska P, Aschoff AJ, Rilinger N, Brambs HJ, Sokiransli R. Чувствительность компьютерной томографии при обнаружении местного рецидива карциномы предстательной железы после радикальной простатэктомии. Br J Radiol 1997; 70: 995-999.
Какова роль компьютерной томографии в диагностике рака простаты?
[Рекомендации] Вольф А.М., Вендер Р.К., Этциони Р.Б., Томпсон И.М., Д’Амико А.В., Волк Р.Дж. и др.Руководство Американского онкологического общества по раннему выявлению рака простаты: обновление 2010 г. CA Cancer J Clin . 2010 март-апрель. 60 (2): 70-98. [Медлайн].
[Рекомендации] Картер Х. Б., Альбертсен П. К., Барри М. Дж. И др. Раннее выявление рака простаты: Руководство AUA. Дж Урол . 2013 Август 190 (2): 419-26. [Медлайн]. [Полный текст].
[Рекомендации] Национальная комплексная онкологическая сеть. Раннее выявление рака простаты. NCCN. Доступно по адресу http: // www.nccn.org/professionals/physician_gls/pdf/prostate_detection.pdf. Версия 1.2019 – 31 января 2019 г .; Дата обращения: 10 мая 2019 г.
[Рекомендации] Целевая группа превентивных служб США. Рак простаты: Скрининг. Доступно по адресу https://screeningforprostatecancer.org/read-the-materials/. 2018; Дата обращения: 10 мая 2019 г.
[Рекомендации] Паркер С., Гиллессен С., Хайденрайх А., Хорвич А., Комитет по руководствам ESMO. Рак простаты: Клинические рекомендации ESMO по диагностике, лечению и последующему наблюдению †. Энн Онкол . 2015 26 сентября Дополнение 5: v69-v77. [Медлайн]. [Полный текст].
Стадии рака простаты. Американское онкологическое общество. Доступно по адресу https://www.cancer.org/cancer/prostate-cancer/detection-diagnosis-staging/staging.html. 18 декабря 2017 г .; Дата обращения: 10 мая 2019 г.
Рак в цифрах и фактах, 2019 г. Американское онкологическое общество. Доступно по адресу https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/annual-cancer-facts-and-figures/2019/cancer-facts-and-figures- 2019.pdf. Дата обращения: 10 мая 2019 г.
Дэниэлс Н.А., Нильсон К.М., Хоффман А.Р., Бауэр округ Колумбия. Половые гормоны и риск рака простаты. Урология . 2010 ноябрь 76 (5): 1034-40. [Медлайн]. [Полный текст].
Hoffman RM, Gilliland FD, Eley JW, Harlan LC, Stephenson RA, Stanford JL, et al. Расовые и этнические различия в поздних стадиях рака простаты: исследование исходов рака простаты. Национальный институт рака . 2001, 7 марта. 93 (5): 388-95.[Медлайн].
Lindquist KJ, Paris PL, Hoffmann TJ, Cardin NJ, Kazma R, Mefford JA, et al. Мутационный ландшафт агрессивных опухолей простаты у афроамериканских мужчин. Cancer Res . 2016 26 февраля. [Medline].
Холл И.Дж., Тейлор Ю.Дж., Росс Л.Е. и др. Обсуждения скрининга рака простаты между врачами первичной медико-санитарной помощи США и их пациентами. J Gen Intern Med . 2011 26 октября (10): 1098-104. [Медлайн].
Holmberg L, Bill-Axelson A, Helgesen F, et al.Рандомизированное исследование, сравнивающее радикальную простатэктомию с осторожным выжиданием при раннем раке простаты. N Engl J Med . 2002 сентябрь 12, 347 (11): 781-9. [Медлайн].
Andriole GL, Crawford ED, Grubb RL 3rd, Buys SS, Chia D, el at. Смертность определяется рандомизированным скрининговым исследованием рака простаты. N Engl J Med . 2009 26 марта. 360 (13): 1310-9. [Медлайн]. [Полный текст].
Schröder FH, Hugosson J, Roobol MJ, Tammela TL, Ciatto S, Nelen V и др.Скрининг и смертность от рака простаты в рандомизированном европейском исследовании. N Engl J Med . 2009 26 марта. 360 (13): 1320-8. [Медлайн].
Sandblom G, Varenhorst E, Rosell J, Löfman O, Carlsson P. Рандомизированное скрининговое испытание на рак простаты: наблюдение через 20 лет. BMJ . 2011 31 марта. 342: d1539. [Медлайн]. [Полный текст].
Тан П., Сун Л., Ульман М.А., Робертсон К.Н., Полашик Т.Дж., Альбала Д.М. Прекращение скрининга рака простаты у пожилых афроамериканцев и мужчин европеоидной расы с учетом риска простат-специфических антигенов. Урология . 2010 ноябрь 76 (5): 1058-62. [Медлайн].
[Рекомендации] Европейская ассоциация урологов. Рекомендации по раку простаты. Uroweb. Доступно на http://uroweb.org/guideline/prostate-cancer/. 2018; Дата обращения: 10 мая 2019 г.
Lowry F. Test избавляет мужчин от ненужных биопсий при раке простаты. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/828845. 24 июля 2014 г .; Доступ: 1 марта 2016 г.
Bul M, van den Bergh RC, Rannikko A, Valdagni R, Pickles T, Bangma CH, et al.Предикторы неблагоприятных результатов повторной биопсии у мужчин, участвующих в проспективной программе активного наблюдения. Евро Урол . 2012 Февраль 61 (2): 370-7. [Медлайн].
Кирмиз С., Ци Дж., Бабиц С.К., Линселл С., Дентон Б., Сингх К. и др. Группы оценок обеспечивают улучшенные прогнозы патологических и ранних онкологических исходов по сравнению с группами риска по шкале Глисона. Дж Урол . 2018 6 сентября [Medline].
Bostwick DG, Qian J.Интраэпителиальная неоплазия предстательной железы высокой степени. Мод Pathol . 2004 17 марта (3): 360-79. [Медлайн].
Ли М.С., Мусса А.С., Ю.К., Каттан М.В., Маги-Галлуцци С., Джонс Дж. С.. Мультифокальная интраэпителиальная неоплазия предстательной железы высокой степени является фактором риска последующего рака простаты. Дж Урол . 2010 ноябрь 184 (5): 1958-62. [Медлайн].
[Рекомендации] NCCN Клинические рекомендации по онкологии: рак простаты. Национальная всеобъемлющая онкологическая сеть.Доступно на http://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf. Версия 2.2019 – 17 апреля 2019 г .; Дата обращения: 10 мая 2019 г.
Юнг С.И., Донати О.Ф., Варгас Х.А., Голдман Д., Хричак Х., Акин О. Рак предстательной железы переходной зоны: дополнительная ценность диффузно-взвешенной эндоректальной МРТ-визуализации в обнаружении опухолей и оценке агрессивности. Радиология . 2013 Ноябрь 269 (2): 493-503. [Медлайн].
Чой В.В., Уильямс С.Б., Гу Х, Липсиц С.Р., Нгуен П.Л., Ху Дж.С.Чрезмерное использование изображений для определения стадии рака простаты низкого риска. Дж Урол . 2011 Май. 185 (5): 1645-9. [Медлайн].
Нанни С., Занони Л., Пултрон С., Скьявина Р., Бруноцилла Е., Лоди Ф. и др. 18 F-FACBC (анти-1-амино-3- 18 F-фторциклобутан-1-карбоновая кислота) по сравнению с 11 ПЭТ / КТ C-холина при рецидиве рака простаты: результаты проспективного исследования. Eur J Nucl Med Mol Imaging . 2016 г. 10 марта [Medline].
Odewole OA, Tade FI, Nieh PT, Savir-Baruch B., Jani AB, Master VA, et al.Обнаружение рецидивирующего рака простаты с помощью анти-3- [ 18 F] FACBC ПЭТ / КТ: сравнение с КТ. Eur J Nucl Med Mol Imaging . 2016 18 апреля. [Medline].
Rastinehad AR, Turkbey B, Salami SS, Yaskiv O, George AK, Fakhoury M, et al. Улучшение выявления клинически значимого рака простаты: магнитно-резонансная томография / трансректальная биопсия простаты под контролем ультразвука. Дж Урол . 2014 июнь 191 (6): 1749-54. [Медлайн].
Сиддики М.М., Раис-Бахрами С., Туркбей Б., Джордж А.К., Ротвакс Дж., Шакир Н. и др.Сравнение МРТ / ультразвуковой биопсии под контролем слияния с ультразвуковой биопсией для диагностики рака простаты. ЯМА . 2015 27 января. 313 (4): 390-7. [Медлайн].
Sankineni S, George AK, Brown AM, Rais-Bahrami S, Wood BJ, Merino MJ, et al. Задний субкапсулярный рак простаты: идентификация с помощью mpMRI и биопсии под контролем слияния MRI / TRUS. Визуализация брюшной полости . 2015 Октябрь 40 (7): 2557-65. [Медлайн].
Bjurlin MA, Meng X, Le Nobin J, Wysock JS, Lepor H, Rosenkrantz AB, et al.Оптимизация биопсии простаты: роль прицельной биопсии магнитно-резонансной томографии в обнаружении, локализации и оценке риска. Дж Урол . 2014 сентябрь 192 (3): 648-58. [Медлайн].
Альбертс А.Р., Шутс И.Г., Бокхорст Л.П., ван Лендерс Г.Дж., Бангма СН, Робол М.Дж. Отбор пациентов на основе риска для целевой биопсии простаты с помощью магнитно-резонансной томографии после отрицательной случайной биопсии под контролем трансректального ультразвукового исследования позволяет избежать ненужных сканирований с помощью магнитно-резонансной томографии. Евро Урол . 2015 г. 2 декабря [Medline].
Hu JC, Chang E, Natarajan S, Margolis DJ, Macairan M, Lieu P и др. Прицельная биопсия простаты у избранных мужчин для активного наблюдения: применимы ли критерии Эпштейна? Дж Урол . 2014 Август 192 (2): 385-90. [Медлайн].
Американский объединенный комитет по раку. Предстательная железа. Amin MB, Edge S, Greene F, Byrd DR, Brookland RK и др., Под ред. AJCC Руководство по стадированию рака . 8-е изд.Нью-Йорк: Спрингер; 2017.
Cooperberg MR, Simko JP, Cowan JE, Reid JE, Djalilvand A, Bhatnagar S, et al. Валидация панели генов прогрессии клеточного цикла для улучшения стратификации риска в современной когорте простатэктомии. Дж. Клин Онкол . 2013 10 апреля. 31 (11): 1428-34. [Медлайн].
Cuzick J, Swanson GP, Fisher G, Brothman AR, Berney DM, Reid JE, et al. Прогностическое значение сигнатуры экспрессии РНК, полученной из генов пролиферации клеточного цикла, у пациентов с раком простаты: ретроспективное исследование. Ланцет Онкол . 2011 марта 12 (3): 245-55. [Медлайн].
Кляйн Э.А., Хаддад З., Юсефи К., Лам Л.Л., Ван К., Чоурнг В. и др. Расшифровка геномного классификатора, измеряемого при биопсии простаты, прогнозирует риск метастазирования. Урология . 2016 г. 22 января [Medline].
Фальзарано С.М., Ферро М., Боллито Э., Кляйн Э.А., Карриери Дж., Маги-Галлуцци К. Новые биомаркеры и геномные тесты при раке простаты: критический анализ. Минерва Урол Нефрол .2015 Сентябрь 67 (3): 211-31. [Медлайн].
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера на прием файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
ПЭТ-сканирование для рака простаты
ПЭТ-сканирование для рака простаты
Если у вас или у вашего близкого был диагностирован какой-либо тип рака, часто остается много вопросов, оставшихся без ответа.Тем, у кого диагностирован рак простаты, врач может предложить провести ПЭТ-сканирование как часть общего плана лечения и наблюдения за любыми рецидивами или прогрессированием заболевания. Мы надеемся, что эта статья может быть ресурсом и поможет ответить на несколько наиболее распространенных вопросов, которые мы получаем о ПЭТ-сканировании при раке простаты.
Поскольку рак простаты является второй по значимости причиной смерти от рака у американских мужчин (1), новые достижения в области ранней диагностики и высококачественной визуализации для определения стадии и повторной постановки рака простаты стали главным приоритетом для медицинского сообщества.Комплексное лечение рака требует высококачественной визуализации и является движущей силой быстрого и постоянного прогресса в методах визуализации, используемых при раке простаты. В последние годы ПЭТ-сканирование для выявления рака простаты становится все более популярным выбором для точного определения местоположения и оценки степени рака простаты. Несмотря на то, что многие традиционные методы визуализации, такие как ТРУЗИ, КТ и МРТ, значительно улучшились, эта статья призвана подчеркнуть важную роль расширенной визуализации, такой как ПЭТ-сканирование при раке простаты.
Хотите узнать больше о ПСМА-ПЭТ-сканировании при раке простаты? Щелкните здесь.
Если вам требуется ПЭТ-сканирование PSMA, присоединяйтесь к нашему списку приоритетов по , нажав здесь.
Что такое ПЭТ-сканирование и почему оно используется при раке простаты?
Новый ПЭТ-сканер GE Discovery IQ
- Что такое ПЭТ-сканирование? «ПЭТ-сканирование», сокращение от «Позитронно-эмиссионная томография», – это метод визуализации, в котором используются радиоактивные индикаторы для четкого изображения целевых участков тела.Он в основном используется в диагностике, начальной стадии и стратегии лечения, для оценки эффективности терапии и для повторного определения стадии или для оценки рецидива заболевания после лечения.
- Почему при раке простаты используется ПЭТ? ПЭТ-сканирование используется при раке простаты из-за его превосходной способности нацеливать и захватывать изображения рака простаты на клеточном уровне. Это позволяет более точно определять стадию и перестраивать общую стратегию лечения рака простаты.В связи с разработкой и изучением новых радиоактивных индикаторов, ПЭТ-сканирование продолжает лидировать в возможностях визуализации при лечении рака простаты.
ПЭТ-сканирование произвело революцию в способах визуализации рака простаты благодаря своей способности воздействовать на рак на клеточном и молекулярном уровне. При сканировании ПЭТ используется радиоактивный индикатор, который поглощается и визуализируется в раковых клетках, связанных с простатой. Это делает ПЭТ-сканирование лучшим выбором, чем более традиционные методы визуализации, которые оценивают только анатомический «снимок» аномалий, а не функциональные аспекты ПЭТ-сканирования.
ПЭТ-сканирование сочетается с компьютерной томографией, выполняемой одновременно, поэтому иногда вы можете прочитать или услышать, как кто-то называет эту процедуру ПЭТ / КТ-сканированием. Благодаря компьютерной томографии, получающей высококачественные анатомические изображения, и ПЭТ, обнаруживающим изменения на молекулярном уровне, их комбинация позволяет создавать чрезвычайно точные наложенные одиночные изображения, которые невозможно воспроизвести с помощью других методов визуализации. Такой уровень точности и аккуратности является причиной того, что ПЭТ-сканирование часто является выбором номер один при попытке определить наиболее четкий путь вперед для многих пациентов с раком простаты.В частности, в настоящее время он преимущественно используется у мужчин с подозрением на рецидив рака простаты после лечения. ПЭТ-сканирование может обнаружить и охарактеризовать очень небольшие участки рецидивирующего рака простаты даже при очень низком уровне ПСА.
Часто задаваемые вопросы о дополнительном сканировании ПЭТ
Безопасно ли сканирование ПЭТ?
Хотя при сканировании ПЭТ используются радиоактивные индикаторы, это «диагностические уровни» излучения, которые полностью безопасны и не имеют известных побочных эффектов.
Сколько времени нужно, чтобы получить результаты после сканирования ПЭТ?
Изображения захватываются и создаются во время процедуры ПЭТ-сканирования, а после этого радиолог использует свое обучение и опыт для интерпретации результатов сканирования и составления письменного отчета о результатах и заключениях. Затем этот отчет передается вашему лечащему врачу, который затем изучит с вами эти результаты и при необходимости обсудит дальнейшее лечение.
Каково пациенту пройти ПЭТ-сканирование?
Пожалуйста, посмотрите это видео, которое мы создали, в котором подробно рассказывается о том, как пройти ПЭТ-сканирование, и даются ответы на все распространенные вопросы о ПЭТ-сканировании.
Когда и почему ПЭТ-сканирование используется при раке простаты?
- Стадия: ПЭТ-сканирование используется для пациентов с известным раком простаты, чтобы точно определить его точное местоположение, определить степень заболевания и определить стратегию лечения.
- Планирование лечения: В некоторых случаях ПЭТ-сканирование может использоваться для целенаправленного нацеливания на определенные области высокого риска для специального лечения. Бывают случаи, когда ПЭТ-сканирование является единственным диагностическим тестом, который может идентифицировать эти скрытые в противном случае области распространения рака.
- Оценка во время и после лечения: ПЭТ-сканирование можно использовать во время и после лечения рака простаты, чтобы определить эффективность или реакцию конкретных лекарств и методов лечения.
- Текущее лечение рака после выявления биохимически рецидивирующего рака простаты – повторное обследование: ПЭТ-сканирование позволяет врачам определить местонахождение и оценить степень рецидива рака простаты. В частности, новый радиофармпрепарат под названием аксумин (см. Ниже) обладает превосходной способностью обнаруживать рецидив рака простаты даже на очень ранних стадиях и у пациентов с низким уровнем ПСА.
Общий пример использования ПЭТ-сканирования после диагностики рака простаты
Важно отметить, что, хотя ПЭТ-сканирование может быть важным инструментом при оценке рака простаты, оно не всегда используется для всех пациентов, и существует множество других методов визуализации и процедур, которые могут быть рекомендованы в зависимости от конкретных потребностей пациента. .
Это пример лечения рака простаты, включающий ПЭТ-сканирование.
- Рак простаты выявляется по результатам скрининга ПСА (простатоспецифический антиген) с помощью анализа крови или DRE (пальцевое ректальное исследование).
- Рак предстательной железы подтверждается с помощью стержневой игольной биопсии с визуализацией (ТРУЗИ или МРТ) до или во время процедуры.
- В некоторых случаях ПЭТ-сканирование может использоваться во время первоначальной оценки и стратегии лечения. Рак простаты оценивается после постановки диагноза с использованием различных методов визуализации для определения степени или стадии рака. В то время как методы визуализации, такие как МРТ, часто используются для определения стадии рака простаты, ПЭТ-сканирование эффективно используется для определения стадии рака простаты, и новые тесты, такие как сканирование ПСМА-ПЭТ, продолжают показывать многообещающие перспективы в качестве лучших будущих решений для определения стадии рака простаты.
- ПЭТ-сканирование обычно является наиболее эффективным способом лечения рецидива рака простаты. После лечения рака простаты для определения эффективности лечения можно использовать ПЭТ-сканирование, и в настоящее время оно широко используется для выявления биохимически рецидивирующего рака простаты для повторной постановки диагноза. Специальный радиоактивный индикатор для ПЭТ, Axumin, был разработан именно для этой цели – нацеливания и повторной диагностики рецидивирующего рака простаты.
Каковы наиболее распространенные «типы» ПЭТ-сканирования рака простаты?
- Аксумин (флуцикловин F-18) ПЭТ-сканирование: в настоящее время используются, в основном, с целью повторной диагностики рецидивирующего рака простаты у пациентов с подозрением на биохимический рецидив.Несмотря на то, что сканирование Axumin PET считается «не по прямому назначению», оно также может использоваться в некоторых случаях для определения начальной стадии рака простаты.
- ФДГ (фтордезоксиглюкоза) ПЭТ-сканирование : Может также использоваться для определения стадии в особых случаях рака простаты. В некоторых случаях, в зависимости от типа опухоли рака простаты, сканирование FDG PET также может использоваться для повторной диагностики рецидивирующего рака простаты.
- PSMA (простатоспецифический мембранный антиген) ПЭТ-сканирование: Используется для обнаружения, определения стадии и повторной диагностики рака простаты.ПСМА-ПЭТ-сканирование оценивается для использования после постановки диагноза рака простаты для определения стадии и определения того, распространился ли рак на другие части тела. Они также оцениваются для использования в локализации и повторной диагностике рецидива рака простаты у пациентов с биохимическим рецидивом.
Axumin (Fluciclovine F-18) ПЭТ-сканирование для лечения рака простаты
Axumin – это одобренный FDA агент, используемый для сканирования Axumin PET при раке простаты. Аксумин часто может визуализировать и восстановить рецидив рака простаты лучше, чем любые другие традиционные методы визуализации.Биохимический рецидив, обычно подозреваемый на повышении уровня ПСА (простатоспецифического антигена), является стандартом при наблюдении за пациентами с подозрением на рецидив рака простаты. Традиционные методы визуализации часто ограничены тем, что они могут обнаружить небольшой лимфатический узел или «подозрительную» находку, но не могут дополнительно функционально охарактеризовать молекулярную активность для определения уровня подозрений. Внедрение Axumin PET-сканирования стало прорывом, позволив врачам точно определять местонахождение и прецизионную диагностику рака простаты, особенно в условиях подозрительно растущего уровня ПСА.
Когда используется ПЭТ-сканирование Axumin при раке простаты?
Сканирование Axumin PET в настоящее время одобрено FDA и используется у пациентов с подозрением на биохимический рецидив рака простаты. После получения одобрения FDA, сканирование Axumin PET быстро стало предпочтительным вариантом для тысяч пациентов в Соединенных Штатах. До сканирования Axumin PET время от времени использовались более традиционные методы визуализации, но с ограниченным универсальным признанием.
Почему ПЭТ-сканирование с использованием аксумина является предпочтительным вариантом для пациентов с подозрением на рецидив рака простаты?
- Axumin PET-сканирование может определять местонахождение и обнаруживать рецидив рака простаты лучше и надежнее, чем другие традиционные методы визуализации.
- В то время как другие методы, такие как КТ, МРТ и УЗИ, позволяют «увидеть» небольшой лимфатический узел или поражение кости, только ПЭТ-сканирование Axumin может определить реальную активность большинства видов рака простаты – в рамках этих небольших результатов, чтобы лучше охарактеризовать и спланировать стратегию лечения. .
- Axumin ПЭТ-сканирование помогает врачам рекомендовать наилучшие планы лечения.
- Axumin ПЭТ-сканирование одобрено FDA и во многих случаях частично или полностью покрывается страховкой для пациентов в США.
Как работают ПЭТ-сканирование с использованием аксумина (флуцикловина F-18)?
В ПЭТ Axumin используется радиоактивный индикатор, вводимый в виде инъекции, который связан с аминокислотой, которая абсорбируется раком простаты гораздо быстрее, чем нормальные клетки. Быстрое поглощение аксумина клетками рака простаты затем отображается с помощью передовых технологий в оборудовании для сканирования ПЭТ. Затем изображения сканирования ПЭТ просматриваются, чтобы определить, было ли какое-либо распространение на другие области тела.
ПСМА (специфический мембранный антиген простаты) ПЭТ-сканирование для лечения рака простаты
Хотя ПЭТ-сканирование с ПСМА все еще ожидает одобрения FDA, продолжающиеся исследования продолжают предполагать, что в ближайшем будущем это будет еще более ценный инструмент визуализации, который будет использоваться как для стадирования, так и для повторной стадии рака простаты. Мы надеемся, что особенности PSMA позволят получить еще более точную визуализацию и скорейшее обнаружение при выполнении ПЭТ-сканирования рака простаты.
Когда используется ПЭТ-сканирование PSMA при раке простаты?
Хотя он все еще ожидает одобрения FDA, он изучается и используется в других странах для следующих целей.
- Стадия: Пациентам с впервые поставленным диагнозом рака простаты полезно использовать ПЭТ-сканирование с ПСМА из-за его превосходной способности обнаруживать распространение рака, предлагая наилучшие возможные варианты лечения в будущем.
- Restaging: Пациенты с подозрением на биохимический рецидив рака простаты, то есть пациенты с повышенным уровнем ПСА после окончательной терапии, получают пользу от использования ПЭТ-сканирования PSMA из-за его способности точно определять местонахождение рецидивирующего рака простаты и определять распространение рака.По обеим этим причинам ПЭТ-сканирование с ПСМА предлагают лучшие варианты лечения рецидивирующего рака простаты.
Как работает ПЭТ-сканирование с ПСМА (специфическим для простаты мембранным антигеном)?
При сканированииPSMA PET используется другой функциональный метод визуализации клеток рака простаты. ПСМА – это гликопротеин, тип сахарного протеина, который находится на поверхности клеток рака простаты. Эти индикаторы, такие как PSMA, вводятся, а затем сканированные изображения ПЭТ получают стандартным способом. Как и все ПЭТ-сканирование, эти изображения затем интерпретируются радиологом и впоследствии используются для определения стратегии лечения.
Аксумин против ПСМА: что лучше?
Аксумин в настоящее время одобрен FDA и используется повсеместно для повторной диагностики рака простаты при подозрении на биохимический рецидив. Следовательно, ПЭТ-сканирование Axumin является лучшим вариантом в настоящее время для повторной диагностики рецидива рака простаты благодаря его одобрению FDA, доступности и очень хорошей способности обнаруживать и характеризовать рецидив рака простаты. Исследования продолжают предполагать, что ПЭТ-сканирование с ПСМА может быть лучшим вариантом как для определения стадии, так и для повторной стадии рака простаты после одобрения FDA для использования в Соединенных Штатах.Для этого необходимы дальнейшие исследования и исследования.
Если вам требуется ПЭТ-сканирование PSMA, присоединяйтесь к нашему списку приоритетов по , нажав здесь.
Следующие шаги
Институт ПЭТ-изображений является ведущим поставщиком ПЭТ-сканирования и имеет более чем 20-летний опыт использования ПЭТ-изображений при раке простаты. Мы понимаем, что у вас все еще могут быть вопросы о том, почему ваш врач предложил вам или кому-то из вашей семьи сделать ПЭТ-сканирование.
Если ваш врач запросил ПЭТ-сканирование для выявления рака простаты как часть вашего медицинского обслуживания, вы, возможно, наткнулись на эту статью как часть поиска дополнительной информации.Мы стремимся держать наших пациентов в курсе последних событий в области ПЭТ-сканирования и ПЭТ-сканирований для рака простаты, делая эти достижения доступными для вас. Независимо от того, являетесь ли вы местным жителем, иностранцем или человеком, часто бывающим в Южной Флориде и нуждающимся в этих услугах, свяжитесь с нами по телефону (954) 981-6668, чтобы обсудить дальнейшие шаги и попросить нас ответить на любые ваши вопросы!
Список литературы
- https://www.cancer.org/cancer/prostate-cancer/about/key-statistics.HTML
- https://www.pcf.org/wp-content/uploads/2018/09/Calais_Jeremie_1.pdf
ПСМА ПЭТ-КТ точно определяет распространение рака простаты
, от NCI Staff
Изображения, полученные с помощью ПЭТ-КТ Ga-68 PSMA у мужчины с раком простаты, показывают опухоли в лимфатических узлах в груди и брюшной полости.
Кредит: адаптировано из Int J Mol Sci.Июль 2013 г. doi: 10.3390 / ijms140713842. CC BY 3.0.
ОБНОВЛЕНИЕ : 1 декабря 2020 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило радиоактивный индикатор Галлий (Ga) 68 PSMA-11 для использования в ПЭТ-визуализации мужчин с раком простаты. По утверждению, индикатор может использоваться в ПЭТ-визуализации рака простаты, который предположительно распространился на другие части тела. Ga 68 PSMA-11 также можно использовать у мужчин, которые успешно прошли курс лечения от рака простаты, но из-за повышенного уровня ПСА предполагается, что их болезнь вернулась.
Для некоторых мужчин с раком простаты результаты крупного клинического исследования показывают, что может быть более эффективный подход к визуализации для обнаружения распространения их рака на другие части тела, чем наиболее часто используемый подход.
В исследовании, проведенном в Австралии, участвовали мужчины, у которых был диагностирован локализованный рак простаты, который, как считалось, подвергался высокому риску распространения за пределы простаты. В исследовании метод визуализации, известный как PSMA PET-CT, был значительно более вероятен для обнаружения метастатических опухолей у этих мужчин, чем стандартный подход к визуализации, используемый во многих странах, который включает компьютерную томографию и сканирование костей.
Использование ПСМА ПЭТ-КТ также было более вероятным, чем стандартный подход к изменению стратегии, которую врачи использовали для лечения рака, – заявил ведущий исследователь исследования Майкл Хофман, профессор ядерной медицины онкологического центра Питера МакКаллума в Мельбурне, и его Коллеги сообщили 22 марта в The Lancet .
Исследование не предназначалось для того, чтобы показать, улучшило ли использование ПСМА ПЭТ-КТ клинические исходы, такие как продолжительность жизни пациентов. Но результаты, по словам доктора Хофмана, основаны на данных других исследований и текущей клинической практики в таких странах, как Австралия и Германия, которые предполагают, что ПЭТ-КТ с ПСМА с большей вероятностью обнаружит метастазы, чем традиционный подход.
«Для такого диагностического теста точность – это самое главное. Вам нужен точный тест, – сказал доктор Хофман. Он отметил, что в этой группе пациентов наличие метастазов должно влиять на лечение мужчин.
Если на момент постановки диагноза рак распространился за пределы простаты, лечение первичной опухоли простаты хирургическим вмешательством или лучевой терапией само по себе «бесполезно», – сказал доктор Хофман. Знание сразу после постановки диагноза, распространился ли рак, «является ключом к лучшей оптимизации лечения этих мужчин.”
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) не одобрило какие-либо агенты визуализации, нацеленные на ПСМА, поэтому ПЭТ-КТ ПСМА недоступна в США за пределами клинических исследований, пояснила Лалита Шанкар, доктор медицины, доктор философии Программа визуализации рака в отделе лечения и диагностики рака NCI.
Несколько агентов визуализации, нацеленных на PSMA, изучаются, сказал доктор Шанкар, и «все они весьма многообещающие». Но, продолжила она, необходимы дальнейшие исследования. В частности, по ее словам, были бы полезны дополнительные клинические испытания, в которых тщательно изучается, как эти методы визуализации «влияют на ведение пациентов».«Нам также нужно посмотреть, повлияет ли это на результаты».
Другой способ обнаружения метастазов
Большинство мужчин, у которых диагностирован рак простаты, имеют локализованное заболевание, то есть рак, по-видимому, ограничен предстательной железой. Однако определенные факторы связаны с более высоким риском того, что рак в конечном итоге распространится (или уже распространился).
В настоящее время в США и многих других странах большинство мужчин с диагнозом «локализованный рак простаты высокого риска» проходят дополнительное тестирование, чтобы выяснить, есть ли признаки метастатического рака.В течение многих лет это делалось с помощью обычной компьютерной томографии (которая использует форму рентгеновских лучей) и сканирования костей (вид ядерной визуализации), последнее из-за того, что рак простаты часто распространяется на кости.
Но обе технологии визуализации имеют ограничения. Ни один из них не особенно хорош в обнаружении отдельных клеток рака простаты и, следовательно, может пропустить очень маленькие опухоли. А сканирование костей может обнаружить повреждение или аномалии костей, которые были вызваны чем-то другим, кроме рака (например, артритом), что приводит к «ложноположительным» результатам, которые могут привести к ненужным дополнительным исследованиям.
Итак, исследователи разрабатывают и тестируют другие средства визуализации, которые могут обнаруживать раковые клетки простаты именно в организме, – объяснил доктор Шанкар.
Как следует из названия, ПЭТ-КТ-сканирование сочетают в себе компьютерную томографию с ПЭТ-сканированием, другим типом теста ядерной визуализации, который требует от пациентов внутривенных инъекций радиоактивного «индикатора», который может быть обнаружен на сканировании.
В ПЭТ-КТ PSMA индикатор, используемый для сканирования ПЭТ, включает молекулу, которая специфически связывается с белком PSMA, который часто в больших количествах обнаруживается на клетках рака простаты.Эта молекула связана с радиоактивным соединением или радиоизотопом. Радиоизотоп, использованный в австралийских испытаниях, называется галлий-68 (Ga-68).
индикаторов, нацеленных на ПСМА, которые используют другие радиоизотопы, также широко изучаются, объяснил Мартин Помпер, доктор медицинских наук, директор отдела ядерной медицины и молекулярной визуализации в Медицинской школе Джонса Хопкинса. Небольшие исследования убедительно показали, что ПЭТ-КТ с ПСМА лучше при обнаружении метастазов у мужчин с локализованным раком простаты.Помпер сказал, что с нетерпением ждали более окончательных ответов от более крупных исследований.
Повышение точности и изменение обращения
Приблизительно 300 мужчин были включены в австралийское исследование, все с недавно диагностированным локализованным раком простаты (на основании биопсии простаты), и все они были признаны страдающими заболеваниями высокого риска. Для всех мужчин в исследовании запланированным лечением было либо хирургическое вмешательство (простатэктомия), либо лучевая терапия только простаты.
Половина мужчин была случайным образом распределена для первоначального обследования КТ и сканирования костей, а другая половина – на ПЭТ-КТ с ПСМА.
На основании изображений, ПЭТ-КТ с ПСМА была на 27% точнее стандартного подхода при обнаружении любых метастазов (92% против 65%). Точность определялась путем объединения чувствительности и специфичности сканирования, показателей, которые показывают способность теста правильно определять, присутствует ли болезнь, а когда нет.
ПСМА ПЭТ-КТ была более точной как для метастазов, обнаруженных в лимфатических узлах в тазу, так и в более отдаленных частях тела, включая кости. Радиационное воздействие также было значительно ниже при использовании ПЭТ-КТ с ПСМА, чем при традиционном подходе.
Исследователи также отслеживали, как результаты визуализации влияют на выбор лечения врачами. Основываясь на результатах визуализации, первоначальный план лечения был изменен для 15% мужчин, прошедших обычную визуализацию, по сравнению с 28% мужчин, которым проводилась ПЭТ-КТ с ПСМА.
Другой ключевой вывод, отметил доктор Хофман, заключался в том, что ПЭТ-КТ с ПСМА гораздо реже давала неубедительные или двусмысленные результаты (7% против 23%).
Это важно, продолжил он, «потому что, если у вас есть сканирование с неоднозначными выводами, оно часто приводит к дополнительным исследованиям, биопсии или другим тестам.”
Будущее PSMA PET-CT
«Это серьезное исследование, отражающее реальный опыт» с ПСМА ПЭТ-КТ в других странах, – сказал д-р Помпер. «Поскольку существует несколько индикаторов, нацеленных на PSMA, следующим шагом будет их одобрение для использования в Соединенных Штатах вне клинических испытаний», – добавил он.
Он предсказал, что, в конце концов, различные индикаторы PSMA будут протестированы лицом к лицу.
Австралийское исследование дополняет растущий объем исследований по улучшению выявления метастатических опухолей у мужчин с раком простаты.Один агент визуализации, флуцикловин F18 (аксумин), который нацелен на клетки рака предстательной железы иначе, чем маркеры, нацеленные на PSMA, уже одобрен в Соединенных Штатах для использования у мужчин с ранее леченным раком простаты, который, по-видимому, прогрессирует (на основе роста Уровни ПСА).
«ПСМА ПЭТ-КТ также изучается в этой группе мужчин», – сказал доктор Шанкар. Одно небольшое клиническое испытание, которое напрямую сравнивало ПЭТ-КТ с ПСМА и ПЭТ-КТ с флуцикловином F18, показало, что целенаправленное сканирование с ПСМА обнаружило больше метастатических опухолей, независимо от их местоположения.NCI финансирует аналогичное, но более крупное клиническое испытание.
Доктор Помпер отметил, что PSMA также обнаруживается на относительно высоких уровнях в сосудистой сети при ряде других видов рака, включая почки, щитовидную железу и молочную железу, поэтому он надеется, что PSMA PET-CT может быть полезен помимо рака простаты.
Исследователи из Калифорнийского университета в Лос-Анджелесе и Калифорнийского университета в Сан-Франциско (UCSF) подали отдельные заявки в FDA на одобрение Ga-68 PSMA-радиоиндикатора, согласно Джереми Кале, доктору медицины.из Онкологического центра Йонссона при Калифорнийском университете в Лос-Анджелесе. Обе заявки могут быть одобрены к концу 2020 года, сказал доктор Кале.
Однако соответствующие приложения отказываются от каких-либо исключительных прав на эти трассировщики, пояснил он. По его словам, как только FDA одобрит эти приложения, другие учреждения, у которых есть производственные мощности, смогут производить свои собственные индикаторы, используя те же спецификации, что и агенты UCLA и UCSF, а затем пройти сокращенный процесс утверждения с FDA, чтобы начать их использовать.
Между тем, все еще неясно, как ПСМА ПЭТ-КТ повлияет на клиническую практику в Соединенных Штатах. Но он уже есть в Австралии и нескольких европейских странах, сказал доктор Хофман. В Австралии больницам не требуется разрешения регулирующих органов для производства собственных индикаторов на основе ПСМА для использования в уходе за пациентами, поэтому по крайней мере 60 больниц в Австралии регулярно используют ПЭТ-КТ с ПСМА.
«Урологи и онкологи-радиологи во многих местах [в Австралии] уже заказывают это сканирование как стандарт лечения», – сказал он.
Также были высказаны опасения по поводу затрат, связанных с более широким использованием ПЭТ-КТ. Хотя стоимость может варьироваться, во многих странах ПЭТ-КТ в настоящее время дороже, чем компьютерная томография и сканирование костей. Однако, если ПЭТ-КТ, нацеленная на ПСМА, получит более широкое распространение, д-р Помпер выразил надежду, что стоимость может снизиться за счет экономии на масштабе, как это произошло с ПЭТ-КТ с ФДГ, которая является наиболее распространенной формой ПЭТ. -КТ используется при раке.
Методы визуализации рака простаты
Рак простаты – вторая по частоте причина смерти от рака среди мужчин в США.Скрининг простаты с помощью пальцевого ректального исследования и специфического для простаты антиген сместил диагноз рака простаты на более низкую степень, ограниченный органом болезнь, усугубляющая чрезмерное выявление и чрезмерное лечение рака простаты. Новый вызов заключается в дифференциации клинически значимых опухолей от опухолей, которые иначе никогда не имели бы становятся очевидными, если бы не скрининг. Быстрая эволюция методов визуализации и синтез анатомических, функциональных и молекулярных данных позволяет улучшить обнаружение и характеристика рака простаты.Однако надлежащее использование изображений затруднено. определить, как много спорных исследований относительно каждой из модальностей и их полезности можно найти в литературе. Паттерны клинической практики медленно внедряли многие из эти достижения в результате. В этом обзоре обсуждаются более устоявшиеся методы визуализации. методы, включая УЗИ, магнитно-резонансную томографию, МР-спектроскопию, Компьютерная томография и позитронно-эмиссионная томография. Мы также рассматриваем несколько перспективные методы на горизонте, в том числе МРТ с динамическим контрастом, Диффузно-взвешенная визуализация, суперпарамагнитные наночастицы и радионуклиды Сцинтиграфия.
1. Введение
Рак простаты – вторая по частоте причина смерти от рака среди мужчин в Соединенных Штатах. Заболеваемость раком простаты относительно постоянна и составляет 165 случаев на 100 000 мужчин. С 1990 г. коэффициент смертности с поправкой на возраст постепенно снизился на 31%, что связано с ранним выявлением и лечением [1]. Скрининг простаты с помощью пальцевого ректального исследования (DRE) и простатоспецифического антигена (PSA) сместил диагноз рака простаты на более низкую степень, ограниченное органом заболевание [2, 3], добавив к чрезмерному выявлению и избыточному лечению рака простаты как минимум на 30%. [4].Недавний обзор Etzioni et al. по оценкам, 10% мужчин с раком простаты низкой степени злокачественности перенесли радикальное хирургическое вмешательство, а 45% – лучевую терапию [5]. С публикацией 10-летних результатов скринингового исследования рака предстательной железы, легких, колоректального рака и яичников (PLCO), демонстрирующих отсутствие снижения смертности при скрининге, новая задача состоит в том, чтобы дифференцировать клинически значимые опухоли от тех, которые в противном случае могли бы никогда не появиться. очевидно, если бы не скрининг [6].
Быстрое развитие методов визуализации позволяет лучше выявлять и определять стадию рака простаты, тем самым направляя соответствующее лечение и последующее наблюдение. Однако трудно определить надлежащее использование визуализации, поскольку в литературе можно найти множество противоречивых исследований, касающихся каждого из методов и их полезности. Здесь мы обсудим более устоявшиеся методы визуализации и рассмотрим несколько перспективных методов на горизонте.
2. Трансректальное УЗИ
2.1. Ультразвук в серой шкале
Трансректальный ультразвук в серой шкале (ТРУЗИ) – это наиболее часто используемый метод оценки простаты, особенно для проведения пункционной биопсии. При подозрении на рак простаты из-за повышенного уровня ПСА или аномального пальцевого ректального исследования (DRE) следующим шагом обычно является систематическая пункционная биопсия, для которой ТРУЗИ является неотъемлемой частью и эффективна для определения контуров простаты в сагиттальной и поперечной плоскостях. Это простой и доступный метод, который может обеспечить довольно точные оценки объема простаты, которые важны для определения плотности ПСА [7].Рак простаты обычно выглядит гипоэхогенным при ТРУЗИ [8], а гипоэхогенные поражения при ТРУЗИ более чем в два раза чаще содержат рак, чем изоэхогенные области [9]. Однако большинство гипоэхогенных поражений, обнаруженных при ТРУЗИ, не являются раком [10]. Более того, до 30% случаев рака простаты являются изоэхогенными [11], а примерно 1% – гиперэхогенными [8]. Сообщается, что положительная прогностическая ценность (PPV) серой шкалы TRUS составляет 52,7%, а отрицательная прогностическая ценность (NPV) составляет 72% с точностью 67% [12]. Таким образом, его полезность при обнаружении и локализации рака простаты несколько ограничена.Тем не менее, этот метод визуализации остается предпочтительным методом визуализации для направленной биопсии простаты, а также для направленной брахтерапии, криотерапии, высокоинтенсивной фокальной ультразвуковой абляции и других местных методов лечения, включая гипертермию, фотодинамическую терапию, противоопухолевые вакцины и генную терапию [13 ].
Значение ТРУЗИТЕ для локального стадирования является спорным, хотя некоторые исследования установлены критерии для различения экстракапсулярного расширения (ECE) на ТРУЗИ, в том числе выпуклого или неправильности капсулы, прилегающей к гипоэхогенному поражению [13], а также длинам контакта поражения с капсулой [14].Многопрофильное исследование показало, что ТРУЗИ не более точна, чем DRE, с целью обнаружения локального распространения опухоли [15], хотя другие ранние отчеты показали повышенную точность, когда результаты ультразвукового исследования были объединены с DRE и уровнем PSA [16]. Другие исследования также обнаружили плохую патологическую корреляцию и неточный прогноз клинической стадии при ТРУЗИ и показали, что неальпируемые опухоли имеют схожие результаты независимо от результатов ТРУЗИ [17, 18]. Однако более недавнее исследование 620 мужчин, которым была проведена ТРУЗИ одним УЗИ до радикальной простатэктомии, показало, что доказательства экстракапсулярного удлинения (ВЭК) с помощью ТРУЗИ коррелируют со значительно более высокой патологической стадией [19].Они обнаружили, что стадирование ТРУЗИ было наиболее значимым прогностическим фактором ЭКЭ по сравнению с установленными факторами риска, такими как степень Глисона и уровень ПСА в сыворотке, и, кроме того, стадия ТРУЗИ, а также другие переменные выполнялись при прогнозировании биохимической неудачи после радикальной простатэктомии. Это исследование было выполнено в одном учреждении одним высококвалифицированным ультразвуковым врачом, и его еще предстоит воспроизвести в других отчетах.
2.2. Ультразвук с контрастным усилением
Интерес к повышению чувствительности ультразвука привел к разработке множества методов, основанных на ультразвуке, но включающих дополнительные технологии.ТРУЗИ с контрастным усилением (CEUS) сочетает в себе ценность традиционного ультразвука в пространственной и временной визуализации простаты с наблюдением, что процесс роста опухоли предстательной железы вызывает неоваскуляризацию [20]. CEUS – это метод измерения сосудистых структур внутри предстательной железы с использованием микропузырьков в качестве контрастного вещества. Газовые капсулы (микропузырьки) размером 1–10 м вводятся в кровоток, а затем визуализируются по мере их прохождения через простату с помощью трансректального ультразвукового зонда.Пузырьки действуют как дополнительные отражатели для увеличения чувствительности цветного и энергетического допплера [21]. Было обнаружено, что отклонения от нормы при CEUS коррелируют с раком при патологическом обследовании [22].
В первые дни CEUS, когда использовалось ультразвуковое исследование с высокой энергией, большинство микропузырьков разрушалось пульсациями, что затрудняло визуализацию микрососудов [23]. В последние годы несколько разработок в этой технологии привели к повышению чувствительности визуализации микропузырьков в микрососудистом русле простаты.Wink et al. недавно оценил результаты нескольких европейских исследований, которые коррелировали данные CEUS и гистологии резекции простаты, и пришел к выводу, что локализация опухоли с помощью CEUS является многообещающим методом. Данные подтверждают использование CEUS для визуализации рака простаты, но чувствительность и специфичность недостаточно высоки, чтобы оправдать прекращение систематической биопсии простаты [21].
Было обнаружено, что использование ультразвука с контрастным усилением для прицельной биопсии позволяет выявлять статистически значимо больше раковых заболеваний с меньшим количеством ядер по сравнению с традиционной биопсией под контролем ультразвука в серой шкале [24].В том же исследовании было обнаружено, что при использовании ультразвука с контрастным усилением вероятность обнаружения рака простаты в 2,6 раза выше, чем при ультразвуковом исследовании в серой шкале. В исследовании, проведенном в Нидерландах [25], изучалась эффективность биопсии предстательной железы, направленной с помощью трехмерного ультразвукового допплеровского ультразвукового исследования (3D-CE-PDU), по сравнению с образцами после радикальной простатэктомии. Было известно, что у всех пациентов в исследовании был рак простаты, и им уже была назначена радикальная простатэктомия. В целом, от 51% до 63% случаев рака простаты были обнаружены с помощью ультразвука с контрастным усилением.Была более высокая чувствительность (68–79%) для обнаружения рака с максимальным диаметром 5 мм. Следует отметить, что исследование обнаружило только 13% экстракапсулярного расширения или инвазии семенных пузырьков, демонстрируя, что 3D-CE-PDU – плохой инструмент для определения стадии.
2.3. Эластография
Другой подход, основанный на ТРУЗИ, – это эластография, которая измеряет жесткость и эластические свойства простаты. Простата сжимается с помощью трансректального зонда, и различия в деформации тканей используются для локализации внутрипростатических поражений.Как и при пальцевом ректальном исследовании, участки с повышенной плотностью более подозрительны на злокачественные новообразования. Pallwein et al. [26] обнаружили чувствительность и специфичность 87% и 92% для выявления очагов рака простаты в исследовании 15 пациентов, которым выполнялась эластография в реальном времени с последующей радикальной простатэктомией. Они обнаружили 28 из 35 опухолевых очагов с наивысшей чувствительностью (100%) для выявления рака на верхушке. В другом исследовании с участием 137 мужчин, которым была сделана прицельная биопсия простаты с эластографией с цветным допплером, отношение шансов равно 1.82, при значительно более высокой вероятности обнаружения рака, чем при биопсии секстанта серой шкалы [27]. Было отмечено более чем двукратное увеличение вероятности злокачественных новообразований в связи с ультразвуковой аномалией; аномальный цветовой поток был связан с показателем Глисона 8–10 (OR 4.12–10.61). Эта ассоциация не была обнаружена в поражениях низшей степени с использованием цветного допплера. Однако аномальные результаты эластографии были связаны со злокачественными новообразованиями для всех степеней опухоли.
В 2008 г. Salomon et al.[28] сообщили о проспективном исследовании 109 мужчин, которым была назначена радикальная простатэктомия и которым была проведена биопсия предстательной железы под контролем эластографии. PPV между подозрительными участками при эластографии и злокачественными участками, обнаруженными при патологическом исследовании после радикальной простатэктомии, составлял 87,8%, а NPV – 59%. Чувствительность и специфичность эластографии при выявлении рака составляли 75,4% и 76,7% соответственно. Специфичность увеличивалась до 80% при диаметре поражения 5 мм.Другое исследование 107 мужчин с уровнем ПСА 4 нг / мл или аномальными показателями пальцевого ректального исследования, которые проходили эластографические исследования, регулярное трансректальное ультразвуковое исследование и ультразвуковую допплерографию, показало, что чувствительность эластографии аналогична чувствительности энергетического допплера (68% против 70%). и выше, чем при обычном УЗИ (50%), со специфичностью 81% [29]. В целом эластография представляется возможным, воспроизводимым инструментом с довольно хорошей чувствительностью для выявления рака простаты. Дальнейшие клинические исследования для уточнения роли эластографии в обнаружении рака простаты и ее использования при проведении биопсии простаты продолжаются.
2.4. Компьютерное УЗИ
Компьютерное УЗИ, также известное как Гистосканирование, позволяет картировать морфологию простаты и идентифицировать злокачественные образования путем характеристики и количественной оценки дезорганизации ткани. Теоретически злокачественное новообразование вызывает дезорганизацию, и компьютерное ультразвуковое исследование обнаружит эти изменения, извлекая эти данные из фоновых ультразвуковых данных. В исследовании 29 пациентов, перенесших радикальную простатэктомию после гистосканирования, была обнаружена тесная корреляция между гистосканированием простаты и патологическими данными.Тест позволял локализовать опухоли и определять их размер в поперечном сечении с довольно хорошей точностью, а также определять мультифокальность, двусторонность и экстрапростатическое расширение. Авторы исследования предполагают, что HistoScanning – это недорогой, неинвазивный тест с разумной точностью, который может помочь в принятии клинических решений при выборе мужчин с высоким уровнем ПСА для прохождения биопсии простаты [30]. Однако дальнейшие исследования, подтверждающие эти данные, отсутствуют.
3.Магнитно-резонансная томография
3.1. Т2-взвешенная магнитно-резонансная томография
Роль стандартной Т2-взвешенной МРТ в диагностике и определении стадии рака простаты все еще развивается и варьируется от центра к центру. Как правило, МРТ имеет довольно хорошую чувствительность, но низкую специфичность [31–33]. Недавний метаанализ исследований корреляции МРТ и гистопатологии показал, что чувствительность обнаружения рака простаты составляет от 37% до 96%, с различиями из-за различных определений рака, исключения рака переходной зоны и критериев, используемых для положительных результатов [34].Специфичность варьировалась от 21% до 67% в этом метаанализе, хотя авторы отмечают, что специфичность трудно оценить из-за присущей этим исследованиям систематической ошибки отбора групп.
Специфичность МРТ снижается из-за ее неспособности отличить низкую интенсивность сигнала Т2, связанного с опухолью, от других патологий, таких как простатит, постбиопсийное кровотечение или изменения в лечении [35]. Как правило, рекомендуется отсрочка от трех до четырех недель между биопсией простаты и МРТ [36, 37], хотя более недавнее исследование рекомендовало отсрочку от шести до восьми недель, когда берется больше образцов биопсии из-за более высокой степени кровотечения [38] ].
Выявление рака простаты в переходной зоне считалось менее эффективным. Исследование Ellis et al. обнаружили, что МРТ пропустила 78 из 79 опухолей передней железы объемом 5 мл, хотя это исследование проводилось без использования эндоректальной МРТ [39]. Другие исследования показали, что МРТ имеет примерно одинаковую точность по всей простате [35], а также что МРТ имеет хорошую чувствительность и специфичность (75% и 87%) при обнаружении рака переходной зоны [40]. Akin et al. [40] предположили, что несколько индикаторов рака переходной зоны включают однородный низкий сигнал, линзовидную форму и инвазию передней фиброзно-мышечной стромы.
3.1.1. Скрининг
Было предложено и изучено множество возможных применений МРТ. Некоторые утверждают, что это может способствовать процессу проверки. У пациентов с положительным результатом скринингового теста на ПСА, но отрицательным результатом биопсии, отрицательный результат МРТ может устранить необходимость в повторной биопсии за счет увеличения NPV отрицательной биопсии простаты. В скрининговой популяции из 92 пациентов Comet-Batlle et al. продемонстрировал NPV для рака при последующей трансректальной биопсии 91% [41], что сравнимо с 85% NPV при биопсии с отрицательным октантом [42].Cheikh et al. сообщили о чувствительности 82,6% и 100% NPV Т2-взвешенной МРТ или МРТ с динамическим контрастированием при оценке видимых подозрительных областей перед повторной иглой биопсии простаты ТРУЗИ [43]. Beyersdroff et al. изучили популяцию из 44 мужчин, у которых был повышенный уровень ПСА, но отрицательная исходная биопсия, и обнаружили, что при ретроспективном анализе МРТ после повторной биопсии результаты МРТ не коррелировали с результатами биопсии [31]. По мнению авторов, это подтвердило, что МРТ имеет довольно низкую специфичность и подвержена ошибкам из-за простатита, фиброза или интраэпителиальной неоплазии.Широкое использование МРТ в целях скрининга не было реализовано, несмотря на несколько многообещающих исследований, в основном из-за высокой стоимости, хотя ее использование у отдельных пациентов может быть оправдано после отрицательных результатов биопсии простаты.
3.1.2. Биопсия простаты под контролем МРТ
Было также предложено использовать МРТ для проведения биопсии простаты, и в настоящее время она исследуется и разрабатывается. Beyersdroff et al. опубликовали отчеты об успешной биопсии простаты под контролем МРТ, отметив, что метод отнимает много времени, требует специального оборудования и очень чувствителен к движению простаты во время биопсии [44].Несколько групп экспериментируют с устройствами для позиционирования иглы и роботизированными манипуляторами для облегчения биопсии под контролем МРТ [45]. Однако рутинное использование МРТ для проведения биопсии простаты не рекомендуется при наличии имеющихся доказательств из-за дороговизны и трудоемкости; хотя при дальнейшем развитии и опыте могут быть показания для биопсии под контролем МРТ у пациентов с предыдущими отрицательными биопсиями под контролем ТРУЗИ.
3.1.3. Предоперационная оценка
Недавно МРТ была оценена на предмет ее полезности в предоперационной оценке перед простатэктомией.Hricak et al. обнаружили, что, просматривая предоперационные эндоректальные МРТ-изображения, хирурги могли более точно решить, сохранять ли сосудисто-нервный пучок во время операции [46]. 135 пациентов были обследованы с помощью МРТ до операции и оценены хирургом и радиологом, а затем сопоставлены с клинической оценкой хирурга во время операции и гистопатологическими данными. Они обнаружили, что, когда хирург решил пощадить NVB, МРТ подтвердила это решение в 84% случаев и было правильным в 96% случаев.Результаты МРТ изменили план хирургического вмешательства у 78% пациентов из группы высокого риска (75% риск ECE по таблицам Партина) и оказались правильными в 93% случаев. Эти результаты были подтверждены недавним исследованием 75 пациентов из Скандинавии, которое показало чувствительность 92% и специфичность 100% для выявления вовлечения ECE / NVB с помощью предоперационной МРТ [47]. Результаты МРТ свидетельствуют в пользу сохранения NVB у 67% пациентов с высокой клинической вероятностью ECE и против сохранения NVB у 33% пациентов с низкой вероятностью и были правильными в 100% случаев.Другая серия исследований показала, что выступление апикальных перипростатических вен на предоперационной эндоректальной МРТ было значительно связано с интраоперационной кровопотерей [48]. Эти исследования поддерживают использование МРТ для предоперационной оценки пациентов, особенно в отношении решения о сохранении или резекции сосудисто-нервных пучков.
3.1.4. Стадия
Благодаря многочисленным достижениям в области технологий, МРТ в настоящее время рассматривается многими как наиболее точный метод визуализации для определения стадии рака простаты, включая метастазы в тазовые лимфатические узлы и тазовые костные метастазы [49–53], хотя исследования показали, что существуют значительные вариабельность использования МРТ для выявления рака простаты внутри наблюдателя [54].Несколько ранних исследований показали, что чувствительность МРТ к обнаружению экстракапсулярного расширения была ограниченной [55–57]; однако развитие технологий повысило точность локальной постановки. Было показано, что использование катушек с фазированной решеткой для эндоректального отдела тела, в отличие от катушек с фазовой решеткой туловища, обеспечивает превосходную точность постановки [58]. Этот метод улучшает пространственное разрешение и отношение сигнал / шум МРТ простаты [31]. Было обнаружено, что эндоректальная МРТ имеет высокую отрицательную и положительную прогностическую ценность, а также хорошую точность при прогнозировании экстракапсулярной инвазии [58, 59].Было проведено два метаанализа точности стадирования с помощью эндоректальной МРТ с разными результатами; один обнаружил, что эндоректальная МРТ улучшила стадию [60], тогда как другой обнаружил обратное [61].
Другие недавние разработки улучшили точность T2-взвешенной МРТ при локальном этапе, включая более быстрые последовательности изображений, постобработку коррекции изображения и более мощные катушки [58, 62, 63]. Использование локализации персекстанта – еще одна разработка в технологии МРТ, которая позволила более эффективно передавать данные [35, 64].Теоретически эндоректальная катушка 3Tesla должна обеспечивать улучшенное соотношение сигнал / шум и улучшать качество изображения, и в нескольких ранних отчетах действительно сообщается о значительном улучшении стадийности с чувствительностью 73–88% и специфичностью 96–100% [65, 66] . Однако эта технология не является широко доступной, и для ее широкого внедрения необходимы дополнительные исследования.
Несмотря на эти технологические достижения, использование МРТ для определения стадии рака простаты все еще вызывает споры, и его использование в различных учреждениях все еще развивается.Несколько исследований были сосредоточены на полезности МРТ для различных групп риска в попытке решить вопрос о том, какой группе пациентов следует пройти предоперационную МРТ для определения стадии. Было обнаружено, что включение МРТ в клинические номограммы увеличивает прогноз локального распространения опухоли во всех группах риска [67]. Engelbrecht et al. предположили, что пациентам с промежуточным риском развития стадии Т3, прогнозируемым на основе ПСА 4–20 нг / мл и баллов по шкале Глисона от 5 до 7, рекомендуется МРТ, поскольку решение о лечении может зависеть от результатов визуализации [ 68].Другая группа обнаружила, что 26% пациентов с низким риском, с ПСА 10 нг / мл и Глисоном 2-7 или ПСА 10,1-20 нг / мл и Глисоном 2-5, имели гистопатологические доказательства ECE или SVI, обнаруженные на МРТ до операции. [63], что может указывать на оправданность рутинной МРТ и в этой группе. Более того, Американская объединенная комиссия по раку в настоящее время рекомендует КТ или МРТ в группе высокого риска с ПСА 20 или Глисона 7-8 [69].
Те, кто возражает против его рутинного использования при предоперационной оценке, ссылаются на его дороговизну и сомнительную полезность.D’Amico et al. предположили, что, хотя МРТ действительно увеличивает прогноз биохимической неудачи у значительного числа пациентов, высокая стоимость рутинного использования МРТ не оправдана в свете сомнительного влияния на сокращение количества ненужных операций [70]. Другое исследование May et al. оценка способности эндоректальной МРТ выявлять и определять стадию рака простаты пришла к выводу, что из-за низкой чувствительности и специфичности, высокой вариабельности внутри наблюдателя и тенденции к изменению стадии рака результаты МРТ не должны приводить к изменению решения о лечении [71].
3.2. Магнитно-резонансная спектроскопическая визуализация
Рост опухоли предстательной железы связан с повышенным обновлением клеточной мембраны и увеличением клеточной пролиферации, что приводит к изменению относительных концентраций определенных метаболитов, включая креатин, холин и цитрат, в частности, к увеличению холина и снижению цитрата. Магнитно-резонансная спектроскопия (MRSI) – это технология, которая увеличивает чувствительность и специфичность МРТ, анализируя этот метаболический профиль дискретных вокселов в простате [72, 73].В крупнейшем исследовании Wefer et al., Сравнивающем MRSI и MRI, было обнаружено, что один MRSI имел более высокую чувствительность (76%), чем T2-взвешенную МРТ (67%), но более низкую специфичность. Однако это и другие исследования показали, что точность диагностики рака простаты наиболее высока, когда анатомическая информация из МРТ и метаболическая информация из MRSI объединены [35, 72, 74]. Другое исследование объединило данные МРТ / MRSI с клиническими и патологическими данными и обнаружило, что комбинированная модель превосходит чисто клинические модели в прогнозировании вероятности незначительного рака простаты [75].
Совсем недавно в нескольких исследованиях анализировалось влияние добавления данных МРТ / MRSI к промежуточным нормограммам. В исследовании 229 пациентов, которым проводилась МРТ, и 383 пациентов, которым проводилась комбинированная МРТ / МРС перед радикальной простатэктомией, рентгенологические данные внесли значительный вклад в стандартную нормограмму для прогнозирования заболевания, ограниченного простатой [67].
Спектроскопия имеет ряд других преимуществ перед традиционной МРТ. Сообщается, что способность MRSI обнаруживать опухоли переходной зоны составляет 80%, что значительно выше, чем у T2-взвешенной МРТ [40].Coakley et al. [76] исследовали способность MRSI оценивать объем рака простаты и обнаружили повышение точности измерений объема при добавлении спектроскопии к МРТ. Yu et al. также продемонстрировали, что использование спектроскопической визуализации снижает вариабельность между наблюдателями, а для менее опытных радиологов улучшает обнаружение ЭКЭ [49].
Недавнее мультиинституциональное исследование 134 мужчин с подтвержденным биопсией раком простаты, перенесших комбинированный MRSI / MRI, дало несколько разочаровывающие результаты [77].По сравнению с эндоректальной МРТ комбинированная МРЗИ / МРТ не показала очевидных преимуществ. Это исследование было специально проведено с участием неопытных операторов и было сосредоточено на пациентах из группы низкого риска с небольшим бременем болезни, представляющих обследованную американскую популяцию.
3.2.1. Агрессивность опухоли
MRSI имеет потенциал как неинвазивный метод оценки агрессивности опухоли, так как он имеет более высокую чувствительность при обнаружении рака более высокой степени [78]. Закиан и др. изучили взаимосвязь между степенью Глисона как мерой агрессивности опухоли и объемными и метаболическими данными MRSI и обнаружили, что соотношение креатин плюс холин к цитрату, которое, как известно, положительно коррелирует с раком простаты, может предсказать агрессивность опухоли.Это исследование также показало, что MRSI выявляет только 44% опухолей Глисона 3 3 по сравнению с 90% опухолей Глисона 7. Таким образом, спектроскопическая информация может способствовать процессу принятия решений, предоставляя информацию об агрессивности опухоли.
3.2.2. Дополнительные области применения
Было предложено дополнительное использование MRSI при раке простаты, включая добавление биопсий в качестве метода выявления как первичного, так и рецидивирующего рака [34, 35], а также в качестве инструмента для проведения биопсии [79, 80]. Из-за более высокой чувствительности MRSI при обнаружении рака, чем биопсия секстанта, особенно когда она локализована на верхушке, где биопсия не может быть взята [35], это может быть адекватным методом наблюдения за пациентами, прошедшими абляционную терапию.Одно исследование показало, что MRSI обнаружил все рецидивирующие очаги опухоли у 25 пациентов, подвергшихся криотерапии по поводу рака простаты [81]. Другое исследование 9 пациентов с рецидивирующим раком простаты после дистанционной лучевой терапии показало, что MRSI и MRI превосходят биопсию при обнаружении рецидива заболевания с чувствительностью 77% и 68% соответственно [79]. Однако они также обнаружили, что специфичность MRSI (78%) была значительно ниже, чем у обычной МРТ, DRE или биопсии секстанта, что было приписано пострадиационным метаболическим изменениям в нормальной простате.Авторы предположили, что MRSI можно использовать в качестве дополнения к другим методам выявления рецидива рака, для проведения биопсии или для руководства лечением путем определения локализации опухоли [79].
3.3. МРТ с динамическим контрастом
МРТ с динамическим контрастом (DCE-MRI) измеряет васкуляризацию ткани предстательной железы, используя временные различия в поглощении внутривенно введенного низкомолекулярного контраста, чтобы отличить доброкачественную ткань от опухоли. Повышенная плотность микрососудов наблюдается при ДГПЖ, интраэпителиальной неоплазии предстательной железы и раке простаты [82], и было обнаружено, что она коррелирует со специфической выживаемостью и прогрессированием заболевания после лечения [83].Некоторые микрососудистые особенности являются характеристиками рака простаты, включая гетерогенную структуру, артериовенозное шунтирование, извилистость сосудов, прерывистый кровоток, высокую проницаемость и плохо сформированные сосуды [82]. Используя различные MR-последовательности, особенно T1-взвешивание [84], эти характеристики можно визуализировать и количественно оценить.
Использование DCE-MRI для первичного обнаружения, локализации и определения стадии рака простаты было изучено несколькими группами с многообещающими результатами. Jager et al.первоначально было обнаружено, что использование DCE-MRI увеличило чувствительность для обнаружения простаты с 57% с T2-взвешенной МРТ до 73% без изменения специфичности [85]. Они также отметили, что DCE-MRI может улучшить чувствительность для обнаружения ECE, и что эта технология может улучшить оценку объема опухоли. Другие исследования подтвердили, что DCE значительно повышает чувствительность выявления рака простаты по сравнению с другими методами [86–89] и что он достаточно точен при обнаружении ECE [90, 91]. Недавнее проспективное исследование показало, что DCE-MRI имеет более высокую точность локализации, чем T2-взвешенная MRI или MRSI как в центральных, так и в периферических железах [92].По сравнению с трансректальным ультразвуковым методом Power-Dopper, DCE-MRI оказалась значительно более чувствительной для выявления рака в периферической зоне [89]. Намимото и др. подтвердил, что DCE-MRI полезен для дифференциации поражений периферической зоны, а также обнаружил более высокую диагностическую точность, когда результаты динамической MR были объединены с постконтрастными T1-взвешенными изображениями [93]. Другие предлагаемые варианты использования DCE-MRI, которые включают обнаружение рецидива и последующее наблюдение после абляционной терапии или андрогенной депривации [82].
DCE может прогнозировать патологическую степень рака простаты, учитывая, что плотность микрососудов коррелирует с оценкой Глисона [94, 95]. Schlemmer et al. отметили, что время до начала кривой улучшения значительно отличалось в опухолях высокой степени злокачественности по сравнению с опухолями низкой степени злокачественности [86]. Другое исследование с использованием патологических образцов для корреляции не обнаружило корреляции между временем улучшения и патологической степенью [96].
Ким и Парк предположили, что DCE-MRI может принести огромную пользу из-за появления и введения 3 Тесла из-за повышенного отношения сигнал / шум и из-за свойств T1 ткани простаты [97].Раннее исследование показало, что при 3 Тесла DCE-MRI имеет более высокую точность и чувствительность, хотя и более низкую специфичность, чем T2-взвешенное воображение, и пришел к выводу, что DCE-MRI может быть более полезен для диагностики и предоперационного определения стадии [51]. Fütterer et al. обнаружили, что DCE-MRI при 3 тесла превосходит 1,5 тесла в отношении определения рака простаты, экстракапсулярного расширения и визуализации периферической зоны и центральной зоны [98]. Они обнаружили, что общая точность постановки составляет 83% при 1,5 Тесла и 100% при 3 Тесла.
Очевидно, что необходимы дополнительные исследования для определения роли DCE-MRI в оценке рака простаты. Основные ограничения этой технологии включают невозможность дифференцировать простатит и рак простаты в периферической зоне и между аденомой простаты и раком в центральной зоне [99]. Имея текущие данные, было предложено использовать DCE-MRI в сочетании с T2-взвешенной МРТ, MRSI и DWI как часть оценки вероятности рака, для определения целевой повторной биопсии [82] и для определения предоперационной стадии пациентов с рак простаты [51, 91].
3.4. Диффузионно-взвешенная визуализация MRI
Диффузионно-взвешенная визуализация (DWI) – это метод получения молекулярной и клеточной информации о простате, в частности о движении и функциональной среде воды в ткани простаты. Измеряя микродиффузию воды во внутриклеточном и внеклеточном пространствах, DWI может рассчитать кажущийся коэффициент диффузии, который отражает сдвиги компартментов в воде, проницаемость мембраны и плотность клеток, все из которых могут быть изменены в раковой ткани [100].Рак простаты имеет более низкий кажущийся коэффициент диффузии, чем нормальная ткань простаты, как в периферической зоне [101], так и в переходной зоне [102], что указывает на уменьшение потока или диффузии воды. Это связано, прежде всего, с увеличением клеточности в этой ткани [101, 102].
В нескольких исследованиях анализировалась ценность добавления DWI к T2-взвешенной МРТ и MRSI, и в целом были обнаружены повышенная чувствительность (54–98%) и специфичность (58–100%) [100, 103, 104].Kim et al. недавно было обнаружено, что комбинированный DWI / T2WI более чувствителен для прогнозирования рецидива рака после лучевой терапии, чем только T2WI [105]. Также было обнаружено, что DWI повышает точность измерения объема опухоли в периферической зоне [106]. Park et al. недавно сообщалось, что DWI может быть полезен при оценке пациентов с постоянно повышенным уровнем ПСА, но отрицательными результатами биопсии простаты, поскольку он более чувствителен, чем Т2-взвешенная МРТ при локализации очагов поражения [107].
Основные ограничения этой технологии включают существенное перекрытие значений ADC между злокачественной тканью и нормальной предстательной железой и предельное отношение сигнал / шум [105].Современные системы МРТ 3Tesla исследуются на предмет их полезности для увеличения отношения сигнал / шум для DWI. Ранние исследования с использованием этой технологии показали высокую чувствительность (94%) и специфичность (91%) в периферической зоне, а также такую же высокую чувствительность (90%) и специфичность (84%) в переходной зоне [108]. Будущие исследования дополнительно прояснят роль DWI в диагностике и определении стадии рака простаты, хотя предварительные исследования очень многообещающие.
3.5. Суперпарамагнитные наночастицы
Другая технология на основе МРТ, которая в настоящее время активно исследуется, – это использование лимфотропных суперпарамагнитных наночастиц в качестве контрастного вещества для обнаружения небольших и не поддающихся обнаружению узловых метастазов.Этот материал вводится внутривенно и поглощается макрофагами в нормальных лимфатических узлах, создавая контраст между этими узлами и злокачественными узлами, в которых макрофаги заменены опухолевыми клетками [109]. Эта технология не зависит от размера или формы лимфатического узла, критериев, на которых основывается традиционная рентгенографическая стадия, и поэтому предполагается, что она более точна при обнаружении метастазов, особенно в узлах нормального размера. Было доказано, что он эффективен при некоторых других формах рака [109].Исследования его использования при раке простаты продолжаются. Harisinghani et al. обнаружили, что МРТ с усилением лимфотропных наночастиц (LNMRI) может обнаруживать метастазы в небольших лимфатических узлах, которые могут считаться доброкачественными на КТ или неусиленной МРТ, и что метастатические узлы были обнаружены вне классической области лимфодиссекции у значительного числа пациентов [ 110]. В этом исследовании оценивали 80 пациентов с LNMRI до тазовой лимфадэктомии или диагностики метастазов с помощью CT, и было обнаружено, что добавление суперпарамагнитных наночастиц увеличивало чувствительность MRI с 45.От 4% до 100% со специфичностью 95,7%. Было высказано предположение, что эта технология может быть особенно полезной для пациентов с высоким риском метастатического заболевания на основе стандартных номограмм стадирования и традиционной МРТ, которые предлагают довольно высокие отрицательные прогностические значения для обнаружения метастатического заболевания [13]. .
Эта технология также может быть полезна при обнаружении рецидивирующего рака, а также при проведении таргетной лучевой терапии. Недавнее исследование показало, что у 26 пациентов с рецидивирующим раком простаты после радикальной простатэктомии, все из которых были кандидатами на спасительную лучевую терапию, LNMRI выявила положительные узлы у 6 пациентов, ни у одного из которых не было увеличенных узлов при осевой визуализации [111].Прежде чем эта многообещающая, но экспериментальная технология получит широкое распространение, необходимы дальнейшие исследования.
4. Компьютерная томография
В настоящее время КТ играет очень небольшую роль в диагностике рака простаты или в определении стадии известных видов рака у пациентов с низким клиническим подозрением на метастатическое заболевание [13]. КТ обнаруживает метастазы в лимфоузлы на основе размера, и в целом КТ имеет очень низкую диагностическую ценность у пациентов с низким риском из-за низкой частоты крупных метастазов в лимфоузлы у этих пациентов.Основная роль КТ при раке простаты заключается в определении стадии у пациентов с подозрением на метастатическое заболевание, чувствительность и специфичность которого варьируется [112, 113]. О’Дауд и др. [114] рекомендуют проводить КТ у пациентов из группы высокого риска с уровнем ПСА 20 нг / мл, 7 баллами по шкале Глисона или, по крайней мере, клинической стадией Т3. Сообщается, что для целей обнаружения метастазов в тазовые лимфатические узлы чувствительность составляет от 25% [115] до 85% [116], но обычно составляет около 36% [117], что недостаточно точно, чтобы оправдать широкое использование, за исключением отдельных Пациенты из группы высокого риска.Точно так же для диагностики метастазов в кости КТ уступает другим методам, таким как сканирование костей и МРТ, и не должна широко использоваться [13].
5. Позитронно-эмиссионная томография
Теория, лежащая в основе позитронно-эмиссионной томографии (ПЭТ), заключается в том, что рак простаты, имеющий высокую скорость метаболизма, потребляет глюкозу через гликолитический путь, что связано с более высоким потреблением глюкозы. ПЭТ использует радиоактивно меченый аналог глюкозы, обычно фтордезоксиглюкозу (ФДГ), в качестве индикатора для измерения скорости метаболизма ткани и пытается идентифицировать раковые поражения на основе их повышенного метаболизма.Несмотря на первоначальный энтузиазм по поводу ПЭТ как метода диагностики рака простаты, исследования показали посредственные результаты с субоптимальной чувствительностью [118, 119]. Effert et al. обнаружили, что они не смогли различить первичный рак простаты и доброкачественную гипертрофию простаты с помощью ПЭТ с ФДГ [120], поскольку оба демонстрируют повышенный метаболизм. Считается, что это происходит из-за более низкой скорости роста и, следовательно, более низкого уровня поглощения радиоактивных индикаторов раком простаты, чем другим раком в организме, для которого было обнаружено, что ПЭТ более полезен [121].Более того, поскольку ФДГ выводится почками, он имеет тенденцию накапливаться в мочевом пузыре и простатическом уретре, таким образом маскируя поглощение простатой [121]. Даже когда это компенсировалось диурезом фуросемидом перед ПЭТ [122] или постоянным орошением мочевого пузыря, чувствительности было недостаточно для надежного выявления рака простаты или метастазов в лимфатические узлы [123].
Исследуются другие радиоактивные индикаторы с другими свойствами. В нескольких исследованиях использовались 11 углеродных и 18 фторидных агентов, включая 11 углерод-метионин, 18 F-фторхолин, 11 углерод-холин и 11 углерод-ацетат в качестве индикаторов. для выявления рака простаты.Эти индикаторы представляют собой радиоактивно меченные аминокислоты, которые концентрируются в поражениях с высокой скоростью синтеза белка и теоретически могут использоваться для выявления раковых поражений. Они используются в диагностике многих различных видов рака с хорошей клинической базой и проходят дальнейшие испытания для использования в первичной диагностике рака простаты, но на данный момент их применение ограничено из-за недостаточной точности [72, 124–126]. Более того, из-за быстрого распада углерода 11 использование этих агентов требует локального циклотрона, что ограничивает его широкую доступность.
Несколько исследований оценивали использование ПЭТ для определения стадии рака простаты. Скьявина и др. [127] обнаружили, что ПЭТ с 11 С-холином лучше, чем клинические номограммы для прогнозирования метастазов в лимфоузлы, с чувствительностью и специфичностью 60% и 98%. Результаты исследования Husarik et al. [128] обнаружили более обескураживающую точность стадирования при ПЭТ 18 F-FCH, при этом только один из пяти гистопатологически подтвержденных метастатических лимфатических узлов обнаружен с помощью изображений.
Наиболее многообещающие результаты ПЭТ / КТ получены в области выявления рецидивов заболевания после первичной терапии рака простаты [129].Риннаб и др. сначала обнаружили, что 11 C-холин был полезен для целенаправленной диссекции лимфатических узлов после лечения рака простаты [130], а затем, совсем недавно, 11 C-холин имеет высокую чувствительность (93%) и PPV (80%). ) для выявления местного рецидива или отдаленных метастазов [131]. Это недавнее исследование подтвердило результаты нескольких предыдущих исследований [132, 133] о том, что ПЭТ / КТ с использованием 11 С-холина может быть полезным подходом для выявления и локализации рецидивирующего заболевания, но также показало, что интегрированные системы ПЭТ / КТ могут быть полезными. особенно полезно при низком уровне ПСА.
Будущее ПЭТ / КТ в области рака простаты светлое, с множеством разработок на горизонте, от новых индикаторов и технологий до новых методов чтения. Ли и др. недавно сообщил, что использование отношения значений поглощения между тканью и мышцами предстательной железы в качестве первичного измерения, 11 ПЭТ с C-холином достигло чувствительности и специфичности 90% и 86%, что может быть осуществимым методом дифференциации доброкачественных поражений простаты от злокачественных . Нуньес предложил комбинированное использование ФДГ и 11 С-метионина на основе временного каскада метаболической активности с повышенным поглощением 11 С-метионина на ранних стадиях рака с последующим относительно более высоким поглощением ФДГ на более поздних стадиях. стадии рака [134].Другая группа недавно сообщила о комбинированном применении 11 C-холина и ФДГ для выявления рака после биохимического рецидива и сообщила о чувствительности 80% при использовании порогового значения ПСА 1,9 нг / мл [135]. Hricak et al. предположил, что новые итеративные методы реконструкции воображения помогут уменьшить количество артефактов [13]. Несколько групп также изучают новые радиоактивные индикаторы, которые включают антитела, нацеленные на молекулы, такие как простатоспецифический мембранный антиген, что может значительно повысить специфичность ПЭТ / КТ [136, 137].
6. Радионуклидная сцинтиграфия
Простасцинт – это иммуноцинтиграфический метод диагностики, использующий [111] индий-капромаб пендетид, мышиное моноклональное антитело, меченное радиоактивной меткой, которое реагирует с простатоспецифическим мембранным антигеном (PSMA), гликопротеином, экспрессируемым тканью простаты. Изображения получены с помощью гамма-камеры SPECT. Он был одобрен FDA в 1996 г. для выявления рецидивирующего рака простаты в мягких тканях [138] с зарегистрированной чувствительностью и специфичностью 62% и 72% [139].Зельцер и др. сравнивали спиральную КТ, ПЭТ и Простасцинт для оценки метастазов в лимфатические узлы у пациентов с рецидивом ПСА. Они обнаружили, что Простасцинт имел более низкий уровень выявления метастазов, чем КТ или ПЭТ [140]. Nagda et al. [141] выполнили ретроспективный обзор 58 пациентов, у которых после простатэктомии наблюдалось повышение уровня ПСА, но отрицательные результаты компьютерной томографии, и им было выполнено сканирование с пендетидом капромаба. PPV при выявлении заболевания вне предстательной железы составлял 27%. PPV для выявления рецидива ямки простаты составлял 50%.Было обнаружено, что статус сканирования не является предиктором ухудшения выживаемости без биохимических рецидивов, что указывает на то, что решения о адъювантной лучевой терапии при биохимическом рецидиве не должны основываться только на результатах исследования капромаба. Другое исследование Koontz et al. аналогичным образом не было обнаружено различий в выживаемости без прогрессирования у пациентов с биохимическими рецидивами в зависимости от результатов сканирования капромаба. Основным ограничением этой технологии является то, что антитело нацелено на эпитоп, который подвергается воздействию только мертвых или умирающих раковых клеток, что, таким образом, ограничивает его чувствительность [142, 143].


 3238 / PersOnko.2018.11.23.01, Шлеммер, Хайнц-Петер
3238 / PersOnko.2018.11.23.01, Шлеммер, Хайнц-Петер