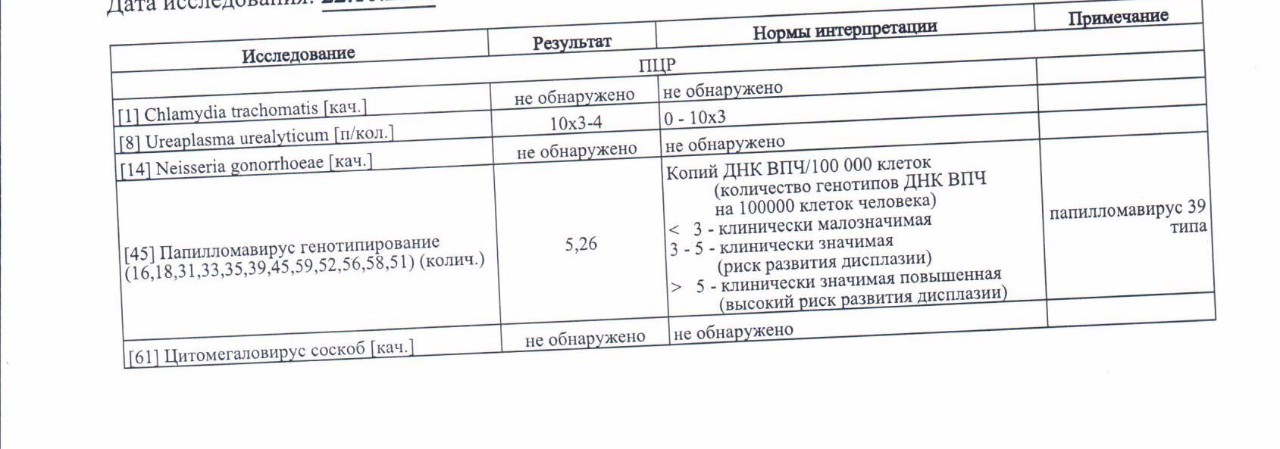
ПЦР-диагностика папилломавирусной инфекции 16,18 тип (количественно)
Выявление ДНК Human Papillomavirus 16/18 в образце, позволяющее обнаружить даже минимальную концентрацию вируса.
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Мазок из зева (ротоглотки), мазок урогенитальный, ректальный мазок, соскоб урогенитальный (ПЦР).
Как правильно подготовиться к исследованию?
- За 3-4 часа до взятия мазков из ротоглотки (зева) не употреблять пищу, не пить, не чистить зубы, не полоскать рот/горло, не жевать жевательную резинку, не курить. За 3-4 часа до взятия мазков из носа не закапывать капли/спреи и не промывать нос. Взятие мазков оптимально выполнять утром, сразу после ночного сна.
- Женщинам взятие урогенитального мазка рекомендуется производить до менструации или через 2 дня после её окончания.
- Мужчинам не мочиться в течение 3 часов до взятия урогенитального мазка.

Общая информация об исследовании
Вирус папилломы человека (ВПЧ) представляет собой совокупность около 100 родственных вирусов. Одни виды вызывают кожные бородавки, а другие могут быть причиной венерических заболеваний (ЗППП) и кондилом.
Генитальный ВПЧ является одним из наиболее распространенных венерических заболеваний в мире.
Инкубационный период может длиться от 2 месяцев до 2-10 лет.
Характерно скрытое течение заболевания, при котором отсутствуют клинические проявления, а при кольпоскопическом, цитологическом и гистологическом обследовании выявляется норма. В 30 % случаев в течение 6-12 месяцев может произойти избавление от вируса.
Чаще всего встречается у молодых женщин и мужчин, при этом основной путь распространения – оральный, анальный или вагинальный секс. Хотя большинство вирусов из этой группы не очень опасны для здоровья, есть, однако, несколько типов папилломы (например, ВПЧ-16, 18), которые могут быть опасны для здоровья.
Диагностика скрытой ВПЧ-инфекции осуществляется только методом ПЦР. Он позволяет найти ДНК ВПЧ в исследуемом биоматериале. Принцип метода основан на амплификации (многократном увеличении числа копий) специфичного для данного возбудителя участка ДНК.
Для чего используется исследование?
- В качестве способа определения риска рака шейки матки (для диагностики самого рака шейки матки используется цитологическое исследование , когда выявляются атипичные клетки эпителия, которые могут быть вестником развития рака шейки матки).

Когда назначается исследование?
Женщинам в возрасте от 30 лет, которые подвержены риску заражения ВПЧ, а также женщинам от 21 года, находящимся в группе риска по заражению ВПЧ и имеющим цитологически выявленные атипичные плоские клетки неясного значения (положительный ASC-US тест).
Могут тестироваться и мужчины, подверженные риску заражения ВПЧ.
Что означают результаты?
Референсные значения:
ДНК ВПЧ 16 типа, Ig – не обнаружено.
ДНК ВПЧ 18 типа, Ig – не обнаружено.
При выявлении ДНК вируса указывается количество и дается интерпретация вирусной нагрузки (клинически значимая/незначимая).
Положительный результат указывает на наличие генетического материала ВПЧ 16-го и 18-го типа в исследуемом образце.
Отсутствие генетического материала ВПЧ 16-го и 18-го типа в исследуемом образце означает, что наличие ВПЧ-инфекции маловероятно.
Если мазок показал цитологические изменения, а результат ПЦР отрицательный, то требуется дальнейший мониторинг, так же как и в случае отрицательного цитологического исследования и положительного ПЦР-теста.
Вопрос: Виктория Романова | 11 Марта, 2021
Сегодня пришёл смс с кодом о результате анализа на антитела, по ссылке забиваю данные и код-пишет:ваш результат не найден
Здравствуйте. Возможно, имеет место технический сбой. Если пришло СМС – значит, результат готов. Печатную версию Вы можете получить в нашем филиале, расположенном по адресу 15 микр дом 8а или позвонить по телефону 517-703 и специалисты call -центра продублируют результат на электронную почту
Вопрос: Наталья | 11 Марта, 2021
Скажите пожалуйста. Если при сдаче анализа на гепатит С показатель 70.9. это положительный результат?
Здравствуйте, да
сдать анализ на 14 типов (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 типы), цены на мазок ПЦР в Москве в ИНВИТРО
Метод определения
ПЦР с детекцией в режиме «реального времени».
Исследуемый материал Соскоб эпителиальных клеток урогенитального тракта
Доступен выезд на домСуммарное выявление ДНК вируса папилломы человека 14 типов высокого онкогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68) в соскобе эпителиальных клеток урогенитального тракта методом ПЦР с детекцией в режиме «реального времени».
Вирус папилломы человека (ВПЧ, Human papillomavirus, HPV) относится к малым ДНК-содержащим вирусам, которые инфицируют эпителиальные клетки и индуцируют пролиферативные поражения кожи и слизистых оболочек. В настоящее время известно около ста типов ВПЧ с различным онкогенным потенциалом, которые условно объединяют в группы высокого и низкого онкогенного риска. Более 90% всех цервикальных карцином позитивны к присутствию ВПЧ. Наиболее часто в биоматериале из опухолей шейки матки обнаруживают 16-й и 18-й типы. Выявление ДНК ВПЧ не подтверждает наличие злокачественного процесса, в большинстве (до 90%) случаев в течение 12-36 месяцев происходит элиминация вируса и самоизлечение. При длительной хронической персистенции вируса и в зависимости от его типа повышается риск развития онкологического процесса. Диагностика заболевания требует дополнительного цитологического, гистологического исследования и динамического наблюдения.
Более 90% всех цервикальных карцином позитивны к присутствию ВПЧ. Наиболее часто в биоматериале из опухолей шейки матки обнаруживают 16-й и 18-й типы. Выявление ДНК ВПЧ не подтверждает наличие злокачественного процесса, в большинстве (до 90%) случаев в течение 12-36 месяцев происходит элиминация вируса и самоизлечение. При длительной хронической персистенции вируса и в зависимости от его типа повышается риск развития онкологического процесса. Диагностика заболевания требует дополнительного цитологического, гистологического исследования и динамического наблюдения.
Поскольку ВПЧ инфицирует эпителиальные клетки, необходимым условием получения достоверного результата является соблюдение техники взятия соскоба. В состав тестов по диагностике и мониторингу ВПЧ введен специальный параметр – контроль взятия материала (КВМ). КВМ – это тест по определению количества геномной ДНК человека в биоматериале, источником которой служат эпителиальные клетки, попавшие в пробу.
Аналитические показатели:
- определяемый фрагмент – специфичные участки ДНК ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 типов;
- специфичность определения – 100%;
- чувствительность определения – 100 копий ДНК ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 типов в образце.

Литература
- Профилактика рака шейки матки: Руководство для врачей. – М.: Изд. «МЕДпресс-информ». 2008:41.
- Заболевания шейки матки и генитальные инфекции. Под ред. проф. В.Н. Прилепской. – М.: Изд. «ГЭОТАР-Медиа». 2016:384.
- Папилломавирусная инфекция. Пособие для врачей. Под ред. проф. д.б.н. В.М. Говоруна. 2009:55.
- Bekkers R., Meijer C., et al. Effects of HPV detection in population-based screening programmers for cervical cancer: a Dutch moment. Gynecologic oncology. 2006;100(3):451-454.
- Khan M. et al. The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type specific HPV testing in clinical practice. Journal of the National Cancer Institute. 2005; 97:1072-1079.
- Snijders J., Meijer C. The value of viral load in HPV detection in screening.
 HPVtoday. 2006;8:8-9.
HPVtoday. 2006;8:8-9.
ДНК папилломавирусов (Human Papillomavirus, ВПЧ), СКРИНИНГ РАСШИРЕННЫЙ с определением 14 типов (Контроль взятия материала, типы 6, 11, 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59), количественный, с пересчетом на у.е. Hybrid Capture по каждому типу
Вирус папилломы человека (ВПЧ) – широко распространенная инфекция, поражающая эпителий кожи и слизистых оболочек. Известно более 100 различных типов вируса папилломы. Вирус папилломы человека может стать причиной появления бородавок, папиллом и кондилом. ВПЧ передается при тесном контакте, поэтому основные пути заражения – половой и контактно-бытовой. Возможна передача ВПЧ от инфицированной матери к плоду. Человек может быть инфицирован несколькими типами ВПЧ одновременно. Наибольшую опасность вирус представляет для женщин, так как некоторые его типы провоцируют развитие рака шейки матки.
К факторам повышенного риска заражения ВПЧ относятся:
- Раннее начало половой жизни
- Большое количество сексуальных партнеров
- Ослабление иммунитета
- Наличие урогенитальных инфекций
- Авитаминозы
- Курение
Для ВПЧ характерно скрытое течение без клинических проявлений.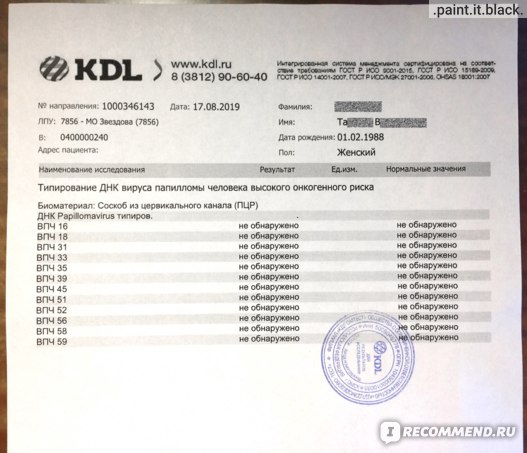 В 30% случаев в течение 1 – 1,5лет происходит самоизлечение и элиминация вируса из организма. Выявить ВПЧ-инфекцию возможно с помощью ПЦР-анализа на ДНК папилломавирусов. Материал для исследования – соскоб эпителия шейки матки, соскоб цервикального канала, соскоб клеток уретры.
В 30% случаев в течение 1 – 1,5лет происходит самоизлечение и элиминация вируса из организма. Выявить ВПЧ-инфекцию возможно с помощью ПЦР-анализа на ДНК папилломавирусов. Материал для исследования – соскоб эпителия шейки матки, соскоб цервикального канала, соскоб клеток уретры.
Долгое присутствие онкогенных типов вируса в организме женщины может приводить к изменению клеток, дисплазии тканей с последующей трансформацией в рак шейки матки. Изучено множество типов вируса, из них наиболее онкогенными являются типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68. Их еще называют ВПЧ высокого онкогенного риска. Для их выявления используется анализ методом ПЦР в режиме реального времени, который определяет не только наличие ДНК ВПЧ в исследуемом биоматериале, но и позволяет идентифицировать тип вируса и определить вирусную нагрузку – количество вируса, что важно для правильного лечения и предупреждения онкологического заболевания.
В каких случаях обычно назначают исследование?
- Для выявления папилломавирусной инфекции высокого онкогенного риска.

- При выявлении в цитологическом мазке изменений клеток, предположительно вызванных ВПЧ- инфекцией
Что именно определяется в процессе анализа?
Выявляется ДНК ВПЧ с определением типа вируса и количественным измерением его концентрации в биоматериале пациента методом ПЦР в реальном времени.
Что означают результаты теста?
Отрицательный результат свидетельствует об отсутствии этих типов вируса ВПЧ. Результат «ОБНАРУЖЕНО» ответ позволяет диагностировать ВПЧ-инфекцию, связанную с выявленным типом вируса и определить вирусную нагрузку.
Сроки выполнения теста.
Результат исследования можно получить через 1-2 дня после сдачи анализа.
Как подготовиться к анализу?
Подготовка к анализу является важным этапом, от которого во многом зависит результат. Перед сдачей анализа нужно исключить применение местных средств (свечей или вагинальных таблеток), после проведения трансвагинального УЗИ или кольпоскопии должно пройти не менее 48 часов. В случае, если вы уже сдавали ранее соскоб на ВПЧ методом ПЦР, то между исследованиями должно пройти не менее месяца, так как раннее взятие материала на повторное исследование может быть неинформативно и привести к ложному результату.
В случае, если вы уже сдавали ранее соскоб на ВПЧ методом ПЦР, то между исследованиями должно пройти не менее месяца, так как раннее взятие материала на повторное исследование может быть неинформативно и привести к ложному результату.
ВПЧ – КВД №2
Что такое ВПЧ?
Генитальная папилломавирусная инфекция – это инфекция, передаваемая половым путем (ИППП). Возбудитель папилломавирусной инфекции – вирусы папилломы человека (ВПЧ). Вирусы папилломы человека – это группа вирусов, которая включает около 100 различных типов. Более 30 типов ВПЧ передаются половым путем, инфицируют половые органы и область ануса женщин и мужчин.
Большинство инфицированных не знают о своем заболевании, не имеют клинических проявлений и, более того, могут самопроизвольно выздороветь.
Часть этих вирусов называют вирусами «высокого канцерогенного риска», они могут вызвать предраковые поражения гениталий. Исследования последних лет подтвердили главную роль ВПЧ в развитии рака шейки матки.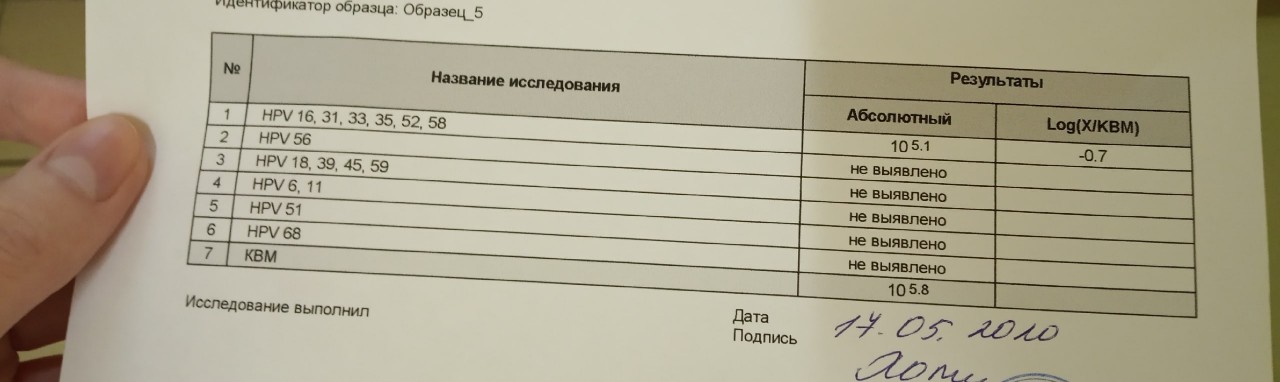 ВПЧ высокого риска также играют роль в возникновении рака вульвы, влагалища у женщин и рака полового члена у мужчин. К вирусам высокого риска относят 16, 18, 31, 33, 35, 39, 45, 52, 53, 56, 58, 59, 68, 69 типы – эти типы ВПЧ ответственны за 95-98% случаев развития рака шейки матки. Они вызывают рост ненормальных клеток, который является обычно плоским и почти невидим при обычном осмотре по сравнению с доброкачественными бородавками, которые вызываются вирусами низкого риска – 6, 11 типами. Доброкачественные аногенитальные бородавки появляются через 2 – 6 месяцев после заражения. На развитие предраковых или раковых изменений, связанных с носительством ВПЧ высокого риска уходят годы и часто происходит самопроизвольное излечение от ВПЧ.
ВПЧ высокого риска также играют роль в возникновении рака вульвы, влагалища у женщин и рака полового члена у мужчин. К вирусам высокого риска относят 16, 18, 31, 33, 35, 39, 45, 52, 53, 56, 58, 59, 68, 69 типы – эти типы ВПЧ ответственны за 95-98% случаев развития рака шейки матки. Они вызывают рост ненормальных клеток, который является обычно плоским и почти невидим при обычном осмотре по сравнению с доброкачественными бородавками, которые вызываются вирусами низкого риска – 6, 11 типами. Доброкачественные аногенитальные бородавки появляются через 2 – 6 месяцев после заражения. На развитие предраковых или раковых изменений, связанных с носительством ВПЧ высокого риска уходят годы и часто происходит самопроизвольное излечение от ВПЧ.
Инфекция наиболее распространена в возрасте от 15 до 40 и затрагивает одинаково и женщин и мужчин. К 50 годам жизни, около 80 процентов женщин приобретут ВПЧ – инфекцию.
Около 50-75% сексуально активных людей инфицируются ВПЧ в течение их жизни, и в большинстве случаев инфекция не вызывает заболевания и самопроизвольно излечивается.
Приблизительно 90% ВИЧ-инфицированных также имеют ВПЧ-инфекцию.
Как передается ВПЧ
Вирусы папилломы человека, инфицирующие половую область, передаются, через половые контакты. Большинство заразившихся не имеют видимых проявлений заболевания и поэтому носители ВПЧ не знают о своем инфицировании и могут заразить своих половых партнеров. Иногда инфицированная мать может заразить новорожденного во время родов. Это может привести к так называемому папилломатозу гортани новорожденных.
Проявления инфекции
Большинство заразившихся людей не знают об этом. ВПЧ часто не вызывает никаких проявлений на коже и слизистых оболочках. У части людей развиваются половые бородавки или происходят предраковые изменения на шейке матки, вульве, анальной области или половом члене. Очень редко эти изменения переходят непосредственно в рак. От инфицирования до развития тяжелой дисплазии в среднем проходит 20 лет. Большинство женщин спонтанно излечиваются в течение 9 – 15 месяцев от момента заражения. Основное проявление папилломавирусной инфекции – половые бородавки или остроконечные кондиломы (вызываются ВПЧ 6 и 11 типа) – мягкие бородавчатые образования на короткой тонкой ножке, напоминающие цветную капусту или петушиный гребень с различным расположением (головка полового члена, половой член, малые и большие половые губы, влагалище, шейка матки, область ануса). Остроконечные кондиломы появляются через 2 – 6 месяцев после заражения. Видимые кондиломы обнаруживаются при осмотре.
Основное проявление папилломавирусной инфекции – половые бородавки или остроконечные кондиломы (вызываются ВПЧ 6 и 11 типа) – мягкие бородавчатые образования на короткой тонкой ножке, напоминающие цветную капусту или петушиный гребень с различным расположением (головка полового члена, половой член, малые и большие половые губы, влагалище, шейка матки, область ануса). Остроконечные кондиломы появляются через 2 – 6 месяцев после заражения. Видимые кондиломы обнаруживаются при осмотре.
Диагностика инфекции
Диагностика кондилом проводится на основании осмотра. Диагностика ВПЧ высокого канцерогенного риска и связанных с ними изменений, более сложная задача. В основе диагностики предраковых заболеваний шейки матки в течении многих стоял цитологический анализ мазка (исследование мазка под микроскопом). Однако он имеет ряд существенных недостатков – сложность, низкая чувствительность и высокая частота неопределенных результатов. Американский комитет FDA (комитет по медикаментам и продовольствию) одобрил исследование ВПЧ методом полимеразной цепной реакции – ПЦР, который может определить 13 типов ВПЧ высокого риска.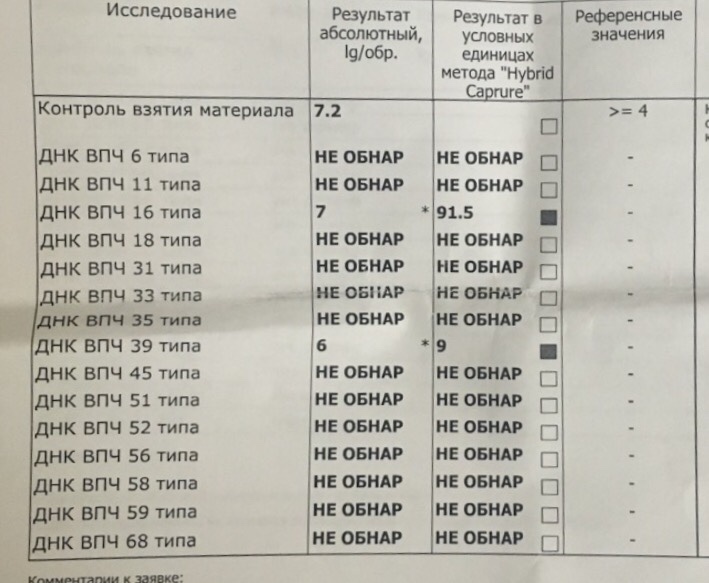 ПЦР на ВПЧобладает высокой чувствительностью, прост в исполнении. Совместное использование цитологических исследований и ПЦР тестов позволяет значительно повысить эффективность диагностики, чувствительность увеличивается до 99 – 100%. Применяемые в РКВД ПЦР тест-системы не уступают, а чаще, даже превосходят зарубежные аналоги. Важно, что выявление ВПЧ высокого риска происходит задолго до появления предраковых изменений слизистых.
ПЦР на ВПЧобладает высокой чувствительностью, прост в исполнении. Совместное использование цитологических исследований и ПЦР тестов позволяет значительно повысить эффективность диагностики, чувствительность увеличивается до 99 – 100%. Применяемые в РКВД ПЦР тест-системы не уступают, а чаще, даже превосходят зарубежные аналоги. Важно, что выявление ВПЧ высокого риска происходит задолго до появления предраковых изменений слизистых.
ПЦР исследование на ВПЧ высокого риска рекомендовано:
– Как первичный метод в дополнение к цитологии для женщин старше 30 лет.
– Для разрешения сомнительных результатов цитологического исследования.
– Пациенткам, проходящим лечение по поводу дисплазии или рака.
– На первом этапе диагностики для стран, где плохо организованы программы обследования на папилломавирусную инфекцию.
– Для обследования мужчин.
Можно ли излечить это заболевание?
Диагностика и лечение ИППП, должна проводиться в условиях специализированной клиники – КВД, имеющей все необходимые средства для быстрой и точной диагностики.
Специфического лекарства против ВПЧ на сегодняшний день нет. Существует множество методов удаления кондилом, но болезнь может вернуться вновь, поскольку вирус остается в организме человека. Рецидивы возможны в 25% случаев в течение 3 месяцев после лечения. При лечении кондилом необходим осмотр половых партнеров. Однако подавляющее большинство половых партнеров заражены ВПЧ и просто не имеют видимых проявлений заболевания.
Лечение предраковых заболеваний заключается в использовании химических, физических и других методов, с целью изменить структуру пораженных участков слизистых оболочек, а также в применении препаратов стимулирующих иммунитет. В дальнейшем необходимо ежегодное цитологическое исследование и определение ВПЧ методом ПЦР.
Какая связь между ВПЧ и раком шейки матки?
Только факты:
- Вирусы папилломы человека высокого риска являются основной причиной рака шейки матки.
- В случаях тяжелой дисплазии (предрака) и рака шейки матки ВПЧ выявляется почти в 100% случаев.

- Выявление ВПЧ связано с 250-кратным увеличением риска развития тяжелой дисплазии.
- Рак шейки матки занимает 1-е место среди причин женской смертности в развивающихся странах.
- Рак шейки матки занимает 2-е место после рака молочной железы среди женщин в мире – 250 тысяч смертей ежегодно.
- В России ежегодно 12 300 женщин заболевает раком шейки матки и более 6 тысяч пациенток ежегодно умирает.
- За последние 10 лет средний возраст заболевших снизился с 58 до 55 лет.
- У женщин до 29 лет заболеваемость выросла в 2 раза.
- ВПЧ высокого риска вызывают рак шейки матки в 100% случаев, рак заднего прохода – 90%, рак влагалища и вульвы – 40%, рак полового члена – 40% и рак ротоглотки в 12% случаев.
- Американское Общество Раковых Заболеваний прогнозировали на 2004 год, что приблизительно у 10 520 женщин разовьется агрессивный рак шейки матки и приблизительно 3 900 женщины умрут от этой болезни. Большинство женщин с агрессивным раком шейки матки, не проходили правильного обследования на ВПЧ инфекцию.

Профилактика инфекции
Вернейший способ предотвращения половой ВПЧ-инфекции состоит в том, чтобы воздержаться от любого полового контакта с другим индивидуумом.
Долговременные сексуальные отношения с постоянным половым партнером не дает 100% гарантии от инфицирования ВПЧ. Трудно определить, без специальных тестов, инфицирован ли в настоящее время половой партнер.
Мужские презервативы из латекса, при правильном применении снижают риск передачи инфекции.
Любые проявления, такие как боль или неприятные ощущения при мочеиспускании, необычная сыпь, выделения являются сигналом для прекращения половых контактов и немедленного обследования в условиях специализированной клиники – РКВД. Если у больного обнаружены ИППП, он должен сообщить об этом своим половым партнерам, для того чтобы они также прошли полное обследование и соответствующее лечение. Это снизит риск развития серьезных осложнений и предотвратит возможность повторного заражения.
ВПЧ-тест (с определением количества и отдельным выявлением 16 и 18 типов вируса)
Метод исследования
Данный тест показан только для женщин
ВПЧ-тест (с определением количества и отдельным выявлением 16 и 18 типов вируса) (код 031218) позволяет выявить суммарное количество ВПЧ высокого канцерогенного риска (16,18,31,33,35,39,45,51,52,56,58,59,68 типов), кроме того наличие и количество ВПЧ 16 и 18 типов указывается отдельно.
Доказательство этиологической роли вируса папилломы человека высокого канцерогенного риска (ВПЧ ВКР) в развитии рака шейки матки сделало тестирование на ВПЧ важнейшей частью цервикального скрининга. На основании данных многочисленных исследований, проведенных в разных странах, ВПЧ-тест превышает по чувствительности цитологическое исследование (ПАП-тест) в выявлении онкологической патологии шейки матки – рака и предраковых заболеваний.
Согласно руководству по скринингу и профилактике рака шейки матки, принятому в США «American Cancer Society, American Society for Colposcopy and Cervical Pathology and American Society for Clinical Pathology Screening Guidelines for the Prevention and Early Detection of Cervical Cancer (2012 г)», ВПЧ-тест совместно с ПАП-тестом признан предпочтительным методом скрининга для женщин от 30 лет.
Во многих странах Европы, где ВПЧ-тесты уже давно используются в программах цервикального скрининга совместно или в дополнение к традиционному ПАП-тесту, в настоящее время ВПЧ-тест начинают использовать как самостоятельный метод скрининга, а ПАП-тест как дополнительный.
В соответствие с международным требованием к ВПЧ-тестам, предназначенным для цервикального скрининга, тесты должны выявлять только типы высокого онкогенного риска. По данным международного противоракового агентства (IARC) к ним относятся не более 14 типов: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68. Среди этих типов важно выделять наиболее канцерогенные 16 и 18 типы, поскольку они чаще и быстрее приводят к развитию предраковой патологии шейки матки (цервикальной интраэпителиальной неоплазии – CIN). На долю ВПЧ 16 и 18 типов в совокупности приходится более чем 70% случаев рака шейки матки. Современные ВПЧ-тесты, основанные на ПЦР с детекцией сигнала в режиме реального времени (Real-time PCR) позволяют выявлять 16 и 18 типы на отдельных каналах детекции.
Согласно выводам крупного исследования ATHENA, проведенного в США, при выявлении 16 и 18 типов ВПЧ у женщин от 25 лет независимо от результатов цитологии (ПАП-теста) рекомендуется направлять пациенток на кольпоскопическое исследование, т. к. риск выявления предраковой патологии (CIN3) при нормальной цитологии у этих пациенток выше, чем у пациенток с другими типами ВПЧ и атипией, выявленной в ПАП-тесте.
к. риск выявления предраковой патологии (CIN3) при нормальной цитологии у этих пациенток выше, чем у пациенток с другими типами ВПЧ и атипией, выявленной в ПАП-тесте.
Показания к исследованию:
- цервикальный скрининг (обследование для выявления предраковых изменений и рака шейки матки)
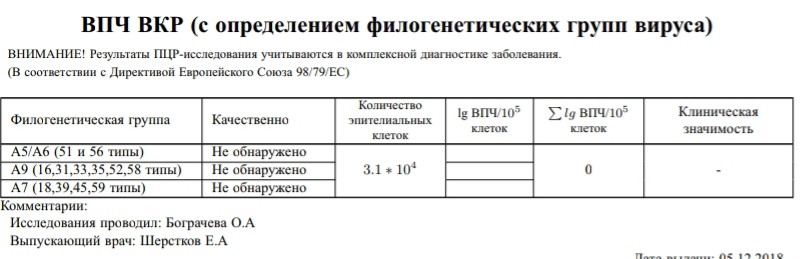
Human Papillomavirus, ДНК количественно [реал-тайм ПЦР]
Молекулярно-генетическое исследование, в ходе которого выявляется ДНК вируса папилломы человека и количественно определяется вирусная нагрузка в материале.
Определяется количество только ВПЧ высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типы) – без указания типа.
Услуги по взятию (сбору) биоматериала
- Мазок урогенитальный
- Ректальный мазок
- Мазок урогенитальный (с секретом простаты)
Срок выполнения
2 суток
Синонимы русские
Вирус папилломы человека (ВПЧ), папиллома-вирус человека.
Синонимы английские
Human Papillomavirus, DNA, Quantitative; HPV, Viral Load.
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Мазок урогенитальный (с секретом предстательной железы), ректальный мазок.
Как правильно подготовиться к исследованию?
- Женщинам рекомендуется сдавать урогенитальный мазок или мочу до менструации или через 2 дня после ее окончания.
- Мужчинам не следует мочиться в течение 3 часов до сдачи урогенитального мазка или мочи.
Общая информация об исследовании
Вирус папилломы человека – ДНК-содержащий вирус из семейства паповавирусов, ассоциированный с развитием кондилом, бородавок, предраковых изменений аногенитальной области, рака шейки матки. Существует более 100 типов ВПЧ, более 30 из них могут инфицировать половые пути, и около 14 генотипов связаны с развитием рака шейки матки, прямой кишки, полового члена и новообразований некоторых других локализаций (например, орофарингеальной карциномы).
Онкогенные папиллома-вирусы имеют в составе ДНК белки Е6/Е7, которые способны подавлять процессы апоптоза (запрограммированной гибели) в клетках с измененным генетическим материалом. Генотипы 1, 2, 3, 5 считаются неонкогенными, а генотипы 6, 11, 42, 43, 44 относятся к папиллома-вирусам низкого онкогенного риска. К ВПЧ высокого онкогенного риска относятся генотипы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68.
Основной путь распространения инфекции – половой, включая орально-генитальные и анальные контакты, также возможна вертикальная (от матери ребенку) и контактно-бытовая передача инфекции. В организм человека может попасть несколько типов ВПЧ одновременно. Заражение обычно происходит после начала половой жизни в возрасте 16-25 лет. При инфицировании онкогенными генотипами вируса между 25 и 35 годами вероятны интраэпителиальные поражения и, как следствие, через несколько лет рак. В 70 % случаев в течение первого года и в 90 % случаев через 2 года после инфицирования возможно самоизлечение.
Рак шейки матки (РШМ) по распространенности занимает 3-е место среди всех злокачественных опухолей у женщин (после рака молочной железы и рака толстой кишки). Частота инвазивного рака шейки матки в мире составляет 15-25 на 100 000 женщин. Новообразования шейки матки возникают в основном у женщин среднего возраста (35-55 лет), редко диагностируются у женщин моложе 20 лет и в 20 % случаев выявляются в возрасте старше 65 лет. 5-летняя выживаемость при локализованном (местном, in situ) раке шейки матки равна 88 %, в то время как выживаемость при распространенном раке не превышает 13 %. Кроме инфицирования онкогенными генотипами ВПЧ, риск развития рака шейки матки повышают курение, хламидийная или герпетическая инфекция, хронические воспалительные гинекологические заболевания, длительное применение противозачаточных препаратов, множественные роды, случаи рака шейки матки в семье, раннее начало половой жизни, частая смена половых партнеров, недостаточное поступление с пищей витаминов А и С, иммунодефициты и ВИЧ-инфекция. Несмотря на то что вирус папилломы человека не всегда приводит к новообразованиям, более 93 % случаев рака шейки матки ассоциированы с ним.
Несмотря на то что вирус папилломы человека не всегда приводит к новообразованиям, более 93 % случаев рака шейки матки ассоциированы с ним.
Полимеразная цепная реакция (ПЦР) с высокой чувствительностью и специфичностью выявляет ДНК вируса папилломы человека (ВПЧ) в более чем 90 % случаев рака и 75-85 % интраэпителиальной неоплазии с выраженной дисплазией. По данным исследований, количественное содержание вируса в материале коррелирует со степенью неоплазии: чем выше вирусная нагрузка, тем выраженнее цитологические изменения в эпителии. При обследовании необходимо учитывать генотип вируса, наличие и степень цитологических и гистологических изменений в тканях, увеличение или снижение вирусной нагрузки через несколько месяцев (6 месяцев и более) после предыдущего обследования.
Для чего используется исследование?
-
Чтобы оценить риск развития новообразований, ассоциированных с ВПЧ (рак шейки матки, рак прямой кишки, рак аногенитальной области и других локализаций).

- Для контроля за эффективностью лечения предраковых заболеваний, ассоциированных с ВПЧ.
- Для мониторинга папиллома-вирусной инфекции и прогнозирования ее течения.
Когда назначается исследование?
- При выявлении цитологических изменений в мазке на атипию, в мазке по Папаниколау, в гистологическом препарате.
- При кондиломах и других морфологических изменениях половых путей.
- При скрининге рака шейки матки у женщин старше 25-30 лет (в качестве дополнительного исследования).
- При наблюдении за инфицированными ВПЧ.
- При лечении рака и предраковых состояний, ассоциированных с ВПЧ.
Что означают результаты?
Референсные значения
|
Компонент |
Референсные значения |
|
ДНК ВПЧ А9 (16,31,33,35,52,58), lg |
Не обнаружено |
|
ДНК ВПЧ А7 (18,39,45,59), lg |
Не обнаружено |
|
ДНК ВПЧ А5/А6 (51,56), lg |
Не обнаружено |
Уровень вирусной нагрузки интерпретируется с учетом результатов цитологического исследования мазков, гистологических изменений в биоптате и генотипа вируса, изменении его количества с течением времени.
Количество ДНК ВПЧ не определяется при отсутствии вируса в исследуемом образце или его минимальном количестве (ниже детектируемого уровня) – риск развития патологического процесса, связанного с ВПЧ, минимальный.
Клинически малозначимая концентрация вируса (менее 103 копий ДНК ВПЧ на 105 клеток) – минимальный риск развития дисплазии, транзиторное течение вирусного процесса.
Клинически значимая концентрация вируса (более 103 копий ДНК ВПЧ на 105 клеток) – хроническая инфекция с высоким риском развития дисплазии и РШМ.
Более 105 копий ДНК ВПЧ на 105 клеток при установленном факте персистентного течения инфекции (ВПЧ выявляется более 1 года) – усиленная вирусная нагрузка, ассоциированная с повышенным риском тяжелой дисплазии, часто встречается при РШМ.
Снижение вирусной нагрузки в 10 раз за 6 месяцев – транзиторная инфекция.
Рост вирусной нагрузки через 6 и более месяцев после лечения указывает на возможность рецидива.
Что может влиять на результат?
Недостоверный результат может быть получен при:
- неправильном взятии и хранении материала;
- загрязнении исследуемого материала.
Важные замечания
- Инфицирование ВПЧ не всегда приводит к раку шейки матки.
- Возможно одновременное заражение несколькими генотипами ВПЧ.
- Результат анализа должен интерпретироваться с учетом заключений цитологического и гистологического исследований.
Также рекомендуется
- Human Papillomavirus 16/18 (HPV 16/18), ДНК [реал-тайм ПЦР]
- Human Papillomavirus 6/11 (HPV 6/11), ДНК [реал-тайм ПЦР]
- Human Papillomavirus высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типы), ДНК без определения типа [ПЦР]
- Human Papillomavirus высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типы), ДНК генотипирование [реал-тайм ПЦР]
- Цитологическое исследование мазков (соскобов) с поверхности шейки матки (наружного маточного зева) и цервикального канала – окрашивание по Папаниколау (Рар-тест)
- Цитологическое исследование мазков (соскобов) с поверхности шейки матки (наружного маточного зева) и цервикального канала на атипию
- Антиген плоскоклеточной карциномы (SCCA)
Кто назначает исследование?
Гинеколог, онколог.
Тип биоматериала и способы взятия
|
Тип |
На дому |
В Центре |
Самостоятельно |
|
Мазок урогенитальный |
да |
||
|
Мазок урогенитальный (с секретом предстательной железы) |
да |
||
|
Ректальный мазок |
да |
да |
На дому: возможно взятие биоматериала сотрудником мобильной службы.
В Диагностическом центре: взятие, либо самостоятельный сбор биоматериала осуществляется в Диагностическом центре.
Самостоятельно: сбор биоматериала осуществляется самим пациентом (моча, кал, мокрота и т.п.). Другой вариант – образцы биоматериала предоставляет пациенту врач (например, операционный материал, ликвор, биоптаты и т.п.). После получения образцов пациент может как самостоятельно доставить их в Диагностический центр, так и вызвать мобильную службу на дом для передачи их в лабораторию.
Литература
- Arbyn M. et al. (2010). “European Guidelines for Quality Assurance in Cervical Cancer Screening. Second Edition–Summary Document”. Annals of Oncology 21 (3): 448–458.
- Hsiu-Ting Tsai, Ching-Hu Wu, Hsiao-Ling Lai, et al. Association between Quantitative High-Risk Human Papillomavirus DNA Load and Cervical Intraepithelial Neoplasm Risk Cancer Epidemiol Biomarkers Prev 2005;14:2544-2549.
- Saslow D, Solomon D, Lawson HW, et al. American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology Screening Guidelines for the Prevention and Early Detection of Cervical Cancer. Am J Clin Pathol. 2012;137:516-542.
- “Genital HPV Infection – CDC Fact Sheet”. Centers for Disease Control and Prevention (CDC). April 10, 2008. Retrieved 13 November 2009.
- Материалы и рекомендации Противоракового Общества России. Режим доступа: http://www.pror.ru/
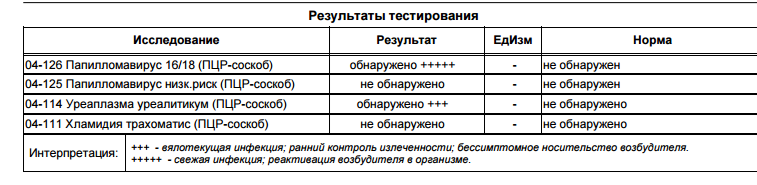
Дифференцированное определение ДНК ВПЧ (Вирус папилломы человека, Human papillomavirus, HPV) низкого онкогенного риска 3-х типов (6, 11, 44) + КВМ в соскобе эпителиальных клеток урогенитального тракта
Определение ДНК вируса папилломы человека (ВПЧ) 6, 11, 44 типа (HPV 6, 11, 44) в соскобе эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени».ВПЧ 6, 11, 44 типов – представители многочисленного рода папилломавирусов. Для всех папилломавирусов характерен выраженный тропизм к тканям кожных покровов и слизистых оболочек. Инфицирование ВПЧ 6, 11 и 44 типа может привести к развитию остроконечных кондилом, поражению слизистой оболочки гортани.
Остроконечные кондиломы. . Возбудитель передаётся при половых контактах. Инкубационный период может составлять от нескольких недель до нескольких месяцев. Характер разрастаний и объём поражённых участков варьируется от практически незаметных до обширных. Возможна злокачественная трансформация инфицированных клеток.
Ювенильный папилломатоз гортани (веррукозный ларингит) – сравнительно редкая патология. Заболевают дети до 5 лет, заразившиеся перинатально. Клинические проявления: появление характерных разрастаний на голосовых связках, приводящих к речевым затруднениям и нарушениям циркуляции воздуха в верхних отделах дыхательных путей.
Аналитические показатели:
Обследование женщин целесообразно проводить в первую половину менструального цикла, не ранее 5 –ого дня. Допустимо обследование во второй половине цикла, не позднее, чем за 5 дней до предполагаемого начала менструации. При наличии патологических изменений, взятие материала проводится в день обращения. Накануне и в день обследования пациентке не рекомендуется выполнять спринцевание влагалища. Не рекомендуется взятие биоматериала на фоне проведения антибактериальной терапии ( общей / местной) и во время menses, ранее 24- 48 часов после полового контакта, интравагинального УЗИ и кольпоскопии. Рекомендуется брать материал не ранее, чем через 14 дней после применения антибактериальных препаратов и местных антисептиков, и не ранее, чем через 1 месяц после применения антибиотиков перорально. Если для исследования берут соскоб из уретры, сбор материала проводят до или не ранее 2 – 3 часов после мочеиспускания.
Для мужчин: За 1–2 суток до взятия мазка (соскоба) необходимо исключить половые контакты. Не рекомендуется взятие биоматериала на фоне проведения антибактериальной терапии ( общей / местной). Нельзя мочиться в течение 1,5-2 часов до процедуры.
С общими рекомендациями для подготовки к исследованиям можно ознакомиться здесь >>Наличие папилломатозных разрастаний на слизистых оболочках половых органов.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Тест качественный. Результат выдаётся в терминах «обнаружено» или «не обнаружено» для каждого типа ВПЧ (6, 11, 44).
Обнаружено:
Не обнаружено:
Обращаем внимание, что сроки выполнения ПЦР-исследований могут быть увеличены при проведении подтверждающих тестов.
Понимание процесса выборов vPC – Cisco
Введение
В этом документе объясняется процесс выбора роли виртуального канала порта (vPC) на коммутаторах серии Nexus.
Предоставили Николай Карташев, Цзюнь Ван, Кен Чжэн, инженеры Cisco TAC.
Предварительные требования
Требования
Cisco рекомендует ознакомиться со следующими темами:
- vPC на коммутаторах серии Nexus
- Протокол связующего дерева (STP)
Используемые компоненты
Информация в этом документе основана на платформе коммутатора Nexus серии 9000.
Информация в этом документе была создана на устройствах в определенной лабораторной среде. Все устройства, используемые в этом документе, были запущены с очищенной (по умолчанию) конфигурацией. Если ваша сеть работает, убедитесь, что вы понимаете потенциальное влияние любой команды.
Технология виртуального порта и каналаVirtual PortChannels (vPC) позволяет ссылкам, физически подключенным к двум различным коммутаторам Ciscoswitch, отображаться как один PortChannel для третьего устройства.Третье устройство может быть коммутатором, сервером или любым другим сетевым устройством, поддерживающим IEEE 802.3ad PortChannels. vPC также позволяет создавать PortChannels уровня 2, которые охватывают два коммутатора. В настоящее время vPC реализован на платформах Cisco Nexus серий 9000, 7000, 5000 и 3000 (с удлинителями коммутации Cisco Nexus серии 2000 или без них).
Программное обеспечение Cisco NX-OS vPC и Cisco CatalystVirtual Switching Systems (VSS) используют аналогичные технологии. Для технологии Cisco EtherChannel термин «Multi -ssis EtherChannel (MCEC)» взаимозаменяемо относится к любой технологии.
Роль vPC
Хотя оба коммутатора vPC выглядят как один коммутатор для нижестоящего устройства, между собой два коммутатора vPC имеют четко определенные роли vPC: vPC Primary и vPC Secondary.
ролей vPC не являются вытесняющими, что означает, что устройство может быть настроено как первичное vPC, но работать как вторичное одноранговое устройство vPC. Это может произойти в следующем сценарии:
- Когда исходное первичное устройство выходит из строя, вторичное устройство vPC становится новым первичным устройством
- Когда система восстанавливается, прежнее первичное устройство становится вторичным и наоборот.
Роль vPC определяет, какое из двух одноранговых устройств vPC обрабатывает блоки данных протокола моста (BPDU) и отвечает на запросы протокола разрешения адресов (ARP). Роль vPC также определяет набор действий, которые должны выполняться первичным и вторичным vPC в ответ на ситуацию разрыва однорангового соединения vPC.
Приоритет роли vPC
Вы также можете использовать команду “приоритет роли ” в команде режима домена vPC, чтобы повлиять на процесс выбора vPC. Диапазон значений от 1 до 65636, значение по умолчанию – 32667.Меньшее значение означает, что у этого коммутатора больше шансов стать основным vPC.
Изменение приоритета одноранговых устройств vPC может вызвать сбои интерфейсов в вашей сети. Если вы хотите снова настроить приоритет роли, чтобы сделать одно устройство vPC основным устройством, настройте приоритет роли как на основном устройстве vPC с более низким значением приоритета, так и на дополнительном устройстве vPC с более высоким значением. Затем отключите одноранговую связь vPC на обоих устройствах, введя команду shutdown, и, наконец, снова включите канал порта на обоих устройствах, введя команду no shutdown.
Изменение роли Hitless vPC
Функция беспрепятственного изменения ролей vPC предоставляет платформу для переключения ролей vPC между одноранговыми узлами vPC, не влияя на потоки трафика. Смена ролей vPC выполняется на основе значения приоритета роли устройства в домене vPC. Одноранговое устройство vPC с более низким приоритетом роли выбирается в качестве основного устройства vPC при выполнении команды « vpc role preempt» .
Дополнительные сведения см. В разделе «Сценарий использования для беспроблемного изменения роли vPC».
Поведение систем vPC при отключении однорангового соединения vPCКогда одноранговый канал vPC не работает, а канал поддержки активности однорангового соединения vPC все еще работает, вторичное одноранговое устройство vPC выполняет следующие операции:
- Приостанавливает порты участников vPC
- Выключает SVI, связанный с vPC VLAN
Это защитное поведение vPC перенаправляет весь трафик с юга на север на основное устройство vPC.
Обратите внимание, что когда одноранговое соединение vPC не работает, оба одноранговых устройства vPC больше не могут синхронизировать друг друга, поэтому разработанный механизм защиты приводит к изоляции одного из одноранговых устройств (в случае вторичного однорангового устройства) от пути данных.
Мастер липкий бит vPCvPC Master Sticky bit – это запрограммированный механизм защиты , введенный для предотвращения ненужной смены ролей (которая потенциально может вызвать нарушение работы сети), когда первичный коммутатор неожиданно перезагружается. vPC Master Sticky Bit позволяет активному коммутатору «придерживаться» своей ПЕРВИЧНОЙ роли, когда неработающий коммутатор возвращается в рабочий режим или когда изолированный коммутатор интегрируется обратно в домен VPC.
Переключение мастер-битов vPC:
1.Для vPC Master Sticky Bit будет установлено значение TRUE в следующих сценариях:
- Когда текущий vPC Primary перезагружается и коммутатор с поддержкой vPC переключает свою роль с vPC Secondary на vPC Operational Primary . Бит залипания не будет установлен, если роль изменится с vPC Operational Secondary на vPC Primary .
- Когда коммутатор с поддержкой vPC переключает свою роль с Нет установить на vPC Primary , когда таймер восстановления перезагрузки (по умолчанию 240 секунд) истекает
2.Значение фиктивного бита мастера vPC будет установлено на FALSE в следующих сценариях:
- При перезагрузке коммутатора с поддержкой vPC (Примечание: для Sticky Bit по умолчанию установлено значение FALSE)
- При изменении или повторном вводе приоритета роли vPC
vPC Sticky master bit сообщается в структуре компонентов программного обеспечения vPC Manager и может быть проверен с помощью этой команды режима exec NX-OS
Campus_N7K2-VPC # показать внутреннюю информацию vpcm системы global | включить липкий регистр игнорирования Sticky Master: ИСТИНА Campus_N7K2-VPC №
Восстановление задержки vPC
После перезагрузки однорангового устройства vPC и его восстановления протоколу маршрутизации требуется время для повторного схождения.На участке восстановления vPC может быть маршрутизирован трафик «черная дыра» от доступа к агрегации / ядру до тех пор, пока не будет восстановлено соединение уровня 3 по восходящей линии связи.
ФункцияvPC Delay Restore задерживает включение ветки vPC на восстанавливающееся одноранговое устройство vPC. vPC Delay Restore позволяет протоколам маршрутизации уровня 3 сойтись, прежде чем разрешить любой трафик на ветке vPC. Это приводит к более плавному восстановлению и нулевой потере пакетов на этапе восстановления (трафик по-прежнему перенаправляется на работающее одноранговое устройство vPC). Эта функция включена по умолчанию с таймером восстановления vPC по умолчанию, равным 30 секундам.Таймер можно настроить в соответствии с конкретным базовым уровнем конвергенции уровня 3 от 1 до 3600 секунд.
Интерфейс восстановления задержки vPC Vlan
Чтобы отложить подключение интерфейсов VLAN на восстановленном одноранговом устройстве vPC, используйте параметр interfaces-vlan команды delay restore ““. Эта функция включена по умолчанию с таймером восстановления vPC по умолчанию, равным 10 секундам.
Процесс выборов vPC
В системе vPC одно одноранговое устройство vPC определяется как первичное vPC, а одно – как вторичное vPC на основе этих параметров и в этом порядке
- мастер-бит залипания vPC установлен на 0 или 1
- Определяемый пользователем приоритет роли vPC (программное обеспечение Cisco NX-OS использует наименьшее числовое значение для выбора основного устройства)
- Значение системного Mac-адреса (программное обеспечение Cisco NX-OS использует наименьший MAC-адрес для выбора основного устройства)
Эта блок-схема (рисунок 1) суммирует шаги, которые проходят оба одноранговых устройства vPC во время процесса выбора основного коммутатора vPC.
- Первый проверяемый параметр между двумя устройствами во время процесса первичного выбора vPC – это главный залипающий бит vPC. Если одноранговое устройство vPC победит в этом сравнении, оно станет основным vPC независимо от настроенного значения приоритета роли vPC или системных MAC-адресов, которые имеют оба одноранговых узла.
- Если оба одноранговых коммутатора vPC имеют одинаковое значение Sticky Bit, процесс выбора перейдет к следующему шагу для сравнения определяемого пользователем приоритета роли vPC.
- Если обе роли vPC настроены на одно и то же значение, процесс выбора продолжится, чтобы сравнить системные MAC-адреса.
Рисунок 1
Как показано в Таблице 1, когда коммутатор vPC имеет главный бит закрепления vPC, установленный на 1 (условие ИСТИНА), а его партнер с битом закрепления, установленным на 0 (условие ЛОЖЬ), сторона ИСТИНА выиграет выборы и возьмет на себя роль vPC Начальный.
| липкий бит vPC Peer 1 установлен на 1 | бит фиксации узла vPC 2 установлен на 1 | основной vPC |
| Ложь (0) | Ложь (0) | Галстук |
| Верно (1) | Ложь (0) | одноранговый узел vPC 1 |
| Ложь (0) | Истинный (1) | одноранговый узел vPC 2 |
| Верно (1) | Истинный (1) | Галстук |
Таблица 1
Сценарий восстановления vPC
Нельзя недооценивать важность понимания процесса выборов vPC, особенно в сценариях восстановления vPC.
На рисунке 2 показана типичная настройка VPC, Nexus-01 – это первичный VPC, а Nexus-02 – вторичный VPC. У них обоих по умолчанию для липких битов установлено значение FALSE.
Рисунок 2
Как показано на Рисунке 3, в Nexus-01 отключено электричество, и он изолирован от сети. Nexus-02 повысился до уровня vPC Primary и установил для vPC Sticky Bit значение TRUE.
И Nexus-02 теперь становится рабочим, и бит фиксации теперь установлен на ИСТИНА.
Рисунок 3
Как показано на рисунке 4, когда Nexus-01 возвращается в режим онлайн после восстановления отключения электроэнергии, Nexus-02 сохранит операционную ПЕРВИЧНУЮ роль независимо от приоритета своей роли (потому что у него есть липкий бит ИСТИНА), а Nexus-02 будет возьмите ВТОРИЧНУЮ роль, когда она появится в сети. Только Nexus-01 начнет процесс инициализации VPC, тогда как N7K-02 останется основным и будет перенаправлять трафик как обычно. Следовательно, не будет видеть сбоев сети .
Есть два таймера, связанных с процессом инициализации vPC на Nexus-01, который теперь является рабочим vPC Вторичным устройством:
- задержка восстановления SVI (по умолчанию 10 секунд)
- задержка восстановления (по умолчанию 30 секунд)
В результате вы можете ожидать 40-секундное время восстановления на Nexus-01 после того, как Nexus-01 будет повторно введен в сеть в качестве вторичного устройства vPC. Однако, поскольку Nexus-02 берет на себя основную роль, весь трафик теперь проходит через Nexus-01, как упоминалось выше, сбоев в сети не будет.
Рисунок 4
Пример сбоя сети из-за неправильной установки липкого бита
Отказ сети вызван НЕПРАВИЛЬНО установленным битом залипания, когда изолированный коммутатор (Nexus-02) вводится обратно в домен VPC
Однако сбой сети может произойти после того, как изолированный коммутатор будет возвращен в домен VPC, если липкие биты не установлены правильно на обоих коммутаторах Nexus. Прежде чем изолированный коммутатор будет возвращен в домен VPC, его бит фиксации должен быть установлен в значение FALSE.(Процедуры замены корпуса N7K см. Https://www.cisco.com/c/en/us/support/docs/interfaces-modules/nexus-7000-series-supervisor-1-module/119033-technote- nexus-00.html # anc11)
Как показано на рисунке 5, Nexus-01 настроен с более высоким приоритетом роли VPC, чем Nexus-02, а Nexus-02 имеет бит закрепления, установленный на TRUE. Каналы E1 / 1 и E1 / 2 Nexus-01 находятся в состоянии пересылки, тогда как E1 / 1 и E1 / 2 в выключенном состоянии.
Рисунок 5
Когда PKA и Peer Link будут восстановлены, Nexus-02 возьмет на себя ПЕРВИЧНУЮ роль независимо от приоритета своей роли (потому что у него есть липкий бит ИСТИНА) и заставит Nexus-01 стать ВТОРИЧНЫМ, и процесс инициализации VPC начнется на Nexus- 01.Таким образом, связь E1 / 1 и E1 / 2 Nexus-01 будет приостановлена VPC и перейдет в оперативный режим по истечении таймеров восстановления реле (по умолчанию 40 секунд). В этом случае будет отображаться 40-секундный сбой сети после восстановления PKA и однорангового соединения, как показано на рисунке 6.
Рисунок 6
| Примечание | При повторном вводе Nexus обратно в домен vPC мы должны убедиться, что на активном устройстве vPC не будет изменения роли vPC. Чтобы избежать изменения роли vPC, когда биты фиксации обоих переключателей установлены на одно и то же значение, активное устройство vPC должно иметь более высокий приоритет роли, чтобы оно сохраняло свою ПЕРВИЧНУЮ роль. Дополнительные сведения о процессе выбора роли VPC см. На рис. 1 в этой статье. |
Virtual PortChannel Краткое руководство по настройке
Обзор
Виртуальный PortChannel (vPC) позволяет ссылкам, физически подключенным к двум различным устройствам Cisco Nexus ™ серии 5000, выступать в качестве одного PortChannel для третьего устройства.Третье устройство может быть коммутатором Cisco Nexus серии 2000 или коммутатором, сервером или любым другим сетевым устройством. VPC может обеспечивать многопутевость уровня 2, что позволяет создать избыточность за счет увеличения пропускной способности, включения нескольких параллельных путей между узлами и трафика с балансировкой нагрузки там, где существуют альтернативные пути.
После включения функции vPC вы создаете одноранговую ссылку поддержки активности, которая отправляет контрольные сообщения между двумя одноранговыми устройствами vPC.
Домен vPC включает в себя одноранговые устройства vPC, одноранговую ссылку поддержки активности vPC, одноранговую ссылку vPC и все каналы PortChannels в домене vPC, подключенные к нижестоящему устройству.На каждом устройстве может быть только один идентификатор домена vPC.
VPC дает следующие преимущества:
• Позволяет одному устройству использовать PortChannel для двух восходящих устройств
• Устраняет заблокированные порты протоколом Spanning Tree
• Обеспечивает топологию без петель
• Использует всю доступную полосу пропускания восходящего канала
• Обеспечивает быструю конвергенцию в случае отказа канала или устройства
• Обеспечивает отказоустойчивость на уровне каналов
• Обеспечивает высокую доступность
VPC не только позволяет создавать PortChannel из коммутатора или сервера, который имеет двойное подключение к паре коммутаторов Cisco Nexus серии 5000, но также может быть развернут вместе с расширителями структуры Cisco Nexus серии 2000.Сценарий развертывания на рисунке 1 создает vPC между двумя портами на каждом из двух Cisco. ® расширители ткани.
Рисунок 1. vPC с двумя портами от каждого из двух удлинителей сети
Сценарий развертывания vPC на рис. 2 позволяет коммутаторам Cisco Nexus серии 2000 подключаться к паре коммутаторов Cisco Nexus серии 5000 и активировать все каналы.
Рисунок 2. vPC с каждым удлинителем матрицы, подключенным к двум коммутаторам Cisco Nexus серии 5000
В дополнение к двум топологиям, показанным на рисунках 1 и 2, вы можете использовать vPC на любом устройстве, поддерживающем PortChannels, для достижения отказоустойчивости и высокой пропускной способности, когда устройство подключено к паре коммутаторов Cisco Nexus серии 5000.
Концепции vPC
В следующем списке определены важнейшие концепции vPC:
• vPC: vPC относится к объединенному каналу порта между одноранговыми устройствами vPC и нисходящим устройством.
• Одноранговый коммутатор vPC: одноранговый коммутатор vPC – это один из пары коммутаторов, которые подключены к специальному каналу PortChannel, известному как одноранговая ссылка vPC. Одно устройство будет выбрано в качестве основного, а другое – в качестве дополнительного.
• Одноранговая ссылка vPC: Одноранговая ссылка vPC – это ссылка, используемая для синхронизации состояний между одноранговыми устройствами vPC. Одноранговый канал vPC передает управляющий трафик между двумя коммутаторами vPC, а также многоадресный, широковещательный трафик данных. В некоторых сценариях сбоя канала он также передает одноадресный трафик. У вас должно быть как минимум два интерфейса 10 Gigabit Ethernet для одноранговых каналов.
• Домен vPC: этот домен включает в себя одноранговые устройства vPC, одноранговый канал поддержки активности vPC и все каналы PortChannels в vPC, подключенные к нижестоящим устройствам.Он также связан с режимом конфигурации, который необходимо использовать для назначения глобальных параметров vPC.
• Ссылка поддержки активности однорангового узла vPC: Ссылка проверки активности однорангового узла отслеживает жизнеспособность коммутатора узла vPC. Ссылка поддержки активности однорангового узла отправляет периодические сообщения проверки активности между одноранговыми устройствами vPC. Канал поддержки активности однорангового узла vPC может быть интерфейсом управления или коммутируемым виртуальным интерфейсом (SVI). По каналу поддержки активности однорангового узла vPC не передается трафик данных или синхронизации; единственный трафик по этой ссылке – это сообщение, указывающее, что исходный коммутатор работает и работает vPC.
• Порт участника vPC: порты участника vPC – это интерфейсы, принадлежащие vPC.
Рисунок 3 иллюстрирует эти концепции.
Рисунок 3. Концепции vPC
Конфигурация vPC
Настройка vPC на Cisco Nexus серии 5000 включает следующие шаги:
• Включите функцию vPC.
• Создайте домен vPC и войдите в режим домена vpc.
• Настройте канал поддержки активности однорангового узла vPC.
• (Необязательно) Настройте приоритет системы.
• (Необязательно) Настройте приоритет роли vPC.
• Создайте одноранговую ссылку vPC.
• Переместите PortChannel в vPC.
Таблица 1 содержит подробную информацию об этих шагах.
Таблица 1. Шаги настройки vPC
Команда | Назначение | |
Шаг 1 | настроить т | Войдите в режим глобальной конфигурации. |
Шаг 2 | feature vpc Пример: switch (config) feature vpc | Включите функцию vPC. Перед настройкой функции vPC необходимо включить ее |
Шаг 3 | vpc domain domain-id Пример: switch (config) # vpc domain 5 switch (config-vpc-domain) # | Создайте домен vPC и назначьте идентификатор домена. |
Шаг 4 | одноранговый IP-адрес назначения для поддержки активности [время ожидания в секундах | интервал мсек {таймаут сек} | {приоритет {предварительное значение | сеть | Интернет | критический | flash-override | вспышка | непосредственный приоритет | процедура}} | tos {tos-value | максимальная надежность | максимальная пропускная способность | мин-задержка | минимальная денежная стоимость | нормальный}} | tos-byte tos-byte-value} | исходный IP-адрес | vrf {менеджмент | default}] Пример: Интерфейс управления для однорангового канала поддержки активности: Коммутатор(config-vpc-domain) # одноранговый узел поддержки активности 172.28.230.85 switch (config-vpc-domain) # SVI для однорангового соединения keepalive: switch (config-vpc-domain) # peer-keepalive destination 172.28.1.100 source 172.28.1.120 vrf default | Настройте адрес IPv4 для удаленного конца однорангового канала поддержки активности vPC. Система не создает одноранговую ссылку vPC, пока вы не настроите одноранговую ссылку поддержки активности vPC. Cisco Nexus серии 5000 не поддерживает создание или настройку дополнительных экземпляров Virtual Route Forwarding (VRF).При загрузке системы создаются два экземпляра VRF: управляющий и стандартный. Интерфейс управления находится в экземпляре управления VRF, и все SVI находятся в экземпляре VRF по умолчанию. И интерфейсы управления, и SVI могут использоваться для одноранговых каналов поддержки активности. Интерфейс управления и экземпляр управления VRF являются значениями по умолчанию. Второй пример показывает, как настроить SVI как канал поддержки активности. Адрес источника должен быть указан, когда экземпляр VRF по умолчанию используется для одноранговой поддержки активности. |
Шаг 5 | приоритет системы Пример: коммутатор(config-vpc-domain) # системный приоритет 4000 коммутатор (config-vpc-domain) # | (Необязательно) Введите системный приоритет, который вы хотите для указанного домена vPC. Диапазон значений: от 1 до 65535. Значение по умолчанию – 32667. При запуске протокола управления агрегацией каналов (LACP) необходимо вручную настроить приоритет системы vPC, чтобы убедиться, что одноранговые устройства vPC являются основными устройствами в LACP. .При настройке приоритета системы вручную убедитесь, что вы настроили одинаковое значение приоритета на обоих одноранговых устройствах vPC. Если эти значения не совпадают, vPC не будет активирован. |
Шаг 6 | приоритет приоритета роли Пример: коммутатор (config-vpc-domain) # приоритет роли 2000 коммутатор (config-vpc-domain) # | (Необязательно) Введите приоритет роли, который требуется для этого коммутатора vPC.Диапазон значений: от 1 до 65636, значение по умолчанию – 32667. Коммутатор с более низким приоритетом будет выбран в качестве основного коммутатора vPC. В случае сбоя однорангового канала одноранговый узел vPC определит, активен ли одноранговый коммутатор, через одноранговый канал поддержки активности vPC. Если первичный коммутатор vPC активен, вторичный коммутатор vPC приостанавливает работу своих портов-участников vPC, чтобы предотвратить возможное зацикливание, в то время как основной коммутатор vPC сохраняет все свои порты-участники vPC активными. |
Шаг 7 | интерфейс порт-канал номер канала vpc peer-link Пример: switch (config) # interface port-channel 20 switch (config-if) # vpc peer-link | Выберите PortChannel, который вы хотите использовать в качестве однорангового канала vPC для этого устройства, и войдите в режим настройки интерфейса. Настройте выбранный PortChannel в качестве однорангового канала vPC. |
Шаг 8 | интерфейс порт-канал номер канала номер vpc Пример: switch (config) #interface e1 / 1 switch (config-if) channel-group 20 switch (config-if) # interface порт-канал 20 коммутатор (config-if) # vpc 100 | Добавьте интерфейс в PortChannel, а затем переместите PortChannel в vPC для подключения к нисходящему устройству.Номер vPC находится в диапазоне от 1 до 4096. Номер vPC не обязательно должен совпадать с номером PortChannel, но он должен совпадать с номером однорангового коммутатора vPC для этого пакета vPC. PortChannel требуется, даже если для PortChannel существует только один интерфейс-член. Когда есть только один член для PortChannel, аппаратный ресурс PortChannel не будет создан. |
Примеры конфигурации vPC
Ниже приведены шаги по настройке vPC на коммутаторе Cisco серии 5000 1, показанном на рисунке 4.
Рисунок 4. Пример конфигурации vPC: vPC с двумя портами от двух удлинителей фабрики
Шаг 1. Настройте IP-адрес интерфейса управления и маршрут по умолчанию.
N5k-1 (конфигурация) # int mgmt 0
N5k-1 (config-if) # ip-адрес 172.25.182.51/24
N5k-1 (config-if) # управление контекстом vrf
N5k-1 (config-vrf) # IP-маршрут 0.0,0.0 / 0 172.25.182.1
Шаг 2. Включите vPC и LACP.
N5k-1 (config) # функция vpc
N5k-1 (config) # функция lacp
Шаг 3. Создайте VLAN.
N5k-1 (конфигурация) #vlan 101
Шаг 4. Создайте домен vPC.
N5k-1 (config) # vpc домен 1
Шаг 5. Настройте приоритет роли vPC (необязательно).
N5k-1 (config-vpc-domain) # приоритет роли 1000
Шаг 6. Настройте одноранговую ссылку поддержки активности. IP-адрес интерфейса управления для коммутатора Cisco Nexus серии 5000 Switch 2 – 172.25.182.52.
N5k-1 (config-vpc-domain) # одноранговый адрес для поддержки активности 172.25.182.52
Примечание:
——– :: Управление VRF будет использоваться как VRF по умолчанию :: ——–
Шаг 7. Настройте одноранговую ссылку vPC. Обратите внимание, что, как и для обычного межкоммутаторного транка, транкинг должен быть включен для тех сетей VLAN, которым принадлежит порт-член vPC.
N5k-1 (config-vpc-domain) # int ethernet 1 / 17-18
N5k-1 (config-if-range) # активен режим группы каналов 1
N5k-1 (конфигурация-если-диапазон) # int po1
N5k-1 (config-if) # одноранговая ссылка vpc
N5k-1 (config-if) # транк в режиме switchport
N5k-1 (config-if) # разрешен транк порта коммутатора vlan 1,101
Шаг 8. Настройте расширители коммутационной сети Cisco Nexus серии 2000 и интерфейс фабрики.
N5k-1 (конфигурация) # fex 100
N5k-1 (config-fex) # закрепление max-links 1
Изменение Max-линков вызовет нарушение трафика.
N5k-1 (конфигурация-fex) # int e1 / 7-8
N5k-1 (config-if-range) # группа-каналов 100
N5k-1 (конфигурация-если-диапазон) # int po100
N5k-1 (config-if) # switchport mode fex-fabric
N5k-1 (config-if) # fex associate 100
Шаг 9. Переместите интерфейс расширителя коммутационной сети на vPC. После того, как расширитель структуры 100 (fex 100) перейдет в оперативный режим, создайте PortChannel для интерфейса eth200 / 1/1 и переместите PortChannel на vPC. Обратите внимание, что номер PortChannel и номер vPC могут отличаться, но номер vPC должен быть одинаковым на обоих коммутаторах Cisco Nexus серии 5000.
N5k-1 (config-if) # int ethernet 100/1/1
N5k-1 (config-if) # группа каналов 10
N5k-1 (конфигурация-если) # int po10
N5k-1 (конфигурация-если) # vpc 10
N5k-1 (config-if) # switchport access vlan 101
Шаги настройки второго коммутатора Cisco Nexus серии 5000 Switch 2:
N5k-2 (конфигурация) # int mgmt 0
N5k-2 (config-if) # IP-адрес 172.25.182.52 / 24
N5k-2 (config-if) # управление контекстом vrf
N5k-2 (config-vrf) # IP-маршрут 0.0.0.0/0 172.25.182.1
N5k-2 (config) # функция vpc
N5k-2 (config) # функция lacp
N5k-2 (конфиг) #vlan 101
N5k-2 (config) # vpc домен 1
N5k-2 (config-vpc-domain) # одноранговый адрес для поддержки активности 172.25.182.51
Примечание:
——– :: Управление VRF будет использоваться как VRF по умолчанию :: ——–
N5k-2 (config-vpc-domain) # int ethernet 1 / 17-18
N5k-2 (config-if-range) # активен режим группы каналов 1
N5k-2 (конфигурация-если-диапазон) # int po1
N5k-2 (config-if) # одноранговая ссылка vpc
N5k-2 (config-if) # транк в режиме switchport
N5k-2 (config-if) # switchport trunk разрешен vlan 1,101
N5k-2 (конфигурация) # fex 100
N5k-2 (config-fex) # закрепление max-links 1
Изменение Max-линков вызовет нарушение трафика.
N5k-2 (конфигурация-fex) # интервал e1 / 9-10
N5k-2 (config-if-range) # группа-каналов 100
N5k-2 (config-if-range) # int po100
N5k-2 (config-if) # switchport mode fex-fabric
N5k-2 (config-if) # fex associate 100
N5k-2 (config-if) # int ethernet 100/1/1
N5k-2 (config-if) # группа каналов 10
N5k-2 (конфигурация-если) # int po10
N5k-2 (конфигурация-если) # vpc 10
N5k-2 (config-if) # switchport access vlan 101
В сценарии развертывания, показанном на рис. 5, расширитель коммутационной сети имеет двойное соединение с парой коммутаторов Cisco Nexus серии 5000.Большинство шагов настройки, связанных с vPC, такие же, как и в предыдущем примере, за исключением того, что интерфейсы фабрики на коммутаторах Cisco Nexus серии 5000 будут перемещены на vPC, а не на интерфейс хоста повторителя фабрики.
Рисунок 5. Пример конфигурации vPC: Fabric Extender с двойным подключением к коммутаторам Cisco Nexus серии 5000
N5k-1 (конфигурация-fex) # int e1 / 7-8
N5k-1 (config-if-range) # группа-каналов 100
N5k-1 (конфигурация-если-диапазон) # int po100
N5k-1 (конфигурация-если) # vpc 100
N5k-1 (config-if) # switchport mode fex-fabric
N5k-1 (config-if) # fex associate 100
Проверка конфигурации vPC
Используйте команды в таблице 2 для отображения информации о конфигурации vPC.
Таблица 2. Команды для проверки конфигурации vPC
Команда | Назначение |
показать элемент | Сообщает, включен ли vPC |
показать краткое описание vpc | Отображает краткую информацию о виртуальных ПК |
показать параметры согласованности vpc | Отображает состояние тех параметров, которые должны быть согласованы для всех интерфейсов vPC |
показать текущую конфигурацию vpc | Отображает информацию о текущей конфигурации для виртуальных ПК |
показать пропускную способность канала порта | Сообщает количество настроенных PortChannels и количество, которое все еще доступно на устройстве |
показать статистику vpc | Отображает статистику по виртуальным ПК |
показать vpc peer-keepalive | Отображает информацию о сообщениях поддержки активности однорангового узла |
показать роль vpc | Отображает статус однорангового узла, роль локального устройства, MAC-адрес системы vPC и системный приоритет, а также MAC-адрес и приоритет для локального устройства vPC |
Проверка совместимости конфигурации vPC
Многие параметры конфигурации и работы должны быть идентичны на всех интерфейсах vPC.Вы должны настроить каналы порта уровня 2, которые вы используете для однорангового канала vPC в режиме транка.
После включения функции vPC и настройки однорангового канала на обоих одноранговых устройствах vPC сообщения Cisco Fabric Services предоставляют копию конфигурации на локальном одноранговом устройстве vPC на удаленное одноранговое устройство vPC. Затем система определяет, отличаются ли какие-либо важные параметры конфигурации на двух устройствах.
Введите команду show vpc consistency-parameters, чтобы отобразить настроенные значения на всех интерфейсах в vPC.Отображаемые конфигурации – это только те конфигурации, которые препятствуют работе однорангового канала vPC и vPC.
С точки зрения совместимости vPC существует два разных типа параметров конфигурации. Первый тип параметров должен быть одинаковым на обоих коммутаторах vPC, и любое различие будет препятствовать работе однорангового канала vPC или vPC. Конфигурация второго типа параметров должна быть идентична на обоих коммутаторах; любые различия в этих параметрах приведут к нежелательному поведению.
Параметры конфигурации, которые должны быть идентичными
Параметры конфигурации, перечисленные в этом разделе, должны быть одинаково настроены на обоих устройствах однорангового канала vPC, иначе vPC перейдет в режим ожидания. Устройства автоматически проверяют совместимость некоторых из этих параметров на интерфейсах vPC. Параметры интерфейса должны быть согласованы для каждого интерфейса, а глобальные параметры должны быть согласованы глобально.
• Режим PortChannel
– включен, выключен или активен
• Скорость соединения на PortChannel
• Дуплексный режим на PortChannel
• Транковый режим на PortChannel
– Собственная VLAN
• Режим протокола связующего дерева
• Конфигурация области протокола связующего дерева для протокола множественного связующего дерева (MST)
• Включение или отключение состояния для каждой VLAN
• Глобальные настройки протокола связующего дерева
– Настройка моста
– Настройка типа порта (вы должны установить все интерфейсы vPC как сетевые порты)
– Настройки защиты от петель
• Настройки интерфейса протокола связующего дерева
– Настройка типа порта
– Защита петли
– Защита корней
• Конфигурация и параметры качества обслуживания (QoS)
– Управление приоритетным потоком (PFC)
– Организация очередей со строгим приоритетом и циклический алгоритм с дефицитом взвешивания (DWRR)
– Максимальный блок передачи (MTU)
Если какой-либо из этих параметров не включен или не определен ни на одном из устройств, проверка согласованности vPC игнорирует эти параметры.
Параметры конфигурации, которые должны быть идентичными
Если любой из следующих параметров не настроен одинаково на обоих одноранговых устройствах vPC, неправильная конфигурация может вызвать нежелательное поведение в потоке трафика:
• Таймеры устаревания MAC-адресов
• Статические записи MAC-адреса
• Все конфигурации и параметры списков управления доступом (ACL)
• Настройки интерфейса протокола связующего дерева
– Фильтр блока данных протокола моста (BPDU)
– Ограждение БПДУ
– Стоимость
– Тип звена
– Приоритет
– VLAN (быстрое связующее дерево для каждой VLAN [PVST +])
• Отслеживание протокола управления группами Интернет (IGMP)
Чтобы убедиться, что все параметры конфигурации совместимы, вы должны отобразить информацию о конфигурации для каждого однорангового устройства vPC после настройки vPC.
Расширенная сигнатура мутации APOBEC3A при раке
APOBEC3A способна дезаминировать сайты VpC в шпильках ДНК in vitro
Для систематического исследования активности дезаминирования APOBEC3A на различных структурированных и неструктурированных субстратах мы инкубировали экстракты клеток, экспрессирующих APOBEC3A. с панелью олигонуклеотидов ДНК и измерили каталитическую активность A3A in vitro 20 . Предыдущие отчеты 1,2,10,11,12,13,14,15,26 установили сильное предпочтение A3A 5′-T по сравнению со всеми другими предшествующими нуклеотидами, когда целевой субстрат является одноцепочечным.Наши результаты подтверждают это: например, неструктурированный (не шпилька) ДНК-субстрат с последовательностью 5′-TC показал умеренную активность в анализе активности, но изменение 5′-TC на 5′-AC отменяло активность (рис. 1). Более того, подтверждая нашу предыдущую работу, A3A демонстрирует заметно более сильную активность, когда TpC представлен на 3′-конце короткой петли шпильки, закрытой стабильно спаренным основанием стержнем. Этот сайт TpC шпильки является высокооптимальным субстратом для A3A, как мы ранее сообщали 20 .Однако мы были удивлены, увидев, что, когда мы тестировали 5′-AC в контексте шпильки, A3A продемонстрировал значительную и хорошо воспроизводимую ферментативную активность, даже выше, чем активность в отношении 5′-TC без шпильки (рис. 1). Мы протестировали дополнительные сайты шпильки VpC и наблюдали аналогичные уровни активности (дополнительный рис. 1A). Эти удивительные результаты предполагают ортогональные, комплексные влияния оптимальной первичной структуры (локальная последовательность ДНК) и вторичной структуры (шпилька ДНК) на активность A3A.Наконец, чтобы убедиться, что активность A3A действительно является лимитирующим этапом в нашем анализе in vitro и что разница в активности A3A на шпильках ДНК не является результатом дифференциальной активности урацил-ДНК-гликозилазы (UDG), модулируемой структурами этих субстратов. мы протестировали синтетические урацил-содержащие ДНК-субстраты в анализе расщепления. Как субстрат, не являющийся шпилькой, так и субстрат шпильки были расщеплены количественно в условиях анализа (дополнительный рис. 1B), подтверждая, что наш анализ не ограничен по скорости активностью UDG и обеспечивает точное считывание уровней активности APOBEC.
Рис. 1: Первичная последовательность и вторичная структура вносят дополнительный вклад в оптимальность субстрата APOBEC3A.Сравниваются четыре субстрата, каждый из которых является версией шпильки ДНК в гене NUP93 человека. Анализ активности APOBEC3A in vitro показывает, что оптимальность субстрата APOBEC3A увеличивается по мере улучшения последовательности ДНК (изменение сайта ApC на сайт TpC), а также по мере улучшения структуры ДНК (изменение сайта без шпильки на сайт шпильки). ).Наибольшая активность наблюдается, когда последовательность и структура оптимальны. Исходные данные представлены в виде файла исходных данных.
Опухоли APOBEC + накапливают мутации в сайтах VpC в образующих шпильку последовательностях
Способность A3A дезаминировать не-TpC сайты в шпильках ДНК in vitro побудила нас повторно исследовать, накапливаются ли мутации C → (T / G) в сайтах, не являющихся TpC в образующих шпильку последовательностях у пациентов с высоким уровнем мутаций APOBEC. Мы проанализировали коллекцию опубликованных полногеномных и экзомно-секвенированных опухолей различных типов рака и оценили их мутационные спектры и частоту мутаций в различных геномных контекстах.Мы сконцентрировались на группе пациентов с убедительными доказательствами мутационных историй, опосредованных APOBEC, используя неотрицательную матричную факторизацию (NMF) для разложения сигнатур мутаций 1,2 и определяя как APOBEC + те опухоли, которым присвоено не менее 50% мутаций. к сигнатуре мутации APOBEC. Мы агрегировали статистику мутаций по разрозненным геномным сайтам, имеющим вторичные структурные характеристики, независимо от предшествующего нуклеотида, чтобы исследовать, как шпильковая зависимость мутабельности A3A на сайтах TpC может быть распространена на контексты VpC.В нашей предыдущей работе мы показали, что частота мутаций APOBEC3A на сайтах TpC увеличивается с увеличением прочности стержня шпильки (здесь определяется как #AT basepairs + 3 × #GC basepairs). В нашем расширенном анализе всех цитозинов мы обнаружили, что эта зависимость сохраняется также и для сайтов VpC (Fig. 2A). Мы также наблюдали те же предпочтения для меньших размеров петель и 3′-позиционирования внутри петли для сайтов VpC, что и для TpC (рис. 2B). Примечательно, что все три возможные последовательности VpC (ApC, CpC, GpC) показали увеличение скорости мутаций в сильных шпильках (дополнительный рис.2A), и все 16 возможных трилуг NNC продемонстрировали эффект (дополнительный рисунок 2B). В целом сайты TpC имеют более высокую частоту мутаций, чем сайты VpC в том же структурном контексте. Однако сайты VpC в оптимальных шпильках демонстрируют значительно более высокую частоту мутаций, чем сайты TpC в линейной ДНК или субоптимальных шпильках. Эти результаты подтверждают, что активность A3A на конкретном субстрате ДНК нельзя предсказать, просто глядя на идентичность 5′-основания, но вместо этого необходимо учитывать как первичную, так и вторичную структуры.
Рис. 2: Сайты VpC и сайты TpC демонстрируют сходные паттерны мутабельности.A Относительная частота мутаций в образцах опухолей APOBEC + увеличивается с увеличением силы потенциала спаривания оснований шпильки как для геномных сайтов TpC, так и для геномных сайтов ApC, CpC и GpC (вместе известных как сайты VpC). Планки погрешностей представляют собой 95% доверительные интервалы. B Частота мутаций уменьшается с размером петли шпильки и требует оптимального позиционирования цитозина внутри петли как для сайтов TpC, так и для VpC.Планки погрешностей представляют собой 95% доверительные интервалы. C Анализ активности APOBEC3A in vitro показывает, что оптимальность субстрата APOBEC3A определяется совместно последовательностью и структурой как для сайтов TpC, так и для VpC. Исходные данные представлены в виде файла исходных данных.
Для дальнейшего изучения того, может ли A3A быть ответственным за мутации шпильки VpC в опухолях, мы протестировали множество дополнительных сайтов TpC и VpC в нашем анализе активности A3A in vitro и показали, что оба класса сайтов включают примеры как хороших, так и плохих субстратов. для A3A (рис.2С). Шпильки с последовательностью VpC могут быть лучшими субстратами для A3A, чем линейные субстраты с последовательностью TpC или шпильки с неблагоприятно расположенной последовательностью TpC. Тем не менее, последовательности TpC всегда являются лучшими субстратами для A3A, чем последовательности VpC в том же структурном контексте.
Вместе наш вычислительный анализ мутаций VpC в опухолях APOBEC + и наши биохимические исследования in vitro показывают, что 5′-расположенный тимин не является абсолютно необходимым для создания субстрата A3A.Сильное структурное предпочтение A3A по отношению к цитозинам в оптимальных шпильках может перекрывать предпочтение последовательности для TpC in vitro и в опухолях.
Примечательно, что многие мутации C → T в шпильках VpC ранее были классифицированы как обусловленные сигнатурой старения 1 . Наши результаты предполагают, что некоторые из этих мутаций в опухолях APOBEC + возникают из-за активности APOBEC. Мы вычислили процент мутаций C → T в последовательностях VCG в каждой опухоли, которые находились в высокооптимальных шпильках. Обычно он был низким (<1%), но был повышен в меньшинстве опухолей, достигая 5% (дополнительный рис.3А). Из 36 опухолей выше 1% половина приходилась на рак груди, затем следовали пять опухолей мочевого пузыря и три аденокарциномы легких. Эти три типа опухолей являются одними из наиболее обогащенных APOBEC типов опухолей, что подтверждает мутагенез APOBEC в качестве своего источника. Некоторые из них имеют повышенную экспрессию APOBEC3A и / или APOBEC3B, но некоторые нет (Supplementary Fig. 3B). Недавно мы показали 18 , что сигнатура мутации APOBEC является плохим предиктором экспрессии APOBEC3A / B в опухолях, потому что, хотя мутации APOBEC являются постоянной записью в геноме раковой клетки, экспрессия APOBEC может быть временной, возвращаясь к исходному уровню после мутагенных эпизодов 4 .
Анализируя асимметрию мутационной цепи, мы и другие ранее 27,28,29,30 сообщили, что APOBEC-ассоциированные мутации TpC обогащены репликативной матрицей отстающей цепи (LGST) по сравнению с шаблоном ведущей цепи (LDST). ), предполагая, что они происходят во время репликации ДНК. Напротив, между транскрибируемыми и нетранскрибируемыми цепями ДНК в транскрибируемых областях генома было небольшое смещение. Мы повторили этот анализ на APOBEC-ассоциированных мутациях VpC (дополнительный рис.4) и обнаружили, что они демонстрируют ту же ассоциацию с репликацией, но не ассоциируют с транскрипцией или хрупкими сайтами 31 , тот же паттерн, что и связанные с APOBEC мутации TpC, предполагая, что как TpC, так и VpC мутации возникают в основном во время репликации ДНК.
Мутации в сайтах шпильки VpC обусловлены APOBEC3A, а не APOBEC3B
Продемонстрировав повышенную частоту мутаций шпилек VpC в опухолях APOBEC + и способность A3A изменять шпильки VpC in vitro, мы затем спросили, является ли A3A основным драйвером VpC мутации шпилек в опухолях.Ранее мы 20 охарактеризовали опухоли APOBEC + по их характеру A3A по сравнению с A3B, используя установленную метрику 32 . Это дает Y-образный «птичий участок» (рис. 3A), который отделяет опухоли с доминированием A3B (левое крыло) от опухолей с доминированием A3A (правое крыло) от APOBEC-отрицательных опухолей (тело). Мутации в сайтах TpC в шпильках обогащены в опухолях с доминированием A3A (красные точки, рис. 3B). Точно так же мутации в сайтах VpC в шпильках также обогащены в опухолях с доминированием A3A (пурпурные точки, рис.3С). Поразительно, что не наблюдается обогащения мутаций шпильками в опухолях с доминированием A3B, ни для шпилек TpC (как ранее сообщалось, 20 ), ни для шпилек VpC. Наконец, мы наблюдали, что опухоли с высоким содержанием шпилечных мутаций TpC – это точно такие же опухоли, демонстрирующие высокое обогащение шпилечных мутаций VpC (рис. 3D), подтверждая, что два класса шпилечных мутаций тесно связаны, и подтверждая, что A3A является единственной причиной. обоих.
Рис. 3. Мутации шпильки в сайтах VpC и TpC вызываются APOBEC3A, а не APOBEC3B.A Набор опухолей, секвенированный с помощью WGS, был стратифицирован по двум параметрам: ось y отделяет опухоли APOBEC- (внизу) от опухолей APOBEC + (вверху), а ось x отделяет опухоли с высоким A3B. символ (слева) от тех, с высоким символом A3A (справа). Точки раскрашены по типу опухоли (легенда справа). B Когда опухоли окрашены фракцией мутаций APOBEC, встречающихся в шпильках TpC, ясно, что опухоли, обогащенные мутациями шпильки TpC (красный цвет), как правило, представляют собой образцы APOBEC + с доминированием A3A. C Когда опухоли окрашены фракцией мутаций APOBEC, встречающихся в шпильках VpC, очевидна та же картина: опухоли с наивысшими уровнями мутаций шпильки VpC (пурпурный), как правило, являются опухолями с доминированием A3A. D Шпильчатые мутации TpC и VpC тесно связаны: опухоли, обогащенные одной, обогащены обеими, что позволяет предположить, что A3A является общей причиной обоих. E Сравнение активности A3A и A3B в отношении олигонуклеотидов ДНК, представляющих нешпильчатые TpC-сайты и шпильчатые VpC-сайты.Активность A3A наблюдается на всех субстратах, но активность A3B не наблюдается на сайтах VpC. Исходные данные представлены в виде файла исходных данных.
Затем, чтобы подтвердить, что A3A, а не A3B, генерирует мутации в сайтах шпильки VpC, мы сравнили in vitro активность A3A и A3B на панели олигонуклеотидов ДНК. Мы использовали субстраты TpC без шпилек для определения количеств A3A и A3B, демонстрирующих сравнимые уровни активности APOBEC (фиг. 3E, два оставленных субстрата). Когда эти количества A3A и A3B были протестированы на субстратах VpC шпильки, только A3A, но не A3B проявили активность (рис.3E, две правые подложки). Мы также показали ту же картину с использованием эндогенной активности APOBEC. Клеточная линия плоскоклеточной карциномы глотки человека BICR6 экспрессирует низкие уровни A3A на исходном уровне и показала низкую активность на субстрате шпильки VpC (дополнительные фиг. 5A, B). Однако стимуляция клеток гемцитабином и интерфероном альфа (GEM / IFNα) резко увеличивала количество белка A3A и увеличивала расщепление субстратов шпильки VpC до десяти раз (дополнительные рис. 5A – D). Эффект устранялся совместным введением небольшой мешающей РНК, специфичной против A3A (siA3A), возвращая уровни расщепления к исходному уровню.Эти результаты подтверждают наши выводы о том, что A3A отвечает за наблюдаемую активность в сайтах шпильки VpC. Напротив, высокие уровни эндогенного A3B в клетках BICR6 не обнаруживают активности на сайтах шпилек VpC, но сильную активность на сайтах TpC без шпилек, что аннулируется обработкой siRNA против A3B (Supplementary Fig. 5E-G). Мы подтвердили этот результат, используя клеточную линию остеосаркомы человека U2OS, которая не экспрессирует обнаруживаемый A3A и высокие уровни A3B (дополнительный рисунок 5H). При нормализованном уровне A3B клеточные экстракты из клеток U2OS и BICR6 проявляли аналогичную активность на сайтах TpC без шпилек, тогда как экстракт клеток U2OS не проявлял активности на сайтах шпилек VpC (дополнительный рис.5Н, I).
APOBEC3A человека проявляет активность в сайтах VpC в
геноме E. coliНаблюдая активность A3A в неканонических сайтах VpC в шпильках ДНК in vitro и мутации в сайтах VpC в образующих шпильки последовательностях в опухолях, мы затем исследовали лабораторная модель активности A3A in vivo: бактериальные клетки, экспрессирующие фермент A3A человека. Ранее мы описали метод обогащения и секвенирования фрагментов ДНК, содержащих урацилы (UPD-seq). Мы применили этот метод к A3A-экспрессирующим E.coli клеток 21 . Урацилы, созданные A3A в различных положениях генома, были количественно определены путем вычисления индекса урациляции (UI), который является количественной мерой частоты, с которой любой цитозин в геноме превращается в урацил посредством A3A. Этот анализ показал, что UI на TpC в пределах предсказанных петель шпильки увеличивался с увеличением прочности ствола и был самым высоким для трилупов с целевым цитозином на 3′-стороне петли (дополнительный рис. 6A), точно соответствуя паттернам, о которых мы сообщали ранее для активности A3A. в синтетических олигонуклеотидах и опухолях человека.Когда эти анализы были расширены на последовательности VpC в геноме E. coli , самые высокие значения UI были обнаружены для сайтов VpC в петлях шпильки с наивысшей прочностью стержня, в которых цитозин был расположен на 3′-стороне трехпутной петли. Сайты VpC в сильных шпильках показали в четыре раза больше урациляции по сравнению с сайтами VpC без шпилек (фиг. 4A), и этот эффект был замечен для всех четырех возможных 5′-нуклеотидов (фиг. 4B). Этот эффект не наблюдался при анализе клеток, экспрессирующих каталитически неактивный точечный мутант A3A или содержащих пустой вектор (дополнительный рис.6Б). Это показывает, что, хотя величина UI намного больше для сайтов TpC в 3-нуклеотидных шпильках, чем для сайтов VpC даже для сильных шпилек (рис. 4A, B, верхние панели), A3A предпочитает цитозины в обеих этих группах сайтов по сайтам. в более крупные петли. Как отмечалось ранее –21 , эффект шпильки на TpC был сильнее для цитозинов, расположенных на LGST во время репликации, чем для LDST (фиг. 4B, нижние панели). Расширяя анализ асимметрии цепи до последовательностей VpC, мы обнаружили, что это также верно для сайтов ApC, CpC и GpC, увеличиваясь до восьми раз для цитозинов на 3′-стороне трилопа (рис.4А, Б, нижние панели). В совокупности эти результаты подтверждают, что A3A может проявлять активность на сайтах, которые ранее не считались субстратами для активности A3A, а именно в последовательностях VpC, представленных в петлях шпильки. Мы рассматриваем эту подпись шпильки VpC как завершающую расширенную подпись APOBEC3A и предоставляем новый программный инструмент ApoHP для количественной оценки шпилек и мутаций шпилек.
Рис. 4: APOBEC3A может дезаминировать участки VpC в бактериях.A Относительная активность APOBEC3A, измеренная как индекс урациляции (UI), в цитозинах в последовательностях VpC в предсказанных петлях шпильки в геноме E.coli . Повышенная активность цитозинов наблюдается в трилопе NVC (звездочки), но только на матрице отстающей цепи (LGST). B Сравнение относительной активности APOBEC3A в последовательностях VpC. Повышенная активность наблюдается на сайтах VpC в петлях сильно спаренных шпилек (звездочки). Активность на сайтах VpC шпильки в несколько раз выше, чем на сайтах TpC без шпилек. Активность в сайтах TpC шпильки намного выше, чем у сопоставимых сайтов VpC. Исходные данные представлены в виде файла исходных данных.
Драйверные и пассажирские мутации в сайтах VpC в опухолях APOBEC +
Если сайты VpC в шпильках ДНК действительно являются субстратами для A3A в опухолях, то можно ожидать повторения мутаций в этих сайтах в опухолях APOBEC +. Мы исследовали 100 самых часто мутирующих пар оснований C: G, включая сайты TpC и VpC, в нашей когорте APOBEC + (рис. 5). Как отмечалось ранее, многие из основных повторяющихся мутаций TpC не входят в известные драйверные гены, но находятся в оптимальных шпильках. Эти сайты TpC, вероятно, являются очагами мутаций-пассажиров из-за их высокой субстратной оптимальности для A3A.Мы также наблюдаем несколько горячих точек мутации VpC в генах, о которых не известно, что они дают преимущество в пригодности, в сайтах, которые, как предполагается, являются высокооптимальными субстратами A3A из-за благоприятного расположения цитозина на 3′-конце короткой петли, закрытой прочно спаренной ножкой. Например, часто встречаются мутировавшие сайты шпильки ApC в ADGRG6 (также называемом GPR126 ) и PLEKHS1 . Эти горячие точки, вероятно, являются предпочтительными мишенями для A3A, которые легко мутировать из-за их оптимальной вторичной структуры.Дополнительные примеры рекуррентно мутировавших шпилек VpC показаны на дополнительном рисунке 7. Эти горячие точки иллюстрируют, что предпочтения субстрата для A3A in vivo шире, чем первоначально предполагалось, и что многие из локусов с наиболее часто повторяющейся мутацией в опухолях APOBEC + можно правильно объяснить как пассажира. мутации горячих точек, вызванные предпочтением A3A шпилькам.
Рис. 5: Точки доступа VpC для пассажиров.100 самых горячих точек мутаций в наборе опухолей APOBEC +. Ось x представляет оптимальность субстрата, ожидаемую частоту мутаций относительно базовой скорости мутаций на всех линейных сайтах TpC.Ось y представляет количество пациентов в этой когорте, несущих мутацию в этом сайте. Горячие точки на оптимальных подложках шпильки для APOBEC3A ( x ≥ 4), вероятно, являются горячими точками для пассажиров, тогда как горячие точки на обычных сайтах ( x <4) являются известными или вероятными драйверами. Горячие точки VpC в PLEKHS1 и ADGRG6 (также называемые GPR126 ) теперь могут считаться оптимальными горячими точками APOBEC3A, несмотря на их неканоническую первичную последовательность. Исходные данные представлены в виде файла исходных данных.
В отличие от повторяющихся мутаций VpC в оптимальных шпильках, многие другие повторяющиеся мутации VpC находятся на сайтах, не являющихся шпильками, в известных генах-драйверах, таких как KRAS и TP53. Эти сайты имеют низкую прогнозируемую оптимальность субстрата по сравнению с частотой мутаций фонового линейного субстрата TpC. Это обычные участки без особых структурных свойств, обеспечивающих оптимальную подложку формата A3A.
Расширенная сигнатура мутации APOBEC3A помогает объяснить геномный Парадокс близнецов
Наше расширенное определение предпочтений субстратов A3A проливает свет на геномный парадокс близнецов, показывая, что эти горячие точки близнецов, вероятно, полностью вызваны APOBEC.В частности, наша статистика опухолей in vivo предлагает модель, в которой возникновение первой мутации, за которой следует репликация ДНК и деление клеток, приводит к распространению мутации на противоположную цепь, что приводит к снижению пригодности этой цепи для A3A, и снижение вероятности возникновения второй мутации (рис. 6A, B). Короче говоря, первая мутация препятствует возникновению второй. Эта модель подтверждается нашими биохимическими экспериментами in vitro с использованием серии синтетических ДНК-олигонуклеотидов, моделирующих двойную горячую точку PLEKHS1 (рис.6С). Мы обнаружили, что сайт VpC в последней позиции петли шпилек двойных горячих точек наиболее изменчив с гуанином в первой позиции петли, то есть в эталонной конфигурации петли. Важно отметить, что мутация нуклеотида TpC в первом положении петли посредством мутагенеза A3A резко снижает мутабельность соседнего сайта VpC. Таким образом, эти анализы in vitro повторяют A3A-опосредованный мутагенез в двойной горячей точке, подтверждая, что оба сайта TpC и VpC являются эффективными субстратами A3A.Более того, когда мутация в TpC становится постоянной благодаря репликации ДНК, она подавляет возникновение мутации в сайте VpC, что объясняет, почему эти пары мутаций редко, а возможно, никогда не наблюдаются в cis в горячей точке близнецов, и разрешает Геномный Парадокс Близнецов: это просто пары близко расположенных «горячих точек» A3A для пассажиров.
Рис. 6: Горячая точка двойной мутации, сочетающая оптимальные сайты TpC и VpC.Горячая точка близнецовой мутации, обнаруженная в гене PLEKHS1 , содержит оптимальный субстрат шпильки на каждой цепи ДНК. A На одной цепи ДНК шпилька содержит последовательность GAAC, а C в последнем положении является оптимальным субстратом VpC для A3A. B На другой цепи ДНК шпилька содержит последовательность GTTC, а C в последнем положении является оптимальным субстратом TpC для A3A. Однако, когда A3A генерирует мутацию в сайте любой цепи, и клетка проходит через репликацию ДНК, тогда мутация распространяется на комплементарную цепь в первом (5 ’) положении петли. Эта мутация приводит к тому, что локальный контекст последовательности больше не является оптимальным, что приводит к снижению наблюдаемой частоты мутаций в опухолях (столбчатые диаграммы).Планки погрешностей представляют собой 95% доверительные интервалы. C Анализ APOBEC3A in vitro подтверждает активность в последовательности петли шпильки GAAC. Переход на AAAC или CAAC снижает оптимальность субстрата, нарушая оптимальную последовательность GAAC. Исходные данные представлены в виде файла исходных данных.
Открытие и характеристика малых молекул, нацеленных на ДНК-связывающий домен ETS ERG при раке простаты
ВВЕДЕНИЕ
Несмотря на неоднородность заболевания, появление полногеномной аналитики начало обнаруживать спектр повторяющихся геномных изменений, которые могут напрямую влияют на прогрессирование и исход заболевания рака простаты (РПЖ) [1, 2].Первые выявленные и наиболее распространенные генетические нарушения, встречающиеся у ~ 50% пациентов с РПЖ, связаны с меж- или внутрихромосомными перестройками, которые приводят к слиянию элемента ответа ДНК андрогенного рецептора (AR) трансмембранной протеазы серина 2 ( TMPRSS2 ) с вариабельные открытые рамки считывания члена семейства ETS, связанного с ETS гена ERG [3]. Обычно ERG не экспрессируется эпителиальными клетками предстательной железы, но слияние с промотором TMPRSS2 вызывает аберрантную AR-управляемую экспрессию ERG , что делает его одним из наиболее часто сверхэкспрессируемых генов при РПЖ.ERG, как известно, в норме регулирует дифференцировку эндотелиальных и гематопоэтических клеток [4], и был вовлечен как движущая сила подмножеств сарком Юинга, лейкозов и примитивных опухолей нейроэктодермы [5]. Обнаружение реаранжировок TMPRSS2-ERG примерно в 20% интраэпителиальных новообразований предстательной железы высокой степени злокачественности позволяет предположить, что эти транслокации происходят на ранней стадии заболевания [6]. В то время как клиническое значение перестройки TMPRSS2-ERG в РПЖ остается спорным, многие исследования связывают пациентов с этими перестройками с плохим исходом заболевания [7, 8].Такие наблюдения стимулировали усилия по созданию неинвазивных скринингов на транслокаций TMPRSS2-ETS отдельно или в сочетании с другими биомаркерами простаты для улучшения стратификации риска у мужчин с диагнозом РПЖ [9, 10].
ERG был задействован как онкогенный узел, который модулирует фенотипы, связанные с РПЖ, включая нарушение программы дифференцировки эпителия через дисрегуляцию AR [11], активацию c-Myc, эпигенетическое репрограммирование через EZh3 [12] и продвижение геномной нестабильности через Нарушение регуляции PARP [13].Более того, сверхэкспрессия ERG приводит к перепрограммированию транскрипции эпителия простаты, что способствует эпителиально-мезенхимальному переходу (EMT) и позволяет трансформированным клеткам приобретать миграционные и инвазивные характеристики [11, 14]. Кроме того, экспрессия ERG часто реактивируется при резистентном к кастрации РПЖ (CRPC) и связана с повышенным шансом резистентности к таксановой терапии [15, 16]. В то время как экспрессия ERG изначально управляется AR посредством слияния с андроген-чувствительными промоторами, сообщалось о самоуправляемой прямой регуляции оставшегося аллеля ERG дикого типа [17].Недавно было показано, что инактивирующие мутации в E3 ubiquitin ligase SPOP уменьшают деградацию ERG, что приводит к повышенным уровням ERG дикого типа [18, 19]. Таким образом, накопление мутантных белков ERG и белков ERG дикого типа, первоначально управляемых AR, которые позже становятся самоподдерживающимися в сочетании с мутациями в SPOP , представляет собой новый механизм, который может способствовать устойчивости к ингибиторам пути AR и, благодаря устойчивая индукция EMT для прогрессирования заболевания при CRPC.
Доказательства того, что экспрессия ERG при РПЖ является критическим фактором, влияющим на развитие, прогрессирование и метастазирование РПЖ [7, 8], делают его многообещающей мишенью для лекарств. Возможность прямого нацеливания на ERG была впервые продемонстрирована с помощью небольшой молекулы YK-4-279, идентифицированной в результате скрининга поверхностного плазмонного резонанса коллекции малых молекул из Программы нацеливания лекарственных средств Национального института рака для нарушения связывания РНК-геликазы A с Фактор ETS, FLI1, при саркоме Юинга [20]. Сообщалось также, что YK-4-279 противодействует активности ERG, хотя его точный способ связывания ETS еще не определен [21].В то время как YK-4-279 находится в стадии клинической разработки для лечения саркомы Юинга, сообщалось о проблемах, связанных с токсичностью и фармакокинетикой [22]. Таким образом, в настоящее время нет одобренных лекарств, которые непосредственно нацелены на ERG или любой другой член семейства ETS [4, 23].
Мы выдвинули гипотезу, что использование рационального подхода к разработке лекарств, поддерживаемого методами скрининга in vitro и in vivo , может идентифицировать небольшие молекулы, которые непосредственно нацелены на ДНК-связывающий домен ETS ERG и тем самым ингибируют метастатический потенциал ERG- положительный РПЖ.Здесь мы сообщаем об использовании установленного конвейера открытия лекарств [24], который объединяет in silico предсказаний с in vitro и in vivo экспериментами для идентификации нового класса анти-ERG соединений. Мы демонстрируем, что ведущее соединение против ERG, VPC-18005, ингибирует ERG-индуцированную транскрипцию и взаимодействует непосредственно с доменом ERG-ETS и нарушает связывание ERG с ДНК. Кроме того, соединение снижает скорость миграции и инвазии ERG-сверхэкспрессирующих клеток и ингибирует метастазирование в моделях ксенотрансплантатов рыбок данио.Эти результаты демонстрируют, что обнаруженное соединение и его производные могут быть разработаны в качестве терапевтических вариантов для смягчения прогрессирования заболевания у мужчин с ERG-экспрессирующим раком простаты и, в конечном итоге, привести к повышению выживаемости для мужчин с запущенным заболеванием.
РЕЗУЛЬТАТЫ
Открытие малых молекул, которые нацелены на ДНК-связывающий домен ETS белка ERG
Существует множество слияний TMPRSS2-ERG , которые кодируют транскриптов ERG . В то время как большинство продуцируют белки ERG с укороченными аминогруппами, все они сохраняют C-концевой ДНК-связывающий домен ETS [8].Этот ДНК-связывающий домен ETS необходим для того, чтобы ERG функционировала как прямой регулятор транскрипции, и структурные данные доступны для его комплекса с ДНК. Таким образом, мы пришли к выводу, что можем использовать подходы in silico для идентификации небольших молекул, нацеленных на домен ETS. Таким образом, такие молекулы должны ингибировать транскрипционную активность всех функциональных мутантных белков ERG, противодействуя их способности взаимодействовать с ДНК. Это, в свою очередь, может нарушить ERG-опосредованные трансформационные события, участвующие в развитии и прогрессировании РПЖ.
Основанный на структуре подход виртуального скрининга, ранее разработанный для нацеливания на интерфейсы белок-ДНК и белок-белок [24], был применен к кристаллической структуре домена ERG-ETS с разрешением 1,7Å [PDB ID: 4IRG] [25]. Интерфейс связывания ДНК был идентифицирован по кристаллической структуре с разрешением 2,8 Å соответствующего комплекса ERG-ДНК [PDB ID: 4IRI] (рис. 1A). Домен ERG-ETS содержит мотив крылатой спирали-поворот-спираль со спиралью α3, расположенной внутри большой бороздки ДНК, содержащей родственную последовательность GGAA [25].С помощью виртуальных атомных зондов был идентифицирован верхний ранжируемый лекарственный поверхностный карман, который частично перекрывает этот интерфейс ERG-ДНК (рис. 1B). Идентифицированный карман находится рядом со спиралью узнавания ДНК (α3), и поэтому было предсказано, что небольшая молекула, связанная в этом сайте, будет конкурентно блокировать связывание ДНК. Три миллиона химических структур, полученных из базы данных ZINC [26], были индивидуально состыкованы в этом кармане. Комбинируя баллы стыковки, позы связывания, консенсусное голосование и свойства лекарственного средства (подробно описанные в разделе «Материалы и методы»), исходный набор из 48 соединений, представляющих 45 различных химических классов, был выбран для анализа in vitro .
Рисунок 1: ERG как лекарственная мишень и открытие VPC-18005. ( A ) Лента, представляющая кристаллическую структуру комплекса ERG-ETS / ДНК [PDB ID: 4IRI], выделяющая мотив крылатой спирали-поворот-спираль домена ETS со спиралью α3 (красная), расположенной внутри большой бороздки ДНК (голубой). ( B ) Слева: карман домена ERG-ETS (показан серой молекулярной поверхностью), который был идентифицирован виртуальными атомными зондами (красные сферы) и использовался для скрининга 3 миллионов малых молекул из базы данных ZINC.Основа ДНК (голубая) показана в иллюстративных целях, но не включена в виртуальный скрининг. Справа: конвейер виртуального скрининга, выделяющий шаги, предпринятые для определения лучших кандидатов для продвижения в экспериментов in vitro (M = миллион; K = тысячи). ( C ) Вестерн-блоттинг лизатов из показательных клеточных линий рака простаты. Уровни ERG (верхняя панель) показаны относительно альфа-тубулина в качестве контроля нагрузки (нижняя панель). ( D ) Люциферазная активность ведущего кандидата VPC-18005 (красная полоса) при 25 мкМ показана по сравнению с другими соединениями, идентифицированными в результате виртуального скрининга.Данные представлены как среднее значение ± стандартная ошибка среднего для 4 технических повторов и выражены как процент активности люциферазы относительно контроля ДМСО. ( E ) Прямоугольная диаграмма иллюстрирует распределение баллов стыковки для 3 миллионов малых молекул, стыкованных в кармане ERG-ETS, и VPC-18005, набравшего верхние 0,01%. ( F ) Дозозависимый эффект VPC-18005 (концентрация среды 0,1–100 мкМ) в клетках PNT1B-ERG (незакрашенный квадрат) и VCaP (закрашенный круг) на ERG-опосредованную активность люциферазы с IC 50 (половина максимальные ингибирующие концентрации) значения 3 мкМ и 6 мкМ соответственно.Данные представлены как среднее значение ± стандартная ошибка среднего для 4 технических повторов и выражены как процент активности люциферазы (Люцифераза / Renilla) относительно контроля ДМСО. Данные были подогнаны с использованием программного обеспечения GraphPad Prism 6 для расчета кривых зависимости ответа от дозы log 10 (концентрация ингибитора) в зависимости от ответа. ( G ) Дозозависимый эффект YK-4-279 (концентрация среды 0,1 – 100 мкМ) в клетках PNT1B-ERG (незакрашенный квадрат) и VCaP (закрашенный кружок) на ERG-опосредованную активность люциферазы, со значениями IC 50 5 мкМ и 16 мкМ соответственно.Данные из 4 технических повторений представлены и соответствуют, как показано на Рисунке 1F. ( H ) Жизнеспособность клеток (MTS) экспрессирующих ERG клеток (PNT1B-ERG (кружок) и VCaP (квадрат)) и клеток, не экспрессирующих ERG (PC3 (треугольник)), после обработки 0,2-25 мкМ VPC-18005 (закрашенная красная фигура) или опубликованный ингибитор YK-4-279 (открытая синяя фигура) в течение 72 часов. Влияние на жизнеспособность представлено как среднее значение ± стандартная ошибка среднего для 3 технических повторов и выражено в процентах от оптической плотности по отношению к контролю ДМСО.
Чтобы оценить биологическую активность против ERG соединений, идентифицированных выше, мы сначала оценили экспрессию ERG в панели линий клеток простаты (рис. 1C).Мы подтвердили экспрессию белка ERG в клетках VCaP (эндогенная сверхэкспрессия) и PNT1B-ERG (стабильная сверхэкспрессия ERG [14]). Напротив, клетки PC3, PNT1B и PNT1B-Mock были отрицательными по экспрессии ERG [14, 27]. Каждое из соединений сначала оценивали в клетках PNT1B-ERG в концентрациях 10 мкМ и 25 мкМ на предмет его способности ингибировать транскрипционную активацию ERG временно трансфицированного, полученного из промотора эндоглина E3 [28], ETS-чувствительного репортера люциферазы светлячка (pETS -luc) конструкция, содержащая 3 консервативных мотива узнавания ETS (GGAA).Репрезентативный пример 5 соединений, которые показали подавление репортера люциферазы на 20% -60%, указаны на рисунке 1D. Соединение VPC-18005 было идентифицировано как наиболее сильный ингибитор активности люциферазы из этого начального набора. Оценка молекулярной стыковки VPC-18005 заняла первое место среди 0,01% всех 3 миллионов молекул, оцененных в виртуальном скрининге, обсужденном ранее (рис. 1E). Прежде чем приступить к углубленному анализу, были оценены растворимость среды и стабильность VPC-18005 (дополнительный рисунок 1).VPC-18005 был растворим в среде и оставался стабильным в течение как минимум 3 дней (93%). Для сравнения, опубликованный ингибитор YK-4-279 был растворимым, но менее стабильным (60%). Для оценки эффективности VPC-18005 был проведен более тщательный анализ реакции на дозу с использованием клеток VCaP и PNT1B-ERG. Было обнаружено, что VPC-18005 ингибирует активность репортера pETS-luc в клетках PNT1B-ERG и VCaP со значениями IC 50 3 и 6 мкМ, соответственно (рис. 1F). Для сравнения, YK-4-279 [21] показал значения IC 50 5 мкМ и 16 мкМ в анализах репортера ETS-Luc на основе клеток PNT1B-ERG и VCaP, соответственно (рис. 1G).
Чтобы оценить, связана ли подавленная активность репортера pETS-luc цитотоксичностью, в течение 72 часов (ч) был проведен анализ MTS для измерения влияния соединений на жизнеспособность клеток (рис. 1H). Обработка VPC-18005 (0,2-25 мкМ) не снижала жизнеспособность ни ERG-экспрессирующих клеток (PNT1B-ERG и VCaP), ни не-ERG-экспрессирующих (PC3) клеток простаты. Предыдущие сообщения предполагают, что IC 50 для цитотоксичности YK-4-279 составляет 10 мкМ для клеток VCaP и> 100 мкМ для клеток PC3 [21].Однако в этом исследовании мы наблюдали опосредованное YK-4-279 ингибирование жизнеспособности клеток как в линиях клеток, экспрессирующих ERG, так и в линиях, не экспрессирующих ERG, при дозах ≥ 5 мкМ (рис. 1H). Был проведен анализ клеточного цикла, который подтвердил результаты анализа жизнеспособности (дополнительная фигура 2А). В то время как VPC-18005 не влиял на распределение клеточного цикла, YK-4-279 существенно увеличивал популяцию sub-G 0 при дозах 5 и 10 мкМ ( p = 0,003 и 0,003, соответственно). Популяция фазы G 0 –G 1 одновременно уменьшалась после обработки 5 и 10 мкМ YK-4-279 ( p = 0.003 и 0,006 соответственно). Анализ клеток в реальном времени показал, что VPC-18005 не подавлял пролиферацию и не индуцировал гибель клеток (дополнительный рисунок 2B). Наблюдали дозозависимый эффект YK-4-279 на рост клеток (дополнительная фигура 2С), и наблюдали, что клетки имели измененную морфологию, что указывает на токсичность и гибель клеток.
Чтобы дополнительно оценить, оказывает ли VPC-18005 какой-либо неспецифический клеточный эффект, анализы люциферазы были выполнены в клетках PNT1B-MOCK и -ERG, обработанных увеличивающимися концентрациями VPC-18005 (дополнительный рисунок 3A), и VPC-18005 оказал минимальное влияние на репортерный сигнал в клетках PNT1B-MOCK по сравнению с клетками PNT1B-ERG.Кроме того, сверхэкспрессия белка ERG при обработке R1881 противодействовала ингибированию VPC-18005 в анализе люциферазы (дополнительная фигура 3B). VPC-18005 был также протестирован против репортера люциферазы андрогенового рецептора (ARR 3 tk-luc) и не показал значительного влияния на экспрессию репортера (дополнительный рисунок 3C). В совокупности эти результаты показали, что VPC-18005 может подавлять активность репортера ERG, не проявляя явной цитотоксичности.
Прямое связывание VPC-18005 с доменом ERG-ETS
Химическая структура VPC-18005 изображена на рисунке 2A.Используя методы компьютерного моделирования, предсказанная поза связывания VPC-18005 была визуализирована более подробно внутри целевого кармана в домене ERG-ETS (рис. 2B и 2C). VPC-18005 состоит из гидрофобной изопропилбензильной группы на одном конце и отрицательно заряженной 5′-карбоксил-4-тиазолиданоновой группы на другом конце, связанных азогруппой с сопряженными двойными связями. Предполагается, что внутри связывающего кармана на домене ERG-ETS VPC-18005 образует солевой мостик с Lys357, водородные связи с Leu313, Trp351 и Tyr372 и гидрофобные взаимодействия с рядом окружающих аминокислотных остатков, включая Gln312, Trp314, Tyr371, Tyr372, Lys375, Ile377, Ile395, Ala398 и Leu399 (нумерация остатков основана на изоформе 5 ERG, идентификатор UniProt: P11308-4; фиг. 2C).
Рисунок 2: Характеристика связывания VPC-18005 с доменом ERG-ETS. ( A ) Химическая структура VPC-18005 в изомерной форме, используемой для стыковки. Рассчитано, что R-изомер имеет наиболее подходящую энергию связи. (Молекулярная масса = 318 г / моль при pH 7). ( B ) Заполняющее пространство представление предсказанной позы связывания VPC-18005 в кармане домена ERG-ETS (оранжевый = углерод, синий = азот, красный = кислород, желтый = сера). ( C ) Остатки белка, которые, как предполагается, будут взаимодействовать с VPC-18005 в домене ERG-ETS.Красные пунктирные линии обозначают водородные связи, а зеленые линии обозначают неполярные упаковочные взаимодействия. ( D ) Нарушения химического сдвига амида, возникающие в результате добавления 10-кратного молярного избытка VPC-18005 к домену ERG-ETS (получено из дополнительного рисунка 5). Цветные полосы обозначают значительные изменения (пурпурный ≥ средний + стандартное отклонение, голубой ≥ средний). Внизу показана вторичная структура домена EGR-ETS. ( E ) Аминокислотные остатки, демонстрирующие значительные нарушения химического сдвига, были картированы в их соответствующие местоположения в домене ERG-ETS (тот же цветовой код, что и в D).( F ) 1 H-ЯМР-контролируемое титрование VPC-18005 (четкие сигналы) с возрастающими концентрациями (от красного до фиолетового) домена ERG-ETS (широкие сигналы). Сигналы от ядер 1 H, непосредственно связанных с указанными химическими фрагментами, сдвигаются и расширяются при связывании белка.
Мы использовали ЯМР-спектроскопию для прямой оценки связывания VPC-18005 с доменом ERG-ETS. Спектр 15 N-HSQC 15 N-меченого белка (100 мкМ) оценивали в присутствии возрастающих концентраций солюбилизированного ДМСО VPC-18005 (дополнительные рисунки 5А и 5В), а также с контролем ДМСО. (Дополнительные рисунки 5D и 5E).Спектры продемонстрировали небольшие дозозависимые изменения химических сдвигов для ряда амидных 1 H N – 15 N групп, которые произошли при добавлении VPC-18005, но не DMSO. График возмущения химического сдвига с VPC-18005 при молярном соотношении 1:10 (т.е. 1 мМ) показал, что белковые остатки с изменениями, превышающими среднее значение (0,01 ppm), в основном располагались вдоль спирали α1, спирали α3 и цепи β3 (рисунок 2D). . Эти амиды группируются вокруг предсказанного кармана связывания VPC-18005 (рис. 2E), что подтверждает его позицию связывания с белком ERG.Следует отметить, что остатки с нарушенными химическими сдвигами амида, включая Leu313 на спирали α1 и Tyr371, Try372, Lys375 на спирали α3, моделируемые для взаимодействия с VPC-18005 посредством водородных связей и гидрофобных взаимодействий, также ранее были показаны как участвующие в ERG- Взаимодействия ДНК [25]. Подгонка кривых титрования 15 N-HSQC к простой изотерме связывания 1: 1 дала значение K D ~ 3 мМ для взаимодействия VPC-18005 с рекомбинантным доменом ERG-ETS (дополнительный рисунок 5C).Для дальнейшей локализации связывающих взаимодействий между VPC-18005 и доменом ERG-ETS было выполнено обратное титрование. В этом случае анализировали спектр -1 H-ЯМР VPC-18005 по сравнению с возрастающими концентрациями рекомбинантного домена ERG-ETS. Несколько ядер 1 H VPC-18005 проявляли ERG-зависимые возмущения химического сдвига. К ним относятся атомы водорода в ароматическом кольце ( 1, H, 7,78 и 7,45 м.д.), метилы в изопропильной группе ( 1 H 1.25 частей на миллион) и сопряженной двойной связи ( 1 H 8,4 частей на миллион) (рис. 2F). Из-за спектрального перекрытия с сигналами от ДМСО не удалось определить возмущения от группы CH 2 рядом с карбоксильной группой VPC-18005. В целом, эти два дополняющих друг друга результата анализа прямого связывания согласуются с предложенной моделью того, как VPC-18005 связывается с доменом белка ERG-ETS на интерфейсе, необходимом для взаимодействия с ДНК.
VPC-18005 нарушает связывание домена ERG-ETS с ДНК
Поскольку не было очевидного влияния VPC-18005 на общую цитотоксичность (рис. 1H), мы оценили влияние обработки VPC-18005 на активность репортера ETS. из-за снижения стабильности белка ERG.Предварительная обработка ингибитором синтеза белка циклогексимидом не вызвала деградации ERG после обработки VPC-18005 в концентрации до 50 мкМ в течение 4 часов (рис. 3A). В увеличенные промежутки времени 24 и 48 часов все еще не наблюдалось наблюдаемой деградации белка ERG (дополнительный рисунок 3D).
Рисунок 3: VPC-18005 нарушает связывание домена ERG-ETS с ДНК. ( A ) Вестерн-блот-анализ экспрессии ERG (верхняя панель) относительно винкулина (нижняя панель) в лизатах из клеток VCaP, обработанных в течение 1 часа циклогексимидом, а затем культивированных в течение 0, 2 или 4 часов с VPC-18005 в указанных концентрации.( B ) EMSA демонстрирует связывание 4 нМ домена ERG-ETS с 1 нМ флуоресцентно меченой дцДНК отдельно и в присутствии возрастающих концентраций ДМСО (верхняя панель, 0,008-17%)), VPC-18005 (средняя панель, 2 мкМ – 8 мМ) и YK-4-279 (нижняя панель 4 мкМ – 8 мМ).
Поскольку уровни белка ERG были стабильными в клетках, обработанных VPC-18005, а данные ЯМР подтверждали его прямое связывание с доменом ERG-ETS, мы затем оценили, может ли VPC-18005 нарушать связывание ERG-ДНК. Анализы сдвига электрофоретической подвижности (EMSA) проводили с использованием очищенного домена ERG-ETS и ДНК-олигонуклеотида, содержащего согласованный мотив узнавания GGAA.Рекомбинантный домен ERG-ETS связывает эту родственную ДНК с K D ~ 1 нМ (дополнительная фигура 6A). VPC-18005, но не контроль ДМСО, демонстрировал дозозависимое нарушение образования рекомбинантного комплекса ERG-ETS / ДНК (фиг. 3B) со значением K I ~ 250 мкМ (дополнительная фиг. 6B). Хотя это свидетельствует об относительно слабом связывании, это согласуется со значением K D , определенным для взаимодействия домена ERG-ETS и VPC-18005 с использованием спектроскопии 15 N-HSQC (дополнительный рисунок 5C).Напротив, YK-4-279 не нарушал связывания между доменом ERG-ETS и ДНК (рис. 3B). Эти результаты были дополнительно подтверждены с использованием ядерного лизата VCaP, где VPC-18005, но не YK-4-279, нарушал образование комплекса ERG-ДНК (дополнительная фигура 6C-6E). В совокупности эти результаты показывают, что VPC-18005 может нарушать связывание белка ERG с ДНК, содержащей элементы ETS-ответа.
Предыдущее исследование [29] показало, что ERG индуцирует экспрессию гена SOX9 через регулируемый AR энхансер в VCaP.SOX9, член семейства SOX (SRY-related HMG box), является фактором транскрипции, который необходим для органогенеза простаты, и его нарушение регуляции участвует в патогенезе рака [30]. Сверхэкспрессия SOX9 на мышиной модели ксенотрансплантата LNCaP приводит к усилению роста опухоли и инвазии [31], а истощение SOX9 в VCaP, как было показано, ингибирует инвазию in vitro и in vivo [29]. SOX9 в основном экспрессируется в клетках VCaP и повышается после обработки метриболоном (R1881) (рис. 4A).Базальная и стимулированная R1881 мРНК SOX9 и экспрессия белка заметно снизились после обработки VPC-18005. Снижение экспрессии ERG и SOX9 было также подтверждено после нокдауна siRNA ERG в клетках VCaP по сравнению с неспецифическим (NS) контролем siRNA (Рисунок 4B).
Рисунок 4: VPC-18005 подавляет экспрессию гена SOX9. ( A ) Уровни мРНК SOX9 и ERG в клетках VCaP, обработанных 1 нМ R1881 и 25 мкМ VPC-18005 и без них. *** р <0.001; * p <0,05, критерий Краскела – Уоллиса с апостериорным критерием множественного сравнения Данна. ( B ) Уровни мРНК SOX9 и ERG в клетках VCaP, трансфицированных миРНК ERG в течение 48 часов. * р <0,0001, непарный т -тест; # p = 0,0007, критерий Манна-Уитни-U. Экспрессия ERG и SOX9 была нормализована до GAPDH. Точки данных представляют эксперимент, проведенный в трех экземплярах. Планки погрешностей указывают стандартную ошибку среднего для n = 9 значений.
VPC-18005 ингибирует миграцию и инвазию ERG-сверхэкспрессирующих клеток
in vitroERG способствует EMT, что позволяет клеткам приобретать миграционные и инвазивные характеристики [7]. Ранее мы показали, что клетки PNT1B приобретают эти инвазивные характеристики, когда ERG стабильно сверхэкспрессируется [14]. Поэтому мы стремились определить, может ли VPC-18005 влиять на миграцию и инвазию этих клеток. Клетки PNT1B-MOCK и -ERG помещали в верхнюю камеру двухкамерной системы анализа клеток в реальном времени и обрабатывали VPC-18005 через 24 часа.Как и ожидалось, в отсутствие VPC-18005, PNT1B-ERG демонстрировал повышенную скорость миграции к нижней камере, содержащей сыворотку, по сравнению с контролем PNT1B-MOCK (Фиг.5A и 5B). После 24-часового воздействия и по сравнению с контролем ДМСО, VPC-18005 (5 мкМ) значительно снижал скорость миграции клеток PNT1B-ERG по сравнению с клетками, обработанными носителем, и результирующая скорость миграции была неотличима от скорости миграции, наблюдаемой для носителя. обработанные клетки PNT1B-MOCK (рис. 5C). Напротив, но в соответствии с результатами цитотоксичности, описанными ранее, обработка YK-4-279 приводила к цитотоксичности в обеих клеточных линиях.Клетки простаты RWPE, сконструированные для сверхэкспрессии ERG, также были протестированы в этом анализе. Никакого влияния на жизнеспособность клеток не наблюдалось после обработки увеличивающимися концентрациями VPC-18005 (дополнительная фигура 4A), и VPC-18005 оказывал умеренное влияние на миграцию клеток RWPE-ERG по сравнению с контролем MOCK (дополнительная фигура 4B и 4C). Для дальнейшего изучения этого ингибирующего эффекта VPC-18005 сфероиды PNT1B-ERG, предварительно обработанные в течение 24 часов контрольным носителем или VPC-18005, погружали в матрицу в присутствии или в отсутствие обработок и наблюдали в течение 6 дней (рис. 5D).Анализ изображений, полученных каждые 2 дня, показал, что скорость инвазии между 2 и 6 днями была значительно снижена как в VPC-18005 ( t -тест; p = 0,02), так и в YK-4-279 ( p = 0,005) обработанных клеток по сравнению с контролем, содержащим носитель. Эти результаты показали, что VPC-18005 ингибирует миграцию и инвазию ERG-сверхэкспрессирующих клеток, не вызывая цитотоксичности.
Фигура 5: VPC-18005 ингибирует миграцию и инвазию клеточных линий простаты in vitro и in vivo .Клетки ( A ) PNT1B-Mock и ( B ) клетки PNT1B-ERG высевали в верхнюю камеру системы анализа клеток в реальном времени (xCelligence) и обрабатывали 5 мкМ VPC-18005 (красная линия), YK -4-279 (синяя линия) или 0,01% ДМСО (контроль; черная линия) через 24 часа. Нормализованный клеточный индекс является мерой миграции клеток через поры верхней камеры и используется в качестве индекса миграции. Пунктирные линии представляют собой стандартные отклонения ( n = 3). Горизонтальная пунктирная красная линия указывает уровень миграции, достигнутый клетками PNT1B-MOCK через 48 часов, по сравнению с клетками -ERG.( C ) Скорость миграции определялась по наклону кривых между 24–48 часами для VPC-18005 (красный) ( p = 0,031, непарный t -тест) и YK-4-279 (синий ) ( p <0,001, непарный t -тест) относительно контроля ДМСО (черный). ( D ) Количественный анализ вторжения сфероида PNT1B-ERG в окружающую матрицу в присутствии или отсутствии VPC-18005 (красная линия), YK-4-279 (синяя линия) или 0,01% ДМСО (черная линия) сверх срок 6 дней.Скорость инвазии между 2 и 6 днями была значительно снижена в тех клетках, которые лечили VPC-18005 ( p = 0,02, непарный t -тест) и YK-4-279 ( p = 0,005, непарный t. -тест) по сравнению с управлением автомобилем. Планки погрешностей указывают стандартную ошибку среднего ( n = 3). ( E ) Предварительно окрашенные клетки PNT1B-Mock и PNT1B-ERG микроинъектировали в желточный мешок (зеленые стрелки) рыбок данио, и метастатическую способность клеток (белые стрелки) определяли с помощью конфокального микроскопа на 2-й день и 5 день.( F ) Оценка токсичности соединения для эмбрионов рыбок данио. Эмбрионы рыбок данио обрабатывали увеличивающейся концентрацией VPC-18005 и YK-4-279 в их воде. Через 4 дня подсчитывали выжившие эмбрионы. ( G ) После 5 дней ежедневного лечения VPC-18005 уменьшал возникновение метастазов у рыбок данио, трансплантированных клетками PNT1B-ERG и VCaP. ДМСО в сравнении с 1 мкМ ( p = 0,03 / 0,03, хи-квадрат) и 10 мкМ ( p = 0,002 / <0,001, хи-квадрат) VPC-18005 (PNT1B / VCaP).YK-4-279 был значимым только при 10 мкМ ( p = 0,02 / 0,04, хи-квадрат).
VPC-18005 ингибирует метастазирование ERG-сверхэкспрессирующих клеток
in vivoЧтобы определить, может ли VPC-18005 влиять на миграционное поведение клеток на животной модели, мы использовали ксенотрансплантацию рыбок данио в качестве инструмента для исследования экстравазации клеток [32]. Сначала мы исследовали, могут ли PNT1B-MOCK и PNT1B-ERG распространяться через тело рыбок данио (рис. 5E). Флуоресцентно меченые клетки вводили в желточный мешок, и через 5 дней PNT1B-ERG можно было увидеть по всему телу рыбы (дополнительное видео 1).Напротив, клетки PNT1B-MOCK не были обнаружены вне желточного мешка. Эмбрионы также оставались жизнеспособными при культивировании в присутствии до 50 мкМ VPC-18005 в течение 72 часов. Напротив, эмбрионы, обработанные YK-4-279, проявляли токсичность при концентрациях> 10 мкМ (рис. 5F). Было обнаружено, что инокулированные желточным мешком клетки PNT1B-ERG и VCaP диссеминировали в направлении головы и хвоста 65-70% эмбрионов соответственно. При культивировании в присутствии VPC-18005 в концентрации 1 и 10 мкМ этот процент рыб с распространением PNT1B-ERG или VCaP снижался до 20–30% от инокулированных животных (рис. 5G).Культивирование эмбрионов в YK-4-279 в концентрации 1 и 10 мкМ привело к диссеминации желточного мешка у 40–60% инокулированных животных (рис. 5G). Эти анализы предоставляют первое принципиальное свидетельство того, что небольшие молекулы, такие как VPC-18005, могут противодействовать метастатическому потенциалу ERG-экспрессирующих клеток простаты.
ОБСУЖДЕНИЕ
Факторы транскрипции семейства ETS являются важными мишенями для разработки лекарств из-за их сильного влияния на многие виды рака [4]. Однако нацеливание на эти факторы транскрипции с помощью малых молекул является сложной задачей из-за отсутствия у них активных центров, которые можно применять под действием лекарств.ЭРГ является важной терапевтической мишенью при РПЖ. Мы подтвердили сверхэкспрессию ERG при РПЖ путем сравнения опухолеспецифических генов с повышенной регуляцией из трех опубликованных наборов данных [1, 33, 34] на основе двукратного порога дифференциальной экспрессии (дополнительный рисунок 7). В то время как ряд генов с нарушенной регуляцией присутствовал в каждом попарном сравнении наборов данных (дополнительные таблицы 1 и 2), единственный ген с повышенной регуляцией, общий во всех трех наборах данных, был ERG . Это выдвигает на первый план ERG как потенциальный главный фактор, влияющий на РПЖ.В настоящее время имеется несколько отчетов, описывающих попытки нацелить ERG с помощью различных агентов, но ни один не привел к одобренным терапевтическим средствам. Они включают использование siRNA [35, 36], shRNA [37], пептидомиметиков [38] и небольшой молекулы DB1255, которая взаимодействует не с белком ERG, а скорее с сайтом узнавания ETS на ДНК (GGAA) [39]. Кроме того, ERG нацелена косвенно через ингибирование ERG-связывающих белков, включая PARP1 [13] и USP9X [40], а также через ERG-регулируемые гены, такие как YAP1 [41].Как отмечалось ранее, среди различных попыток противодействия ERG сообщалось, что только одна небольшая молекула, YK-4-279, непосредственно нацелена на белок ERG [22], но с ограничениями, подробно описанными выше.
В отличие от этих попыток, мы использовали устоявшийся рациональный подход к открытию лекарств [24] для прямого нацеливания на ДНК-связывающий интерфейс домена ERG-ETS. Эксперименты по ЯМР-спектроскопии продемонстрировали, что VPC-18005 связывается непосредственно с доменом ETS белка ERG. Данные ЯМР согласуются с моделированием in silico режима связывания VPC-18005 с ERG.В частности, нарушение Tyr371, ключевого остатка, необходимого для взаимодействия ERG-ДНК [25], с помощью VPC-18005, наблюдаемое в спектрах 15 N-HSQC, обеспечивает возможный механизм антагонизма. Наложение VPC-18005 на ДНК в кармане ERG дополнительно выявило предсказываемый взаимоисключающий характер их интерфейсов связывания (рис. 6). VPC-18005 не только частично занимает ту же границу раздела, что и ДНК, но и отрицательно заряженная карбоксильная группа также отображается непосредственно поверх отрицательно заряженной фосфатной группы основной цепи ДНК.
Рисунок 6: Взаимоисключающее связывание VPC-18005 и ДНК с доменом ERG-ETS. Предполагается, что положение карбоксильной группы в VPC-18005 (оранжевый = углерод, синий = азот, красный = кислород, желтый = сера) совпадает с положением фосфатной группы на основной цепи ДНК (голубые ленты и палочки). Таким образом, ожидается, что связывание VPC-18005 или ДНК с доменом ERG-ETS будет взаимоисключающим. В то время как нижняя часть химической структуры VPC-18005 занимает ту же общую площадь, что и ДНК, верхняя часть, состоящая из изопропильной части и ароматического кольца, простирается дальше в карман (показано серой сеткой).Структура белка ERG-ETS повернута на -90 градусов по вертикальной оси по сравнению со структурой, показанной на рисунке 2.
Также следует отметить, что VPC-18005 связывает изолированный домен ERG-ETS in vitro с мМ сродством, и это значительно слабее, чем аффинное взаимодействие нМ ERG с родственными ему последовательностями ДНК. Однако в контексте клеточной среды связывание фактора транскрипции с ДНК является гибким и чувствительным к химическим воздействиям [42, 43]. Таким образом, VPC-18005 является биологически активным, когда присутствует в клеточных анализах в мкМ концентрациях.Различия между результатами in vitro и in vivo могут возникать по множеству причин, от потенциально повышенных внутриклеточных концентраций VPC-18005 до высокочувствительных эффектов этого соединения в сети кооперативных межмолекулярных взаимодействий, необходимых для транскрипции. В целом, VPC-18005 является первым зарегистрированным низкомолекулярным ингибитором (SMI), который напрямую противодействует ДНК-связывающему интерфейсу на белке ERG, и он дополняет несколько успешных примеров, когда SMI, как было показано, нарушают взаимодействия белок-ДНК факторов транскрипции. [42].
Использование минимального контроля промотор-люцифераза Renilla предположило, что ингибирование от VPC-18005 было специфическим для ERG-чувствительного репортера, а не неспецифическим эффектом на общую транскрипцию (дополнительная фигура 9B). Однако из-за консервативности последовательности в домене ETS ожидается, что соединения против ERG, такие как VPC-18005, будут иметь потенциал связываться и ингибировать другие факторы ETS. Действительно, предварительные спектроскопические эксперименты ЯМР показали, что VPC-18005 также взаимодействует с ETS-доменами PU.1 и ETV4. Тем не менее, как показано здесь, VPC-18005 нетоксичен в активных концентрациях и до сих пор не продемонстрировал каких-либо проблем, связанных со специфичностью. Следует также отметить, что многие из этих факторов ETS являются онкогенными и вовлечены в широкий спектр раковых заболеваний [4]. Хотя будущая разработка новых производных VPC-18005 может быть приоритетной на основе их избирательного связывания с ERG, те, которые демонстрируют беспорядочную или повышенную специфичность для альтернативных факторов ETS, следует рассматривать как ведущие терапевтические средства против рака, связанного с этими факторами.
VPC-18005 ингибирует транскрипционную активность ERG дозозависимым образом. Кроме того, VPC-18005 может ингибировать экспрессию регулируемого ERG гена SOX9 , который, как ранее было показано, стимулирует инвазию РПЖ [29, 31]. VPC-18005 не влиял на жизнеспособность клеток, но действительно влиял на подвижность клеток, что приводило к уменьшению миграции / инвазии клеток in vitro и в модели ксенотрансплантата рыбок данио. Поскольку гибель раковых клеток является показателем токсичности, а неподвижность раковых клеток – мерой предотвращения метастазов, наше исследование поддерживает нетоксичные антиметастатические применения VPC-18005 и его производных.Будущие клинические исследования таких анти-ERG препаратов можно смоделировать на основе предыдущих клинических испытаний антиметастатических препаратов для пациентов с метастатическим заболеванием с низким бременем [44]. Ключевые показатели эффективности антиметастатических препаратов у пациентов включают ингибирование дальнейших метастазов / инвазии в ткани, уменьшение состояний, связанных со скелетом, уменьшение боли / употребления наркотиков, увеличение выживаемости (уменьшение разрушения конечных органов) и уменьшение циркулирующих опухолевых клеток [45].
Таким образом, эти результаты демонстрируют принципиальное доказательство того, что нацеливание малых молекул на домен ERG-ETS может подавлять транскрипционную активность и обратно трансформированные характеристики рака простаты, аберрантно экспрессирующие ERG.Ведущее в настоящее время соединение, VPC-18005, ингибировало ERG с низкими микромолярными концентрациями в экспериментах in vitro и in vivo . В исследованиях фармакодинамики и токсикологии на мышах VPC-18005 является растворимым, стабильным и биодоступным при пероральном приеме, и не проявляет общей токсичности при однократных дозах до 500 мг / кг и после 4-недельного двухразового использования при испытании 150 мг / кг (дополнительный рисунок). 10). Мы ожидаем, что будущие усилия в области медицинской химии (medchem) улучшат ее активность до субмикромолярного или наномолярного диапазона.Действительно, наша первоначальная разработка medchem идентифицировала дополнительные производные благодаря химическому сходству и модификациям каркаса VPC-18005 (дополнительная таблица 3). Из этих кандидатов VPC-18065 и 18098 с концевыми фрагментами, которые являются более гидрофобными, продемонстрировали несколько лучшие значения IC 50 (2 мкМ и 1 мкМ соответственно в анализах люциферазы) по сравнению с VPC-18005 (дополнительная фигура 8). Удаление карбоксильной группы в VPC-18100 привело к потере ингибирования в анализах репортерной люциферазы, как мы и ожидали, учитывая, что, как предполагается, карбоксилат образует солевой мостик с соседним Lys357.Хотя модификации, протестированные на сегодняшний день, еще не привели к значительной субмикромолярной активности, эти производные действительно обеспечивают рабочую взаимосвязь между структурой и активностью, которая будет определять будущие усилия в области медицины. ДНК-связывающие домены факторов транскрипции часто консервативны и демонстрируют низкую частоту мутаций, поскольку структурный компромисс может привести к потере функции [46]. Нацеливание на такие ДНК-взаимодействующие области может повысить ценность соответствующих лекарств из-за меньшей устойчивости, вызванной мутациями, но также затрудняет прямую оценку специфичности связывания путем мутагенеза.
РПЖ, одно из наиболее распространенных злокачественных новообразований у мужчин, на ранней стадии лечится хирургическим путем и лучевой терапией, но в конечном итоге прогрессирует до запущенных форм, которые лечатся в основном терапией андрогенной депривации (ADT). Эффективность АДТ носит временный характер из-за механизмов резистентности, связанных с аберрантной выработкой андрогенов и мутациями в рецепторе андрогенов [47]. Недавние исследования не только установили ERG как критическую мишень для лекарств при РПЖ [7], но также сообщили о регуляции с прямой связью ERG.Это подтверждает мнение о том, что, несмотря на исходную зависимость от рецептора андрогенов, экспрессия ERG может в конечном итоге стать самоуправляемой и устойчивой к ADT [17]. Таким образом, прототипы лекарств против ERG, такие как VPC-18005, разработанные посредством рациональной разработки лекарств, как описано здесь, могут конкретно нацеливаться на злокачественную трансформацию и метастазирование, вызванные ERG, и не подвержены текущим ограничениям лечения РПЖ, таким как лекарственная устойчивость к антиандрогенам. и побочные эффекты от ADT. Благодаря доступности неинвазивных тестов мочи для определения ERG [9], будущие анти-ERG препараты могут быть специально прописаны 50% пациентов с РПЖ, которые являются ERG-положительными, и проложат путь к прецизионной медицине.
МАТЕРИАЛЫ И МЕТОДЫ
In silico моделирование и виртуальный скринингОпубликованная рентгеновская кристаллическая структура домена ERG-ETS (PDB: 4IRG) [25] была подвергнута обработке алгоритма Site Finder, реализованного в молекулярной операционной среде. (MOE) [48], который использовал виртуальные атомные зонды для поиска на поверхности белка подходящих карманов для связывания малых молекул. Кристаллическая структура комплекса ERG / ДНК (PDB: 4IRI) [25] была использована для определения интерфейса ERG-ДНК.Карман с самым высоким рейтингом был идентифицирован и использован для последующего виртуального скрининга. Перед молекулярным стыковкой была подготовлена структурная модель домена ERG-ETS с использованием модуля Protein Preparation Wizard программы Maestro v9.3 из пакета программ Schrodinger 2012. Сетка стыковки была сосредоточена в кармане, состоящем из следующих аминокислот: Pro306, Gly307, Gln310, Ile311, Gln312, Leu313, Trp314, Trp351, Lys355, Met360, Lys364, Leu365, Ala368, Tyr371, Tyr372, Lys375, Ile395 , Ala398, Leu399 (нумерация остатков основана на изоформе 5 ERG, идентификатор UniProt: P11308-4).Всего из базы данных ZINC версии 12 [26] было загружено 19 607 722 (~ 20 миллионов) низкомолекулярных структур. Из 20 миллионов наборов в общей сложности 29 (~ 3 миллиона) молекул, которые обладают следующими свойствами, подобными свинцу и лекарству, были извлечены для молекулярного докинга: молекулярная масса от 250 до 400 Да, logP <= 5, водородная связь. доноров <= 5, акцепторов водородных связей <= 10, количества вращающихся связей <= 10 и количества колец <= 4. Каждой молекуле было придано ожидаемое состояние протонирования при pH 7 и минимизированная энергия под действием MMFF94x (сольватация: Борна) силовое поле с помощью МО.Каждую молекулу стыковали с ранее определенной сеткой стыковки на модели белка домена ERG-ETS с помощью программы Glide (Small-Molecule Drug Discovery Suite, версия 5.8, Schrödinger, LLC, New York, NY, 2012). Стандартная точность, все остальные параметры установлены по умолчанию. 1% лучших (~ 30 000 молекул), ранжированных по баллам стыковки, рассчитанным на основе сил взаимодействия, включая водородные связи и гидрофобные взаимодействия, были отобраны для перехода к следующему этапу виртуального скрининга.В этом наборе предсказанный pK i был рассчитан для каждой молекулы с использованием пользовательского скрипта MOE SVL, а эффективность лиганда рассчитана с использованием Glide. Кроме того, этот набор из 30 000 молекул был повторно докуплен в тот же карман с помощью программы стыковки eHiTs [49]. Среднеквадратичное отклонение (RMSD) было рассчитано между позициями стыковки из Glide и eHiTs для каждой молекулы. Был использован метод согласованной оценки (голосования), каждое соединение получило один голос по каждому из следующих критериев: 1) верхние 20% значений pK и , 2) верхние 20% значения эффективности лиганда и 3) верхние 20% стыковки eHiTs. баллов и 4) RMSD <= 3 A.На заключительном этапе отбора были отобраны первые 3000 молекул, ранжированные по количеству голосов. На этом этапе химическая структура каждой молекулы в предсказанном кармане связывания ERG-ETS была вручную исследована с использованием трехмерной визуальной среды в MOE. Предпочтение отдавалось соединениям с благоприятными позициями связывания и взаимодействиями с окружающими аминокислотными остатками. Молекулы были исключены из выборки, если они содержат проблемные или беспорядочные фрагменты. Помимо ручного обследования, для выявления таких проблемных групп использовалась программа FAFDrugs [50].Всего для тестирования было отобрано 48 соединений. MOE и MarvinSketch использовались для визуализации и представления моделей белков и химических структур. Поиск химического сходства на основе коэффициента Танимото был выполнен для хитового соединения VPC-18005 (подготовленного, как подробно описано в дополнительных материалах и методах) в базе данных ZINC, с дополнительными производными medchem, разработанными с использованием MOE.
Клеточная культура
Клетки карциномы предстательной железы человека VCaP (CRL-2876) и PC3 (CRL-1435) получали из Американской коллекции типовых культур (АТСС).Клетки VCaP несут эндогенный гибрид TMPRSS2-ERG , тогда как клетки PC3 этого не делают, но экспрессируют член семейства ETS ETV4. Иммортализованная линия эпителиальных клеток предстательной железы PNT1B [27] была приобретена в ATCC. Клетки PNT1B-Mock, PNT1B-ERG, RWPE-Mock и RWPE-ERG являются соответствующими по клонам контрольными и ERG-экспрессирующими линиями эпителиального эпителия простаты, созданными в доме [14]. Клетки PC3 поддерживали в среде RPMI 1640 (Life Technologies) с добавлением 5% (об. / Об.) Фетальной бычьей сыворотки (FBS). Клетки VCaP поддерживали в среде DMEM с низким содержанием бикарбоната (ATCC) с добавлением 10% FBS.Клетки PNT1B-Mock и –ERG поддерживались в среде DMEM (Life Technologies) с добавлением 10% FBS и при отборе бластицидина. Клетки выращивали в увлажненном инкубаторе с 5% CO 2 при 37 ° ° C.
Вестерн-блот
Клетки лизировали на льду с буфером RIPA, содержащим коктейль ингибиторов протеазы (Pierce). Первичные антитела: ERG (1: 1000, EPR3864 (2), Abcam), α-тубулин (1: 20 000, Millipore), винкулин (1: 1000, Abcam). Иммунореактивность определяли с использованием вторичных антител, конъюгированных с козьими антителами против кроликов или кроликов с пероксидазой хрена (HPR) (1: 10 000) (Santa Cruz), и визуализацию осуществляли с помощью хемилюминесценции (Pierce).Для ингибирования синтеза белка добавляли 10 мкМ циклогексимида на 1 час, а затем заменяли средой для обработки в течение указанного периода времени.
Двойной репортерный анализ люциферазы
Все соединения, выбранные из виртуального скрининга, были протестированы в основанном на люциферазе ERG-ответном репортерном анализе с использованием двух линий клеток с избыточной экспрессией ERG, VCaP и PNT1B-ERG, ранее разработанных в компании [14 ]. Клетки (3000) в 150 мкл на лунку 96-луночного планшета были засеяны и после 24 ч инкубации были трансфицированы 50 нг ETS-зависимого репортера люциферазы светлячка, полученного из промотора Endoglin E3 (–507 / –280 из (E3) промотор [28], вставленный в репортерный вектор люциферазы (Signosis), ARR 3 tk-luc [24] и 5 нг репортера люциферазы Renilla (pRL-tk, Promega) с использованием реагента для трансфекции TransIT 20/20 (Mirus, США ).После 16-часовой инкубации среду для обработки добавляли еще на 48 часов. Активность люцифераз Firefly и Renilla измеряли с помощью планшет-ридера TECAN M200Pro. Сравнение пустого вектора с репортером, реагирующим на ETS, демонстрирует активацию только в присутствии последовательности, реагирующей на ETS (дополнительная фигура 9A). Данные были нормализованы сначала по люциферазе Renilla, а затем по контролю со средой ДМСО на каждом планшете, если не указано иное. Первоначально пораженные соединения были идентифицированы как соединения со средним нормализованным показанием люциферазы (показания люциферазы светлячка / люциферазы Renilla), которые составляют 60% или менее от среднего нормализованного считывания люциферазы контроля DMSO-media (т.е.е. Снижение активности люциферазы на 40% или более) при 10 мкМ. Типичный пример необработанных показаний люциферазы Renilla представлен на дополнительном рисунке 9B. Люциферазные анализы повторяли для каждого ведущего соединения при нескольких концентрациях (от 0,1 до 100 мкМ), чтобы установить дозозависимый ответ и значение IC 50 . Анализ репортера AR выполняли, как описано ранее [24].
Анализ пролиферации / жизнеспособности клеток
3- (4,5-диметилтиазол-2-ил) -5- (3-карбоксиметоксифенил) -2- (4-сульфофенил) -2H-тетразолий, внутренняя соль (MTS).Клетки высевали с плотностью 3000 клеток на лунку (кроме VCaP при 20 000 на лунку) в 100 мкл соответствующей среды в 96-луночные культуральные чашки. Двадцать четыре часа спустя 100 мкл среды, содержащей контрольный носитель или соединения. Каждое лечение готовили в трех экземплярах. После 72-часовой обработки жизнеспособность клеток оценивали с использованием реагента для анализа пролиферации клеток в одном растворе CellTiter 96 ® (Promega) в соответствии с инструкциями производителя. Значения были нормализованы к контролю ДМСО.
ЯМР-спектроскопия
Экспрессия и очистка домена ERG-ETS. Плазмида pET28a, кодирующая остатки 307–400 домена ERG-ETS, была экспрессирована в E. coli BL21 (λDE3) . Культуры объемом 1 л выращивали при 37 ° C в среде M9, снабженной 3 г / л 13 C 6 -глюкозы и / или 1 г / л 15 NH 4 Cl. Клеткам давали возможность вырасти до О. 600 = 0,6, и экспрессию белка индуцировали добавлением 1 мМ IPTG. По истечении 4 часов индукции клетки собирали центрифугированием и хранили при –80 ° ° C в течение по крайней мере 1 цикла замораживания / оттаивания.Клетки ресуспендировали в 40 мл буфера для лизиса на каждый 1 л культуры. Клетки лизировали, пропуская 5 раундов гомогенизации и 10 минут обработки ультразвуком. Лизат клеток центрифугировали при 15k об / мин в течение 1 часа, и супернатант подвергали очистке на никелевой колонке. Колонку промывали 25 мМ имидазолом (50 мМ фосфат, 1 М NaCl, pH 7,4), и белки элюировали 1 М имидазолом. Фракции, содержащие домен ETS, подтверждали с помощью SDS-PAGE и объединяли. Метку His 6 расщепляли тромбином, и образец без метки концентрировали до 2 мл и подвергали эксклюзионной хроматографии по размеру S75.Фракции проверяли с помощью SDS-PAGE, фракции, содержащие чистый образец, объединяли и концентрировали. Достаточное количество белка диализовали в буфер ЯМР (20 мМ фосфат натрия, 150 мМ NaCl, 2 мМ DTT, 0,1 мМ EDTA, pH 6,5) для всех экспериментов ЯМР. Спектральные отнесения ЯМР. Данные ЯМР регистрировали при 25 или 28 ° C на оборудованном криозондом спектрометре Bruker Avance III на 850 МГц. Данные обрабатывались и анализировались с помощью NMRpipe [51] и Sparky [52]. Сигналы от основной и боковой цепи 1 H, 13 C и 15 N ядер были отнесены к стандартным многомерным экспериментам с гетероядерной корреляцией.Титрование под контролем ЯМР. Взаимодействие соединений с доменом ERG-ETS отслеживали с помощью спектров 15 N-HSQC с повышенной чувствительностью. Эксперименты включали титрование немеченого солюбилизированного в ДМСО соединения или контрольного ДМСО в 15 N-меченный домен ERG-ETS. Возмущения химического сдвига были рассчитаны на основе комбинированного амида 1 H N и 15 N изменений сдвига как Δδ = [(0,2 × Δδ N ) 2 + (Δδ H ) 2 ] 1/2 .Взаимное титрование проводили с использованием 1 H-ЯМР для мониторинга эффектов постепенного добавления немеченого белка к образцу VPC-18005 (180 мкМ) в 20 мМ фосфате, 150 мМ NaCl, 2 мМ DTT, 0,1 мМ EDTA, pH 6.5. Сигнал от воды подавлялся предварительным насыщением.
Анализ сдвига электрофоретической подвижности (EMSA)
Очищенный домен ERG-ETS (см. ЯМР-спектроскопия) хранили в буфере (20 мМ фосфат натрия, 200 мМ NaCl, 2 мМ DTT, 0,1 мМ EDTA, pH 6,5). Для приготовления зонда для анализа сдвига геля смешивали равные количества (200 нМ) ДНК, меченных флуорофором Alexa-488 (5′-CGGCC AAGCCGGAAGTGAGTG-3 ‘и его комплемент), нагревали до 95 ° C в течение 30 минут и затем медленно охлаждали до 25 ° C в течение нескольких часов.Первоначальный анализ сдвига геля выполняли путем титрования постоянной 1 нМ меченой дцДНК с ERG в концентрациях от 0,3 до 0,5 мкМ. В реакционную смесь были включены глицерин (3%) и 0,2 мг / мл бычьего сывороточного альбумина (БСА). После инкубирования при комнатной температуре в течение 1 часа образцы загружали в 10% природный гель полиакриламида и подвергали электрофорезу при 10 ° C. Гель сканировали с помощью тепловизора Typhoon 9200, снабженного синим лазером для возбуждения при 490 нм, и измеряли флуоресценцию. при 520 нм.Отсканированное изображение было проанализировано с помощью Image J [48]. Подгонка нелинейным методом наименьших квадратов (GraphPad Prism) данных титрования к изотерме связывания 1: 1 дала равновесную константу диссоциации (значение K D ~ 1 нМ) для взаимодействия домена ERG-ETS с ДНК. Уравнение изотермы связывания: f b, i = [ERG] i / ([ERG] i + K D ), где [ERG] i – общая концентрация домена ERG-ETS ( действительное приближение, как K D > 1 нМ общей дцДНК) в каждой точке титрования (i), а связанная фракция, f b, i , рассчитывалась как интенсивность полосы связанной ДНК в этой точке относительно интенсивности с насыщением 0.5 мкМ белка. Результат этого первоначального исследования был использован для установки молярного отношения домена ERG-ETS: ДНК в последующих анализах конкуренции с VPC-18005. Для этих анализов 4 нМ домена ERG-ETS смешивали с 1 нМ меченной флуорофором дцДНК, титровали с помощью VPC-18005 (разведенного из исходного раствора ДМСО) и анализировали по тому же протоколу EMSA. Данные соответствовали уравнению для конкурентного связывания, f b, i = [ERG] / ([ERG] + K D {1 + [VPC-18005] i / K I }), где K I – константа диссоциации ингибитора, а связанная фракция, f b, i , была рассчитана как интенсивность полосы связанной ДНК в каждой точке титрования по сравнению с таковой без добавления VPC-18005.Контрольный эксперимент проводили путем титрования эквивалентными количествами ДМСО.
Для экспериментов с участием ERG из клеток VCaP ядерный белок VCaP экстрагировали с использованием набора для экстракции CelLytic NuCLEAR (Sigma). Первоначальный анализ сдвига геля выполняли путем титрования константы 1 нМ меченого ядерного экстракта дцДНК при концентрациях от 1,1 пг / мкл до 1,76 мкг / мкл (дополнительная фигура 6C). Для последующих анализов 55 нг / мкл ядерного экстракта смешивали с 1 нМ меченной флуорофором дцДНК, титровали VPC-18005 (разбавленным из исходного раствора ДМСО) и анализировали с использованием того же протокола EMSA.
Анализ экспрессии генов
Тотальную РНК экстрагировали из клеток VCaP с использованием набора RNeasy Plus (Qiagen). Обратную транскрипцию выполняли с использованием набора iScript First-Strand cDNA Synthesis Kit (Bio-Rad Laboratories) с использованием 100 нг общей РНК в качестве матрицы. Праймеры полимеразной цепной реакции (ПЦР) для обратной транскрипции в реальном времени для ERG, синтезированных с помощью IDT (прямой, 5′- CGCAGATTATCGT GCCAGCAGAT -3 ‘; обратный, 5′-CCATATTCTTTCACC GCCCACTCC-3′) и SOX9 (анализ праймеров Quantitect, Qiagen).Количественную ОТ-ПЦР в реальном времени проводили в трех экземплярах для каждого образца с использованием термоциклера ABI ViiA7 QPCR. В каждую реакцию добавляли 1 мкл кДНК, 1 мкл прямого и обратного праймеров (или 1 мкл праймеров Quantitect) и 6 мкл смеси Sybr Green Master Mix (Applied Biosystems) с водой до конечного объема 12 мкл. Все праймеры использовали в концентрации 5 мкмоль / л. Условия цикла ПЦР: 95 ° C в течение 10 минут, затем 40 циклов при 95 ° C в течение 15 секунд, 60 ° C в течение 1 минуты. Данные были нормализованы по эталонным генам: GAPDH (прямой, 5’- CCATATTCTTCACCGCCCACTCC -3 ‘; обратный, 5′- GGCATGGACTGTGGTCATGAG -3’). Для сравнения образцов использовали метод 2 -ΔΔ CT .Специфичность продукта ПЦР подтверждена с помощью кривой плавления.
Анализ клеток в реальном времени (xCELLigence)
Миграцию клеток контролировали с использованием планшетов для миграции CIM-16 через платформу xCELLigence (ACEA). Среду с добавлением FBS (160 мкл) добавляли в нижнюю камеру планшета и инкубировали при комнатной температуре в течение 30 мин. Затем устанавливали верхнюю камеру и в каждую лунку добавляли 30 мкл бессывороточной среды (SFM) и оставляли для уравновешивания в инкубаторе на 1 час при 37 ° C. После инкубации для каждой лунки снимали фоновый анализ.Клетки PNT1B-ERG или –MOCK, культивированные в течение 24 часов в SFM, высевали в лунки верхней камеры из расчета 30000 клеток на лунку и через 24 часа добавляли 100 мкл желаемой обработки (контроль носителя, VPC-18005 и YK -4-279). Считывание значений индекса клеток в реальном времени регистрировали каждые 5 минут до конца эксперимента (48 часов).
Анализ вторжения сфероидов
Анализ вторжения клеток 3D Spheroid BME (Trevigen) выполняли в соответствии с инструкциями производителя. Вкратце, 5000 клеток PNT1B-ERG и 5 мкл ЕСМ были приготовлены в питательной среде до общего объема 50 мкл и засеяны в 96-луночный планшет для формирования сфероидов, пригодный для 3D-культуры, и инкубированы при 37 ° C в течение 72 часов.Сфероиды предварительно обрабатывали VPC-18005 или ДМСО в течение 24 ч, после чего добавляли 50 мкл гелевой инвазионной матрицы. Затем сфероиды инкубировали при 37 ° C в течение 3-7 дней и фотографировали с помощью микроскопа Zeiss AxioObserver Z1 в каждой лунке в день добавления инвазионной смеси и каждые два дня после этого. Сфероиды повторно обрабатывали 50 мкл контроля носителя или соединения через 72 часа.
Данио
Исследования проводились в соответствии с протоколами, соответствующими Канадскому совету по уходу за животными, и с одобрения Комитета по уходу за животными Университета Британской Колумбии.Штамм рыбок данио дикого типа содержался в аквариумах в соответствии со стандартными протоколами [53]. Эмбрионы были созданы путем естественного попарного скрещивания и выращивались при температуре 28,5 ° C в цикле 14 часов света / 10 часов темноты в чашке Петри размером 100 мм 2 , содержащей аквариумную воду. Фенилтиомочевину (0,2 мМ PTU, Sigma) добавляли к эмбрионам через 10 ч после оплодотворения (hpf) для предотвращения образования пигмента. Анализ распространения желточного мешка. Клеточные линии РПЖ флуоресцентно метили за день до микроинъекции 1,5 мкМ красителя CellTracker CM-Dil (Life Technologies) в соответствии с инструкциями производителя.Эмбрионы дикого типа подвергали дехорионированию со скоростью 2 dpf. После анестезии триканом в желточный мешок микроинъектировали приблизительно 50–70 раковых клеток. Затем эмбрионы переносили на чашки размером 100 мм 2 , которые содержали воду из аквариума с добавленным PTU и контролем VPC-18005, YK-4-279 или ДМСО. Эмбрионы оценивали визуально на наличие ксенографа. Те эмбрионы, которые не содержали клеток, были удалены из эксперимента. Эмбрионы содержались при температуре 35 90 327 o 90 328 ° C на протяжении всего эксперимента.Приблизительно 50 рыбам вводили инъекцию в каждую клеточную линию, и метастазирование определяли на 4 и 5 день путем наблюдения с помощью микроскопа Zeiss Axio Observer (объектив 5X), контролируемого с помощью программного обеспечения Zen 2012. Фиксированные (мертвые) клетки использовали в качестве контроля, чтобы гарантировать, что наблюдаемое распространение не связано с абсорбцией желточным мешком.
Статистика
Данные представлены как среднее ± стандартная ошибка среднего (SEM), если не указано иное. Для анализа использовались тест Краскела-Уоллиса с апостериорным критерием множественного сравнения Данна, критерий хи-квадрат, двусторонний дисперсионный анализ с последующим апостериорным LSD-тестом Фишера и t -тест, как указано в подписях к соответствующим рисункам. p <0,05 считалось значимым. Статистический анализ выполняли с использованием GraphPad Instat или GraphPad Prism 6 (GraphPad Software, Inc.).
Вклад авторов
Концепция и дизайн: M.S.B., M.R.M., M.H., M.E.C .; Разработка методологии: M.S.B., M.R.M., M.H., P.A-C., M.E.C., D.L., L.P.M., A.C .; Сбор данных: M.S.B., M.R-M., M.H., D.L., A.K., P.Y., M.M., M.N., S.L., K.D., C.Y., F.G., Y.G., T.Y., S.L .; Анализ и интерпретация данных: М.S.B., M.R-M., M.H., D.L., M.E.C., A.C., L.P.M .; Написание, рецензирование и / или редактирование рукописи: M.S.B., M.R-M., M.H., M.E.C., L.P.M., D.L .; Административная, техническая или материальная поддержка: P.S.R., A.C., M.G., C.G-E., L.P.M .; Авторский надзор: P.S.R., A.C., M.E.C.
БЛАГОДАРНОСТИ
Авторы выражают благодарность Xianghong Shan, Hans Adomat и Alice Tai за их техническую помощь.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
ПОДДЕРЖКА ГРАНТА
Проект поддержан фондами, предоставленными грантом проекта Terry Fox New Frontiers Program (# TFF116129, MEC), Центрами передового опыта по коммерциализации и исследованиям (CECR), NIH Pacific Northwest Cancer SPORE (# P50 CA097186) , Грант-в-помощи Фонда рака простаты Британской Колумбии (MRM), Канадский институт исследований в области здравоохранения (CIHR; MOP-136834 для LPM), Стипендия для постдокторантуры Канады по раку простаты (# PDF2015-01, M.С. Поддержка приборов ЯМР была предоставлена CIHR, Канадским фондом инноваций (CFI) и Фондом развития знаний Британской Колумбии (BCKDF).
ССЫЛКИ
1. Вятт А.В., Мо Ф, Ван К., Макконеги Б., Брамбхатт С., Джонг Л., Митчелл Д.М., Джонстон Р.Л., Хэгерт А., Ли Э., Лью Дж., Йунг Дж., Шреста Р. и др.Неоднородность межопухолевого транскриптома рака простаты высокого риска. Genome Biol. 2014; 15: 426.
2. Ядав С.С., Ли Дж., Лавери Х.Дж., Ядав К.К., Тевари А.К. Технология секвенирования нового поколения для диагностики, прогноза и индивидуального лечения рака простаты. Урол Онкол. 2015; 33: 267.e1–13.
3. Томлинс С.А., Родос Д.Р., Пернер С., Дханасекаран С.М., Мехра Р., Сан XW, Варамбалли С., Цао Х, Чинда Дж., Куэфер Р., Ли К., Монти Дж. Э., Шах Р. Б. и др. Рекуррентное слияние генов факторов транскрипции TMPRSS2 и ETS при раке простаты.Наука. 2005; 310: 644–48.
4. Гутьеррес-Хартманн А., Дюваль Д.Л., Брэдфорд А.П. Факторы транскрипции ETS в эндокринной системе. Trends Endocrinol Metab. 2007; 18: 150–58.
5. Джованнини М., Бигель Дж. А., Серра М., Ван Дж. Й., Вей Ю. Х., Найкум Л., Эмануэль Б. С., Эванс Г. А.. Слитые транскрипты EWS-erg и EWS-Fli1 в саркоме Юинга и примитивных нейроэктодермальных опухолях с вариантными транслокациями. J Clin Invest. 1994; 94: 489–96.
6. Cerveira N, Ribeiro FR, Peixoto A, Costa V, Henrique R, Jerónimo C, Teixeira MR.Слияние генов TMPRSS2-ERG, вызывающее сверхэкспрессию ERG, предшествует изменениям числа копий хромосом при карциномах простаты и парных поражениях HGPIN. Неоплазия. 2006; 8: 826–32.
7. Адамо П., Ладомери MR. Онкоген ERG: ключевой фактор рака простаты. Онкоген. 2016; 35: 403–14.
8. Сент-Джон Дж., Пауэлл К., Конли-Лакомб М.К., Чинни С.Р. Экспрессия гена слияния TMPRSS2-ERG в опухолевых клетках простаты и ее клиническое и биологическое значение в прогрессировании рака простаты. J Cancer Sci Ther.2012; 4: 94–101.
9. Tomlins SA, Day JR, Lonigro RJ, Hovelson DH, Siddiqui J, Kunju LP, Dunn RL, Meyer S, Hodge P, Groskopf J, Wei JT, Chinnaiyan AM. TMPRSS2 в моче: ERG Plus PCA3 для индивидуальной оценки риска рака простаты. Eur Urol. 2016; 70: 45–53.
10. Лаксман Б., Моррис Д.С., Ю. Дж., Сиддики Дж., Цао Дж., Мехра Р., Лонигро Р. Дж., Цодиков А., Вей Дж. Т., Томлинс С. А., Чиннайян А. М.. Мультиплексный биомаркерный анализ мочи первого поколения для раннего выявления рака простаты.Cancer Res. 2008; 68: 645–49.
11. Yu J, Yu J, Mani RS, Cao Q, Brenner CJ, Cao X, Wang X, Wu L, Li J, Hu M, Gong Y, Cheng H, Laxman B, et al. Интегрированная сеть слияния генов рецептора андрогена, поликомб и TMPRSS2-ERG при прогрессировании рака простаты. Раковая клетка. 2010; 17: 443–54.
12. Chng KR, Chang CW, Tan SK, Yang C, Hong SZ, Sng NY, Cheung E. Совместно регулирующая сеть репрессоров транскрипции, управляющая андрогенным ответом при раке простаты. EMBO J. 2012; 31: 2810–23.
13. Бреннер Дж. К., Атик Б., Ли Й., Йокум А. К., Цао К., Асангани И. А., Патель С., Ван Х, Лян Х., Ю Дж., Паланисами Н., Сиддики Дж., Ян В. и др. Механическое обоснование ингибирования поли (АДФ-рибозы) полимеразы при раке предстательной железы с положительным слиянием генов ETS. Раковая клетка. 2011; 19: 664–78.
14. Беккер-Сантос Д.Д., Го Й., Гаффари М., Викерс Э.Д., Леман М., Альтамирано-Димас М., Олуми А., Фурукава Дж., Шарма М., Ван И, Дедхар С., Кокс М.Э. Интегрин-связанная киназа как мишень для ERG-опосредованных инвазивных свойств в моделях рака простаты.Канцерогенез. 2012; 33: 2558–67.
15. Галлетти Дж., Матов А., Белтран Х., Фонтан Дж., Мигель Москера Дж., Чунг С., Макдональд Т. Ю., Сунг М., О’Тул С., Кенч Дж. Г., Сук Чае С., Кимовски Д., Тагава С. Т. и др. ERG индуцирует устойчивость к таксану при устойчивом к кастрации раке простаты. Nat Commun. 2014; 5: 5548.
16. Gsponer JR, Braun M, Scheble VJ, Zellweger T., Bachmann A, Perner S, Vlajnic T., Srivastava M, Tan SH, Dobi A, Sesterhenn IA, Srivastava S, Bubendorf L, Ruiz C. ERG перегруппировка и белок экспрессия в прогрессировании устойчивого к кастрации рака простаты.Prostate Cancer Prostatic Dis. 2014; 17: 126–31.
17. Мани Р.С., Айер М.К., Цао К., Бреннер Дж.К., Ван Л., Гош А., Цао Х, Лонигро Р.Дж., Томлинс С.А., Варамбалли С., Чиннайян А.М. TMPRSS2-ERG-опосредованная прямая регуляция ERG дикого типа при раке предстательной железы человека. Cancer Res. 2011; 71: 5387–92.
18. Ан Дж., Рен С., Мерфи С.Дж., Далангуд С., Чанг С., Панг Х, Цуй И, Ван Л., Пэн И, Чжан Х, Чжу И., Ван С., Холлинг Г.С. и др. Усеченные онкопротеины ERG из слияний TMPRSS2-ERG устойчивы к SPOP-опосредованной деградации протеасом.Mol Cell. 2015; 59: 904–16.
19. Ган В., Дай Х, Лунарди А., Ли З., Инузука Х, Лю П., Вармех С., Чжан Дж., Ченг Л., Сунь И., Асара Дж. М., Бек А. Х., Хуанг Дж. И др. SPOP способствует убиквитинизации и деградации онкопротеина ERG для подавления прогрессирования рака простаты. Mol Cell. 2015; 59: 917–30.
20. Erkizan HV, Kong Y, Merchant M, Schlottmann S, Barber-Rotenberg JS, Yuan L, Abaan OD, Chou TH, Dakshanamurthy S, Brown ML, Uren A, Toretsky JA. Небольшая молекула, блокирующая взаимодействие онкогенного белка EWS-FLI1 с РНК-геликазой А, подавляет рост саркомы Юинга.Nat Med. 2009; 15: 750–56.
21. Rahim S, Beauchamp EM, Kong Y, Brown ML, Toretsky JA, Uren A. YK-4-279 ингибирует опосредованную ERG и ETV1 инвазию клеток рака простаты. PLoS One. 2011; 6: e19343.
22. Rahim S, Minas T, Hong SH, Justvig S, elik H, Kont YS, Han J, Kallarakal AT, Kong Y, Rudek MA, Brown ML, Kallakury B, Toretsky JA, Üren A. Низкомолекулярный ингибитор ETV1, YK-4-279, предотвращает рост и метастазирование рака простаты в модели ксенотрансплантата мыши. PLoS One. 2014; 9: e114260.
23. Нокс С., Ло В., Джуисон Т., Лю П., Ли С., Фролкис А., Пон А., Банко К., Мак С., Невеу В., Джумбоу И., Эйснер Р., Го А.С., Вишарт Д.С. DrugBank 3.0: исчерпывающий ресурс, посвященный исследованиям лекарств «омикс». Nucleic Acids Res. 2011; 39: D1035–41.
24. Далал К., Рошан-Монири М., Шарма А., Ли Х., Бан Ф, Хассона М.Д., Хсинг М., Сингх К., Леблан Э., Дем С., Томлинсон Гунс Э.С., Черкасов А., Ренни П.С. Селективное нацеливание на ДНК-связывающий домен рецептора андрогенов в качестве перспективной терапии рака простаты.J Biol Chem. 2014; 289: 26417–29.
25. Реган М.С., Хораньи П.С., Прайор Е.Е. мл., Сарвер Дж. Л., Кафисо Д. С., Бушвеллер Дж. Х. Структурные и динамические исследования фактора транскрипции ERG показывают, что связывание ДНК аллостерически аутоингибируется. Proc Natl Acad Sci USA. 2013; 110: 13374–79.
26. Ирвин Дж. Дж., Стерлинг Т., Майзингер М.М., Болстад Е.С., Коулман Р.Г. ЦИНК: бесплатный инструмент для открытия химии для биологии. Модель J Chem Inf. 2012; 52: 1757–68.
27. Berthon P, Cussenot O, Hopwood L, Leduc A, Maitland N.Функциональная экспрессия sv40 в нормальных эпителиальных и фибробластных клетках предстательной железы человека – паттерн дифференцировки неопухолевых клеточных линий. Int J Oncol. 1995; 6: 333–43.
28. Pimanda JE, Chan WY, Donaldson IJ, Bowen M, Green AR, Göttgens B. Экспрессия эндоглина в эндотелии регулируется Fli-1, Erg и Elf-1, действующими на промотор и -8 kb. усилитель. Кровь. 2006; 107: 4737–45.
29. Цай С., Ван Х, Хе ХХ, Чен С., Хе Л., Ма Ф, Муччи Л., Ван К., Фиоре С., Совальски А.Г., Лода М., Лю XS, Браун М. и др.ERG индуцирует опосредованную андрогенными рецепторами регуляцию SOX9 при раке простаты. J Clin Invest. 2013; 123: 1109–22.
30. Хуанг З., Херли П.Дж., Симонс Б.В., Маркионни Л., Берман Д.М., Росс А.Э., Шеффер Э.М. Sox9 необходим для развития простаты и инициации рака простаты. Oncotarget. 2012; 3: 651–63. doi: 10.18632 / oncotarget.531
31. Wang H, Leav I, Ibaragi S, Wegner M, Hu GF, Lu ML, Balk SP, Yuan X. SOX9 экспрессируется в эпителии простаты плода человека и усиливает инвазию рака простаты.Cancer Res. 2008; 68: 1625–30.
32. Teng Y, Xie X, Walker S, White DT, Mumm JS, Cowell JK. Оценка метастазов раковых клеток человека у рыбок данио. BMC Рак. 2013; 13: 453.
33. Тейлор Б.С., Шульц Н., Иеронимус Х., Гопалан А., Сяо Ю., Карвер Б.С., Арора В.К., Каушик П., Керами Е., Рева Б., Антипин Ю., Мициадес Н., Ландерс Т. и др. Интегративное геномное профилирование рака простаты человека. Раковая клетка. 2010; 18: 11–22.
34. Исследовательская сеть Атласа генома рака. Молекулярная таксономия первичного рака простаты.Клетка. 2015; 163: 1011–25.
35. Шао Л., Текедерели И., Ван Дж., Юка Е., Цанг С., Суд А., Лопес-Берестейн Г., Озполат Б., Иттманн М. Высокоспецифичное нацеливание гена слияния TMPRSS2 / ERG с использованием липосомных нановекторов. Clin Cancer Res. 2012; 18: 6648–57.
36. Сан К., Доби А., Мохамед А., Ли Х., Тангапажам Р.Л., Фурусато Б., Шахедуззаман С., Тан С.Х., Вайдьянатан Г., Уитман Э., Хоксворт Д.Д., Чен И., Нау М. и др. Слияние TMPRSS2-ERG, обычное геномное изменение при раке простаты, активирует C-MYC и отменяет дифференцировку эпителия простаты.Онкоген. 2008; 27: 5348–53.
37. Ван Дж., Цай Й., Ю. В., Рен С., Спенсер Д.М., Иттманн М. Плейотропные биологические активности альтернативно сплайсированных транскриптов гибридного гена TMPRSS2 / ERG. Cancer Res. 2008; 68: 8516–24.
38. Ван Х, Цяо Y, Асангани И.А., Атик Б., Поляков А., Цеслик М., Пичиая С., Чакраварти Б.В., Цао Х, Цзин Х, Ван С.Х., Апель И.Дж., Ван Р. и др. Разработка пептидомиметических ингибиторов продукта слияния генов ERG при раке простаты. Раковая клетка. 2017; 31: 532–548.e7.
39. Nhili R, Peixoto P, Depauw S, Flajollet S, Dezitter X, Munde MM, Ismail MA, Kumar A, Farahat AA, Stephens CE, Duterque-Coquillaud M, David Wilson W, Boykin DW, David-Cordonnier MH . Ориентация на ДНК-связывающую активность фактора транскрипции ERG человека с использованием новых гетероциклических дитиофендиамидинов. Nucleic Acids Res. 2013; 41: 125–38.
40. Ван С., Коллипара Р.К., Шривастава Н., Ли Р., Равиндранатан П., Эрнандес Е., Фриман Е., Хамфрис К. Г., Капур П., Лотан И., Фазли Л., Глив М. Е., Плимат С. Р. и др.Удаление онкогенного фактора транскрипции ERG путем ингибирования деубиквитиназы при раке простаты. Proc Natl Acad Sci USA. 2014; 111: 4251–56.
41. Нгуен Л.Т., Третьякова М.С., Сильвис М.Р., Лукас Дж., Клезович О., Коулман И., Болури Х., Кутявин В.И., Моррисси К., True LD, Нельсон П.С., Васиухин В. ERG активирует транскрипционную программу YAP1 и способствует развитию возрастных опухолей простаты. Раковая клетка. 2015; 27: 797–808.
42. Дарнелл Дж. Младший. Факторы транскрипции как мишени для лечения рака.Nat Rev Рак. 2002; 2: 740–49.
43. Bhagwat AS, Vakoc CR. Факторы транскрипции при раке. Тенденции рака. 2015; 1: 53–65.
44. Вебер Г.Ф. Почему в терапии рака не хватает эффективных препаратов против метастазирования? Cancer Lett. 2013; 328: 207–11.
45. Адамс Д.Л., Мартин С.С., Альпо Р.К., Шарпантье М., Цай С., Берган Р.К., Огден И.М., Каталония В., Чумсри С., Тан С.М., Кристофанилли М. Циркулирующие гигантские макрофаги как потенциальный биомаркер солидных опухолей. Proc Natl Acad Sci USA.2014; 111: 3514–19.
46. Рошан-Монири М, Хсинг М, Батлер М.С., Черкасов А, Ренни П.С. Орфанные ядерные рецепторы как мишени для лекарств для лечения рака простаты и груди. Лечение рака Ред. 2014 г .; 40: 1137–52.
47. Denmeade SR, Isaacs JT. История лечения рака простаты. Nat Rev Рак. 2002; 2: 389–96.
48. Группа химических вычислений. Молекулярная рабочая среда (MOE). 1010 Sherbooke St. West, Suite # 910, Montreal, QC, Canada, h4A 2R7, 2016.
49.Жолдос З., Рид Д., Саймон А., Саджад С.Б., Джонсон А.П. eHiTS: новая быстрая, исчерпывающая гибкая система стыковки лигандов. Модель графа Дж. Моля. 2007; 26: 198–212.
50. Lagorce D, Sperandio O, Baell JB, Miteva MA, Villoutreix BO. FAF-Drugs3: веб-сервер для расчета свойств соединения и проектирования химической библиотеки. Nucleic Acids Res. 2015; 43: W200–7.
51. Delaglio F, Grzesiek S, Vuister GW, Zhu G, Pfeifer J, Bax A. NMRPipe: система многомерной спектральной обработки, основанная на конвейерах UNIX.J Biomol ЯМР. 1995; 6: 277–93.
52. Годдард Т.Д., Кнеллер Д.Г. СПАРКИ 3. Калифорнийский университет в Сан-Франциско. 1999.
53. Вестерфилд М. Книга о рыбках данио. Руководство по лабораторному использованию рыбок данио (Danio rerio), 4-е издание. Univ. из Oregon Press, Юджин. 2000.
Функциональный анализ мутаций рецепторов андрогенов, которые придают устойчивость к антиандрогенам, выявленную в циркулирующей внеклеточной ДНК пациентов с раком простаты | Genome Biology
де Боно Дж. С., Логотетис С. Дж., Молина А., Физази К., Норт С., Чу Л. и др.Абиратерон и увеличение выживаемости при метастатическом раке простаты. N Engl J Med. 2011; 364: 1995–2005.
PubMed Central Статья PubMed Google ученый
Ли З, Бишоп А.С., Алямани М., Гарсия Дж. А., Драйсер Р., Банч Д. и др. Превращение абиратерона в D4A стимулирует противоопухолевую активность при раке простаты. Природа. 2015; 523: 347–51.
PubMed Central Статья CAS PubMed Google ученый
Beer TM, Armstrong AJ, Rathkopf DE, Loriot Y, Sternberg CN, Higano CS и др. Энзалутамид при метастатическом раке простаты перед химиотерапией. N Engl J Med. 2014; 371: 424–33.
PubMed Central Статья PubMed Google ученый
Scher HI, Beer TM, Higano CS, Anand A, Taplin ME, Efstathiou E, et al. Противоопухолевая активность MDV3100 при устойчивом к кастрации раке простаты: исследование 1-2 фазы. Ланцет. 2010; 375: 1437–46.
PubMed Central Статья CAS PubMed Google ученый
Montgomery RB, Mostaghel EA, Vessella R, Hess DL, Kalhorn TF, Higano CS, et al. Поддержание внутриопухолевых андрогенов при метастатическом раке простаты: механизм роста опухоли, устойчивой к кастрации. Cancer Res. 2008. 68: 4447–54.
PubMed Central Статья CAS PubMed Google ученый
Молер Дж. Л., Грегори К. В., Форд 3-й ОН, Ким Д., Уивер К. М., Петруш П. и др. Андрогенная ось при рецидивирующем раке простаты. Clin Cancer Res. 2004; 10: 440–8.
Артикул CAS PubMed Google ученый
Дем С.М., Тиндалл DJ. Альтернативно сплайсированные варианты рецепторов андрогенов. Endocr Relat Cancer. 2011; 18: R183–196.
PubMed Central Статья CAS PubMed Google ученый
Watson PA, Chen YF, Balbas MD, Wongvipat J, Socci ND, Viale A и др. Варианты сплайсинга конститутивно активных андрогенных рецепторов, экспрессируемые при устойчивом к кастрации раке простаты, требуют полноразмерного андрогенного рецептора. Proc Natl Acad Sci U S. A. 2010; 107: 16759–65.
PubMed Central Статья CAS PubMed Google ученый
Таплин М.Э., Бубли Г.Дж., Шустер Т.Д., Франц М.Э., Спунер А.Е., Огата Г.К. и др. Мутация гена рецептора андрогенов при метастатическом андрогеннезависимом раке простаты.N Engl J Med. 1995; 332: 1393–8.
Артикул CAS PubMed Google ученый
Сузуки Х, Сато Н., Ватабе Й, Масаи М., Сейно С., Шимазаки Дж. Мутации гена рецептора андрогенов при раке простаты человека. J Стероид Biochem Mol Biol. 1993. 46: 759–65.
Артикул CAS PubMed Google ученый
Таплин М.Э., Бубли Г.Дж., Ко Ю.Дж., Смолл Э.Дж., Аптон М., Раджешкумар Б. и др.Селекция на мутации рецепторов андрогенов при раке простаты, леченном антагонистами андрогенов. Cancer Res. 1999; 59: 2511–5.
CAS PubMed Google ученый
Уолтеринг К.К., Урбануччи А., Висакорпи Т. Аберрации рецепторов андрогенов (AR) при устойчивом к кастрации раке простаты. Mol Cell Endocrinol. 2012; 360: 38–43.
Артикул CAS PubMed Google ученый
Лоренте Д., Матео Дж., Зафейриу З., Смит А.Д., Сандху С., Ферральдески Р. и др. Смена и отмена гормональных препаратов при устойчивом к кастрации раке простаты. Нат Рев Урол. 2015; 12: 37–47.
Артикул CAS PubMed Google ученый
Bohl CE, Miller DD, Chen J, Bell CE, Dalton JT. Структурная основа аккомодации нестероидных лигандов в рецепторе андрогенов. J Biol Chem. 2005; 280: 37747–54.
PubMed Central Статья CAS PubMed Google ученый
Чжао XY, Маллой П.Дж., Кришнан А.В., Свами С., Навоне Н.М., Пил Д.М. и др. Глюкокортикоиды могут способствовать андроген-независимому росту клеток рака простаты через мутировавший рецептор андрогенов. Nat Med. 2000. 6: 703–6.
Артикул CAS PubMed Google ученый
Bohl CE, Gao W., Miller DD, Bell CE, Dalton JT. Структурная основа антагонизма и устойчивости бикалутамида при раке простаты. Proc Natl Acad Sci U S A.2005. 102: 6201–6.
PubMed Central Статья CAS PubMed Google ученый
Хара Т., Миядзаки Дж., Араки Х., Ямаока М., Канзаки Н., Кусака М. и др. Новые мутации рецептора андрогенов: возможный механизм синдрома отмены бикалутамида. Cancer Res. 2003. 63: 149–53.
CAS PubMed Google ученый
Таплин М.Э., Раджешкумар Б., Халаби С., Вернер С.П., Вода Б.А., Пикус Дж. И др.Мутации рецепторов андрогенов при андроген-независимом раке простаты: исследование рака и лейкемии, группа B, 9663. J. Clin Oncol. 2003. 21: 2673–8.
Артикул CAS PubMed Google ученый
Korpal M, Korn JM, Gao X, Rakiec DP, Ruddy DA, Doshi S, et al. Мутация F876L в рецепторе андрогенов придает генетическую и фенотипическую устойчивость к MDV3100 (энзалутамиду). Рак Discov. 2013; 3: 1030–43.
Артикул CAS PubMed Google ученый
Balbas MD, Evans MJ, Hosfield DJ, Wongvipat J, Arora VK, Watson PA и др. Преодоление мутационной устойчивости к антиандрогенам с помощью рационального дизайна лекарств. Элиф. 2013; 2: e00499.
Артикул PubMed Google ученый
Джозеф Дж. Д., Лу Н., Цянь Дж., Сенсинтаффар Дж., Шао Дж., Бригам Д. и др. Клинически значимая мутация рецептора андрогена придает устойчивость к антиандрогенам второго поколения энзалутамиду и ARN-509.Рак Discov. 2013; 3: 1020–9.
Артикул CAS PubMed Google ученый
Шварценбах Х., Аликс-Панабьер С., Мюллер И., Летанг Н., Вендрелл Дж. П., Ребиллард Х и др. Внеклеточная опухолевая ДНК в плазме крови как маркер циркулирующих опухолевых клеток при раке простаты. Clin Cancer Res. 2009; 15: 1032–8.
Артикул CAS PubMed Google ученый
Swarup V, Rajeswari MR. Циркулирующие (бесклеточные) нуклеиновые кислоты – многообещающий неинвазивный инструмент для раннего выявления ряда заболеваний человека. FEBS Lett. 2007; 581: 795–9.
Артикул CAS PubMed Google ученый
Schwarzenbach H, Hoon DS, Pantel K. Внеклеточные нуклеиновые кислоты как биомаркеры у онкологических больных. Nat Rev Рак. 2011; 11: 426–37.
Артикул CAS PubMed Google ученый
Azad AA, Volik SV, Wyatt AW, Haegert A, Le Bihan S, Bell RH, et al. Аберрации гена рецептора андрогенов в циркулирующей внеклеточной ДНК: биомаркеры терапевтической устойчивости при устойчивом к кастрации раке простаты. Clin Cancer Res. 2015; 21 (10): 2315–24.
Артикул CAS PubMed Google ученый
Мунуганти Рави С.Н., Хассона Мохамед Д.Х., Леблан Э., Фревин К., Сингх К., Ма Д. и др. Идентификация мощного антиандрогена, который нацелен на сайт BF3 рецептора андрогена и ингибирует устойчивый к энзалутамиду рак простаты.Chem Biol. 2014; 21: 1476–85.
Артикул CAS PubMed Google ученый
Jehle K, Cato L, Neeb A, Muhle-Goll C, Jung N, Smith EW, et al. Корегуляторный контроль действия рецепторов андрогенов с помощью нового мотива связывания ядерных рецепторов. J Biol Chem. 2014; 289: 8839–51.
PubMed Central Статья CAS PubMed Google ученый
Эстебанес-Перпина Э., Арнольд Л.А., Нгуен П., Родригес Э.Д., Мар Э., Бейтман Р. и др.Поверхность на рецепторе андрогенов, которая аллостерически регулирует связывание коактиватора. Proc Natl Acad Sci U S. A. 2007; 104: 16074–9.
PubMed Central Статья CAS PubMed Google ученый
Monge A, Jagla M, Lapouge G, Sasorith S, Cruchant M, Wurtz JM и др. Неверность и беспорядочные половые связи мутантного рецептора андрогена при гормонорезистентном раке простаты. Cell Mol Life Sci. 2006; 63: 487–97.
Артикул CAS PubMed Google ученый
van de Wijngaart DJ, Molier M, Lusher SJ, Hersmus R, Jenster G, Trapman J, et al. Систематический структурно-функциональный анализ мутантов андрогенного рецептора Leu701 объясняет свойства мутанта рака простаты L701H. J Biol Chem. 2010. 285: 5097–105.
PubMed Central Статья PubMed Google ученый
Дафф Дж., Макьюэн И.Дж. Мутация гистидина 874 в лиганд-связывающем домене рецептора андрогена приводит к беспорядочной активации лиганда и изменению взаимодействий коактиватора p160.Мол Эндокринол. 2005; 19: 2943–54.
Артикул CAS PubMed Google ученый
Фентон М.А., Шустер Т.Д., Фертиг А.М., Таплин М.Э., Колвенбаг Г., Бубли Г.Дж. и др. Функциональная характеристика мутантных рецепторов андрогенов от андроген-независимого рака простаты. Clin Cancer Res. 1997; 3: 1383–8.
CAS PubMed Google ученый
Hoffman-Censits J, Kelly WK.Энзалутамид: новый антиандроген для пациентов с кастратрезистентным раком простаты. Clin Cancer Res. 2013; 19: 1335–9.
Артикул CAS PubMed Google ученый
Pal SK, Stein CA, Sartor O. Энзалутамид для лечения рака простаты. Эксперт Opin Pharmacother. 2013; 14: 679–85.
Артикул CAS PubMed Google ученый
Vogelzang NJ.Энзалутамид – большой шаг вперед в лечении метастатического рака простаты. N Engl J Med. 2012; 367: 1256–7.
Артикул PubMed Google ученый
Clegg NJ, Wongvipat J, Joseph JD, Tran C, Ouk S, Dilhas A, et al. ARN-509: новый антиандроген для лечения рака простаты. Cancer Res. 2012; 72: 1494–503.
PubMed Central Статья CAS PubMed Google ученый
Торен П.Дж., Ким С., Фам С., Мангалджи А., Адомат Х, Guns ES и др. Противораковая активность нового селективного ингибитора CYP17A1 на доклинических моделях кастратрезистентного рака простаты. Mol Cancer Ther. 2015; 14: 59–69.
Артикул CAS PubMed Google ученый
Romanel A, Tandefelt DG, Conteduca V, Jayaram A, Casiraghi N, Wetterskog D, et al. Плазменный АР и абиратерон-резистентный рак простаты. Sci Transl Med.2015; 7: 312re310.
Артикул Google ученый
Чен Э., Совальский А.Г., Гао С., Цай К., Вознесенский О., Шефер Р. и др. Лечение абиратероном при устойчивом к кастрации раке простаты приводит к селекции мутантных рецепторов андрогенов, чувствительных к прогестерону. Clin Cancer Res. 2015; 21 (6): 1273–80.
Артикул CAS PubMed Google ученый
Де Леон Дж. Т., Иваи А., Фо С., Гарсия Ю., Балсигер Н. А., Сторер К. Л. и др.Нацеленная на регуляцию передачи сигналов рецептора андрогена с помощью коаперона 90 теплового шока FKBP52 в клетках рака простаты. Proc Natl Acad Sci U S. A. 2011; 108: 11878–83.
PubMed Central Статья PubMed Google ученый
Munuganti RS, Leblanc E, Axerio-Cilies P, Labriere C, Frewin K, Singh K и др. Нацеливание на сайт функции связывания 3 (BF3) рецептора андрогенов посредством виртуального скрининга. 2. Разработка производных 2 – ((2-феноксиэтил) тио) -1H-бензимидазола.J Med Chem. 2013; 56: 1136–48.
Артикул CAS PubMed Google ученый
Lack NA, Axerio-Cilies P, Tavassoli P, Han FQ, Chan KH, Feau C, et al. Нацеливание на сайт функции связывания 3 (BF3) человеческого рецептора андрогенов посредством виртуального скрининга. J Med Chem. 2011; 54: 8563–73.
PubMed Central Статья CAS PubMed Google ученый
Ban F, Leblanc E, Li H, Munuganti RS, Frewin K, Rennie PS и др. Открытие 1H-индол-2-карбоксамидов в качестве новых ингибиторов функции связывания рецептора андрогена 3 (BF3). J Med Chem. 2014; 57: 6867–72.
Артикул CAS PubMed Google ученый
Лаллоус Н, Далал К, Черкасов А, Ренни ПС. Нацеливание на альтернативные участки рецептора андрогенов для лечения резистентного к кастрации рака простаты. Int J Mol Sci. 2013; 14: 12496–519.
PubMed Central Статья PubMed Google ученый
Далал К., Рошан-Монири М., Шарма А., Ли Х., Бан Ф., Хассона М.Д. и др. Селективное нацеливание на ДНК-связывающий домен рецептора андрогенов в качестве перспективной терапии рака простаты. J Biol Chem. 2014; 289: 26417–29.
PubMed Central Статья CAS PubMed Google ученый
Jenster G, van der Korput HA, van Vroonhoven C, van der Kwast TH, Trapman J, Brinkmann AO. Домены рецептора андрогена человека, участвующие в связывании стероидов, активации транскрипции и субклеточной локализации. Мол Эндокринол. 1991; 5: 1396–404.
Артикул CAS PubMed Google ученый
Робинсон Д., Ван Аллен Е.М., Ву Ю.М., Шульц Н., Лонигро Р.Дж., Москера Д.М. и др. Интегративная клиническая геномика распространенного рака простаты.Клетка. 2015; 161: 1215–28.
Артикул CAS PubMed Google ученый
Scher HI, Sawyers CL. Биология прогрессирующего, устойчивого к кастрации рака простаты: направленная терапия, нацеленная на сигнальную ось рецепторов андрогенов. J Clin Oncol. 2005; 23: 8253–61.
Артикул CAS PubMed Google ученый
Veldscholte J, Ris-Stalpers C, Kuiper GG, Jenster G, Berrevoets C, Claassen E, et al.Мутация в лиганд-связывающем домене рецептора андрогенов человеческих клеток LNCaP влияет на характеристики связывания стероидов и ответ на антиандрогены. Biochem Biophys Res Commun. 1990; 173: 534–40.
Артикул CAS PubMed Google ученый
Culig Z, Hobisch A, Cronauer MV, Cato AC, Hittmair A, Radmayr C, et al. Мутантный рецептор андрогенов, обнаруженный на поздней стадии карциномы предстательной железы, активируется андрогенами надпочечников и прогестероном.Мол Эндокринол. 1993; 7: 1541–50.
CAS PubMed Google ученый
Ньюмарк Дж. Р., Харди Д. О., Тонб Д. К., Картер Б. С., Эпштейн Д. И., Айзекс В. Б. и др. Мутации гена рецептора андрогенов при раке простаты человека. Proc Natl Acad Sci U S. A. 1992; 89: 6319–23.
PubMed Central Статья CAS PubMed Google ученый
Денис Л., Малер К. Фармакодинамика и фармакокинетика бикалутамида: определение активного режима дозирования.Урология. 1996; 47: 26–8. обсуждение 29–32.
Артикул CAS PubMed Google ученый
Gao W., Bohl CE, Dalton JT. Химия и структурная биология рецептора андрогенов. Chem Rev.2005; 105: 3352–70.
PubMed Central Статья CAS PubMed Google ученый
He B, Gampe Jr RT, Kole AJ, Hnat AT, Stanley TB, An G, et al. Структурная основа междоменных и коактиваторных взаимодействий рецепторов андрогенов предполагает переход в преобладание функции активации ядерных рецепторов.Mol Cell. 2004. 16: 425–38.
Артикул CAS PubMed Google ученый
Thorvaldsdóttir H, Robinson JT, Mesirov JP. Integrative Genomics Viewer (IGV): высокопроизводительная визуализация и исследование данных геномики. Краткий биоинформ. 2013; 14: 178–92.
PubMed Central Статья PubMed Google ученый
Использование сетей VPC | Google Cloud
На этой странице описано, как создавать, изменять и удалять VPC. сети.На этой странице предполагается, что вы знакомы с характеристиками Сети VPC, описанные в сети VPC обзор. Сети и подсети разные ресурсы в Google Cloud.
Попробуйте сами
Если вы новичок в Google Cloud, создайте учетную запись, чтобы оценить, как VPC работает в реальном мире сценарии. Новые клиенты также получают 300 долларов в качестве бесплатных кредитов для запуска, тестирования и развертывать рабочие нагрузки.
Попробуйте VPC бесплатноСоздание сетей
Вы можете создать сеть VPC в автоматическом или индивидуальном режиме.Каждая новая сеть, которую вы создаете, должна иметь уникальное имя в пределах одного и того же проект.
Создание сети в автоматическом режиме
Сети в автоматическом режиме создают одну подсеть в каждом облаке Google регион автоматически при создании сети. По мере того как новые регионы становятся доступны, новые подсети в этих регионах автоматически добавляются в режим сети. Диапазоны IP для автоматически созданных подсетей приходят из заранее определенного набора диапазонов. Все авто сети режима используют тот же набор диапазонов IP.
Важно: Прочтите рекомендации по автоматическому режиму сетей, прежде чем создавать одну для производственное использование. Производственные сети следует планировать заранее, а Режимные сети лучше подходят для большинства производственных сценариев.Консоль
- Перейдите на страницу сетей VPC в Google Cloud Console.
Перейти на страницу сетей VPC - Щелкните Создать сеть VPC .
- Введите Имя для сети.
- Выберите Автоматически для режима создания подсети .
- В разделе Правила брандмауэра выберите одно или несколько предопределенных правила брандмауэра, которые касаются распространенных случаев использования подключение к виртуальным машинам. Если вы не хотите их использовать, выберите без правил. Вы можете создать свои собственные правила брандмауэра после вы создаете сеть.
Выберите Режим динамической маршрутизации для сети VPC.
Для получения дополнительной информации см. Динамическую маршрутизацию. режим. Вы можете изменить режим динамической маршрутизации позже.
Максимальный блок передачи (MTU) : Выберите, есть ли в сети MTU
1460(по умолчанию) или1500.Просмотрите информацию о MTU в ознакомьтесь с концепциями перед установкой MTU на1500.Щелкните Создать .
gcloud
Создайте сеть в автоматическом режиме, используя следующую команду gcloud :
Вычислительные сети gcloud создают СЕТЬ \
--subnet-mode = авто \
--bgp-routing-mode = DYNAMIC_ROUTING_MODE \
--mtu = MTU
Замените заполнители допустимыми значениями:
- СЕТЬ – это имя сети VPC.
- DYNAMIC_ROUTING_MODE может быть
глобальнымилирегиональнымдля управления поведение облачных маршрутизаторов в сети. Для большего информация, обратитесь к динамической маршрутизации режим. - MTU – максимальная единица передачи в сети. MTU может
либо
1460(по умолчанию), либо1500. Просмотрите информацию о MTU в перед настройкой MTU на1500.
API
Создайте сеть с автоматическим режимом.
POST https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / global / networks
{
"autoCreateSubnetworks": true,
"name": "auto-network1",
"mtu": MTU
} Заменить следующее:
- PROJECT_ID – идентификатор проекта, в котором VPC сеть создана.
- MTU – максимальная единица передачи в сети. MTU может
либо
1460(по умолчанию), либо1500. Просмотрите информацию о MTU в перед настройкой MTU на1500.
Чтобы указать динамическую маршрутизацию
Режим
сети VPC используйте поле routingConfig :
POST https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / global / networks
{
"routingConfig": {
"routingMode": " DYNAMIC_ROUTING_MODE "
},
"autoCreateSubnetworks": true,
"name": " СЕТЬ ",
"mtu": MTU
} Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, в котором VPC сеть создана.
- СЕТЬ – это имя сети VPC.
- DYNAMIC_ROUTING_MODE может быть
глобальнымилирегиональнымдо управлять поведением объявления маршрута облачных маршрутизаторов в сеть. Для получения дополнительной информации см. Динамическую маршрутизацию. режим. - MTU – максимальная единица передачи в сети. MTU может
либо
1460(по умолчанию), либо1500. Просмотрите информацию о MTU в перед настройкой MTU на1500.
Для получения дополнительной информации см. networks.insert метод.
Создание сети в настраиваемом режиме
Для сетей VPC в настраиваемом режиме создайте сеть, а затем создайте подсети, которые вы хочу в пределах региона. Необязательно указывать подсети для всех регионов правильно прочь, или даже совсем, но вы не можете создавать экземпляры в регионе, в котором нет подсеть определена.
Вы можете создавать подсети при создании сети, или вы можете добавить подсети позже.
Консоль
- Перейдите на страницу сетей VPC в Google Cloud Console.
Перейти на страницу сетей VPC - Щелкните Создать сеть VPC .
- Введите Имя для сети.
- Выберите Custom для режима создания подсети .
В разделе Новая подсеть укажите следующую конфигурацию параметры для подсети:
- Укажите Имя для подсети.
- Выберите регион .
Введите диапазон IP-адресов . Это основной IP диапазон для подсети.
Если вы выбрали диапазон, который не является адресом RFC 1918, убедитесь, что диапазон не конфликтует с существующей конфигурацией. Для большего информацию см. Подсеть диапазоны.
Чтобы определить вторичный диапазон для подсети, нажмите Создать вторичный Диапазон IP .
Если вы выбрали диапазон, который не является адресом RFC 1918, убедитесь, что диапазон не конфликтует с существующей конфигурацией.Для большего информацию см. Подсеть диапазоны.
Частный доступ к Google : выберите, следует ли включить Частный доступ к Google для подсеть при ее создании или позже при ее редактировании.
Журналы потоков : выберите, следует ли включать поток VPC журналы для подсети при ее создании или позже, отредактировав его.
Нажмите Готово .
Чтобы добавить другие подсети, щелкните Добавить подсеть и повторите предыдущие шаги.Вы также можете добавить в сеть дополнительные подсети после того, как вы создали сеть.
Выберите Режим динамической маршрутизации для сети VPC.
Для получения дополнительной информации см. Динамическую маршрутизацию. режим. Вы можете изменить режим динамической маршрутизации позже.
Максимальный блок передачи (MTU) : Выберите, есть ли в сети MTU
1460(по умолчанию) или1500. Просмотрите информацию о MTU в ознакомьтесь с концепциями перед установкой MTU на1500.Щелкните Создать .
gcloud
Создайте новую сеть с настраиваемым режимом, используя следующую команду gcloud . После
вы создали свою сеть, добавьте в нее подсети, выполнив добавление
подсети направления.
Вычислительные сети gcloud создают СЕТЬ \
--subnet-mode = custom \
--bgp-routing-mode = DYNAMIC_ROUTING_MODE \
--mtu = MTU
Замените заполнители допустимыми значениями:
- СЕТЬ – это имя сети VPC.
- DYNAMIC_ROUTING_MODE может быть
глобальнымилирегиональнымдо управлять поведением объявления маршрута облачных маршрутизаторов в сеть. Для получения дополнительной информации см. Динамическую маршрутизацию. режим. - MTU – максимальная единица передачи в сети. MTU может
либо
1460(по умолчанию), либо1500. Просмотрите информацию о MTU в перед настройкой MTU на1500.
API
Создайте сеть с настраиваемым режимом.
POST https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / global / networks
{
"autoCreateSubnetworks": false,
"name": " СЕТЬ ",
"mtu": MTU ,
"routingConfig": {
"routingMode": " DYNAMIC_ROUTING_MODE "
}
}
Замените следующие заполнители значениями из вашей среды:
- PROJECT_ID – идентификатор проекта, в котором VPC сеть создана.
- СЕТЬ – это имя сети VPC.
- DYNAMIC_ROUTING_MODE может быть
глобальнымилирегиональнымдо управлять поведением объявления маршрута облачных маршрутизаторов в сеть. Для получения дополнительной информации см. Динамическую маршрутизацию. режим. - MTU – максимальная единица передачи в сети. MTU может
либо
1460(по умолчанию), либо1500. Просмотрите информацию о MTU в перед настройкой MTU на1500.
Для получения дополнительной информации см. сетей.вставить метод .
Terraform
Вы можете создать сеть VPC в настраиваемом режиме с подсетями, используя Модуль Terraform.
Например, вы можете добавить этот блок в свою конфигурацию Terraform:
модуль "vpc" {
source = "terraform-google-modules / network / google"
версия = "~> 2.5"
project_id = " PROJECT_ID "
network_name = " NETWORK_NAME "
routing_mode = " ROUTING_MODE "
подсети = [
{
subnet_name = " ИМЯ ПОДСЕТИ "
subnet_ip = " SUBNET_RANGE "
subnet_region = " SUBNET_REGION "
}
]
}
Заменить следующее:
- PROJECT_ID – идентификатор проекта, в котором создается сеть VPC.
- NETWORK_NAME – имя сети VPC.
- ROUTING_MODE может быть
глобальнымилирегиональнымдо управлять поведением объявления маршрута облачных маршрутизаторов в сеть. Для получения дополнительной информации см. Динамическую маршрутизацию. режим. - SUBNET_NAME – имя новой подсети.
- SUBNET_RANGE – это основной диапазон IP-адресов для подсети. За подробнее см. Подсеть диапазоны.
- SUBNET_REGION – регион, в котором расположена подсеть.
О правилах межсетевого экрана
После создания сети создайте правила брандмауэра. разрешить или запретить трафик между ресурсами в сети, например, связь между экземплярами ВМ. Вы также используете правила брандмауэра, чтобы контролировать, какой трафик уходит. или входит в сеть VPC в Интернет или из Интернета.
Просмотр сетей
Просмотрите VPC и устаревшие сети в вашем проекте.За Сетей VPC, вы можете просматривать информацию об их подсетях и их режим создания подсети.
Консоль
Перейдите на страницу сетей VPC в консоли Google Cloud.
Перейти на страницу сетей VPCНа консоли перечислены все ваши VPC и устаревшие сети.
Выберите сеть VPC, чтобы просмотреть сведения о ней, например пиринговые соединения и подсети.
gcloud
Перечислите сети в вашем проекте, как показано в следующем примере.
список вычислительных сетей gcloud
Команда выводит список всех ваших VPC и старых сетей. Устаревшие сети показывают режим создания подсети
LEGACY, а В сетях VPC отображаетсяAUTOилиCUSTOM.ИМЯ SUBNET_MODE BGP_ROUTING_MODE IPV4_RANGE GATEWAY_IPV4 custom-network ТАМОЖЕННЫЙ РЕГИОНАЛЬНЫЙ по умолчанию АВТО РЕГИОНАЛЬНЫЙ legacy-network1 УСТАРЕВШИЙ РЕГИОНАЛЬНЫЙ 10.240.0.0/16 10.240.0,1
Опишите сеть, чтобы просмотреть подробные сведения о ней, например пиринговые соединения. и подсети.
Вычислительные сети gcloud описывают СЕТЬ
API
Список всех сетей в вашем проекте.
ПОЛУЧИТЬ https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / global / networks
Замените PROJECT_ID на идентификатор проекта, который содержит список сетей VPC.
Для получения дополнительной информации см.
networks.listметод.Опишите сеть, чтобы просмотреть подробные сведения о ней.
ПОЛУЧИТЬ https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / global / networks / СЕТЬ
Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, который содержит Сеть VPC.
- СЕТЬ – имя сети VPC. описать.
Для получения дополнительной информации см.
networks.getметод.
Работа с подсетями
При создании или редактировании подсети необходимо соблюдать следующие правила:
В рамках проекта подсеть не может иметь то же имя, что и VPC. сеть, если он не является членом этой сети. Внутри проекта подсети в один и тот же регион должен иметь уникальные имена. Например, сеть с именем
productionможет иметь несколько подсетей, также называемыхproduction, пока каждая из этих подсетей находится в уникальном регионе.Вы не можете изменить имя или регион подсети после того, как вы ее создали. Однако вы можете удалить подсеть и заменить ее, если нет ресурсов. используй это.
Каждая подсеть должна иметь основной диапазон и, необязательно, один или несколько дополнительных диапазоны для псевдонима IP. По сети пределы описывают максимальное количество вторичных диапазоны, которые вы можете определить для каждой подсети. Первичный и вторичный диапазоны IP-адресов должен быть допустимым диапазоном.
В сети VPC все диапазоны первичных и вторичных IP-адресов должны быть уникальными, но они не должны быть смежными , а не .Например, основной диапазон подсети может быть
10.0.0.0/24, в то время как основной диапазон другой подсети в той же сети может быть192.168.0.0/16.Основной диапазон IP-адресов для подсети можно расширить, но не заменяются и не сокращаются после создания подсети.
Вы можете удалить и заменить диапазон вторичных IP-адресов подсети, только если ни один экземпляр не использует этот диапазон.
Минимальный размер первичного или вторичного диапазона составляет восемь IP-адресов.В Другими словами, самая длинная маска подсети, которую вы можете использовать, –
/29.
Первичный и вторичный диапазоны для подсетей не могут перекрываться ни с какими выделенный диапазон, любой основной или вторичный диапазон другой подсети в той же сети или любые диапазоны IP-адресов подсетей в пиринговых сетях.
Google Cloud создает соответствующую подсеть маршруты для первичного и вторичного IP диапазоны. Маршруты подсети и, следовательно, диапазоны IP-адресов подсети должны иметь наибольшее количество конкретные диапазоны IP по определению.
Первичный и вторичный диапазоны не могут конфликтовать с локальными диапазонами IP-адресов, если вы подключили свою сеть VPC к другой сети с Cloud VPN, Выделенное межсоединение или партнерское межсоединение.
Диапазоны IP-адресов для всех подсетей должны быть уникальными среди VPC сети, которые связаны друг с другом VPC Сетевой пиринг.
Диапазоны IP-адресов подсети не могут конфликтовать с местами назначения для статических маршруты.
Избегайте использования IP-адресов из
10.128.0.0 / 9блок для первичной подсети или вторичные диапазоны IP-адресов. Автоматически созданные подсети в автоматическом режиме сети используют IP-адреса из этого блока. если ты используйте IP-адреса в блоке10.128.0.0/9, вы не сможете подключиться из вашей сети в сеть VPC в автоматическом режиме, используя Пиринг VPC или туннели Cloud VPN.
Вывод списка подсетей
Вы можете увидеть все подсети, существующие для проекта.
Консоль
- Перейдите на страницу сетей VPC в Google Cloud Console.
Перейти на страницу сетей VPC
Подсети во всех сетях VPC показаны. - Щелкните имя сети, затем щелкните вкладку Подсети на Информация о сети VPC страница для просмотра подсетей только для этой сети, а не для всех сетей.
gcloud
Вы можете перечислить все подсети во всех сетях вашего проекта или показать только подсети для конкретной сети или региона. Следующий список показывает примеры команд.
Используйте эту команду для вывода списка всех подсетей во всех сетях VPC, во всех регионах:
gcloud список подсетей вычислительных сетей
Используйте эту команду для вывода списка всех подсетей в определенном VPC. сеть, заменив NETWORK на имя сети:
gcloud список подсетей вычислительных сетей \ --network = СЕТЬ
Используйте эту команду для вывода списка всех подсетей в определенном регионе, заменив REGION с названием региона:
gcloud список подсетей вычислительных сетей \ --filter = "регион :( РЕГИОН …)"
API
Список всех подсетей в вашем проекте.
ПОЛУЧИТЬ https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / aggregated / subnetworks
Замените PROJECT_ID на идентификатор проекта, который содержит подсети в список.
Для получения дополнительной информации см. subnetworks.aggregatedList метод.
Описание подсети
Вы можете просмотреть подробную информацию о существующей подсети, например, ее основной диапазон IP-адресов, любой дополнительные диапазоны IP-адресов и их регион, выполнив действия, описанные в этом разделе.
Консоль
- Перейдите на страницу сетей VPC в Google Cloud Console.
Перейти на страницу сетей VPC
Все сети и подсети в вашем проекте представлены в иерархическом виде, где подсети показаны в виде записей внутри сетей. - Чтобы сосредоточиться на подсетях для конкретной сети, щелкните имя сеть. На странице сведений о сети VPC щелкните имя подсети в вкладка Subnets , чтобы просмотреть страницу со сведениями о подсети .
gcloud
Список подсетей для определения имен и регионы существующих подсетей в вашем проекте.
Опишите подсеть с помощью следующей команды
gcloud, заменив ПОДСЕТЬ с его именем и РЕГИОН с его область, край.Подсети вычислительных сетей gcloud описывают ПОДСЕТЬ \ --region = РЕГИОН
API
Список подсетей в определенном регионе, чтобы найти имя подсети.
ПОЛУЧИТЬ https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / регионы / РЕГИОН / подсети
Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, который содержит подсети в список.
- РЕГИОН – это название региона Google Cloud, в котором содержит подсети для списка.
Для получения дополнительной информации см.
subnetworks.listметод.Опишите подсети, чтобы просмотреть подробные сведения.
ПОЛУЧИТЬ https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / регионы / REGION / subnetworks / SUBNET
Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, который содержит подсеть для описания.
- РЕГИОН – это название региона Google Cloud, в котором содержит описываемую подсеть.
- ПОДСЕТЬ – имя описываемой подсети.
Для получения дополнительной информации см.
subnetworks.getметод.
Добавление подсетей
При создании подсети вы устанавливаете имя, регион и, по крайней мере, основной IP-адрес. диапазон адресов согласно правилам подсети.
Консоль
- Перейдите на страницу сетей VPC в Google Cloud Console.
Перейти на страницу сетей VPC - Щелкните имя сети VPC, чтобы отобразить ее сеть VPC. подробности стр.
Щелкните Добавить подсеть . В появившейся панели:
- Укажите имя .
- Выберите регион .
Введите диапазон IP-адресов . Это основной IP диапазон для подсети.
Если вы выбрали диапазон, который не является адресом RFC 1918, убедитесь, что диапазон не конфликтует с существующей конфигурацией. Для большего информацию см. Подсеть диапазоны.
Чтобы определить вторичный диапазон для подсети, нажмите Создать вторичный Диапазон IP .
Если вы выбрали диапазон, который не является адресом RFC 1918, убедитесь, что диапазон не конфликтует с существующей конфигурацией. Для большего информацию см. Подсеть диапазоны.
Частный доступ к Google : Вы можете включить Частный доступ к Google для подсеть при ее создании или позже при ее редактировании.
Журналы потоков : вы можете включить поток VPC журналы для подсети при ее создании или позже, отредактировав его.
Щелкните Добавить .
gcloud
Следующая команда gcloud создает новую подсеть в данной сети.
Подсети вычислительных сетей gcloud создают ПОДСЕТЬ \
--network = СЕТЬ \
--range = ПЕРВИЧНЫЙ_ДИАПАЗОН \
--region = РЕГИОН
Замените заполнители допустимыми значениями:
- ПОДСЕТЬ – имя новой подсети.
- СЕТЬ – имя сети VPC, которая будет содержать новую подсеть.
- PRIMARY_RANGE – это основной диапазон IP-адресов для новой подсети в Обозначение CIDR. Для получения дополнительной информации см. Подсеть. диапазоны.
- РЕГИОН – регион Google Cloud, в котором новая подсеть будет создан.
Вы можете изменить предыдущую команду с помощью следующих дополнительных флагов:
-
--secondary-range =SECONDARY_RANGE_NAME=SECONDARY_RANGE : Замените SECONDARY_RANGE_NAME именем дополнительного диапазона и SECONDARY_RANGE со вторичным диапазоном в нотации CIDR.В ограничения на сеть описывают максимум количество дополнительных диапазонов, которые вы можете определить для каждой подсети. -
--enable-flow-logs: Включает журналы потоков VPC в подсеть во время создания. -
--enable-private-ip-google-access: Включает Частный доступ Google в подсети по адресу время создания. -
--purpose: позволяет создать подсеть только для прокси для Внутренняя балансировка нагрузки HTTP (S). -
--role: Только для внутренней балансировки нагрузки HTTP (S), позволяет указать роль (активная или резервная) только для прокси подсеть.
API
Создайте подсеть в данной сети VPC.
POST https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / region / REGION / subnetworks
{
"ipCidrRange": " IP_RANGE ",
"сеть": " NETWORK_URL ",
"имя": " ПОДСЕТЬ "
}
Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, который содержит Сеть VPC, которую нужно изменить.
- РЕГИОН – это название региона Google Cloud, в котором подсеть добавлена.
- IP_RANGE – это основной диапазон IP-адресов для подсети. За подробнее см. Подсеть диапазоны.
- NETWORK_URL – это URL-адрес сети VPC. где вы добавляете подсеть.
- ПОДСЕТЬ – имя подсети.
Для получения дополнительной информации см. подсетей. Вставка метод.
Удаление подсетей
Используйте следующие инструкции для удаления подсети, созданной вручную.Прежде чем ты сможешь При удалении подсети необходимо удалить все ресурсы, которые ее используют. Например, вы нужно удалить Виртуальные машины, зарезервированные внутренние IP-адреса, внутренние правила переадресации и Шлюзы Cloud NAT, использующие подсеть.
Примечание. Для сетей с автоматическим режимом: не может, удалить какие-либо автоматически созданы подсети. Однако вы можете преобразовать сеть с автоматическим режимом в настраиваемую. режим сети, а затем автоматически удалите неиспользуемые созданы подсети.Консоль
- Перейдите на страницу сетей VPC в Google Cloud Console.
Перейти на страницу сетей VPC
Все сети и подсети в вашем проекте представлены в иерархическом виде, где подсети отображаются как записи в сетях. - Чтобы сосредоточиться на подсетях для конкретной сети, щелкните имя сеть. На странице сведений о сети VPC щелкните имя подсети. на вкладке Подсети , чтобы просмотреть страницу со сведениями о подсети .
- Щелкните Удалить подсеть .
- В появившемся сообщении нажмите Удалить для подтверждения.
gcloud
Используйте следующую команду gcloud для удаления подсети:
gcloud вычислить подсети сети удалить ПОДСЕТЬ \
--region = РЕГИОН
Замените заполнители допустимыми значениями:
- ПОДСЕТЬ – имя удаляемой подсети.
- РЕГИОН – регион, в котором существует подсеть.
API
Удалить подсеть в данной сети VPC.
УДАЛИТЬ https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / регионы / РЕГИОН / subnetworks / ПОДСЕТЬ
Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, который содержит подсеть для Удалить.
- РЕГИОН – это название региона Google Cloud, в котором содержит описываемую подсеть.
- ПОДСЕТЬ – имя удаляемой подсети.
Для получения дополнительной информации см. subnetworks.delete метод.
Расширение диапазона первичных IP-адресов
Вы можете расширить основной диапазон IP-адресов существующей подсети, изменив ее маска подсети, установка длины префикса на меньшее число . Предлагаемый новый основной диапазон IP-адресов подсети должен следовать за подсетью правила.
При расширении диапазона IP автоматически созданной подсети в автоматическом режиме
сеть (или в сети с настраиваемым режимом, которая ранее была сетью с автоматическим режимом),
самый широкий префикс (маска подсети), который вы можете использовать, – /16 .Любой префикс шире, чем /16 будет конфликтовать с первичными диапазонами IP-адресов другого автоматически
созданы подсети.
Консоль
- Перейдите на страницу сетей VPC в Google Cloud Console.
Перейти на страницу сетей VPC
Все сети и подсети в вашем проекте представлены в иерархическом виде, где подсети отображаются как записи в сетях. - Чтобы сосредоточиться на подсетях для конкретной сети, щелкните имя сеть. На странице сведений о сети VPC щелкните имя подсети. на вкладке Подсети , чтобы просмотреть страницу со сведениями о подсети .
- Щелкните Изменить .
Введите новый, более широкий блок CIDR в поле диапазона IP-адресов .
Допустимые диапазоны см. В разделе Подсеть. диапазоны.
Нажмите Сохранить .
gcloud
Расширьте основной диапазон IP-адресов подсети с помощью следующей команды gcloud :
gcloud вычислительные сети подсети expand-ip-range SUBNET \ --region = РЕГИОН \ --prefix-length = PREFIX_LENGTH
Замените заполнители допустимыми значениями:
- ПОДСЕТЬ – имя подсети.
- РЕГИОН – регион, в котором расположена подсеть.
- PREFIX_LENGTH – размер маски подсети в битах. Если основной IP
диапазон:
10.1.2.0/24, вы можете указать20, чтобы уменьшить маску подсети до 20 бит, что изменяет диапазон первичных IP-адресов на10.1.2.0/20. Для действительного диапазоны, см. Подсеть диапазоны.
API
Расширение диапазона основных IP-адресов существующей подсети.
POST https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / регионы / REGION / subnetworks / SUBNET / expandIpCidrRange
{
"ipCidrRange": " IP_RANGE "
}
Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, который содержит подсеть для изменить.
- РЕГИОН – это название региона Google Cloud, в котором подсеть, которую нужно изменить.
- ПОДСЕТЬ – имя изменяемой подсети.
- IP_RANGE – это расширенный диапазон IP-адресов для подсети. За допустимые диапазоны, см. Подсеть диапазоны.
Для получения дополнительной информации см. subnetworks.expandIpCidrRange метод.
Редактирование вторичных диапазонов
Вы можете добавить дополнительные диапазоны IP-адресов в подсети или удалить любые вторичный диапазон, пока в нем не используются IP-адреса ресурсов.
gcloud
Добавьте новый вторичный диапазон IP-адресов в подсеть, используя следующий gcloud команда:
Обновление подсетей вычислительных сетей gcloud ПОДСЕТЬ \ --region = РЕГИОН \ --add-secondary-range = SECONDARY_RANGE_NAME = SECONDARY_RANGE
Замените заполнители допустимыми значениями:
- ПОДСЕТЬ – имя подсети.
- РЕГИОН – регион, в котором расположена подсеть.
- SECONDARY_RANGE_NAME – имя дополнительного диапазона.
- SECONDARY_RANGE – это вторичный диапазон IP-адресов в нотации CIDR. За допустимые диапазоны, см. Подсеть диапазоны.
Удалите дополнительный диапазон IP-адресов из подсети, используя следующий gcloud команда:
Обновление подсетей вычислительных сетей gcloud ПОДСЕТЬ \ --region = РЕГИОН \ --remove-secondary-range = ИМЯ_ДИАПАЗОНА_ДВИЖЕНИЯ
Замените заполнители допустимыми значениями:
- ПОДСЕТЬ – имя подсети.
- РЕГИОН – регион, в котором расположена подсеть.
- SECONDARY_RANGE_NAME – это имя дополнительного диапазона, который будет удаленный.
API
Изменение диапазонов дополнительных IP-адресов для существующей подсети.
ПАТЧ https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / регионы / РЕГИОН / subnetworks / ПОДСЕТЬ
{
"secondaryIpRanges": [
{
"rangeName": " SECONDARY_RANGE_NAME ",
"ipCidrRange": " IP_RANGE "
},
{
"rangeName": " SECONDARY_RANGE_NAME ",
"ipCidrRange": " IP_RANGE "
}],
"fingerprint": " SUBNETWORK_FINGERPRINT "
}
Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, который содержит подсеть для изменить.
- РЕГИОН – это название региона Google Cloud, в котором содержит изменяемую подсеть.
- ПОДСЕТЬ – имя изменяемой подсети.
- SECONDARY_RANGE_NAME – имя дополнительного IP-адреса. классифицировать.
- IP_RANGE – это расширенный диапазон IP-адресов для подсети. За допустимые диапазоны, см. Подсеть диапазоны.
- SUBNET_FINGERPRINT – идентификатор отпечатка пальца для существующего подсеть, которая предоставляется при описании подсеть.
Для получения дополнительной информации см. subnetworks.patch метод.
Изменение сетей
Переход в пользовательский режим
Вы можете преобразовать сеть с автоматическим режимом в сеть с пользовательским режимом, используя этот процедура. Ознакомьтесь с рекомендациями по автоматическому режиму сети для справочной информации о причинах, по которым вы могли бы захотеть это сделать.
Преобразование сети с автоматическим режимом в сеть с настраиваемым режимом сохраняет всех его автоматически созданные подсети и любые добавленные вами подсети.Имена подсети и диапазоны IP-адресов не меняются.
Важно: Невозможно преобразовать сеть с пользовательским режимом в сеть с автоматическим режимом. Преобразование из автоматического режима в пользовательский – это односторонний процесс. Сети в автоматическом режиме которые были преобразованы в пользовательский режим, работают так, как если бы они были созданы в Пользовательский режим. После преобразования сети с автоматическим режимом в пользовательский режим необходимо просмотреть все API
вызовы и команды gcloud , которые неявно ссылаются на любую подсеть, которая была
автоматически создается, когда сеть находится в автоматическом режиме.Вызовы и команды API
необходимо будет изменить так, чтобы они явно ссылались на подсеть. За gcloud команды, у которых есть флаг спецификации подсети ( --subnet ), этот флаг
требуется для ссылки на подсети в сети с настраиваемым режимом.
Консоль
- Перейдите на страницу сетей VPC в Google Cloud Console.
Перейти на страницу сетей VPC - Щелкните имя сети VPC, чтобы отобразить ее сеть VPC. подробности с.
- Щелкните Изменить .
- В разделе Режим создания подсети выберите Пользовательский .
- Нажмите Сохранить .
gcloud
Преобразуйте сеть с автоматическим режимом в сеть с настраиваемым режимом, используя следующие , заменив NETWORK именем сети.
Обновление вычислительных сетей gcloud СЕТЬ \
--switch-to-custom-subnet-mode
API
Преобразование существующей сети с автоматическим режимом в сеть с настраиваемым режимом.
POST https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / global / networks / СЕТЬ / switchToCustomMode
Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, который содержит Сеть VPC для преобразования.
- СЕТЬ – это имя сети VPC для конвертировать.
Для получения дополнительной информации см. networks.switchToCustomMode метод.
Изменение режима динамической маршрутизации
Каждая сеть VPC имеет связанный режим динамической маршрутизации, который контролирует поведение облачных маршрутизаторов в сети. Ссылаться на раздел режима динамической маршрутизации в Обзор сети VPC Страница , чтобы понять, как каждый режим влияет как облачные маршрутизаторы обмениваются маршрутами и применяют изученные маршруты.
Внимание: Изменение режима динамической маршрутизации может привести к прерыванию трафик внутри сети, а также включение или отключение маршрутов неожиданными способами.Внимательно изучите роль каждого облачного маршрутизатора, прежде чем менять режим динамической маршрутизации.Консоль
- Перейдите на страницу сетей VPC в Google Cloud Console.
Перейти на страницу сетей VPC - Щелкните имя сети VPC, чтобы отобразить ее сеть VPC. подробности с.
- Щелкните Изменить .
- В разделе Режим динамической маршрутизации выберите Глобальный или Региональный .
- Нажмите Сохранить .
gcloud
Измените режим динамической маршрутизации сети VPC с помощью
следующая команда gcloud :
Обновление вычислительных сетей gcloud СЕТЬ \
--bgp-routing-mode = DYNAMIC_ROUTING_MODE
Замените заполнители допустимыми значениями:
- NETWORK – имя сети VPC. чей режим динамической маршрутизации нужно изменить.
- DYNAMIC_ROUTING_MODE – это либо
global, либорегиональное, в зависимости от желаемого поведения всех облачных маршрутизаторов в сеть.
API
Изменение режима динамической маршрутизации существующей сети VPC.
ПАТЧ https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / global / networks / СЕТЬ
{
"routingConfig": {
"routingMode": " ROUTING_MODE "
}
}
Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, который содержит Сеть VPC, которую нужно изменить.
- СЕТЬ – это имя сети VPC для изменить.
- ROUTING_MODE – это либо
GLOBAL, либоREGIONAL.
Для получения дополнительной информации см. subnetworks.patch метод.
Изменение MTU сети
Каждая сеть VPC имеет MTU. Не стоит менять сеть MTU во время работы виртуальных машин. Это может привести к тому, что виртуальные машины будут разные MTU, что может привести к ненадежному сетевому подключению.
Подробнее об изменении MTU сети см. Максимальный блок передачи.
Рекомендуемый способ обновления сетевого MTU – остановить все запущенные экземпляры виртуальных машин, измените сетевой MTU, затем запустите все экземпляры. ВМ на основе предоставленных Google Образы Linux автоматически настраивают каждый из своих сетевых интерфейсов для использования MTU подключенной сети VPC при их запуске. Вы должны вручную обновить MTU виртуальных машин Windows и виртуальных машин на основе пользовательских образов, которые не полагаться на DHCP для настройки сетевого MTU.
Чтобы обновить MTU интерфейсов в виртуальных машинах Windows, выполните следующую команду в каждом экземпляре:
netsh interface ipv4 set subinterface NAME mtu = 1500 store = persistent
Консоль
Обновление сетевого MTU не поддерживается в Cloud Console.См. Инструмент командной строки gcloud или инструкции API.
gcloud
Остановить все ВМ
Для каждой зоны в сети остановите все виртуальные машины в этой зоне.
Вычислительные экземпляры gcloud останавливают INSTANCE_NAMES ... \
--zone = ЗОНА
Обновить сетевой MTU
Обновление вычислительных сетей gcloud СЕТЬ \
--mtu = MTU
Перезапустить виртуальные машины
Для каждой зоны в сети запустите все виртуальные машины в этой зоне.
Вычислительные экземпляры gcloud запускают ИМЕНА ЭКЗАМЕНОВ ... \
--zone = ЗОНА
Замените заполнители допустимыми значениями:
- INSTANCE_NAMES … – это список экземпляров, разделенных пробелами.
- СЕТЬ – имя сети VPC. чей режим динамической маршрутизации нужно изменить.
- MTU – максимальная единица передачи в сети. MTU может
либо
1460(по умолчанию), либо1500.Просмотрите информацию о MTU в перед настройкой MTU на1500.
API
Изменить MTU существующей сети VPC.
ПАТЧ https://www.googleapis.com/compute/v1/projects/ PROJECT_ID / global / networks / СЕТЬ
{
"mtu": MTU
}
Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, который содержит Сеть VPC, которую нужно изменить.
- СЕТЬ – это имя сети VPC для изменить.
- MTU – максимальная единица передачи в сети. MTU может
либо
1460(по умолчанию), либо1500. Просмотрите информацию о MTU в перед настройкой MTU на1500.
Для получения дополнительной информации см. subnetworks.patch метод.
В качестве альтернативы, если вы не хотите останавливать все виртуальные машины в сети одновременно время, вы можете переносить по одному экземпляру в новую сеть с другим MTU.Перенос виртуальных машин в новую сеть позволяет избежать использования всего VPC. изменение конфигурации.
- Создайте новую сеть с новым MTU.
- Используйте руководство и инструкции в разделе Миграция виртуальной машины между сети для мигрировать виртуальные машины по одной.
Удаление сети
Если сеть не используется, ее можно удалить. Прежде чем вы сможете удалить сети, вы должны удалить все ресурсы во всех ее подсетях, и все ресурсы, которые ссылаются на сеть. Ресурсы, которые ссылаются на сеть включают в себя шлюзы Cloud VPN, облачные маршрутизаторы, правила брандмауэра и настраиваемые статические маршруты.
Консоль
- Перейдите на страницу сетей VPC в Google Cloud Console.
Перейти на страницу сетей VPC - Щелкните имя сети VPC, чтобы отобразить ее сеть VPC. подробности с.
- Щелкните Удалить сеть VPC .
- В появившемся сообщении нажмите Удалить для подтверждения.
gcloud
Удалите сеть с помощью следующей команды gcloud , заменив СЕТЬ с именем удаляемой сети.
gcloud compute networks удалить СЕТЬ
API
Удалите сеть VPC, чтобы удалить ее из проекта.
УДАЛИТЬ https://compute.googleapis.com/compute/v1/projects/ PROJECT_ID / global / networks / СЕТЬ
Замените заполнители допустимыми значениями:
- PROJECT_ID – идентификатор проекта, который содержит Сеть VPC, которую нужно удалить.
- СЕТЬ – это имя сети VPC для Удалить.
Для получения дополнительной информации см. subnetworks.delete метод.
Мониторинг вашей сети VPC
Вы можете включить ведение журнала сетевых потоков к виртуальным машинам и от них. Видеть Использование журналов потока VPC для получения инструкций.
Вы можете включить ведение журнала для правил брандмауэра, чтобы увидеть, какие правила разрешены или заблокировал какой трафик. Видеть Использование ведения журнала правил брандмауэра для получения инструкций.
Перенос ВМ
Вы можете перенести экземпляры виртуальной машины (ВМ) из одной сети в другой в рамках данного проекта.Инструкции см. В разделе «Миграция виртуальной машины между сети.
Что дальше
Попробуйте сами
Если вы новичок в Google Cloud, создайте учетную запись, чтобы оценить, как VPC работает в реальном мире сценарии. Новые клиенты также получают 300 долларов в качестве бесплатных кредитов для запуска, тестирования и развертывать рабочие нагрузки.
Попробуйте VPC бесплатно(PDF) Химерный ретровирусный вирус-помощник и последовательность IRES пикорнавируса для устранения метилирования ДНК для клеток с улучшенной ретровирусной упаковкой
54 и 78 (рис.4), тогда как вирус-помощник показал только 12, 19 и
61% метилирования ДНК соответственно (рис. 3). Аналогичные результаты
наблюдались также в клетках AMIZ, трансфицированных вектором LEIN
tor. Клетки при непрерывном отборе не показали детектируемого метилирования ДНК
5⬘ LTR, но 30% (56-й день) и 36%
(67-й день) метилирование ДНК было обнаружено в клетках без селекции (рис. 6). . Клетки AMIZ, трансфицированные LEIN, при непрерывном отборе
имели векторный титр 1.5 10
7
КОЕ / мл на 67 день,
по сравнению с 4 4 10
4
КОЕ / мл на 67 день, в ячейках без отбора
. Эта 1000-кратная разница в титрах, вероятно, отражает
тот факт, что структурные белки вирусов функционируют как мульти-
-меры (15). Формирование мультимеров происходит по сигмоиде
, а не по линейной зависимости от дозы в отношении концентрации белка
, которая более прямо коррелирует с экспрессией гена вируса-помощника
и метилированием ДНК.Эффект метилирования ДНК хозяина
на 5⬘ LTR хелперного вируса, таким образом, усиливается транскрипцией, сборкой вируса и затем продуцированием вектора
.
Для поддержания эффективного вмешательства рецептора Env и активного производства вируса
необходим пороговый уровень экспрессии гена вируса-помощника
. При ретровирусной инфекции этот пороговый уровень экспрессии гена
устанавливается накоплением достаточного числа копий вируса
в результате суперинфекции до тех пор, пока не будет достигнута и сохранена эффективная интерференция рецептора Env
(40).В нашем исследовании пороговый уровень экспрессии гена вируса-помощника
был достигнут путем отбора зеоцина, а не путем увеличения числа копий вируса-помощника
. Суперинфекция
наблюдалась, когда давление отбора было ослаблено и экспрессия гена helper vi-
rus снизилась. Эти результаты подтверждают предположение, что непрерывный отбор хелперного вируса в VPC
может усилить интерференцию рецептора Env и снизить вероятность образования RCR
.
Для непрерывного производства вируса экспрессия ретровирусного гена
должна регулироваться на достаточном уровне, не препятствуя росту и дифференцировке клеток-хозяев
. Повышенные уровни вирусных РНК и белков
в инфицированных клетках могут вызывать цитопатические эффекты, обычно за счет гибели клеток, путем прерывания продукции или трансляции мРНК хозяина
(47). Хотя мы,
, наблюдали, что клетки AMIZ при непрерывной селекции про-
жизнеспособны медленнее, чем клетки AMIZ без отбора, клетки AMIZ
при непрерывной селекции G418 и зеоцина для высокой экспрессии гена
в течение 67 дней (рис.5) все еще распространяются (данные не показаны
). Мы не пытались отбирать экспрессию гена pPAM3
путем селекции лекарственного средства против плазмиды маркера лекции tk se-
вируса простого герпеса, котрансфицированной в клетки PA317. Этот подход
вряд ли будет успешным, поскольку селекционная маркерная плазмида
отделена от pPAM3. Альтернативным подходом к обратному метилированию является обработка 5⬘-азацитидином
(5-аза-C) для обратного метилирования ДНК (21, 24).В предыдущих экспериментах
мы обнаружили, что только небольшая часть экспрессии вируса-помощника pPAM3
может быть восстановлена с помощью 5-аза-C (54).
Обработка 5-аза-С конкретно не отменяет метилирование ДНК вируса-помощника
; он также ингибирует клеточную ДНК-метил-
трансферазу и вызывает цитотоксичность для обработанных клеток (21). Данные
этого исследования предполагают, что комбинация последовательностей хелперного вируса
и IRES с селектируемыми маркерами является жизнеспособным вариантом
для устранения метилирования ДНК хозяина хелперного вируса из VPC.
Одним из возможных применений этого химерного вируса-помощника для генной терапии
могло бы быть создание упаковывающих клеток
, выделенных из первичной клеточной культуры без субклонирования. Это могло бы быть полезно для трансплантации VPC пациентам (42) без иммунной элиминации
мышиного VPC и вирионов (48, 49). Ряд исследований серии
был направлен на создание ретровирусной упаковывающей линии клеток
с использованием либо аденовируса (4, 9, 25), либо вируса простого герпеса
(46) для импорта генома ретровирусного вспомогательного вируса в клетки-мишени
in vivo. или ex vivo.В этом исследовании химерный ретровирусный вирус-помощник
pAM3-IRES-Zeo был использован для создания объединенной популяции
клеток, трансфицированных pAM3-IRES-Zeo, клеток AMIZ.
Клетки AMIZ, трансфицированные ретровирусным вектором, поддерживали титры
между 3,5 10
6
и 1,5 10
7
КОЕ / мл. Эти титры
сопоставимы с зарегистрированными титрами от индивидуально клонированных
VPC, которые обычно варьируются от 10
4
до 10
7
КОЕ / мл (30).
Трансфекция pAM3-IRES-Zeo в клетки с последующей селекцией для положительных популяций может занять всего 2 недели или меньше,
в зависимости от эффективности трансфекции. Поскольку некоторые первичные культуры клеток
слишком чувствительны для эффективного выделения антибиотика se-
, может потребоваться замена селективного маркера зеоцина на клеточный поверхностный маркер
или ген GFP для преодоления
препятствий для получения VPC из первичных клеточных линий. .
БЛАГОДАРНОСТИ
Мы благодарим Джона П. Леви за предоставленный вектор LESN и Джорджа
Кука за редакционные исправления.
Эта работа была частично поддержана грантом Медицинского центра Iowa Methodist
, Де-Мойн, и грантом исследовательского проекта RPG-98-
091-01-MBC Американского онкологического общества (C.J.L.). W.-B. Янг
является получателем докторской стипендии по программе Molecular,
Cellular and Developmental Biology Program, Университет штата Айова,
Эймс.
СПИСОК ЛИТЕРАТУРЫ
1. Беднарик Д. П., Дж. А. Кук и П. М. Питха. 1990. Инактивация LTR
ВИЧ путем метилирования ДНК CpG: доказательства роли в латентном периоде. EMBO J.
9: 1157–1164.
2. Беднарик Д. П., Дж. Д. Моска и Н. Б. Радж. 1987. Метилирование как модуль экспрессии вируса иммунодефицита человека. J. Virol. 61: 1253–1257.
3. Бестор Т. Х. и Б. Тайко. 1996. Создание паттернов метилирования генома.
Нат.Genet. 12: 363–367.
4. Кэплен, Н. Дж., Дж. Н. Хиггинботам, Дж. Р. Шил, Н. Ваханян, Ю. Йошида,
и Х. Хамада. 1999. Адено-ретровирусные химерные вирусы как in vivo транс-
-продуцирующие агенты. Gene Ther. 6: 454–459.
5. Сидар, Х. 1988. Метилирование ДНК и активность генов. Ячейка 53: 3–4.
6. Кормак Б. П., Р. Х. Вальдивия и С. Фалькоу. 1996. Оптимизированные для FACS
мутантов зеленого флуоресцентного белка (GFP). Gene 173: 33–38.
7.Коссет, Ф. Л., Ю. Такеучи, Дж. Л. Баттини, Р. А. Вайс и М. К. Коллинз. 1995.
Высокотитровые упаковывающие клетки, продуцирующие рекомбинантные ретровирусы, устойчивые к
сыворотке человека. J. Virol. 69: 7430–7436.
8. Фейл Р., М. Д. Бояно, Н. Д. Аллен и Г. Келси. 1997. Родительский хромо-
некоторая специфическая конформация хроматина в импринтированном гене U2af1-rs1 у
мыши. J. Biol. Chem. 272: 20893–20900.
9. Фен, М., У. Х. Джексон, младший, К. К.Goldman, C. Rancourt, M. Wang, S. K.
Dusing, G. Siegal, and D. T. Curiel. 1997. Стабильная трансдукция гена in vivo через
новый аденовирусный / ретровирусный химерный вектор. Nat. Biotechnol. 15: 866–870.
10. Гатиньол, А., Х. Дюран и Г. Тираби. 1988. Устойчивость к блеомицину, вызванная белком, связывающим лекарство. FEBS Lett. 230: 171–175.
11. Хаас Дж., Э. К. Парк и Б. Сид. 1996. Ограничение использования кодонов в экспрессии
гликопротеина оболочки ВИЧ-1.Curr. Биол. 6: 315–324.
12. Hasse, A., and W.A. Schulz. 1994. Усиление метилирования репортерного гена de novo
фрагментами ДНК из контрольной области альфа-фетопротеина.
J. Biol. Chem. 269: 1821–1826.
13. Хендрих Б. и А. Берд. 1998. Идентификация и характеристика семейства
метил-CpG-связывающих белков млекопитающих. Мол. Клетка. Биол. 18:
6538–6547.
14. Hoeben, R.C., A.A. Migchielsen, R.C. van der Jagt, H.van Ormondt и
A. J. van der Eb. 1991. Инактивация длинного концевого повтора
вируса лейкемии мышей Молони в клеточных линиях мышиного фибробласта связана с мета-
илилированием и зависит от его положения в хромосоме. J. Virol. 65: 904–912.
15. Хантер, Э. 1994. Макромолекулярные взаимодействия в сборке ВИЧ и
других ретровирусов. Семин. Virol. 5: 71–83.
16. Ja¨hner, D., and R. Jaenisch. 1985. Ретровирус-индуцированное метилирование de novo
ифлуктуирующих последовательностей хозяина коррелирует с неактивностью гена.Nature 315: 594–
597.
17. Janerhner, D., and R. Jaenisch. 1985. Хромосомное положение и специфическое метилирование de-
в энхансерных последовательностях номов ретровирусов ge-
, передаваемых через зародышевую линию, во время развития мыши.



 HPVtoday. 2006;8:8-9.
HPVtoday. 2006;8:8-9.