Рентгенодиагностика хронических заболеваний лёгких у детей :: ТРУДНЫЙ ПАЦИЕНТ
М.В. Костюченко
Московский НИИ педиатрии и детской хирургии Росмедтехнологий, Москва
В диагностике хронических неспецифических заболеваний лёгких у детей определяющее значение имеют рентгенологические методы.
Быстрое развитие рентгенологии, увеличение количества рентгенологических методик, их совершенствование, необходимость в короткий срок установить точный диагноз ставит перед исследователями вопрос о применении максимального, но достаточного набора исследований. Применение каждого последующего метода должно обеспечить получение тех данных, которые нельзя было установить с помощью предыдущего. В последние годы педиатрическая пульмонологическая клиника обогатилась новыми рентгенодиагностическими методами. Речь идет о компьютерной томографии, магниторезонансной томографии, ангиографии, томографии высокого разрешения. [1].
Результаты современных рентгеновских специальных исследований способствуют распознаванию лёгочных заболеваний. В настоящее время стало возможным дифференцировать отдельные нозологические формы, объединённые ранее общим определением – хронические неспецифические заболевания лёгких.
Традиционная рентгенография грудной клетки до сих пор остаётся основным методом первичного обследования органов дыхания у детей. Это обусловлено небольшой лучевой нагрузкой, информативностью, доступностью. В то же время по обзорной рентгенограмме определяют показания к дополнительным или специальным методам исследования или ограничиваются рентгенографией при наличии видимых изменений достаточных для постановки диагноза. С помощью рентгенографии осуществляется возможность динамического наблюдения за развитием процесса в лёгких, позволяющего корректировать терапию [2].
Хроническая патология лёгких у детей включает различные группы заболеваний: • инфекционно- воспалительные болезни лёгких;
• врождённые пороки развития бронхолёгочной системы;
• наследственные болезни лёгких;
• аллергические болезни лёгких.

Согласно новой международной классификации болезней и проблем, связанных со здоровьем, Х пересмотра, которая рекомендована Минздравом РФ к использованию с 1999 г. к хроническим инфекционно-воспалительным заболеваниям лёгких относят хронический бронхит, бронхоэктатическую болезнь лёгких и др. [5].
Хронический бронхит. Для рентгенодиагностики хронических бронхитов у детей характерен целый ряд косвенных признаков: умеренно выражены признаки обструктивного синдрома, усиление лёгочного рисунка диффузно с обеих сторон, малоструктурные корни лёгких, иногда локальная деформация лёгочного рисунка. Изменения носят, как правило, стойкий характер. Показана компьютерная томография, на которой помимо описанных изменений могут выявляться как деформация бронхов, так и цилиндрические бронхоэктазы, обычно в области нижних отделов лёгких. При обострении: лёгочный рисунок становится более грубым, нечётким, появляются участки буллезных вздутий, возможны мелкие субсегментарные ателектазы, уплотнение и снижение структуры корней. Положительная динамика наступает не раньше 10-14 дней. Наиболее тяжёлой формой хронического бронхита является облитерирующий бронхиолит. Облитерирующий бронхиолит у детей рассматривают как осложнение тяжёлых респираторно-вирусных инфекций, приводящих к облитерации бронхиол. В связи с тяжёлыми вентиляционными нарушениями и ранним развитием хронического лёгочного сердца дети становятся инвалидами с раннего возраста [6].

Бронхоэктатическая болезнь – развивается при инфицировании бронхоэктазов и наличии в них хронического гнойного воспалительного процесса. Бронхоэктазами называются сегментарные расширения просветов бронхов, обусловленные деструкцией или нарушением нервно-мышечного тонуса их стенок вследствие воспаления, дистрофии, склероза или гипоплазии структурных элементов бронхов. Различают врождённые и приобретённые бронхоэктазы. В зависимости от рентгенологической картины выделяют следующие типы бронхоэктазов: варикозный, веретенообразный, мешотчатый, цилиндрический смешанный. Описаны также ателектатический, атрофический, гипертрофический, деструктивный, диспластический, постбронхитический и ретенционный типы [4].
Поскольку на обзорных рентгенограммах просветы расширенных бронхов не всегда удаётся выявить, обычно для показаний бронхографического исследования ориентируются на целый ряд косвенных рентгенологических признаков, наряду с клиническими проявлениями болезни. Это, прежде всего, стойкая локальная деформация лёгочного рисунка по ячеисто-петлистому типу, уменьшение объёма поражённых отделов лёгких. Применение спиральной компьютерной томографии позволяет повысить точность рентгеновского метода в диагностике бронхоэктазов у детей. В зависимости от формы, бронхоэктазы при этом исследовании имеют вид тубулярных или кольцевидных структур с уровнями жидкости или без них. Трёхмерная реконструкция изображения позволяет изучать пространственное расположение трахеи, сосудистого русла, бронхиального дерева.
Бронхография в настоящее время также сохраняет свое значение для выявления формы, распространённости бронхоэктазов и является решающим методом рентгенодиагностики патологии бронхов. Бронхография – метод искусственного контрастирования бронхиального дерева для получения рентгеновского изображения бронхов.
 Для контрастирования бронхов используют различные рентгенодиагностические контрастные вещества (пропилйодон, желойодон). В детской практике не следует использовать масляные растворы йодолипола, недопустимо также применение бария. Эти вещества надолго задерживаются в бронхах, что может вызвать излишнее раздражение слизистой оболочки, закупорку просветов, привести к ателектазам, олеогранулемам [10].
Для контрастирования бронхов используют различные рентгенодиагностические контрастные вещества (пропилйодон, желойодон). В детской практике не следует использовать масляные растворы йодолипола, недопустимо также применение бария. Эти вещества надолго задерживаются в бронхах, что может вызвать излишнее раздражение слизистой оболочки, закупорку просветов, привести к ателектазам, олеогранулемам [10].Бронхографическое исследование позволяет совместно с хирургами решать вопрос о целесообразности и возможности хирургического лечения.
Основу формирования хронических воспалительных заболеваний лёгких, нередко составляют пороки развития бронхолёгочной системы. По нашим данным, пороки развития лёгких выявляются в клинике у 8-10 % больных с хроническими воспалительными бронхолёгочными поражениями. Врождённые заболевания лёгких являются одной из наиболее сложных диагностических, патогенетических и терапевтических проблем современной пульмонологии. Вместе с тем своевременная их диагностика обеспечивает успех терапевтических мероприятий [1, 7].
Пороки развития бронхолёгочной системы весьма многообразны. Существует множество классификаций врождённых пороков развития лёгких. Мы остановимся на рентгенодиагностике форм, наиболее часто встречающихся в практической работе пульмонолога. К ним относятся следующие пороки развития:
1. Пороки, связанные с недоразвитием бронхолёгочных структур (агенезия, аплазия, гипоплазия лёгкого).
2. Пороки развития стенки трахеи и бронхов (синдром Мунье-Куна, Вильямса-Кемпбелла, врождённая лобарная эмфизема).
3. Кисты лёгких.
4. Пороки развития лёгочных сосудов; агенезия и гипоплазия лёгочной артерии и её ветвей.
В арсенале современной рентгенодиагностики пороков развития лёгких используются как традиционные (рентгенография грудной клетки), так и специальные методы обследования (бронхография, томография, компьютерная томография, магнитно-резонансная томография) [10].
Агенезия, аплазия, гипоплазия лёгкого
Агенезией принято называть отсутствие лёгкого вместе с главным бронхом, а при аплазии лёгкого сохраняется культя главного бронха. Аплазия и агенезия лёгкого являются результатом раннего нарушения эмбриогенеза на 1-2 месяце внутриутробного развития.
На обзорной рентгенограмме грудной клетки поражённая сторона значительно уменьшена в объёме (сужены межреберные промежутки), интенсивно затемнена поражённая сторона за счёт смещения органов средостения. Очень важным симптомом является смещение здорового лёгкого в области верхнего средостения в сторону поражения (медиастинальная грыжа), а также наличие полосы просветления, идущей паравертебрально за счёт смещения трахеи. Доказательными признаками являются результаты специальных исследований бронхографии или компьютерной томографии, с помощью которых устанавливается отсутствие главного бронха при агенезии лёгкого или наличие культи при аплазии лёгкого. Эти пороки могу сочетаться с другими аномалиями.
Гипоплазия лёгкого и его доли – порок развития, связанный с нарушением формирования лёгкого в период 2-5 месяцев внутриутробного развития. Для гипоплазии характерно недоразвитие всех структурных элементов лёгкого – сосудов, бронхов, паренхимы. В последнее время гипоплазию разделяют на простую и кистозную. Простая гипоплазия встречается чаще, чем кистозная.
Простая гипоплазия на обзорной рентгенограмме характеризуется уменьшением лёгкого, обеднением лёгочного рисунка, на стороне поражения отмечается высокое расположение купола диафрагмы, смещение тени средостения в сторону порока, возможна медиастинальная грыжа здорового лёгкого.

При кистозной гипоплазии в дополнение к вышеописанным признакам на стороне поражения выявляются множественные тонкостенные, наслаивающиеся друг на друга округлые полостные образования. В стадии обострения стенки полостей становятся более плотными, а в полостях появляются горизонтальные уровни жидкости. Компьютерная томография позволяет уточнить локализацию и распространённость кист. Окончательный диагноз устанавливают при бронхографическом исследовании. На бронхограммах отчётливо видны округлые кисты с чёткими контурами, заполненные контрастным веществом. Кистозная гипоплазия доли лёгкого обычно требует хирургического лечения.
Пороки развития стенки трахеи и бронхов
К этой группе относятся трахеобронхомегалия или синдром Мунье-Куна, синдром Вильямса-Кемпбелла и др. Синдром Мунье-Куна заключается в чрезмерном расширении трахеи, а иногда и главных бронхов вследствие врождённой аномалии эластичной и мышечной ткани. Трахеобронхомегалия часто сопровождается хронической инфекцией дыхательных путей. В литературе есть упоминания о сочетании порока с кистозной гипоплазией, а также с выраженными пневмосклеротическими и бронхоэктатическими изменениями в нижних отделах лёгких.
Рентгенологическая картина при этом пороке весьма характерна – на сверхжёстком снимке грудной клетки выявляется резко расширенная трахея, диаметр которой превосходит нормальные размеры в полтора раза и становится равным поперечнику верхнегрудных позвонков, трахея при этом выходит за правый контур позвоночника. Диагноз трахеобронхомегалии ставится на основании рентгенологического исследования. В настоящее время внедрение в практику компьютерной томографии позволяет изменить мнение о чрезвычайной редкости этой патологии.
Синдром Вильямса-Кемпбелла, впервые описанный в 1960 году, представляет собой врождённый порок развития хрящей бронхов 3-7 порядка, дистальнее зоны поражения вновь определяется хрящевая ткань, её обнаруживают в бифуркационных углах. Слабость бронхиальной стенки приводит к дискинезии бронхов – избыточному расширению их просвета во время вдоха и сужению на выдохе. Поражение бронхов, как правило, двустороннее. Правое лёгкое поражается чаще и больше, чем левое, нижние отделы страдают чаще и больше, чем другие. При этом на рентгенограмме определяется снижение прозрачности лёгочной ткани за счёт деформации лёгочного рисунка по ячеистому типу, возможны неравномерные вздутия лёгочной ткани. Бронхография даёт типичную картину веретенообразных бронхоэктазов проксимальных отделов бронхов, за которыми прослеживаются нерасширенные дистальные отделы бронхов.
Слабость бронхиальной стенки приводит к дискинезии бронхов – избыточному расширению их просвета во время вдоха и сужению на выдохе. Поражение бронхов, как правило, двустороннее. Правое лёгкое поражается чаще и больше, чем левое, нижние отделы страдают чаще и больше, чем другие. При этом на рентгенограмме определяется снижение прозрачности лёгочной ткани за счёт деформации лёгочного рисунка по ячеистому типу, возможны неравномерные вздутия лёгочной ткани. Бронхография даёт типичную картину веретенообразных бронхоэктазов проксимальных отделов бронхов, за которыми прослеживаются нерасширенные дистальные отделы бронхов.
В основе врождённой лобарной эмфиземы лежит сужение бронха и нарушение, вследствие этого, бронхиальной вентиляции по клапанному типу, приводящей к эмфиземе соответствующего участка лёгкого. Бронхиальный стеноз может быть вызван сдавлением извне аномально расположенным сосудом, увеличенными лимфоузлами. Однако главной причиной сужения бронха является локальное недоразвитие хряща стенки бронха. Реже встречается гипертрофия слизистой оболочки бронха с образованием складок, играющих роль клапана. Также возможна врождённая патология самой паренхимы лёгкого, заключающаяся в гипоплазии эластических волокон и перерастяжении альвеол в результате задержки воздуха в измененном участке лёгкого. Заболевание обнаруживается у детей первых недель жизни. Обычно поражается верхняя доля слева. Поражённая доля в 2-3 раза увеличена в объёме, в ней видны буллы разных размеров [1].
На обзорной рентгенограмме обнаруживают резко повышенную прозрачность одного лёгкого, низкое стояние купола диафрагмы на этой же стороне, смещение тени средостения в противоположную (здоровую сторону), типично выявление медиастенальной грыжи в области верхнего средостения за счёт вздутой доли пораженного лёгкого в отличие от грыжи здорового лёгкого при гипоплазии. Часто определяется гиповентиляция сдавленной, обычно нижней доли, на стороне поражения.
Основные заболевания, с которыми следует дифференцировать лобарную эмфизему в первую очередь следующие. Эмфизема лёгкого или доли лёгкого при закупорке бронха инородным телом. Клиническая и рентгенологическая картины при этих заболеваниях могут быть идентичны, особенно в первые дни болезни. В решении вопроса может помочь поднаркозная бронхоскопия.
Эмфизема лёгкого или доли лёгкого при закупорке бронха инородным телом. Клиническая и рентгенологическая картины при этих заболеваниях могут быть идентичны, особенно в первые дни болезни. В решении вопроса может помочь поднаркозная бронхоскопия.
Ограниченный пневмоторакс при разрыве одной из булл. При долевой эмфиземе лёгочный рисунок обеднен, но прослеживается. При пневмотораксе лёгочный рисунок не виден, а лёгкое коллабировано. Применение при дифференциальной диагностике бронхографии у маленьких детей нецелесообразно ввиду возможных осложнений [8].
Кисты лёгких
Врожденные кисты лёгкого возникают в результате нарушения развития бронха (бронхогенная киста) или дисплазии лёгочной ткани и нередко сочетаются с другими пороками развития лёгких (аномалии деления бронхов и др.). Врождённые кисты могут быть одиночными и множественными. Нередко они бессимптомны и обнаруживаются случайно при рентгеновском исследовании. Врождённые кисты чаще наблюдаются с одной стороны, в области верхней доли левого лёгкого. На обзорных рентгенограммах врождённая киста выглядит как чётко очерченное одиночное или множественное просветление на неизменённом лёгочном поле. В зависимости от содержимого кисты можно увидеть воздушную полость или полость с уровнем жидкости. Отсутствие теней перифокального воспаления позволяет дифференцировать врождённую кисту от хронического абсцесса лёгкого. Лёгочные кисты могут осложняться напряжением, а также прорывом в плевральную полость с образованием пневмоторакса или пиопневмоторакса. Помощь в диагностике врождённой кисты может оказать компьютерная томография или бронхография.
Пороки развития лёгочных сосудов
Агенезия и гипоплазия лёгочной артерии и её ветвей. Рентгенологические изменения при пороках развития лёгочной артерии довольно типичны: на обзорной рентгенограмме отмечается резкое смещение органов средостения в поражённую сторону, сужен корень и отсутствует лёгочный рисунок, определяется грыжа верхнего средостения. Все, как при гипоплазии лёгкого, однако при бронхографии патологии бронхиального дерева не отмечается.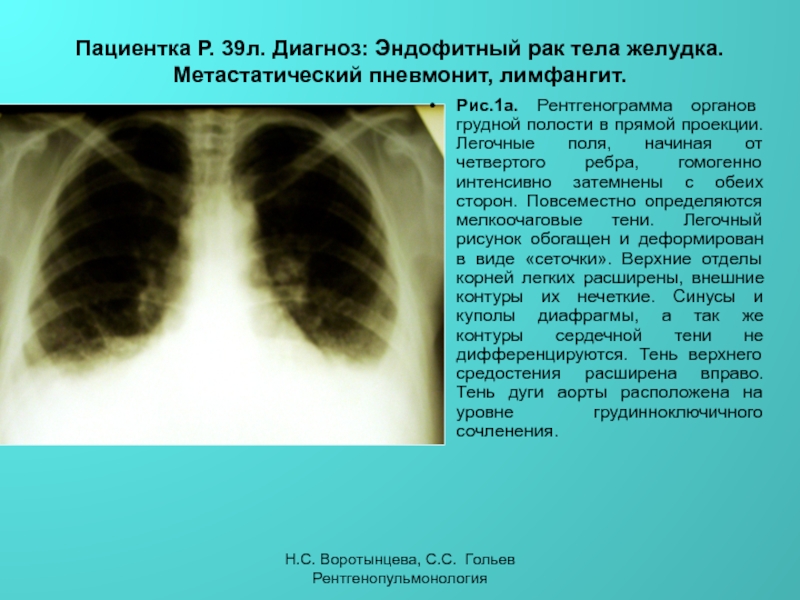 Окончательный диагноз устанавливают при ангиопульмонографии. При этом определяется полное или частичное отсутствие одного из стволов лёгочной артерии. С помощью этого исследования удаётся по этим признакам различить агенезию, аплазию или гипоплазию лёгочной артерии. В настоящее время магнитно-резонансная ангиография вытесняет ангиопульмонографию.
Окончательный диагноз устанавливают при ангиопульмонографии. При этом определяется полное или частичное отсутствие одного из стволов лёгочной артерии. С помощью этого исследования удаётся по этим признакам различить агенезию, аплазию или гипоплазию лёгочной артерии. В настоящее время магнитно-резонансная ангиография вытесняет ангиопульмонографию.
Серьёзную проблему пульмонологии составляют поражения лёгких наследственного характера. Это моногенно наследуемые болезни лёгких (первичная цилиарная дискенезия, идиопатический диффузный фиброз лёгких, гемосидероз лёгких, альвеолярный микролитиаз) а также другие наследственные страдания, при которых поражается бронхолёгочная система (муковисцидоз, первичные иммунодефицитные состояния и др.) [5].
Особый интерес представляет первичная цилиарная дискинезия. Типичным представителем этого заболевания является синдром Картагенера. Врождённый комбинированный порок с триадой симптомов, включающих обратное расположение органов грудной и брюшной полости, хронический бронхолёгочный процесс, пансинусит. Характер изменений определяется по результатам рентгенологического обследования. На обзорных рентгенограммах определяется обратное расположение органов грудной и брюшной полости, при этом важно наличие маркеров правой и левой стороны на рентгеновском снимке. Поражение лёгких, как правило, двустороннее, с преимущественной локализацией в нижних отделах лёгких в виде деформации, усиления и огрубления лёгочного рисунка, нередко с участками инфильтрации при обострении процесса. При бронхографии у этих больных выявлялись: признаки деформирующего бронхита, смешанные и цилиндрические бронхоэктазы, возможен поликистоз, отмечаются случаи отсутствия изменений бронхиального дерева. В связи с этим было показано, что облигатным признаком этой патологии является бронхит, наличие бронхоэктазов не является обязательным симптомом. На рентгенограммах околоносовых пазух выявляются признаки двустороннего гайморита, пансинусита – затемнение всех околоносовых пазух.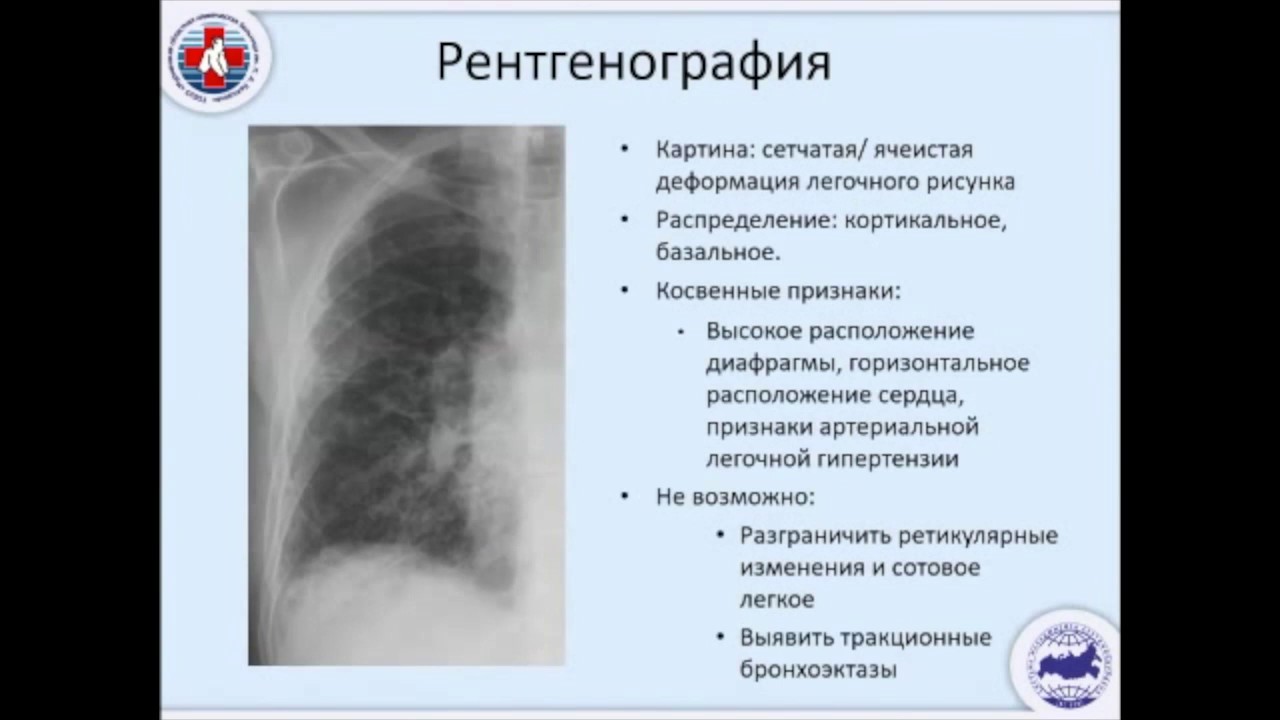 Довольно часто у этих детей выявляется искривление носовой перегородки.
Довольно часто у этих детей выявляется искривление носовой перегородки.
В настоящее время есть все основания отказаться от бронхографии при обследовании детей с синдромом Картагенера. Её с успехом может заменить компьютерная томография – менее инвазивный и достаточно информативный метод при этой патологии.
Важнейшей проблемой пульмонологии является проблема хронических аллергических заболеваний лёгких. В их числе бронхиальная астма, экзогенный аллергический альвеолит и др. Эти заболевания держат первенство по своей распространённости, возможности инвалидизации и опасности для жизни. Мы выделяем целый ряд рентгенологических особенностей отличающих аллергические от инфекционно-бактериальных лёгочных заболеваний. К признакам, характерным для аллергических лёгочных заболеваний, относятся: наличие признаков обструктивного синдрома, отсутствие «реакции корней лёгких», летучие, слабоинтенсивные инфильтративные тени в проекциях верхних и средних отделах лёгких размером от мелкоочаговых теней до сегментарных или лобарных затемнений с быстрой положительной динамикой в течение 3-5 дней, без остаточных изменений лёгочной ткани. Эти изменения хорошо выявляются на обзорных рентгенограммах грудной клетки. Тяжесть хронических аллергических заболеваний лёгких определяется развитием пневмосклероза. Пневмосклероз при этих заболеваниях рассматривается как следствие длительно текущего хронического аллергического воспаления. Для выявления ранних признаков пневмосклероза, не выявленных на обзорных рентгенограммах, показана компьютерная томография. КТ признаками пневмосклероза являются: деформация лёгочного рисунка, снижения пневматизации в виде матового стекла, изменения коэффициента плотности, которые считаются ранними проявлениями пневмосклероза который может быть обратимым на этой стадии [9].
Как известно, бронхография у детей с аллергическими бронхолёгочными заболеваниями не показана, вместе с тем хронические аллергические заболевания иногда сопровождаются развитием бронхоэктазов. Здесь для дифференциальной диагностики компьютерная томография незаменима. Так, при аллергическом бронхолёгочном аспергиллёзе с помощью компьютерной томографии можно выявить изменения в паренхиме лёгкого в виде мелких плотных теней (гранулемы), а также смешанные бронхоэктазы в проксимальных отделах бронхов, характерные изменения для этого заболевания, в то время как для бронхоэктатической болезни характерны бронхоэктазы дистальных отделов бронхиального дерева.
Здесь для дифференциальной диагностики компьютерная томография незаменима. Так, при аллергическом бронхолёгочном аспергиллёзе с помощью компьютерной томографии можно выявить изменения в паренхиме лёгкого в виде мелких плотных теней (гранулемы), а также смешанные бронхоэктазы в проксимальных отделах бронхов, характерные изменения для этого заболевания, в то время как для бронхоэктатической болезни характерны бронхоэктазы дистальных отделов бронхиального дерева.
Таким образом, использование в рентгенодиагностике новых современных специальных исследований, наряду с традиционными методами, позволяет диагностировать признаки болезни на ранних этапах, позволяет разрабатывать дифференциальные критерии рентгенодиагностики.
Литература
1. Розенштраух Л.С., Рыбакова Н.И., Винер М.Г. Рентгенодиагностика заболеваний органов дыхания: Руководство для врачей. 2 изд. М.: Медицина, 1987; 268-274: 118-146.
2. Харченко А.Г., Котляров П.М. Методы медицинской визуализации в диагностике заболеваний органов дыхания // Пульмонология. 1999; 4: 48- 50.
3. Костюченко М.В., Розинова Н.Н., Тодуа Ф.И. и др. Диагностическое значение компьютерной томографии при хронических заболеваниях лёгких у детей // Материнство и детство. 1992; 8: 14-16.
4. Михайлов А.Н. Руководство медицинской визуализации. Минск: Выш. шк.; 1996; 23-25.
5. Каганов С.Ю., Розинова Н.Н. Пульмонология детского возраста и её насущные проблемы // Российский вестник перинатол. и педиатрии. 2000; 6: 6-11.
6. Спичак Т.В.. Лукина О.Ф., Марков Б.А. Критерии диагностики облитерирующего бронхиолита в детском возрасте // Детский доктор. 1999; 8: 24-27.
7. Вельтищев Ю.Е., Каганов С.Ю, Таль В. В кн.: Врождённые и наследственные заболевания лёгких у детей. М.: Медицина, 1986; 4: 83-162.
8. Рокицкий М.Р. Хирургические заболевания лёгких у детей: Руководство. Л.: Медицина, 1988; 233-245.
9. Дрожжев М.Е., Костюченко М.В. Гормонозависимая форма бронхиальной астмы и вопросы кортикостероидной терапии. В кн. : Бронхиальная астма у детей / Под ред. Каганова С.Ю. М.: Медицина, 1999; 16: 236.
: Бронхиальная астма у детей / Под ред. Каганова С.Ю. М.: Медицина, 1999; 16: 236.
10. Костюченко М.В. Современные методы рентгенодиагностики хронических неспецифических заболеваний лёгких у детей // Рос. Вестн. Перинатол. и педиатрии. 2002; 33-37.
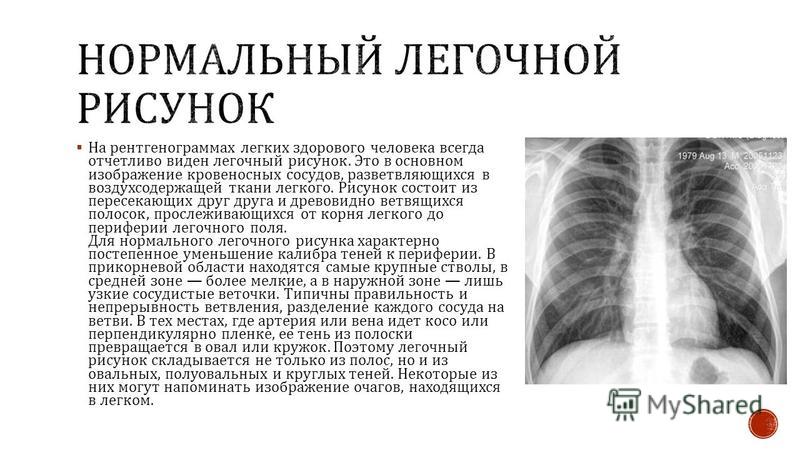
обогащение легочного рисунка
Усиление лёгочного рисунка на рентгене
2020-5-16 В заключении можно часто увидеть фразу ?усиление лёгочного рисунка на рентгене?, обогащение — на единицу площади рентгенограммы сосудов больше,
get priceДеформация и усиление легочного рисунка на
用户评级: 3.4/5Усиление прикорневого легочного рисунка что
Усиление легочного рисунка в прикорневой зоне прослеживается при хроническом поражении бронхиального дерева, при котором снижена проходимость воздуха по бронхам.
get priceЧто значит что легочный рисунок усилен на
заболевания сердца, вызывающие застой крови в малом круге кровообращения, сердечная недостаточность усиление и обогащение легочного рисунка формируется за счет полнокровия сосудов в нижних отделах;
get priceУсиление легочного рисунка на рентгене что это
Усиление легочного рисунка в нижних отделах характерно для сегментарной и нижнедолевой пневмонии. Локальные изменения отслеживаются на начальной стадии пневмонии, когда сосуды разрастаются вокруг
get priceЧто значит усиление легочного рисунка в нижних
Усиление легочного рисунка в нижних отделах при хронических пневмониях Диагноз хроническая пневмония снят из клинического употребления, но на снимках иногда можно отслеживать появление инфильтративных теней
get priceЛегочный рисунок усилен в прикорневых зонах
Усиление прикорневого легочного рисунка в средней зоне наблюдается при хроническом бронхите, бронхиальной астме, туберкулезе, саркоидозе, ряде других патологических форм.
get priceДеформация легочного рисунка Медицинская
Усиление легочного рисунка на флюорографии: причины, возможные заболевания, отзывы В статье рассмотрим, что означает усиление легочного рисунка на флюорографии.
Легочный рисунок усилен: что это значит на
Что значит усиление легочного рисунка в прикорневых зонах на флюорографии: диффузные и локальные изменения Если легочной рисунок усилен в прикорневых зона, но других признаков болезни нет, то это не считается
get priceИзменения легочного и корневого рисунка
Изменения легочного рисунка синдром, часто наблюдающийся при заболеваниях легких. Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
get priceЛегочный рисунок усилен: что это значит на
Что значит усиление легочного рисунка в прикорневых зонах на флюорографии: диффузные и локальные изменения Если легочной рисунок усилен в прикорневых зона, но других признаков болезни нет, то это не считается
get priceИзменения легочного и корневого рисунка
Изменения легочного рисунка синдром, часто наблюдающийся при заболеваниях легких. Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
get priceЛегочный рисунок усилен в прикорневых зонах
Усиление прикорневого легочного рисунка в средней зоне наблюдается при хроническом бронхите, бронхиальной астме, туберкулезе, саркоидозе, ряде других патологических форм.
get priceсгущение легочного рисунка Здоровье мира
заболевания сердца, вызывающие застой крови в малом круге кровообращения, сердечная недостаточность усиление и обогащение легочного рисунка
get priceУсиление легочного рисунка что это значит
Насколько серьезно следующее заключение рентгенолога: “В медиальных зонах усилен и обогащен легочный рисунок за счет сосудистого компонента. Корни легких тяжисты, корень справа в хвостовой части инфильтрирован
get priceЧто такое деформация легких — Медицина мира
заболевания сердца, вызывающие застой крови в малом круге кровообращения, сердечная недостаточность усиление и обогащение легочного рисунка формируется за счет полнокровия сосудов в нижних отделах;
get priceСиндром изменения корней легких
Обогащение, отсутствие структурности и деформация легочного рисунка часто сочетаются, в результате чего на рентгенограммах появляются новые элементы легочного рисунка в виде очагово-подобных, линейных и
get priceлегочный рисунок обогащен
Обогащение легочного рисунка за счет более развитой сети сосудов, возможно небольшая уплотненность стенок бронхов.
Что такое обогащение сосудистого компонента
№73185 Что такое обогащение сосудистого компонента легочного рисунка Нина Жен., 40 лет. Россия Москва
get priceУсиленный легочной рисунок Вопросы и ответы
Год назад, увидев на рентгене легких усиление легочного рисунка, мне поставили диагноз: хронический бронхит. Через пол года, описывая результат флюорографии, рентгенолог сказал, что в легких была болезнь, но уже все
get priceЧто значит что легочный рисунок усилен на
Усиление и обогащение легочного рисунка формируется за счет полнокровия сосудов. Больше оно выражено в нижних отделах. Иногда сочетается с появлением жидкости в плевральных синусах. 5.
get priceЧто такое обогащение сосудистого компонента
№73185 Что такое обогащение сосудистого компонента легочного рисунка Нина Жен., 40 лет. Россия Москва
get priceУсиленный легочной рисунок Вопросы и ответы
Год назад, увидев на рентгене легких усиление легочного рисунка, мне поставили диагноз: хронический бронхит. Через пол года, описывая результат флюорографии, рентгенолог сказал, что в легких была болезнь, но уже все
get priceКак лечить усиление легочного рисунка
1.1 Причины усиления легочного рисунка справа, слева и в нижних отделах 2 В каких случаях стоит бить тревогу 2.1 Усиление легочного рисунка у
get priceНа тему легочного рисунка Портал радиологов
2020-6-12 Коллеги, опишите данный снимок как бы вы написали протокол,если бы вам принесли эту р-грамму на описание, дайте заключение, если необходимо. Особое внимание прошу уделить описанию легочного рисунка. Ola-la, а данное
get priceУсиление легочного рисунка туберкулез
В норме эти веточки тонкие, едва заметные. При наличии патологических процессов в тканях лёгких в заключении пишут об усилении лёгочного рисунка.
get priceОбогащение легочного рисунка Вопрос
Некоторое обогащение легочного рисунка в медиальных отделах. Литеральные реберно- диафрагмальные синусы свободны. Тень сердца не расширена. Корни структурны, не расширены.
Тень сердца не расширена. Корни структурны, не расширены.
Рентгеносемиотика и дифференциальная
Синдром затемнения 2. Синдром просветления 3. Синдром изменения легочного рисунка 4. Синдром изменения корня легкого
get priceПериваскулярные изменения в легких — Лор и
Обогащение, отсутствие структурности и деформация легочного рисунка часто сочетаются, в результате чего на рентгенограммах появляются новые элементы легочного рисунка в виде очагово-подобных, линейных и
get priceПеревод терминов компьютерной томографии,
Линейные изменения легочного рисунка. Усиление и обогащение легочного рисунка за счет линейных изменений представляет собой результат
get priceМожем выдохнуть: нейросеть определит COVID-19 по флюорографии | Статьи
Российская разработка позволит с точностью 80% быстро поставить предварительный диагноз COVID-19 по рентгеновским снимкам и предотвратит 13% человеческих ошибок. Добиться этого удастся благодаря использованию нейросети для определения пневмонии, которая сейчас обучается с помощью изображений легких зараженных коронавирусом людей. Система уже может учитывать такие отличительные особенности этого заболевания, как локализация воспалительного процесса и синдром матового стекла. Ожидается, что внедрение искусственного интеллекта снизит время обработки снимка и увеличит точность диагностики в тех регионах, где ощущается нехватка квалифицированного медперсонала и специализированных тест-систем.
Атипичное затемнение
Быстрые тест-системы для выявления коронавируса пока распространены недостаточно. А те из них, которые применяют сейчас активнее всего, позволяют поставить диагноз не ранее чем через 24 часа после взятия биоматериала. Поэтому врачи ищут альтернативные способы, с помощью которых можно определить заболевание по ряду свойственных ему косвенных признаков. Российские ученые предложили использовать для предварительной постановки диагноза рентгеновские снимки легких, анализом которых займется специально обученная система искусственного интеллекта.
— В настоящее время врачи нашли такие отличительные признаки коронавирусной пневмонии, как интерстициальное (воспаление и нарушение структуры альвеол. — «Известия») поражение легких преимущественно с обеих сторон. При нем усиливается легочный рисунок, а также характерные инфильтративные (скопление жидкости. — «Известия») изменения в виде затемнений, — рассказал руководитель Центра искусственного интеллекта университета Иннополис Рамиль Кулеев. — Для выявления данных особенностей мы в настоящее время обучаем нашу нейронную сеть, которая прежде специализировалась на раннем обнаружении признаков обычной пневмонии.
Фото: Depositphotos
Кроме того, система способна учитывать характерный для коронавирусной пневмонии синдром матового стекла, при котором изображение ткани на снимке становится размытым.
Причем для обучения нейросети разработчики используют реальные снимки легких заболевших COVID-19 людей. Они берутся из открытой базы данных, размещенной на сайте Github, которая оперативно пополняется по мере развития эпидемии. Если же говорить о предположениях на тему отличительных свойств коронавирусной пневмонии, то они уже подтвердились результатами международных научных работ.
— Недавно научный журнал Radiology опубликовал исследование КТ-снимков зараженных коронавирусом пассажиров с круизного лайнера Diamond Princess, — пояснил ассистент-профессор университета Копенгагена, ведущий научный сотрудник университета Иннополис Булат Ибрагимов. — По его результатам более половины пассажиров, у которых еще не было выраженных симптомов заболевания, имели затемнения в легочных полях.
По мнению эксперта, этот факт также говорит о диагностическом потенциале флюорографических исследований, которые на сегодняшний день считаются наиболее безопасным и распространенным инструментом для анализа органов грудной клетки.
Кабинет с подключением
В настоящее время команда ученых уже провела первичное тестирование методики и сравнила ее эффективность с врачебными результатами диагностики.
— В рамках эксперимента мы установили, что точность определения патологии у нашей нейросети составляет 80%, — отметил Рамиль Кулеев. — При этом она смогла зафиксировать отклонения там, где врач не смог их обнаружить — произошло это в 13% исследований.
Согласно мнению ученого, это говорит о потенциальных возможностях системы искусственного интеллекта по предотвращению врачебных ошибок. При этом точность определения диагноза разработчики планируют улучшить, обучая систему с помощью новых снимков, количество которых они надеются уже в ближайшее время довести до нескольких тысяч образцов.
Интерес к разработке со стороны медицинского сообщества «Известиям» подтвердили в республиканском клиническом противотуберкулезном диспансере Татарстана.
Фото: РИА Новости/Алексей Даничев
— Когда врач-клиницист сталкивается с пациентом, имеющим признаки заражения коронавирусной инфекцией, в своем арсенале он имеет ограниченный набор инструментов, позволяющих оперативно поставить диагноз, — сообщил заведующий рентгенодиагностическим отделением диспансера Сергей Коновалов. — Поэтому автоматическое распознавание результатов распространенной в нашей стране цифровой рентгенографии действительно могло бы помочь специалистам в выявлении у больных с COVID-19 тех прогрессирующих изменений в легких, которые являются его характерными признаками.
Ожидается, что предстоящее внедрение системы будет предполагать подключение рентгенографических кабинетов отечественных лечебных заведений к облачному онлайн-сервису, который предназначен для оперативной обработки полученной от врачей информации. Это позволит уменьшить необходимое для исследования снимков время, увеличит точность диагностики и улучшит ее качество — особенно в тех регионах, где ощущается нехватка квалифицированного медперсонала и специализированных тест-систем.
Также использование сервиса может существенно снизить нагрузку на врачей-рентгенологов, что будет актуально при увеличении количества исследований на фоне дальнейшего развития пандемии. Наконец, в исключительных обстоятельствах станет возможен вариант полностью дистанционного изучения результатов исследований без участия местного врача, что станет значимым шагом в развитии телемедицины. Однако и в этом случае в кабинете c табличкой «Рентген» должен находиться лаборант, который сможет производить качественные снимки.
Наконец, в исключительных обстоятельствах станет возможен вариант полностью дистанционного изучения результатов исследований без участия местного врача, что станет значимым шагом в развитии телемедицины. Однако и в этом случае в кабинете c табличкой «Рентген» должен находиться лаборант, который сможет производить качественные снимки.
ЧИТАЙТЕ ТАКЖЕ
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
567891011
12131415161718
19202122232425
2627282930
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Хроническая обструктивная болезнь легких: компьютерная томография высокого разрешения в диагностике эмфиземы и облитерирующего бронхиолита
Введение. По данным Глобальной инициативы по ХОБЛ [1], хроническая обструктивная болезнь легких (ХОБЛ) — это хроническое медленно прогрессирующее заболевание, характеризующееся необратимой или частично обратимой (при применении бронхолитиков или другого лечения) обструкцией бронхиального дерева. В материалах данного форума считается, что ХОБЛ является комбинацией эмфиземы и поражения бронхиального дерева и, как правило, осложняется легочной гипертензией, что клинически проявляется дыхательной недостаточностью и признаками легочного сердца [2–6].
По данным Глобальной инициативы по ХОБЛ [1], хроническая обструктивная болезнь легких (ХОБЛ) — это хроническое медленно прогрессирующее заболевание, характеризующееся необратимой или частично обратимой (при применении бронхолитиков или другого лечения) обструкцией бронхиального дерева. В материалах данного форума считается, что ХОБЛ является комбинацией эмфиземы и поражения бронхиального дерева и, как правило, осложняется легочной гипертензией, что клинически проявляется дыхательной недостаточностью и признаками легочного сердца [2–6].
ХОБЛ относится к распространенным заболеваниям человека. В ближайшие годы прогнозируется дальнейший рост заболеваемости [2–4]. В эпидемиологических данных о заболеваемости и смертности часто недооценивают значение и распространенность ХОБЛ, так как обычно она не диагностируется до развития клинически выраженных и относительно тяжелых стадий заболевания [1, 3]. По данным Европейского респираторного общества, только 25 % случаев заболевания диагностируется своевременно [6]. В Узбекистане диагностика ХОБЛ находится на еще более низком уровне. По данным Министерства здравоохранения Узбекистана показатель распространенность ХОБЛ по разным регионам Узбекистана от 67 в до 168 случаев на 10000 населения.
В настоящее время компьютерная томография (КТ) является одним из ведущих методов медицинской визуализации в диагностике различных заболеваний органов грудной полости [7, 14,15]. Эта методика позволяет существенно расширить диагностические возможности лучевых методов исследования в выявлении различных рентгеноморфологических изменений легких и бронхов. Например, замена шаговой КТ на спиральный (толщина коллимационного среза 2.5 мм) и КТ высокого разрешения (толщина коллимационного среза 1 мм с алгоритмом реконструкции изображений с высоким пространственным разрешением) специфичность метода значительно возросла [17].
В связи с этим для выявления ХОБЛ на ранних стадиях целесообразно применение МСКТ и особенно методики КТВР. КТВР изменила подходы к диагностике ХОБЛ. С введением в клиническую практику КТВР разграничение различных форм эмфиземы и бронхиолита стало более точным. Реальный вклад КТВР в изучение болезней мелких дыхательных путей является одним из наиболее важных достижений метода КТ в течение последнего десятилетия [7, 18].
КТВР изменила подходы к диагностике ХОБЛ. С введением в клиническую практику КТВР разграничение различных форм эмфиземы и бронхиолита стало более точным. Реальный вклад КТВР в изучение болезней мелких дыхательных путей является одним из наиболее важных достижений метода КТ в течение последнего десятилетия [7, 18].
Целью данного исследования явилось определение роли рентгенографии и КТВР в диагностике ХОБЛ с различной степенью вентиляционной недостаточности легких.
Материал и методы: Исследовано 34 больных (из них 19 мужчин и 15 женщин) проходивших обследование с подозрением на хроническую обструктивную болезнь легких,в возрасте от 20 до 70 лет (средний возраст 58 лет). Длительность заболевания колебалась от 5 до 15 лет.
Наиболее характерным клиническим признаком являлась одышка со снижением толерантности к физической нагрузке, которая отмечалась у больных пожилого возраста (n-12) и отхождение мокроты по утрам при умывании (n = 12). У 2 наиболее тяжелых пациентов отмечалось участие в дыхательных экскурсиях вспомогательных мышц шеи. Диагностическое значение имели результаты аускультации: жесткое дыхание, выслушиваемое над всей поверхностью легких, и сухие рассеянные низкотональные хрипы. При появлении мокроты у 15 пациентов выслушивались влажные мелкопузырчатые хрипы. У 10 пациентов кашель отсутствовал или был выражен незначительно. У курящих пациентов (n = 5) отмечались прогрессирование одышки и кашель со слизисто-гнойной мокротой.
Для оценки степени обструкции ХОБЛ пациентам выполнялась спирометрия на аппарате Спироанализатор/STT95 фирмы FukudaSangyoCo. Ltd. Основной показатель тяжести заболевания ХОБЛ — значение объема форсированного выдоха за 1-ю секунду (ОФВ1). Наиболее чувствительным критерием нарушения бронхиальной проходимости является отношение ОФВ1 к ФЖЕЛ — индекс Тиффно. Индекс Тиффно менее 70 % в период ремиссии болезни свидетельствует об обструктивных нарушениях и характерен для всех пациентов с ХОБЛ, за исключением 0 стадии заболевания. Обструкция считается хронической, если, несмотря на проводимую терапию, она регистрируется больше 3 раз в год. Этот показатель является ранним признаком ограничения воздушного потока даже при сохранении ОФВ1 80 % от должных величин. Результаты оценки функции внешнего дыхания изучались нами совместно с пульмонологом, в результате чего делалось окончательное заключение о характере течения ХОБЛ и степени обструкции бронхов. На основание это заключение пациенты разделенына 3 группы.
Обструкция считается хронической, если, несмотря на проводимую терапию, она регистрируется больше 3 раз в год. Этот показатель является ранним признаком ограничения воздушного потока даже при сохранении ОФВ1 80 % от должных величин. Результаты оценки функции внешнего дыхания изучались нами совместно с пульмонологом, в результате чего делалось окончательное заключение о характере течения ХОБЛ и степени обструкции бронхов. На основание это заключение пациенты разделенына 3 группы.
Показатели функции внешнего дыхания в зависимости от степени тяжести ХОБЛ
|
№ |
Степени тяжести |
ОФВ1 в % от должного |
Число больных |
|
1 |
Легкая |
ОФВ1>80 % от должных величин. Обычно хронический кашель иногда с выделением мокроты. |
12 |
|
2 |
Средняя тяжесть |
50 %<ОФВ <80 % от должных величин. Хронический кашель с выделением умеренного количества мокроты |
13 |
|
3 |
Тяжелая |
30 %<ОФВ <50 % от должных величин. |
6 |
|
4 |
крайне тяжелая |
ОФВ 1 <30 % от должных величин или ОФВ 1 <50 % от должных величин в сочетании с хронической дыхательной или правожелудочковой недостаточностью |
3 |
С целью уточняющей диагностики всем больным проводилось лучевое обследование. Прежде всего выполнялась рентгенография грудной клетки в двух проекциях на рентгеновском аппарате TITAN-2000 (Корея). Дальнейший диагностический поиск включал стандартную КТ легких и органов средостения в режиме спирального сканирования и КТВР в шаговом режиме. Исследование выполнялось на аппарате SiemensSomatomEmotion (Германия). Технические параметры при выполнении КТВР были следующими: напряжение 130 кВ, сила тока 120мAс, время сканирования 2 с, толщина среза 1 мм, шаг 10 мм, алгоритм реконструкции высокого разрешения. Внутривенное введение контрастного вещества не проводили. Сканирование выполняли на высоте вдоха.
Результаты и их обсуждение: у 5 из 12больныхс 1-ой стадией вентиляционной недостаточности (ОФВ1>80 % от должных величин)на рентгенограммах отмечалось сгущение и умеренная деформация легочного рисунка в базальных отделах легких. У 7 больных патологических изменений в легких не было выявлено. При выполнении КТВР у 9 больных были отмечены расширение, деформация сегментарных и субсегментарных бронхов, у 10 больных поражение было отмечено преимущественно, в периферических бронхах легких. Почти у всех больных отмечено симптом «воздушной ловушки».
На рентгенограммах 8 из 13больных с 2-ой стадией вентиляционной недостаточности было отмечено увеличение объёма соединительной ткани в лёгких и бронхах, сетчатый рисунок (пневмосклероз). У 12 больных обнаружено утолщение стенок бронхов, неравномерная прозрачность лёгочных полей. При выполнении КТВР у всех больных отмечались признаки поражения бронхов различного калибра. При этом утолщение и деформация стенок сегментарных и субсегментарных бронхов установлена у 10 больных, из них у 9 отмечался симптом «трамвайных рельсов». Усиление легочного рисунка в нижних долах легких отмечено у 11 больных. При КТВР исследование в фазе вдоха признаки «мозаичного» легкого были отмечены у 11. У 3 больных отмечены небольшие округлых зон патологически низкой плотности особенно в верхние доли легких (внутридольковая эмфизема) и 2-х больных на уровне главного бронха (парасептальная эмфизема).
У 12 больных обнаружено утолщение стенок бронхов, неравномерная прозрачность лёгочных полей. При выполнении КТВР у всех больных отмечались признаки поражения бронхов различного калибра. При этом утолщение и деформация стенок сегментарных и субсегментарных бронхов установлена у 10 больных, из них у 9 отмечался симптом «трамвайных рельсов». Усиление легочного рисунка в нижних долах легких отмечено у 11 больных. При КТВР исследование в фазе вдоха признаки «мозаичного» легкого были отмечены у 11. У 3 больных отмечены небольшие округлых зон патологически низкой плотности особенно в верхние доли легких (внутридольковая эмфизема) и 2-х больных на уровне главного бронха (парасептальная эмфизема).
У 3-х из 6больных с 3-й стадией вентиляционной недостаточности на рентгенограммах было обнаружено увеличение объёма соединительной ткани в лёгких(сетчатый рисунок), у 2-х утолщения стенок бронхов. У всех больных в 3-й стадии выявлялось усиление и деформация легочного рисунка в нижних отделах легких. У 5 больных отмечалось наличие бронхоэктазов. При КТВР выявились следующие изменения: признаки утолщение стенок бронхов — у 3 больных, симптом «трамвайных рельсов» у 2 больных и у 2 больных на уровне мелких бронхов множественные мелкие внутридольковые очаги-симптом «дерево в почках» и небольших округлых зон патологически низкой плотности(эмфизема). У 4 больных были обнаружены мешковидные бронхоэктазы, а цилиндрические у всех пациентов. Практический у всех пациентов отмечается симптом «воздушной ловушки».
У всех больных с 4-й стадией вентиляционной недостаточности на рентгенограммах были обнаружены множественные мешковидные бронхоэктазы, сгущение и усиление легочного рисунка в нижних отделах, увеличение в размерах тени сердца. При КТВР легкие оставались вздутыми и находились в состояние «фиксированного вдоха». У 2 пациентов отмечено наличие крупных и гигантских субплевральных зоны пониженной плотности с видимыми стенками (буллы). Диагностическое значение в этих случаях имело выявление бронхоэктазов и симптом клапанного вздутия.
|
№ |
Степени тяжести |
ОФВ1 в % от должного |
Число больных |
R-признаки |
КТВР |
|
1 |
Легкая |
ОФВ1>80 % от должных величин. Обычно хронический кашель иногда с выделением мокроты. |
12 |
сгущение и умеренное деформация легочного рисунка в базальных отделах легких. |
расширение и деформация сегментарных и субсегментарных бронхов. Симптом «воздушной ловушки». |
|
2 |
Средняя тяжесть |
50 %<ОФВ <80 % от должных величин. Хронический кашель с выделением умеренного количества мокроты |
13 |
изменение легочного рисунка в виде пневмосклероза,утолщение стенкой бронхов. |
утолщение и деформация стенок сегментарных и субсегментарных бронхов, симптом «трамвайных рельс», «мозаичного» легкого |
|
3 |
Тяжелая |
30 %<ОФВ) <50 % от должных величин. |
6 |
легочного рисунка в виде пневмосклероза,утолщения стенок бронхов,усиление и деформация легочного рисунка в нижних отделах легких и наличие бронхоэктазов |
утолщение стенок,симптом трамвайных рельсов,симптом (дерево с почками),мешковидно-цилиндрических бронхоэктазов, симптом «воздушной ловушке».воздушные полости неправильной формы |
|
4 |
крайне тяжелая |
ОФВ 1 <30 % от должных величин или ОФВ 1 <50 % от должных величин в сочетании с хронической дыхательной или правожелудочковой недостаточностью |
3 |
множественные мещковидные бронхоэктазии,сгущение и усиление легочного рисунка в нижних отделах. Увеличение в размерах тени сердца. |
вздутыелегкие, бронхоэктазов и симптом клапанного вздутия. |
У3 пациентов (3-й стадии) были обнаружены воздушные полости неправильной формы, стенками которых являлась неизмененная легочная ткань без видимых стенок. Воздушные полости имели центрилобулярное расположение, изменения были наиболее выраженными в верхних долях, особенно в верхушечных и задних сегментах. У 7 пациентов(2–3 й стадий) зоны пониженной плотности, округлой формы и небольших размеров (2–3 мм) располагались также субплеврально и парасептально. У 2 пациентов (4-й стадии) отмечено наличие крупных и гигантских субплевральных булл с видимыми стенками и сочетание их с воздушными полостями другой локализации (рис. 1).
1).
Рис.1. Больной Ахмадалиев Е. 74г. МСКТ аксиальная срез грудной клетки толщиной 2.5 мм. Внутридольковая сливная и парасептальная буллезная эмфизема. Множественные воздушные полости (стрелки) различных размеров преимущественно без видимых стенок на фоне неизмененной паренхимы.
По данным ряда авторов [8, 18,23], эти изменения соответствуют различным вариантам эмфиземы (внутридольковой, парасептальной, панлобулярной. У 5 пациентов при КТ на высоте вдоха определялись признаки экспираторной воздушной ловушки в объемах от единичных долек до сегментов. У 2 пациентов данный симптом сочетался с признаками мозаичности легочной ткани на высоте вдоха. На фоне зон избыточной прозрачности отмечалось уменьшение калибра соответствующих ветвей легочной артерии. По материалам ряда авторов [11, 15, 24] данные симптомы косвенно свидетельствуют об облитерирующем бронхиолите, при котором морфологи отмечают разрастание грануляций в просвете дистальных бронхиол и фиброзирование их стенок вплоть до почти полной облитерации просвета. В результате при вдохе вторичная долька заполняется воздухом, растягивается, а при выдохе не спадается.
Рис.2. Больной Шукуров А. 49л. МСКТ аксиального среза грудной клетки толщиной 2.5 мм. Облитерирующий бронхиолит, бронхит. Множественные воздушные ловушки (стрелки), утолщение и нечеткость стенок бронхов, цилиндрически расширенные бронхи на фоне воздушных ловушек.
У 1 пациентов (4й стадии) данной группы с помощью КТВР выявлены цилиндрические и варикозные бронхоэктазы бронхов 4–8 порядков, у 5 пациентов(2–3й стадий) отмечены утолщение стенок бронхов и нечеткость их контуров. Кроме того, по данным КТВР у 3 пациентов(3-й стадии) внутри вторичных долек отмечено появление мелких очагов на фоне некоторого усиления внутридолькового интерстициального рисунка. Данные проявления в научной литературе [12, 15,16, 25] названы симптомами “дерево с набухшими почками” или “игрушечные человечки” и морфологически соответствуют проявлениям облитерирующего бронхиолита различной этиологии. У 3 пациентов(3–4й стадий) отмечено сочетание признаков эмфиземы и бронхиолита (рис. 3).
У 3 пациентов(3–4й стадий) отмечено сочетание признаков эмфиземы и бронхиолита (рис. 3).
Рис.3. Эмфизема, инфекционныйбронхиолит и облитерирующий бронхиолит. На фоне воздушных ловушек и неизмененной паренхимы легких видна внутридольковая и парасептальная эмфизема. Симптом “дерева с набухшими почками” как проявление инфекционного бронхиолита (стрелки).
Выводы:
1. В рамках ХОБЛ развивается как минимум 2 параллельных патологических процесса (эмфизема и облитерирующий бронхиолит), имеющие различные симптомы при КТВР.
2. При ХОБЛ облитерирующий бронхиолит сочетается с инфекционным бронхитом и/или бронхиолитом, нередко с эмфиземой, что создает характерную, часто патогномоничную КТ картину.
3. Клинические проявления одышки при ХОБЛ обусловлены выраженностью облитерирующего бронхиолита, а не эмфиземы.
4. КТВР должна стать методом выбора в лучевой диагностике ХОБЛ.
Литература:
1. Белявский А. С. Глобальная инициатива по ХОБЛ. Пересмотр 2003 г.
2. Авдеев С. Н. Хроническая обструктивная болезнь легких в таблицах и схемах. М.: Атмосфера, 2003.
3. Авдеева О. Е. и др. // Хронические обструктивные болезни легких / Под ред. А. Г. Чучалина. М., 1998.
4. Хроническая обструктивная патология легких у взрослых и детей: Руководство для врачей / Под ред. А. Н. Кокосова. СПб.: СпецЛит, 2004.
5. Чучалин А. Г., Овчаренко С. И. Современный взгляд на хроническую обструктивную болезнь легких // Врач. 2004. № 5. С. 4.
6. СоŁto D. B. et al. Predictor of physician diagnosis of COPD in the USA Abstracts // ERS Ann. Congres. Oct. 9–13. Madrid, 1999. № 2857.
7. Власов П. В. Лучевая диагностика заболеваний органов грудной полости. М.: Видар, 2006.
8. Варламов В. В. Эмфизема легких (патогенез, диагностика и хирургическое лечение): клинико-экспериментальное исследование: Автореф. дис…. мед.наук. Л., 1991.
дис…. мед.наук. Л., 1991.
9. Клинические рекомендации. Хроническая обструктивная болезнь легких / Под ред. А. Г. Чучалина. М.: Атмосфера, 2003.
10. Ciba Guest Symposium. Terminology, definitions and classification of chronic pulmonary emphysema and related conditions // Thorax. 1959. V. 14. Р. 286–299.
11. Черняев А. Л., Самсонова М. В. Облитерирующий бронхиолит // Хронические обструктивные болезни легких / Под ред. А. Г. Чучалина. М.: ЗАО Бином; СПб.: Невский диалект, 1998. С. 381–384.
12. Юдин А. Л., Афанасьева Н. И., Горюнов А. А. Современная лечевая диагностика хронической обструктивной болезни легких // Врач. 2004. № 5. С. 42.
13. Yung FryySmith A., Hyde C. Lung volume reduction surgery (LVRS) for chronic obstructive pulmonary disease (COPD) with underlying severe emphysema // Thorax. 1999. V. 54. P. 779–789.
14. Китаев В. В. Компьютерная томография высокого разрешения в диагностике заболеваний легких // Мед.виз. 1997. № 4. С. 21–26.
15. Тюрин И. Е. Компьютерная томография органов грудной полости. СПб.: ЭЛБИ-СПб, 2003.
16. Webb W. R. Radiology of Obstructive Pulmonary Disease.,1997.
17. Webb W. R., Muller N. L., Naidich D. P. High-resolutions CT of the lung. Philadelphia: Lippincott-Raven, 2nded.
18. Харченко В. П., Глаголев Н. А. Рентгеновская компьютерная томография в диагностике заболеваний легких и средостения. М.: Медика, 2005.
19. Cooper J. D., Patterson G. A. Lung volume reduction surgery for severe emphysema // Chest Surg. Clin. Nord Am. 1995. N 5.Р.813–815.
20. Cooper J. D., Patterson G. A., Sunderesan R. S. Results of 150 consecutive bilateral lung volume reduction procedures in patients with severe emphysema // Thorac. Cardiovasc.Surg. 1996. V. 112. P. 1319–1329.
21. Fensler E. A., Cugell D. W., Knudsen R. J., Fitzgerald M. X. Surgical manage of Emphysema // Clin. Chest Med. 1983.N 4. P. 443–463.
22. Janus E. D. et al. Smoking, lung function and alphaa11 antitrypsin deficiency // Lancet. 1980. V. 1. P. 152–154.
23. Morgan M. D. L. et al. Value of computed tomography for selecting patients with bullous emphysema // Thorax. 1986. V. 41. P. 855–862.
Случай рубцового саркоидоза | “Клінічна імунологія. Алергологія. Інфектологія”
Саркоидоз представляет собой хроническое воспалительное гранулематозное заболевание, этиология которого до сегодняшнего дня неизвестна. Саркоидоз характеризуется поражением различных органов и систем (легких, медиастенальных лимфатических узлов, кожи, глаз, костной системы). Рубцовый саркоидоз появляется в местах старых рубцов и является редкой формой кожного саркоидоза. Также данное поражение кожи встречается при системном саркоидозе и достаточно трудно диагностируется.
Клинический случай вверхПациентка М., 1975 г., обратилась с жалобами на появление высыпаний на коже лба, переносицы, в области щек и красной каймы губ. Первые кожные элементы на красной кайме губ появились 5 лет назад, через год после татуажа. После обращения к дерматологу был установлен диагноз «Вирусные бородавки» и проведена криодеструкция образований, которые через время после удаления появились вновь. Неоднократно проводилась электрокоагуляция, лазерная коагуляция, однако лечение было неэффективным – после каждого удаления через время отмечался рецидив высыпаний.
Из анамнеза выяснилось, что с 2002 г. пациентка находится на диспансерном учете по поводу саркоидоза легких и однократно получила курс терапии, включающий тиосульфат натрия 30%, витамин Е, полькортолон в дозе 4 мг в сутки в течение 2 нед. Последние 5 лет дополнительной терапии не получала.
Рис. 1. Пациентка М., 1975 г.: множественные гранулематозноые высыпания на коже лица и красной каймы губ
Рис. 1. Пациентка М., 1975 г.: множественные гранулематозноые высыпания на коже лица и красной каймы губ
Пациентка М., 1975 г.: множественные гранулематозноые высыпания на коже лица и красной каймы губ
Рис. 2. Пациентка М., 1975 г.: дерматоскопия высыпаний на коже красной каймы губ (а) и коже щеки (б) – феномен «яблочного желе»
Рис. 2. Пациентка М., 1975 г.: дерматоскопия высыпаний на коже красной каймы губ (а) и коже щеки (б) – феномен «яблочного желе»
Объективно при осмотре на коже лица в области лба и щек множественные желтоватого цвета гранулематозные высыпания и рубцы после деструкции. По краю красной каймы губ на месте предшествующего татуажа множественные гранулематозные высыпания розово-желтого цвета (рис. 1). При проведении дерматоскопии определялся признак «яблочного желе» (рис. 2).
Результаты клинико-лабораторных и инструментальных методов исследований вверхКлинический анализ крови: СОЭ – 6 мм/ч, гемоглобин (HGB) – 129 г/л, эритроциты (RBC) – 3,89х1012/л, гематокрит (HCT) – 0,38L/L, средний объем эритроцита (MCV) – 98 фл, среднее содержание гемоглобина в эритроците (MCH) – 33,2 пг, средняя концентрация гемоглобина в эритроците (MCHC) – 339 г/л, ширина распределения эритроцитов (RDW) – 10,9%, цветной показатель – 0,99, тромбоциты (PLT) – 203х109/л, средний объем эритроцита – 10,6 фл, лейкоциты (WBC) – 7,1х109/л, лимфоциты (LYM) – 22,2%, лимфоциты абс. количество (LYM) – 1,57 г/л, моноциты (MON) – 7,4%, моноциты абс. количество (MON) – 0,52 г/л, эозинофилы (EOS) – 1,3%, эозинофилы абс. количество (EOS) – 0,09 г/л, базофилы (BAS) – 0,5%, базофилы абс. количество (BAS) – 0,04 г/л, палочкоядерные нейтрофилы – 5,0%, сегментоядерные нейтрофилы – 63,6%, тромбокрит (PCT) – 0,215%.
Биохимический анализ крови: кальций – 2,45 ммоль/л, ангиотензинпревращающий фермент (АПФ, АСЕ) – 65 Ед/л, глюкоза – 3,31 ммоль/л, общий белок – 75,07 г/л, билирубин общий – 16,21 мкмоль/л, билирубин прямой – 2,38 мкмоль/л, билирубин непрямой – 13,8 мкмоль/л, гамма-глутамилтрансфераза – 16 Ед/л, АлАТ – 10,0 Ед/л, АсАТ – 18 Ед/л, щелочная фосфатаза – 57,6 Ед/л, холестерин – 7,20 ммоль/л.
Анализ крови на сифилис: иммуноферментный анализ (ИФА) на сифилис – результат отрицательный, реакция пассивной гемагглютинации (РПГА) – отрицательная, реакция микропреципитации (РМП) с активной и инактивированной сывороткой – отрицательная.
Антитела к ВИЧ 1/2 – не обнаружены.
Ультразвуковое исследование органов брюшной полости: печень: правильно расположена, обычной формы, не выступает из-под края реберной дуги. Структура паренхимы однородна. Эхогенность и звукопроводимость паренхимы не изменены. Очаговых образований не выявлено. Внутрипеченочные желчные протоки и печеночные вены не расширены. Воротная вена не расширена. Желчный пузырь обычных размеров, стенки не изменены, конкрементов в просвете не выявлено. Холедох не расширен. Поджелудочная железа обычных размеров: головка – 31 мм (норма 11–32 мм), тело – 12 мм (норма 4–21 мм), хвост – 21 мм (норма 7–35 мм). Структура паренхимы однородна. Эхогенность паренхимы обычная. Панкреатический проток не расширен. Селезенка не увеличена, расположена типично, контуры ровные, паренхима однородна. Почки: расположены типично, нормальной формы и размеров. Толщина паренхимы во всех отделах в пределах возрастной нормы. Эхогенность паренхимы обычная. Кортико-медуллярная дифференциация сохранена. Лоханки расширены до 1 мм. Мочеточники расширены до 3 мм. Через 20 мин после опорожнения мочевого пузыря пиелоуретероэктазия не отмечается. Мочевой пузырь обычной формы, стенки ровные. Патологических включений не выявлено. Объем мочевого пузыря в момент исследования – 328 мл. Остаточной мочи нет. Заключение: признаки пузырномочеточникового рефлюкса.
Рис. 3. Пациентка М., 1975 г.: КТ ОГК: усиление и деформация легочного рисунка, преимущественно в базальных отделах легких, увеличение, расширение срединных структур за счет лимфаденопатии
Рис. 3. Пациентка М., 1975 г.: КТ ОГК: усиление и деформация легочного рисунка, преимущественно в базальных отделах легких, увеличение, расширение срединных структур за счет лимфаденопатии
Рентгенологическое исследование органов грудной клетки (ОГК): на обзорной рентгенограмме ОГК легкие без очаговых и инфильтративных изменений. Легочный рисунок диффузно усилен, обогащен, деформирован, с участками обызвествления. Корни легких малоструктурные, повышенной интенсивности. Срединная тень расширена за счет лимфоаденопатии. Реберно-диафрагмальные синусы свободные. Сердце расширено в поперечнике влево за счет гипертрофии левого желудочка. Заключение: саркоидоз легких. Без отрицательной динамики (рис. 3).
Легочный рисунок диффузно усилен, обогащен, деформирован, с участками обызвествления. Корни легких малоструктурные, повышенной интенсивности. Срединная тень расширена за счет лимфоаденопатии. Реберно-диафрагмальные синусы свободные. Сердце расширено в поперечнике влево за счет гипертрофии левого желудочка. Заключение: саркоидоз легких. Без отрицательной динамики (рис. 3).
- 2004 г.: легкие без очаговых и инфильтративных изменений. Легочный рисунок не изменен. Трахея свободно проходима, не смещена. Главные бронхи свободно проходимы, не смещены. Паратрахеальные лимфоузлы увеличены до 13 мм, бифуркационные – с образованием конгломератов размерами до 40×30 мм, парааортальные – 45×32 мм, бронхопульмональные, больше справа, – до 16 мм. Заключение: лимфаденопатия медиастинальных и бронхопульмональной групп.
Рис. 4. Пациентка М., 1975 г.: рентгенологическое исследование ОГК: легочный рисунок диффузно усилен, обогащен, деформирован, с участками обызвествления. Корни легких малоструктурны, повышенной интенсивности
Рис. 4. Пациентка М., 1975 г.: рентгенологическое исследование ОГК: легочный рисунок диффузно усилен, обогащен, деформирован, с участками обызвествления. Корни легких малоструктурны, повышенной интенсивности
2016 г.: на серии КТ очаговых и инфильтративных изменений в легких не выявлено. Стенки бронхов несколько уплотнены. Корни легких не структурны, расширены. Отмечается увеличение, расширение срединных структур за счет лимфоаденопатии, бронхопульмональных трахеобронхиальных, паратрахеальных и бифуркационных лимфоузлов в виде пакетов диаметром 12–14 мм с вкраплениями извести, изменения более выражены в правом корне легкого. Сердце, магистральные сосуды и диафрагма расположены обычно, контуры не изменены. Жидкости в плевральных полостях нет. Заключение: КТ-признаки саркоидоза легких (рис. 4). В сравнении с предыдущими исследованиями (рентгенография легких 2004, 2006 г.) – без динамики.
Жидкости в плевральных полостях нет. Заключение: КТ-признаки саркоидоза легких (рис. 4). В сравнении с предыдущими исследованиями (рентгенография легких 2004, 2006 г.) – без динамики.
Патогистологическое исследование иссеченного участка кожи лба и красной каймы губ: микроскопически в образцах – гранулематозное поражение кожи. Характер строения гранулем позволяет предположить наличие саркоида с поражением вышеуказанных тканевых структур.
Проба Манту – отрицательная.
После консультации пульмонолога назначена терапия системными глюкокортикостероидами (ГКС; преднизолон), местно – лечение ГКС-мазями. Через 3 мес отмечался регресс высыпаний на коже лица.
Обсуждение вверхСаркоидоз представляет собой хроническое полиорганное заболевание неизвестной этиологии, характеризующееся образованием неказеозных гранулем в пораженных органах. Кожные проявления относительно редки и составляют 20–35%. Они делятся на две группы: специфические и неспецифические.
Специфические кожные проявления имеют вид пятен, папул, узелков, бляшек, подкожных узелков, инфильтративных рубцов и ознобленной волчанки. Неспецифические – проявляются в виде кальцификации, мультиформной эритемы, почесухи и синдрома Свита. Поскольку саркоидоз кожи имеет много вариантов, диагноз установить достаточно трудно. Для установления диагноза важна комплексная оценка клинических, гистопатологических и лабораторных исследований.
По данным Marchell R.M. и соавт., у 29% пациентов с кожным саркоидозом высыпания начинаются как рубцовые поражения. Янардаг и др. сообщают о возникновении рубцового саркоида в местах травмы – после внутримышечной инъекции, татуировки, венопункции, на месте высыпаний после перенесенного опоясывающего герпеса. Ряд авторов указывает, что причиной рубцового саркоида является предыдущее загрязнение старых рубцов инородными телами, что можно рассматривать как гранулемы инородного тела.
Легочные нарушения, как известно, встречаются чаще у пациентов с ознобленной волчанкой и рубцовым саркоидозом, чем у пациентов с другими вариантами саркоидоза кожи. Симптомы рубцового саркоидоза могут помочь обнаружить системное поражение, особенно поражение легких. Рубцовый саркоидоз без других поражений кожи встречается редко. Латентный период до реактивации старых кожных рубцов составляет от 6 мес до 59 лет. Дифференциальная диагностика рубцового саркоидоза включает инфекционные дерматологические заболевания, сифилис, болезнь Крона, розацеа, гранулемы инородного тела и келоидные рубцы.
Рис. 5. Пациентка М., 1975 г.: рубцовый саркоидоз: регресс высыпаний через 3 мес после проведенной терапии
Рис. 5. Пациентка М., 1975 г.: рубцовый саркоидоз: регресс высыпаний через 3 мес после проведенной терапии
Саркоидоз имеет крайне неоднородную клиническую картину и, таким образом, определяется как «великий имитатор». При подозрении на саркоидоз рубца биопся берется из реактивированного старого шрама и может быть подтверждена после проведения гистологического исследования.
Лечение и прогноз саркоидоза кожи зависит в первую очередь от системности поражений. Топические ГКС могут быть эффективны при изолированном саркоидозе рубца. В случае системного поражения эффективны системные ГКС, гидроксихлорохин, метотрексат, тетрациклин, изотретиноин, пентоксифиллин, аллопуринол, витамин D, талидомид, азатиоприн, циклофосфамид, микофенолятмофетил и ингибиторы фактора некроза опухолей.
В описанном клиническом случае пациентка продемонстрировала положительный ответ на системную и местную терапию ГКС, о чем свидетельствует регресс как кожной симптоматики (рис. 5), так и улучшение со стороны легких при последующем рентгенологическом исследовании.
Список литературы
1. Савоськина В.О. Саркоидоз кожи (болезнь Бенье—Бека—Шауманна) // Клінічна імунологія. Алергологія. Інфектологія. – 2014. – Спецвипуск № 8 (77). – С. 15–18.
2. Савоськина В.О. Случай язвенно атрофической формы саркоидоза // Клінічна імунологія. Алергологія. Інфектологія. – 2015. – Спецвипуск № 1. – С. 60–62.
3. Özlem Su1, Nahide Onsun1, Buğçe Topukçu1, Hatice Kutbay Özçelik2, Alkım Ünal Çakıter1, Nur Büyükpınarbaşılı3.Disseminated scar sarcoidosis may predict pulmonary involvement in sarcoidosis. Acta Dermatovenerologica. 2013; 22:71-74 doi: 10.2478/v10162-012-0038-8
4. Mahajan VK, Sharma NL, Sharma RC, Sharma VC.Cutaneous sarcoidosis: clinical profile of 23 Indian patients. Indian J Dermatol Venereol Leprol. 2007; 73:16-21.
5. Manz LA, Rodman OG. Reappearance of quiescent scars. Sarcoidosis. Arch Dermatol. 1993; 129:105-8.
6. Chudomirova K, Velichkova L, Anavi B, Arnaduova M. Recurrent sarcoidosis in skin scars accompanying systemic sarcoidosis. J Eur Acad Dermatol Venereol. 2003; 17:360-1.
7. Hanno R, Needelman A, Eiferman RA, Callen JP. Cutaneous sarcoidal granulomas and the development of systemic sarcoidosis. Arch Dermatol. 1981; 117:203-7.
8. Samtsov AV. Cutaneous sarcoidosis. Int J Dermatol. 1992; 31:385-91.
9. Lodha S, Sanchez M, Prystowsky S. Sarcoidosis of the skin: a review for the pulmonologist. Chest. 2009; 136:583-96.
10. Marchell RM, Judson MA. Chronic cutaneous lesions of sarcoidosis. Clin Dermatol. 2007; 25:295-302.
11-21: список литературы находится в редакции
Випадок рубцевого саркоїдозуВ.О. Савоськіна
Резюме
Розвиток саркоїдної гранульоми в ділянці застарілих рубців є рідкісною формою маніфестаціі шкірного саркоїдозу. В статті наведено клінічний випадок 42-річної жінки, у якої розвинувся саркоїдоз в місцях застарілих рубців після татуажу губ. При біопсії були виявлені ділянки гранулематозної тканини без казеозного некрозу, характерні для саркоїдозу. Комп’ютерна томографія органів грудної клітки виявила посилення і деформацію легеневого малюнку, переважно в базальних відділах легень, збільшення, розширення серединних структур за рахунок лимфаденопатії без вогнищ ураження в легенях. Після застосування короткого курсу системних і місцевих кортикостероїдів у пацієнтки відзначався успішний регрес шкірного саркоїдозу.
Ключові слова: шкірний саркоїдоз, дерматоскопія, лікування.
The case of cicatricial sarcoidosisV.О. Savoskyna
Abstract
Infiltration of sarcoid granuloma in old cutaneous scars is one of the uncommon cutaneous manifestations of sarcoidosis. Here, we report the case of a 42-year-old female who presented with swelling and irritation in 5 old scars after tattoo. An incisional scar biopsy revealed noncaseating granulomas consistent with sarcoidosis. High-resolution CT (HRCT) revealed right paratracheal, both hilar, paraaortic, and subcarinal lymphadenopathy without any nodular densities in both lung fields. Successful regression of cutaneous inflammation was achieved using a short course of oral and topical steroids.
Key words: cutaneous sarcoidosis, dermoscopy, treatment.
Поражение легких по типу матового стекла на КТ
Главная статьи Поражение легких по типу матового стекла на КТБлагодаря мультиспиральной компьютерной томографии грудной клетки, или МСКТ, которая считается наиболее информативным методом обследования легких, врачи могут диагностировать инфекционно-воспалительные и онкологические заболевания на ранних стадиях.
«Матовые стекла» характерны для пневмонии, туберкулеза, рака легких и других опасных состояний. Какие именно и по каким признакам их различают? Рассмотрим подробнее в этой статье.
Что такое «матовое стекло»?
«Матовые стекла» — это участки уплотнения легочной ткани, которые хуже пропускают X-Ray лучи. По-другому их называют очагами уплотнения ткани легких. На томограммах такие области напоминают светлые пятна или мутноватый налет. Очаги по типу «матового стекла» свидетельствуют о том, что альвеолы легких заполнены жидкостью (транссудатом, кровью), а не воздухом. Также они могут свидетельствовать о снижении пневматизации легких из-за фиброзных изменений. Альвеолы участвуют в газообмене, снабжают клетки кислородом и выводят углекислый газ, поэтому заполнение их полости жидким веществом или клетками соединительной ткани недопустимо.
Если общая площадь «матовых стекол» увеличивается, это свидетельствует о прогрессирующем инфекционно-воспалительном заболевании. Пациента начинает беспокоить нехватка воздуха, одышка, кашель.
При каких заболеваниях «матовое стекло» проявляется на томограммах?
По данным кафедры лучевой диагностики ММА им. Сеченова, картину «матовости» чаще всего дают пневмонии (вирусные, бактериальные, грибковые), однако инфильтрация легких характерна и для других патологических состояний. Вот только некоторые из них:
- Альвеолярный протеиноз;
- Пневмонит;
- Кровоизлияние;
- Гранулематозы;
- Альвеолярный отек;
- Аллергический альвеолит;
- Туберкулез;
- Медикаментозное поражение легких;
- Инфаркт легкого;
- Вирусная инфекция;
- Дерматомиозит;
- Опухоли;
- Ревматоидный артериит;
- Респираторный бронхиолит с ИЗЛ;
- Синдром Съегрена;
- Синдром Гудпасчера;
- Склеродермия.
Оценивая данные КТ легких, врач-рентгенолог дифференцирует заболевания по специфической картине «матовых стекол»: их количеству, локализации, наличию других признаков, по которым возможно определить причину патологических изменений ткани легких. Например, для двусторонней вирусной пневмонии характерно наличие «матовых стекол», расположенных периферически в нижних и задних отделах легких. В более поздней стадии наблюдается консолидация очагов инфильтрации с утолщением перегородок альвеол.
«Матовые стекла» при туберкулезе могут быть расположены рядом с бронхами или диссеминированы — в этом случае наблюдается множество маленьких светлых участков (инфильтратов), хаотично расположенных во всей полости легких. Также при туберкулезе на КТ легких можно обнаружить характерные фиброзные тяжи, ведущие к корню легкого — это перибронхиальное воспаление, признаки лимфостаза с увеличением лимфатических узлов. Единичные участки «матового стекла» малого размера без четкого паттерна какого-либо заболевания могут указывать на новообразование, развивающийся фиброз, аденокарциному (рак) легких.
Иногда «матовые стекла» указывают на сосудистые патологии, которые приводят к сдавливанию альвеолярного пространства. У пациентов с ожирением могут появится в гравитационно-зависимых (нижних) областях легких под воздействием лишнего веса. У здоровых пациентов эффект «матового стекла» может проявиться на томограммах в случае, если сканирование грудной клетки проведено на выдохе (правильно — на глубоком вдохе).
Не принимая в расчет эти погрешности и говоря об истинном синдроме «матового стекла» на КТ легких, отметим, что это признак нефункциональных участков легких. В норме уплотнений и препятствий для дыхания быть не должно, а легочная ткань представлена на томограммах однородным темным цветом. Очень редко «матовые стекла» указывают на индивидуальные особенности организма пациента, например, на нетипичное расположение диафрагмы у новорожденных. Но это единичные случаи, поэтому давайте рассмотрим наиболее распространенные паттерны заболеваний, при которых на томографии встречаются «матовые стекла».
«Матовые стекла» на КТ при пневмонии
Чаще всего «матовое стекло» на КТ проявляется при воспалении легких, причем это может быть абсолютно любая пневмония: вирусная, бактериальная, с атипичным развитием симптомокомплекса, очень редкая интерстициальная и так далее. Поскольку спектр возбудителей пневмонии чрезвычайно широк, а дифференцировать заболевания легких по одному эффекту «матового стекла» не всегда представляется возможным, пациенту рекомендуется лабораторная диагностика — анализ крови или отделяемого из дыхательных путей на предмет микоплазм, пневмококков, коронавируса и других возбудителей.
Общим признаком острых пневмоний на КТ является наличие инфильтратов («матовых стекол») разной формы и протяженности. «Матовые стекла» расположены вокруг очагов или диффузно, как при туберкулезе. Однако в отличие от туберкулеза, их размер обычно больше, есть тенденция к консолидации инфильтратов и образованию рисунка по типу «булыжной мостовой». В отдельных случаях визуализируются просветы бронхов, содержащих газ. Это называется синдромом «воздушной бронхографии». В сочетании с эффектом «матового стекла», он также относится к явным признакам пневмонии.
Для пневмонии, вызванной коронавирусом COVID-19, характерно периферическое расположение очагов поражения под плеврой. Наиболее уязвимы билатеральные нижние доли и задние отделы легких. Отмечается тенденция к консолидации «матовых стекол» и утолщению перегородок альвеол, иногда — признаки фиброза легких.
Тяжелым формам коронавирусной пневмонии сопутствует острый респираторный дистресс-синдром. ОРДС — это обширное двухстороннее воспаление, при котором наблюдается множество инфильтратов и отек легких. На томограммах фрагментарные участки «матового стекла» кортикальной формы присутствуют с двух сторон и имеют вид «лоскутного одеяла».
При пневмоцистной пневмонии, вызванной дрожжеподобным грибом Pneumocystis Jirovecii, наблюдается несколько иная картина. Участки уплотнения легких по типу «матового стекла» обычно расположены с двух сторон симметрично (но иногда диффузно и неравномерно). Уплотнения преобладают в прикорневых областях легких, а диффузные изменения — в верхних и нижних отделах. Для пневмоцистной пневмонии, как и для вирусной, ассоциированной с COVID-19, характерны эффект консолидации и симптом «лоскутного одеяла», но на томограммах легких видны и другие признаки: воздушные кисты, пневмоторакс.
Отдельную группу заболеваний представляют идиопатические интерстициальные пневмонии, причину которых не удается установить. Помимо «матового стекла» на сканах КТ легких можно обнаружить симптом «сотового легкого», бронхоэктазы, ретикулярные изменения. Идиопатические пневмонии требуют гистологического обследования.
На основании данных компьютерной томографии легких и анамнеза пациента врач-рентгенолог сможет определить поражение легких, характерное для пневмонии. В рамках дифференциальной диагностики учитывается плотность и форма «матовых стекол», их количество, в целом оценивается рисунок. Однако определить возбудителя пневмонии и тактику лечения можно после дополнительной лабораторной диагностики.
«Матовое стекло» на КТ при туберкулезе
Очаги инфильтрации по типу «матового стекла» встречаются и при туберкулезе. Его вызывает бактерия Mycobacterium tuberculosis. Считается, что все взрослые люди, достигшие возраста 30 лет, являются носителями микобактерии в «спящем» виде. Когда иммунитет подавлен, бактерии туберкулеза могут активизироваться, и человек заболеет.
При туберкулезе на КТ легких обычно видны множественные мелкие (милиарные) очаги, диссеминированные по легким. Возможна их концентрация в определенной доле. Часто присутствует инфильтрат в форме «дорожки», ведущей к корню легкого. Отмечается увеличение лимфатических узлов. Окончательно отличить туберкулез от пневмонии возможно по результатам ПЦР-диагностики — анализа крови на предмет возбудителя инфекционного воспаления легких.
«Матовое стекло» на КТ при отеке легких
Отёк легких — это осложнение массивного воспаления, сепсиса, токсического отравления. Отек часто возникает как осложнение хронических и острых заболеваний легких, следствие коронарной ишемии, сердечной недостаточности, патологических сбоев в работе других органов и их систем.
При кардиогенном отеке легких наряду с «матовыми стеклами» наблюдается утолщение междолевой плевры, сетчатая деформация легочного рисунка, а контуры корней легких расширенные и нечеткие.
К дополнительным признакам отека легких на КТ относится увеличение диаметра легочных сосудов, расширение камер сердца и жидкость в плевральной полости.
«Матовое стекло» при аденокарциноме (раке) легкого
По эффекту «матового стекла» на КТ легких определяют злокачественные новообразования — рак легких. Аденокарцинома — самый распространенный вид опухоли; существенным «спусковым механизмом» для ее образования является курение, наследственность, возраст (старше 40 лет).
Опухоль аденокарцинома формируется из клеток железистого эпителия. На томограмме представлена единичным обычно небольшим (от 2 мм) участком уплотнения по типу «матового стекла». В отдельных случаях у пациента наблюдается несколько «матовых стекол» диффузного или диффузно-мозаичного типа. Аденокарцинома представлена различными морфологическими подтипами и требует динамического наблюдения.
Не пытайтесь самостоятельно интерпретировать изображения. Выявить «матовые стекла» и дать им дифференцированную оценку может только профильный врач специалист, прошедший обучение и имеющий соответствующий сертификат.
Характер деформации и прогностическая ценность продольной деформации правого желудочка у детей с легочной артериальной гипертензией | Сердечно-сосудистое УЗИ
Айви Д.Д., Абман С.Х., Барст Р.Дж., Бергер Р.М.Ф., Боннет Д., Флеминг Т.Р., Хаворт С.Г., Радж Ю.Ю., Розенцвейг Е.Б., Нейк И.С., Стейнхорн Р.Х., Бегетти М. Детская легочная гипертензия. JACC. 2013; 62 (25, доп.): 117–26.
Артикул Google Scholar
Хаворт С.Г., Хислоп А.А.Лечение и выживаемость у детей с легочной артериальной гипертензией: Служба легочной гипертензии для детей Великобритании, 2001–2006 гг. Сердце. 2009; 95: 312–7.
CAS Статья PubMed Google Scholar
Fraisse A, Jais X, Schleich JM, di Filippo S, Maragnes P, Beghetti M, Gressin V, Voisin M, Dauphin C, Clerson P, Godart F, Bonnet D. Характеристики и перспективы на 2 года план детей с легочной артериальной гипертензией во Франции.Arch Cardiovasc Dis. 2010; 103: 66–74.
Артикул PubMed Google Scholar
Барст Р.Дж., МакГун М.Д., Эллиотт К.Г., Форман А.Дж., Миллер Д.П., Айви Д.Д. Выживаемость при детской легочной артериальной гипертензии: данные реестра для оценки раннего и долгосрочного ведения болезни легочной артериальной гипертензии. Тираж. 2012; 125: 113–22.
Артикул PubMed Google Scholar
van Loon RL, Roofthooft MT, Hillege HL, ten Harkel AD, van Osch-Gevers M, Delhaas T, Kapusta L, Strengers JLM, Rammeloo L, Clur SAB, Mulder BJM, Berger RMF. Детская легочная гипертензия в Нидерландах: эпидемиология и характеристика в период с 1991 по 2005 гг. Циркуляция. 2011; 124: 1755–64.
Артикул PubMed Google Scholar
Ван Лун Р.Л., Рофтхоофт М.Т., Дельхаас Т., ван Ош-Геверс М., тен Харкель А.Д., Стренджерс JLM, Бэккс А, Хиллеге Х.Л., Бергер РМ.Исход педиатрических больных с легочной артериальной гипертензией в эпоху новых медицинских методов лечения. Am J Cardiol. 2010; 106: 117–24.
Артикул PubMed Google Scholar
Бернус А., Вагнер Б.Д., Аккурсо Ф., Доран А., Каесс Х., Айви Д.Д. Уровни мозгового натрийуретического пептида в ведении педиатрических пациентов с легочной артериальной гипертензией. Грудь. 2009. 135: 745–51.
CAS Статья PubMed Google Scholar
Ламмерс А.Е., Хислоп А.А., Хаворт С.Г. Прогностическое значение натрийуретического пептида B-типа у детей с легочной гипертензией. Int J Cardiol. 2009. 135: 21–6.
Артикул PubMed Google Scholar
Ghio S, Klersy C, Magrini G, D’Armini AM, Scelsi L, Raineri C, Pasotti M, Serio A, Campana C, Vigano M. Прогностическая значимость эхокардиографической оценки функции правого желудочка у пациентов при идиопатической легочной артериальной гипертензии.Int J Cardiol. 2010; 140: 272–8.
Артикул PubMed Google Scholar
Д’Алонзо Г.Е., Барст Р.Дж., Эйрес С.М., Бергофски Э.Х., Брандаж Б.Х., Детре К.М., Фишман А.П., Голдринг Р.М., Гровс Б.М., Кернис Дж.Т., Леви П.С., Пьетра Г.Г., Рид Л.М., Ривз Д.Т., Rich S, Vreim CE, Williams GW, Wu M. Выживаемость пациентов с первичной легочной гипертензией. Результаты национального проспективного реестра. Ann Intern Med. 1991; 115: 343–349.
Артикул PubMed Google Scholar
Kassem E, Humpl T, Friedberg MK. Прогностическая значимость 2-мерного, М-режима и допплеровского эхо-показателей функции правого желудочка у детей с легочной артериальной гипертензией. Am Heart J. 2013; 165: 1024–31.
Артикул PubMed Google Scholar
Tei C. Новый неинвазивный индекс для комбинированной систолической и диастолической функции желудочков. J Cardiol. 1995. 26 (2): 135–6.
CAS PubMed Google Scholar
Lopez L, Colan SD, Frommelt PC, Ensing GJ, Kendall K, Younoszai AK, Lai WW, Geva T. Рекомендации по методам количественной оценки во время выполнения детской эхокардиограммы: отчет группы по разработке педиатрических измерений Американского общества Совет по педиатрии и врожденным порокам сердца по эхокардиографии. J Am Soc Echocardiogr. 2010; 23: 465–95.
Артикул PubMed Google Scholar
Кестенбергер М., Фридберг М.К., Равекес В., Нестаас Э., Хансманн Г.Неинвазивная визуализация при врожденных пороках сердца: инновации в трансторакальной эхокардиографии. J Clin Exp Cardiolog. 2012; Дополнение 8: 002.
PubMed Central Google Scholar
Koestenberger M, Ravekes W, Everett A, Stueger HP, Heinzl B, Gamillscheg A, Cvirn G, Boysen A, Fandl A, Nagel B. Функция правого желудочка у младенцев, детей и подростков: контрольные значения систолическая экскурсия в плоскости трехстворчатого кольца (TAPSE) у 640 здоровых пациентов и расчет значений z-score.J Am Soc Echocardiogr. 2009; 22: 715–9.
Артикул PubMed Google Scholar
Koestenberger M, Nagel B, Ravekes W, Avian A, Heinzl B, Cvirn G, Fritsch P, Fandl A, Rehak T., Gamillscheq A. Контрольные значения пиковой систолической скорости трикуспидального кольца у здоровых педиатрических пациентов. расчет значений z-показателя и сравнение с систолической экскурсией в плоскости трикуспидального кольца. Am J Cardiol. 2011; 109: 116–21.
Артикул PubMed Google Scholar
Мертенс Л., Фридберг М.К. Визуализация правого желудочка – современное состояние. Nat Rev Cardiol. 2010; 7: 551–63.
Артикул PubMed Google Scholar
Теске А.Дж., Де Бок BWL, Мелман П.Г., Сисверда ГТ, Доевенданс П.А., Крамер М.Дж. Эхокардиографическая количественная оценка функции миокарда с использованием визуализации деформации тканей, руководство по получению и анализу изображений с использованием тканевого допплера и отслеживания спеклов. Кардиоваск Ультразвук.2007; 5: 27.
Артикул PubMed PubMed Central Google Scholar
Meris A, Faletra F, Conca C, Klersy C, Regoli F, Klimusina J, Penco M, Pasotti E, Pedrazzini GB, Moccetti T, Auricchio A. Время и величина регионарной желудочковой функции: отслеживание спеклов –Исследование производной деформации здоровых людей и пациентов с дисфункцией правого желудочка. J Am Soc Echocardiogr. 2010. 23 (8): 823–31.
Артикул PubMed Google Scholar
Dragulescu A, Mertens LL. Развитие эхокардиографических методов оценки функции желудочков у детей. Arch Cardiovasc Dis. 2010; 103: 603–14.
Артикул PubMed Google Scholar
Окумура К., Хумпл Т., Драгулеску А., Мертенс Л., Фридберг М.К. Продольная оценка деформации миокарда правого желудочка в зависимости от выживаемости без трансплантата у детей с идиопатической легочной гипертензией.J Am Soc Echocardiogr. 2014. 27 (12): 1344–51.
Артикул PubMed Google Scholar
Рудски Л.Г., Лай В.В., Афилало Дж., Хуа Л., Хандшумахер, доктор медицины, Чандрасекаран К., Соломон С.Д., Луи Е.К., Шиллер Н.Б. Рекомендации по эхокардиографической оценке правых отделов сердца у взрослых: отчет Американского общества эхокардиографии, одобренный Европейской ассоциацией эхокардиографии, зарегистрированным отделением Европейского общества кардиологов и Канадским обществом эхокардиографии.J Am Soc Echocardiogr. 2010. 23: 685–713.
Артикул PubMed Google Scholar
Роберсон Д.А., Цуй У. Индекс Tei правого желудочка у детей: влияние метода, возраста, площади поверхности тела и частоты сердечных сокращений. J Am Soc Echocardiogr. 2007; 20: 764–70.
Артикул PubMed Google Scholar
Friedberg MK, Silverman NH. Отношение продолжительности систолического к диастолическому у детей с синдромом гипоплазии левых отделов сердца: новый допплеровский индекс функции правого желудочка.J Am Soc Echocardiogr. 2007. 20 (6): 749–55.
Артикул PubMed Google Scholar
Крапо Р.О., Касабури Р., Коутс А.Л., Энрайт П.Л., Макинтайр Н.Р., Маккей Р.Т., Джонсон Д., Вангер Дж.С., Зебаллос Р.Дж. Заявление ATS: рекомендации для теста с шестиминутной ходьбой. Am J Respir Crit Care Med. 2002; 166: 111–9.
Артикул Google Scholar
Rich S, редактор. Резюме Всемирного симпозиума по первичной легочной гипертензии.Франция: Эвиан; 1998.
Google Scholar
Fukuda Y, Tanaka H, Sugiyama D, Ryo K, Onishi T, Fukuya H, Nogami M, Ohno Y, Emoto N, Kawai H, Hirata K. Полезность спекл-трекинга свободной стенки правого желудочка для оценка работы правого желудочка у пациентов с легочной гипертензией. ДЖЕЙС. 2011; 24 (10): 1101–8.
Google Scholar
Драгулеску А., Гроссе-Вортманн Л., Редингтон А., Фридберг М.К., Мертенс Л.Дифференциальное влияние дилатации правого желудочка на деформацию миокарда у пациентов с дефектами межпредсердной перегородки и пациентов после тетралогии пластики Фалло. Int J Cardiol. 2012; 168: 803–10.
Артикул PubMed Google Scholar
Леви П.Т., Мейя ААС, Мачефски А., Фаулер С., Голландия М.Р., Сингх Г.К. Нормальные диапазоны измерений систолического и диастолического напряжения правого желудочка у детей: систематический обзор и метаанализ.ДЖЕЙС. 2014. 27 (5): 549–60. e3.
Google Scholar
Негиши К., Лукас С., Негиши Т., Гамильтон Дж., Марвик TH. Что является основным источником разногласий в измерении деформации между поставщиками: визуализация или анализ? Ультразвук Med Biol. 2013; 39: 714–20.
Артикул PubMed Google Scholar
Саймон М.А., Раджагопалан Н., Матье М.А., Шрофф С.Г., Пинский М.Р., Лопес-Кандалес А.Тканевая допплерография декомпенсации правого желудочка при легочной гипертензии. Застойная сердечная недостаточность. 2009. 15: 271–6.
Артикул PubMed PubMed Central Google Scholar
Пелусо Д., Тона Ф, Мурару Д., Ромео Дж., Куккини Ю., Марра М. П., Иличо С., Бадано ЛП. Обзор геометрии и функции правого желудочка при легочной гипертензии: неинвазивная оценка. Болезни. 2014; 2: 274-95. DOI: 10.3390 / болезни2030274.
Ферфериева В., Ван ден Берг А., Клаус П., Ясайтите Р., Веулеманс П., Пелленс М., Ла Герче А., Радемакерс Ф., Хериджерс П., Д’Хуг Дж. Относительное значение деформации и скорости деформации для внутренней функции миокарда. Am J Physiol Heart Circ Physiol. 2012; 302 (1): h288–95. DOI: 10.1152 / ajpheart.00429.2011.
CAS Статья PubMed Google Scholar
Edvardsen T, Skulstad H, Aakhus S, Urheim S, Ihlen H. Региональная систолическая функция миокарда во время острой ишемии миокарда, оцененная с помощью тензометрической допплер-эхокардиографии.J Am Coll Cardiol. 2001. 37 (3): 726–30.
CAS Статья PubMed Google Scholar
Ho SH, Nihoyannopoulos P. Анатомия, эхокардиография и нормальные размеры правого желудочка. Сердце. 2006; 92 (Suppl1): i2–13.
Артикул PubMed PubMed Central Google Scholar
Рашмер Р.Ф., Кристал Д.К., Вагнер К. Функциональная анатомия сокращения желудочков.Circ Res. 1953; 1: 162–70.
CAS Статья PubMed Google Scholar
Vitarelli A, Conde Y, Cimino E, Stellato S, D’Orazio S, D’Angeli I, Nguyen BL, Padella V, Caranci F, Petroianni A, D’Antoni L, Terzano C. функция правого желудочка по данным деформации при хронической обструктивной болезни легких. Eur Respir J. 2006; 27: 268–75.
CAS Статья PubMed Google Scholar
Brili S, Stamatopoulos I, Misailidou M, Chrysohoou C, Tousoulis D, Tatsis I, Stefanidis C. Кривые продольной деформации свободной стенки правого желудочка отличаются по морфологии у пациентов с легочной артериальной гипертензией по сравнению с контрольной группой. Int J Cardiol. 2013. 167: 2753–6.
Артикул PubMed Google Scholar
Mauritz GJ, Kind T, Marcus JT, Bogaard HJ, van de Veerdonk M, Postmus PE, Boonstra A, Westerhof N, Vonk-Noordegraaf A.Прогрессивные изменения в геометрическом укорочении правого желудочка и долгосрочное выживание при легочной артериальной гипертензии. Грудь. 2012; 141: 935–43.
Артикул PubMed Google Scholar
Haeck MLA, Scherptong RWC, Marsan NA, Holman ER, Schalij MJ, Bax JJ, Vliegen HW, Delgado V. Прогностическое значение продольной пиковой систолической деформации правого желудочка у пациентов с легочной гипертензией. Circ Cardiovasc Imaging. 2012; 5: 628–36.
Артикул PubMed Google Scholar
Fine NM, Chen L, Bastiansen PM, Frantz RP, Pellikka PA, Oh JK, Kane GC. Прогноз исхода путем количественной оценки функции правого желудочка у 575 пациентов с легочной гипертензией. Circ Cardiovasc Imaging. 2013. 6 (5): 711–21.
Артикул PubMed Google Scholar
Шехата М.Л., Харуни А.А., Скрок Дж., Баша Т.А., Бойс Д., Лехтзин Н., Матхай С.К., Гиргис Р., Осман Н.Ф., Лима Дж.А.Региональная и глобальная бивентрикулярная функция при легочной артериальной гипертензии: исследование МРТ сердца. Радиология. 2013; 266: 1. http://pubs.rsna.org/doi/abs/10.1148/radiol.12111599.
Артикул Google Scholar
Коринек Дж., Ван Дж., Сенгупта П.П., Миядзаки К., Кьяргард Дж., МакМахон Э., Абрахам Т.П., Белохлавек М. Двумерная деформация – независимый от допплера ультразвуковой метод для количественной оценки регионарной деформации: проверка in vitro и in vivo.J Am Soc Echocardiogr. 2005; 18: 1247–53.
Артикул PubMed Google Scholar
Амундсен Б. Х., Хелле-Валле Т., Эдвардсен Т., Торп Х., Кросби Дж., Лизегген Э, Стойлен А., Ихлен Х., Лима Дж. А., Смисет О. А., Слордал С.А. Неинвазивное измерение деформации миокарда с помощью эхокардиографии с отслеживанием спеклов: проверка на соответствие сономикрометрии и магнитно-резонансной томографии с метками. J Am Coll Cardiol. 2006; 47: 789–93.
Артикул PubMed Google Scholar
Картирование региональной деформации у анестезированных здоровых субъектов во время спонтанной вентиляции
Ключевые сообщения
Региональные динамические биомеханические характеристики легкого стали ключом к пониманию его поведения в отношении здоровья и болезни.
Мы успешно составили карту региональной объемной деформации с расширенным анализом томографических изображений у субъектов с неповрежденными легкими и спонтанным дыханием.
В этих условиях, близких к физиологическим, мы обнаружили сильно гетерогенную паренхиму легких, которую невозможно обнаружить стандартными методами.
Кроме того, мы оценили региональную объемную деформацию легких в двух временных точках, предложив индекс гетерогенности деформации и индекс прогрессии деформации для стандартизации отчета о региональной деформации.
Предпосылки
Легкое можно описать как предварительно напряженную сеть вязкоупругих тканевых элементов, деформированных поверхностным натяжением. Эта характеристика позволяет ткани деформироваться в зависимости от времени в зависимости от приложенного давления и возвращаться к своей исходной конфигурации после того, как давление снижается.1 Дыхание вызывает явление непрерывной циклической деформации с каждым вдохом на протяжении всей жизни, где приложенное давление является давлением на вдохе. . С точки зрения биомеханики, деформация легких, связанная с приливной инфляцией, измеряется как деформация.Напряжение всего легкого (общая деформация) можно определить как соотношение между дыхательным объемом (V T ) и контрольным объемом, обычно объемом в конце пассивного выдоха, который известен как функциональная остаточная емкость (FRC). ). Важно отметить, что стресс в легких – это сила, развиваемая на структуру легких (единицу поверхности) из-за транспульмонального давления. Одной из уникальных характеристик легочной ткани является то, что в своем физиологическом состоянии ткань не подвергается стрессу, поскольку поддерживается транспульмональным давлением даже в конце выдоха.2 3 Транспульмональное давление и воздушные отсеки легкого неоднородны, поэтому сила (напряжение), прилагаемое к легкому, неоднородна. В этих условиях региональная деформация легкого, вероятно, неоднородна, но большинство современных методов позволяют только количественно оценить глобальную деформацию.
С математической точки зрения региональная деформация в точке деформируемого тела определяется из производных поля смещения, которое деформирует тело, то есть функции, которая сопоставляет точки в эталонной конфигурации с их соответствующими местоположениями в деформированной конфигурации.Для описания поля смещения недавно были разработаны методы регистрации деформируемых изображений, которые успешно применялись при описании движения легкого4. Карты региональной деформации, полученные при регистрации изображений, в последнее время стали признаваться в качестве инструмента в изучении патофизиологии легких. Одним из преимуществ этих методов является их неинвазивный характер, который позволяет изучать несколько временных точек и несколько дыхательных циклов всего легкого.
Недавно был введен трехмерный (3D) биомеханический анализ, основанный на методах конечных элементов, для количественной оценки региональной деформации легких по КТ-изображениям.5 6 Используя этот метод, наша группа количественно определила региональную деформацию у 11 здоровых людей во время одного полного вдоха (общая емкость легких) в положении лежа на спине, обнаружив значительное влияние силы тяжести на объемную региональную деформацию 6. с клинической точки зрения, потому что стратегии по снижению супрафизиологических уровней глобальной приливной деформации легких, то есть низкий V, ограничение управляющего давления, среди прочего, связаны с лучшими клиническими исходами у пациентов с повреждением легких и без него.7–10 Региональная деформация легких изучалась методом конечных элементов у пациентов со здоровыми и остро поврежденными легкими. Общим для этих исследований является то, что измерения проводились в течение одного дыхательного цикла и контролируемой вентиляции, будь то при механической вентиляции или добровольном полном вдохе.5–7 11 Региональная деформация и неоднородность являются ключевыми концепциями для изучения биомеханических характеристик легких при многих заболеваниях.12 –14 Измерение региональной деформации и изменений неоднородности с течением времени во время приливной вентиляции имеет решающее значение для понимания механобиологии легких в физиологических условиях.14–17
Помня об этом, мы разработали это экспериментальное исследование для создания трехмерных карт региональной деформации и неоднородности легких здоровых крыс при спонтанном дыхании. Кроме того, мы хотели оценить, можно ли количественно оценить изменения региональной объемной деформации легких с течением времени.
Методы
Анестезия и мониторинг животных
В этом исследовании использовали шесть взрослых крыс Sprague-Dawley. В нашем исследовательском центре на животных перед экспериментом крыс содержали в среде с регулируемой влажностью, освещением и температурой.Еда и вода предоставлялись без ограничений.
После индукции ингаляционного анестетика 2% изофлураном (Aesica Queenborough, Великобритания) была введена внутрибрюшинная инъекция кетамина (30 мг / кг, Drag Pharma Invetec) плюс ксилазин (5 мг / кг, Alfasan, Woerden-Holland). Во время получения изображения использовался ингаляционный изофлуран (1,5%). Адекватный уровень анестезии был введен и контролировался с помощью двигательной активности и оценки анестезии грызунов.18 Субъекты выздоровели и были помещены в свои боксы.Перед вторым этапом получения изображения была проведена внутрибрюшинная инъекция кетамина плюс ксилазин. Доля вдыхаемого кислорода (FiO 2 ) поддерживалась на уровне 100% на этапе наблюдения.
Ректальную температуру, показания ЭКГ, частоту дыхания и уровни насыщения кислородом контролировали с помощью системы физиологического мониторинга мелких животных (Холлистон, Массачусетс, США). Температуру тела поддерживали с помощью внешнего обогревателя. Комнатную температуру поддерживали на уровне 25 ° C.
Получение изображения
Микро-КТ (µ-КТ) изображения были получены от субъектов в положении лежа после 10 минут клинической стабильности (T0). Субъекты были помещены в положение лежа для восстановления и наблюдались в течение 3 часов. Этот период был запланирован с учетом известных зависящих от времени последствий анестезии для физиологии дыхательной системы, то есть ателектаза, паттернов дыхания и объема легких19. 20 После периода наблюдения было выполнено второе сканирование µ-CT (T3).
µ-CT изображений получали с использованием коммерческого µ-CT сканера SkyScan 1278 in vivo (Bruker microCT, Kontich, Бельгия).В эту систему интегрировано устройство физиологического мониторинга, которое включает в себя дыхательные движения и возможности четырехмерной микротомографии с временным разрешением. Методы динамического сканирования, используемые для протокола четырехмерного сканирования µ-CT со свободным дыханием, демонстрируют внутреннюю проблему артефактов движения. Мы использовали респираторный метод временного стробирования, чтобы уменьшить эти артефакты. Регистрировали движение грудной клетки животных и отслеживали их дыхание, чтобы применить эту процедуру.На этих записях были установлены пороги стробирования. Сканы были получены при напряжении источника 70 кВ и токе 140 мкА. Разрешение было установлено на 50 мкм. Ретроспективно синхронизированное сканирование в «режиме списка» было выполнено со временем экспозиции 40 мс, поворотом сканирования на 360 ° и шагом 0,75 °. За один шаг было получено двадцать пять изображений для последующей сортировки по фазам дыхательного цикла. Время всех записанных на видео максимумов дыхательных движений вдоха и время получения всех проекционных изображений записывались во время сканирования в текстовые файлы с точностью ± 1 мс для облегчения сортировки в режиме списка.Далее обрабатывались стробированные и объединенные в интервалы изображения в конце выдоха и в конце вдоха вокруг приливного дыхания. Цепочка дыхательных волн отображалась в реальном времени, а в конце процесса сканирования данные экспортировались для дальнейшего использования. Вся процедура сканирования заняла около 16 мин. Затем изображения µ-CT были подвергнуты постобработке с применением специальных фильтров изображения для увеличения отношения сигнал / шум и усиления контраста. Процессы реконструкции изображений, сортировки по времени и постобработки изображений были выполнены с использованием программного обеспечения, предоставленного Bruker (NRecon, Tsort, DataViewer и CTAn).Впоследствии сегментирование легких было выполнено с использованием контурно-активного метода, реализованного в программном обеспечении ITK-Snap, 21, в котором семена вручную высаживаются внутри домена легкого. Эти семена начинают итеративно расти в секторах с низкими градиентами шкалы серого, пока не достигнут краев, где градиент значительно увеличивается. Окончательные результаты сегментации изображения всегда проверялись клиническими экспертами, чтобы гарантировать анатомически правильные структуры.
Сегментированные изображения использовались для расчета параметров вентиляции.Полученные маски позволили вычислить объем легких в конце вдоха (EILV) и объем легких в конце выдоха (EELV). Предполагалось, что FRC равняется EELV, и V T во время спонтанной вентиляции был определен как V T = EILV − EELV. Общая деформация была рассчитана как V T / FRC, а минутная вентиляция была определена как V мин = RR × V T .
В конце исследования животных умерщвляли путем внутривенного введения летальной дозы тиопентала (50 мг / кг, Richmond Laboratories, Буэнос-Айрес, Аргентина).
Биомеханический анализ и региональные карты объемной деформации
Биомеханический анализ на основе изображений был выполнен, как описано ранее.5 6 В основном, тетраэдрические сетки конечных элементов использовались в сегментированных масках легких (слева и справа), процесс создания сетки был выполнялась с использованием библиотеки алгоритмов вычислительной геометрии.22 Затем модели конечных элементов были подвергнуты вариационному методу восстановления деформации, который используется для получения непрерывной аппроксимации поля тензора градиента деформации, из которого региональная объемная деформация и основная Коэффициенты растяжения рассчитываются для получения и визуализации трехмерных карт объемной деформации по результатам сканирования μ-CT на вдохе и выдохе.
Процедура регистрации изображения была выполнена с использованием пакета NiftyReg, 23, который генерирует непрерывное отображение для каждой точки легкого на выдохе в ее соответствующее место на изображении вдоха. Этот пакет находит оптимальное преобразование между этими двумя наборами изображений μ-CT, минимизируя функцию стоимости, которая включает меры сходства и эластичную регуляризацию (используется для обеспечения гладкости преобразования). Дополнительный онлайн-файл показывает видео последовательных шагов, выполняемых для получения трехмерных региональных карт деформации легких.Эти процедуры позволяют нам создать карту региональной объемной деформации от выдоха до стадии вдоха, которая указывает на локальную деформацию паренхимы. Мы разделили каждый домен легкого на 10 изоволюметрических областей интереса (ROI), чтобы сравнить картину пространственного распределения региональной деформации в трех направлениях: от вершины к основанию (AB), от дорсальной к вентральной (DV) и от реберной к средостенной (CM) направлениям (рисунок 1). Средневзвешенное значение и SD значения региональной объемной деформации вычисляются для каждой области интереса, где выборка включает тетраэдры, содержащиеся в каждой области интереса, и взвешивание выполняется в соответствии с объемом каждого тетраэдра.Временная эволюция региональной объемной деформации в каждой области интереса была изучена с помощью индекса прогрессии региональной деформации (SPI), определенного в формуле (i):
Рисунок 1Трехмерный эскиз осей, по которым измерялась региональная объемная деформация. с методом конечных элементов: апикально к основанию, дорсально к вентральному и реберно к средостению.
(i) SPI = ROI (x) – средняя деформация в T3 / ROI (x) – средняя деформация в T0.
SPI = 1 означает отсутствие изменений, SPI> 1 относится к прогрессированию, а SPI <1 означает снижение региональной нагрузки с течением времени.
Чтобы оценить дисперсию региональной деформации в ROI, мы определили индекс неоднородности деформации (SHI), который соответствует коэффициенту вариации распределения деформации ROI, выраженному в единицах изменения объема. SHI выражается формулой (ii):
(ii) SHI ROI (x) = [1 + SD ROI для штамма (x)] / [1 + средняя ROI для штамма (x)].
Статистический анализ
Данные выражены как среднее значение ± стандартная ошибка среднего. Для сравнения физиологических респираторных данных в начале и в конце эксперимента мы использовали знаковый ранговый критерий Вилкоксона.Дисперсионный анализ был использован для анализа распределения изоволюметрических ROI вдоль анализируемых осей (внутригрупповые). Для статистического анализа использовали программный пакет IBM SPSS (V.20.0; SPSS, Чикаго, Иллинойс, США) и GraphPad Prism V.5.0 (GraphPad Software, Ла-Хойя, Калифорния, США). Значимость была установлена на уровне p <0,05.
Результаты
Средний вес испытуемых составил 285 ± 8 г. Все животные выполнили экспериментальный протокол.
Физиологические измерения
Во время первой серии измерений V T и V мин были близки к физиологическим значениям.После периода наблюдения мы наблюдали значительное снижение V T и V мин в T3 по сравнению с T0, без значительных изменений FRC и общей деформации. В таблице 1 показаны респираторные переменные и общие рассчитанные параметры из анализа μ-CT в T0 и T3.
Таблица 1Физиологические респираторные данные в начале (T0) и в конце исследования (T3)
Региональное распределение деформации
При анализе 3-осевого регионального распределения деформации легких мы наблюдали значительный градиент региональной деформации легких. по направлению AB в точке T0.Три верхних ROI на этой оси имели меньшую региональную деформацию, чем среднее значение. Напротив, две базальные области интереса имели более высокую региональную деформацию по сравнению со средним значением. Эти различия исчезают на Т3. Распределение региональной деформации легких в точках T0 и T3 с использованием подразделений областей интереса AB, DV и CM показано на рисунке 2.
Рисунок 2Региональная деформация изоволюметрических областей интереса (ROI) в точках T0 и T3 вдоль вершины к основанию (A), дорсально к вентральной (B) и реберной к медиастинальной (C) осям. Данные показаны как среднее и SE.Пунктирная красная линия показывает среднее значение 10 изоволюметрических областей интереса вдоль оси.
Развитие региональной деформации
Распределение региональных значений SPI вдоль направлений AB, DV и CM показано на рисунке 3. Мы наблюдали значительное снижение региональной деформации в 5 из 10 областей интереса в направлении AB, в 4 из 10 в вентрально-дорсальном направлении и 6 из 10 по оси CM.
Рисунок 3Индекс прогрессии региональной деформации изоволюметрических областей интереса (ROI) в точках T0 и T3 вдоль вершины к основанию (A), от дорсальной к вентральной (B) и от реберной к средостенной (C) осям.Данные показаны как среднее и SE. Пунктирная красная линия показывает среднее значение 10 изоволюметрических областей интереса вдоль оси.
Неоднородность деформации
Значения SHI вдоль направлений AB, DV и CM представлены на рисунке 4 в точках T0 и T3. Неоднородность была частой, от 30% до 40% в большинстве проанализированных областей интереса, но мы не обнаружили определенной закономерности на исследованных осях.
Рисунок 4Индекс региональной неоднородности деформации изоволюметрических областей интереса (ROI) в точках T0 и T3 вдоль вершины к основанию (A), от дорсальной к вентральной (B) и от реберной к средостенной (C) осям.Данные показаны как среднее и SE. Пунктирная красная линия показывает среднее значение 10 изоволюметрических областей интереса вдоль оси.
Обсуждение
В этом исследовании мы успешно построили трехмерные региональные карты деформации и неоднородности легких анестезированных здоровых крыс во время спонтанного дыхания в двух временных точках. Это актуально, потому что метод конечных элементов позволил нам выявить изменения в регионарной механобиологии легких при отсутствии первичного повреждения легких в условиях, близких к физиологическим.Даже в этих условиях метод конечных элементов является чувствительным инструментом для выявления региональных явлений во всем легком, подтверждая его как прорывный метод изучения региональных явлений легких во многих экспериментальных сценариях. 4–6 11 12 14
В нашем эксперименте мы обнаружил региональный градиент деформации в направлении AB в начале периода наблюдения при анализе распределения объемной деформации по этой оси. Регионарная деформация в верхушке была ниже, а в основании выше по сравнению со средним значением.Этот градиент исчез в конце периода наблюдения, когда V t был ниже по сравнению с началом. В большинстве областей интереса наблюдалось снижение деформации области, даже когда измерения общей деформации и FRC не имели значительных изменений. Кроме того, выявлена неоднородность деформации легких без первичного повреждения. Важно подчеркнуть, что это горячая тема респираторной физиологии и патофизиологии, поскольку изначально считалось, что гетерогенность деформации легких возникает только во время болезни.Эти региональные различия невозможно измерить физиологическими или стандартными методами компьютерной томографии.
Ожидалось, что в этой экспериментальной модели со временем произойдут изменения параметров дыхательной системы. Мы не вызывали первичного повреждения легких, но анестезирующие препараты, такие как кетамин, ксилазин и изофлуран, вызывают гиповентиляцию, в частности, снижение V t .24–28 Наблюдаемые вариации в регионарной деформации в течение периода наблюдения можно объяснить тем, что этот механизм, даже если FRC не изменился.Другой механизм, который может вызвать изменения в дыхательной системе, – это FiO 2 , который был установлен на уровне 100%. Это может вызвать зависящий от времени абсорбционный ателектаз, который может привести к ателектравме, одному из основных факторов напряжения сдвига из-за циклического раскрытия и схлопывания альвеол.24 29 В целом, эти эффекты анестезии с течением времени позволили нам провести два измерения и сравнить их различия, подтверждая неинвазивный характер этой техники. Чтобы количественно оценить временную эволюцию регионарной деформации в легком, мы ввели понятие регионального SPI.Региональная деформация не улучшилась в нашем исследовании, так как значения SPI во всех ROI не были значительно> 1. Для количественной оценки этой неоднородности мы предлагаем концепцию регионального SHI, которая позволяет нам охарактеризовать неоднородности региональных деформаций в легком. Мы обнаружили, что региональная неоднородность деформации составляла от 30% до 40% в большинстве областей интереса по трем анализируемым осям и в двух исследованных временных точках. Это открытие имеет особое значение для трансляции, поскольку гетерогенность легких, измеряемая с точки зрения региональных различий в аэрации тканей, связана с повышением уровня стресса и смертностью пациентов.15 Важно отметить, что региональный стресс связан с региональным напряжением посредством определяющих соотношений (региональная эластичность), и, поскольку региональное напряжение может быть непосредственно оценено с помощью биомеханического анализа на основе изображений, оно может оказаться лучшим предиктором регионального стресса. .30
Наши результаты могут иметь важное трансляционное влияние на понимание региональной деформации легких с точки зрения, которая варьируется от описания продвинутых биомеханических механизмов повреждения легких до клинических последствий для улучшения терапевтических стратегий (например, неинвазивная вентиляция и высокий поток носовые канюли поддерживают дыхательную недостаточность), что может улучшить результаты.
Интерес к региональному штамму растет, но на данный момент клинические и экспериментальные данные для его количественной оценки очень ограничены. Наиболее изученным методом является электроимпедансная томография (ЭИТ). EIT имеет множество клинических преимуществ, но информация, собранная с помощью этого метода, является частичной, учитывая оценку одного сегмента легких (ROI) по одной оси (DV). Кроме того, паренхима легких, анализируемая в конце выдоха, не совпадает с областью, оцениваемой в конце вдоха, из-за каудального движения легких, вызванного экскурсией мышцы диафрагмы.31 Измерение объемной регионарной деформации легких методом конечных элементов позволяет преодолеть многие из этих ограничений, но это относительно новый метод, который все еще находится в стадии разработки. Тем не менее, мы думаем, что эти результаты также могут быть использованы в будущих исследованиях для отчета о стандартизированной региональной деформации легких, включая изоволюметрический анализ ROI, по крайней мере, по двум осям, а также SHI и прогрессирование во времени (SPI).
Наша работа имеет определенные ограничения, которые необходимо улучшить в будущих экспериментах.Региональная объемная деформация легких – это новая область исследований, поэтому золотой стандарт для количественной оценки и описания еще не установлен. Это не позволяет нам сравнивать наши результаты с другими методами. Учитывая помехи, создаваемые металлическими артефактами во время получения изображений µ-CT, животных нельзя было контролировать с помощью специальных инструментов, таких как EIT или давление в пищеводе. Как уже отмечалось ранее, метод конечных элементов в этой области все еще находится в стадии разработки, поэтому для получения изображений в настоящее время требуются высокие уровни излучения.Кроме того, существует задержка между получением изображений и созданием карт деформации. Также эти ограничения препятствуют его клиническому использованию. Однако дальнейшие разработки этого метода, вероятно, позволят идентифицировать явления региональной деформации с использованием протоколов с низким уровнем излучения и автоматизированного анализа для создания этих изображений в реальном времени, что откроет поле для многих клинических условий. Несмотря на эти ограничения, мы подчеркиваем новаторский характер этой работы в количественной оценке временных изменений регионарной деформации по КТ-изображениям у анестезированных здоровых субъектов во время спонтанного дыхания.
В заключение, можно составить карту региональной деформации легких и количественно оценить неоднородность и изменения во времени у здоровых субъектов во время спонтанного дыхания. Здоровые легкие могут иметь значительную региональную деформацию легких, и эта деформация неоднородна. Расширенный анализ КТ-изображений, подобный представленному в этом исследовании, поможет понять механобиологию легких при многих заболеваниях. В будущем этот метод может помочь оценить эффект терапевтических вмешательств, таких как фармакологическое лечение и респираторная поддержка (например, назальные канюли с высоким потоком и механическая вентиляция).
Благодарности
Авторы хотели бы поблагодарить Plataforma Experimental Bio-CT, факультет стоматологии Чилийского университета (FONDEQUIP EQM150010), за выполнение анализа µ-CT.
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера на прием файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку “Назад” и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
границ | Количественная оценка региональной деформации легких с помощью четырехмерной компьютерной томографии: сравнение традиционной и колебательной вентиляции
Введение
Повреждение легких, вызванное вентилятором (VILI), может непреднамеренно произойти у тяжелобольных пациентов, получающих искусственную вентиляцию легких, из-за вредных нагрузок и напряжений, связанных с потоками газа, движущимися под положительным давлением (Slutsky and Ranieri, 2013).Пациенты с поврежденными, воспаленными и / или отечными легкими, например с острым респираторным дистресс-синдромом (ОРДС), особенно подвержены риску ВИЛИ из-за повышенной гетерогенности вентиляции (Carrasco Loza et al., 2015). Поддержание нормального уровня артериального кислорода и напряжения углекислого газа у пациентов с ОРДС может быть чрезвычайно трудным при использовании традиционной механической вентиляции (CMV), поскольку увеличение дыхательного объема или управляющего давления для компенсации дефицита газообмена может быть вредным для механически перегруженных легких. (Сеть по синдрому острого респираторного дистресс-синдрома, 2000; Amato et al., 2015; Gattinoni et al., 2016a). Цель вентиляции с защитой легких – обеспечить жизненно необходимый газообмен, не усугубляя существующее повреждение уязвимых паренхиматозных тканей.
В некоторых случаях высокочастотная осцилляторная вентиляция (HFOV) была предложена в качестве спасательного лечения рефрактерной гипоксемии при ОРДС, учитывая ее теоретически идеальные свойства для защиты легких: небольшие дыхательные объемы, которые снижают риск травмы от динамического напряжения (т. Е. volutrauma) и высокое среднее давление в дыхательных путях, которое предотвращает циклический набор / прекращение набора (т.э., ателектравма) (Sklar et al., 2017). Несмотря на обширную историю научных и клинических исследований на протяжении нескольких десятилетий, оптимальные стратегии для инициирования и лечения HFOV остаются предметом разногласий (Malhotra and Drazen, 2013; Kneyber and Markhorst, 2016; Nguyen et al., 2016). В настоящее время HFOV может не подходить для многих пациентов с ОРДС по нескольким причинам. Во-первых, использование высокого среднего давления в дыхательных путях может привести к нарушению гемодинамики из-за нарушения венозного возврата и низкого сердечного выброса (Meade et al., 2017). Кроме того, высокая скорость деформации в тканях легких во время HFOV также может способствовать развитию VILI за счет увеличения механической мощности, рассеиваемой через паренхиму (Gattinoni et al., 2016b; Protti et al., 2016; Herrmann et al., 2019b). Наконец, высокочастотные колебательные потоки распределяются неоднородным и частотно-зависимым образом, предрасполагая области с избыточной вентиляцией к избыточному механическому напряжению, а области с недостаточной вентиляцией – к прекращению рекрутирования и ателектазу (Amini and Kaczka, 2013; Herrmann et al., 2016).
Таким образом, многочастотная колебательная вентиляция (MFOV) также была предложена в качестве альтернативного метода для защитной вентиляции легких путем одновременной подачи нескольких частот колебательного потока и давления (Kaczka et al., 2015; Herrmann et al., 2019b). Было показано, что MFOV улучшает газообмен и механическую функцию по сравнению с традиционными «одночастотными» HFOV (Kaczka et al., 2015; Herrmann et al., 2018). Его постулируемый механизм положительного эффекта основан на частотной зависимости распределения вентиляции и транспортировки газа при обычных и колебательных режимах вентиляции (Herrmann et al., 2018), которые можно использовать, используя формы волны потока с повышенным содержанием гармоник. Учитывая такую частотную зависимость потока газа через дерево дыхательных путей, механически несопоставимые области поврежденного легкого могут, таким образом, выборочно отфильтровывать «менее желательные» частотные компоненты широкополосной колебательной формы волны, подаваемой в отверстие дыхательных путей. Соответствующая гомогенизация внутрилегочного переноса газа с помощью MFOV может затем способствовать усиленному газообмену и одновременно более равномерно распределять механическую нагрузку на вентиляцию легких по всему легкому.Тем не менее, конкретных экспериментальных доказательств в поддержку такого механизма нет, и еще предстоит выяснить, улучшает ли MFOV региональное распределение паренхиматозной деформации в легком по сравнению с CMV или традиционным HFOV.
Цель этого исследования состояла в том, чтобы охарактеризовать распределение регионарной приливной деформации легких при обычном и колебательном режимах вентиляции у свиней в исходных условиях и после острого повреждения легких олеиновой кислотой. Мы предположили, что такие вариации будут менее неоднородными во время MFOV, по сравнению с CMV или традиционным одночастотным HFOV.В частности, мы количественно оценили внутриприливные вариации в динамической региональной аэрации легких, объемной деформации и скорости объемной деформации во время CMV, HFOV и MFOV, используя частотно-избирательную четырехмерную компьютерно-томографическую реконструкцию изображения (4DCT) (Herrmann et al., 2017) и регистрацию. (Чжао и др., 2016).
Материалы и методы
Препараты для животных
Все экспериментальные процедуры были одобрены Комитетом Института по уходу и использованию животных Университета Айовы (номер протокола 5061428).В этом исследовании использовались десять здоровых свиней весом от 9 до 13 кг. После внутримышечной инъекции 2,2 мг кг -1 телазола, 1,1 мг кг -1 кетамина и 1,1 мг кг -1 ксилазина, общая анестезия вызывалась во время спонтанного дыхания с помощью ингаляционного изофлурана, доставляемого через нос. Каждую свинью затем интубировали эндотрахеальной трубкой с манжетами (внутренний диаметр 4,5–5,5 мм) и искусственно вентилировали (Uni-Vent Eagle Model 754, ZOLL Medical Corporation, Chelmsford, MA).Капнография, периферическая сатурация кислорода ( S p O 2 ) и кривые электрокардиограммы были получены с использованием монитора пациента Philips, оснащенного измерительным модулем M3001A (Philips Healthcare, Andover, MA). Хирургический разрез шеи был выполнен для канюляции внутренней яремной вены и сонной артерии, а также для перемещения эндотрахеальной трубки в разрез трахеи чуть ниже гортани. Эндотрахеальные трубки укорачивались вручную (до конечной длины 12–15 см в зависимости от диаметра трубки) перед трахеостомией, чтобы уменьшить мертвое пространство аппарата.Анестезия поддерживалась внутривенной инфузией пропофола (7–9 мг / кг -1 ч -1 ), а мышечное расслабление достигалось с помощью периодических внутривенных болюсов рокурония (1-2 мг / кг -1 ) или панкуроний (0,01–0,15 мг / кг –1 ).
Повреждение легкого было вызвано медленной инфузией 0,08 см 3 кг -1 олеиновой кислоты во внутреннюю яремную вену в течение 15 минут. Для созревания травмы требовалось ~ 90 минут, что подтверждалось отношением артериального давления кислорода к вдыхаемой фракции кислорода ( P a O 2 : F i O 2 ) <300 мм рт. с 5 см вод. ст. 2 O положительного давления в конце выдоха (ПДКВ).Дополнительная олеиновая кислота (0,04 см 3 кг -1 ) вводилась, если P a O 2 : F i O 2 оставалось> 300 мм рт. При необходимости нормальное системное артериальное кровяное давление (систолическое / диастолическое ≥ 90/60 мм рт. Ст.) Поддерживалось внутривенными растворами кристаллоидов и прерывистыми дозами фенилэфрина (1-2 мкг кг -1 ).
Протокол эксперимента
Все измерения и режимы вентиляции были выполнены в исходных условиях и после повреждения легких.Каждому субъекту была проведена механическая вентиляция с использованием CMV, HFOV и MFOV в случайном порядке с интервалом в 30 минут с использованием гибридного осциллятора / вентилятора FabianHFO (Acutronic Medical Systems AG, Швейцария). Среднее давление в дыхательных путях (P¯aw) было установлено равным 12 см вод. Ст. 2 O для всех модальностей. В исходных условиях F i O 2 было установлено на 40%, но было увеличено для поддержания S p O 2 ≥ 90% после повреждения легкого. ЦМВ с контролируемым давлением подавали со скоростью от 20 до 32 минут -1 (0.От 33 до 0,53 Гц) с соотношением вдох: выдох 1: 2. Одночастотный HFOV передавался с частотой 5 Гц, в то время как MFOV был доставлен с использованием комбинации наложенных синусоид 5, 10, 15 и 20 Гц с однородными амплитудами потока (Kaczka et al., 2015). Примеры форм сигналов вентилятора представлены на дополнительных рисунках S-1, S-2, S-3. Частота дискретизации записанных форм сигналов вентилятора составляла 200 Гц. Давление привода ИВЛ или амплитуды давления были отрегулированы для получения артериального давления CO 2 ( P a CO 2 ) в целевом диапазоне 30–60 мм рт.Каждый 30-минутный экспериментальный интервал сопровождался анализом газов артериальной крови и последовательностью сканирования 4DCT без прерывания механической вентиляции (Herrmann et al., 2017). Между каждым экспериментальным интервалом вентиляции для восстановления контрольного механического и физиологического состояния использовали 15-минутный период вымывания ЦМВ и 30-секундный маневр набора до 35 см вод. Ст. 2 O давления в дыхательных путях. После завершения экспериментального протокола субъекты были умерщвлены внутривенным раствором пентобарбитала натрия и фенитоина натрия (1 мл + 0.2 мл кг −1 ).
Оценка газообмена и механики
Оксигенацию оценивали с использованием индекса оксигенации (OI), определенного как (Ortiz et al., 1987):
OI = P¯aw · FiO2PaO2 (1)Эффективность выведения CO 2 во время каждого метода оценивалась с использованием функции искусственной вентиляции легких ( V C ), определенной как (Kaczka et al., 2015):
VC = Vrms2 · PaCO2Wt (2), где В среднеквадратичное значение – это среднеквадратическое значение кривой объема В ( t ), подаваемой в отверстие дыхательного пути:
Vrms = 1T∫0T [V (t) -V¯] 2dt.(3)T обозначает продолжительность времени, в течение которого выполняется интегрирование в уравнении (3) (т. Е. Одно дыхание для CMV или одна секунда во время HFOV / MFOV), а V¯ – это среднее значение формы волны объема в интервале от 0 до Т . Пиковая амплитуда громкости ( V pp ) вычислялась как разница между наибольшим и наименьшим значениями изменяющегося во времени объема:
Vpp = max tV (t) -min tV (t). (4)Динамическая эластичность дыхательной системы ( E rs ) во время CMV с регулируемым давлением вычислялась как частное от управляющего давления (Δ P aw ) и дыхательного объема:
Ers = ΔPaw · Vpp-1 (5)где:
ΔPaw = макс tPaw (t) -мин tPaw (t).(6)Измерения респираторного импеданса ( Z rs ) были получены при исходных условиях и после созревания повреждения легкого. Псевдослучайная форма волны, состоящая из девяти синусоид в диапазоне частот от 0,078 до 8,9 Гц, была сгенерирована цифро-аналоговым преобразователем (NI USB-6356, National Instruments, Остин, Техас), прошедшим фильтр нижних частот с частотой 12 Гц (858L8B-2). , Frequency Devices, Haverhill, MA) и используется в качестве входного управляющего сигнала для настраиваемого сервоуправляемого генератора пневматического давления (Kaczka and Lutchen, 2004).Давление в дыхательных путях измерялось датчиком, установленным на проксимальном конце эндотрахеальной трубки (Celesco LCVR-0050, Canoga Park, CA), а поток измерялся с помощью пневмотахометра с экраном (4700A, Hans Rudolph, Shawnee, KS), соединенного с дифференциалом. датчик давления (Celesco LCVR-0002, Canoga Park, CA). Сигналы давления и потока в дыхательных путях регистрировались с частотой 40 Гц в течение ~ 90 с во время приложения вынужденных колебаний, что позволяет трижды повторять периодический контрольный сигнал длительностью 25,6 с. Каждый спектр Z rs и соответствующая ему функция когерентности (γ 2 ) были вычислены с использованием методики периодограммы Велча (Welch, 1967) с прямоугольным оконным режимом и 80% перекрытием.Комплексные значения Z rs были оценены только на девяти частотах, используемых в контрольном сигнале (Suki and Lutchen, 1992). Соответствующие спектры сопротивления R rs и реактивного сопротивления X rs определялись действительной и мнимой частями Z rs соответственно. Резонансная частота f res была оценена по пересечению нуля X rs с использованием сплайн-интерполяции.rs (f) = R + j2πfIaw + (η-j) H (2πf) α (7)
, где Ẑ rs обозначает прогнозируемое моделью Z rs и α = (2π) tan-1 (1η). Параметры модели оценивались методом ограниченного нелинейного градиентного спуска (MATLAB, Natick, MA).
Получение и обработка изображений
КТ сканирований получали с использованием Siemens SOMATOM Force (Siemens Healthineers, Германия) в режиме осевого сканирования с осевым покрытием 5,76 см и толщиной среза 0,6 мм. Субъектов непрерывно сканировали при напряжении трубки 80 кВп и токе трубки 150 мА с периодом вращения сканера 250 мс.Каждое сканирование длилось в общей сложности 30 с, что привело к облучению в 345 мГр и созданию непрерывного набора проекционных изображений. Последовательности изображений 4DCT были реконструированы ретроспективным объединением данных рентгеновской проекции в соответствии с фазой механической вентиляции с использованием частотно-избирательного алгоритма реконструкции (Herrmann et al., 2017), что дало от 13 до 21 объемных изображений на последовательность 4DCT с изотропными 0,6 мм. Пространственное разрешение. Соответствующие временные частоты дискретизации для 21-фазной последовательности изображений составляли 7 Гц во время CMV с основным 0.33 Гц и 105 Гц во время HFOV или MFOV с основной частотой 5 Гц. Каждая последовательность была периодической во временном измерении (т.е. фаза вентиляции), так что выбор «начального» изображения в последовательности был произвольным. Каждое объемное изображение во временной последовательности было помечено I n ( x n ), где n индексирует количество изображений в последовательности от 0 до N – 1 и . x n – вектор, представляющий трехмерное пространственное положение.Воксели, соответствующие пространственным положениям в легких, были идентифицированы с помощью полностью автоматизированного алгоритма сегментации с использованием глубокой сверточной нейронной сети (Gerard et al., 2018, 2020), создавая отчетливую маску легкого M n ( x ). n ) для каждой фазы изображения. Нейронная сеть была обучена с использованием сегментированных вручную легких на КТ-изображениях, полученных из нескольких наборов данных экспериментальных моделей повреждения легких, включая подмножество изображений из текущего исследования.
Периодическое движение респираторных структур оценивалось с использованием метода регистрации деформируемых 4-мерных изображений. Эта процедура произвела N функций трехмерного преобразования, обозначенных как ϕ n ( X ) = x n , где X – вектор, представляющий трехмерное пространственное положение в эталонной кадр усредненного по фазе изображения I avg ( X ) и x n представляет пространственное положение в изображении I n ( x 90 n ).Изображение I avg ( X ) использовалось в качестве цели для групповой регистрации изображений I n ( x n ), n = 0… N – 1. Таким образом, ϕ n ( X ) = x n – это пространственное отображение из системы координат I avg ( X ) в I n ( x n ), так что деформированное изображение I n → avg ( X ) было создано с респираторными структурами, выровненными по целевому изображению как :
In → avg (X) = In (ϕn (X)) (8)На рисунке 1 показана схема преобразования преобразований между всеми изображениями в периодической последовательности и I avg ( X ).Преобразования ϕ n ( X ) были связаны вместе с использованием 4-мерных кубических B-сплайнов и совместно оценены для обеспечения гладкости как в пространственном, так и во временном измерении (Metz et al., 2011). Параметры функции преобразования были итеративно скорректированы с использованием библиотеки Elastix (Klein et al., 2010), чтобы минимизировать сумму квадратов разностей объемов ткани (SSTVD) между каждыми I n → avg ( X ) и I avg ( X ), чтобы каждое деформированное изображение сохраняло объем ткани, содержащийся в каждом вокселе (Горбунова и др., 2008; Инь и др., 2009; Чжао и др., 2016). Таким образом, изменения плотности вокселей CT из-за вариаций фракционного содержания газа были скорректированы с использованием этой функции стоимости подобия. После регистрации ϕ n ( X ) и его обратное отображение ϕn-1 (xn) использовались для совмещения изображений между произвольными фазами. Деформированные изображения были обозначены как I n → m ( x m ), что указывает на n -е изображение, деформированное в m -ю пространственную опорную рамку:
In → m (xm) = In (ϕn (ϕm-1 (xm))) (9) Для тривиального случая м = n уравнение (9) упрощается до I n → n ( x n 90) =
I ( x n ).Концептуально, совместив изображения из любых двух фаз может быть достигнуто за счет деформации одной пространственной системы отсчета к другой, проходя через целевой системе отсчета Х (см рисунок 1). Используя этот подход, все изображения были деформированы, чтобы выровнять структуры с одной, произвольно выбранной эталонной фазой на высоте м = 0. Фазовые вариации региональной аэрации и деформации затем могут быть связаны с тканью, содержащейся в интересующей области на эталонной фазе. . На рис. 2 схематически показано использование одной эталонной фазы для выравнивания структур дыхания на нескольких фазах вентиляции, что позволяет отслеживать коррелированные с тканями изменения в аэрации и региональном объеме.Затем изменения региональной аэрации оценивали по диапазону значений интенсивности вокселей на деформированном изображении:
, тогда как изменения региональной объемной деформации оценивались с использованием матрицы Якоби (Jn → m) пространственных производных преобразования:
Jn → m (xm) = ∇xm (ϕn (ϕm-1 (xm))) (11), где ∇ x м – оператор пространственного градиента. Обратите внимание, что Jn → m выражается в -й пространственной системе отсчета м и описывает градиент преобразования «обратный ход» ϕn (ϕm-1 (xm)).Это обратное преобразование интерпретируется как точка «отвода» x n в фазе вентиляции n до соответствующей точки x м в фазе м . Региональный объем изменяется относительно опорной фазы (то есть м = 0) были вычислены с помощью определителя Jn → м:
Vn (x0) V0 (x0) = | Jn → 0 (x0) | (12), где V n ( x 0 ) соответствует изменяющемуся по фазе объему области, которая в эталонной фазе 0 занимает единственный воксель с центром в позиции x 0 .Соответственно, V 0 ( x 0 ) везде равно объему одного воксела δ V , определяемого пространственным разрешением изображения. Таким образом, уравнение (12) можно упростить до:
Vn (x0) = δV · | Jn → 0 (x0) | (13)Обратите внимание, что | Jn → 0 | <1, когда соответствующая область сдувается относительно эталонной фазы, | Jn → 0 |> 1, когда она расширяется, и | Jn → 0 | = 1, когда нет изменения объема (т. деформация). На рисунке 3 показан пример последовательности изображений для каждого способа вентиляции у одного пострадавшего субъекта, демонстрирующий изменяющуюся по фазу аэрацию I n → 0 ( x 0 ) и изменение объема V n ( x 0 ) для каждого вокселя в интересующей области выборки в x 0 .Также предусмотрены последовательности анимированных изображений для одного объекта в исходных условиях и при травмах (дополнительные анимации S-1, S-2). Изменяющаяся фаза деформация (ε) для каждой области легкого по отношению к соответствующему состоянию минимального раздувания была определена как:
εn (x0) = Vn (x0) -min nVn (x0) min nVn (x0) (14)Изменения региональной объемной деформации оценивали по диапазону ε n ( x 0 ):
Δε (x0) = max nεn (x0) -min nεn (x0) (15)Поскольку минимальное значение ε n ( x 0 ) по определению равно нулю, уравнение (15) может быть уменьшено до:
Δε (x0) = max nεn (x0) (16)Аналогичным образом, региональная объемная скорость деформации (ε˙) была рассчитана по временной скорости изменения ε n ( x ) с использованием прямой разностной схемы:
ε˙n (x0) = ε (n + 1) mod N (x0) -εn (x0) δt (17), где δ t – разница во времени между соседними фазами.Оператор по модулю используется для обозначения периодичности фазы вентиляции. Значение δ t вычисляется из основной частоты вентиляции ( f 0 ) и количества изображений в последовательности 4DCT ( N ):
Наконец, изменения региональной скорости объемной деформации оценивали по диапазону ε˙n (x0):
Δε˙ (x0) = max nε˙n (x0) -min nε˙n (x0) (19)Обратите внимание, что ε˙n (x0) обычно будет положительным во время раздувания определенной области легких и отрицательным во время соответствующего сдувания.Таким образом, Δε˙ (x0) будет отражать сумму самых быстрых темпов инфляции и дефляции в регионе.
Рисунок 1 . Схема, иллюстрирующая совместно оцененные трехмерные преобразования ϕ n ( X ) = x n сопоставление всех изображений в периодической последовательности изображений 4DCT I n ( x n ) и целевое среднее изображение I avg ( X ).Сплошные черные стрелки указывают на преобразование из целевой системы координат X в общую систему координат x n . Пунктирные черные стрелки указывают на обратное преобразование. Серые стрелки представляют периодическую последовательность фаз вентиляции N , индексированных от 0 до N – 1. Любой I n ( x n ) может быть деформирован для достижения структурного выравнивания с любым другой I м ( x м ) путем применения последовательности двух преобразований xn = ϕn (ϕm-1 (xm)), деформирования x m через X .
Рисунок 2 . Схема периодической последовательности изображений 4DCT во время традиционной механической вентиляции (A) , с фазами вдоха и выдоха (B) . Регистрация изображения используется для сопоставления каждого изображения в последовательности с одной эталонной фазой (C) , после чего внутриприливные вариации аэрации и регионального объема могут быть связаны с конкретными областями легочной ткани (D) .
Рисунок 3 . Регистрация четырехмерного изображения использовалась для деформации изображений таким образом, чтобы респираторные структуры были выровнены по одной эталонной фазе.После регистрации региональную аэрацию и изменение объема в легком оценивали по вариациям значения вокселей деформированного изображения и определителя якобианской матрицы деформации. Этот метод применялся во время традиционной механической вентиляции (CMV), высокочастотной колебательной вентиляции (HFOV) и многочастотной колебательной вентиляции (MFOV). Продолжительность вентиляционного цикла обозначается интервалом между отметками. В этом примере каждому вентиляционному циклу соответствует последовательность изображений, представляющих 21 различную вентиляционную фазу.Обратите внимание, что для ясности показаны несколько циклов каждой формы волны вентиляции, однако все циклы идентичны. См. Также Дополнительные анимации S-1, S-2.
Вокселей в пределах 6,0 мм от границ изображения вдоль рострально-каудальной оси были исключены из маски для целей анализа изображения из-за возможных артефактов регистрации, вызванных движением легочной ткани в или из осевого поля зрения. Региональная аэрация (Δ I ), деформация (Δε) и скорость деформации (Δε˙) сравнивались между субъектами, условиями легких и модальностями вентиляции по их среднему значению по всей маске легкого, коэффициенту вариации и пространственным градиентам в право-левое, дорсально-вентральное и рострально-каудальное направления.Пространственные градиенты для каждой переменной были определены из наклонов, рассчитанных с помощью линейной регрессии относительно положения вдоль каждой из основных анатомических осей. Пространственные градиенты исследовались ненормализованными и нормализованными по пространственному среднему, в каждом случае сравнивая значения градиента со знаком (то есть положительный и отрицательный) и величину градиента (то есть абсолютное значение).
Учитывая гармонический характер MFOV, отдельные частотные компоненты I n , ε n и ε˙n были оценены с использованием дискретного преобразования Фурье (ДПФ), чтобы связать эти периодические временные интервалы. различные свойства в каждой пространственной позиции на гармонические амплитудные и фазовые составляющие.Региональная неоднородность объемной деформации (Δε) оценивалась с помощью декомпозиции октодерева и супервокселя, каждая из которых рекурсивно подразделяла интересующие области (ROI) в пределах маски легкого. Оба метода разложения были инициализированы одной областью интереса, содержащей всю маску легкого. На каждом рекурсивном шаге обозначенная область интереса разделялась на несколько новых областей интереса, если стандартное отклонение интенсивности содержащихся вокселей превышало фиксированный порог, установленный на стандартное отклонение нормированного на среднее значение Δε ≥ 0.3. Декомпозиция октодерева, трехмерное расширение декомпозиции квадродерева, была использована для разделения каждой области интереса на восемь октантов в соответствии с делением пополам корональной, сагиттальной и поперечной плоскостями (Perchiazzi et al., 2014). Разложение супервокселей использовалось для разделения каждой области интереса на две новые области интереса с помощью взвешенной кластеризации вокселей в размере к в соответствии с сходством интенсивности и пространственной близостью (Conze et al., 2017). Рекурсивное подразделение продолжалось до тех пор, пока все области интереса не содержали значения стандартного отклонения ниже порогового значения или не были <0.2% маски легкого. Затем региональную неоднородность Δε количественно оценивали с помощью среднего объема ROI (V¯ROI) как доли маски легкого.
Статистика
Непараметрические тесты суммы рангов Крускала-Уоллиса были выполнены для каждого результата, проверены основные эффекты состояния легких (то есть исходный уровень, травма) и модальности вентиляции (то есть CMV, HFOV, MFOV) на уровне значимости 0,05. Эффект вентиляции был протестирован отдельно в исходных и травмированных условиях. Для исходов со значительным основным эффектом вентиляции различия между модальностями были выявлены с помощью сравнения Dunn post hoc с поправкой на ранговые связи и дальнейшей корректировкой с помощью процедуры Бенджамини-Хохберга для снижения частоты ложных открытий.Для статистических расчетов использовался веб-инструмент (Vasavada, 2016).
Результаты
На рисунке 4 представлена сводка спектров респираторного импеданса Z rs для всех субъектов, измеренных в исходных условиях и в условиях травмы, а в таблице 1 представлена сводка модели постоянной фазы, примененной к Z rs . В исходных условиях средняя эластичность ткани на основе модели H составляла 121 см H 2 O L -1 при 1 рад с -1 (0.16 Гц) с коэффициентом вариации 0,31. Увеличение H после повреждения олеиновой кислотой было сильно изменчивым, в результате в среднем 435 см H 2 O L -1 при 1 рад с -1 с коэффициентом вариации 0,94. Для сравнения, измерение динамической эластичности ( E rs ) во время CMV (уравнение 5) составило 148,9 ± 26,9 см вод. Ст. 2 OL -1 и 257,5 ± 64,2 см вод. травмированные состояния соответственно.Резонансная частота ( f res ) увеличивалась после повреждения легкого, в некоторых случаях превышая диапазон измерения, допускаемый параметрами выборки. Таблица 2 содержит сводку всех значимых эффектов, выявленных непараметрическими тестами Краскела-Уоллиса, а также апостериорных сравнений , если это необходимо. Эти результаты описаны ниже в контексте конкретных фигур.
Рисунок 4 . Респираторный импеданс, измеренный в исходных условиях (черный) и травмированный (белый), представлен средним значением (кружки) и стандартным отклонением (планки ошибок) на каждой частоте для разных субъектов.Комплексный спектр импеданса представлен его действительной частью или синфазной составляющей (т. Е. Сопротивлением) и ее мнимой частью или противофазной составляющей (т. Е. Реактивным сопротивлением). Когерентность обеспечивает оценку качества сигнала и линейности измеренной зависимости между колебаниями давления и расхода.
Таблица 1 . Механика дыхательной системы.
Таблица 2 . Статистически значимые эффекты, определенные с помощью критерия суммы рангов Краскела-Уоллиса для основных эффектов состояния легких (т.е., исходный уровень, травмированный) и способ вентиляции (т. е. CMV, HFOV, MFOV).
На рис. 5 показаны результаты газообмена, связанные с ИВЛ, включая индекс оксигенации (OI = PaO2-1 · FiO2 · P¯aw) и функцию затрат на вентиляцию (VC = PaCO2 · Vrms2 · Wt-1). Существенный основной эффект состояния легких (исходный или поврежденный) был обнаружен для P a O 2 , PaO2 · FiO2-1, OI и P a CO 2 ( p <0,001). Существенный основной эффект вентиляции был обнаружен в Δ P aw , Vpp · Wt-1, Vrms · Wt-1 и V C ( p <0.001) для обоих состояний легких, а также при НО для травмированного состояния ( p <0,05). В частности, медиана OI увеличилась на 300% для травмированных субъектов по сравнению с исходным уровнем ( p <0,001), но была на 48% ниже для травмированных субъектов во время MFOV по сравнению с CMV ( p <0,05). MFOV и HFOV были связаны с более низким медианным значением V C как для исходных, так и для травмированных состояний по сравнению с CMV (HFOV на 84% ниже, чем CMV, p <0.01; MFOV на 93% ниже, чем CMV, p <0,001). Попарное сравнение V C для MFOV и HFOV также показало статистически значимое различие, со снижением медианы V C для MFOV на 60% по сравнению с HFOV ( p <0,05). Медиана Vrms · Wt-1 была на 41% ниже для MFOV по сравнению с HFOV ( p = 0,0505 исходный уровень; p <0,05 поврежденных) и на 75% ниже для MFOV по сравнению с CMV ( p <0,001).
Рисунок 5 .Результаты газообмена, представленные прямоугольными диаграммами, показывающими минимум, максимум и квартили для субъектов в исходных (черный) и травмированных (белый) условиях, во время традиционной механической вентиляции (CMV), высокочастотной колебательной вентиляции (HFOV) и многочастотной колебательная вентиляция (МФОВ). Звездочки указывают уровни значимости (* p <0,05, *** p <0,001) для основных эффектов (C = состояние легких, MB = модальность для исходного состояния, MI = модальность для травмированного состояния).См. Таблицу 2 для дополнительных пояснений. P a O 2 = артериальное давление кислорода; F i O 2 = фракционный вдыхаемый кислород; P a CO 2 = артериальное давление углекислого газа; Δ P aw = амплитуда давления в дыхательных путях; V pp = размах громкости; Wt = масса тела; V rms = среднеквадратичный объем.
На рис. 6 показаны основанные на регистрации оценки региональной вентиляции, такие как внутриприливные изменения в воксельной аэрации (Δ I ), объемной деформации (Δε) и скорости объемной деформации (Δε˙).Существенный главный эффект состояния (исходный уровень по сравнению с травмой) был обнаружен для Δ I пространственного среднего ( p <0,001), коэффициента вариации Δε ( p <0,001) и коэффициента вариации Δε˙ ( p <0,01). Существенный основной эффект вентиляции был обнаружен для пространственных средних всех трех переменных - Δ , I , Δε и Δε˙ – как в исходном состоянии, так и в условиях травмы легких ( p <0,001). В частности, MFOV и HFOV продуцировали меньшее Δ I , меньшее Δε и большее Δε˙ по сравнению с CMV в исходных условиях и в травмированных условиях ( p <0.05). Для травмированного состояния MFOV приводил к значительно более низким Δ , и Δε по сравнению с HFOV ( p <0,05), но не отличался для Δε˙ ( p = 0,20).
Рисунок 6 . Сводка измерений региональной вентиляции на основе регистрации изображений при внутриприливных изменениях аэрации (Δ I ), объемной деформации (Δε) и скорости объемной деформации (Δε˙). Среднее значение и коэффициент вариации по всей маске легкого показаны для каждой переменной, представленные прямоугольными диаграммами, показывающими минимум, максимум и квартили для субъектов в исходных (черный) и травмированных (белый) условиях, во время обычной механической вентиляции (CMV), высоких частотно-колебательная вентиляция (HFOV) и многочастотная колебательная вентиляция (MFOV).Звездочки указывают уровни значимости (** p <0,01, *** p <0,001) для основных эффектов (C = состояние легких, MB = модальность для исходного состояния, MI = модальность для травмированного состояния). См. Таблицу 2 для дополнительных пояснений.
На рис. 7 показаны ненормированные пространственные градиенты Δ I , Δε и Δε˙ в правой-левой, дорсально-вентральной и каудально-ростральной осях. Наибольшие наблюдаемые величины пространственного градиента наблюдались вдоль дорсально-вентральной оси.В частности, поврежденное состояние легкого было связано со значительно более положительными дорсально-вентральными градиентами Δε ( p <0,001) и Δε˙ ( p <0,05). Режим вентиляции оказал значительное влияние на все дорсально-вентральные градиенты в исходных условиях (Δ I , p <0,001; Δε, p <0,001; Δε˙, p <0,01), при этом MFOV дает наименьшее отрицательные дорсально-вентральные градиенты Δ I и Δε, но наиболее положительные дорсально-вентральные градиенты Δε˙.Хотя модальность не была значимым предиктором вариабельности фактического значения (положительного или отрицательного) любого дорсально-вентрального градиента для травмированных субъектов, она была значимым основным эффектом для величин всех дорсально-вентральных градиентов (Δ I ). , p <0,001; Δε, p <0,01; Δε˙, p <0,05). В целом HFOV и MFOV снижали величины дорсально-вентрального градиента Δ I и Δε как в исходных условиях, так и в условиях травмы, одновременно увеличивая соответствующий градиент Δε˙.На рисунке 8 показаны соответствующие нормированные на среднее значение пространственные градиенты. В общем, нормализация каждого пространственного градиента соответствующим пространственным средним объясняет большую часть изменчивости, наблюдаемой в ненормализованных пространственных градиентах (рис. 7) в отношении различных режимов вентиляции. Об этом также свидетельствует потеря значительных различий между режимами вентиляции для соответствующих пространственных градиентов, как показано в таблице 2.
Рисунок 7 . Ненормализованные значения пространственного градиента (A) и величины (B) для измерений региональной вентиляции на основе регистрации изображений внутриприливных изменений аэрации (Δ I ), объемной деформации (Δε) и объемной скорости деформации (Δε˙) .Для каждой переменной показаны линейные пространственные градиенты в каждом из трех основных анатомических направлений по всей массе легкого, представленные прямоугольными диаграммами, показывающими минимум, максимум и квартили для субъектов в исходных (черный) и травмированных (белый) условиях во время традиционной механической вентиляции. (CMV), высокочастотная колебательная вентиляция (HFOV) и многочастотная колебательная вентиляция (MFOV). Звездочки указывают уровни значимости (* p <0,05, ** p <0.01, *** p <0,001) для основных эффектов (C = состояние легких, MB = модальность для исходного состояния, MI = модальность для травмированного состояния). См. Таблицу 2 для дополнительных пояснений.
Рисунок 8 . Средне-нормализованные значения пространственного градиента (A) и величины (B) для измерений региональной вентиляции на основе регистрации изображений внутриприливных изменений аэрации (Δ I ), объемной деформации (Δε) и скорости объемной деформации (Δε ˙). Для каждой переменной показаны линейные пространственные градиенты в каждом из трех основных анатомических направлений по всей массе легкого, представленные прямоугольными диаграммами, показывающими минимум, максимум и квартили для субъектов в исходных (черный) и травмированных (белый) условиях во время традиционной механической вентиляции. (CMV), высокочастотная колебательная вентиляция (HFOV) и многочастотная колебательная вентиляция (MFOV).Звездочки указывают уровни значимости (* p <0,05, ** p <0,01, *** p <0,001) для основных эффектов (C = состояние легких, MB = модальность для исходного состояния, MI = модальность для травмированного условие). См. Таблицу 2 для дополнительных пояснений.
На рис. 9 показан пример областей интереса, определяемых рекурсивным супервокселем и декомпозицией октодерева, выполненной на нормированном на среднее значение Δε у одного субъекта. Сгруппированные области проиллюстрированы с помощью контуров и областей с заливкой в двумерных представлениях среза, а также визуализации полупрозрачной поверхности в трехмерных проекциях.Обратите внимание, что супервоксельная декомпозиция дает более крупные смежные области интереса, несмотря на использование тех же критериев принятия решения для рекурсивного подразделения кластера. На рисунке 9 также представлена сводная информация о среднем размере кластера (V¯ROI) по субъектам, состоянию и способам вентиляции. Существенное влияние на состояние легких было обнаружено для техники октодерева ( p <0,001) с уменьшением медианы V¯ROI на 32% в поврежденных легких.
Рисунок 9 . Региональная неоднородность внутриприливных вариаций объемной деформации (Δε) во время традиционной механической вентиляции (CMV), высокочастотной колебательной вентиляции (HFOV) и многочастотной колебательной вентиляции (MFOV).Региональная неоднородность оценивалась по размеру, количеству и распределению представляющих интерес областей или кластеров (рандомизированных цветов), полученных рекурсивным супервокселом или декомпозицией октодерева. Примеры из репрезентативного субъекта (A) и объемы кластеров как часть маски легкого (B) , представленные прямоугольными диаграммами, показывающими минимум, максимум и квартили для субъектов в исходных (черный) и травмированных (белый) условиях . Звездочки указывают уровни значимости (*** p <0.001) для основных эффектов (C = состояние легких).
На рисунке 10 показаны примерные распределения амплитуды и фазы деформации на первых четырех гармониках для CMV, HFOV или MFOV, вычисленные с использованием дискретного преобразования Фурье изменяющихся во времени определителей Якоби в выровненных изображениях. На рисунке 11 представлена сводка амплитуд гармонических деформаций во время HFOV и MFOV для всех субъектов, коррелированных с соответствующими амплитудами кривой объема вентилятора V ( t ). Колебательные волны представляли собой синусоиду 5 Гц (HFOV) и комбинацию синусоид 5, 10, 15 и 20 Гц с однородными амплитудами потока (MFOV).Распределение относительной амплитуды в кривых потока, подаваемых аппаратом ИВЛ, в основном сохранялось по всему легкому, согласно метрикам, основанным на регистрации ( r 2 = 0,78). Однако измерения гармонических искажений во время HFOV показали, что почти 20% спектральной мощности при региональной деформации было сосредоточено в высших гармониках формы волны 5 Гц (т. Е. 10, 15, 20 Гц), тогда как форма волны объема вентилятора показала только 5 % гармонических искажений (Zhang et al., 1995; Amini et al., 2017).
Рисунок 10 . Представления в частотной области коррелированной с тканью региональной амплитуды деформации (A) и фазовых вариаций (B) у одного пациента во время традиционной механической вентиляции (CMV), высокочастотной колебательной вентиляции (HFOV) и многочастотной колебательной вентиляции (MFOV). Для каждого режима вентиляции амплитуды и фазы деформации были получены из дискретного преобразования Фурье изменяющихся во времени детерминантов Якоби в каждом вокселе с использованием преобразований, сопоставленных с одним эталонным изображением.В каждом поперечном сечении эталонного изображения цвет вокселя в (A) указывает амплитуду деформации на этой частоте, соответствующую амплитуде объемной деформации относительно минимального объема этого конкретного воксела. Цвет вокселя в (B) указывает величину фазового сдвига (опережающего или запаздывающего) относительно средней фазы всех вокселей легких на указанной частоте.
Рисунок 11 . Амплитуды гармоник (A) из измерений региональной деформации на основе изображений и соответствующие амплитуды из формы волны объема вентилятора, измеренной в отверстии дыхательных путей при исходных (кружки) и травмированных (треугольники) условиях.Индекс гармонических искажений (B) Среднее значение и стандартное отклонение для каждого набора измерений, сгруппированных по исходным (черный) и поврежденным (белый) состояниям легких.
Обсуждение
В этом исследовании мы продемонстрировали, что осцилляторная вентиляция улучшает среднюю региональную деформацию легких, а также пространственные градиенты деформации легких по сравнению с традиционным способом контроля давления у свиней с гетерогенным повреждением легких. Это исследование выявило механизм, с помощью которого повышенное содержание гармоник в сигналах MFOV может улучшить газообмен по сравнению с CMV или одночастотными сигналами HFOV.
Повышение эластичности дыхательной системы после повреждения легкого (т. Е. Увеличение на 183% для E rs и на 355% для H ) согласуется со значительным нарушением рекрутирования легких и / или дисфункцией сурфактанта. Следовательно, для поддержания эвкапнии с сопоставимой частотой дыхания требовалось повышенное давление при вождении. Несмотря на схожую Vpp · Wt-1 и функцию затрат на вентиляцию ( V C ), управляющее давление (Δ P aw ) после повреждения легкого увеличилось до 18.7 см вод. Ст. 2 O, по сравнению с 13,0 см вод. Ст. 2 O на исходном уровне (рис. 5). Повышенная Δ P aw во время CMV после травмы превышала порог 15 см вод. Ст. 2 O, установленный Amato et al. (2015), выше которого отношение шансов смертности было больше единицы у пациентов с ОРДС. Использование Δ P aw > 15 см вод.Однако такая эвристика применима только во время CMV, для которого колебания P aw хорошо коррелируют с деформацией легких. Во время колебательных режимов вентиляции Δ P aw , вычисленное по уравнению (6), не представляет упругое давление, раздувающее периферические альвеолы, но также включает значительные потери давления из-за резистивных и инерционных нагрузок, создаваемых эндотрахеальной трубкой и проводящими дыхательными путями, особенно с увеличением частоты. Тот факт, что Δ P aw было больше во время MFOV, чем HFOV, указывает на то, что для преодоления повышенных резистивных и инерционных потерь на частотах до 20 Гц по сравнению с 5 Гц требовались большие амплитуды давления, но не указывает на то, что эти большие дыхательные пути давление передавалось на дистальные альвеолы (Pillow et al., 2002). Мы обнаружили, что пространственное среднее напряжение во всем легком во время CMV не изменилось после травмы, несмотря на увеличение Δ P aw и Δ I пространственного среднего (рис. 6). Некоторое свидетельство примирения этого несоответствия проявляется в значительно увеличенном коэффициенте вариации для Δε (рис. 6). При более тщательном изучении региональных распределений деформации в поврежденных легких, Δε была почти равна нулю в консолидированных областях легкого с I > -100 HU.Напротив, Δε увеличивалось на 25% в областях с нормальной вентиляцией (т.е. -900 HU < I <-500 HU) по сравнению со средним значением по всей маске легкого. Таким образом, увеличенное Δ P aw , необходимое для доставки аналогичного Vpp · Wt-1 (фиг. 5), привело к концентрированным штаммам в задействованном легком. Этот результат согласуется с концепцией «детское легкое», которая описывает снижение функционального рекрутируемого объема при ОРДС (Gattinoni and Pesenti, 2005; Gattinoni et al., 2016а).
Пространственные градиенты приливной деформации также дают некоторое представление о перераспределении механических потоков после повреждения легких. Как и ожидалось, величины градиентов вправо-влево были небольшими по сравнению с величинами дорсально-вентрального и каудально-рострального градиентов (Рисунок 7). Наиболее заметно повреждение легких было связано с резкими изменениями дорсально-вентральных градиентов Δε. Вентиляция у здоровых субъектов во время CMV имеет тенденцию распределяться в сторону дорсальной и каудальной областей легких. Однако различные степени повреждения легкого приводили к консолидации или прекращению рекрутирования зависимого легкого, так что дорсально-вентральные градиенты Δε были уменьшены (или даже обращены вспять) в зависимости от степени отека, особенно для CMV и HFOV.Интересно, что внутриприливные изменения аэрации имеют тенденцию к сохранению дорсально-вентрального градиента Δ I до и после травмы, несмотря на положительный сдвиг, наблюдаемый в дорсально-вентральных градиентах Δε. Следует отметить, что фактическое пространственное распределение Δ , I и Δε, вероятно, плохо описывается линейными функциями пространственного положения после повреждения легких и даже может быть немонотонным (Johnson et al., 2017). Например, отрицательные дорсально-вентральные градиенты могут быть возможны в задействованном легком, но им противодействует нулевая вентиляция в зависимом легком, не задействованном в работе, так что результирующий общий линейный градиент может быть отрицательным, нулевым или даже положительным.Тем не менее, по сравнению с любым CMV или HFOV, MFOV уменьшал величину пространственных градиентов вентиляции независимо от состояния легких. К другим стратегиям улучшения распределения вентиляции и устранения больших дорсально-вентральных градиентов относится вентиляция в положении лежа на животе (Scholten et al., 2017; Xin et al., 2018), которая не использовалась в этом исследовании. Положение лежа на животе служит для устранения крупномасштабных гравитационных градиентов при расширении легких (Hoffman, 1985), но не ожидается, что оно повлияет на локальные межрегиональные механические различия, на которые нацелено MFOV.Наконец, и HFOV, и MFOV были связаны с более положительными каудально-ростральными градиентами Δ I по сравнению с CMV, независимо от состояния травмы ( p <0,001). Данные, связанные с ЦМВ, показывают, что в отличие от осцилляторных модальностей ЦМВ преимущественно вентилирует базальные области легких, что согласуется с предыдущим исследованием позитронно-эмиссионной томографии (Венегас и др., 1993).
Большая часть изменчивости величин пространственного градиента при различных режимах вентиляции была связана с изменениями средних пространственных значений.Напротив, нормализованные градиенты (то есть пространственные градиенты, деленные на пространственное среднее) показали меньше значительных различий между модальностями (рисунок 8, таблица 2). Этот вывод указывает на то, что, по крайней мере, для конкретных частот и форм волны, используемых в этом исследовании, относительные пространственных градиентов не были существенно изменены модальностью. Частично это может быть связано с преобладанием составляющей 5 Гц как в сигналах HFOV, так и MFOV, которая почти в каждом случае была ниже резонансной частоты (Таблица 1) и, следовательно, ниже пороговой частоты для развития региональной неоднородности вентиляции из-за резонансной частоты. амплификация (Herrmann et al., 2019а). Затем наши результаты показывают, что широкополосные формы волны MFOV, производя ту же относительную неоднородность вентиляции , что и HFOV, все же уменьшают среднюю деформацию и величину градиентов деформации, которые связаны с риском VILI.
На основании нашего супервоксельного анализа и анализа октодерева, региональная гетерогенность деформации не сильно различалась в зависимости от модальности вентиляции, хотя поврежденные легкие действительно требовали меньшего размера для описания пространственной кластеризации Δε по сравнению с исходными условиями (рис. 9).Таким образом, повреждение легких может привести к повышенной гетерогенности мелкомасштабных деформаций (Kaczka et al., 2011; Perchiazzi et al., 2014). Следует отметить, что наши оценки региональной деформации, полученные на основе регистрации изображений, по своей сути являются гладкими из-за использования B-сплайнов для определения пространственно-временных деформаций. Расхождение между результатами, полученными на основе супервокселов и октодерева, также может быть частично связано с дискретной анатомической структурой легких, которая состоит из предполагаемого континуума губчатых паренхиматозных тканей, пронизанных разветвленными сетями дыхательных путей и сосудов.Предполагается, что дыхательные пути и сосуды не будут подвергаться большим объемным деформациям во время механической вентиляции и, следовательно, вызывают неоднородности в пространственном поле Δε. Такие неровности могут быть приблизительно очерчены границами супервокселей, которые жестко не ограничены. Напротив, декомпозиция октодерева строго плоская, и поэтому может потребоваться большая степень рекурсивного деления, чтобы изолировать такие нерегулярные пространственные распределения Δε (Perchiazzi et al., 2014). Разложение супервокселей включает пространственную близость, а также интенсивность изображения, так что уменьшение взвешивания пространственной близости может облегчить идентификацию более крупных кластеров, хотя и с нерегулярными границами.Следовательно, возможно, что наши результаты будут изменены, если более мелкие дыхательные пути и кровеносные сосуды будут дополнительно сегментированы от паренхимы легких до кластерного анализа, или если для разложения супервокселя использовалось другое взвешивание пространственной близости.
Разделение гармоник региональной вентиляции иллюстрирует потенциальное влияние нелинейной механики во время HFOV на частоте 5 Гц (Рисунок 11). Например, регистрация изображения привела к оценке амплитуд ε˙ на частотах 10, 15 и 20 Гц, примерно равных одной трети амплитуд при 5 Гц, несмотря на то, что форма волны вентилятора состоит только из колебаний 5 Гц (дополнительный рисунок S-4).Напротив, амплитуды ε˙ во время MFOV аппроксимируют входное распределение равномерного амплитудного потока по всем четырем гармоникам (дополнительный рисунок S-4). Внутрилегочное гармоническое искажение распределенных потоков во время HFOV (только с одной частотой) может быть результатом использования потоков большей амплитуды, усугубляющих присущие механические нелинейности, но также может быть результатом сложного взаимодействия механически взаимозависимых тканей легких (Suki and Bates, 1991). ; Suki et al., 1991). Во время MFOV использование потоков малой амплитуды может способствовать относительно линейному механическому поведению легочных тканей.Также возможно, что наблюдаемая нелинейность может быть частично связана с артефактом изображения и ошибками в регистрации изображения, приводящими к неверно идентифицированному высокочастотному движению с малой амплитудой. Однако, если предположить, что наши результаты регистрации точны, амплитуды ε˙, измеренные на высших гармониках во время HFOV, на удивление велики, почти сравнимые с теми, которые были намеренно получены во время MFOV. Вероятно, что механизмы, с помощью которых MFOV может усиливать транспорт газа, уже происходят, по крайней мере, до некоторой степени, в пределах периферии легких во время HFOV.Однако MFOV может индуцировать эти высшие гармоники напрямую, без дополнительных затрат на создание высоких скоростей потока на основной частоте. Последствия таких накладных расходов могут включать, например, увеличенные пространственные градиенты деформации и скорости деформации из-за гравитационной зависимости (Рисунок 7).
Ограничения
MFOV может улучшить распределение вентиляции и эффективность газообмена (Kaczka et al., 2015; Herrmann et al., 2018, 2019b). Однако, учитывая технические ограничения аппарата ИВЛ, а также нашу методику реконструкции динамического КТ-изображения, предполагающую строгую периодичность движений (Herrmann et al., 2017), осциллограмма MFOV, использованная в этом исследовании, включала только гармонические составляющие основной частоты. Кардиогенное движение не было синхронизировано с дыхательным движением и поэтому является источником артефактов на реконструированных изображениях дыхательного движения 4DCT, в зависимости от относительной периодичности между частотой вентилятора и частотой сердечных сокращений. Такой артефакт может проявляться в виде быстрых колебаний плотности КТ (Herrmann et al., 2017), что может влиять на основанные на регистрации оценки скорости деформации, особенно в областях, прилегающих к средостению.
Кроме того, интерпретация регионального напряжения в непосредственной близости от найма / прекращения найма является сложной задачей по нескольким причинам. Стандартные методы регистрации изображений (например, с использованием функции стоимости подобия, определенной как сумма квадратов разностей интенсивностей) предполагают равномерное преобразование интенсивности для прогнозирования соответствия вокселей, но не могут учитывать локальные изменения интенсивности, связанные с изменением доли газа. Следовательно, эти подходы могут привести к предсказанию нефизических деформаций, таких как сокращение неаэрированных областей легких.Функция стоимости подобия суммы квадратов разностей объемов тканей (SSTVD), используемая в этом исследовании, решает эту проблему с помощью неравномерного преобразования интенсивности, которое учитывает локальные вариации интенсивности КТ, которые возникают из-за изменения пропорций содержания газа в ткани в каждом из них. область легких во время дыхания или вентиляции (Zhao et al., 2016). Другой проблемой при регистрации поврежденных легких является отсутствие контраста или структурных ориентиров в консолидированных регионах, что делает практически невозможным подтверждение предполагаемого воксельного соответствия, особенно когда между двумя изображениями происходят большие изменения в рекрутинге.В этом исследовании использовалась визуализация с высоким временным разрешением (7–105 Гц), чтобы минимизировать время между соседними фазами вентиляции, что привело к небольшим деформациям и небольшим изменениям набора между соседними регистрируемыми изображениями. Линейная эластическая регуляризация дает правдоподобные предсказания воксельного соответствия в областях с небольшим контрастом, предполагая, что паренхима легких деформируется как линейный эластичный материал. Важным ограничением большинства методов регистрации является предположение о плавно меняющейся деформации, которая может неточно отражать прерывистое движение на четких структурных границах между аэрированной и неаэрированной легочной тканью.Из-за ограниченного пространственного разрешения в этом исследовании (0,6 мм) каждый воксель может содержать до десятков альвеол. Таким образом, трудно, если не невозможно, определить основную причину наблюдаемых изменений аэрации (Cereda et al., 2019). Например, одно и то же изменение аэрации одного воксела может представлять собой равномерное сдутие его альвеол, полное прекращение рекрутирования только части альвеол или любую их комбинацию. Таким образом, прогнозирование набора / прекращения набора на основе воксельной аэрации является спекулятивным.
Наконец, хотя наше исследование было сосредоточено на региональном распределении аэрации, деформации и скорости деформации в качестве основных показателей вентиляции и VILI, точную взаимосвязь между этими механическими переменными и VILI установить трудно. VILI – сложный процесс, связанный с разнообразным набором механических стимулов (Hussein et al., 2013; Carrasco Loza et al., 2015; Güldner et al., 2016; Smith et al., 2017; Tonetti et al., 2017) . Так называемая «механическая мощность» (то есть скорость диссипации энергии через паренхимные ткани) может обеспечить лучший прогноз VILI по сравнению с деформацией или скоростью деформации отдельно (Gattinoni et al., 2016b; Серпа Нето и др., 2018). Однако измерение региональной механической мощности нецелесообразно, учитывая требование регионального давления газа в легких для его оценки. В качестве альтернативы, ВИЛИ можно также оценить с помощью поглощения фтор-дезоксиглюкозы (ФДГ) (Wellman et al., 2014), сывороточных или альвеолярных воспалительных цитокинов (Liu et al., 2013), содержания белка в жидкости бронхоальвеолярного лаважа (Smith et al., 2017) и гистопатология. Все эти количественные измерения повреждения легких требуют длительной механической вентиляции до измерения, некоторые из которых могут быть получены только после смерти .
Заключение
В модели ОРДС свиней с использованием олеиновой кислоты высокочастотная и многочастотная колебательная вентиляция привела к повышению эффективности газообмена и снижению региональной деформации легких по сравнению с традиционной механической вентиляцией легких. MFOV также уменьшил пространственные градиенты деформации легких по сравнению с CMV или HFOV, что привело к более равномерному общему распределению деформации легких. Напротив, нормированные на среднее значение пространственные градиенты в меньшей степени зависели от режима вентиляции, что указывает на то, что использование более высоких частот гармоник в MFOV существенно не меняет относительной гетерогенности вентиляции .Таким образом, уменьшенные градиенты пространственной деформации, наблюдаемые с MFOV, по сравнению с HFOV или CMV, можно объяснить снижением средней паренхимальной деформации . Таким образом, MFOV поддерживает газообмен с уменьшением деформации легких и может обеспечить дополнительное преимущество по сравнению с HFOV за счет уменьшения неоднородности вентиляции, связанной с пространственными градиентами абсолютной деформации, а также за счет уменьшения деформации, связанной с традиционной вентиляцией или одночастотными колебаниями.
Заявление о доступности данных
Наборы данных, созданные для этого исследования, доступны по запросу соответствующему автору.
Заявление об этике
Исследование на животных было рассмотрено и одобрено Комитетом Института по уходу и использованию животных Университета Айовы (номер протокола 5061428).
Авторские взносы
JH и DK разработали исследование, собрали данные и написали рукопись. JH, SG, WS, MH, JR, GC, EH и DK проанализировали данные и отредактировали рукопись.
Финансирование
Эта работа была поддержана канцелярией помощника министра обороны по вопросам здравоохранения в рамках программы рецензируемых медицинских исследований в рамках награды No.W81XWH-16-1-0434. Мнения, толкования, выводы и рекомендации принадлежат авторам и не обязательно одобряются Министерством обороны. Это исследование также было поддержано отделением анестезии в больнице и клиниках Университета Айовы и наградами Национального института здравоохранения R41 HL140640, R01 CA166703 и R01 HL142625. В этой работе использовался компьютерный томограф, который был приобретен на средства гранта 1S10OD018526 Национального института здравоохранения США.Это исследование было частично поддержано высокопроизводительными вычислительными ресурсами, предоставленными Университетом Айовы, Айова-Сити, Айова.
Конфликт интересов
JH и DK являются соучредителями и акционерами OscillaVent, Inc. JR и EH являются соучредителями и акционерами VIDA Diagnostics, Inc.
Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Андреа Фонсека да Круз, Бакир Хайдаревич, Эли Шмидт, Челси Слоун и Келли М. Старк помогали выполнять экспериментальный протокол. Мелисса Сэйлор, Джаррон Ата и Шейна Хог помогли с компьютерной томографией. Ахмед Халавейш, Мэтью К. Фулд и Siemens Healthineers (Форххайм, Германия) оказали техническую помощь в реконструкции изображения. Андреа Фонсека да Круз, Эли Шмидт, Чарльз А. Маскардо и Итан Л. Чен помогли выполнить сегментацию изображений вручную.ZOLL Medical Corporation щедро предоставила портативный вентилятор для использования в экспериментах на животных. Авторы глубоко признательны за их вклад в это исследование.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fphys.2020.00014/full#supplementary-material
Сноски
Список литературы
Сеть острого респираторного дистресс-синдрома (2000).Вентиляция с меньшими дыхательными объемами по сравнению с традиционными дыхательными объемами при остром повреждении легких и остром респираторном дистресс-синдроме. Сеть по синдрому острого респираторного дистресс-синдрома. N. Engl. J. Med. 342, 1301–1308. DOI: 10.1056 / NEJM200005043421801
CrossRef Полный текст | Google Scholar
Амато М. Б., Мид М. О., Слуцкий А. С., Брошард Л., Коста Е. Л., Шенфельд Д. А. и др. (2015). Движущая сила и выживаемость при остром респираторном дистресс-синдроме. N. Engl. J. Med. 372, 747–755. DOI: 10.1056 / NEJMsa1410639
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Амини Р., Херрманн Дж. И Качка Д. В. (2017). Интриторальное чрезмерное растяжение и прекращение рекрутирования в поврежденном легком: имитационное исследование. IEEE Trans. Биомед. Англ. 64, 681–689. DOI: 10.1109 / TBME.2016.2572678
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Амини, Р., Качка, Д. В. (2013). Влияние частоты вентиляции и жесткости паренхимы на распределение потока и давления в модели легкого собаки. Ann. Биомед. Англ. 41, 2699–2711. DOI: 10.1007 / s10439-013-0866-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карраско Лоса, Р., Вильямисар Родригес, Г., и Медель Фернандес, Н. (2015). Повреждение легких, вызванное искусственной вентиляцией легких (VILI), при остром респираторном дистресс-синдроме (ARDS): волютравма и молекулярные эффекты. Откройте Respir. Med. J. 9, 112–119. DOI: 10.2174/187430640150
12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Середа, М., Xin, Y., Goffi, A., Herrmann, J., Kaczka, D. W., Kavanagh, B.P., et al. (2019). Визуализация поврежденного легкого: механизмы действия и клиническое использование. Анестезиология . 131, 716–749. DOI: 10.1097 / ALN.0000000000002583
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Conze, P.H., Noblet, V., Rousseau, F., Heitz, F., de Blasi, V., Memeo, R., et al. (2017). Масштабно-адаптивные случайные леса на основе супервокселей для сегментации опухоли печени в динамических КТ-сканированиях с контрастным усилением. Внутр. J. Comput. Ассистент. Радиол. Surg. 12, 223–233. DOI: 10.1007 / s11548-016-1493-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаттинони, Л., Марини, Дж. Дж., Песенти, А., Квинтел, М., Манчебо, Дж., И Брошард, Л. (2016a). «Детское легкое» стало взрослым. Intensive Care Med. 42, 663–673. DOI: 10.1007 / s00134-015-4200-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаттинони, Л., Тонетти, Т., Крессони, М., Cadringher, P., Herrmann, P., Moerer, O., et al. (2016b). Причины повреждения легких, связанные с вентилятором: механическая сила. Intensive Care Med. 42, 1567–1575. DOI: 10.1007 / s00134-016-4505-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Герард С. Э., Херрманн Дж., Качка Д. В., Муш Г., Фернандес-Бустаманте А. и Рейнхардт Дж. М. (2020). Сверточные нейронные сети с несколькими разрешениями для полностью автоматизированной сегментации остро поврежденных легких у нескольких видов животных. Med. Изображение Анал. 60: 101592. DOI: 10.1016 / j.media.2019.101592
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джерард, С. Э., Херрманн, Дж., Качка, Д. В., и Рейнхард, Дж. М. (2018). «Перенос обучения для сегментации поврежденных легких с использованием сверточных нейронных сетей от грубого к тонкому», в Анализ изображений движущихся органов, груди и грудной клетки (Гранада: Springer International Publishing), 191–201.
Google Scholar
Горбунова, В., Лол, П., Ашраф, Х., Дирксен, А., Нильсен, М., и де Брюин, М. (2008). Регистрация изображений с сохранением веса для мониторинга прогрессирования заболевания при КТ легких. Med. Image Comput. Comput. Интерв. 11, 863–870. DOI: 10.1007 / 978-3-540-85990-1_104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Güldner, A., Braune, A., Ball, L., Silva, P.L., Samary, C., Insorsi, A., et al. (2016). Сравнительное влияние волютравмы и ателектравмы на воспаление легких при экспериментальном остром респираторном дистресс-синдроме. Крит. Care Med. 44, 1–12. DOI: 10.1097 / CCM.0000000000001721
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Херрманн, Дж., Хоффман, Э. А., Качка, Д. В. (2017). Частотно-избирательная компьютерная томография: приложения при периодических движениях грудной клетки. IEEE Trans. Med. Imaging 36, 1722–1732. DOI: 10.1109 / TMI.2017.2694887
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Херрманн, Дж., Лилитват, В., Таухай, М.Х., Качка Д. В. (2019a). Высокочастотная осцилляторная вентиляция и повреждение легких, вызванное вентилятором: размер имеет значение. Крит. Care Med. 48, e66 – e73. DOI: 10.1097 / CCM.0000000000004073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Херрманн Дж., Таухай М. Х. и Качка Д. В. (2016). Региональный газотранспорт в гетерогенном легком при колебательной вентиляции. J. Appl. Physiol. 121, 1306–1318. DOI: 10.1152 / japplphysiol.00097.2016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Херрманн Дж., Таухай М. Х. и Качка Д. В. (2018). Неоднородность паренхиматозной деформации при колебательной вентиляции: почему две частоты лучше, чем одна. J. Appl. Physiol. 124, 653–663. DOI: 10.1152 / japplphysiol.00615.2017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Херрманн Дж., Таухай М. Х. и Качка Д. В. (2019b). Деформация, скорость деформации и механическая мощность: сравнение оптимизации для колебательной вентиляции. Внутр. j. Нумер. Метод. Биомед. Англ. 35: e3238. DOI: 10.1002 / cnm.3238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хусейн, О., Уолтерс, Б., Строц, Р., Валенсия, П., МакКолл, Д., и Хубмайр, Р. Д. (2013). Биофизические детерминанты повреждения плазматической мембраны альвеолярного эпителия, связанного с механической вентиляцией легких. Am. J. Physiol. Легочная клетка. Мол. Physiol. 305, L478 – L484. DOI: 10.1152 / ajplung.00437.2012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Качка, Д.В., Цао, К., Кристенсен, Г. Э., Бейтс, Дж. Х. и Саймон, Б. А. (2011). Анализ регионарной механики при травме легких у собак с использованием вынужденных колебаний и регистрации трехмерных изображений. Ann. Биомед. Англ. 39, 1112–1124. DOI: 10.1007 / s10439-010-0214-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kaczka, D. W., Herrmann, J., Zonneveld, C. E., Tingay, D. G., Lavizzari, A., Noble, P. B., et al. (2015). Многочастотная колебательная вентиляция в преждевременном легком: влияние на газообмен, механику и распределение вентиляции. Анестезиология 123, 1394–1403. DOI: 10.1097 / ALN.0000000000000898
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kaczka, D. W., and Lutchen, K. R. (2004). Пневматический генератор давления с сервоприводом для измерения импеданса дыхательных путей и высокочастотной вентиляции. Ann. Биомед. Англ. 32, 596–608. DOI: 10.1023 / B: abme.0000019179.87974.7d
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кляйн, С., Старинг, М., Мерфи, К., Вьергевер, М.А., и Плюм, Дж. П. (2010). Elastix: набор инструментов для регистрации медицинских изображений на основе интенсивности. IEEE Trans. Med. Imaging 29, 196–205. DOI: 10.1109 / TMI.2009.2035616
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кнейбер, М. К. Дж., И Маркхорст, Д. Г. (2016). Действительно ли мы знаем, как использовать высокочастотную колебательную вентиляцию легких у тяжелобольных детей? Am. J. Respir. Крит. Care Med. 193, 1067–1068.DOI: 10.1164 / rccm.201512-2418LE
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю С., И, Ю., Ван, М., Чен, К., Хуан, Ю., Лю, Л. и др. (2013). Высокочастотная вентиляция снижает повреждение легких во время высокочастотной колебательной вентиляции у овец с острым респираторным дистресс-синдромом. Анестезиология 119, 398–411. DOI: 10.1097 / ALN.0b013e31829419a6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мид, М.О., Янг, Д., Ханна, С., Чжоу, К., Бахман, Т. Е., Боллен, К. и др. (2017). Выраженность гипоксемии и влияние высокочастотной осцилляторной вентиляции при остром респираторном дистресс-синдроме. Am. J. Respir. Крит. Care Med. 196, 727–733. DOI: 10.1164 / rccm.201609-1938OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мец, К. Т., Кляйн, С., Шаап, М., ван Валсум, Т., и Ниссен, В. Дж. (2011). Нерезкая регистрация данных динамической медицинской визуализации с использованием nD + t B-сплайнов и подхода групповой оптимизации. Med. Изображение Анал. 15, 238–249. DOI: 10.1016 / j.media.2010.10.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ортис Р. М., Силли Р. Э. и Бартлетт Р. Х. (1987). Экстракорпоральная мембранная оксигенация при дыхательной недостаточности у детей. Pediatr. Clin. North Am. 34, 39–46. DOI: 10.1016 / S0031-3955 (16) 36179-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Perchiazzi, G., Rylander, C., Derosa, S., Pellegrini, M., Pitagora, L., Polieri, D., et al. (2014). Региональное распределение податливости легких по результатам анализа компьютерных томограмм. Респир. Physiol. Neurobiol. 201, 60–70. DOI: 10.1016 / j.resp.2014.07.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Подушка, Дж. Дж., Слай, П. Д., Хантос, З., и Бейтс, Дж. Х. (2002). Зависимость амплитуд внутрилегочного давления от механики дыхания при высокочастотной колебательной вентиляции у недоношенных ягнят. Pediatr. Res. 52, 538–544. DOI: 10.1203 / 00006450-200210000-00013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Protti, A., Maraffi, T., Milesi, M., Votta, E., Santini, A., Pugni, P., et al. (2016). Роль скорости деформации в патогенезе отека легких, вызванного вентилятором. Крит. Care Med. 44, e838 – e845. DOI: 10.1097 / CCM.0000000000001718
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Серпа Нето, А., Делиберато, Р. О., Джонсон, А. Э. У., Бос, Л. Д., Аморим, П., Перейра, С. М. и др. (2018). Механическая вентиляция связана со смертностью у пациентов в критическом состоянии: анализ пациентов в двух наблюдательных когортах. Intensive Care Med. 44, 1914–1922. DOI: 10.1007 / s00134-018-5375-6
PubMed Аннотация | CrossRef Полный текст
Скляр, М.С., Фан, Э., и Голигер, Э.С. (2017). Высокочастотная колебательная вентиляция у взрослых с ОРДС: прошлое, настоящее и будущее. Сундук 152, 1306–1317. DOI: 10.1016 / j.chest.2017.06.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смит, Б. Дж., Бартолак-Суки, Э., Суки, Б., Рой, Г. С., Хэмлингтон, К. Л., Шарлебуа, К. М. и др. (2017). Связь утечки газа через гематоэнцефалический барьер, вызванной повреждением аппарата ИВЛ, с нарушениями функции легких у мышей. Перед. Physiol. 8: 466. DOI: 10.3389 / fphys.2017.00466
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Суки, Б., Хантос, З., Дароци, Б., Алкаси, Г., и Надь, С. (1991). Нелинейность и гармонические искажения легких собак, измеренные по низкочастотным вынужденным колебаниям. J. Appl. Physiol. 71, 69–75. DOI: 10.1152 / jappl.1991.71.1.69
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Суки Б. и Лютчен К. Р. (1992). Псевдослучайные сигналы для оценки очевидных функций передачи и когерентности нелинейных систем: приложения к механике дыхания. IEEE Trans.Биомед. Англ. 39, 1142–1151. DOI: 10.1109 / 10.168693
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тонетти Т., Васкес Ф., Рапетти Ф., Майоло Г., Коллино Ф., Ромитти Ф. и др. (2017). Движущее давление и механическая сила: новые цели для предотвращения VILI. Ann. Пер. Med. 5: 286. DOI: 10.21037 / атм.2017.07.08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Венегас, Дж. Г., Цузаки, К., Фокс, Б. Дж., Саймон, Б.А., и Хейлз, К.А. (1993). Региональная связь между грудной стенкой и расширением легких во время HFV: исследование с помощью позитронной визуализации. J. Appl. Physiol. 74, 2242–2252. DOI: 10.1152 / jappl.1993.74.5.2242
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уэлч, П. (1967). Использование быстрого преобразования Фурье для оценки спектров мощности: метод, основанный на усреднении по времени по коротким модифицированным периодограммам. IEEE Trans Audio Electroacoust 15, 70–73.DOI: 10.1109 / TAU.1967.1161901
CrossRef Полный текст | Google Scholar
Веллман, Т. Дж., Винклер, Т., Коста, Э. Л., Муш, Г., Харрис, Р. С., Чжэн, Х. и др. (2014). Влияние местной приливной деформации легких на воспаление у здоровых овец и овец, подвергшихся воздействию липополисахаридов. Крит. Care Med. 42, e491–500. DOI: 10.1097 / CCM.0000000000000346
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Синь, Ю., Середа, М., Хамедани, Х., Пурфати, М., Siddiqui, S., Meeder, N., et al. (2018). Нестабильная инфляция, вызывающая понимание травмы из положения лежа и парных компьютерных томографий. Am. J. Respir. Крит. Care Med. 198, 197–207. DOI: 10.1164 / rccm.201708-1728OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, Q., Suki, B., and Lutchen, K.R. (1995). Гармонические искажения от нелинейных систем с широкополосными входами: приложения к механике легких. Ann. Биомед. Англ. 23, 672–681.DOI: 10.1007 / bf02584464
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао Б., Кристенсен Г. Э., Хён Сонг Дж., Пан Ю., Джерард С. Э., Рейнхардт Дж. М. и др. (2016). «Сохранение объема ткани для регистрации деформируемых изображений для изображений легких с 4DCT», в конференции IEEE Conference on Computer Vision and Pattern Recognition Workshops (CVPRW) (Las Vegas, NV), 41–49.
Google Scholar
Номенклатура
Ассистент радиолога: Общие болезни
Авторы: Schaefer-Prokop, C, Prokop M, Fleischmann D, Herold CJ.
Европейская радиология 2001; 11: 373-392
Этот обучающий файл на основе браузера основан на тексте HRCT Dr.Webb.
Он предлагает широкий спектр случаев, связанных с распространенными паттернами HRCT заболеваний, диффузными заболеваниями легких и их значением, а также клиническими характеристиками.
Это один из лучших образовательных компакт-дисков из когда-либо созданных.
пользователя Hansell DM.
Radiol Clin North Am 2001: 39: 1115-35
Уэбба, Мюллера и Найдича.
Зампатори М., Сверзеллати Н., Полетти В. и др.
Semin Ultrasound CT MR
2005; 20 (3): 176-85
Это совместное заявление Американского торакального общества (ATS) и Европейского респираторного общества (ERS) было принято Советом директоров ATS в июне 2001 г. и Исполнительным комитетом ERS в июне 2001 г.
Кристина Мюллер-Ман, доктор медицины, Клаудиа Гросс, доктор медицины, Катарина Шмид, доктор медицины, Леопольд Штибелленер, доктор медицины, и Александр А.Банкир, Мэриленд
RadioGraphics 2007; 27: 595-615
Авторы: LE Heyneman, S. Ward, DA Lynch, M Remy-Jardin, T. Johkoh и NL Muller
Американский журнал рентгенологии, Том 173, 1617-1622
Сантьяго Э.Росси, доктор медицины, Джереми Дж. Эразмус, доктор медицины, Х. Пейдж МакАдамс, доктор медицины, Томас А. Спорн, доктор медицины и Филип К. Гудман, доктор медицины.
Радиография. 2000; 20: 1245-1259
Раннее нарушение деформации миокарда, оцененное с помощью регионарной спекл-трекинг-эхокардиографии при неопределенной форме болезни Шагаса без фиброза, обнаруженного с помощью магнитного резонанса сердца
Abstract
Болезнь Шагаса (БК) станет причиной 200 000 смертей от сердечно-сосудистых заболеваний во всем мире в течение следующих 5 лет.Раннее выявление хронической кардиомиопатии Шагаса (ХКЧ) представляет собой сложную задачу. Мы стремились проверить, может ли эхокардиография с отслеживанием спеклов (STE) обнаружить зарождающееся повреждение миокарда при БК. МЕТОДЫ. Среди 325 человек с положительными серологическими тестами 25 (возраст 55 ± 12 лет) были отобраны для составления группы с неопределенной формой болезни Шагаса (IFCD) на основании строгих критериев бессимптомности и нормальных результатов ЭКГ / рентгенологических исследований. Эту группу сравнивали с группой из 20 пациентов с CCC (55 ± 11 лет) и группой из 20 неинфицированных субъектов подобранной контрольной группы (NC) (48 ± 10 лет).Пациенты с CD и NC были подвергнуты STE, а пациенты с CD были подвергнуты сердечному магнитному резонансу (CMR) с поздним введением гадолиния для выявления сердечного фиброза с помощью техники позднего усиления. Глобальная продольная деформация (GLS), окружная (GCS) и радиальная деформация (GRS) определялась как среднее значение сегментов, измеренных с трех апикальных проекций (GLS) и коротких осей (GRS и GCS). Продольную деформацию регионарного левого желудочка (LV) (Reg LS) измеряли в каждом из 17 сегментов.Скручивание измерялось как разность систолических пиков между базальным и апикальным ротациями и индексировалось по длине ЛЖ для выражения скручивания. РЕЗУЛЬТАТЫ: общие показатели STE (GLS, GCS, скручивание и скручивание) были снижены в CCC по сравнению с NC (GLS: -14 ± 6,3% против -19,3 ± 1,6%, p = 0,001; GCS: -13,6 ± 5,2% против -17,3 ± 2,8%; p = 0,008; скручивание: 8 ± 7 ° против 14 ± 7 °, p = 0,01 и скручивание: 0,96 ± 1 ° / см против 1,9 ± 1 ° / см, p = 0,005), но не показали различий в IFCD против NC. RegLS был снижен при IFCD по сравнению с NC в четырех сегментах ЛЖ: базальный-нижний (-16,3 ± 3,3% против -18.6 ± 2,2%, p = 0,013), базальный инферосептальный (-13,1 ± 3,4 против -15,2 ± 2,7, p = 0,019), средний инферосептальный (-17,7 ± 3,2 против -19,4 ± 2, p = 0,032) и средний нижнебоковой (-15,2 ± 3,5 против -17,8 ± 2,8, p = 0,014). Эти отклонения в RegLS возникали в отсутствие фиброза миокарда, обнаруживаемого с помощью CMR, почти у 92% пациентов с IFCD, в то время как фиброз миокарда присутствовал у 65% пациентов с CCC. ЗАКЛЮЧЕНИЕ: RegLS выявляет раннее региональное нарушение деформации миокарда, которое не зависит от фиброза у субъектов IFCD.
Информация об авторе
Региональная продольная деформация снижается при IFCD до появления значительного фиброза.По мере того, как CD прогрессирует до CF, общие измерения STE левого желудочка (GLS, GCS, скручивание и скручивание) и GLS правого желудочка снижаются.
Ранний патологический паттерн деформации БК включает нижний, перегородочно-нижний и нижнебоковой сегменты ЛЖ. Распознавание регионального характера деформации кардиомиопатии Шагаса может помочь выявить заболевание даже на ранних стадиях.
Образец цитирования: Romano MMD, Moreira HT, Marin-Neto JA, Baccelli PE, Alenezi F, Klem I, et al. (2020) Раннее нарушение деформации миокарда, оцененное с помощью регионарной спекл-трекинг-эхокардиографии при неопределенной форме болезни Шагаса без фиброза, обнаруженного с помощью магнитного резонанса сердца.PLoS Negl Trop Dis 14 (11): e0008795. https://doi.org/10.1371/journal.pntd.0008795
Редактор: Мелисса Нолан, Университет Южной Каролины, США
Поступила: 8 июня 2020 г .; Одобрена: 14 сентября 2020 г .; Опубликовано: 30 ноября 2020 г.
Авторские права: © 2020 Romano et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: Это исследование финансировалось FAPESP (Fundacao de Apoio a Pesquisa do Estado de Sao Paulo, www.fapesp.br), обрабатывающим гранты 2016 / 25403-9 для JAMN. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Спустя более столетия после открытия в 1909 г. [1] Болезнь Шагаса (БК), вызванная инфекцией простейшими Trypanosoma cruzi , все еще является серьезной проблемой общественного здравоохранения в Латинской Америке [2] и из-за миграция в течение последних десятилетий, также в неэндемичных регионах, таких как США и некоторые европейские страны [3–5].
По оценкам, 50–60% субъектов хронически инфицированы T . cruzi остаются на протяжении всей жизни с неопределенной формой CD (IFCD) i.е. у них нет клинических признаков органического поражения. Хотя концепция IFCD иногда подвергалась сомнению [6], ее определение – применительно к состоянию инфицированного человека, у которого нет симптомов и отклонений при физикальном обследовании, электрокардиографии в 12 отведениях (ЭКГ) и радиологическом исследовании пациента. сердце, пищевод и толстая кишка – это признано временем и поддерживается в последних рекомендациях [7, 8]. В основном это связано с убеждением, что пока инфицированный человек остается с этой неопределенной формой заболевания, прогноз хороший, а риск смерти аналогичен таковому у неинфицированных субъектов из контрольной группы (NC).Напротив, хроническая кардиомиопатия Шагаса (ХКК) является наиболее серьезным из различных клинических проявлений БК, ответственным за высокое бремя заболеваемости и смертности, которое включает наиболее частую причину внезапной смерти и до 11,0% случаев сердечной недостаточности в эндемичных случаях. регионы [2, 9–11].
Два основных вопроса, касающихся МФКР, остаются нерешенными. Первый связан с тем, какие генетические или приобретенные факторы определяют у конкретного пациента установку кардиомиопатии [12, 13]. Во-вторых, будут ли какие-либо анатомические или функциональные отклонения, обнаруженные у лиц с IFCD, предвещать последующее развитие CCC в естественном течении болезни [14].
Вторая проблема особенно актуальна, когда известно, что не было доказано, что этиологическое лечение приносит пользу пациентам уже с CCC [15], тогда как раннее лечение людей с IFCD может быть более многообещающим подходом [14]. Кроме того, в будущем раствор вакцины может быть доступен для использования на людях на основе многообещающих результатов с экспериментальной моделью хронического T на мышах. cruzi , демонстрируя снижение паразитарной нагрузки и поражение сердца [16].В этом контексте диагностические подходы, способные предсказать появление CCC и выявить ранние признаки повреждения миокарда, были бы наиболее полезными, особенно если показано, что они имеют прогностическое значение в естественном течении CD.
Двумерная эхокардиография с отслеживанием спекл-трекинга (STE), метод количественной оценки глобальной и региональной деформации миокарда [17, 18], как было показано, позволяет обнаруживать ранние изменения деформации миокарда при некоторых неишемических кардиомиопатиях [19–21].
Предварительные исследования с участием лиц с IFCD с использованием STE описали смешанные результаты, не продемонстрировав снижения общей деформации ЛЖ, но сообщили о более низких значениях радиальной деформации в среднем и нижнем сегменте у лиц с IFCD по сравнению с пациентами с NC [22].В другом исследовании более низкие продольные скорости, но не деформация, были описаны в небольшой группе из 8 человек без аномалий на ЭКГ в 12 отведениях и с нормальным ЛЖ при эхокардиографии [23]. Кроме того, в подгруппе бессимптомных пациентов с болезнью Шагаса было обнаружено снижение региональной продольной деформации ЛЖ (RegLS) по сравнению со здоровыми людьми в двух сегментах ЛЖ [24]. Однако эти результаты не были подтверждены другим исследованием пациентов с CD, но без доказательств сердечного вовлечения, в котором глобальная и сегментарная деформация ЛЖ была аналогична таковой у пациентов с NC; в этом исследовании более низкая RegLS, глобальная продольная, радиальная и окружная деформация ЛЖ появилась только в подгруппе пациентов с БК, у которых фиброз миокарда обнаружен с помощью магнитно-резонансной томографии сердца (МРТ) [25].
Мы предположили, что RegLS или глобальная элевация ST могут выявить раннюю дисфункцию миокарда при IFCD. Таким образом, цели этого исследования заключались в следующем: (1) сравнить систолические общие (продольные (GLS), радиальные (GRS) или окружные (GCS)) значения систолического LV и RegLS между людьми с IFCD, NC соответствующего возраста и пациентами с CCC; и (2) наблюдать, коррелирует ли аномалия деформации ЛЖ с наличием и степенью фиброза миокарда, измеренная с помощью магнитно-резонансной томографии сердца (МРТ).
Методы
Дизайн исследования
Это поперечное исследование было разработано для сравнения значений деформации желудочков у субъектов Шагаса (IFCD и CCC) и лиц с NC соответствующего возраста.Расчет размера выборки был основан на предполагаемой 15% разнице в значениях глобальной продольной деформации ЛЖ между тремя группами и привел к оценке 23 человек в каждой исследуемой группе [26].
Исследуемая популяция
Для создания группы IFCD были привлечены лица с положительной серологией на CD и без симптомов сердечного заболевания, нормальной ЭКГ и нормальной рентгенограммой грудной клетки для поиска в медицинских записях больниц в течение 2015–2016 годов. Критерии включения: два положительных серологических теста на CD, возраст ≥18 лет.Критерии исключения: возраст ≥ 85 лет; наличие любых других сердечно-сосудистых заболеваний, ограничивающие двигательные нарушения сердечные тесты; артериальная гипертензия; серьезные психические заболевания, почечная недостаточность или цирроз печени. Пациенты, которым уже был поставлен диагноз ССС, были последовательно включены в амбулаторные клиники Университетской больницы Медицинской школы Рибейран-Прету Университета Сан-Паулу, Бразилия. Здоровые добровольцы, которые по возрасту и полу соответствовали лицам МФКР, были приглашены к участию и прошли серологические тесты на БК, которые во всех случаях дали отрицательные результаты.Все набранные пациенты прошли стандартную ЭКГ в 12 отведениях, рентген грудной клетки в вертикальном положении и трансторакальную эхокардиографию в покое. Субъекты с CD прошли CMR в тот же день эхокардиографии. Волонтеры NC были сданы на те же экзамены, за исключением CMR. Все аномалии ЭКГ, такие как полная блокада правой ножки пучка Гиса (БПНПГ), полная блокада левой ножки пучка Гиса (БЛНПГ) и блокада переднего левого пучка Гиса (ППНПГ), были определены в соответствии с ранее опубликованными рекомендациями (20). Любой вид атриовентрикулярной блокады классифицировался просто как «AV-блокада».
Институциональный комитет по этике исследований одобрил протокол исследования (номер процесса HCRP 17096/2015 ), которое проводилось в соответствии с Хельсинкской декларацией. Письменное информированное согласие было получено от всех участников.
Эхокардиография
Все изображения трансторакальной эхокардиографии были собраны проспективно, чтобы гарантировать наилучшее качество изображения, тем же сертифицированным эхокардиографом (PB), который был обучен получать полную традиционную эхокардиографию и последовательности изображений, предназначенные для анализа отслеживания спеклов, включая скручивание и скручивание левого желудочка (LV) .Изображения были получены с помощью Vivid E9 или S6 (GE Healthcare, Хортен, Норвегия) с преобразователем с фазированной решеткой 1,4–4,6 МГц. Получение изображений строго следовало ранее опубликованным руководствам [27, 28]. Вкратце, изображения апикальной части ЛЖ были получены на максимально длинной оси ЛЖ, что позволило избежать укорочения ЛЖ; Изображения короткой оси ЛЖ были получены на уровне базальной, сосочковой мышцы и верхушки. Уровень апекса определялся как наиболее апикальная возможная короткая ось на основе апикальной четырехкамерной проекции. Изображения были записаны с ЭКГ по крайней мере в трех последовательных сердечных циклах при спокойном дыхании.Все изображения были получены с частотой 55–90 кадров / сек.
Изображения были заархивированы как специальные исходные данные GE и проанализированы другим исследователем (MMDR), не зависящим от исследуемой группы, с помощью программного обеспечения EchoPac (GE Vingmed Ultrasound AS) версии 112.
Обычные эхокардиографические размеры и функция левого (LV) и правого (RV) желудочков были собраны следующим образом: линейный поперечный размер LV в диастоле и систоле (LVDd, LVDs), продольный размер измерен как среднее значение продольных линейных размеров в двухкамерной проекции. и четырехкамерные представления, конечный диастолический объем (LV EDV), конечный систолический объем (LV ESV) и фракция выброса (LVEF), полученные из модифицированного правила Симпсона [29]; Линейные поперечные размеры ПЖ на базальном уровне апикальной четырехкамерной проекции и систолическая скорость доплеровского трикуспидального кольца (S ’).Оценка движения стенки левого желудочка была рассчитана на основе режима сегментации из 17, как описано ранее [30].
Анализ деформации при двумерной эхокардиографии
Один опытный врач (MMDR) выполнил все двухмерные анализы деформации, используя три апикальных проекции ЛЖ, 4-камерный специальный вид ПЖ и вид короткой оси ЛЖ на базальном, срединно-папиллярном и апикальном уровнях. По возможности для анализа выбирали второй из трех полученных сердечных циклов. Все измерения деформации были собраны как «полная толщина» (или мезо) миокарда, и были измерены значения конечной систолической деформации (ESS), избегая измерения постсистолической деформации.Контрольная точка времени была вручную установлена на начало QRS. Конечная систола [31] определялась во время закрытия аорты по допплеровскому сигналу скорости в тракте оттока ЛЖ при измерении деформации ЛЖ и во время закрытия клапана легочной артерии по допплеровскому сигналу тракта оттока ПЖ при измерении деформации ПЖ. Эндокардиальную границу прослеживали в конце систолы, а интересующую область корректировали, чтобы исключить перикард. Проверяли целостность отслеживания, а также целостность кривых деформации и измеренных пиков.Сегменты с постоянно неадекватным отслеживанием были исключены из анализа. Максимум 2 исключенных сегмента считался допустимым для ЛЖ и 1 сегмент для 4-камерного анализа деформации правого желудочка.
Продольная деформация (ЛЖ и ПЖ) была измерена как конечная систолическая деформация (ESS) от полноразмерного миокарда, который по умолчанию назван средним слоем в программном обеспечении GE EchoPac. Глобальная продольная деформация (GLS) автоматически измерялась системой как среднее из 17 значений сегментарной деформации из трех проекций ЛЖ в апикальной проекции.Аналогичным образом собирали сегментарную деформацию ЛЖ из каждого из 17 сегментов ЛЖ. Окружная и радиальная деформация также измерялась как ESS. Глобальная окружная (GCS) и радиальная деформация (GRS) была рассчитана как среднее значение каждого сегмента из 18-сегментной модели, полученной из изображений короткой оси в базальном (6 сегментов), среднем (6 сегментов) и апикальном (6 сегментах) Уровни LV. Все значения деформации были выражены в% изменений. Величину скручивания ЛЖ собирали по полученной кривой апексно-базальной ротации. Конечный систолический пик полученной кривой вычитания был измерен вручную с использованием метки времени закрытия аортального клапана в качестве точки отсчета времени в программном обеспечении.Величина скручивания выражалась в градусах и делилась на продольный размер ЛЖ для построения величины скручивания, первая выражалась в градусах / см [32].
Магнитный резонанс сердца
Магнитно-резонансные изображения сердца были получены от всех субъектов Шагаса (группы IFCD и CCC) в тот же день, что и запись эхокардиографии. Кинопетли были получены с использованием установившейся последовательности импульсов свободной прецессии, стробируемой с помощью ЭКГ, полученной с помощью сканера 1,5 Тесла Achieva (Philips, Нидерланды), с заранее определенным протоколом, следующим образом: время повторения 3.8 мс, время эхо-сигнала 6 мс, угол поворота 45 °, 30 фаз сбора данных, матрица 256×160 и поле обзора 360–400 мм. LV и RV анализировали на коротких осевых срезах (толщина 8 мм, зазор между срезами 2 мм). Для оценки ткани миокарда и выявления фиброза субъекты получали контраст на основе гадолиния 0,2 ммоль / кг (Ominiscan, GE Healthcare) путем внутривенной инфузии. Последовательность импульсов быстрого градиентного эхо-сигнала с восстановлением инверсии, взвешенная по T1, применялась через 10 мин после введения контраста. Для выявления усиления гадолиния использовали срезы LV толщиной 10 мм без зазора.Экзамены были записаны в шаблон DICOM в HCRP-Brazil. Изображения были переданы в специальное программное обеспечение для чтения (Duke precession Saas) в соответствии с рекомендациями HIPPA по конфиденциальности и деидентифицированы для слепого анализа. Два опытных врача отвечали за считывание изображений CMR (IK, SD), не обращая внимания как на данные эхокардиографии, так и на группу субъектов. Метод суммирования диска Симпсона использовался для определения объемов желудочков и фракции выброса из срезов по короткой оси. Отток жилого автофургона в объемы автофургона не вошел.Границы эндокарда очерчивали вручную, исключая сосочковые мышцы и трабекулы. Чтобы обнаружить рубец миокарда, сигнал гиперусиления оценивался визуально с использованием 17-сегментной модели с пятибалльной шкалой для каждого сегмента, в которой 0 = нет гиперусиления, 1 = 1–25%, 2 = 26–50%. , 3 = 51–75% и 4 = 76–100%. Мы рассчитали общий размер рубца ЛЖ (% миокарда) путем суммирования региональных баллов и деления на общее количество проанализированных сегментов (n = 17). Регистрировали процентное соотношение любого количества рубца (> 0%) на любой стене (% LV) для групп IFCD и CCC Chagas.
Воспроизводимость
Параметры деформации эхокардиографии GLS, GCS, GRS и RegLS были протестированы на воспроизводимость в подгруппе из 15 субъектов, случайно выбранных пропорционально трем исследуемым группам (IFCD, CCC и NC). Для вариабельности внутри наблюдателя, повторное считывание (MMDR) было выполнено по крайней мере через месяц после первого считывания, без учета предыдущего. Что касается вариабельности между наблюдателями, второй опытный врач-эхокардиограф (FA) выполнил анализ, используя ту же методику, описанную ранее, также не обращая внимания как на анализ первого читателя, так и на отдельную группу исследования.Сравнение результатов проводилось с использованием внутриклассового коэффициента корреляции (ICC) для оценки абсолютного согласия и коэффициента вариации (CV), определяемого стандартным отклонением, деленным на среднее значение и выраженным в процентах.
Статистический анализ
Расчет размера выборки проводился стандартными методами [26]. Данные были выражены как среднее ± стандартное отклонение. Непрерывные данные были проверены на нормальность распределения с помощью тестов Шапиро-Уилка и на равную дисперсию с тестами Барлетта.Данные между группами (NC против IFCD против CCC) сравнивали с использованием дисперсионного анализа (ANOVA) с последующим попарным анализом Tuckey post-hoc. При необходимости использовали t-критерий Стьюдента, критерий хи-квадрат или критерий Краскела-Уоллиса. Корреляцию между средним уровнем GLS ЛЖ или GLS ПЖ и процентом фиброза оценивали с помощью коэффициента корреляции Пирсона. Уровень значимости был установлен как p <0,05. Все статистические анализы были выполнены с использованием Stata 14.0 (StataCorp, College Station, TX).
Результаты
Популяционный скрининг лиц IFCD описан в блок-схеме ( Рис. 1 ).Мы изучили истории болезни всех 325 последовательных бессимптомных субъектов с положительными серологическими тестами Шагаса, оцененных в нашем учреждении с 1 января 2015 года по 31 декабря 2016 года. После критериев исключения, показанных на рис. , , была составлена группа IFCD. 25 человек. Другая подгруппа из 20 последовательно прошедших скрининг пациентов с болезнью Шагаса и клиническими признаками поражения сердца составила группу CCC.
Исходные характеристики 20 пациентов с CCC, 25 пациентов с IFCD и 20 пациентов из нормальной контрольной группы (NC) описаны в таблице 1 .Демографические и большинство клинических характеристик были сопоставимы между тремя группами, но класс NYHA> 1, отклонения ЭКГ и кардиомегалия были обнаружены только в группе CCC.
Стандартные эхокардиографические параметры и параметры деформации, проанализированные в 3 группах, показаны в Таблице 2 . При сравнении групп NC и IFCD стандартные переменные эхокардиографии не различались статистически, за исключением незначительного увеличения конечного систолического диаметра ЛЖ (3,0 ± 0,5 против 2).8 ± 0,4 (р = 0,023).
Глобальные параметры штамма GLS и GCS как из LV, так и из правого желудочка также были сходными между людьми в группах IFCD и NC. GRS был ниже в группе IFCD по сравнению с группой NC (28,4 ± 14,6 против 34,2 ± 10,3; p = 0,043), и наблюдалась тенденция к снижению в группе CCC по сравнению с группой NC (25,8 ± 15,4 против 34,2 ± 10,3; р = 0,058). У лиц с CCC было меньше GLS и GCS, скручивания и скручивания по сравнению с группой NC. У этих пациентов с CCC также были более низкие значения GLS ПЖ как с четырехкамерной точки зрения, так и со стороны свободной стенки ПЖ.( Таблица 2, Рис. 2 и Рис. 3)
Рис. 2. Общий штамм от LV (GLS, GCS, GRS) и RV (свободная стенка) GLS в группах IFCD и CCC.
На рис. 2 показаны медианные значения GLS, GCS, GRS и RV GLS для каждой исследуемой группы (NC, IFCD и CCC). Все показатели глобальной деформации ЛЖ и ПЖ выражают тенденцию к снижению от NC до IFCD и до CCC. IFCD = неопределенная форма болезни Шагаса; CCC = хроническая кардиомиопатия Шагаса; LV = левый желудочек; RV = правый желудочек; GLS = общая продольная деформация; GCS = общая окружная деформация; GRS = общая радиальная деформация.p-значение сравнения NC и IFCD.
https://doi.org/10.1371/journal.pntd.0008795.g002
Рис. 3. Скручивание LV (панель A) и кручение (панель B) между группами.
На рис. 3 показаны медианные значения скручивания (панель A) и кручения (панель B) с тенденцией к снижению от NC к IFCD и к CCC. p-значение сравнения NC и IFCD.
https://doi.org/10.1371/journal.pntd.0008795.g003
По сравнению с группой NC, у субъектов IFCD было значительно снижено RegLS в сегментах 3 (базальный нижне-перегородочный), 4 (базальный-нижний), 9 (средний нижний сегмент перегородки) и 11 (средний нижний сегмент перегородки) (, таблица 3, ).Снижение RegLS было еще более выраженным у пациентов с CCC для всех сегментов, за исключением 2 (базальный передне-перегородочный), 6 (базальный переднебоковой) и 8 (средний передне-перегородочный) (, таблица 3) .
Фиброз миокарда был количественно определен у 36 из 45 пациентов с CD (IFCD + CCC). Фиброз выявлен у 12 из них (2 человека (8%) из группы IFCD и у 10 пациентов (65%) из группы CCC). Среди лиц с CD не было значительных различий в демографических характеристиках между людьми с фиброзом или без него.По сравнению с пациентами без фиброза, люди с фиброзом имели значительно более высокий диаметр ЛЖ (5,2 ± 0,9 против 4,5 ± 0,5; p = 0,013) и систолическую функцию нижнего левого желудочка (ФВЛЖ: 45,7 ± 13,7 против 59,6 ± 6,8, p = 0,001). Пациенты без фиброза имели значительно более высокие значения GLS (-18,5 ± 3,4 против -14,0 ± 5,8, p = 0,006) по сравнению с пациентами с обнаруженным фиброзом. Однако GCS, GRS, скручивание и кручение между ними не различались ( Таблица 4 ). Фиброз был более распространен в среднем нижнебоковом, базальном нижнебоковом и верхушечном сегментах.
Хотя между GLS и фиброзом была статистически значимая корреляция (r = 0,625, p <0,001) во всей группе пациентов с CD (IFCD и CCC), она не была линейной (, рис. 4, ). На графике не обнаруживается значительного фиброза, даже если уровень GLS ниже нормального (пунктирная линия) для этого программного обеспечения, и только заметное снижение GLS позволяет идентифицировать пациентов со значительной степенью фиброза (, рис. 4, ).
На фиг. 5 показаны иллюстративные субъекты с IFCD и CCC, показывающие, как RegLS снижается в нижнем и заднем сегментах пациента с IFCD даже без фиброза миокарда; эта аномалия RegLS еще более выражена у пациентов из группы CCC и в данном случае топографически связана с фиброзом.
Рис. 5. Наглядные примеры субъектов с IFCD (панели A и B) и CCC (панели C и D).
Панели A и C показывают RegLS в виде “яблочка”. На нижних панелях (B и D) представлены значения движения стенки (слева) и гиперусиление (фиброз) справа. Этот субъект IFCD (панели A и B) показывает снижение RegLS даже без фиброза миокарда при LGE. Субъект CCC (C и D) показывает худшие значения RegLS, и имеется топографическая корреляция с фиброзом.
https: // doi.org / 10.1371 / journal.pntd.0008795.g005
Воспроизводимость
Значения изменчивости GLS, GCS, GRS и твиста внутри наблюдателя оценивались с помощью коэффициента внутриклассовой корреляции (ICC) следующим образом: 0,99, 0,90, 0,86 и 0,97. ICC для изменчивости GLS, GCS, GRS и твиста между наблюдателями составляли 0,99, 0,89, 0,86 и 0,98. Вариабельность RegLS у разных наблюдателей варьировала от 0,43 (апикальный латеральный сегмент) до 0,91 (средний нижний сегмент).
Обсуждение
Фундаментальная гипотеза исследования о том, что STE может идентифицировать раннее глобальное или региональное поражение миокарда у людей на ранних стадиях CD, была подтверждена открытием, что RegLS действительно снижается в четырех сегментах LV (базальный нижний, базальный нижний -септальный, средний нижне-перегородочный и средний нижнебоковой) в группе IFCD, несмотря на отсутствие каких-либо других доказательств дисфункции LV (LVEF, GLS или GCS) или фиброза, обнаруженного с помощью CMR.Насколько нам известно, это первое исследование, показывающее аномальный характер деформации при раннем поражении миокарда у лиц с IFCD, у которых нет определяемого фиброза. Глобальные показатели анализа деформации миокарда при МФКР не нарушались. Однако у пациентов с ССС почти все сегменты ЛЖ показали заметно сниженный RegLS, а нарушение деформации миокарда коррелирует с наличием регионарного фиброза.
Сравнение наших результатов с результатами предыдущих предварительных исследований с использованием STE в контексте CD затруднено из-за различий в выборке популяций и технических подходов.Например, результаты снижения RegLS на ранних стадиях CD, представленные здесь, частично согласуются с данными, сообщенными Barbosa et al, о снижении RegLS в двух сегментах ЛЖ (базально-нижнем и нижне-перегородочном) по сравнению с NC [ 24]. Соответствие наблюдается, несмотря на тот факт, что результаты аномалий деформации в их исследовании не коррелировали с каким-либо анализом характеристик ткани и этот метод измерения деформации, если он общий или систолический пик, не был описан. Напротив, Gomes et al измерили общую, но не систолическую пиковую деформацию, и не обнаружили значительных различий в каком-либо региональном параметре деформации между людьми с IFCD и NC [25].Однако при оценке небольшой подгруппы из 7 пациентов с IFCD с фиброзом, обнаруженным с помощью CMR, они обнаружили снижение RegLS в базальном сегменте нижней перегородки, хотя эта аномалия была связана со снижением GLS, GCS и GRS в этой подгруппе. Даже с учетом того, что их выборка IFCD включала небольшую группу (4,8%) пациентов с левой передней фасцикулярной блокадой, которые не могли быть охарактеризованы как имеющие IFCD по строгим критериям нормальной ЭКГ, не было различий в RegLS между группами.Фактически, дефекты проводимости изменяют региональные паттерны деформации [33], и выбор авторов для измерения глобального пика вместо систолического пика может объяснить такие отличия от наших данных. При измерении систолического пика в соответствии с рекомендациями специалистов по напряжению [31, 34] региональные различия были очевидны в нашем исследовании.
Важно подчеркнуть, что результаты нашего исследования, подкрепляющие предыдущие данные, которые показали, что индексы деформации глобальной деформации миокарда ЛЖ GLS и GCS все еще сохраняются в предположительно ранних фазах CD [22, 24, 25], косвенно подтверждаются более недавнее поперечное исследование пациентов с различными стадиями кардиомиопатии Шагаса, проведенное Echeverría et al.Они также сообщили, что значение GLS с порогом -20,5% может выявить начало изменений миокарда, несмотря на то, что это не низкое значение нормальности в большинстве специализированных программ [35].
ИзмеренияSTE в нашем исследовании строго контролировались. Это первое исследование с использованием STE у пациентов с CD, которое строго следовало недавно опубликованному стандартизированному документу для измерения деформации миокарда [34]. Значения деформации измерялись как конечный систолический (ESS) пик, а время ESS определялось как время закрытия аортального клапана по доплеровскому сигналу при измерении параметров LV и как время до закрытия клапана легочной артерии при измерении параметров RV.В отличие от нашего исследования, определения времени измерения пиковой деформации не всегда согласовывались в предыдущих отчетах о CD [22, 24, 25]. Мы предполагаем, что, учитывая высокую распространенность нарушений проводимости у пациентов с БК [36], точные систолические временные определения могут иметь большое влияние на измерения деформации, так что этот фактор, возможно, способствовал объяснению некоторых противоречивых результатов, полученных в различных исследованиях [ 37].
Измерение GRS дало более противоречивые данные в исследованиях пациентов с различными формами CD [22].Результаты нашего исследования могут быть связаны с большим стандартным отклонением этого параметра, а также с различными техническими факторами, которые могут влиять на значения GRS. Хотя метод STE считается независимым от угла, он все же зависит от качества изображения. Измерения спеклов можно проводить в любом направлении, но размер спеклов не является однородным в каждой области двумерных эхокардиографических изображений из-за латерального разрешения. При визуализации ЛЖ из апикального окна для измерения продольной деформации влияние латерального разрешения может не иметь такого же значения, как в боковых и перегородочных сегментах изображений короткой оси.Сложность оценки спеклов на боковых сторонах изображения сектора увеличивается из-за того, что радиальная деформация измеряется как смещение спеклов относительно центральной контрольной точки в полости ЛЖ. Все эти факторы могут играть важную роль в интерпретации изменчивости данных радиальной деформации, как обсуждалось выше.
Это исследование также показывает, что значения скручивания и скручивания ЛЖ снижаются только при поздних формах БК, тогда как предыдущие данные, представленные Гарсиа-Альваресом и соавторами для небольшой подгруппы из 9 пациентов с IFCD, показали снижение значений скручивания по сравнению с контрольной группой [22]. .Напротив, наши результаты согласуются с результатами Lima et al, которые не показали разницы в скручивании или скручивании при IFCD по сравнению с NC [23]. Однако эти авторы не обнаружили аномальных значений скручивания или скручивания в своей группе пациентов с CCC, что, возможно, объясняется возрастными различиями в группах. Рассматривая скручивание как выражение циркулярной деформации как основания, так и верхушки ЛЖ, этот параметр, вероятно, больше зависит от работы периферических миокардиальных волокон, которые преимущественно расположены в средней стенке миокарда [28, 32].Поскольку средняя стенка является основным местом фиброза при CD [38], понятно, что скручивание и перекручивание могут быть аномальными у пациентов с CCC, как обнаружено в нашем исследовании, но не при IFCD, когда GCS все еще сохраняется.
Было показано, что фиброз миокарда, обнаруженный с помощью CMR, имеет прогностическое значение у пациентов с CCC [39, 40]. Однако наши результаты позволяют предположить, что нарушение регионарной деформации миокарда на ранних стадиях БК возникает до фиброза миокарда. За это могут быть ответственны другие механизмы повреждения миокарда, такие как отек или воспаление, аналогично тому, о чем сообщалось при других кардиомиопатиях [37, 41].Исследования на экспериментальной модели ССС у хомяков показали, что ранняя региональная систолическая дисфункция ЛЖ коррелирует с воспалением, но не с фиброзом миокарда [42]. Примечательно, что какими бы ни были лежащие в основе механизмы, ответственные за это, региональная дисфункция миокарда, выраженная индексом сегментарной оценки движения стенки (WMSi), была значимо и независимо связана со смертью у 1508 пациентов с ССС, наблюдаемых в течение 5,4 лет в исследовании BENEFIT. [30].
Важное соображение относительно наших результатов заключается в том, что меньшее количество людей (8%) с IFCD имели фиброз миокарда по сравнению с ранее сообщенными данными из других серий IFCD (12-27% субъектов) [43].Эти расхождения могут быть вызваны несколькими причинами. В отличие от других описанных серий, в которые пациенты были набраны из кардиологических клиник или специализированных третичных центров [24, 44], в нашем исследовании предметы были выбраны из широкой популяции (n = 325) серологически положительных, но бессимптомных субъектов, которые не были пациентами. любой кардиологической клиники. Более того, они были объектами серологического тестирования на CD из-за менее угрожающих условий, таких как предоперационная оценка, сдача крови или другая некардиологическая ситуация.Кроме того, уместно подчеркнуть, что в некоторых исследованиях с использованием STE IFCD не был полностью охарактеризован в соответствии с классическим определением [24, 25]. Это контрастирует с нашей более строгой методологией отбора субъектов с МФКР; клинические критерии при отборе пациентов с IFCD были строго соблюдены, такие как полностью нормальная ЭКГ и рентгенография грудной клетки.
Клинические последствия
Распознавание аномального паттерна региональной деформации при CD может помочь в обнаружении сердечного поражения даже на ранних стадиях заболевания.Может быть полезно идентифицировать эту сущность в группе пациентов с подозрением на неишемическую кардиомиопатию, которые все еще представляют диагностическую проблему [45], в основном в неэндемичных странах, где серологическое тестирование не используется в качестве скрининга.
Раннее обнаружение регионального повреждения миокарда может помочь в разработке стратегии последующего наблюдения и ведения этой группы пациентов с БК. Поскольку региональное поражение миокарда было прогностическим в этой популяции, стратегии лечения в будущем могут определяться оценкой RegLS.
Ограничения
Мы понимаем, что размер выборки является ограничением. Тем не менее, мы основывали размер выборки на основной гипотезе исследования и следовали заранее разработанным строгим критериям для скрининга 325 субъектов и отбора группы из 25 человек из МФКР.
Произошла значительная, но случайная потеря данных CMR для анализа фиброза. Хотя все пациенты с CD были проспективно изучены с помощью CMR в один и тот же день эхокардиографии, что является важным и дорогостоящим аспектом исследования, по-прежнему доля 38% в группе CCC и 23%.3% в группе IFCD не смогли пройти оценку фиброза из-за технических проблем с полученными изображениями. Кроме того, в этом исследовании не проводилась оценка отека и воспаления с помощью изображений CMR, чтобы проверить гипотезу о раннем нарушении индексов деформации, связанном с этими патологическими изменениями, а не с фиброзом.
Наконец, поперечный дизайн исследования не позволяет делать выводы о прогностической важности паттерна RegLS на ранних стадиях CD.Для ответа на этот вопрос необходимо провести дальнейшие исследования с конкретным дизайном. Вскоре должны появиться результаты продолжающегося такого исследования [46].
Выводы
RegLS снижается в нижне-перегородочном, нижнем и нижнебоковом сегментах ЛЖ у пациентов с IFCD при отсутствии нарушения общих показателей деформации миокарда и выявляемого фиброза миокарда. Пациенты с CCC имели заметно аномальный характер деформации, связанный с уменьшением GLS ЛЖ, GCS, скручивания и скручивания, а также GLS правого желудочка.
Перспективы
Хроническая кардиомиопатия, вызванная болезнью Шагаса, является наиболее распространенной из неишемических кардиомиопатий в эндемичных странах Латинской Америки, и из-за миграционных потоков в течение последних десятилетий ее распространенность увеличивается также в Северной Америке и Европе. RegLS снижается у субъектов с IFCD еще до фиброза миокарда или любых других признаков поражения сердца. В группе пациентов с ССС наблюдается нарушение глобальных индексов деформации со стороны ЛЖ, таких как GLS и GCS, скручивание и скручивание, а также GLS ПЖ.
Список литературы
- 1. Марин-Нето Дж. А., Расси А. Младший. Последние сведения о болезни сердца Шагаса в первую столетнюю годовщину ее открытия. Rev Esp Cardiol. 2009. 62 (11): 1211–6. pmid: 19889330.
- 2. Исследование глобального бремени болезней C. Глобальная, региональная и национальная заболеваемость, распространенность и годы, прожитые с инвалидностью для 301 острого и хронического заболевания и травмы в 188 странах, 1990–2013 гг .: систематический анализ для исследования глобального бремени болезней 2013 г.Ланцет. 2015; 386 (9995): 743–800. pmid: 26063472; PubMed Central PMCID: PMC4561509.
- 3. Берн С., Монтгомери С.П. Оценка бремени болезни Шагаса в США. Clin Infect Dis. 2009; 49 (5): e52–4. pmid: 19640226.
- 4. Рекена-Мендес А., Альдасоро Е., де Лаццари Е., Сикури Е., Браун М., Мур Д.А. и др. Распространенность болезни Шагаса среди латиноамериканских мигрантов, проживающих в Европе: систематический обзор и метаанализ. PLoS Negl Trop Dis. 2015; 9 (2): e0003540.pmid: 25680190; PubMed Central PMCID: PMC4332678.
- 5. Hotez PJ. Рост забытых тропических болезней в «новом Техасе». PLoS Negl Trop Dis. 2018; 12 (1): e0005581. pmid: 29346369; PubMed Central PMCID: PMC5773009.
- 6. Марин-Нето Ж.А., Алмейда Филхо О.К., Пазин-Филхо А, Масиэль BC. [Неопределенная форма болезни Шагаса. Предложение новых диагностических критериев и перспектив раннего лечения кардиомиопатии. Arq Bras Cardiol. 2002. 79 (6): 623–7. pmid: 12532246.
- 7. Андраде Дж. П., Марин-Нето Дж. А., Паола А. А., Вилас-Боас Ф., Оливейра Г. М., Бакал Ф. и др. [I Латиноамериканские рекомендации по диагностике и лечению кардиомиопатии Шагаса]. Arq Bras Cardiol. 2011; 97 (2 Приложение 3): 1–48. pmid: 21952638.
- 8. Диас JC, Диас E, Nobrega GC. Длительное наблюдение за пациентом после острой фазы болезни Шагаса (южноамериканский трипаносомоз): дальнейшее лечение и излечение от инфекции. Rev Soc Bras Med Trop. 2015; 48 (5): 629–32.pmid: 26516979.
- 9. Трэйна М.И., Эрнандес С., Санчес Д.Р., Дюфани Дж., Салих М., Абухамида А.М. и др. Распространенность болезни Шагаса среди иммигрантов из Латинской Америки в США с нарушениями проводимости на электрокардиограмме. PLoS Negl Trop Dis. 2017; 11 (1): e0005244. pmid: 28056014; PubMed Central PMCID: PMC5242541.
- 10. Перес-Молина Ю.А., Молина И. Болезнь Шагаса. Ланцет. 2018; 391 (10115): 82–94. Epub 2017/07/05. pmid: 28673423.
- 11. Echeverria LE, Morillo CA.Американский трипаносомоз (болезнь Шагаса). Заражение Dis Clin North Am. 2019; 33 (1): 119–34. Epub 2019/02/05. pmid: 30712757.
- 12. Марин-Нето Дж. А., Расси А. Младший, Симоэс М. В., Масиэль BC, Шмидт А. Шагас Болезнь сердца. В: Yusuf S, Cairns JA, Camm AJ, Fallen EL, Gersh BJ, редакторы. Доказательная кардиология 2010. п. 18.
- 13. Расси А. мл., Расси А., Марин-Нето Я. Болезнь Шагаса. Ланцет. 2010. 375 (9723): 1388–402. pmid: 20399979
- 14. Расси А. младший, Марин ЯН, Расси А. Хроническая кардиомиопатия Шагаса: обзор основных патогенных механизмов и эффективности этиологического лечения после исследования BENznidazole Evaluation для прерывания трипаносомоза (BENEFIT). Mem Inst Oswaldo Cruz. 2017; 112 (3): 224–35. pmid: 28225900; PubMed Central PMCID: PMC5319366.
- 15. Morillo CA, Марин-Нето Дж. А., Авезум А., Соса-Эстани С., Расси А. мл., Росас Ф. и др. Рандомизированное исследование бензнидазола при хронической кардиомиопатии Шагаса. N Engl J Med.2015. 373 (14): 1295–306. pmid: 26323937.
- 16. Барри М.А., Верстег Л., Ван К., Поллет Дж., Жан Б., Гусовский Ф. и др. Прототип терапевтической вакцины индуцирует защитный иммунитет и снижает сердечный фиброз на мышиной модели хронической инфекции Trypanosoma cruzi. PLoS Negl Trop Dis. 2019; 13 (5): e0007413. pmid: 31145733; PubMed Central PMCID: PMC6542517 человек против болезни Шагаса. FG работает в Eisai Inc, которая намеревается продвигать E6020 в качестве адъюванта вакцины.
- 17.Дален Х., Торстенсен А., Аасе С.А., Ингул С.Б., Торп Х., Ваттен Л.Дж. и др. Сегментная и глобальная продольная деформация и скорость деформации на основе эхокардиографии 1266 здоровых людей: исследование HUNT в Норвегии. Eur J Echocardiogr. 2010. 11 (2): 176–83. pmid: 19946115.
- 18. Такамура Т., Дохи К., Ониши К., Сакураи Ю., Итикава К., Цудзи А. и др. Обратимая региональная неоднородность левого желудочка, количественно определенная с помощью смещения спекл-трекинга и визуализации деформации у пациентов с острой тромбоэмболией легочной артерии.J Am Soc Echocardiogr. 2011. 24 (7): 792–802. pmid: 21481566.
- 19. Урбано-моральный Дж. А., Роуин Е. Дж., Марон М. С., Крин А., Пандиан Н. Г.. Исследование общей и региональной механики миокарда с помощью трехмерной спекл-трекинг-эхокардиографии и взаимосвязи с гипертрофией и фиброзом при гипертрофической кардиомиопатии. Circ Cardiovasc Imaging. 2014; 7 (1): 11–9. pmid: 24275954.
- 20. Казелли С., Марон М.С., Урбано-Морал Дж. А., Пандиан Н. Г., Марон Б. Дж., Пелличча А. Дифференциация гипертрофии левого желудочка у спортсменов от гипертрофии у пациентов с гипертрофической кардиомиопатией.Am J Cardiol. 2014; 114 (9): 1383–9. pmid: 25217454.
- 21. Попович З.Б., Квон Д.Х., Мишра М., Буахамсри А., Гринберг Н.Л., Тамиларасан М. и др. Связь между региональной функцией желудочков и фиброзом миокарда при гипертрофической кардиомиопатии, оцененная с помощью эхокардиографии с отслеживанием спекл-трекинга и магнитно-резонансной томографии с отложенным усилением. J Am Soc Echocardiogr. 2008. 21 (12): 1299–305. pmid: 172.
- 22. Гарсия-Альварес А., Ситжес М., Регейро А., Поятос С., Хесус Пиназо М., Посада Е. и др.Анализ деформации миокарда при болезни сердца Шагаса с использованием спекл-трекинг-эхокардиографии. J Card Fail. 2011. 17 (12): 1028–34. Epub 2011/11/30. pmid: 22123367.
- 23. Лима М.С., Вильяррага Х.Р., Абдуч М.С., Лима М.Ф., Круз С.Б., Биттенкур М.С. и др. Комплексный анализ механики левого желудочка с помощью спекл-трекинг-эхокардиографии при болезни Шагаса. Кардиоваск Ультразвук. 2016; 14 (1): 20. pmid: 27229468; PubMed Central PMCID: PMC4882839.
- 24. Barbosa MM, Costa Rocha MO, Vidigal DF, Bicalho Carneiro Rde C, Araujo RD, Palma MC, et al.Раннее обнаружение нарушений сократимости левого желудочка с помощью двумерного спекл-трекинга при болезни Шагаса. Эхокардиография. 2014; 31 (5): 623–30. pmid: 25232573.
- 25. Гомес В.А., Алвес Г.Ф., Хадлич М., Азеведо К.Ф., Перейра И.М., Сантос С.Р. и др. Анализ регионарной деформации левого желудочка у пациентов с болезнью Шагаса и нормальной систолической функцией левого желудочка. J Am Soc Echocardiogr. 2016; 29 (7): 679–88. pmid: 27086044.
- 26. Chow S-C.Расчет размера выборки в клинических исследованиях. В: Shein-Chung Chow JS, Hansheng Wang, Юлия Лохныгина, редактор. 1. Издание третье, изд. NY. США: Чепмен и Холл / CRC; 2018. с. p510.
- 27. Ланг Р.М., Бадано Л.П., Мор-Ави В., Афилало Дж., Армстронг А., Эрнанд Л. и др. Рекомендации по количественной оценке камеры сердца с помощью эхокардиографии у взрослых: обновленные данные Американского общества эхокардиографии и Европейской ассоциации сердечно-сосудистой визуализации. Eur Heart J Cardiovasc Imaging.2015; 16 (3): 233–70. pmid: 25712077.
- 28. Мор-Ави В., Ланг Р.М., Бадано Л.П., Белохлавек М., Кардим Н.М., Дерумо Дж. И др. Современные и развивающиеся эхокардиографические методы количественной оценки механики сердца: консенсусное заявление ASE / EAE по методологии и показаниям, одобренное Японским обществом эхокардиографии. Eur J Echocardiogr. 2011; 12 (3): 167–205. pmid: 21385887.
- 29. Сапин PM, Шредер KM, Gopal AS, Smith MD, DeMaria AN, King DL.Сравнение двух- и трехмерной эхокардиографии с циневентрикулографией для измерения объема левого желудочка у пациентов. J Am Coll Cardiol. 1994. 24 (4): 1054–63. pmid: 7930197.
- 30. Schmidt A, Dias Romano MM, Marin-Neto JA, Rao-Melacini P, Rassi A, Mattos A, et al. Влияние трипаноцидного лечения на эхокардиографические параметры при кардиомиопатии Шагаса и прогностическое значение индекса движения стенок: ПРЕИМУЩЕСТВО пробного эхокардиографического подисследования. J Am Soc Echocardiogr.2018. pmid: 30420161
- 31. Мада Р.О., Лысянский П., Дарабан А.М., Дюшенн Дж., Фойгт Ю. Как определить конечную диастолу и конечную систолу ?: Влияние времени на измерения деформации. JACC Cardiovasc Imaging. 2015; 8 (2): 148–57. pmid: 25577447.
- 32. Беладан СС, Калин А., Рошка М., Гингина С., Попеску Б.А. Динамика скручивания левого желудочка: принципы и применение. Сердце. 2014; 100 (9): 731–40. pmid: 23661636.
- 33. Литерс И.П., Дэвис А., Зустерзил Р., Этуотер Б., Рисум Н., Согаард П. и др.Нарушения регионарного сокращения левого желудочка по данным эхокардиографического отслеживания спеклов в комбинированной правой ножке пучка Гиса с блокадой левого переднего пучка Гиса по сравнению с блокадой левой ножки пучка Гиса. J Electrocardiol. 2016; 49 (3): 353–61. pmid: 26931516.
- 34. Войт Дж. Ю, Педризетти Дж., Лысянский П., Марвик Т. Х., Хоул Х., Бауманн Р. и др. Определения общего стандарта для двумерной эхокардиографии с отслеживанием спеклов: согласованный документ рабочей группы EACVI / ASE / Industry по стандартизации визуализации деформации.J Am Soc Echocardiogr. 2015; 28 (2): 183–93. pmid: 25623220.
- 35. Эчеверрия Л.Е., Рохас Л.З., Вилламисар М.К., Луенгас С., Чавес А.М., Родригес Дж.А. и др. Эхокардиографические параметры, отслеживание спеклов и уровни натрийуретического пептида в головном мозге как индикаторы прогрессирования неопределенной стадии кардиомиопатии Шагаса. Эхокардиография. 2020; 37 (3): 429–38. pmid: 32045055.
- 36. Марин-Нето JA, Кунья-Нето E, Maciel BC, Simoes MV. Патогенез хронической болезни сердца Шагаса.Тираж. 2007. 115 (9): 1109–23. pmid: 17339569.
- 37. Кольер П., Фелан Д., Кляйн А. Тест в контексте: напряжение миокарда, измеренное с помощью спекл-трекинг-эхокардиографии. J Am Coll Cardiol. 2017; 69 (8): 1043–56. pmid: 28231932.
- 38. Rochitte CE, Oliveira PF, Andrade JM, Ianni BM, Parga JR, Avila LF и др. Отсроченное усиление миокарда с помощью магнитно-резонансной томографии у пациентов с болезнью Шагаса: маркер тяжести заболевания. J Am Coll Cardiol. 2005. 46 (8): 1553–8.pmid: 16226184.
- 39. Volpe GJ, Moreira HT, Trad HS, Wu KC, Braggion-Santos MF, Santos MK и др. Рубец левого желудочка и прогноз при хронической кардиомиопатии Шагаса. J Am Coll Cardiol. 2018. 72 (21): 2567–76. pmid: 30466514.
- 40. Сенра Т., Янни Б.М., Коста АСР, Мэди С., Мартинелли-Филхо М., Калил-Филхо Р. и др. Долгосрочное прогностическое значение фиброза миокарда у пациентов с кардиомиопатией Шагаса. J Am Coll Cardiol. 2018. 72 (21): 2577–87. pmid: 30466515.
- 41. Логструп BB, Нильсен JM, Ким WY, Poulsen SH. Отек миокарда при остром миокардите, обнаруженный с помощью эхокардиографического 2D анализа деформации миокарда. Eur Heart J Cardiovasc Imaging. 2016; 17 (9): 1018–26. pmid: 26588987.
- 42. Oliveira LFL, Carvalho EEV, Mejia J, Santana-Silva J, Romanno MMD, Cunha-Neto E, et al. Нарушение перфузии миокарда в состоянии покоя связано с воспалением, но не с фиброзом, экспериментальной хронической кардиомиопатией Шагаса. Eur Heart J.2013; 34: 978–. WOS: 000327744606107.
- 43. Торреао Дж. А., Янни Б. М., Мэди С., Наиа Э., Расси С. К., Номура С. и др. Характеристика ткани миокарда при болезни сердца Шагаса с помощью сердечно-сосудистого магнитного резонанса. J Cardiovasc Magn Reson. 2015; 17: 97. pmid: 26581396; PubMed Central PMCID: PMC4652401.
- 44. Нойя-Рабело М.М., Маседо Т.Т., Ларокка Т., Мачадо А., Пачеко Т., Торреао Дж. И др. Наличие и распространение фиброза миокарда при неопределенной форме болезни Шагаса: исследование с использованием магнитного резонанса.Arq Bras Cardiol. 2018; 110 (2): 124–31. pmid: 29466491; PubMed Central PMCID: PMC5855905.
- 45. Регейро А., Гарсия-Альварес А., Ситжес М., Ортис-Перес Дж. Т., Де Каральт М. Т., Пиназо М. Дж. И др. Вовлечение миокарда в болезнь Шагаса: выводы из магнитного резонанса сердца. Int J Cardiol. 2013; 165 (1): 107–12. pmid: 211.
- 46. Минна М. Романо HTM, Андре Шмидт, Бенедито Карлос Масиэль, Анис Расси, Хосе Антонио Марин-Нето, Эрик Веласкес. Полезность глобального продольного напряжения левого желудочка для прогнозирования сердечно-сосудистых исходов у пациентов с кардиомиопатией Шагаса.Circ J. 2017; 136 (Приложение 1): 1.
Распределение вентиляции легких – обзор
Распределение вентиляции
Распределение вентиляции, которое может влиять на распределение вдыхаемых аэрозолей между областями легких и время пребывания в этих областях, может быть важным фактором, определяющим отложение частиц в легких. У крупных млекопитающих, таких как человек, существует градиент силы тяжести, который вызывает объем альвеол в зависимых областях легких (т.е., самые нижние области в легких), чтобы быть меньше, чем в независимых областях легких. Во время нормального приливного дыхания в зависимых областях вентиляция может быть несколько увеличена по сравнению с независимыми областями. По мере распространения дыхания также могут распространяться связанные частицы в воздухе. Имеются некоторые экспериментальные данные о связи между региональным отложением ультратонких, мелких и крупных частиц и региональной вентиляцией в здоровом и больном легком. Неоднородность вентиляции из-за обструктивного заболевания обычно превышает нормальные градиенты, вызванные гравитацией.
Распределение вентиляции было изучено у ряда видов животных. Существует выраженный градиент гравитации в распределении вентиляции стоящих лошадей, при этом зависимые (вентральные) области получают больше каждого вдоха, чем независимые (спинные) области (Amis et al., 1984). Сообщалось, что у стоящих шетландских пони поздняя беременность увеличивает вентиляцию независимых областей, возможно, из-за внутрибрюшного давления на зависимые (вентральные) области (Schramel et al., 2012). В отличие от лошадей, данные, полученные до 20 дней после родов, показали равную вентиляцию вентрально-спинной у этих пони. В положении лежа на спине собаки и ленивцы демонстрируют повышенную вентиляцию зависимых (спинных) областей по сравнению с независимыми (вентральными) областями (Hoffman and Ritman, 1985). Однако в положении лежа и у собак, и у ленивцев вентрально-дорсальная вентиляция практически одинакова. Положение, в котором находятся крысы, также может влиять на региональную доставку и осаждение вдыхаемых аэрозолей.Сообщалось, что у крыс независимая область легкого лучше вентилируется, независимо от того, лежит ли она на спине, на животе или на боку (Rooney et al., 2009; Dunster et al., 2012). У людей на режим вентиляции влияет как положение тела, так и вздутие легких.
Milic-Emili et al. (1966) показали, что апикальные (независимые) и базальные (зависимые) различия в плевральном давлении могут влиять на распределение вентиляции у здоровых людей. У людей, стоящих в вертикальном положении, апикальное легкое получает большую часть вдыхаемого воздуха при малых объемах легких (менее 20% жизненной емкости).Выше этого объема вертикальная пропорция вентиляции относительно постоянна для дыхания, при этом базальные области (зависимая часть) имеют несколько увеличенную вентиляцию по сравнению с апикальными областями (Milic-Emili et al., 1966). Эффект гравитации смещается за счет изменения положения тела. Например, когда он лежит на левом боку, аэрозоли, вдыхаемые при малых объемах легких, будут предпочтительно переноситься и откладываться в правом легком (Bennett et al., 2002). У людей, стоящих в вертикальном положении, при больших объемах легких (70% или более от общей емкости легких) частицы транспортируются преимущественно в левое легкое и откладываются в нем (Bennett et al., 2002). Более равномерное распределение осаждения частиц слева направо наблюдается для ингаляций, близких к функциональной остаточной емкости. Лево-правая асимметрия осаждения частиц при больших объемах легких в первую очередь связана с различиями в вентиляции легких (Möller et al., 2009). Однако влияние градиентов силы тяжести на вентиляцию и лево-правую асимметрию у стоящих в вертикальном положении людей, описанное здесь для здоровых людей, невелико по сравнению с неоднородностью вентиляции, вызванной обструктивным заболеванием легких (Suga et al., 1995).
Сообщалось о региональном осаждении аэрозолей размером от 0,5 до 1,0 мкм, превышающем региональную вентиляцию, в плохо вентилируемых зонах, и это объясняется увеличением времени пребывания в зонах с препятствиями (Susskind et al., 1986; Trajan et al., 1984). Однако другие показывают увеличение отложения при увеличении вентиляции. Например, у пациентов с пересаженным легким и облитерирующим бронхиолитом наблюдалась значительная ассоциация повышенного осаждения аэрозоля (1,2 мкм MMAD) в лучше вентилируемых областях (O’Riordan et al., 1995). О тенденции к увеличению осаждения аэрозоля (0,78 мкм MMAD) с усилением вентиляции также сообщалось у здоровых людей и бессимптомных курильщиков (Chamberlain et al., 1983). Другие исследования с использованием аэрозолей аналогичного размера не обнаружили никакой связи между вентиляционным распределением и отложением частиц (O’Riordan and Smaldone, 1994; Smaldone et al., 1991). Во всех этих исследованиях региональная вентиляция сравнивалась с региональным осаждением частиц с использованием сцинтиграфических методов. Смешанные результаты этих исследований могут быть связаны с осаждением, не имеющим простой монотонной связи с вентиляцией.
Brown et al. (2001) исследовали взаимосвязь между частицами MMAD размером 5 мкм у здоровых людей и пациентов с муковисцидозом, используя сцинтиграфические методы.

 Хронический кашель с выделением значительного количества мокроты
Хронический кашель с выделением значительного количества мокроты Хронический кашель с выделением значительного количества мокроты
Хронический кашель с выделением значительного количества мокроты Жидкости в плевральных полостях нет. Заключение: КТ-признаки саркоидоза легких (рис. 4). В сравнении с предыдущими исследованиями (рентгенография легких 2004, 2006 г.) – без динамики.
Жидкости в плевральных полостях нет. Заключение: КТ-признаки саркоидоза легких (рис. 4). В сравнении с предыдущими исследованиями (рентгенография легких 2004, 2006 г.) – без динамики.