Вирус папилломы человека (ВПЧ) и рак шейки матки
Что такое ВПЧ?Вирус папилломы человека (ВПЧ) является самой распространенной вирусной инфекцией половых путей. Большинство сексуально активных женщин и мужчин приобретают инфекцию в какой-то момент своей жизни, а некоторые могут быть повторно инфицированы.
Пиковый период инфицирования как для женщин, так и для мужчин начинается вскоре после того, как они становятся сексуально активными. ВПЧ передается половым путем, но для передачи вируса не обязателен проникающий секс. Телесный генитальный контакт является хорошо установленным путем передачи инфекции.
Многие типы ВПЧ не причиняют проблем. ВПЧ-инфекции обычно проходят сами, без каких-либо вмешательств, через несколько месяцев после инфицирования, и около 90% проходят в течение 2 лет. Небольшая доля инфекций, вызываемых определенными типами ВПЧ, может продолжаться и приводить к развитию рака шейки матки.
На сегодняшний день рак шейки матки является самой распространенной болезнью, связанной с ВПЧ. Почти все случаи рака шейки матки могут быть обусловлены ВПЧ‑инфекций.
Почти все случаи рака шейки матки могут быть обусловлены ВПЧ‑инфекций.
Инфекция, вызываемая некоторыми типами ВПЧ, может также приводить к развитию рака ануса, вульвы, влагалища, пениса и ротоглотки, который можно предотвратить благодаря использованию таких же стратегий первичной профилактики, как и для рака шейки матки.
Типы ВПЧ, не вызывающие рак (особенно типы 6 и 11), могут приводить к развитию остроконечных кондилом и респираторного папилломатоза (болезнь, при которой опухоли вырастают в дыхательных путях, ведущих из носа и рта в легкие). И хотя эти состояния очень редко приводят к смерти, они часто могут приводить к заболеваниям. Остроконечные кондиломы широко распространены, крайне инфекционны и негативно сказываются на сексуальной жизни.
Как ВПЧ-инфекция приводит к развитию рака шейки матки?Хотя большинство ВПЧ-инфекций и предраковых поражений проходят сами по себе, для всех женщин существует риск того, что ВПЧ-инфекция может стать хронической, а предраковые поражения разовьются в инвазивный рак шейки матки.
У женщин с нормальной иммунной системой рак шейки матки развивается в течение 15-20 лет. У женщин с ослабленной иммунной системой, например с ВИЧ-инфекцией при отсутствии лечения, на его развитие может потребоваться лишь 5-10 лет.
Факторы риска персистенции ВПЧ и развития рака шейки матки- тип ВПЧ – его канцерогенность, или способность вызывать рак;
- иммунный статус – люди с ослабленной иммунной системой, такие как ВИЧ-инфицированные люди, с большей вероятностью имеют стойкие ВПЧ-инфекции, которые быстрее развиваются в предрак и рак;
- коинфекция другими возбудителями, передаваемыми половым путем, такими как возбудители простого герпеса, хламидиоза и гонореи;
- количество родов (число рожденных детей) и ранние первые роды;
- употребление табака.
Рак шейки матки является четвертым наиболее распространенным видом рака среди женщин в глобальных масштабах – по оценкам, в 2018 г.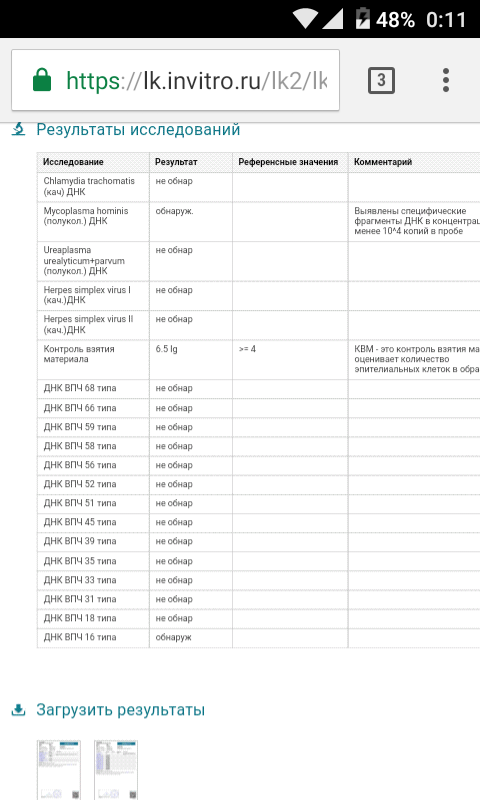 произошло 570 000 новых случаев заболевания, и на этот вид рака пришлось 7,5% всех случаев смерти женщин от рака. По оценкам, более 85% из более чем 311 000 ежегодных случаев смерти от рака шейки матки происходят в странах с низким и средним уровнем дохода. Вероятность заболевания раком шейки матки у женщин с ВИЧ-инфекцией в шесть раз выше, чем у женщин, не инфицированных ВИЧ, и, по оценкам, 5% всех случаев заболевания раком шейки матки связаны с ВИЧ (2).
произошло 570 000 новых случаев заболевания, и на этот вид рака пришлось 7,5% всех случаев смерти женщин от рака. По оценкам, более 85% из более чем 311 000 ежегодных случаев смерти от рака шейки матки происходят в странах с низким и средним уровнем дохода. Вероятность заболевания раком шейки матки у женщин с ВИЧ-инфекцией в шесть раз выше, чем у женщин, не инфицированных ВИЧ, и, по оценкам, 5% всех случаев заболевания раком шейки матки связаны с ВИЧ (2).
В странах с высоким уровнем дохода имеются программы, которые предоставляют девочкам возможности для вакцинации против ВПЧ, а женщинам – для регулярного скрининга. Скрининг позволяет выявлять предраковые поражения на стадиях, когда их можно легко лечить.
В странах с низким и средним уровнем дохода доступ к таким профилактическим мерам ограничен, и рак шейки матки часто выявляется лишь на поздних стадиях, когда развиваются симптомы. Кроме того, доступ к лечению болезни на таких поздних стадиях (например, хирургическая операция, лучевая терапия и химиотерапия) может быть очень ограниченным, что приводит к высоким уровням смертности от рака шейки матки в этих странах.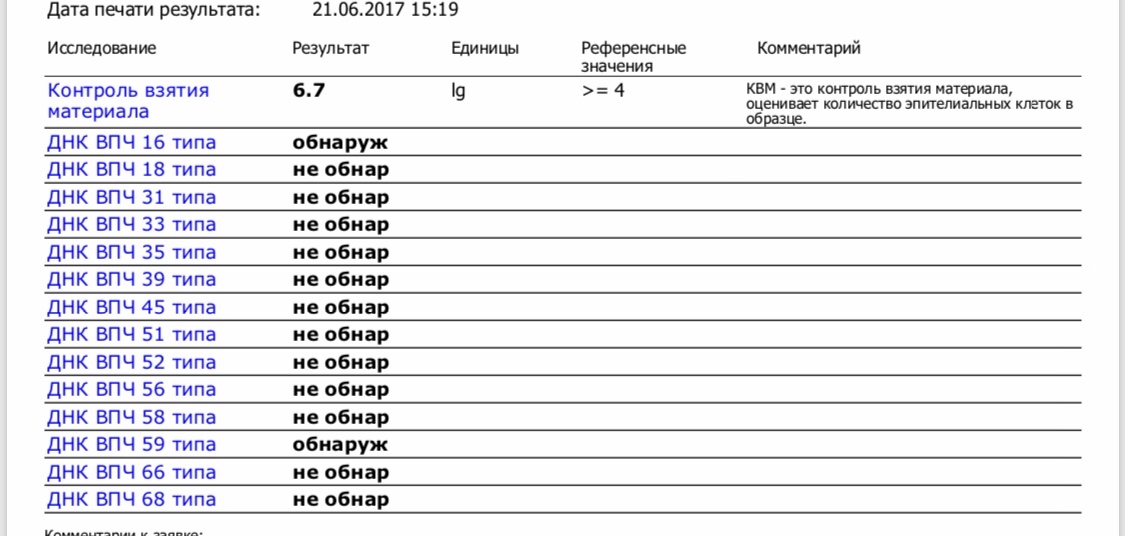
Высокую глобальную смертность от рака шейки матки (стандартизированный по возрасту показатель: 6,9/100 000 в 2018 г.) можно снизить с помощью эффективных мероприятий.
Борьба с раком шейки матки: комплексный подходВ Глобальной стратегии по ускорению элиминации рака шейки матки как проблемы общественного здравоохранения, принятой ВАЗ в 2020 г., рекомендуется применять комплексный подход к профилактике рака шейки матки и борьбе с ним. Рекомендуемый комплекс мер включает мероприятия, охватывающие весь жизненный цикл.
| Первичная профилактика | Вторичная профилактика | Третичная профилактика |
|---|---|---|
Девочки 9-14 лет
| Женщины 30 лет или старше | Все женщины по мере необходимости |
Девочки и мальчики в соответствующих случаях
|
| Лечение инвазивного рака в любом возрасте
|
Борьба должна быть многодисциплинарной и включать компоненты просвещения на уровне общин, социальной мобилизации, вакцинации, скрининга, лечения и паллиативной помощи.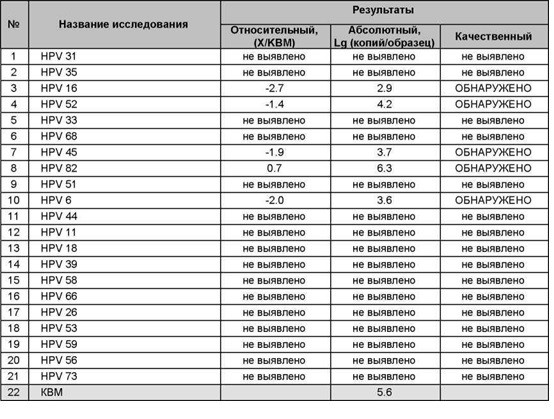
Первичная профилактика начинается с вакцинации девочек против ВПЧ в возрасте 9‑14 лет, то есть до того, как они становятся сексуально активными.
Женщины, ведущие активную половую жизнь, должны проходить скрининг для выявления аномальных цервикальных клеток и предраковых поражений начиная с 30‑летнего возраста. Скрининг сексуально активных женщин с ВИЧ-инфекцией следует начинать в более раннем возрасте, сразу после получения положительного результата теста на ВИЧ.
Для лечения предраковых поражений рекомендуется удаление аномальных клеток или поражений, которое проводится амбулаторно (аномальную ткань шейки матки можно разрушить с помощью криотерапии или термоабляции).
При наличии признаков рака шейки матки варианты лечения инвазивного рака включают хирургическую операцию, лучевую терапию и химиотерапию, и пациентов необходимо направлять на правильный уровень обслуживания.
Вакцинация против ВПЧВ настоящее время имеются 3 преквалифицированные вакцины, защищающие от ВПЧ
16 и 18, которые, как известно, вызывают как минимум 70% раковых заболеваний шейки матки. Третья вакцина защищает еще от пяти канцерогенных типов ВПЧ, которые вызывают еще 20% раковых заболеваний шейки матки. Учитывая, что вакцины, которые защищают только от ВПЧ 16 и 18, имеют также некоторую перекрестную защиту от этих менее распространенных типов ВПЧ, вызывающих рак шейки матки, ВОЗ считает, что эти три вакцины в равной мере защищают от рака шейки матки. Две из этих вакцин защищают также от ВПЧ 6 и 11 типов, которые приводят к развитию аногенитальных кондилом.
Третья вакцина защищает еще от пяти канцерогенных типов ВПЧ, которые вызывают еще 20% раковых заболеваний шейки матки. Учитывая, что вакцины, которые защищают только от ВПЧ 16 и 18, имеют также некоторую перекрестную защиту от этих менее распространенных типов ВПЧ, вызывающих рак шейки матки, ВОЗ считает, что эти три вакцины в равной мере защищают от рака шейки матки. Две из этих вакцин защищают также от ВПЧ 6 и 11 типов, которые приводят к развитию аногенитальных кондилом.
Результаты клинических испытаний и пост-маркетингового наблюдения свидетельствуют о том, что вакцины против ВПЧ в высокой степени безопасны и эффективны в профилактике ВПЧ-инфекций, серьезных предраковых поражений и инвазивного рака (3).
Вакцины против ВПЧ наиболее эффективны, если вакцинация проводится до воздействия ВПЧ. Поэтому ВОЗ рекомендует проводить вакцинацию девочек в возрасте от 9 до 14 лет, когда большинство из них еще не начинают половую жизнь. Вакцины не могут лечить ВПЧ-инфекции или связанные с ВПЧ заболевания, такие как рак.
В некоторых странах введена вакцинация мальчиков с учетом того, что вакцинация позволяет предотвращать развитие генитального рака как у мужчин, так и у женщин, а две имеющиеся вакцины позволяют также предотвращать развитие генитальных кондилом у мужчин и женщин.
ВОЗ рекомендует проводить вакцинацию девочек в возрасте 9-14 лет, поскольку это является самой эффективной с точки зрения затрат мерой общественного здравоохранения против рака шейки матки.
Вакцинация против ВПЧ не заменяет скрининг на рак шейки матки. В странах, где вакцинация против ВПЧ введена в действие, программы скрининга все еще могут нуждаться в разработке или усилении.
Скрининг на предраковые поражения и их лечениеСкрининг на рак шейки матки включает тестирование на предрак и рак, при этом проводится все больше тестов на ВПЧ-инфекцию. Тестирование проводится среди женщин, не имеющих симптомов и чувствующих себя совершенно здоровыми. Если скрининг выявляет ВПЧ-инфекцию или предраковые поражения, их можно легко лечить и тем самым предотвратить развитие рака. Скрининг может также выявить рак на ранней стадии с высокой вероятностью излечения.
Скрининг может также выявить рак на ранней стадии с высокой вероятностью излечения.
С учетом того что предраковые поражения развиваются на протяжении многих лет, каждой женщине начиная с 30 лет, а затем регулярно (в зависимости от используемого теста) рекомендуется проходить скрининг. Для сексуально активных женщин с ВИЧ‑инфекцией скрининг необходимо проводить как можно раньше, как только они узнают о своем ВИЧ-статусе.
Скрининг должен быть увязан с лечением и ведением пациентов с положительными результатами скрининга. Скрининг без надлежащего ведения пациентов не соответствует требованиям этики.
В настоящее время ВОЗ рекомендует 3 разных типа скрининга:
- ДНК-тестирование на типы ВПЧ высокого риска
- визуальная проверка с использованием уксусной кислоты
- обычный тест Папаниколау (Pap) и жидкостная цитология
Для лечения предраковых поражений ВОЗ рекомендует использовать криотерапию или термоабляцию, а также процедуру электрохирургического петлевого иссечения при ее наличии.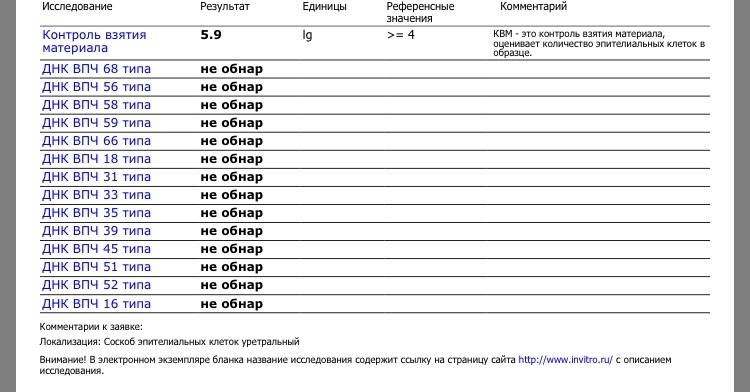 В случае поражений на поздних стадиях женщин следует направлять для дальнейших исследований и надлежащего лечения.
В случае поражений на поздних стадиях женщин следует направлять для дальнейших исследований и надлежащего лечения.
Женщин с симптомами, позволяющими предполагать рак шейки матки, необходимо направлять в соответствующие медицинские учреждения для дальнейшего обследования, диагностики и лечения.
Симптомы ранней стадии рака шейки матки могут включать:
- нерегулярные кровянистые выделения или небольшие кровотечения в период между менструациями у женщин репродуктивного возраста;
- кровянистые выделения или кровотечения в постклимактерический период;
- кровотечения после полового акта; и
- обильные влагалищные выделения, иногда с неприятным запахом.
По мере развития рака шейки матки могут появляться более серьезные симптомы, включая:
- постоянные боли в области спины, ноги и/или таза;
- потеря веса, усталость, потеря аппетита;
- выделения с неприятным запахом и неприятные ощущения во влагалище; и
- отек ноги или обеих нижних конечностей.

На более поздних стадиях могут возникать другие тяжелые симптомы в зависимости от того, на какие органы распространился рак.
Диагноз рака шейки матки должен ставиться на основе результатов гистопатологического исследования. Определение стадии проводится на основе размера опухоли и распространения болезни в пределах таза и на удаленные органы. Лечение зависит от стадии болезни и включает хирургическую операцию, лучевую терапию и химиотерапию. Паллиативная помощь также является важным элементом ведения онкологических пациентов, позволяющим облегчать чрезмерную боль и страдания.
Деятельность ВОЗВсемирная ассамблея здравоохранения приняла глобальную стратегию по ускорению элиминации рака шейки матки как проблемы общественного здравоохранения и установленные в ней цели и задачи на период 2020-2030 гг. (WHA73.2) (4). В рамках глобальной стратегии поставлены задачи для ускорения элиминации рака шейки матки:
- пороговое значение для элиминации в качестве проблемы общественного здравоохранения установлено на уровне 4 на 100 000 женщин в год;
- для того чтобы страны встали на путь элиминации рака шейки матки к 2030 г.
 должны быть достигнуты приведенные ниже целевые показатели 90-70-90;
должны быть достигнуты приведенные ниже целевые показатели 90-70-90; - 90% девочек к 15 годам должны быть в полной мере вакцинированы против ВПЧ;
- 70% женщин должны пройти скрининг на основе высокоэффективного теста в возрасте 35 лет и затем в возрасте 45 лет;
- 90% женщин с выявленной болезнью шейки матки должны получать лечение (обеспечить лечение для 90% женщин с предраком; обеспечить ведение 90% женщин с инвазивным раком).
ВОЗ разработала руководство и инструментарий по профилактике рака шейки матки и борьбе с ним путем вакцинации, скрининга и лечения инвазивного рака, которые размещены в хранилище знаний. ВОЗ сотрудничает со странами и партнерами в разработке и осуществлении всеобъемлющих программ в соответствии с глобальной стратегией.
Справочная литература(1) Ferlay J, Ervik M, Lam F, Colombet M, Mery L, Piñeros M, Znaor A, Soerjomataram I, Bray F (2018).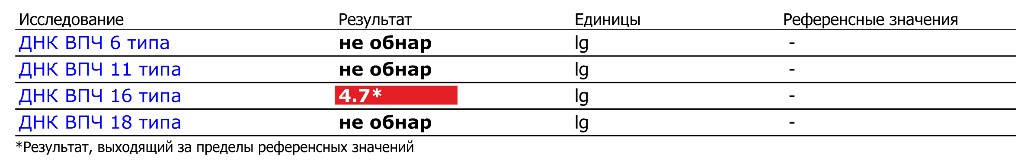 Global Cancer Observatory: Cancer Today. Lyon, France: International Agency for Research on Cancer. Available from: https://gco.iarc.fr/today
Global Cancer Observatory: Cancer Today. Lyon, France: International Agency for Research on Cancer. Available from: https://gco.iarc.fr/today
(2) Stelzle D, Tanaka LF, Lee KK, et al. Estimates of the global burden of cervical cancer associated with HIV. Lancet Glob Health 2020; published online Nov 16. DOI:S2214-109X(20)30459-9 https://www.thelancet.com/journals/langlo/article/PIIS2214-109X(20)30459-9/fulltext
(3) Lei et al (2020) HPV Vaccination and the Risk of Invasive Cervical Cancer. N Engl J Med 2020;383:1340-8. DOI: 10.1056/NEJMoa1917338
(4) World Health Organization. Global strategy to accelerate the elimination of cervical cancer as a public health problem https://www.who.int/publications/i/item/9789240014107
Human Papillomavirus 16/18 (HPV 16/18), ДНК (выявление, генотипирование и количественное определение) [реал-тайм ПЦР]
Выявление ДНК Human Papillomavirus 16/18 в образце, позволяющее обнаружить даже минимальную концентрацию вируса.
Синонимы русские
Папиллома-вирусы человека 16-го и 18-го типов, ВПЧ 16,18.
Синонимы английские
Papillomavirus hominis 16,18, DNA.
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Соскоб из прямой кишки, соскоб урогенитальный.
Общая информация об исследовании
Вирус папилломы человека (ВПЧ) представляет собой совокупность около 100 родственных вирусов. Одни виды вызывают кожные бородавки, а другие могут быть причиной венерических заболеваний (ЗППП) и кондилом.
Генитальный ВПЧ является одним из наиболее распространенных венерических заболеваний в мире. Инкубационный период может длиться от 2 месяцев до 2-10 лет. Характерно скрытое течение заболевания, при котором отсутствуют клинические проявления, а при кольпоскопическом, цитологическом и гистологическом обследовании выявляется норма.
Чаще всего встречается у молодых женщин и мужчин, при этом основной путь распространения – оральный, анальный или вагинальный секс. Хотя большинство вирусов из этой группы не очень опасны для здоровья, есть, однако, несколько типов папилломы (например, ВПЧ-16, 18), которые могут быть опасны для здоровья. Обычно они не вызывают видимых изменений, но, находясь в эпителии, способны вызывать рак шейки матки, а также другие, менее распространенные, опухоли, например рак влагалища, рта, горла, пениса и ануса. Тест на ВПЧ определяет ДНК именно таких вирусов, связанных с высоким риском развития рака. Объединение ДНК папиллома-вируса с геном клетки приводит к дисплазии/неоплазии (чаще всего в переходной зоне шейки матки). Инфицирование ими приводит к относительно доброкачественному бовеноидному папулёзу или плоскоклеточным интраэпителиальным неоплазиям шейки матки.
Диагностика скрытой ВПЧ-инфекции осуществляется только методом ПЦР. Он позволяет найти ДНК ВПЧ в исследуемом биоматериале. Принцип метода основан на амплификации (многократном увеличении числа копий) специфичного для данного возбудителя участка ДНК.
Он позволяет найти ДНК ВПЧ в исследуемом биоматериале. Принцип метода основан на амплификации (многократном увеличении числа копий) специфичного для данного возбудителя участка ДНК.
Для чего используется исследование?
- В качестве способа определения риска рака шейки матки (для диагностики самого рака шейки матки используется цитологическое исследование (мазок с окраской по Папаниколау), когда выявляются атипичные клетки эпителия, которые могут быть вестником развития рака шейки матки).
Когда назначается исследование?
Женщинам в возрасте от 30 лет, которые подвержены риску заражения ВПЧ, а также женщинам от 21 года, находящимся в группе риска по заражению ВПЧ и имеющим цитологически выявленные атипичные плоские клетки неясного значения (положительный ASC-US тест).
Могут тестироваться и мужчины, подверженные риску заражения ВПЧ.
Что означают результаты?
Референсные значения:
ДНК ВПЧ 16 типа, Ig – не обнаружено.
ДНК ВПЧ 18 типа, Ig – не обнаружено.
При выявлении ДНК вируса указывается количество и дается интерпретация вирусной нагрузки (клинически значимая/незначимая, а также вероятность дисплазии).
Положительный результат указывает на наличие генетического материала ВПЧ 16-го и 18-го типа в исследуемом образце.
Отсутствие генетического материала ВПЧ 16-го и 18-го типа
в исследуемом образце означает, что наличие ВПЧ-инфекции маловероятно.Если мазок Папаниколау показал цитологические изменения, а результат ПЦР отрицательный, то требуется дальнейший мониторинг, так же как и в случае отрицательного цитологического исследования и положительного ПЦР-теста.
Скачать пример результатаВажные замечания
- Положительный результат ПЦР не говорит об имеющемся раке шейки матки или его обязательном появлении. Данный тест лишь позволяет оценить риск развития заболевания.
Также рекомендуется
[09-105] Human Papillomavirus высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типы), ДНК без определения типа [реал-тайм ПЦР]
[09-106] Human Papillomavirus высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типы), ДНК генотипирование [реал-тайм ПЦР]
[09-018] Human Papillomavirus 16/18 (HPV 16/18), ДНК [реал-тайм ПЦР]
[09-019] Human Papillomavirus 31/33 (HPV 31/33), ДНК [реал-тайм ПЦР]
[09-020] Human Papillomavirus 6/11 (HPV 6/11), ДНК [реал-тайм ПЦР]
[09-115] Human Papillomavirus высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типы), ДНК количественно, без определения типа [реал-тайм ПЦР]
[09-148] Human Papillomavirus 16 (HPV 16), ДНК [реал-тайм ПЦР]
[09-149] Human Papillomavirus 18 (HPV 18), ДНК [реал-тайм ПЦР]
[09-170] Human Papillomavirus (HPV) высокого канцерогенного риска – скрининговое определение генотипов (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68) и генотипирование 16 и 18 типов [реал-тайм ПЦР, Roche Cobas 4800]
Кто назначает исследование?
Терапевт, врач общей практики, гинеколог, уролог, инфекционист.
Что делать, если у вас обнаружен Вирус папилломы человека (ВПЧ)? Диагностика, лечение, профилактика.
Сейчас часто начали диагностировать у пациентов вирус папилломы человека (ВПЧ) и после этого стал возникать извечный вопрос, что делать?
Для начала, хотелось бы немного рассказать о нем: определение вируса папилломы человека.
Если обобщить, то ВПЧ – инфекция может находиться в следующих формах:
- Латентное течение определяется как персистенция папилломавируса в базальном слое эпителия. При этом вирус находится в эписомальной форме (молекула ДНК вируса не внедрена в молекулу ДНК клетки) и не приводит к патологическим изменениям в клетках. Латентное течение инфекции характеризуется отсутствием клинических проявлений, кольпоскопической, цитологической и гистологической нормой. Наличие ВПЧ-инфекции определяется ДНК-методами (ПЦР).
- Продуктивная инфекция предусматривает клинические проявления инфекции (папилломы, бородавки, кондиломы).
 При этом вирус, существующий в эписомальной форме, копируется в инфицированных клетках. Одновременно происходит усиленное размножение клеток базального слоя эпителия, что ведет к прогрессированию инфекции и появлению вегетаций (разрастаний). Клинически продуктивная инфекция определяется как бородавки или папилломы. Вирус выявляется методом ПЦР. При гистологическом исследовании определяются явления гиперкератоза (повышенного ороговения, т.е. старения клеток).
При этом вирус, существующий в эписомальной форме, копируется в инфицированных клетках. Одновременно происходит усиленное размножение клеток базального слоя эпителия, что ведет к прогрессированию инфекции и появлению вегетаций (разрастаний). Клинически продуктивная инфекция определяется как бородавки или папилломы. Вирус выявляется методом ПЦР. При гистологическом исследовании определяются явления гиперкератоза (повышенного ороговения, т.е. старения клеток). - Дисплазия (неоплазия) развивается при интеграции (внедрение) ДНК вируса в геном клетки. При неоплазии происходят изменения в структуре эпителиальных клеток. Наиболее часто поражения локализуются в переходной зоне шейки матки. На стыке многослойного плоского и цилиндрического эпителия базальные клетки, чувствительные к вирусной инфекции, находятся в непосредственной близости к поверхностным слоям, что облегчает контакт с вирусом при инфицировании. ВПЧ-инфекция подтверждается при гистологическом обследовании и кольпоскопии.

- В случае карциномы инвазивной опухоли вирус в клетке существует в интегрированной форме. При этом выявляются измененные, «атипичные» клетки, свидетельствующие о злокачественности процесса. Наиболее частая локализация – переходная зона шейки матки. Выявляется при кольпоскопическом и гистологическом исследовании.
Как проявляется ВПЧ – инфекция?
Основным симптомом инфекции вызванной вирусом папилломы человека является образование так называемых остроконечных кондилом.
Внешне остроконечные кондиломы похожи на обычные бородавки. Они могут иметь небольшие размеры (от нескольких миллиметров до сантиметра), розоватую или телесного цвета окраску, гладкую или слегка бугристую поверхность.
Чаще всего остроконечные кондиломы образуются в области наружных половых органов.
У женщин остроконечные кондиломы могут возникать вблизи клитора, на малых и больших половых губах, во влагалище и на шейке матки.
У мужчин остроконечные кондиломы образуются на половом члене и мошонке.
Также кондиломы могут образоваться в области анального отверстия, в мочеиспускательном канале или в любом другом месте на коже (кожа шеи, подмышечные впадины). Несколько расположенных рядом кондилом могут сливаться в одну большую «бородавку».
Как правило, остроконечные кондиломы безболезненны. В некоторых случаях в области кондилом ощущается легкий зуд и дискомфорт.
Когда нужно обратиться к врачу?
Обязательно обратитесь к врачу, если вы заметили у себя на коже образования (бородавки, выросты) похожие на остроконечные кондиломы. Врач назначит вам необходимые обследования, которые помогут установить точную причину болезни и исключить другие заболевания, передающиеся половым путем.
Диагностика ВПЧ?
Для подтверждения диагноза папилломавирусной инфекции используется метод ПЦР (полимеразной цепной реакции), который позволяет определить ДНК вируса и точно установить, каким типом вируса заражен человек.
В современных диагностических лабораториях определяется тип вируса, его количество (вирусная нагрузка) и интеграция вируса в геном. В начале статьи приведена информация, которая показывает, что наиболее опасны ВПЧ высокого онкогенного риска (ВОР). Имеет значение кроме типа вируса, определение и его количества. От этого зависит тактика лечения. Интеграция вируса в геном клетки, к сожалению, в наших лабораториях не определяется. Этот анализ важен в ранней диагностике дисплазии эпителия шейки матки и неинвазивной карциномы.
Очень важно, чтобы все поняли, даже если ПЦР анализ выявит у вас онкогенные формы ВПЧ, это не означает, что у вас уже есть рак шейки матки или что вы неминуемо заболеете им в ближайшее время, так как, далеко не во всех случаях ВПЧ приводит к развитию рака. От момента заражения до появления предрака могут пройти годы.
От момента заражения до появления предрака могут пройти годы.
Для того чтобы определить вызвал ли ВПЧ изменение клеток шейки матки и есть ли риск развития рака нужно обязательно пройти тщательное гинекологическое обследование, которое включает в себя обязательно :
- Кольпоскопию (осмотр шейки матки аппаратом, напоминающим микроскоп и позволяющий осматривать под увеличением от 8 до 20 крат).
- Цитологический мазок (ПАП тест), который используется для определения диспластических изменений в клетках шейки матки.
- Бактериоскопическое исследование выделений из влагалища. Часто ВПЧ-инфекция сочетается с другими инфекциями передающимися половым путем (примерно в 20% случаев), поэтому может быть необходимо дополнительное дообследование для определения хламидиоза, микоплазмоза, уреаплазмоза и трихомониаза.
- Прицельная биопсия – взятие кусочка ткани шейки матки в случаи наличия дисплазии или подозрения на злокачественную опухоль шейки матки.

Лечение ВПЧ
Поскольку полного излечения от папилломавирусной инфекции в настоящее время достичь невозможно (наряду с этим часто наблюдается спонтанное, самопроизвольное излечение), лечат проявления ВПЧ, а не присутствие вируса в организме. При этом эффективность различных методов лечения составляет 50-70 %, а в четверти случаев заболевание вновь проявляет себя уже спустя несколько месяцев после окончания лечения. Вопрос о целесообразности лечения каждой пациентки решается врачом индивидуально. При этом необходимо избегать факторов, снижающих иммунитет (переохлаждение, сильные эмоциональные стрессы, хроническое переутомление, авитаминоз). Существуют исследования, которые говорят о профилактическом эффекте ретиноидов (бета-каротин и витамин А), витамина С и микроэлементов, таких как фолаты, в отношении заболеваний, вызванных ВПЧ.
Среди методов лечения проявлений ВПЧ инфекции (остроконечных кондилом и папиллом) чаще всего используются:
- Деструктивные методы – это местное лечение, направленное на удаление кондилом.
 Различают физические (криодеструкция, лазеротерапия, диатермокоагуляция, электрохирургическое иссечение) и химические (трихлоруксусная кислота, ферезол, солкодерм) деструктивные методы, а также хирургическое удаление кондилом. Цитотоксические препараты – подофиллин, подофиллотоксин (кондилин), 5-фторурацил. Женщинам детородного возраста на время лечения рекомендуют надежную контрацепцию или отказ от половой жизни.
Различают физические (криодеструкция, лазеротерапия, диатермокоагуляция, электрохирургическое иссечение) и химические (трихлоруксусная кислота, ферезол, солкодерм) деструктивные методы, а также хирургическое удаление кондилом. Цитотоксические препараты – подофиллин, подофиллотоксин (кондилин), 5-фторурацил. Женщинам детородного возраста на время лечения рекомендуют надежную контрацепцию или отказ от половой жизни. - Имунологические методы Наиболее часто для лечения ВПЧ-инфекции используются интерфероны (лаферон, лаферобион, альфарекин, реаферон, виферон). Они представляют собой семейство белков, которые вырабатываются клетками иммунной системы в ответ на стимуляцию вирусами. Отдельно стоит препарат Алокин-альфа, который стимулирует выработку собственного интерферона и активирует клеточный иммунитет.
- Специфические противовирусные препараты (цидофовир, панавир, алпиразин). Известный противовирусный препарат ацикловир (зовиракс) не оказывает действие на ВПЧ.
 Из местных (влагалищных) препаратов противовирусным действием обладает Эпиген интим спрей и Бетадин.
Из местных (влагалищных) препаратов противовирусным действием обладает Эпиген интим спрей и Бетадин.
Профилактика ВПЧ
Может быть неспецифическая и специфическая.
Неспецифическая включает предотвращение заражения ВПЧ половым путем, здоровый образ жизни с целью укрепления работы иммунной системы и сбалансированное питание включающее в себя бета-каротин, витамин А, витамина С и фолиевую кислоту.
Специфическая профилактика – вакцинация.Вакцины для профилактики ВПЧ содержат органические вещества, структура которых похожа на структуру живых вирусов ВПЧ. Эти вещества ни в коем случае не могут вызвать болезнь.
После введения вакцины в организме человека начинают вырабатываться клетки иммунной системы, которые препятствуют внедрению ВПЧ в организм.
В настоящее время существует два типа вакцин против ВПЧ: квадривалентная Гардасил (Gardasil) и бивалентная Церварикс (Cervarix).
Церварикс предотвращает заражения ВПЧ 16 и 18, которые вызывают 70% всех случаев рака шейки матки и рака заднего прохода.
Гардасил, кроме защиты от ВПЧ 16 и 18 типов, предоставляет защиту ещё и от ВПЧ 6 и 11 типов, вызывающих 90% случаев бородавок на половых органах.
Гардасил и Церварикс защищают от заражения людей, которые еще не заражены ВПЧ соответствующего типа. Они не могут устранить вирус из организма человека, если он уже проник в него и не могут вылечить болезни (например, остроконечные кондиломы или дисплазию шейки матки) которые вирус уже успел спровоцировать. Именно по этой причине, прививки против ВПЧ рекомендуется делать в детском и подростковом возрасте, до начала половой жизни.
Таким образом, вакцина Гардасил защищает от заражения ВПЧ 6, 11, 16 и 18 типов и рекомендуется для профилактики рака и дисплазии шейки матки, рака влагалища и наружных половых органов у женщин, а также для профилактики рака заднего прохода и остроконечных кондилом у мужчин и женщин. Вакцина Церварикс защищает от заражения ВПЧ 16 и 18 типов и рекомендуется для профилактики рака и дисплазии шейки матки у женщин и рака заднего прохода у мужчин и женщин.
Вакцина Церварикс защищает от заражения ВПЧ 16 и 18 типов и рекомендуется для профилактики рака и дисплазии шейки матки у женщин и рака заднего прохода у мужчин и женщин.
В 2014 году была выпущена девятивалентная вакцина у которой устранены недостатки предшествующих. Девятивалентная вакцина «Гардасил 9» охватывает дополнительные пять типов вируса высокого онкогенного риска: 31, 33, 45, 52 и 58. В декабре 2014 года «Гардасил 9» был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) Минздрава США.
По состоянию на 2013 год вакцины зарегистрирована более, чем в 125 странах мира, почти в 20 странах входят в национальные календари прививок, в мире распространено 111 миллионов доз препарата.Автор: Сумцов Дмитрий Георгиевич
сдать анализ на 16,18 тип (высокого онкогенного риска), цены на ПЦР в Москве в ИНВИТРО
Метод определения
ПЦР с детекцией в режиме «реального времени».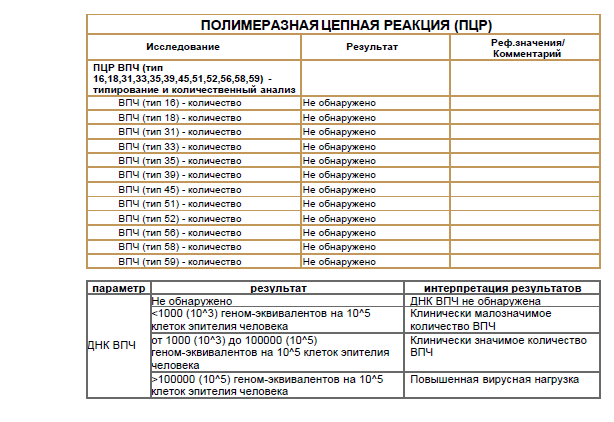
Исследуемый материал Соскоб эпителиальных клеток урогенитального тракта
Доступен выезд на дом
Качественное определение ДНК ВПЧ (Вирус папилломы человека, Human papillomavirus, HPV) высокого онкогенного риска двух типов (16, 18) в соскобе эпителиальных клеток урогенитального тракта методом ПЦР с детекцией в режиме «реального времени».
Вирус папилломы человека (ВПЧ, Human papillomavirus, HPV) относится к малым ДНК-содержащим вирусам, которые инфицируют эпителиальные клетки и индуцируют пролиферативные поражения кожи и слизистых оболочек. В настоящее время известно около ста типов ВПЧ с различным онкогенным потенциалом, которые условно объединяют в группы высокого и низкого онкогенного риска. Более 90% всех цервикальных карцином позитивны к присутствию ВПЧ. Наиболее часто в биоматериале из опухолей шейки матки обнаруживают 16-й и 18-й типы. Выявление ДНК ВПЧ не подтверждает наличие злокачественного процесса, в большинстве (до 90%) случаев в течение 12-36 месяцев происходит элиминация вируса и самоизлечение. При длительной хронической персистенции вируса и в зависимости от его типа повышается риск развития онкологического процесса. Диагностика заболевания требует дополнительного цитологического, гистологического исследования и динамического наблюдения.
Более 90% всех цервикальных карцином позитивны к присутствию ВПЧ. Наиболее часто в биоматериале из опухолей шейки матки обнаруживают 16-й и 18-й типы. Выявление ДНК ВПЧ не подтверждает наличие злокачественного процесса, в большинстве (до 90%) случаев в течение 12-36 месяцев происходит элиминация вируса и самоизлечение. При длительной хронической персистенции вируса и в зависимости от его типа повышается риск развития онкологического процесса. Диагностика заболевания требует дополнительного цитологического, гистологического исследования и динамического наблюдения.
Поскольку ВПЧ инфицирует эпителиальные клетки, необходимым условием получения достоверного результата является соблюдение техники взятия соскоба. В состав тестов по диагностике и мониторингу ВПЧ введен специальный параметр – контроль взятия материала (КВМ). КВМ – это тест по определению количества геномной ДНК человека в биоматериале, источником которой служат эпителиальные клетки, попавшие в пробу.
Аналитические показатели:
- определяемый фрагмент – специфичные участки ДНК ВПЧ 16, 18 типов;
- специфичность определения – 100%;
- чувствительность определения – 100 копий ДНК ВПЧ 16, 18 типов в образце.

Литература
- Профилактика рака шейки матки: Руководство для врачей. – М.: Изд. «МЕДпресс-информ». 2008:41.
- Заболевания шейки матки и генитальные инфекции. Под ред. проф. В.Н. Прилепской. – М.: Изд. «ГЭОТАР-Медиа». 2016:384.
- Папилломавирусная инфекция. Пособие для врачей. Под ред. проф., д.б.н. В.М. Говоруна. 2009:55.
- Bekkers R., Meijer C., et al. Effects of HPV detection in population-based screening programmers for cervical cancer: a Dutch moment. Gynecologic oncology. 2006;100(3):451-454.
- Khan M. et al. The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type specific HPV testing in clinical practice. Journal of the National Cancer Institute. 2005; 97:1072-1079.
- Snijders J., Meijer C. The value of viral load in HPV detection in screening.
 HPV today. 2006;8:8-9.
HPV today. 2006;8:8-9.
Анализ крови на ВПЧ и рак шейки матки, кольпоскопия цена- CMD
Вирус папилломы человека (ВПЧ) – ДНК-содержащий вирус семейства Papillomaviridae. В это семейство входят распространенные и генетически разнообразные вирусы, инфицирующие и поражающие клетки эпителия (кожа, слизистые аногенитальной области, ротовой полости).
Известно более 130 генотипов ВПЧ. По клинической классификации их делят на кожные и аногенитальные типы папилломавирусов. Именно аногенитальные типы ВПЧ вызывают поражения слизистых оболочек влагалища и шейки матки. Самые безобидные из этих заболеваний – доброкачественные остроконечные кондиломы половых органов, самое опасное – рак шейки матки.
Передаются вирусы папилломы человека при половых контактах. С началом половой жизни этим вирусом заражается подавляющее большинство женщин. Следует учитывать, что риск заражения ВПЧ зависит и от количества половых партнёров и от сексуального поведения единственного партнёра (распространенность ВПЧ у мужчин примерно равна распространенности среди женщин).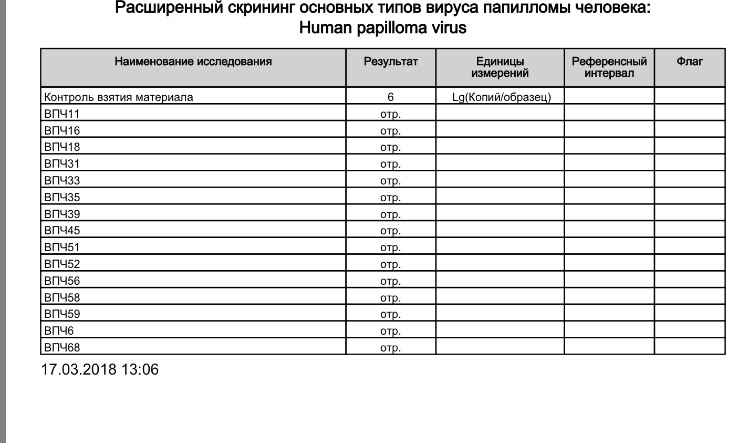
Сама по себе папилломавирусная инфекция – не заболевание. Через 6-18 месяцев у ~80% инфицированных женщин вирус уходит из организма самостоятельно, без какого-либо лечения, не вызывая болезней (спонтанная элиминация). И только у небольшого процента женщин с хронической (персистентной) инфекцией, обусловленной высокоонкогенными генотипами ВПЧ, через 10-20 лет может развиться рак шейки матки. Кажется, времени для успешной диагностики и лечения вполне достаточно, но расслабляться не стоит.
Папилломавирусная инфекция очень коварна, и связанные с нею предраковые изменения, как правило, не только не вызывают никакого беспокойства и дискомфорта, но часто и не обнаруживаются при обычном гинекологическом осмотре.
Поэтому для выявления папилломавирусной инфекции применяется ВПЧ-тест методом полимеразной цепной реакции (ПЦР). ВПЧ-тест – надежный помощник врача: обнаружение папилломавируса и определение его генотипа позволяет определить дальнейшую тактику ведения и лечения женщины.
При этом нужно учитывать, что выявление ВПЧ группы высокого канцерогенного риска у женщин не является основанием для постановки диагноза злокачественной опухоли, но служит поводом к дальнейшему обследованию, более интенсивному наблюдению и, при необходимости, лечению предраковых изменений слизистой шейки матки.
Исход ВПЧ-инфекции зависит от генотипа вируса. Все папилломавирусы подразделяются на группы по «вредности» или «онкогенности». ВПЧ-тесты методом полимеразной цепной реакции (ПЦР) позволяют выявить все распространённые и клинически значимые генотипы ВПЧ.
К группе низкого канцерогенного риска относятся 6, 11 генотипы ВПЧ: они могут быть причиной остроконечных кондилом и дисплазий легкой степени. Анализ на ВПЧ 6 и 11 генотипов применяется для дифференциальной диагностики с заболеваниями не папилломавирусной этиологии и при обследовании беременных для оценки риска развития папилломатоза гортани у новорожденных.
К раку шейки матки чаще всех приводят 16 и 18 генотипы папилломавирусов. Они, вместе с 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68 типами входят в группу высокого канцерогенного риска. При проведении анализов на вирус папилломы человека именно на эти генотипы нужно обращать особое внимание. Наиболее важен анализ ДНК ВПЧ 16 типа и 18 типа, особенно, если их концентрация («вирусная нагрузка») высока. А онкогенный потенциал 51 и 56 типов не так велик, поэтому они менее опасны, даже если в анализе на ВПЧ присутствуют в относительно большом количестве.
Они, вместе с 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68 типами входят в группу высокого канцерогенного риска. При проведении анализов на вирус папилломы человека именно на эти генотипы нужно обращать особое внимание. Наиболее важен анализ ДНК ВПЧ 16 типа и 18 типа, особенно, если их концентрация («вирусная нагрузка») высока. А онкогенный потенциал 51 и 56 типов не так велик, поэтому они менее опасны, даже если в анализе на ВПЧ присутствуют в относительно большом количестве.
- Вирус папилломы человека 16/18, качественное определение ДНК, ПЦР
- Вирус папилломы человека 16/18, количественное определение ДНК, ПЦР
- Вирус папилломы человека высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68), суммарное качественное определение ДНК, ПЦР
- Вирус папилломы человека высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52,56, 58, 59), качественное определение ДНК с указанием типа вируса
- Вирус папилломы человека высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68), суммарное количественное определение ДНК
- ВПЧ-тест расширенный (с определением количества и типа вируса)
Сдать анализ на ВПЧ у женщин методом ПЦР (ВПЧ-тест) можно самостоятельно, без направления врача.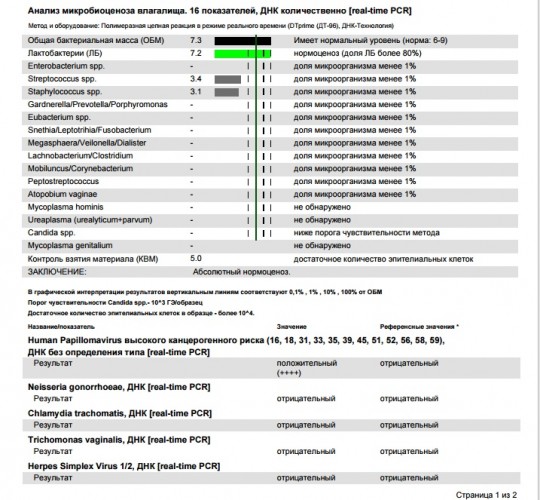 Если ВПЧ-инфекция не выявлена (отрицательный результат ВПЧ-теста), то риск развития рака шейки матки низок. Но следует помнить – при продолжении активной половой жизни риск инфицирования ВПЧ сохраняется.
Если ВПЧ-инфекция не выявлена (отрицательный результат ВПЧ-теста), то риск развития рака шейки матки низок. Но следует помнить – при продолжении активной половой жизни риск инфицирования ВПЧ сохраняется.
При положительном результате ВПЧ-теста, обнаружении ВПЧ высокого канцерогенного риска, необходимо сделать расширенное исследование для уточнения генотипа вируса (анализ ВПЧ – типирование) и «вирусной нагрузки» (вирус папилломы человека – количественный анализ). Затем необходимо обратиться к врачу-гинекологу для проведения кольпоскопии – осмотра шейки матки под увеличением с помощью специального прибора – кольпоскопа.
Все дополнительные анализы на вирус папилломы человека и другие исследования должны проводиться по назначению и под контролем врача.
Если поражение слизистой шейки матки выявлено на ранней стадии, предшествующей раку, то лечение более эффективно и практически не имеет побочных эффектов. Если не обнаружено никаких патологических изменений слизистой шейки матки, то и необходимости в лечении нет: вероятнее всего, организм справится с вирусом самостоятельно.
Однако через 1 год необходимо пройти повторное ВПЧ-тестирование и, если вирус все еще присутствует, снова обследоваться у врача-гинеколога.
Анализ на вирус папилломы человека (ВПЧ) методом ПЦР и цитологические исследования.
В России в систему обязательного медицинского страхования (ОМС) включено цитологическое исследование – «мазок на онкоцитологию». Нужны ли тогда ВПЧ-тесты?
Основой современных скрининговых программ раннего выявления онкологической патологии шейки матки является цитологическое исследование по Папаниколау (ПАП-тест, окраска по Папаниколау). К сожалению, далеко не во всех российских медицинских учреждениях используется эта методика, очень часто применяются другие, менее совершенные способы приготовления (окраски) цитологического мазка.
Кроме того важно знать, что цитологический метод – это не анализ на вирус папилломы человека. Цитология «не видит» сам вирус, а выявляет клетки эпителия, уже измененные под его воздействием, то есть клиническую и субклиническую формы ВПЧ-инфекции. У цитологического теста есть и весьма существенные недостатки – низкая чувствительность, субъективность трактовки и зависимость результата от качества взятия цитологического мазка.
У цитологического теста есть и весьма существенные недостатки – низкая чувствительность, субъективность трактовки и зависимость результата от качества взятия цитологического мазка.
Именно поэтому для традиционного цитологического скрининга характерно большое количество ложноотрицательных и неопределенных результатов, требующих повторных исследований.
Для уменьшения возможности ошибок цитологические тесты были усовершенствованы – внедрён метод жидкостной цитологии. Жидкостная цитология – новая технология приготовления образцов клеток из шейки матки для цитологического исследования. Преимущества данного метода – уменьшение количества неадекватных мазков, артефактов, возможность избежать загрязнения проб воспалительным экссудатом, эритроцитами, что обеспечивает высокое качество цитологических препаратов. Сегодня именно этот метод цитологического скрининга заболеваний шейки матки рекомендован ВОЗ (Всемирной Организацией Здравоохранения) в качестве «золотого стандарта» для исследований цервикальных мазков.
Согласно последним международным и отечественным рекомендациям совместное применение анализа на ВПЧ (ВПЧ-теста методом ПЦР) и цитологического исследования (ПАП-теста) является предпочтительным методом для раннего выявления онкологической патологии шейки матки у женщин старше 29 лет. Такой скрининг необходимо проходить регулярно – один раз в 3 года.
Полезные статьи на сайте лаборатории Литех
ВПЧ — мелкие ДНК-овые вирусы, характерная особенность которых заключается в способности вызывать пролиферацию эпителия кожи и/или слизистых оболочек. Они относятся к семейству паповавирусов. ВПЧ не размножаются в культуре клеток, поэтому сведения о биологии вирусов получены с помощью молекулярно-генетических технологий и эпидемиологических исследований. Показано существование 100 типов, отличающихся по строению ДНК, 75 из них молекулярно клонированы и полностью секвенированы. Типирование ВПЧ основано не на антигенных различиях, а на ДНК-гомологии.
Среди 30 типов ВПЧ, которые поражают аногенитальную область, различают типы высокого и низкого онкогенного риска.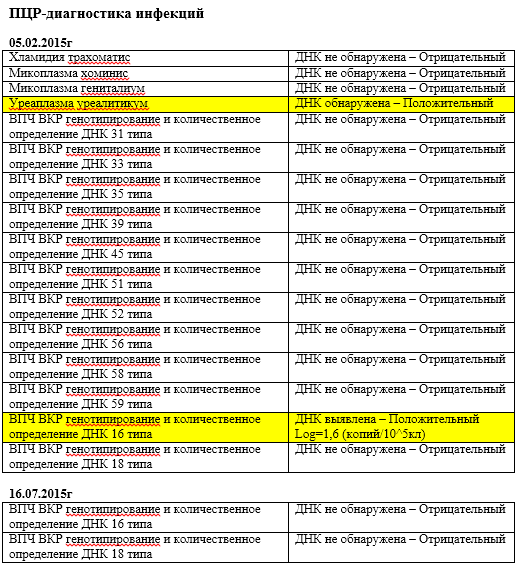 В 93% случаев инвазивного рака аногениталий обнаруживают ВПЧ, при этом 50% из них – ВПЧ 16.
В 93% случаев инвазивного рака аногениталий обнаруживают ВПЧ, при этом 50% из них – ВПЧ 16.
Установлен половой путь передачи ВПЧ-инфекции. Вследствие частого бессимптомного пребывания ВПЧ в организме инфицированные люди зачастую не знают, что они инфицированы. Недавно появившиеся генитальные бородавки более инфекционны, чем давно существующие.
Резкое снижение иммунитета, наблюдаемое при СПИДе, при лечении цитотоксическими препаратами, сопровождается реактивацией латентной папилломавирусной инфекции, что клинически проявляется в виде образования множественных папилломатозных разрастаний.
Как происходит репликация вируса, сборка вирусных частиц и их высвобождение из клетки считать полностью установленными еще нельзя.
Известны два способа репликации — постоянная репликация эписомного генома в базальном слое эпителия и вегетативная репликация в более дифференцированных клетках гранулярного слоя. Репликация эписомного генома происходит постоянно, но количество копий ДНК низкое. Вегетативная репликация происходит в ядрах клеток, где генерируется потомство. Высвобождение вирусных частиц происходит в результате дегенерации десквамированных клеток.
Вегетативная репликация происходит в ядрах клеток, где генерируется потомство. Высвобождение вирусных частиц происходит в результате дегенерации десквамированных клеток.
Вирус заражает самый нижний глубокий слой кожи или слизистой оболочки, происходит усиленное размножение клеток этого слоя, что и приводит к образованию разрастаний. Сам вирус в глубоких слоях не размножается, его интенсивное размножение происходит в поверхностных слоях — в чешуйчатых клетках, которые по мере оттеснения к поверхности перестают делиться и становятся более пригодными для размножения вируса.
Вирус папилломы человека в отличие от многих других вирусов, не растет в культуре клеток и не может быть получен в виде массы вирусных частиц — вирионов. Однако с помощью электронного микроскопа вирионы этого вируса обнаружены в пораженных тканях.
Вирус может быть найден также с помощью современных молекулярно-биологических методов, которые основаны на обнаружении дезоксирибонуклеиновой кислоты, являющейся геномом вируса.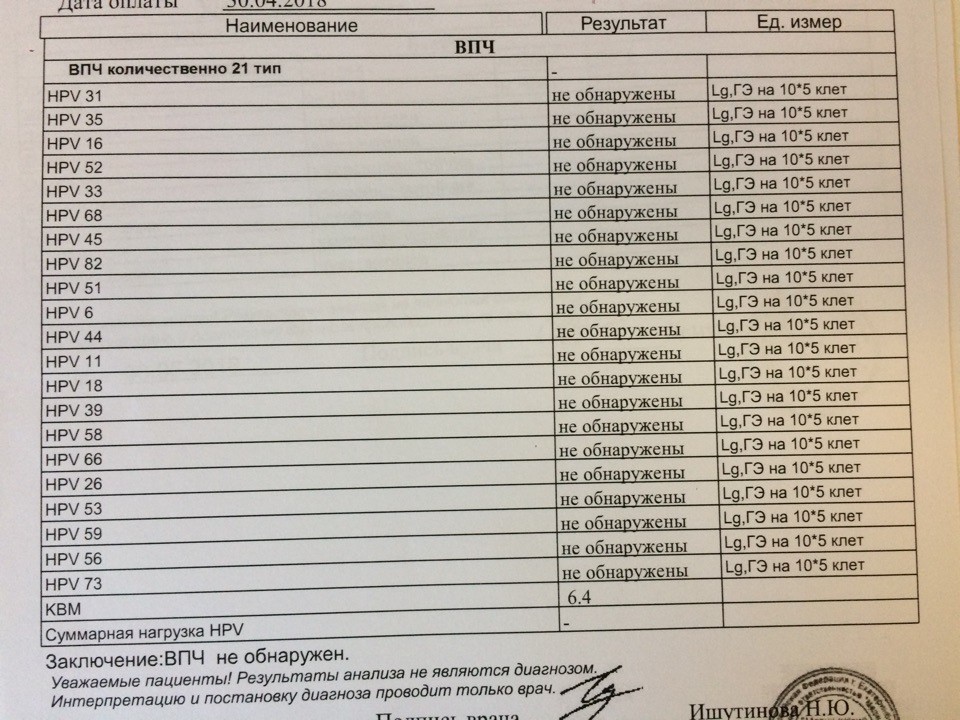 Нуклеиновые кислоты ДНК и РНК обладают способностью к гибридизации. С помощью нагревания или действия химических веществ ДНК из двухнитевой спирали переходит в однонитевую, но сохраняет способность достраивать вторую нить, комплементарную к существующей при наличии в реагирующей среде затравок (праймеров), которые определяют направление достройки второй нити, и химических веществ для построения ДНК. Процесс воссоздания второй нити по образцу одиночной нити или ее части называют молекулярной гибридизацией, а участок, который используют в гибридизации (участок ДНК или РНК), называют зондом.
Нуклеиновые кислоты ДНК и РНК обладают способностью к гибридизации. С помощью нагревания или действия химических веществ ДНК из двухнитевой спирали переходит в однонитевую, но сохраняет способность достраивать вторую нить, комплементарную к существующей при наличии в реагирующей среде затравок (праймеров), которые определяют направление достройки второй нити, и химических веществ для построения ДНК. Процесс воссоздания второй нити по образцу одиночной нити или ее части называют молекулярной гибридизацией, а участок, который используют в гибридизации (участок ДНК или РНК), называют зондом.
Благодаря молекулярно-гибридизационным методам стало известно, что существует много типов папилломавирусов, 30 из них инфицируют половые органы и область заднего прохода. У женщин инфицируется и покрывается генитальными бородавками область преддверия влагалища, стенки влагалища, шейка матки, наружное отверстие уретры. У мужчин поражается головка полового члена, крайняя плоть, мошонка, анальная область.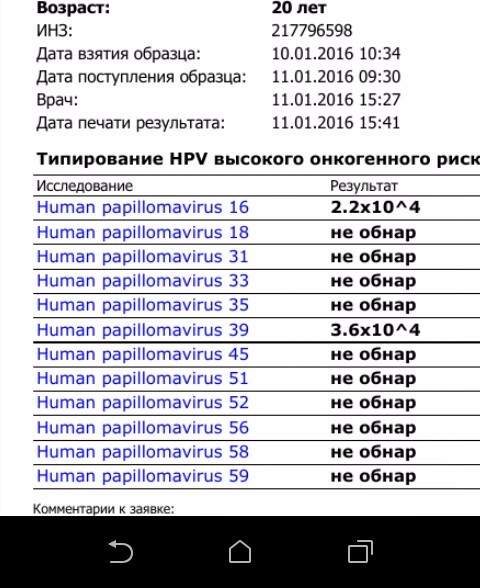 В родах папилломавирус передается новорожденному ребенку.
В родах папилломавирус передается новорожденному ребенку.
В табл. 1 приведены типы ВПЧ, встречающиеся при различных заболеваниях.
По мере изучения ВПЧ гибридизационными методами выяснилось, что риск злокачественного перерождения связан с несколькими типами ВПЧ. Они были обозначены как вирусы высокого риска онкогенного заболевания. Это типы ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68. Перечень типов ВПЧ высокого онкогенного риска расширяется за счет уточнения строения ДНК и появления новых типов промежуточного риска.
Вирусами низкого риска остаются 5 типов ВПЧ — 6, И, 42, 43, 44. Отмечено, что 16 тип наиболее часто встречается в ткани плоскоклеточного рака шейки матки, а 18 тип — в ткани железистого рака — аденокарциномы. Установлено, что существуют дозазависимые отношения, т.е. при высоком содержании ДНК ВПЧ в материале, взятом из шеечного канала матки, риск опухоли или неоплазии более высок и наоборот. В табл. 2 сведены признаки, связанные с ВПЧ-инфекцией, обусловленной онкогенными и неонкогенными типами ВПЧ.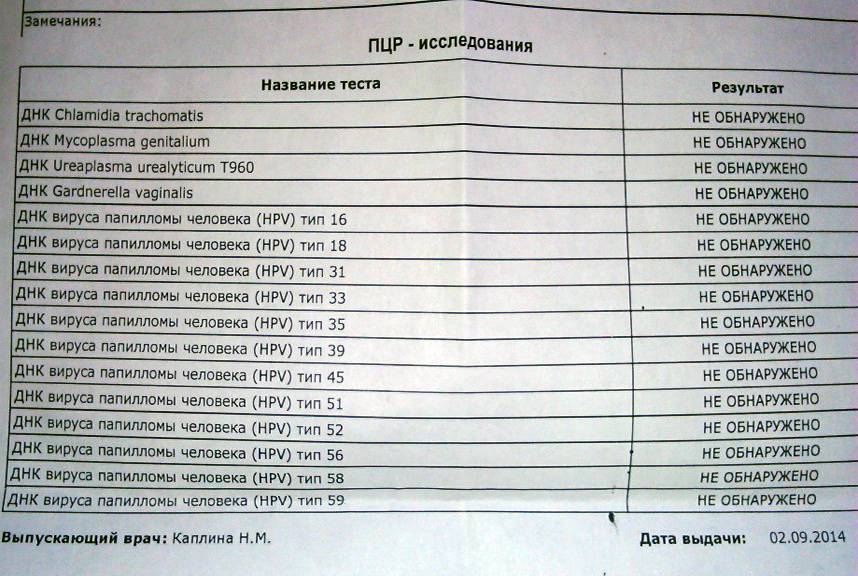
Максимальная заболеваемость, обусловленная ВПЧ, наблюдается в возрасте от 18 до 28 лет. Однако и в старших группах в силу возрастных изменений иммунитета и гормональной функции, которые благоприятствуют многим факторам канцерогенеза, возможны проявления папилломавирусной инфекции и клеточная трансформация ракового характера.
Таблица 1
Типы ВПЧ, обнаруженные при различных поражениях кожи и слизистых оболочек (Villiers E. М., 1989)
|
Клинические появления |
ВПЧ типы |
|
Кожные поражения |
|
|
Подошвенные бородавки |
1,2,4 |
|
Обычные бородавки |
2, 4, 26, 27, 29, 57 |
|
Плоские бородавки |
3,10,28,49 |
|
Бородавки Бютчера |
7 |
|
Бородавчатая эпидермодисплазия |
5, 8, 9, 10, 12, 15, 19, 36 |
|
Небородавчатые кожные поражения |
37,38 |
|
Поражения слизистых гениталии |
|
|
Condylomata accuminata |
6, 11,42-44,54 |
|
Некондиломатозные поражения |
43, 51, 52, 55, 56, 57—59, 61, 64, 67—70 |
|
Карцинома |
16, 18, 31, 33, 35, 39, 45, 51, 52, 54, 56, 66, 68 |
|
Поражения слизистых оболочек не гениталий |
|
|
Папиллома гортани |
6, 11,30 |
|
Карцинома шеи, языка |
2,6, 11, 16, 18,30 |
Таблица 2 Различия ВПЧ-инфекции в зависимости от генотипа вируса
|
Признак |
Типы вируса |
|
|
Онкогенные (16, 18 и др.) |
Неонкогенные (6, 1 1 и др.) |
|
|
Персистирующее течение Количество вируса (число копий наклетку) |
Всегда 1 1 1.5 |
Редко 3.8 |
ВПЧ – КВД №2
Что такое ВПЧ?
Генитальная папилломавирусная инфекция – это инфекция, передаваемая половым путем (ИППП). Возбудитель папилломавирусной инфекции – вирусы папилломы человека (ВПЧ). Вирусы папилломы человека – это группа вирусов, которая включает около 100 различных типов. Более 30 типов ВПЧ передаются половым путем, инфицируют половые органы и область ануса женщин и мужчин.
Большинство инфицированных не знают о своем заболевании, не имеют клинических проявлений и, более того, могут самопроизвольно выздороветь.
Часть этих вирусов называют вирусами «высокого канцерогенного риска», они могут вызвать предраковые поражения гениталий. Исследования последних лет подтвердили главную роль ВПЧ в развитии рака шейки матки. ВПЧ высокого риска также играют роль в возникновении рака вульвы, влагалища у женщин и рака полового члена у мужчин. К вирусам высокого риска относят 16, 18, 31, 33, 35, 39, 45, 52, 53, 56, 58, 59, 68, 69 типы – эти типы ВПЧ ответственны за 95-98% случаев развития рака шейки матки. Они вызывают рост ненормальных клеток, который является обычно плоским и почти невидим при обычном осмотре по сравнению с доброкачественными бородавками, которые вызываются вирусами низкого риска – 6, 11 типами. Доброкачественные аногенитальные бородавки появляются через 2 – 6 месяцев после заражения. На развитие предраковых или раковых изменений, связанных с носительством ВПЧ высокого риска уходят годы и часто происходит самопроизвольное излечение от ВПЧ.
Инфекция наиболее распространена в возрасте от 15 до 40 и затрагивает одинаково и женщин и мужчин. К 50 годам жизни, около 80 процентов женщин приобретут ВПЧ – инфекцию.
Около 50-75% сексуально активных людей инфицируются ВПЧ в течение их жизни, и в большинстве случаев инфекция не вызывает заболевания и самопроизвольно излечивается.
Приблизительно 90% ВИЧ-инфицированных также имеют ВПЧ-инфекцию.
Как передается ВПЧ
Вирусы папилломы человека, инфицирующие половую область, передаются, через половые контакты. Большинство заразившихся не имеют видимых проявлений заболевания и поэтому носители ВПЧ не знают о своем инфицировании и могут заразить своих половых партнеров. Иногда инфицированная мать может заразить новорожденного во время родов. Это может привести к так называемому папилломатозу гортани новорожденных.
Проявления инфекции
Большинство заразившихся людей не знают об этом. ВПЧ часто не вызывает никаких проявлений на коже и слизистых оболочках. У части людей развиваются половые бородавки или происходят предраковые изменения на шейке матки, вульве, анальной области или половом члене. Очень редко эти изменения переходят непосредственно в рак. От инфицирования до развития тяжелой дисплазии в среднем проходит 20 лет. Большинство женщин спонтанно излечиваются в течение 9 – 15 месяцев от момента заражения. Основное проявление папилломавирусной инфекции – половые бородавки или остроконечные кондиломы (вызываются ВПЧ 6 и 11 типа) – мягкие бородавчатые образования на короткой тонкой ножке, напоминающие цветную капусту или петушиный гребень с различным расположением (головка полового члена, половой член, малые и большие половые губы, влагалище, шейка матки, область ануса). Остроконечные кондиломы появляются через 2 – 6 месяцев после заражения. Видимые кондиломы обнаруживаются при осмотре.
Диагностика инфекции
Диагностика кондилом проводится на основании осмотра. Диагностика ВПЧ высокого канцерогенного риска и связанных с ними изменений, более сложная задача. В основе диагностики предраковых заболеваний шейки матки в течении многих стоял цитологический анализ мазка (исследование мазка под микроскопом). Однако он имеет ряд существенных недостатков – сложность, низкая чувствительность и высокая частота неопределенных результатов. Американский комитет FDA (комитет по медикаментам и продовольствию) одобрил исследование ВПЧ методом полимеразной цепной реакции – ПЦР, который может определить 13 типов ВПЧ высокого риска. ПЦР на ВПЧобладает высокой чувствительностью, прост в исполнении. Совместное использование цитологических исследований и ПЦР тестов позволяет значительно повысить эффективность диагностики, чувствительность увеличивается до 99 – 100%. Применяемые в РКВД ПЦР тест-системы не уступают, а чаще, даже превосходят зарубежные аналоги. Важно, что выявление ВПЧ высокого риска происходит задолго до появления предраковых изменений слизистых.
ПЦР исследование на ВПЧ высокого риска рекомендовано:
– Как первичный метод в дополнение к цитологии для женщин старше 30 лет.
– Для разрешения сомнительных результатов цитологического исследования.
– Пациенткам, проходящим лечение по поводу дисплазии или рака.
– На первом этапе диагностики для стран, где плохо организованы программы обследования на папилломавирусную инфекцию.
– Для обследования мужчин.
Можно ли излечить это заболевание?
Диагностика и лечение ИППП, должна проводиться в условиях специализированной клиники – КВД, имеющей все необходимые средства для быстрой и точной диагностики.
Специфического лекарства против ВПЧ на сегодняшний день нет. Существует множество методов удаления кондилом, но болезнь может вернуться вновь, поскольку вирус остается в организме человека. Рецидивы возможны в 25% случаев в течение 3 месяцев после лечения. При лечении кондилом необходим осмотр половых партнеров. Однако подавляющее большинство половых партнеров заражены ВПЧ и просто не имеют видимых проявлений заболевания.
Лечение предраковых заболеваний заключается в использовании химических, физических и других методов, с целью изменить структуру пораженных участков слизистых оболочек, а также в применении препаратов стимулирующих иммунитет. В дальнейшем необходимо ежегодное цитологическое исследование и определение ВПЧ методом ПЦР.
Какая связь между ВПЧ и раком шейки матки?
Только факты:
- Вирусы папилломы человека высокого риска являются основной причиной рака шейки матки.
- В случаях тяжелой дисплазии (предрака) и рака шейки матки ВПЧ выявляется почти в 100% случаев.
- Выявление ВПЧ связано с 250-кратным увеличением риска развития тяжелой дисплазии.
- Рак шейки матки занимает 1-е место среди причин женской смертности в развивающихся странах.
- Рак шейки матки занимает 2-е место после рака молочной железы среди женщин в мире – 250 тысяч смертей ежегодно.
- В России ежегодно 12 300 женщин заболевает раком шейки матки и более 6 тысяч пациенток ежегодно умирает.
- За последние 10 лет средний возраст заболевших снизился с 58 до 55 лет.
- У женщин до 29 лет заболеваемость выросла в 2 раза.
- ВПЧ высокого риска вызывают рак шейки матки в 100% случаев, рак заднего прохода – 90%, рак влагалища и вульвы – 40%, рак полового члена – 40% и рак ротоглотки в 12% случаев.
- Американское Общество Раковых Заболеваний прогнозировали на 2004 год, что приблизительно у 10 520 женщин разовьется агрессивный рак шейки матки и приблизительно 3 900 женщины умрут от этой болезни. Большинство женщин с агрессивным раком шейки матки, не проходили правильного обследования на ВПЧ инфекцию.
Профилактика инфекции
Вернейший способ предотвращения половой ВПЧ-инфекции состоит в том, чтобы воздержаться от любого полового контакта с другим индивидуумом.
Долговременные сексуальные отношения с постоянным половым партнером не дает 100% гарантии от инфицирования ВПЧ. Трудно определить, без специальных тестов, инфицирован ли в настоящее время половой партнер.
Мужские презервативы из латекса, при правильном применении снижают риск передачи инфекции.
Любые проявления, такие как боль или неприятные ощущения при мочеиспускании, необычная сыпь, выделения являются сигналом для прекращения половых контактов и немедленного обследования в условиях специализированной клиники – РКВД. Если у больного обнаружены ИППП, он должен сообщить об этом своим половым партнерам, для того чтобы они также прошли полное обследование и соответствующее лечение. Это снизит риск развития серьезных осложнений и предотвратит возможность повторного заражения.
Что такое ВПЧ 16 и 18?
Около 40 из 150 или около того типов ВПЧ могут инфицировать области гениталий и другие слизистые оболочки (например, ротовую полость и горло), но только часть из них может вызывать рак.
У большинства людей ВПЧ-инфекции носят временный характер, поскольку инфицированные клетки выделяются из организма естественным путем. Однако у меньшинства людей ВПЧ сохраняется, и если стойкий ВПЧ относится к типу 16 или 18, наблюдается заметное увеличение риска развития генитального, анального или орального рака (в зависимости от того, где находится инфекция).
Но даже у людей, у которых сохраняется ВПЧ, время от инфицирования ВПЧ высокого риска до развития рака обычно измеряется годами.
У женщин такой медленный рост позволяет обнаруживать предраковые изменения в клетках шейки матки, называемые дисплазией, с помощью скрининговых мазков Папаниколау или, в последнее время, тестов на ВПЧ, которые ищут типы ВПЧ высокого риска в клетках шейки матки.
Не существует скрининговых тестов для выявления рака других частей тела, связанного с ВПЧ.
ВПЧ является обычным, но часто неправильно понятымВПЧ, по оценкам, заражает более 90 процентов U.S., ежедневно заражаются около 12 000 американцев в возрасте от 15 до 24 лет. Это наиболее часто диагностируемое заболевание, передающееся половым путем (ЗППП) в США и за рубежом.
ВПЧ также вызывает обычные кожные бородавки, которые не считаются ЗППП.
Однако, несмотря на его повсеместное распространение, широко распространенное мнение о ВПЧ неверно.
«Самое распространенное заблуждение, которое возникают у моих пациентов, когда они получают положительный результат теста на ВПЧ высокого риска, состоит в том, что это ЗППП, похожее на хламидиоз или герпес», – говорит Джейн О, доктор медицины, гинеколог (акушер-гинеколог). в Арлингтон-Хайтс, штат Иллинойс.
Хотя ВПЧ передается половым путем, доктор О говорит, что почти каждый, кто имел половые контакты, рано или поздно заразится ВПЧ.
«Единственные люди, у которых не будет ВПЧ, – это те, кто никогда не имел сексуальных контактов с кем-либо или с кем-то, у кого был половой контакт с одним партнером, который также никогда не имел сексуальных контактов с кем-либо», – добавляет Ох.
Как я узнаю, что у меня ВПЧ?Несмотря на то, что ВПЧ является обычным явлением, многие женщины никогда не узнают, что заразились им, поскольку инфицированные ВПЧ клетки часто выделяются из шейки матки без какого-либо вмешательства.
Это особенно верно для женщин младше 30 лет.
«Много раз, когда женщины заражаются ВПЧ в молодом возрасте, наблюдается высокий уровень выведения вируса, и они, как правило, избавляются от него самостоятельно, без каких-либо процедур, таких как кольпоскопия, которую мы часто выполняли в начале 2000-х годов. – сказала Салена Занотти, доктор медицины, акушер-гинеколог клиники Кливленда в Эйвоне, штат Огайо. «Это потому, что наша иммунная система определенно более активна, чем мы моложе».
Кольпоскопия – это процедура, при которой для исследования шейки матки используются увеличительное устройство и яркий свет.
По этой причине Центры по контролю и профилактике заболеваний (CDC) и Американский колледж акушеров и гинекологов рекомендуют, если у женщины в анамнезе нормальные мазки Папаниколау и нет определенных факторов риска, таких как ослабленный иммунитет. Система должна сдавать мазок Папаниколау и тест на ВПЧ каждые пять лет с 30 до 65 лет.
Занотти говорит, что она проводит тест на ВПЧ у кого-то в возрасте двадцати лет, только если у него был сдан мазок Папаниколау. назад с ненормальными результатами.
«Чтобы помочь отсортировать эти показания, мы проводим тест на ВПЧ», – сказал Занотти.
Хотя О соглашается с тем, что женщинам в возрасте от двадцати лет не нужно проходить тестирование на ВПЧ, она проверяет своих пациентов не реже одного раза в три года, начиная с 30 лет.
«В своей практике я встречал женщин с отрицательным результатом на ВПЧ в один год и с положительным результатом в следующем. Многое может произойти за пять лет, поэтому я не собираюсь терять время на тестирование», – говорит О.
Что делать, если результат анализа на ВПЧ 16 или 18 окажется положительным?Положительный результат теста на ВПЧ 16 или 18 не гарантирует, что у вас разовьется рак шейки матки, но это означает, что любая дисплазия, обнаруженная при мазке Папаниколау, сопряжена с более высоким риском развития рака.
На основе результатов этих двух тестов ваш врач может разработать план либо лечения дисплазии, либо проведения дополнительных анализов, чтобы исключить рак, либо порекомендовать более частые контрольные визиты для поиска дополнительных изменений.
«Клетки шейки матки тестировались в течение длительного времени, и мы знаем, какие изменения в шейке матки вызывает ВПЧ», – отмечает Занотти.
Если вам поставят диагноз ВПЧ и все остальные тесты пройдут успешно, то, скорее всего, ВПЧ исчезнет сам по себе в течение одного-двух лет, если у вас нет подавленной иммунной системы.
Как насчет скрининга на анальный ВПЧ?Если вас беспокоит ВПЧ в заднем проходе, О добавляет, что ВПЧ не вызывает таких же изменений в заднем проходе, как шейка матки, поэтому мазок Папаниколау не будет эффективным тестом для выполнения.
Ваш врач может направить вас к специалисту, который выполняет мазки Папаниколау анального канала, аноскопию или аноскопию с высоким разрешением, в которых используется увеличительный инструмент с высоким разрешением для выявления аномальных клеток.
Повышение заболеваемости раком горла, связанным с ВПЧ 16В течение многих лет тяжелое употребление табака и алкоголя было основными факторами риска развития рака ротоглотки – задней части горла, включая основание языка и миндалины.
Сегодня ВПЧ является основной причиной рака ротоглотки во всем мире.
В США считается, что ВПЧ вызывает 70 процентов всех случаев рака ротоглотки, а ВПЧ 16 вызывает 60 процентов всех случаев рака ротоглотки, согласно данным CDC. (1)
Как оральная ВПЧ-инфекция, так и связанный с ВПЧ рак ротоглотки гораздо чаще встречаются среди мужчин, чем среди женщин.
Кроме того, оральная инфекция ВПЧ 16 встречается у мужчин в шесть раз чаще, чем у женщин в возрасте от 18 до 69, согласно отчету, опубликованному 17 ноября в журнале Annals of Internal Medicine .(2)
В отчете дополнительно обнаружено следующее:
- Общая распространенность оральной инфекции ВПЧ составляла 11,5 процента среди мужчин и 3,2 процента среди женщин.
- Оральная ВПЧ-инфекция высокого риска была более распространена среди мужчин, чем среди женщин, 7,3 процента по сравнению с 1,8 процента.
- Среди мужчин, которые сообщили о наличии двух или более однополых партнеров по оральному сексу, распространенность инфекции ВПЧ высокого риска составила 22,2 процента.
- Распространенность орального ВПЧ среди мужчин, которые также были инфицированы генитальным ВПЧ, была в четыре раза выше (19.3 процента), чем среди лиц без генитального ВПЧ (4,4 процента).
Хорошая новость заключается в том, что при раке ротоглотки, вызванном ВПЧ, пятилетняя выживаемость после лечения намного выше, чем при раке головы и шеи, не связанном с ВПЧ. (3)
СВЯЗАННЫЕ: 5 фактов, которые нужно знать о связанном с ВПЧ раке горла
Защищает ли вакцина против ВПЧ от типов 16 и 18?Вакцина против ВПЧ, Гардасил 9, защищает как от типов 16, так и от 18, а также от нескольких других типов вируса, вызывающих рак, и от двух основных причин генитальных бородавок.
CDC рекомендует всем мальчикам и девочкам делать вакцину против ВПЧ в возрасте 11 или 12 лет. Однако ее можно вводить в возрасте до 26 лет для женщин и до 21 года для мужчин.
CDC дополнительно рекомендует вакцину всем мужчинам, имеющим половые контакты с мужчинами, и мужчинам с ослабленной или ослабленной иммунной системой, в том числе от ВИЧ, в возрасте до 26 лет.
Занотти отмечает, что некоторые родители не решаются давать своему ребенку вакцину против ВПЧ. потому что ВПЧ связан с сексуальной активностью.
«Я говорю своим пациентам:« Если вы вакцинировали своего ребенка от кори, эпидемического паротита и краснухи, в наши дни он с большей вероятностью заразится ВПЧ, чем краснухой, а ВПЧ – это то, что вызывает рак.Это довольно ясно: если вы можете сделать что-то, чтобы предотвратить рак, почему бы и нет? »- говорит она.
Занотти добавляет, что, хотя все больше родителей делают прививки своим сыновьям, это все еще не так распространено, как вакцинация девочек. «Но если в следующие 10 лет мальчики будут вакцинироваться так же часто, мы увидим, что количество ВПЧ значительно снизится», – говорит она.
Тем не менее, О предупреждает, что вакцина против ВПЧ не устраняет необходимость более безопасные сексуальные практики.
«Каждый должен знать, что вакцина против ВПЧ не является надежным методом предотвращения всех видов рака шейки матки», – говорит она.«Нам все еще нужно защищать себя: используйте презервативы, ограничивайте количество партнеров, поддерживайте нашу иммунную систему и получайте мазки Папаниколау, чтобы предотвратить рак шейки матки».
Секвенирование ДНК: еще не совсем HPC
Секвенирование ДНКпривело к беспрецедентным открытиям в области наук о жизни с момента появления технологий секвенирования следующего поколения (NGS) десять лет назад. Сейчас, когда стоимость секвенирования генома человека падает ниже 1000 долларов, в центре внимания оказывается реальность персонализированной медицины, и в основе всего этого лежит секвенирование ДНК.Однако каждый секвенированный геном является продуктом обширного вычислительного процесса, который преобразует сотни гигабайт необработанных выходных данных секвенатора в согласованные геномы, и индустрия секвенирования требует все более крупных вычислительных ресурсов и ресурсов хранения, чтобы не отставать.
Крупные центры секвенирования сейчас сталкиваются со многими проблемами горизонтального масштабирования, которые высокопроизводительные вычисления (HPC) решали в течение многих лет, и интеллектуальные центры секвенирования быстро осознали, что наем людей, имеющих опыт работы в операциях HPC, делает их впереди. кривой управления крупномасштабной вычислительной инфраструктурой.А с учетом известного факта, что технология секвенирования ДНК опережает закон Мура, это масштабное масштабирование необходимо будет ускорить, то есть для каждого нового поколения секвенсоров потребуется больше , а не просто более быстрые вычисления и хранение.
Несмотря на растущий размер вычислительных кластеров и кластеров хранения в цехах секвенирования, в области вычислительной биологии, основанной на секвенировании, фактически еще не используются высокопроизводительные вычисления. На самом деле, маловероятно, что на важные научные вопросы, на которые в ближайшем будущем ответит биоинформатика, потребуются суперкомпьютеры.Скорее, вычислительные потребности секвенирования ДНК могут быть удовлетворены более экономично за счет использования лабораторных и ориентированных на предприятие технологий.
Вкратце, имеет смысл изучить основные точки соприкосновения между биоинформатикой и киберинфраструктурой высокопроизводительных вычислений: (1) вычислительная нагрузка, исходящая от секвенирования ДНК, (2) критические параметры производительности, которые определяют эффективную архитектуру системы для данных рабочих нагрузок, и (3) ) алгоритмы и приложения, используемые для продвижения в этой области.
Вычислительная нагрузка
Параллелизм данных Статистические методы и лежат в основе всех рабочих нагрузок по секвенированию ДНК, поскольку физический процесс декодирования ДНК подвержен ошибкам. Эти ошибки и неопределенности ошибок эффективно смягчаются путем многократного секвенирования одних и тех же фрагментов ДНК и расчета показателей качества – показателя того, насколько вероятно, что любая конкретная точка данных может быть ошибкой, – которые распространяются практически на все вычисления, выполняемые по всему набору геномных данных.На очень высоком уровне общий процесс работы с секвенированной ДНК можно разбить на три этапа, каждый со своими собственными требованиями к хранилищу и вычислениям.
Шаг № 1 включает в себя запуск инструмента физического секвенсора («секвенирование») и преобразование необработанных выходных данных оптических или электронных датчиков в миллионы коротких считываний, состоящих из As, Ts, Gs и Cs («базовый вызов») . Все вычисления на этом этапе выполняются на самом приборе секвенирования, что минимизирует нагрузку на внешнюю вычислительную инфраструктуру.Кроме того, выходные данные рассчитываются практически в реальном времени и непрерывно копируются в сетевую файловую систему, что приводит к перемещению сетевых данных, которое в среднем составляет около десятка мегабит / сек в течение нескольких дней работы секвенсора.
Шаг № 2 сопоставляет миллионы коротких чтений, сгенерированных на этапе № 1, с эталонным геномом («выравнивание»), чтобы определить, как все эти чтения подходят друг другу. Как только эти миллионы считываний собираются вместе, части выровненной последовательности, которые отличаются от эталонного генома, вызываются («вызов варианта») и сохраняются в виде более компактного набора данных.Этот шаг может удвоить или утроить размер набора данных, полученного на шаге № 1, потребовать до десяти раз больше места для рабочего места и потребовать сотни или тысячи основных часов.
Шаг № 3 берет названные варианты и пытается соотнести эти различия с научными или медицинскими значимыми явлениями. Это может включать перекрестные ссылки на вызываемые варианты с базами данных известных вариантов, попытку найти недокументированные варианты, общие для общей группы пациентов, которые имеют такое же заболевание, или любое количество других анализов более высокого порядка.
Львиная доля вычислительных ресурсов потребляется на этапе № 2, который часто принимает форму дюжины или более приложений, которые объединяются в конвейер для постепенного уточнения и исправления ошибок согласования и вызываемых вариантов. Большинство отделов секвенирования проводят секвенирование до конца шага № 2, прежде чем передать данные обратно биологам, поскольку эти конвейеры достаточно стандартизированы и следуют общей концептуальной процедуре. Хотя исследователи, как правило, имеют собственный выбор конкретных приложений и опций для конвейеров вызова вариантов, шаг № 2 обычно очень мало различается между запусками секвенсора в любом конкретном цехе секвенирования, а вычислительные требования обусловлены требованиями высокой пропускной способности, а не высокой производительности. .
Скорее, инновации и научные открытия происходят на этапе № 3, и в отличие от этапа № 2, требующего больших вычислительных ресурсов, анализ на этапе № 3 чаще всего выполняется в вычислительной инфраструктуре лабораторного масштаба. Инструменты и анализы часто разрабатываются индивидуально и реализуются на относительно низкопроизводительных, но хорошо используемых языках, таких как R, Python и Perl, и многие анализы, которые напоминают операции, подобные SQL, выигрывают от хранения геномных данных в реляционных базах данных. Хотя полезность Python как языка HPC неуклонно растет, R начинает демонстрировать большую поддержку параллелизма, а SQL, поддерживаемый HPC, показал большие перспективы в биоинформатике, эффективная интеграция этих инструментов с традиционной инфраструктурой HPC все еще находится в зачаточном состоянии.
Просто гораздо чаще можно увидеть множество копий одного и того же сценария R или Python, анализирующих разные подмножества набора геномных данных, чем увидеть, как одно распараллеленное приложение анализирует весь геном на нескольких узлах. Это результат двух основных факторов:
- С помощью анализа геномных данных в масштабе рабочей станции еще предстоит сделать грандиозное открытие, поэтому инвестиции в разработку программного обеспечения не окупаются.
- Секвенирование по-прежнему слишком дорого, чтобы собирать достаточно большие наборы данных для проведения статистического анализа вариантов, который потребовал бы сильно связанных многоузловых вычислений
Ни один из этих двух факторов не является принципиально ограничивающим, и очень вероятно, что более сложные анализы, которые обнаруживают сложные взаимосвязи между целыми геномами или большими наборами выборок, станут более распространенными в ближайшие годы.Вероятно, что эти вычисления, которые могут включать решение очень больших разреженных матриц, превратятся в настоящие методологии HPC, когда базовая наука станет ограничиваться скоростью R и Python. Начало этой эволюции уже очевидно с появлением биоинформатики на графических процессорах, Xeon Phis, FPGA, других специализированных ASIC, но в действительности эти ускоренные приложения почти исключительно демонстрируют доказательства концепции, обращаясь только к небольшому подмножеству проблем или решая тривиально параллельные задачи.
Топология сети
Большая часть вычислительной нагрузки, которая лежит после секвенирования ДНК, приходится на рутинные процессы выравнивания и вызова вариантов, которые, как правило, очень параллельны данным. Подобно приложениям в HPC, этот вариант конвейера вызова создает большую нагрузку на сеть из-за больших объемов данных, которые необходимо перемещать между подключенным к сети хранилищем и узлами, выполняющими вычисления. Однако, в отличие от обычных высокопроизводительных вычислений, практически никакой из этого сетевого трафика с высокой пропускной способностью не перемещается между вычислительными узлами; скорее, наиболее важный путь к данным лежит между вычислительной структурой и межсоединением хранилища.Таким образом, ключевым моментом является оптимизация топологии кластера для большой входящей и выходной полосы пропускания, а не для разделения полосы пропускания фабрики.
Рассмотрим типичную ориентированную на вычисления систему, такую как Cray XE6 от NERSC, Hopper, которая имеет 6384 вычислительных узла, соединенных в трехмерный тор. Несмотря на то, что он имеет огромную пропускную способность в рамках вычислительной структуры (более 3,8 ТБ / с в каждую сторону), данные, которые должны покинуть эту структуру, чтобы отправиться на диск, направляются через 56 узлов XIO, подключающихся к временной файловой системе Hopper.Эта конфигурация обеспечивает гораздо более скромную поперечную полосу пропускания между вычислениями и хранилищем – 224 ГБ / с, так что при пиковой нагрузке каждый вычислительный узел может только читать и записывать данные в хранилище со скоростью около 36 МБ / с.
Чтобы представить эти 36 МБ / с в перспективе, рассмотрим следующий профиль ввода-вывода из задания, которое сортировало около 630 гигабайт ДНК:
Samtools составляет 1,38 ТБ выровненных чтений на 16-ядерном узле, показывающих 930 МБ / с непрерывного чтения.Для этого задания один узел читал со средней скоростью 930 МБ / с за 5.5 часов, а это означает, что только 247 из 6 384 вычислительных узлов Hopper смогут выполнять такого рода задания до того, как будут полностью загружены узлы ввода-вывода. Конечно, эта скорость чтения 930 МБ / с на узел – это крайний предел того, что потребуется для работы в биоинформатике (или другом), но такая нагрузка была бы немыслимой для кластера анализа секвенирования, если бы несколько секвенсоров ДНК завершили секвенирование в в то же время.
Таким образом, для операций упорядочивания требуются кластеры с явно ориентированными на данные структурами.Кластеры с интенсивным использованием данных, такие как Gordon в SDSC, представляют собой значительный шаг в этом направлении; как и Hopper, он имеет межсоединение в виде трехмерного тора, которое обеспечивает скромную пропускную способность пополам 384 ГБ / с по всей вычислительной структуре [1]. Однако подсистема хранения подключена к этой вычислительной фабрике в каждой точке трехмерного торуса, обеспечивая два основных преимущества для возможностей ввода-вывода Gordon:
- Каждый вычислительный узел использует коммутатор InfiniBand совместно с узлом ввода-вывода, который выполняет маршрутизацию к структуре хранения. Это гарантирует однопроходный путь данных от вычислений к хранилищу, который никогда не должен касаться структуры тора [2].
- Совокупное соотношение вычислительных ресурсов к узлу ввода-вывода составляет впечатляющие 16: 1 (сравните с Blue Waters 56: 1, Hopper 114: 1 или HECToR 234: 1).
Эти два фактора обеспечивают поперечную полосу пропускания 160 ГБ / с между вычислительной структурой и структурой хранения, несмотря на то, что структура хранения основана на 20 Гбит / с Ethernet вместо 32 Гбит / с QDR InfiniBand. Эта конфигурация предоставляет каждому вычислительному узлу 156 МБ / с при полной загрузке ввода-вывода, что в 4 раза больше, чем доступно для такой системы, как Hopper.
Это не означает, что кластеры секвенирования лучше всего обслуживаются межсоединениями тора; Преимущества широкой поперечной полосы пропускания между вычислениями и хранилищем применимы и к другим топологиям.Фактически, наиболее рентабельная сетевая топология для кластера упорядочивания будет полностью отказываться от полосы пропускания пополам (т. Е. Без дискретной высокопроизводительной вычислительной фабрики) и вместо этого будет состоять из меньших вычислительных кластеров, каждый из которых имеет свой собственный узел ввода-вывода, который направляется непосредственно к ткань хранения. Эта конфигурация сводит к минимуму затраты на обеспечение широкополосного подключения между вычислительными ресурсами и хранилищем за счет исключения неиспользуемых дополнительных сетей.
Рабочая нагрузка ввода-вывода
Наиболее интенсивными операциями ввода-вывода в приложениях HPC являются операции, в которых состояние всей моделируемой системы (например, положение x, y и z каждого атома, составляющего вирусный капсид) должно быть проверено или сохранено на диск. .Поскольку каждый узел задания сохраняет свою часть моделирования в DRAM, каждый узел должен одновременно сбрасывать содержимое своей памяти в файловую систему, чтобы получить полностью согласованную контрольную точку. Высокопроизводительные параллельные файловые системы, такие как Lustre, специально разработаны, чтобы справиться с этим массово параллельным вводом-выводом, так что одна очень большая симуляция может создать один файл контрольной точки в одной файловой системе. Но создание контрольных точек остается одной из самых сложных проблем масштабируемости в высокопроизводительных вычислениях и находится в центре внимания текущих исследований и разработок.
Профиль ввода-вывода конвейеров выравнивания последовательностей ДНК и вызова вариантов не требует такого же строгого параллелизма из-за отсутствия тесной связи. Хотя выравнивание сотен человеческих геномов все еще может налагать огромные совокупные требования к пропускной способности (как в случае вышеупомянутой операции сортировки 900 МБ / с / узел), каждый узел выполняет свою долю работы независимо от всех остальных. Это упрощает требования к файловой системе для секвенирования кластеров двумя способами:
- Одна логическая операция (например,g., выравнивание ста геномов) не должно останавливаться (ждать у параллельного барьера), пока все узлы не запишут свои промежуточные результаты на диск. Как только один узел установил контрольную точку своих данных, он может продолжить свои вычисления, пока другие узлы все еще пишут. Это снижает общую потерю эффективности вычислений при превышении лимита пропускной способности хранилища, поскольку полоса пропускания ввода-вывода становится проблемой емкости, а не возможностей.
- Данные не обязательно должны храниться в одной файловой системе, поскольку геномные данные могут быть разделены произвольно.Поскольку большинство приложений биоинформатики будут успешно работать с сегментированными данными, часто проще хранить набор геномных данных в нескольких менее производительных сетевых файловых системах, чем справиться с затратами и сложностями масштабирования одной большой параллельной файловой системы.
Компромисс для секвенирования ДНК заключается в том, что их рабочие нагрузки ввода-вывода, как правило, требуют гораздо большего количества операций ввода-вывода в секунду (IOPS), чем приложения HPC, из-за того, что их данные распределяются по множеству файлов. Общеизвестно, что параллельные файловые системы плохо подходят для рабочих нагрузок с большим объемом метаданных, связанных с работой с большим количеством файлов меньшего размера, поэтому общая производительность приложения может фактически выиграть от использования нескольких сетевых файловых систем вместо одной параллельной файловой системы:
Производительность метаданных файловой системы ZFS, обслуживаемой через NFS, по сравнению с 32-OSS Lustre 2.4 файловая система.Даже при низком уровне параллелизма высокопроизводительный сервер NFS может превзойти параллельную файловую систему в задачах, требующих большого количества метаданных, таких как создание файлов. При более высоком параллелизме можно добавить больше серверов NFS, чтобы линейно масштабировать производительность метаданных, поскольку считывание последовательностей ДНК, согласованное считывание и вызываемые варианты легко разделяются на несколько файлов в нескольких файловых системах. С другой стороны, параллельные файловые системы демонстрируют гораздо более скромное масштабирование, даже если к файловой системе добавляются дополнительные серверы метаданных, поэтому преимущества сегментирования геномных данных не могут быть эффективно реализованы на них.
Жизненный цикл данных
Жизненный цикл данных или процессы, с помощью которых данные создаются, перемещаются, уточняются и удаляются из подсистемы хранения, также является важным фактором при проектировании вычислительных систем с интенсивным использованием данных, поскольку он может определять оптимальный баланс производительности, емкости и т. Д. и политика. Типичные приложения HPC и конвейеры секвенирования на самом деле имеют общий жизненный цикл данных в широком смысле:
| Шаг в жизненном цикле | Приложение HPC (e.г., | Конвейер секвенирования (например, полногеномное исследование клинического испытания ) |
| 1. Прочтите входной набор данных | Чтение файла контрольной точки из предыдущего задания | Получение сырых выходных данных секвенатора ДНК |
| 2. Периодически выгружать данные во время вычислений | Дамп конфигурации всей системы для анализа ex situ | Сохранение последовательно более точных выравниваний последовательностей |
| 3.Запишите большой конечный результат | Дамп окончательной конфигурации системы, а также дополнительные метрики для полного перезапуска | Сохранить полностью законченный и выровненный геном |
| 4. Удалить промежуточные временные данные | ||
| 5. Переместите данные в хранилище с меньшей производительностью и большей емкостью для анализа | ||
| 6. Сократите данные до ценных компонентов и перенесите их в автономное хранилище | Субдискретизация данных и сохранение на ленту | Загрузите чтения и оценки качества в Amazon S3 |
Однако критическое различие между жизненными циклами рабочих нагрузок высокопроизводительных вычислений и секвенирования заключается в сильной взаимосвязи между распределенными приложениями высокопроизводительных вычислений.Эта связь приводит к всплескам высокоинтенсивного параллельного ввода-вывода на этапах с 1 по 3 жизненного цикла, когда значительная часть высокопроизводительной временной файловой системы кластера может быть «горячей». Для сравнения: выполнение конвейеров анализа последовательности очень слабо связано, и они чаще вызывают небольшие горячие точки в файловой системе, которые перемещаются по мере того, как узлы обрабатывают свои собственные рабочие очереди.
Отсюда следует, что производительная система хранения для кластера последовательного анализа не обязательно должна обеспечивать высокую емкость в дополнение к высокой производительности.Скорее, его емкость должна быть достаточно большой для хранения горячих точек данных, и эти рабочие наборы данных могут быть загружены и выведены из более медленных файловых систем с высокой емкостью по мере необходимости для отдельных узлов. При наличии надлежащей инфраструктуры автоматизации этот подход может значительно снизить затраты, связанные с приобретением высокопроизводительных уровней хранения, за счет сведения их емкости к минимуму.
Облачные вычисления находятся в самом конце такого рода архитектуры, и отказ от физических кластеров в пользу публичных или частных облаков для последовательного анализа продемонстрировал некоторый успех.В общей архитектуре облачных вычислений используется объектное хранилище (например, Amazon S3) для размещения больших объемов данных секвенирования и локализованное блочное хранилище для обработки; горячие данные помещаются в временное хранилище, когда экземпляр инициализируется, и копируются обратно по завершении, полностью отказываясь от высокопроизводительной системы хранения.
Пожалуй, больше, чем в любой другой области, в приложениях наиболее очевиден разрыв между вычислительной биологией, управляемой секвенированием, и высокопроизводительными вычислениями.В то время как традиционные приложения HPC были вынуждены использовать высокую степень параллелизма с момента появления массивно-параллельных архитектур в начале 1990-х годов, технологии NGS, лежащие в основе программного обеспечения для биоинформатики, намного новее. Это привело к появлению двух основных факторов, препятствующих развитию вычислительных аспектов анализа последовательностей.
Данные еще не стандартизированы
Физика и химия, лежащие в основе секвенирования ДНК, все еще развиваются и производят новые формы данных.В то время как As, Ts, G и C при секвенировании остаются неизменными, различные компании разрабатывают новые технологии, которые дополняют считывание исходных последовательностей метаданными, которые могут помочь в выравнивании и обнаружении вариантов. Для каждой новой технологии и типа данных необходимо разрабатывать новые алгоритмы и программное обеспечение, которые часто заменяют старые методы и приложения.
Еще больше усложняет это тот факт, что эти достижения в технологии секвенирования обусловлены конкурирующими коммерческими интересами. В результате типы данных и аналитические приложения, которые могут использовать эти данные, сильно фрагментированы на рынке, и вычислительные требования секвенирования ДНК находятся в центре этого поля битвы.Пока эти форматы в конечном итоге не сойдутся в каком-либо стандартизированном способе выражения этих дополнительных метаданных, разработчикам научных приложений по-прежнему рискованно тратить время на оптимизацию алгоритмов и кода, когда совместимость может быть нарушена выпуском новой модели секвенсора.
Качество ПО остается низким
Взрыв биоинформатики во главе с NGS произошел в то время, когда технические барьеры на пути к вычислениям были значительно уменьшены за счет удобных программных библиотек, инструментов и языков.Хотя это позволило биологам быстро разработать новые вычислительные методологии с использованием выразительных языков, таких как R и Python, эти языки, как известно, медлительны и относятся к параллелизму как к второсортным гражданам. Это привело к тому, что прикладное пространство биоинформатики было завалено кодами, которые никогда не переходили от подтверждения концепции к готовым к производству научным приложениям.
Отсутствие внимания к масштабируемости и производительности не ограничивается приложениями, выполняемыми в небольшом масштабе.Например, Объединенный институт генома (JGI) – это крупная операция по секвенированию, которая секвенировала 56 терабаз ДНК и потратила 20 миллионов часов работы ядра на свой внутренний вычислительный кластер в течение 2012 года. Однако из этого огромного объема вычислений более 95 процентов задач работал только на одном ядре. В том же году JGI потратил дополнительно 11 миллионов часов работы ядра на Hopper, NERSC Cray XE6, при этом «большинство из них использовали всего 24 ядра (один узел Hopper) для многих экземпляров последовательного кода». [3] Для сравнения, Trestles (кластер малых рабочих мест Национального научного фонда) только 38 процентов рабочих мест требовали единого ядра в том же году.
Это не означает, что не существует приложений биоинформатики, требующих серьезных инженерных усилий. Однако даже эти коды обычно обходят стороной общие инструменты HPC (например, путем реализации параллельных циклов for в потоках pthread вместо использования OpenMP), что исключает использование общих инструментов сопоставления процессоров и профилирования производительности. Хотя некоторые наиболее популярные инструменты биоинформатики начинают серьезно относиться к оптимизации производительности, они часто полагаются на технологии (такие как Java и ее среда виртуальных машин), которые остаются на периферии HPC.
Нет никаких сомнений в том, что секвенирование ДНК быстро становится основным потребителем вычислительных циклов наряду с традиционными областями вычислительной науки. Постоянно падающие цены на секвенирование и появление диагностики на основе генома в клинической практике гарантируют, что эта тенденция сохранится. Тем не менее, самые большие вычислительные требования при секвенировании ДНК по-прежнему связаны с рутинной обработкой необработанных выходных данных секвенатора, а статистический анализ геномов, который способствует открытиям в биологии и медицине, в настоящее время все еще выполняется в масштабе рабочих станций.
По мере снижения затрат на секвенирование ДНК и совершенствования технологий появятся большие объемы более разнообразной информации для анализа, и именно здесь сложные исследования, которые не могут просто использовать параллелизм данных, присущий геномным данным, начнут требовать истинных HPC. Когда настанет день, когда биоинформатика станет ограничиваться вычислениями, а не секвенированием, высокопроизводительные вычисления будут к этому готовы; ограничение будет в пределах текущего ландшафта однопоточных кодов или кодов с общей памятью.
Уже началась работа по демонстрации доказательств концепции для создания действительно высокопроизводительных инструментов биоинформатики, но эти проекты оптимизации, как правило, сосредоточены только на подкомпонентах всего процесса согласования и вызова вариантов.В действительности, непрерывный процесс преобразования необработанных данных в высококачественные согласованные сопоставления и вызываемые варианты следует распознавать как единый логический процесс и оптимизировать как таковой. Текущий метод запуска набора данных через конвейеры дискретных приложений (каждое со своими особенностями) в корне неэффективен.
В идеале, приложения биоинформатики будут следовать по тому же пути, что и традиционные области вычислительной науки, и в конечном итоге сойдутся в полностью интегрированных, высокопроизводительных приложениях биоинформатики.Например, пакет молекулярной динамики LAMMPS представляет собой код для моделирования материалов, который включает в себя эффективную основу для распараллеливания, а также множество имитационных моделей, а также инструменты для моделирования материалов в различных экспериментальных условиях. Нет причин, по которым высокопроизводительная структура для работы с распределенным набором считываний последовательностей ДНК не может быть разработана аналогичным образом, и вполне вероятно, что биоинформатика будет двигаться в этом направлении по мере того, как проблемы выходят за рамки возможностей одного узла.
В широком смысле эти проблемы, которые мешают биоинформатике действительно проникнуть в высокопроизводительные вычисления, не являются уникальными или неожиданными; Вычислительная физика и химия на заре своего существования столкнулись со многими похожими проблемами. Разница в том, что физика и химия имели роскошь вырасти с HPC, тогда как секвенирование ДНК выталкивается в HPC из-за неумолимого роста индустрии секвенирования ДНК. Этот импульс, стоящий за секвенированием, сейчас привлекает экспертов из всех областей, включая высокопроизводительные вычисления, и нет никаких сомнений в том, что отрасль преодолеет эти проблемы роста в ближайшие годы.
[1] Это не совсем так, потому что у Gordon есть вторая структура QDR InfiniBand с той же полосой пропускания, зарезервированной для хранения.
[2] Это верно только для записи на Гордоне. Чтения из Lustre попадают в вычислительную структуру на узлах ввода-вывода, не зависящих от местоположения, и обычно должны проходить через тор, чтобы добраться до запрашивающего вычислительного узла.
[3] Цитируется из High Performance Computing and Storage Requirements for Biological and Environmental Research Target 2017 (DOE Report LBNL-6256E), ed by Richard A.Гербер и Харви Дж. Вассерман. Доступно на сайте http://www.escholarship.org/uc/item/69z9k2wh
HTDNA На главную | Биотех
Основная задача DNA Services Lab заключается в предоставлении первоклассных услуг и современного оборудования для поддержки фундаментальных, экологических, сельскохозяйственных и трансляционных медицинских исследований для исследователей нашего кампуса и внешних академических и корпоративных сотрудников.
Инструменты
Приложения
Приборы
* Мы являемся сертифицированным поставщиком последовательностей Illumina
Иллюмина NovaSeq 6000
Это новейший прибор от Illumina для сверхвысокопроизводительного секвенирования геномной ДНК, РНК-Seq, ДНК, обработанной бисульфитом, библиотек нацеленных и парных пар, а также любых образцов, требующих большой глубины.
Опции секвенирования NovaSeq
| Проточная ячейка | Тип считывания и длина | Цена за переулок (индекс | )Количество однократных чтений | Кол-во парных чтений | Гб / пер. |
|---|---|---|---|---|---|
| Сп | Одиночные чтения, 100 бит / с | $ 1,720 | 400-500 миллионов | 40-50 | |
| Парные чтения, 2x150bp | $ 2,380 | 800 миллионов + | 120 | ||
| Парные чтения, 2x250bp | $ 3 350 | 800 миллионов + | 200 | ||
| S1 | Одиночные чтения, 100 бит / с | $ 3 370 | 800 миллионов + | 80 | |
| Парные чтения, 2x100bp | 4 280 долл. США | 1.5 миллиардов + | 160 | ||
| Парные чтения, 2x150bp | 4 600 долл. США | 1,5 миллиарда + | 240 | ||
| S2 | Одиночные чтения, 100 бит / с | $ 5 350 | 1,5 миллиарда + | 165 | |
| S4 | Парные чтения, 2x150bp | $ 6 300 | 5-6 миллиардов | 750-850 |
PacBio Продолжение IIe
Это последний прибор от PacBio, он производит самые длинные считывания с высочайшей точностью по сравнению с предыдущими приборами PacBio.Это предпочтительный инструмент для сборки сложных геномов. Кроме того, он используется для характеристики полноразмерных 16S и других ампликонов и полноразмерных транскриптомов (IsoSeq).
Одна ячейка SMRT 8M производит
- 20-30 Гбайт чтения HiFi с исправлением ошибок с фрагментами 10-25кб
- 150-250 + Гбайт необработанных чтений с фрагментами от 10кб до 50кб
- Считывает кДНК или ампликон с исправленными ошибками 2–4 миллиона.
Иллюмина MiSeq
Для секвенирования библиотек из ампликонов (например: 16S, 18S, ITS и т. Д.), Геномной ДНК, малых РНК, RNA-Seq, ChIP-Seq и т. Д.
- Одиночное или парное чтение, длина от 50 до 300 бит
- V2 Nano run производит от 500 000 до 2 миллионов парных чтений
- V2 массовый запуск дает от 8 до 20 миллионов парных чтений
- V3 запускает от 10 до 40 миллионов парных чтений
- Проточная ячейка содержит 1 полосу
Оксфордская сетка с нанопорами
Длинное секвенирование считывает с геномной ДНК, РНК, кДНК, 16S или других ампликонов.
- Одна проточная ячейка производит от 1 до 9 миллионов считываний в зависимости от типа пробы
- Чтения обычно составляют от 5 до 40 Кбайт, а некоторые чтения из геномной ДНК HMW достигают 250 Кбайт
- Каждая проточная ячейка обрабатывает один или несколько проб
10x Genomics
Система 10x Chromium производит библиотеки для секвенирования транскриптомов 3 ‘ из одиночных клеток, ATAC-seq и мультиомик ( RNAseq + ATACseq ) .
- Библиотеки, построенные на 10x, полностью совместимы с секвенированием Illumina.
- Одноклеточные библиотеки могут быть созданы от 500 до 10 000 ячеек в библиотеке.
- Одноячеечные библиотеки секвенированы для 28x100nt или 28x150nt на NovaSeq, рекомендуется минимум 50k чтений на ячейку. Также доступны библиотеки экспрессии генов
- 10x Visium Spatial.
Симптомы, осложнения, причины и лечение
Вирус папилломы человека является наиболее распространенным вирусом, передающимся половым путем, и основной причиной остроконечных кондилом.У мужчин проявляются специфические симптомы после заражения вирусом.
Вирус папилломы человека (ВПЧ) поражает кожу и влажные мембраны, выстилающие тело. Это группа из более чем 100 вирусов, и разные типы ВПЧ встречаются в разных частях тела.
ВПЧ типов 6 и 11 вызывают более 90% остроконечных кондилом у обоих полов. ВПЧ типов 16 и 18 вызывают большинство раковых заболеваний, связанных с ВПЧ.
Хотя у большинства мужчин, инфицированных ВПЧ, симптомы отсутствуют, у некоторых развиваются наросты или бородавки.
Они могут возникать на:
- половом члене
- яичках
- анусе
- паху и бедрах
- языке и верхней части рта
Остроконечные кондиломы могут быть маленькими или большими, плоскими или приподнятыми, или иметь форму цветной капусты .
Они могут выглядеть как шишка или группа шишек в области вокруг полового члена, ануса или гениталий.
Эти бородавки не часто болят, но могут быть некрасивыми.
ВПЧ не является раком, но вирус ВПЧ может вызывать изменения в организме, которые могут привести к раку.
Врач может не диагностировать рак в течение многих лет после заражения ВПЧ, потому что изменения в клетках, содержащих ВПЧ, нарастают очень медленно.
Симптомы рака анального канала, связанного с ВПЧ, включают:
- кровотечение, выделения, боль или зуд из ануса
- опухоль лимфатических узлов в области ануса или паха
- изменения в привычках кишечника или формы стула
Рак полового члена может привести к:
- Изменениям тканей полового члена, таким как цвет, утолщение кожи или скопление тканей
- болезненные или безболезненные язвы или новообразования на половом члене, которые могут кровоточить
Рак задней части полового члена горло может вызвать:
- постоянная боль в горле или ушах
- постоянный кашель
- проблемы с дыханием или глотанием
- потеря веса
- изменение голоса или охриплость
- уплотнения или образования на шее
Лекарства еще не нашли способ отличить временный ВПЧ от ВПЧ, который может перерасти в рак.
ВПЧ передается при прямом и интимном контакте, в том числе половым, для обоих полов. Вирус может передаваться от одного человека к другому при оральном, анальном или вагинальном сексе или при соприкосновении кожи с кожей другого человека.
Если кто-то болен ВПЧ, он может распространять вирус, даже если у него никогда не было видимых симптомов.
Вероятность того, что человек заразится ВПЧ, увеличивается из-за определенных факторов, в том числе:
- половой анамнез, включающий несколько партнеров
- возраст, поскольку ВПЧ чаще встречается в подростковом или молодом возрасте
- при необрезании
- поврежденная кожа
Люди должны проконсультироваться с врачом, если на гениталиях появляются какие-либо бородавки или бородавки, вызывающие дискомфорт или боль.
В то время как некоторые типы ВПЧ могут вызывать только остроконечные кондиломы, другие также могут вызывать рак.
В США ежегодно врачи диагностируют более 42 000 случаев рака, связанных с ВПЧ. Примерно 18 300 из этих видов рака встречаются у мужчин.
У мужчин врачи связывают ВПЧ с развитием следующих видов рака:
- ВПЧ может быть причиной более 90% случаев рака анального канала, которым ежегодно страдает 2200 мужчин.
- Более 60% случаев рака полового члена начинаются с ВПЧ.
- Около 70% людей с раком ротоглотки, который возникает в задней части горла, у основания языка и миндалин, может быть вызван ВПЧ.
По сравнению с мужчинами, вступающими в половые контакты только с женщинами, у мужчин, практикующих секс с другими мужчинами, выше вероятность развития анального рака, связанного с ВПЧ.
У мужчин с ослабленной иммунной системой из-за ВИЧ или по другим причинам вероятность развития анального рака, связанного с ВПЧ, выше, чем у других. У мужчин с ВИЧ также появляются более серьезные остроконечные кондиломы, которые сложнее лечить.
В настоящее время лечения ВПЧ не существует, но лечение может помочь при состояниях, связанных с ВПЧ, и при некоторых симптомах.
В настоящее время не существует рутинного скрининга для диагностики ВПЧ у мужчин. Однако врач часто может определить, есть ли у человека ВПЧ, исследуя появившиеся бородавки. Если у человека есть несколько факторов риска, врач может также взять мазок из анальной области на ВПЧ.
Врач может вылечить образовавшиеся кондиломы с помощью рецептурных препаратов или удалить их хирургическим путем.
Хирургическое удаление бородавок включает их замораживание или сжигание, в зависимости от их размера, расположения и формы. Этот метод известен как криотерапия.
Однако избавление от бородавок не может предотвратить передачу вируса половому партнеру.
Если человек не лечится от остроконечных кондилом, они вряд ли перерастут в рак. Скорее всего, они уйдут, вырастут, умножатся или останутся прежними.
Если ВПЧ перерастает в одну из распространенных форм рака, врач или онколог лечит человека, сочетая хирургическое вмешательство, химиотерапию и лучевую терапию.
Профилактика
Получение вакцин и правильное использование презервативов во время полового акта может снизить риск заражения ВПЧ. Однако презервативы не могут обеспечить полную защиту от вируса папилломы человека, поскольку он может присутствовать в местах, не закрытых презервативом.
Хотя лечения нет, три эффективных вакцины могут помочь предотвратить ВПЧ. Все три вакцины предотвращают заражение ВПЧ 16 и 18 типов. Эти две вакцины в наибольшей степени связаны с раком.
Одна из вакцин также защищает от типов 6 и 11, которые чаще всего связаны с остроконечными кондиломами.
Врачи рекомендуют мальчикам получать серию двухдозовой вакцины против ВПЧ в возрасте 11–12 лет.
Врач может назначить три дозы в следующих случаях:
- Разница между двумя дозами составляла менее 5 месяцев.
- Ребенку больше 14 лет, поэтому он должен получить три дозы в течение 6 месяцев.
- У человека менее эффективная иммунная система.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило Гардасил 9, вакцину, подходящую для людей в возрасте 9–45 лет.В 2014 году Гардасил 9 получил одобрение как безопасный только для детей в возрасте до 26 лет.
FDA обновило это, чтобы включить взрослых в возрасте до 45 лет, если они не получили вакцину в молодом возрасте.
С момента начала вакцинации против ВПЧ в США количество женщин в возрасте 14–19 лет с одним из четырех основных типов ВПЧ снизилось с 11,5% до 4,3%. У женщин 20–24 лет этот показатель снизился с 18,5% до 12,1%.
Вакцина против ВПЧ безопасна и эффективна. Исследования не сообщили о серьезных побочных эффектах, хотя FDA сообщает, что это может вызвать боль в месте инъекции, отек, легкое изменение цвета и головные боли.
Вакцина не предотвращает других ИППП и не лечит людей, у которых уже есть ВПЧ или заболевания, связанные с ВПЧ.
По данным Центров по контролю и профилактике заболеваний (CDC), инфекция ВПЧ обычно проходит без лечения в течение 2 лет. По оценкам, 90% инфекций ВПЧ излечиваются с помощью иммунной системы, не причиняя никакого вреда.
Тем не менее, врачу сложно активно лечить вирусы, а на формирование иммунитета могут уйти месяцы или даже годы.Человек потенциально может иметь ВПЧ в течение многих лет, прежде чем ему поставят диагноз или возникнут осложнения.
Если у человека есть остроконечные кондиломы, ему следует избегать половых контактов, пока он не вылечит это заболевание.
Период, в течение которого генитальные бородавки могут распространяться после удаления, неизвестен. Использование барьерного противозачаточного средства, например презерватива, может помочь предотвратить дальнейшее распространение инфекции.
Хотя ВПЧ является распространенным явлением и у большинства сексуально активных взрослых в какой-то момент жизни будет ВПЧ, связанные с ВПЧ раковые заболевания и проблемы со здоровьем в целом встречаются реже.
HPViewer: чувствительное и специфическое генотипирование вируса папилломы человека в метагеномной ДНК
Предпосылки
Вирус папилломы человека (ВПЧ) – это тип двухцепочечного вируса с небольшой ДНК, который вызывает почти 610 000 случаев рака в мире ежегодно [1]. В настоящее время в Международном справочном центре по ВПЧ (http://www.hpvcenter.se) идентифицировано 210 типов ВПЧ, и это число ежемесячно увеличивается. В эпистеме вируса папилломы (PaVE) (https: // pave.niaid.nih.gov/). Многие исследования продемонстрировали, что ВПЧ является жизненно важной причиной рака шейки матки [2–4], и эти исследования классифицировали типы ВПЧ как высокого и низкого риска. Муньос и др. Сгруппировали ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82 как группы высокого риска; и HPV 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81, 89 считались низким риском [5]. ВПЧ также был связан с другими видами рака, включая рак ротоглотки [6], головы, шеи [7–9]. Особую тревогу вызывает тот факт, что заболеваемость раком ротоглотки, ассоциированным с ВПЧ [10], очень быстро растет.Кроме того, ДНК ВПЧ была обнаружена при раке легких, толстой кишки, пищевода и мочевого пузыря [11–14].
Традиционные клинические методы обнаружения ВПЧ можно разделить на три группы: анализы гибридизации нуклеиновых кислот, амплификация нуклеиновых кислот и анализы на основе антител [15]. Анализы гибридизации нуклеиновых кислот используют гибридизацию in situ, которая может выявить 13 генотипов ВПЧ с наиболее высоким риском, включая типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, и 68 через коктейль биотинилированных зондов (GenPoint HPV Probe Cocktail, Dako) или другие типы HPV с специально разработанными зондами [16].Inno-LiPA [17] может обнаруживать 32 типа HPV с помощью ПЦР-амплификации области консервативного гена L1 длиной 65 п.н. с последующей гибридизацией блоттинга обратной линии для идентификации конкретных типов HPV. Анализ TaqMan PCR в реальном времени также может быть использован для обнаружения ВПЧ путем определения наличия мРНК генов Е6 ВПЧ [18]. Существует два одобренных FDA анализа на ВПЧ с использованием амплификации нуклеиновых кислот. Тест Cobas® HPV Test от Roche (Индианаполис, Индиана, США) позволяет обнаруживать 14 типов ДНК ВПЧ высокого риска с помощью ПЦР и флуоресценции [19].Aptima® от GenProbe (Woburn, MA, USA) нацелена на мРНК HPV высокого риска из генов E6 / E7 путем транскрипционной амплификации [20]. Непрямой анализ на инфекцию HPV16 доступен с помощью иммуногистохимии экспрессии человеческого гена p16, потому что существует сверхэкспрессия p16 в результате интеграции HPV-16 в геном хозяина и нарушения пути ретинобластомы [21]. Совсем недавно Lavezzo et al. (2016) предложили новый метод генотипирования HPV в зависимости от консервативных праймеров ПЦР для области E6 / E7 [22], но этот новый метод ограничен обнаружением только типов HPV с высоким риском.
Эти методы, хотя и охватывают в основном 26 типов ВПЧ высокого / низкого риска, достаточны для выявления всех типов ВПЧ, связанных с раком шейки матки [23]. Наше понимание причинно-следственной связи ВПЧ с другими видами рака в основном основано на исследованиях с использованием методов выявления ВПЧ шейки матки. Однако распределение типов ВПЧ при раке шейки матки среди женщин из разных популяций неоднородно [24], и не существует методов или наборов, специально разработанных для выявления типов ВПЧ, обнаруживаемых при раке ротоглотки.Таким образом, распространенность ВПЧ при этих раковых заболеваниях может быть недооценена из-за неспособности набора для цервикального ВПЧ обнаруживать все типы ВПЧ, поэтому необходим метод широкого диапазона для обнаружения всех типов ВПЧ, чтобы позволить полную оценку роли ВПЧ в раковых заболеваниях за пределами шейка матки.
Секвенирование образцов тканей человека или биологических жидкостей с помощью дробовика – это надежный инструмент, который может расширить узкий спектр традиционных подходов к обнаружению ВПЧ. Это зависит от конвейеров биоинформатики для определения и определения генотипа HPV, считываемого из большого пула последовательностей ДНК человека и микробов.Johannsson et al. (2013) применили MEGABLAST для фильтрации считываний человека и бактерий и выполнили сборку de novo для получения длинных контигов и использовали BLASTn против GenBank для идентификации HPV [25]. Ма и др. (2014) применили структуру генотипирования ВПЧ через BLAST к локальной эталонной базе данных ВПЧ для обнаружения считываний ВПЧ в наборах данных, сгенерированных из различных участков тела человека с помощью полногеномного секвенирования с дробовиком (WGS) [26]. BLAST – мощный, но трудоемкий инструмент [27], и он очень неэффективен для обработки миллионов коротких фрагментов ДНК из метагеномных данных.HPVDetector, разработанный в 2015 году [28], зависит от выравнивателя Барроуза-Уиллера [29], чтобы сопоставить показания дробовика с их базой данных эталонного генома. Существует также несколько программ, разработанных для идентификации всех вирусов, включая HPV, в данных полногеномного секвенирования (WGS), таких как Metavir2 [30], VirSorter [31], VirusTAP [32], VirusScan [33], Vipie [34], VIP [35] и VirFinder [36]. В таблице 1 приводится сводка важных характеристик 9 различных доступных программ.
Таблица 1.Сравнение существующих средств обнаружения ВПЧ или вирома
Одним из факторов, влияющих на идентификацию ВПЧ с помощью коротких считываний в данных WGS, является ложная положительность, вызванная гомологичными последовательностями и / или повторами, общими для хозяина, микробов и ВПЧ.Кроме того, генотипирование может быть неточным, если обнаруженные считывания ВПЧ принадлежат более чем одному типу ВПЧ. Один из подходов к уменьшению ложной положительности заключается в использовании сборки de novo для создания больших контигов, которые покрывают большую область генома HPV за пределами общей области. Из 9 программ 6 применяли или требовали подход к сборке de novo , включая VirSorter, VirFinder, Metavir2, VirusTAP, Vipie и VIP. Однако контиги из сборки de novo могут быть построены только в том случае, если данные имеют достаточный охват, что ограничивает его способность обнаруживать HPV в образцах, в которых считывания HPV слишком малы для формирования контига.Другой подход к снижению ложноположительности – отфильтровывать последовательности генома хозяина и бактерии. Например, VIP VirusTAP и VirusScan вычитают входные фрагменты ДНК, которые могут выравниваться с геномом хозяина перед поиском ДНК ВПЧ. Эта стратегия имеет два недостатка из-за большого размера генома хозяина. Выравнивание входных фрагментов ДНК с геномом хозяина не только занимает много времени, но также требует большого пространства для хранения базы данных генома хозяина для локального использования. Кроме того, этот подход не снижает количество ошибок генотипирования из-за гомологии между близкородственными генотипами ВПЧ.HPVDetector, программа, специально разработанная для обнаружения ВПЧ, не учитывает ложноположительные проблемы, связанные с геномом хозяина и гомологией между различными типами ВПЧ.
В настоящем исследовании мы разработали новую программу обнаружения ВПЧ – HPViewer, которая уменьшает ложное обнаружение ДНК ВПЧ за счет маскировки простых повторов, обычно общих для генома человека, прокариот и гомологичных последовательностей, общих для разных типов ВПЧ. Мы оценили чувствительность и специфичность HPViewer, используя 100 100 образцов моделирования, а также в наборе данных WGS от пациентов с рецидивирующим респираторным папилломатозом, который, как известно, связан с HPV6 / 11 [37], сравнили производительность HPViewer с HPVDetector, VirusTAP и Vipie.Мы также применили HPViewer для определения распределения распространенности ВПЧ и изучения модели совместной встречаемости типов ВПЧ в различных участках тела здоровых образцов из проекта Human Microbiome Project (HMP).
Результаты
Геномы ВПЧ имеют общие простые повторы с геномами человека и прокариот
Метагеномные данные обычно состоят из фрагментов геномов человека и прокариот. Чтобы обнаружить последовательности ДНК человека и прокариот, которые могут мешать идентификации ВПЧ, мы сравнили 182 генома ВПЧ [38] с геномом человека (GRCh48) с помощью BLASTn [27] и обнаружили 165118 совпадений (идентичность> 90%, длина выравнивания> 50 п.н.) между 14 типов ВПЧ и все хромосомы человека (рис. 1 а, б).Все совпадения были простыми повторами, и большинство из них были повторами TA (83,94%) и TG (15,94%). Также были обнаружены другие менее распространенные повторы, такие как TTC, TTCTCC и CATA. В частности, патогенные ВПЧ низкого риска типов 6, 72, 73 имеют простые повторы последовательности с человеческими chr3, chr1, chr1 и chrY соответственно.
Рис. 1. Общие последовательности ВПЧ в геномах человека и прокариот.( a, b ) Общие последовательности между ВПЧ и геномом человека. Каждая линия представляет собой одно выравнивание BLASTn. Синие линии представляют повторы TG, красные линии представляют повторы TA, а зеленые линии представляют другие выравнивания повторов.( c, d ) Общие последовательности между геномами HPV и прокариот. Большинство из них были повторами TG и TA. Единственным общим повтором другого типа был повтор GAACGG между HPV107 и Streptomyces clavuligerus плазмиды pSCL2 (NZ_CP016560.1). Картированные геномы прокариот были перечислены в дополнительной таблице 1.
Используя ту же стратегию, мы также сравнили геномы ВПЧ с 1781 прокариотическим геномом (эталонные геномы прокариот NCBI 112 и 1669 репрезентативных геномов прокариот NCBI) ( дополнительная таблица 2 ) и нашли 575 совпадений между 8 типами HPV и 18 видами прокариот (рис.1 c, d), в основном TA (81.22%) и повторов TG (18,61%) плюс повторы GAACGG (0,17%). Ни один из 8 типов ВПЧ не относился к цервикальным ВПЧ с высоким или низким риском. Во всех 1 375 680 п.н. из 182 геномов ВПЧ на простые повторы приходилось 16 359 п.н. (1,19%).
Гомологичные последовательности широко распространены среди типов ВПЧ
Помимо гомологии между ВПЧ и другими организмами, гомология между типами ВПЧ также может влиять на генотипирование ВПЧ. Чтобы оценить степень гомологии, мы выровняли каждый полный геном ВПЧ с геномами всех других типов, перемещая все возможные фрагменты ДНК длиной 100 п.н. по всему геному с порогом идентичности 90%.Степень гомологии между различными типами ВПЧ сильно различалась. Существует 29 типов HPV, которые не имеют гомологии с каким-либо другим типом HPV, но 85,9% генома HPV76 гомологичны другим типам HPV. В 182 геномах HPV 368 789 пар оснований (26,81%) были гомологичны между двумя или более типами HPV.
Дизайн HPViewer
Мы использовали новый подход маскировки, чтобы минимизировать влияние общих последовательностей на генотипирование ВПЧ. Вместо фильтрации общих последовательностей путем сопоставления миллионов необработанных считываний в каждом образце с геномами человека и прокариот мы замаскировали простые повторяющиеся последовательности в эталонной базе данных геномов ВПЧ с помощью RepeatMasker [39].Затем мы сравнили эти замаскированные геномы ВПЧ с геномами человека и прокариот и не нашли совпадений, что указывает на то, что наша стратегия повторной маски устранила ложноположительный вызов считывания ДНК человека или прокариот как ВПЧ. Затем мы замаскировали все гомологичные области, общие для типов ВПЧ, а также простые повторы в качестве нашей стратегии маски гомологии. Мы обнаружили, что маска повторов удаляла только несколько сотен нуклеотидов, в то время как маска гомологии значительно изменяла распределение эффективных длин генома HPV (рис. 2).Наконец, мы построили матрицу расстояния гомологии и дерево гомологии только с использованием гомологичных последовательностей, общих для любого другого типа ВПЧ ( Дополнительный рис. 1, ).
Рис. 2 Распределение эффективных размеров генома ВПЧ среди исходных геномов ВПЧ и геномов ВПЧ в базах данных маски повторов и маски гомологии.Для наших стратегий масок длина геномов ВПЧ не изменилась, и мы назвали не-N-последовательности генома ВПЧ эффективным геномом. В целом, эффективная длина генома HPV составляла 7 100-8 104 п.н. для исходных геномов, 7 100-7 995 п.н. для геномов с маской повторов и 1061-7698 п.н. для геномов с маской гомологии.
Оценка чувствительности и специфичности HPViewer с использованием смоделированных данных
Мы разработали HPViewer для специфического обнаружения и количественной оценки HPV по метагеномным данным. Первоначально мы планировали использовать режим маски повторения для устранения ложной положительности, вызванной геномами человека и прокариот, и режим маски гомологии для предотвращения ошибок в генотипировании среди близкородственных типов ВПЧ.
Мы оценили эти два режима на 100 100 смоделированных образцах, состоящих из 143 типов HPV, на различной глубине секвенирования.Чувствительность постепенно увеличивалась с увеличением глубины последовательности для обоих режимов. На глубине 2 считывания / образец режим повторной маски (76,8%) был намного более чувствительным, чем режим маски гомологии (29,4%) из-за игнорирования истинных считываний HPV, общих для разных типов HPV в режиме маски гомологии ( Рис 3а). Чувствительность достигла плато (> 98,9%) при 50 чтениях в обоих режимах. Специфичность была ~ 100% для обоих режимов при 2-10 чтениях и поддерживалась для режима маски гомологии до 1000 чтений. Однако специфичность постепенно снижалась при> 50 чтениях и упала до 89.8% при 1000 считываний для режима повторной маски из-за ошибок генотипирования близкородственных типов ВПЧ (рис. 3b). Напротив, доступное в настоящее время программное обеспечение HPVDetector [28] было менее специфичным, чем оба режима, и менее чувствительным, чем режим с повторной маской (рис. 3).
Рис. 3 Оценка HPViewer с использованием смоделированных данных секвенирования дробовика HPV.Мы сравнили производительность трех режимов HPViewer и HPVDetector, используя 100 100 смоделированных образцов HPV. ( a, b ) Сравнение чувствительности и специфичности трех режимов HPViewer и HPVDetector с использованием смоделированных данных одного HPV с различной глубиной секвенирования: 2, 5, 10, 50, 100, 500, 1000 считываний.При каждой глубине секвенирования мы моделировали каждый образец 100 ВПЧ. Учитывая, что HPVDetector содержит только 143 типа геномов HPV, мы сгенерировали только смоделированные чтения из этих геномов HPV.
Чтобы преодолеть низкую чувствительность режима маски гомологии и низкую специфичность режима маски повторения, мы создали новый гибридный подход, объединив два режима, используя матрицу попарных расстояний гомологии. В этом подходе сначала использовался режим повторной маски для проверки всех считываний HPV в образце.Если был обнаружен только один тип ВПЧ, считывание считалось истинно положительным. Если было обнаружено несколько типов ВПЧ, их расстояние гомологии определяли с использованием матрицы попарных расстояний гомологии. Соответствие ВПЧ без близких родственников (расстояние гомологии <0,35) считалось истинно положительным, в то время как близкородственные типы ВПЧ исследовались в режиме маски гомологии. Только типы ВПЧ, повторно обнаруженные с использованием режима маски гомологии, считались истинно положительными (рис. 4). Режим гибридной маски имел ту же чувствительность, что и режим повторной маски, 76.8%, на глубине 2 считываний и улучшенная специфичность режима повторной маски до 98,7% с 89,8% при 1000 считываний (рис. 3). Эти данные свидетельствуют о том, что эта гибридная маска оптимальна для обнаружения ВПЧ в образцах, содержащих большое или низкое количество считываний ВПЧ. Этот гибридный метод проверки был установлен по умолчанию в распределенной версии программного обеспечения HPViewer.
Рисунок 4 Рабочий процесс в гибридном режиме HPViewer.Гибридный режим HPViewer представляет собой комбинацию базы данных повторяющихся масок и базы данных масок гомологии через матрицу расстояний гомологии.Входными данными является обрезанный файл fastq, а на выходе – таблица, содержащая типы и количество ВПЧ.
Сравнение производительности HPViewer с HPVDetector, VirusTAP и Vipie с использованием данных секвенирования рецидивирующего респираторного папилломатоза
Мы оценивали HPViewer на образцах, инфицированных известными типами HPV. Мы выполнили секвенирование опухолевых тканей и сопоставили растворы для ротовой полости шести пациентов с рецидивирующим респираторным папилломатозом, который, как известно, вызван ВПЧ 6 или 11.HPViewer обнаружил HPV6 в 4 опухолевых тканях и 2 соответствующих образцах для смыва для полости рта и HPV11 в 2 опухолевых тканях. Напротив, HPVDetector, автономная программа, разработанная для прямого генотипирования считываний HPV из необработанных последовательностей дробовика, неверно идентифицировала повторные считывания из генома человека как ложноположительные HPV19 (n = 4 образца), HPV71 (n = 9) или HPV82 (n = 7). ) (Таблица 2). HPVDetector также неверно идентифицировал два чтения как HPV 11 в образце 7T, который полностью соответствовал HPV6. Для этих 12 образцов HPVDetector предсказал среднее значение 1.9 неправильных типов ВПЧ на образец (рис. 5а). В опухолевых тканях HPVDetector постоянно занижал количество считываний HPV по сравнению с HPViewer (p = 0,028, двусторонний парный t-тест) как для HPV6, так и для HPV11 (таблица 2).
Таблица 2.Сравнение HPViewer и других программ по обнаружению и генотипированию ВПЧ при рецидивирующем респираторном папилломатозе
Рисунок 5 Сравнение различных инструментов на образцах секвенирования рецидивирующего респираторного папилломатоза.( a ) Количество неверно предсказанных типов ВПЧ по 12 образцам секвенирования.Неправильно предсказанные типы ВПЧ состояли из ложноположительных и ложноотрицательных типов. (b) Сравнение времени выполнения HPViewer, HPVDetector, VirusTAP и Vipie для файла fastq, содержащего 7,6 M операций чтения. VirusTAP и Vipie были веб-инструментами, поэтому у них также было время для загрузки.
VirusTAP – это веб-инструмент [32], который фильтрует считывания человека и бактерий и объединяет de novo отфильтрованных считываний в контиги. Он мог обнаружить ВПЧ только в образцах с очень большим количеством считываний ВПЧ.Например, он смог обнаружить HPV6 в образце 15T, в котором HPViewer идентифицировал 1223 чтения HPV, но не смог обнаружить HPV6 в образцах 7T и 12T, в которых HPViewer идентифицировал 361 и 228 чтения HPV. Vipie – еще одна программа обнаружения вирусов [34], которая использует сборку de novo всех операций чтения в контиги. Он был более чувствителен, чем VirusTAP, и имел эквивалентную производительность с HPViewer в образцах опухолей с> 100 считываний HPV. Он успешно обнаружил HPV6 в четырех образцах опухолей и HPV11 в двух образцах опухолей.Однако ему не удалось обнаружить ВПЧ в образцах смыва для полости рта, которые содержали только очень небольшое количество считываний ВПЧ. Например, 6 считываний HPV51 и 2 считывания HPV6 в образце 3W и 2 считывания HPV6 в образце 7W не наблюдались Vipie.
Мы сравнили время вычисления HPViewer с HPVDetector, VirusTAP и Vipie при анализе парного файла fastq образца 3T (файл fastq.gz, 340 МБ, 7,6 МБ чтения). Задача заняла около двух минут для HPViewer и HPVDetector, 12 минут для VirusTAP (плюс 2 минуты времени загрузки) и 32 минуты для Vipie (плюс 7 минут времени загрузки) (рис. 5b).VirusTAP и Vipie требуют больше времени, чем HPViewer и HPVDetector для выполнения одной и той же задачи, потому что им требовалось дополнительное время для процесса сборки de novo . VirusTAP предварительно выбирает считывания вируса перед сборкой de novo на небольшом количестве выбранных последовательностей, в то время как Vipie выполняет сборку de novo на всех считываниях перед идентификацией контигов HPV. Более продолжительное время, которое требовалось Vipie для анализа образца 3T, чем VirusTAP, отражает тот факт, что его масштаб сборки de novo был намного больше, чем у VirusTAP.
Оценка HPViewer с данными секвенирования с дробовиком от здоровых людей в рамках проекта Human Microbiome
Чтобы оценить производительность HPViewer с наборами данных с неизвестным статусом ВПЧ, мы загрузили наборы метагеномных данных HMP Illumina, которые были первоначально созданы из 1573 образцов, собранных из 18 различных участки тела у здоровых американцев. HPViewer обнаружил 104 типа HPV, представляющих 4 рода HPV (Alpha, Beta, Gamma, Mu) [40] в 175 образцах (рис. 6 и таблица 3) в 16 из 18 участков тела (общая распространенность: 11.10%). Из 104 обнаруженных типов ВПЧ 84 типа ВПЧ (81,73%) не должны быть обнаружены с помощью самого широкого спектра цервикального набора для обнаружения ВПЧ, Linear Array® (37 типов ВПЧ) [15]. Среди 104 типов ВПЧ четырьмя наиболее часто обнаруживаемыми типами были ВПЧ51, 17, 18, 89, в то время как 10 типов высокого риска (66,67%, 10/15) и 7 типов низкого риска (58,33%, 7/12). ) Среди этих здоровых образцов были обнаружены ВПЧ. Участком тела с наибольшей распространенностью ВПЧ была левая ретроаурикулярная складка (65,22%), за которой следовала правая ретроаурикулярная складка (54.84%), вагинальный инроитус (50,00%), передние ноздри (37,96%) и задний свод (32,41%), в то время как ВПЧ не был обнаружен в образцах небных миндалин и крови. В соответствии с их профилями распространенности ВПЧ, спинка языка, слизистая оболочка щек, надгубной налет, подвздошный мешок и стул были сгруппированы в одну группу, а три связанных с влагалищем участка тела – середина влагалища, влагалищный вход, задний свод – были сгруппированы вместе и три связанные с кожей участки тела – передние ноздри и левая, правая ретросуставная складка – были сгруппированы в другую группу (Рис. 6; Дополнительная таблица 3 ).Это показало, что распространенность ВПЧ была связана с окружающей средой его обитания, и подтвердило предыдущие исследования, которые предполагали, что кишечник, рот и кожа имеют свои собственные спектры разнообразия ВПЧ [41–44]. Совместное появление нескольких типов ВПЧ в одном образце было общим с различными паттернами в отношении участков тела (рис. 7; Дополнительная таблица 4 ). В сети совместной встречаемости было 89 типов ВПЧ, одновременно встречающихся с другими, по крайней мере, один раз. Эта сеть имеет некоторое сходство с предыдущим исследованием [26].Интересно, что HPV23-173 в коже, HPV54-89 и HPV39-51 во влагалище были тремя наиболее часто наблюдаемыми сочетаниями (трижды), и мы не обнаружили какой-либо взаимосвязи совместного возникновения между кожей и влагалищем. Эти результаты подтверждают, что HPViewer представляет собой средство обнаружения широкого диапазона, подходящее для оценки наличия ВПЧ за пределами женской половой системы.
Таблица 3.Сводка по ВПЧ-положительным образцам из проекта Human Microbiome Project
Рисунок 6 Сводка по распространенности ВПЧ по метагеномным данным дробовика от HMP.На 11 из 18 сайтов, на которых проводилась оценка, было по крайней мере два положительных на ВПЧ образца. Сайты сгруппированы по вертикали в зависимости от их распространенности ВПЧ. Число в скобках рядом с меткой участка тела представляет собой общий положительный образец на ВПЧ / общее количество образцов, а число на графике – это распространенность ВПЧ для каждого типа ВПЧ в каждом участке тела.
Рис. 7 График совместной встречаемости ВПЧ в образцах HMP кожи, влагалища и полости рта.Состоит из всех 104 типов ВПЧ. Каждый узел представляет один тип ВПЧ, а каждое ребро представляет два связанных узла, сосуществующих, как было обнаружено.Толщина представляет собой частоту совместной встречаемости в диапазоне от 1 до 3. Узлы без каких-либо краев не наблюдались совместной встречаемости. Кожа включает передние ноздри, левую / правую ретроаурикулярную складку; влагалище включает среднюю часть влагалища, задний свод, влагалище; полость рта включает слюну, спинку языка, носоглотку и слизистую оболочку щек. Чаще всего совпадение (края) произошло на коже или во влагалище, и только шесть совпадений в полости рта.
Обсуждение
ВПЧ является важным патогеном для человека не только потому, что он является основной причиной рака шейки матки, ротоглотки и анального канала, но также из-за растущего числа доказательств того, что нецервикальные типы ВПЧ могут играть этиологическую роль в возникновении многих других видов рака. сайты тела.Учитывая неадекватность наборов для выявления цервикального ВПЧ для всех 210 типов ВПЧ, метагеномное дробовидное секвенирование стало одной из наиболее многообещающих стратегий обнаружения ВПЧ в образцах человека. Теперь мы показываем, что HPV не только разделяет значительное количество гомологичных последовательностей между различными типами HPV, но также имеет обширные простые повторы с человеком и некоторыми прокариотами. С помощью HPVDetector, ранее опубликованной программы, специально разработанной для обнаружения ВПЧ в метагеномных данных, мы обнаружили, что гомологичные последовательности внутри ВПЧ вызывают ошибки в генотипировании ВПЧ, а общие повторы происхождения человека или прокариот могут быть ошибочно приняты за ДНК ВПЧ, что указывает на необходимость разработать программу для более точного выявления и генотипирования ВПЧ.
Тип HPV определяется, если последовательность его основного гена L1 капсида менее чем на 90% аналогична последовательностям любых других типов [45]. В настоящем исследовании мы обнаружили, что часто области одного типа ВПЧ имеют высокое сходство (> 90%) с другими типами, несмотря на то, что их гены L1 имеют схожесть менее 90%. В 28 типах ВПЧ общие части составляли более 50% их геномов. Эти различия в сходстве геномов ВПЧ затрудняют создание рабочего порога для точного генотипирования типов ВПЧ с использованием коротких считываний, полученных при секвенировании дробовика.Тем не менее, клинически важно точно определить тип ВПЧ в каждом образце, поскольку типы ВПЧ различаются по своим патогенным свойствам. Мы создали базу данных по типу, удалив все области, которые имели> 90% сходства между типами ВПЧ, из эталонных геномов ВПЧ (маска гомологии). Мы использовали базу данных для конкретных типов в HPViewer и продемонстрировали, что режим маски гомологии в HPViewer может уменьшить ошибочную классификацию чтений до менее 0,3%.
Идеальная программа для обнаружения и генотипирования ВПЧ по последовательностям дробовика должна быть как специфичной, так и чувствительной.Некоторые типы ВПЧ имеют простые повторы с геномом человека и геномами прокариот. В образцах папилломатоза HPVDetector ошибочно классифицировал TG-повторы человеческого происхождения как HPV 71. VirusTAP предпринимает два шага для обеспечения специфичности. Один состоит в том, чтобы отфильтровать считывания, которые являются общими для ВПЧ и не-ВПЧ организмов, а второй, который также применяется Vipie, заключается в создании больших собранных контигов de novo , чтобы минимизировать влияние локальных неспецифических областей. Показано, что этот подход является наиболее специфичным среди всех оцениваемых программ.Однако высокая специфичность достигается за счет более низкой чувствительности из-за невозможности собрать контиги достаточной длины, когда образец содержит несколько считываний HPV. В исследовании папилломатоза VirusTAP не удалось обнаружить HPV 6 в образцах опухолей, несмотря на то, что каждый образец содержал сотни считываний HPV 16. Vipie более чувствителен, чем VirusTAP, но не может обнаруживать ВПЧ в образцах, содержащих менее 10 считываний ВПЧ. Напротив, HPVDetector чувствителен, но менее специфичен из-за ложных срабатываний считываний, совместно используемых ВПЧ, человеком и прокариотами или между типами ВПЧ.
HPViewer обнаруживает ВПЧ путем прямого сопоставления считываний с эталонными геномами, специфичными для ВПЧ, без сборки de novo . Он достиг такой же специфичности, что и VirusTAP и Vipie, с порогом, установленным с помощью ПЦР для конкретного типа HPV, и более высокой чувствительностью, способной обнаруживать HPV в образцах, сделавших всего два считывания HPV. Важность обнаружения низких показателей HPV была продемонстрирована на примере исследования рецидивирующего респираторного папилломатоза. VirusTAP не смог распознать инфекцию ВПЧ в двух (33%) из шести образцов опухоли, несмотря на несколько сотен считываний ВПЧ в наборах данных, что делает его неадекватным для диагностики инфекции ВПЧ в клинических образцах.Vipie не смогла обнаружить присутствие HPV 6 в двух пероральных образцах, в которых было два чтения HPV в каждом образце. Поскольку эти четыре считывания принадлежали к одним и тем же штаммам в соответствующих образцах опухоли папилломы, невозможность их обнаружения может недооценивать потенциальную передачу ВПЧ от рецидивирующего респираторного папилломатоза пероральным путем.
Методы
Две базы данных генома ВПЧ в HPViewer
Мы загрузили все 182 эталонных генома ВПЧ из PaVE для этого исследования.Bowtie2 (версия 2.2.7) – это инструмент для выравнивания, использованный в этом исследовании [47]. Все метагеномные считывания были согласованы с нашими настроенными базами данных HPV через bowtie2 в сквозном, чувствительном режиме.
Мы создали две локальные базы данных HPV с двумя разными стратегиями маскирования, маской повторения и маской гомологии. Для базы данных масок повторов мы использовали RepeatMasker, чтобы заменить низкую сложность и простые повторяющиеся области всех геномов HPV на «N». Для базы данных масок гомологии, вдохновленной Метафланом [48], мы создали базу данных по типу ВПЧ, замаскировав гомологичные последовательности, общие для разных типов ВПЧ, а затем дополнительно замаскировали повторы с помощью RepeatMasker ( Supplementary Fig 1 ).Создание базы данных масок гомологии состояло из трех этапов. Во-первых, все фрагменты ДНК размером 100 п.н. из каждого полного генома HPV, созданного с помощью EMBOSS [49], были сопоставлены со всеми другими типами HPV с 90% -ным порогом идентичности с помощью bowtie2 (параметры bowtie2: -a –score-min L, 0,6, 0,6). Затем мы замаскировали совпадающие области на геномах ( Supplementary Fig 1 ). Наконец, после того, как все гомологичные области были замаскированы, RepeatMasker был также применен для всех обработанных геномов ВПЧ, чтобы замаскировать низкую сложность и области простых повторов ( Supplementary Fig 1 ).Для баз данных масок повторов и масок гомологии длина геномов ВПЧ не была изменена, и только некоторые фрагменты были заменены как «N», и мы назвали не-N последовательности генома ВПЧ эффективным геномом. Распределение эффективного размера генома исходного HPV, маски повторов и маски гомологии было произведено с помощью пакета R, ggplot2 [50].
Мы проверили базу данных масок повторов с помощью BLASTn в отношении геномов человека (GCRh48) и прокариот (эталонные геномы Prokaryotic RefSeq 112 и 1669 репрезентативных геномов) (https: // www.ncbi.nlm.nih.gov/genome/browse/reference/), и не было найдено совпадений с идентичностью> 90% в области выравнивания> 50 п.н. График циркулярных последовательностей общих последовательностей между ВПЧ и прокариотами человека был создан с помощью Circos 0.69 [51].
Построение дерева гомологии между 182 типами ВПЧ и гибридной маски HPViewer
Для того, чтобы исследовать сходство последовательностей между типами ВПЧ, мы выбрали из каждого генома только 100-парные фрагменты генома с> 90% идентичностью два или более типов HPV от каждого типа HPV, все другие основания в геномах были замаскированы как N ( Supplementary Fig 1 ).Было 29 типов ВПЧ без каких-либо участков длиной 100 п.н., которые соответствовали бы другим типам. Выбранные части из оставшихся 153 геномов ВПЧ были выровнены по множеству с помощью MUSCLE 3.8.31 [52]. Матрица попарных расстояний была рассчитана с помощью MEGA7 [53], а дерево максимального правдоподобия было построено с помощью RAxML 8.2.9 в рамках модели замены GTRCAT. с 1000 повторениями начальной загрузки [54]. Дерево гомологии с корнем средней точки было визуализировано с помощью FigTree v1.4.3 [55] ( Supplementary Fig 2 ).
Для гибридного режима HPViewer сначала используется режим маски повторения для идентификации всех типов HPV в образце.Мы устанавливаем порог обнаружения одного типа ВПЧ в образце как два разных выровненных считывания, охватывающих не менее 150 оснований одного эталонного генома типа ВПЧ ( Дополнительный рисунок 4 ). Мы использовали SAMtools depth [56], чтобы получить покрытие для каждой позиции картированных геномов ВПЧ. Когда длина покрытых позиций отображенных считываний для одного типа HPV меньше 150, мы отбрасываем этот тип HPV как ложноположительный. Когда покрываемая длина превышала 150 п.н., мы считали это обнаруженным.
Когда в файле данных образца обнаружен только один тип ВПЧ, вероятность ложноположительных результатов от других типов ВПЧ отсутствует, поэтому это считается истинно положительным. Когда в образце обнаружено несколько типов ВПЧ, типы ВПЧ проверяются на предмет близости друг к другу (расстояние гомологии <0,35) с использованием матрицы попарных расстояний гомологии. Дистанционно связанные типы ВПЧ указываются непосредственно в профиле ВПЧ. Тесно связанные типы ВПЧ должны быть повторно протестированы, таким образом, считывания ВПЧ, сгенерированные из выходного файла bam в режиме повторения с помощью BEDtools [57], повторно выравниваются с базой данных маски гомологии.Только похожие типы HPV, обнаруженные в режиме маски гомологии, также добавляются в профиль HPV.
Моделирование данных секвенирования HPV с помощью дробовика с помощью Grinder
Смоделированные образцы HPV, использованные в нашей оценке модели, были получены Гриндером [58], и каждый образец содержит один из 143 типов HPV, которые обнаруживаются HPVDetector. Для каждого типа ВПЧ мы сгенерировали 100 образцов с семью различными уровнями считывания ВПЧ, имитируя разную глубину секвенирования: 2, 5, 10, 50, 100, 500 и 1000. Всего было 100 100 смоделированных образцов (143 * 100 * 7).Считывания длиной 100 п.н. были взяты из выбранных геномов с добавлением 5% мутаций для увеличения разнообразия.
Выявление и генотипирование ВПЧ у пациентов с рецидивирующим папилломатозом гортани с помощью HPViewer
После одобрения Институционального наблюдательного совета Медицинской школы Нью-Йоркского университета (номер исследования S13-00119) были обследованы шесть пациентов с подтвержденным патологией рецидивирующим респираторным папилломатозом. идентифицированы из большого пула пациентов, участвующих в крупномасштабном продольном исследовании.Ткань опухоли удаляли эндоскопически, фиксировали в формалине и заливали парафином. Диагноз рецидивирующего респираторного папилломатоза был установлен при гистопатологическом исследовании опухолевой ткани. Для извлечения ДНК залитую парафином ткань разрезали на срезы толщиной 20 микрон. Полную геномную ДНК экстрагировали из неокрашенных срезов тканей с использованием набора для выделения тканевой ДНК BiOstic FFPE (Mo Bio Carlsbad, CA).
Образцы для полоскания рта были собраны у тех же шести пациентов в соответствии с протоколом Национального исследования здоровья и питания (NHANES) [59].Вкратце, испытуемых просили прополоскать 5 мл жидкости для полоскания рта Scope® без полоскания горла в течение одной минуты. Затем образцы для промывки ротовой полости закрывали и хранили не более одной недели при 4 ° C перед экстракцией ДНК. Для экстракции ДНК образцы центрифугировали в течение 10 минут при 3200 g. ДНК в бесклеточном супернатанте осаждали раствором изопропанол / гликоген и осаждали в течение 10 минут при 2000 g, как описано ранее [59]. Осадок ресуспендировали в 200 мкл раствора для гидратации ДНК (Qiagen).
Чтобы оценить чувствительность и специфичность HPViewer, мы определили истинные составы ВПЧ в этих образцах папилломы и смывах для полости рта. Поскольку только HPV типов 6 и 11 ранее наблюдались в папилломе гортани [37], мы провели стандартную ПЦР для HPV6 и 11 с использованием праймеров от Tucker et al. (2001) [60] по этим 12 образцам. Мы обнаружили HPV6 в 4 опухолевых тканях и 2 совпадающих образцах для смыва для полости рта и HPV11 в 2 опухолевых тканях. Дополнительная ПЦР с более низкой температурой отжига подтвердила, что HPV6 присутствовал в образцах 3W и 7W и что как 3T, так и 3W были отрицательными для HPV11 (, дополнительный рисунок 5, ).
При первоначальном скрининге Bowtie2 этих образцов в немаскированной базе данных HPV небольшое количество считываний, соответствующих HPV71, было обнаружено во всех шести оральных образцах и трех образцах опухоли, а также HPV19 и 82 в некоторых образцах. Проверка этих считываний выявила последовательности, такие как повторы TG (, дополнительный рис. 3), , которые соответствуют повторам TG в геноме HPV71. После маскировки базы данных HPV с помощью RepeatMasker не было обнаружено ни одного чтения, соответствующего HPV19, 71 или 82.
HPViewer идентифицировал только 2 чтения HPV6 в образцах для промывания полости рта 3W и 7W.Эти образцы были подтверждены как положительные на HPV6 с помощью ПЦР. Проверка последовательности этих считываний показала, что они содержат те же полиморфизмы, что и в гораздо большем количестве считываний в сопоставленных образцах опухолей от одних и тех же пациентов, что свидетельствует о низком уровне высвобождения ВПЧ из папилломы в полость рта. HPViewer обнаружил только одно чтение HPV11 в образце 3W, но HPV11 не был обнаружен с помощью ПЦР в 3W или 3T. Следовательно, мы установили порог обнаружения для HPViewer на 2 различных чтения на образец для одного типа HPV.
Метагеномные данные из проекта Human Microbiome Project
Мы загрузили 1573 набора метагеномных данных секвенирования с дробовиком из Human Microbiome Project (https://hmpdacc.org/hmp/) ( Supplementary Table 5 ). Образцы HMP (с ранее удаленными данными человека) были получены из 18 участков тела, включая передние ноздри, прикрепленную ороговевшую десну, кровь, слизистую оболочку щеки, подвздошный мешок, левую ретроаурикулярную складку, среднюю часть влагалища, носоглотку, небные миндалины, задний свод, правый ретроаурикулярный складка, слюна, стул, поддесневой налет, наддесневой налет, горло, спинка языка и влагалище ( Дополнительная таблица 3 ).Тепловая карта распространенности ВПЧ для различных участков тела была создана с помощью пакета R, gplot [61]. Совместная встречаемость ВПЧ для трех участков тела была получена с помощью Gephi 0.9.1 [62].
Подкаст Big Compute: высокопроизводительные вычисления и геномика революционизируют медицину
В этом выпуске подкаста Big Compute Podcast Габриэль Бронер приглашает Марка Бородкина, главного операционного директора Bionano Genomics, обсудить, как геномика и HPC позволяют врачам и исследователям диагностировать сложные заболевания и назначать уникальные индивидуальные методы лечения, основанные на индивидуальных вариациях ДНК.
Зарегистрируйтесь, чтобы слушать будущие выпуски подкастов Big Compute в прямом эфире
Найдите подкаст Big Compute в подкастах Apple.
Обзор и ключевые комментарии
Достижения в области геномики и высокопроизводительных вычислений открывают новую форму медицины. Вариации ДНК указывают на тип заболевания, поражающего пациента, и также указывают на наилучшее возможное лечение. Традиционно лечение назначается в зависимости от типа заболевания, такого как «рак легких», но только небольшая часть пациентов реагирует положительно.Вариации в ДНК позволяют врачам понять конкретный тип рака и лучший курс действий для лечения, поскольку я перехожу к новой форме персонализированной медицины.
Что такое сложные заболевания?
«Я делю сложные заболевания на два различных типа: один – это редкие заболевания, которые встречаются у небольшого процента населения (в то время как в одних только США с ними живут 25 миллионов человек). Другая область – это рак. , где у каждого пациента есть уникальная подпись, которая определяет, как прогрессирует рак, и какое лечение должно быть.”
Как изменяется ДНК при заболевании?
«Наша ДНК кодирует, кто мы есть. Этот геном постоянно меняется. Большинство этих изменений не причиняют вреда и представляют собой простые «орфографические ошибки». Однако, если эти варианты удаляют ген, эта функция будет отсутствовать. Иногда наши тела способны компенсировать это, а иногда наши тела не могут компенсировать, и в этом случае, например, мышечная дистрофия может быть фатальной. Некоторые варианты очень далеки друг от друга, но их можно объединить, чтобы создать новый белок, который может причинить вред, как в случае лейкемии, называемой ХМЛ.”
Как мы можем обнаруживать вариации для улучшения диагнозов?
«В течение многих лет мы обнаруживали большие вариации в ДНК. Вы можете посмотреть на хромосомы под микроскопом. Более современные методы включают секвенирование ДНК, которое позволяет находить небольшие вариации. Совсем недавно моя компания представила оптическое картографирование. Мы берем очень длинные фрагменты ДНК из крови или тканей человека, подготавливаем их с помощью химического метода маркировки и пропускаем их через 100 000 наноканалов.Сравнивая со здоровым человеком, мы обнаруживаем структурные вариации. Врачи могут искать уже обнаруженные варианты для постановки диагноза. Исследователи используют оптическое картирование, чтобы найти новые вариации и новые маркеры для разработки новых лекарств или новых методов лечения ».
Как мы можем улучшить лечение на основе информации ДНК?
«Посмотрите на рак. Мы говорим, что у человека конкретный тип рака, говоря, что у него рак легких. Существуют методы лечения рака легких.Есть люди, которые отвечают хорошо, а другие очень плохо. Так почему это так? Исследователи рака осознали, что у каждого из этих видов рака есть своя сигнатура, которая заставляет их прогрессировать по-разному и по-разному реагировать на терапию. Цель этого нового метода терапии – назначить терапию, которая подходит именно вам ».
Как сегодня используются разработанные вами решения?
«В настоящее время нас используют для клинических исследований пациентов с лейкемией и мышечными дистрофиями по всему миру.Исследователи стремятся заменить стандартное лечение чем-то более дешевым, быстрым и обеспечивающим более высокое разрешение. В некоторых из этих исследований они ищут новые биомаркеры. Когда клинические тесты показывают, что у пациента редкое заболевание, точность диагноза сегодня составляет 30-50%. Обнаружение этих биомаркеров – предвестник новой терапии »
Не могли бы вы рассказать о своем выборе использования высокопроизводительных вычислений в облаке для анализа ДНК?
«Мы пришли к выводу, что опережаем закон Мура в нашей способности генерировать данные о пациентах, быстрее получать геномику пациентов и анализировать более сложные события в ДНК.Нам нужно больше вычислений. Мы рассматривали высокопроизводительные вычисления в облаке как лучший способ масштабирования для того, что мы делаем сегодня и в будущем, поскольку это позволяет нам быстро масштабироваться. Мы выбрали интегрированные высокопроизводительные вычисления в облачное решение, и это позволяет нам, как только мы получаем данные из наших инструментов, передавать данные в облако. Наш конвейер биоинформатики находится в облаке, и мы можем одновременно обслуживать большое количество клиентов. Наш переход в облако стал возможен благодаря уникальным возможностям Rescale.”
«Одна из вещей, которую мы поняли довольно рано, когда исследовали облако. Дело в том, что мы хотели предоставить нашим исследователям и врачам простое в использовании решение. Один из вариантов заключался в том, чтобы сделать это самостоятельно: поместить наш конвейер в контейнер в AWS, написать примечания к приложению и попросить наших пользователей заняться этим. Мы очень быстро поняли, что это оттолкнет наших клиентов, потому что наша задача – находить информативные данные о пациентах, поэтому мы решили абстрагироваться от высокопроизводительных вычислений в облаке с помощью Rescale и нашего программного обеспечения.Все, что нужно знать нашим клиентам, – это то, что решение обеспечивает необходимую им безопасность и производительность, и им не нужно изучать новый жаргон облака ».
Можем ли мы представить себе будущее, в котором мы будем проходить регулярные анализы ДНК в кабинете врача?
«Это будущее наступит. Некоторые проблемы связаны с технологиями. Но помимо этого существуют гораздо более серьезные проблемы, и они связаны с наличием генетических консультантов, которые могут передать информацию, которая была обнаружена в вашем геноме, в надлежащем контексте.Иногда мы можем сказать, что у вас есть этот тип болезни, но чаще это вероятность того, что вы заболели. Пытаться передать эти вероятности значимым образом делают консультанты-генетики, а у нас будет нехватка консультантов-генетиков. Мы находимся в начале понимания того, на что способны эти геномные инструменты »
Бородкин Марк
Марк Бородкин – главный операционный директор Bionano Genomics, геномной компании, специализирующейся на диагностике сложных заболеваний.Марк имеет 20-летнюю историю успеха в разработке систем для медико-биологических наук и производства медицинского оборудования.
Габриэль Бронер
Габриэль Бронер – вице-президент и генеральный директор подразделения высокопроизводительных вычислений Rescale. До прихода в Rescale в июле 2017 года Габриэль проработал 25 лет в отрасли в качестве архитектора ОС в Cray, генерального директора в Microsoft, главы отдела инноваций в Ericsson и вице-президента и генерального директора по высокопроизводительным вычислениям в SGI / HPE.
| BM.Оптимизировано 3,36 |
| Направлен на приложения, которые оптимизированы только для ЦП и могут выполняться параллельно на большом количестве ядер. | Посекундная оплата с минимумом одного часа. Бесплатно для локального хранилища RDMA или NVMe SSD. | Представление вычислительных инстансов с процессорами Intel Xeon Ice Lake 3-го поколения |
| VM.Optimized3.Flex |
| Направлен на приложения, которые оптимизированы только для ЦП и могут выполняться параллельно на большом количестве ядер. | Посекундный биллинг с гибкостью выбора OCPU и памяти. | Представление вычислительных инстансов с процессорами Intel Xeon Ice Lake 3-го поколения |
| BM.HPC2.36 |
| Направлен на приложения, которые оптимизированы только для ЦП и могут выполняться параллельно на большом количестве ядер. | Посекундная оплата с минимумом одного часа. Бесплатно для локального хранилища RDMA или NVMe SSD. | Виртуальные люди в Oracle Cloud Infrastructure HPC |
| BM.GPU4.8 |
| Направлен на приложения, предназначенные для работы на графических процессорах.Кластерная сеть RDMA – дополнительный бонус для приложений, которые могут работать параллельно. | Посекундная оплата с минимумом одного часа. Бесплатно для локального хранилища RDMA или NVMe SSD. | NVIDIA A100 Bare Metal Performance в Oracle Cloud Infrastructure |
| БМ.ГПУ3.8 |
| Направлен на приложения, предназначенные для работы на графических процессорах. | Посекундная оплата с минимумом одного часа. Вложение блочного хранилища определяется пользователем и оплачивается отдельно. | Тестирование графических процессоров для прогнозирования кардиотоксичности лекарств в Oracle Cloud |
| BM Стандарт E4.128 |
| Предназначен для рабочих нагрузок с большим объемом памяти, которые не нужно масштабировать за пределы пары экземпляров. | Посекундный биллинг с гибкостью выбора OCPU и памяти. | Представление платформы Oracle Cloud Compute E4 на процессорах AMD EPYC третьего поколения |
| VM.Standard.E4.Flex |
| Предназначен для рабочих нагрузок с большим объемом памяти, которые не нужно масштабировать за пределы пары экземпляров. | Посекундная оплата с минимумом одного часа. Вложение блочного хранилища определяется пользователем и оплачивается отдельно. | Представление платформы Oracle Cloud Compute E4 на процессорах AMD EPYC третьего поколения |
| BM.Standard.E3.128 |
| Предназначен для рабочих нагрузок с большим объемом памяти, которые не нужно масштабировать за пределы пары экземпляров. |


 должны быть достигнуты приведенные ниже целевые показатели 90-70-90;
должны быть достигнуты приведенные ниже целевые показатели 90-70-90;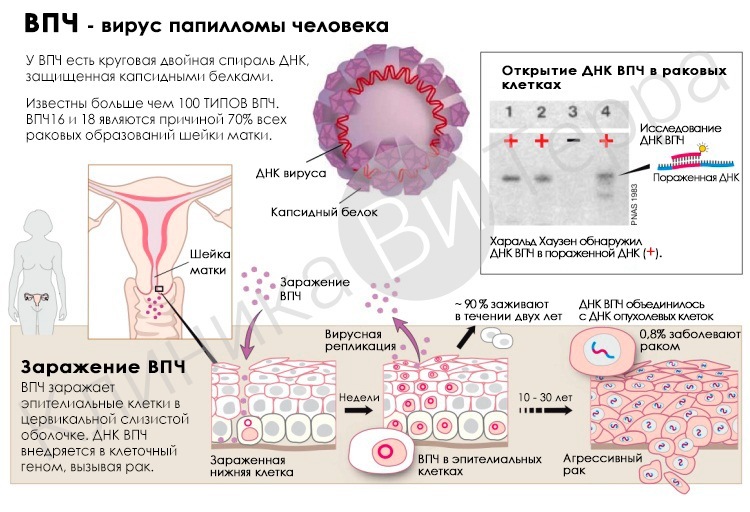 При этом вирус, существующий в эписомальной форме, копируется в инфицированных клетках. Одновременно происходит усиленное размножение клеток базального слоя эпителия, что ведет к прогрессированию инфекции и появлению вегетаций (разрастаний). Клинически продуктивная инфекция определяется как бородавки или папилломы. Вирус выявляется методом ПЦР. При гистологическом исследовании определяются явления гиперкератоза (повышенного ороговения, т.е. старения клеток).
При этом вирус, существующий в эписомальной форме, копируется в инфицированных клетках. Одновременно происходит усиленное размножение клеток базального слоя эпителия, что ведет к прогрессированию инфекции и появлению вегетаций (разрастаний). Клинически продуктивная инфекция определяется как бородавки или папилломы. Вирус выявляется методом ПЦР. При гистологическом исследовании определяются явления гиперкератоза (повышенного ороговения, т.е. старения клеток).
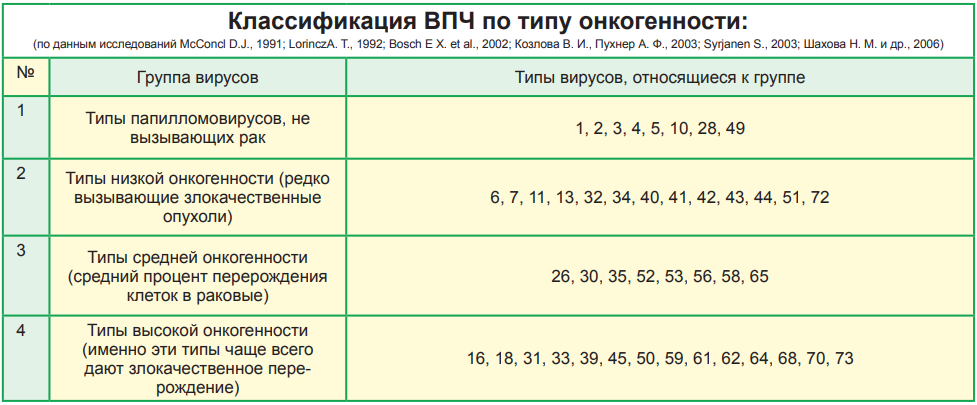
 Различают физические (криодеструкция, лазеротерапия, диатермокоагуляция, электрохирургическое иссечение) и химические (трихлоруксусная кислота, ферезол, солкодерм) деструктивные методы, а также хирургическое удаление кондилом. Цитотоксические препараты – подофиллин, подофиллотоксин (кондилин), 5-фторурацил. Женщинам детородного возраста на время лечения рекомендуют надежную контрацепцию или отказ от половой жизни.
Различают физические (криодеструкция, лазеротерапия, диатермокоагуляция, электрохирургическое иссечение) и химические (трихлоруксусная кислота, ферезол, солкодерм) деструктивные методы, а также хирургическое удаление кондилом. Цитотоксические препараты – подофиллин, подофиллотоксин (кондилин), 5-фторурацил. Женщинам детородного возраста на время лечения рекомендуют надежную контрацепцию или отказ от половой жизни. Из местных (влагалищных) препаратов противовирусным действием обладает Эпиген интим спрей и Бетадин.
Из местных (влагалищных) препаратов противовирусным действием обладает Эпиген интим спрей и Бетадин.
 HPV today. 2006;8:8-9.
HPV today. 2006;8:8-9.