Протонная терапия при лимфоме
Лимфома – тип рака, который возникает в лимфатической системе человека и классифицируется либо как болезнь Ходжкина, либо как неходжкинская лимфома. Из-за того, что лимфатические узлы расположены в разных местах человеческого организма, лимфома может иметь любую локализацию.
Обычно лимфома лечится химиотерапией с последующей лучевой терапией. Но нередко онкопатологии этого типа образуются в груди рядом с важными органами, такими как сердце, легкие или пищевод. Это затрудняет доставку высоких доз радиации в опухоль без риска повреждения этих чувствительных зон.
Протонная терапия дает шанс на выздоровление больным с лимфомами, неоперабельными вследствие их локализации. Наша команда специалистов– онкологов способна создать такой план лечения, при котором радиация будет точно воздействовать на самые труднодосягаемые опухоли, в тоже время неповреждая здоровые ткани и не задевая жизненно важные органы.
Бывают обратные случаи: опухоли некоторых больных оказываются устойчивыми к химиотерапии. Лучевая терапия становится единственным возможным методом лечения, но для уничтожения раковых клеток требуется высокая доза радиационного облучения. При использовании стандартной лучевой терапии следствием может стать негативное воздействие на здоровые ткани, особенно опасное в тех случаях, когда новообразованиезалегает в непосредственной близости от жизненно важных органов. Протонная терапия, при которой направленный пучок протонов доставляет энергию непосредственно в раковые клетки, не задевая при этом нормальные ткани, дает шанс на выздоровление пациентам с лимфомами, устойчивыми к химиотерапии.
Процедуры обычно занимают от 15 до 30 минут в
день и проводятся пять раз в неделю приблизительно от 4 до 7 недель.
Курс лечения и длительность процедуры каждый день меняется в зависимости
от индивидуального случая каждого больного.
Значение лучевой терапии при первичной медиастинальной В-крупноклеточной лимфоме Текст научной статьи по специальности «Клиническая медицина»
ЗНАЧЕНИЕ ЛУЧЕВОЙ ТЕРАПИИ ПРИ ПЕРВИЧНОЙ МЕДИАСТИНАЛЬНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЕ
Г.С. Тумян, д-р мед. наук
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохи-на» Минздрава России, Каширское ш., д. 24, Москва, Российская Федерация, 115478
Получено: 25 октября 2015 г. Принято в печать: 22 декабря 2015 г.
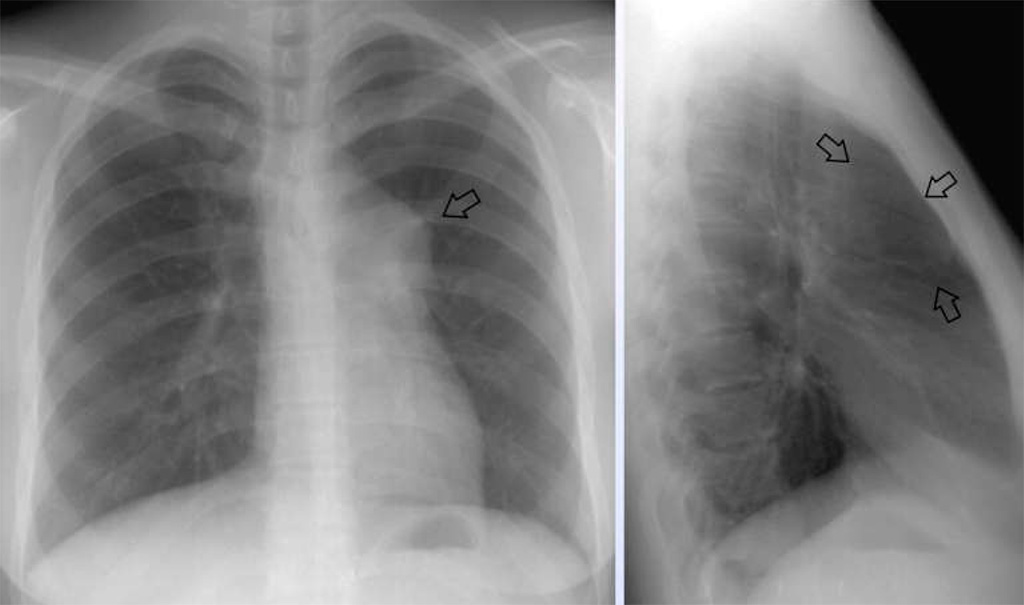
Первичная медиастинальная В-крупноклеточная лимфома (ПМВКЛ) относится к первичным экстрано-дальным опухолям и происходит из В-клеток мозгового слоя вилочковой железы. Болезнь чаще встречается у молодых женщин. Медиана возраста составляет примерно 30 лет. Опухоль характеризуется преимущественно местнораспространенным характером роста в пределах переднего верхнего средостения с частым вовлечением органов грудной клетки. Заболевание обычно проявляется симптомами компрессии медиастинальных структур с развитием плеврита и/или перикардита, синдромом сдавления верхней полой вены. У ‘/3 больных наблюдается вовлечение экстранодальных органов за пределами средостения (почек, надпочечников, поджелудочной железы, яичников, ЦНС).
В ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России с 2000 по 2014 г. получало лечение 103 больных с иммуноморфологическим диагнозом ПМВКЛ. Медиана возраста составила 30 лет (диапазон 15—63 года), 55 % были женщины. У 62 % больных при первом обращении отмечался локальный процесс в пределах средостения, примерно у 1/3 пациентов определялся плеврит или перикардит (в 26 случаях выпот был сочетанным), у 46 % — синдром сдавления верхней полой вены.
Опухолевый субстрат при ПМВКЛ обычно представлен диффузным лимфоидным инфильтратом из клеток среднего и крупного размера с округло-овальными или многодольчатыми ядрами, с морфологией центро-бластов и иммунобластов в различных соотношениях. Характерным признаком является стромальный склероз с формированием альвеолоподобного строения, часто присутствуют поля некроза. При иммуногистохимическом исследовании опухолевой ткани определяется экспрессия пан-В-клеточных антигенов, В-клеточных транскрипционных факторов (PAX5, Oct-2, BOB.1 и MUM1), отсутствует экспрессия иммуноглобулина М, часто отмечается коэкспрессия антигенов CD23 и CD30. Антиген CD30 экспрессируется примерно в 80 % случаев, но в отличие от лимфомы Ходжкина и анапластической крупноклеточной лимфомы — более слабо и менее гомогенно.
В качестве первого метода противоопухолевого воздействия могут использоваться различные режимы имму-нохимиотерапии: R-CHOP, MACOP-B ± R, DA-EPOCH-R, причем преимущество одной схемы перед другой не показано. Согласно нашим данным, статистически значимых различий в отдаленных результатах лечения ПМВКЛ в группах с различным режимом терапии (R-CHOP — 18 больных, MACOP-B ± R — 52, R-EPOCH — 16) не получено (p = 0,4). При медиане наблюдения 34 мес. выживаемость без прогрессирования составила 83 %. Следует отметить, что ни у одного из 16 больных, получавших
SIGNIFICANCE OF RADIATION THERAPY IN PRIMARY MEDIASTINAL B-LARGE CELL LYMPHOMA
G.S. Tumyan, DSci
N.N. Blokhin Russian Cancer Research Center, 24 Kashirskoye sh., Moscow, Russian Federation, 115478
Received: October 25, 2015 Accepted: December 22, 2015
лечение по программе R-EPOCH, не зарегистрировано развития рецидивов или прогрессирования болезни, хотя небольшое число наблюдений не позволяет делать окончательных выводов.
После завершения лекарственного лечения у большинства больных ПМВКЛ сохраняется значительная резидуальная масса в средостении. Это создает серьезные трудности в разграничении остаточной опухолевой и фиброзной тканей. Последняя присутствует при этой форме заболевания. Наиболее информативной в данной ситуации является позитронно-эмиссионная томография (ПЭТ). Этот метод исследования в настоящее время включен в стандарты оценки эффективности лечения при лимфоме Ходжкина и диффузной В-крупноклеточной лимфоме (ДВКЛ). В то же время информативность и прогностическая ценность ПЭТ при ПМВКЛ пока еще изучаются. Так, в ретроспективное исследование Mémorial Sloan-Kettering Cancer Center было включено 54 больных ПМВКЛ, которые получали лечение по программе R-CHOP/ICE без лучевой терапии (ЛТ) [1]. Общая (ОВ) и выживаемость без прогрессирования (ВБП) в течение 3 лет составили 88 и 78 % соответственно в группе ПЭТ-отрицательных больных. ПЭТ на промежуточных этапах лечения была выполнена у 51 из 54 больных, у 24 (47 %) из них определялись очаги патологического накопления радиофармпрепарата. Однако этот факт не имел отрицательного влияния на дальнейшее течение заболевания.
В другом ретроспективном исследовании канадских ученых показано, что частота ПЭТ-положительных случаев после иммунохимиотерапии при ПМВКЛ выше, чем при ДВКЛ, и составляет примерно 41 % [2]. Для анализа значения и стандартизации оценки результатов ПЭТ-КТ Международная группа по экстранодальным лимфомам (IELSG) инициировала в 2007 г. проспективное исследование, включавшее 115 больных ПМВКЛ, ПЭТ-данные которых были доступны для централизованного изучения [3]. Все пациенты получали стандартное лечение (R-CHOP-21/14 os R-MACOP-B os R-VACOP-B), 102 (89 %) больным проводилась затем консолидирующая ЛТ. Полный метаболический ответ (1—2 балла по шкале Deauville) был достигнут у 54 (47 %) больных [4]. У 61 пациента накопление радиофармпрепарата в резиду-альной опухоли было выше, чем фоновое в средостении, при этом у 27 (23 %) пациентов оно было ниже, чем в печени (3 балла по шкале Deauville), а у 34 (30 %) — значительно выше (4 — 5 баллов по шкале Deauville).
www.medprint.ru
95
Deauville, отдаленные результаты лечения были такими же хорошими, как и у ПЭТ-отрицательных пациентов. Авторы делают вывод, что уровень накопления препарата в печени при ПМВКЛ является наиболее информативным и прогностически значимым фактором, позволяющим идентифицировать больных с низким (1—3 балла по шкале Deauville) и высоким риском (4 — 5 баллов по шкале Deauville): 5-летняя ВБП составила 99 и 68 % (р < 0,0001), ОВ — 100 и 83 % (р = 0,0003) соответственно.
Аналогичные результаты сообщают американские авторы после применения программы DA-EPOCH-R. У 50 % больных ПМВКЛ после завершения иммунохимио-терапии сохраняется ПЭТ-позитивность при сравнении с фоновым в средостении (> 3 баллов по шкале Deauville). Тем не менее без дальнейшего лечения только у 3 из 18 пациентов развился рецидив заболевания, причем во всех наблюдениях интенсивность накопления радиофармпрепарата соответствовала 5 баллам по шкале Deauville [5].
Таким образом, при ПМВКЛ отмечается большое число ложноположительных результатов, что, возможно, связано с применением ритуксимаба и активностью тимуса у большинства молодых больных. Это предположение подтверждается отсутствием прогностического значения данных промежуточных ПЭТ при ПМВКЛ. Было бы логично предположить, что для нивелирования воспалительной реакции желательно выполнять исследование на более поздних сроках после завершения иммунохимиотерапии, однако потеря преимущества в применении ЛТ у тех больных, которым она действительно показана, делает сомнительной целесообразность этой гипотезы. Очевидно одно: необходимы дальнейшие исследования для определения возможности изменения программы лечения или отказа от ЛТ у больных ПМВКЛ с учетом результатов ПЭТ.
Очевидно одно: необходимы дальнейшие исследования для определения возможности изменения программы лечения или отказа от ЛТ у больных ПМВКЛ с учетом результатов ПЭТ.
В ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России ПЭТ после окончания лекарственного лечения выполнена 56 больным ПМВКЛ, из них у 20 (36 %) определялись очаги патологического накопления радиофармпрепарата в остаточной опухоли. У ПЭТ-отрицательных больных 5-летняя ВБП оказалась значительно выше (91 и 50 % соответственно; р = 0,05).
Целесообразность облучения средостения является, пожалуй, наиболее обсуждаемым вопросом при ПМВКЛ. На одной чаше весов — увеличение риска вторых опухолей, в частности рака молочной железы, и кардиопульмональные осложнения у молодых больных; на другой — крайне неблагоприятный прогноз в случае развития рецидива заболевания. После рецидива 2-летняя ОВ больных ПМВКЛ не превышает 15 %. Исторически наилучшие результаты получены при применении химиолучевого лечения. Согласно данным IELSG, глубина противоопухолевого ответа значительно
возрастает после применения облучения, причем независимо от вида химиотерапии. Частота полных ремиссий после химиотерапии составляет 51 %, после ЛТ — 74 % [6]. Позднее многие исследовательские группы показали переход ПЭТ-позитивности в ПЭТ-негативность после применения облучения. В 2 ретроспективных исследованиях продемонстрировано улучшение показателей бессобытийной и общей выживаемости при добавлении ЛТ.
С другой стороны, в литературе немало сообщений о безболезненной для пациентов возможности избежать облучения. В ретроспективном исследовании канадских авторов рутинное применение ЛТ в качестве консолидации после иммунохимиотерапии не улучшило отдаленных результатов [7]. Согласно их данным, 96 больных ПМВКЛ получали Н-СНОР. До 2005 г. всем проводилось облучение.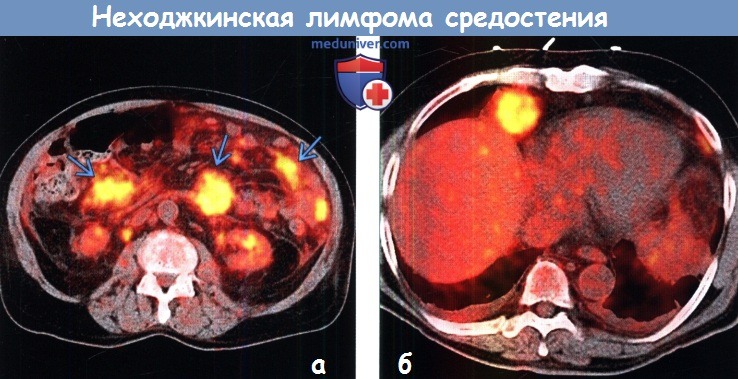 Позднее из 59 больных, включенных в исследование, ЛТ получило только 24 (41 %) пациента, которые имели ПЭТ-положительные результаты после лекарственного лечения. При медиане наблюдения более 5 лет выживаемость больных в разных группах оказалась одинаковой, что подтверждает вывод о возможности отказа от ЛТ при определенных условиях. Этот вывод подтверждают американские исследователи: 3-летняя бессобытийная выживаемость после программы DA-EPOCH-R составляет 93 %, при этом ЛТ была проведена только 2 больным [5]. По-видимому, эти противоречивые литературные данные будут разрешены после опубликования результатов крупного международного исследования (IELSG 37), дизайн которого включает централизованную оценку результатов ПЭТ и рандомизацию ПЭТ-отрицательных пациентов после иммунохимиотерапии на дальнейшее наблюдение или консолидирующую ЛТ.
Позднее из 59 больных, включенных в исследование, ЛТ получило только 24 (41 %) пациента, которые имели ПЭТ-положительные результаты после лекарственного лечения. При медиане наблюдения более 5 лет выживаемость больных в разных группах оказалась одинаковой, что подтверждает вывод о возможности отказа от ЛТ при определенных условиях. Этот вывод подтверждают американские исследователи: 3-летняя бессобытийная выживаемость после программы DA-EPOCH-R составляет 93 %, при этом ЛТ была проведена только 2 больным [5]. По-видимому, эти противоречивые литературные данные будут разрешены после опубликования результатов крупного международного исследования (IELSG 37), дизайн которого включает централизованную оценку результатов ПЭТ и рандомизацию ПЭТ-отрицательных пациентов после иммунохимиотерапии на дальнейшее наблюдение или консолидирующую ЛТ.
ЛИТЕРАТУРА/REFERENCES
1. Moskowitz CH, Hamlin PA, Maragulia J, et al. Sequential dose-dense RCHOP followed by ICE consolidation (MSKCC protocol 01-142) without radiotherapy for patients with primary mediastinal large B cell lymphoma. Blood (ASH Annual Meeting Abstracts). 2010;118: Abstract 420.
2. Savage KJ, Yenson PR, Shenkier T, et al. The outcome of primary mediastinal large B-cell lymphoma (PMBCL) in the R-CHOP treatment era. Blood (ASH Annual Meeting Abstracts). 2012;120: Abstract 303.
3. Martelli M, Ceriani L, Zucca E, et al. 18-fluorodeoxyglucose positron-emission tomography predicts survival following chemoimmunotherapy for primary mediastinal large B cell lymphoma: results of the IELSG 26 Study. J Clin Oncol. 2014;32(17):1769-75. doi: 10.1200/jco.2013.51.7524.
4. Meignan M, Barrington S, Itti E, et al. Report on the 4th International Workshop on Positron Emission Tomography in Lymphoma. Leuk Lymphoma. 2014;55(1):31-7. doi: 10.3109/10428194.2013.802784.
Leuk Lymphoma. 2014;55(1):31-7. doi: 10.3109/10428194.2013.802784.
5. Dunleavy K, Pittaluga S, Maeda LS, et al. Dose adjusted EPOCH-Rituximab therapy in Primary Mediastinal B-Cell Lymphoma. N Engl J Med. 2013;368(15):1408-16. doi: 10.1056/nejmoa1214561.
6. Zinzani PL, Martelli M, Bertini M, et al. Induction chemotherapy strategies for primary mediastinal large B-cell lymphoma with sclerosis: a retrospective multinational study on 426 previously untreated patients. Haematologica. 2002;87(12):1258-64.
7. Savage K, Al-Rajhi N, Voss N, et al. Favorable outcome of primary mediastinal large B-cell lymphoma in a single institution: the British Columbia experience. Ann Oncol. 2006;17:123-30. doi: 10.1093/annonc/mdj030.
96
Клиническая онкогематология
НМИЦ онкологии им. Н.Н. Блохина
Вот уже почти 70 лет Онкоцентр – это уникальный симбиоз науки и клинической практики, мультидисциплинарный подход к лечению онкологических больных, хирургическая школа, известная далеко за пределами России. Здесь изучаются и совершенствуются морфологические, иммунологические и генетические методы диагностики.Специалисты Блохина – авторы клинических рекомендаций по онкологии.
Ежегодно в Онкоцентре противоопухолевое лечение проходят более 35 тысяч пациентов всех возрастов. Еще почти 6 000 граждан России получают помощь дистанционно – посредством телемедицинских консультаций.
Онкоцентр – это:
- Комбинированное лечение пациентов
- Собственное производство химио- и радиофармацевтических препаратов
- Собственные методы иммунотерапии опухолей
- Передовые технологии реабилитации онкопациентов
- «Центры компетенций» по различным нозологиям, в том числе первый в России центр компетенций по лечению пациентов с опухолями без выявленного первичного очага
- Собственное отделение переливания крови, доноры которого снабжают кровью и ее компонентами исключительно пациентов Онкоцентра
- Первый и единственный онкологический центр, имеющий в своем составе специализированное отделение реабилитации для онкопациентов
- Крупнейшая педагогическая школа в области онкологии в России
На протяжении многих лет Онкоцентр является членом Международного Противоракового Союза (UICC) при Всемирной организации здравоохранения (ВОЗ) и членом Ассоциации Европейских Онкологических Институтов (OECI) в Женеве.
В 2019 году НИИ детской онкологии и гематологии НМИЦ онкологии им. Н.Н. Блохина стал полноправным членом ведущей мировой организации, которая объединяет трансплантационные центры Европы и мира – Европейской группы по трансплантации крови и костного мозга (EBMT).
НМИЦ онкологии им. Н.Н. Блохина:
- Онкологическая помощь мирового уровня, доступная каждому
- Инновации в онкологии
- Уникальный опыт для коллег
Неходжкинские лимфомы (лимфосаркомы) у взрослых
Различают два основных типа лимфом – болезнь Ходжкина, названную так по имени автора, описавшего это заболевание, и неходжкинские лимфомы.
Неходжкинские лимфомы (лимфосаркомы) (НХЛ) развиваются из лимфоидной ткани, которая выполняет защитную функцию организма. Лимфоидная ткань, представлена лимфоцитами и имеется в лимфатических узлах, селезенке, вилочковой железе, аденоидах, миндалинах, костном мозге и желудочно-кишечном тракте.
Среди лимфоцитов выделяют В-клетки и Т-клетки, из которых могут развиваться НХЛ.
При этом В-клеточные лимфомы встречаются чаще (85%) по сравнению с Т-клеточными (15%).
Классификация неходжкинских лимфом
Наиболее часто используется Европейско-американская классификация, разработанная в рамках Всемирной организации здравоохранении (ВОЗ).
По этой классификации НХЛ подразделяются в зависимости от их клеточной принадлежности.
Диффузная В-крупноклеточная лимфома составляет 31% от общего числа лимфом. Эта лимфома возникает наиболее часто после 60 лет и отличается быстрым ростом. При этом 40-50% больных удается полностью излечить.
Фолликулярная лимфома, на которую приходится 22% от общего числа НХЛ. Этот вид лимфомы диагностируется обычно в возрасте около 60 лет и характеризуется медленным ростом. Длительная (5-летняя) выживаемость больных колеблется в пределах 60-70%. Со временем фолликулярная лимфома может превратиться в быстрорастущую диффузную лимфому.
Хронический лимфоцитарный лейкоз/мелкоклеточная лимфоцитарная лимфома. На эти родственные заболевания приходится 7% от общего количества лимфом. Они отличаются медленным ростом, но плохо поддаются лечению. Тем не менее больные с этими заболеваниями могут жить в течение 10 лет. Иногда возможно превращение их в быстрорастущие лимфомы.
Лимфома из клеток мантийной зоны (6%) чаще поражает мужчин в возрасте около 63 лет. Этот тип лимфомы хотя и растет не очень быстро, однако лишь 20% больных живет в течение 5 лет.
Экстранодальные В-клеточные лимфомы маргинальной зоны – MALT-лимфомы (8%). Средний возраст больных – около 60 лет. Часто выявляется в желудке, отличается медленным местным ростом. Хорошо излечивается на ранних стадиях.
Нодальная В-клеточная лимфома маргинальной зоны (2%). Характеризуется медленным ростом. Многие больные с ранними стадиями заболевания могут быть полностью излечены.
Селезеночная В-клеточная лимфома маргинальной зоны встречается у пожилых больных, чаще мужского пола. Нередко лечение не назначается до появления выраженных симптомов в результате увеличения селезенки.
Первичная медиастинальная В-клеточная лимфома (2%) возникает в средостении преимущественно у женщин в возрасте 30-40 лет и характеризуется быстрым ростом. 50% больных могут быть излечены.
Лимфома Беркитта и беркиттоподобная лимфома(2%) возникает в 90% случаев у мужчин в возрасте около 30 лет. Отличается быстрым ростом. При интенсивной химиотерапии 50% больных могут быть полностью излечены.
Лимфоплазмоцитарная лимфома (макроглобулинемия Вальденстрема) составляет 1% от общего числа НХЛ. Заболевание отличается медленным течением, но полностью его излечить нельзя. Тем не менее большинство больных живут более 5 лет.
Волосатоклеточный лейкоз относится к очень редким заболеваниям и выявляется у пожилых людей.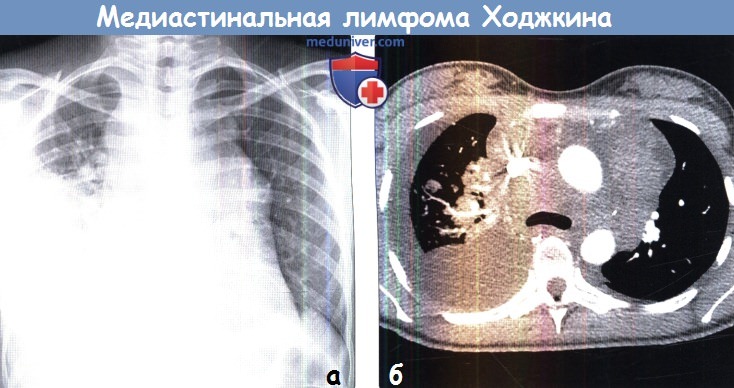 Характеризуется медленным ростом. Некоторые больные не нуждаются в лечении.
Характеризуется медленным ростом. Некоторые больные не нуждаются в лечении.
Первичная лимфома центральной нервной системы (ЦНС) может поражать как головной, так и спинной мозг. Ранее эта опухоль считалась очень редкой, однако в настоящее время она выявляется чаще у больных СПИДом. 30% больных живут 5 и более лет.
Т-лимфобластная лимфома/лейкоз из клеток-предшественников (2%). Это заболевание можно рассматривать как лимфому или лейкоз. Различие зависит от количества опухолевых клеток в костном мозге. В случае выявления менее 25% опухолевых клеток ставится диагноз лимфомы, а более 25% – лейкоза.
75% больных составляют мужчины, а остальные 25% – женщины. Средний возраст пациентов – 25 лет. Если костный мозг не поражен, то вероятность излечения высокая, а при его вовлечении в процесс вероятность излечения не превышает 20%.
Периферические Т-клеточные лимфомы (7%) подразделяются на несколько видов:
Кожная Т-клеточная лимфома (грибовидный микоз, синдром Сезари) составляет менее 1% среди всех лимфом и выявляется в возрасте 50-60 лет. Выживаемость больных в течение 5 лет колеблется от 5 до 58% в зависимости от скорости роста опухоли.
Ангиоиммунобластная Т-клеточная лимфома характеризуется быстрым ростом и неблагоприятным прогнозом.
Экстранодальная Т-клеточная лимфома из естественных киллеров, назальный тип встречается во всех возрастных группах. Исход заболевания зависит от степени распространения опухолевого процесса.
Т-клеточная лимфома с энтеропатией возникает у людей, чувствительных к клейковине – белку пшеничной муки. Прогноз (исход) заболевания неблагоприятный.
Т-клеточная панникулитоподобная лимфома подкожной клетчатки вначале растет медленно, но со временем может стать быстрорастущей опухолью. Химиотерапия дает лишь частичный эффект.
Анапластическая крупноклеточная лимфома, Т/0-клеточная (2%) чаще возникает у молодых людей. Химиотерапия позволяет излечить многих больных.
Химиотерапия позволяет излечить многих больных.
Частота возникновения неходжкинских лимфом (нхл)
Более 90% НХЛ диагностируется у взрослых больных. Чаще всего НХЛ возникают в возрасте 60-70 лет. Риск возникновения этой опухоли увеличивается с возрастом.
Персональный риск возникновения НХЛ в течение всей жизни составляет приблизительно 1 к 50.
С начала 70-х годов отмечено почти двукратное увеличение частоты НХЛ. Это явление трудно объяснить. В основном это связывают с инфекцией, вызванной вирусом иммунодефицита человека. Частично такое увеличение можно связать с улучшением диагностики.
С конца 90-х годов наблюдается стабилизация частоты возникновения НХЛ.
НХЛ чаще выявляются у мужчин по сравнению с женщинами.
В 2002 году в России было выявлено 5532 случая НХЛ у взрослых больных.
В США в 2004 году по предварительным данным ожидается 53370 случаев НХЛ у взрослых и детей.
Факторы риска возникновения неходжкинских лимфом
Факторы риска могут быть генетическими (наследственными), связанными с образом жизни и окружающей средой.
Возраст является самым важным фактором риска возникновения НХЛ. Большинство случаев НХЛ диагностируется у людей старше 60 лет.
Врожденные нарушения иммунной системы предрасполагают не только к инфекциям, но и повышают риск развития НХЛ у детей и молодых взрослых.
Ожирение может повысить риск НХЛ.
Радиация увеличивает вероятность возникновения лейкоза, рака щитовидной железы и НХЛ. У больных, получавших лучевую терапию по поводу злокачественной опухоли, позднее повышается риск развития НХЛ. Этот риск еще более повышается при применении комбинации химиотерапии и облучения.
Бензол, гербициды и инсектициды ассоциируются с повышенным риском возникновения НХЛ.
Приобретенный иммунодефицит, вызванный применением различных препаратов у больных по поводу пересадки органов, повышает риск развития НХЛ.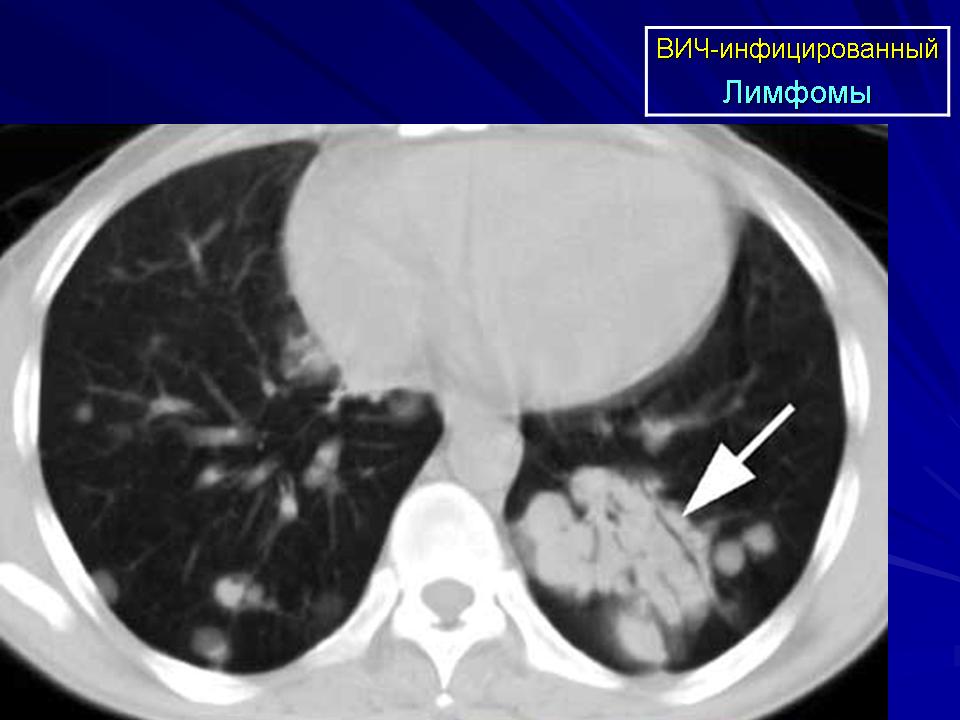
Инфекции, вызванные вирусом иммунодефицита человека, сопровождаются увеличением риска возникновения некоторых типов НХЛ.
Вирус Эпштейна-Барр ассоциируется с повышенным риском развития лимфомы Беркитта и других лимфом, особенно у больных СПИДом.
Бактерия Helicobacter pylori, вызывающая язву желудка, может также привести к лимфоме той же локализации.
Устранение (по возможности) известных факторов риска может в известной степени содействовать профилактике этого заболевания.
Диагностика неходжкинских лимфом
Внимательное отношение к появившимся необычным признакам и симптомам может помочь в ранней диагностике НХЛ.
НХЛ могут сопровождаться различными симптомами в зависимости от месторасположения опухоли.
Увеличенные лимфатические узлы на шее, в подмышечной, надключичной или паховой областях могут быть легко обнаружены как врачом, так и самим больным.
При возникновении опухоли в вилочковой железе или лимфатических узлах грудной полости возможно сдавление трахеи, что приводит к кашлю, одышке и отеку верхней половины тела и лица.
Поражение лимфатических узлов живота вызывает увеличение его размеров как за счет опухолевых узлов, так и скопления жидкости. Сдавление кишки может вызывать явления частичной или полной кишечной непроходимости, что приводит к тошноте, рвоте и боли в животе.
Лимфома желудка сопровождается болью в верхних отделах живота, тошнотой, рвотой и снижением аппетита.
При НХЛ головного мозга больные отмечают головную боль, тошноту, рвоту, судороги и пр.
В случае лимфомы кожи появляется зуд, подкожное уплотнение красновато-багрового цвета.
Кроме местных симптомов могут отмечаться и общие симптомы в виде необъяснимого похудения, повышения температуры, сильных потов, особенно по ночам, и выраженного зуда кожи. Указанные симптомы указывают на наличие распространенного опухолевого процесса и ухудшают прогноз (исход) заболевания.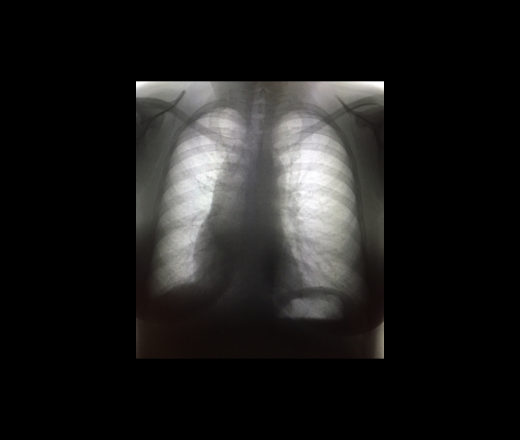
Следует иметь в виду, что увеличение лимфатических узлов может быть связано также с инфекцией. В связи с этим нередко назначаются антибиотики. Если в течение нескольких недель не отмечается уменьшения размеров лимфатических узлов, следует провести детальное обследование: Биопсия (взятие кусочка опухоли для исследования) является окончательным методом диагностики лимфомы. При этом биопсию могут выполнять как иглой, так и с помощью небольшой операции.
Пункция и биопсия костного мозга необходимы для выяснения наличия в нем опухолевых клеток.
Спинномозговая пункция дает возможность обнаружить опухолевые клетки в спинномозговой жидкости.
Кроме того, проводятся иммуногистохимические, цитометрические, цитогенетические и молекулярно-генетические исследования клеточного субстрата с целью уточнения типа лимфомы, что важно для определения прогноза заболевания и выбора тактики лечения.
Рентгенография грудной клетки дает возможность выявить увеличенные лимфатические узлы и вилочковую железу, а также жидкость в плевральных полостях.
Компьютерная томография (КТ) особенно целесообразна при лимфомах области головы, шеи, грудной полости, живота и области таза, так как позволяет детально изучить опухоль и окружающие органы и ткани.
Магнитно-резонансная томография (МРТ) особенно целесообразна при исследовании головного и спинного мозга.
Сканирование с галлием-67 позволяет обнаружить поражение лимфатических узлов, внутренних органов и костей.
Сканирование костной системы с помощью технеция-99 выявляет костные поражения, вызванные лимфомой.
Ультразвуковое исследование (УЗИ) дает возможность детально изучить лимфатические узлы, печень, селезенку и почки.
Определение стадии (степени распространения) неходжкинских лимфом
После детального обследования, включающего все вышеперечисленные методы, уточняется стадия лимфомы (сI – по IV) в зависимости от степени распространения опухолевого процесса.
При наличии у больного общих симптомов к стадии добавляется символ Б (или латинская буква В), а при их отсутствии – символ А.
Для прогнозирования скорости роста опухоли и эффективности лечения разработан международный прогностический индекс (МПИ), который учитывает 5 факторов, включая возраст больного, стадию заболевания, поражение не только лимфатических узлов, но и других органов, общее состояние больного, уровень лактатдегидрогеназы (ЛДГ) в сыворотке крови.
К благоприятным прогностическим факторам относятся: возраст менее 60 лет, стадии I-II, отсутствие поражения органов, хорошее общее состояние, нормальные уровни ЛДГ.
К неблагоприятным прогностическим факторам относятся: возраст пациента выше 60 лет, стадии III и IV, поражение лимфатических узлов и органов, неудовлетворительное общее состояние и повышение уровней ЛДГ.
Лечение неходжкинских лимфом
Оперативный метод имеет ограниченное применение у больных НХЛ. Обычно операция заключается в удалении части опухоли для исследования с целью уточнения диагноза.
Лишь в случае изолированного поражения какого-либо органа, например, желудка возможно хирургическое вмешательство. Однако и в этом случае предпочтение нередко отдается лучевому методу.
У больных НХЛ обычно используется наружное облучение источниками высоких энергий. У больных с I и II стадиями НХЛ облучение может быть основным методом лечения, однако чаще всего применяется комбинация химиотерапии и облучения.
Лучевую терапию можно использовать в качестве паллиативного (временно облегчающего) метода при поражении головного и спинного мозга, а также для уменьшения боли в случае сдавления нервных окончаний.
Лучевая терапия может вызывать незначительные изменения со стороны кожи и повышенную утомляемость.
Другие побочные эффекты связаны с местом облучения.
Так, лучевая терапия на область живота может приводить к энтеропатии и поносу.
Облучение грудной клетки может вызвать повреждение легочной ткани и затруднение дыхания.
Облучение легких, особенно у курильщиков, иногда приводит к развитию рака той же локализации.
Серьезные побочные эффекты облучения головного мозга проявляются через 1-2 года и включают головную боль и нарушение памяти.
Необходимо иметь в виду, что побочные эффекты химиотерапии могут усугубляться при применении облучения.
Под химиотерапией подразумевается применение противоопухолевых препаратов для уничтожения опухолевых клеток. При этом используются многие препараты и их комбинации (сочетания).
Лечение проводится в виде курсов с интервалами 2-4 недели. Химиотерапия может проводиться как в отделении, так и в поликлинических (амбулаторных) условиях в зависимости от сложности лечения, его побочных действий, состояния больного и других факторов.
Больной может получать одну или несколько схем лечения в зависимости от эффективности терапии.
Противоопухолевая терапия уничтожает опухолевые клетки, но одновременно повреждает и нормальные быстро делящиеся клетки, к которым относится костный мозг, слизистая оболочка полости рта и желудочно-кишечного тракта, волосяные фолликулы. Выраженность побочных эффектов зависит от типа, общей и суммарной дозы препарата, а также длительности химиотерапии.
В результате лечения у больного могут возникнуть: облысение, появление язв во рту, повышенная восприимчивость к инфекциям за счет снижения количества лейкоцитов, кровоточивость в результате снижения числа тромбоцитов, утомляемость при снижении уровня эритроцитов, потеря аппетита.
Указанные побочные явления являются временными и проходят после прекращения лечения.
В настоящее время имеется возможность профилактики и лечения осложнений химиотерапии назначением противорвотных препаратов, антибиотиков, факторов роста, стимулирующих выработку лейкоцитов, противовирусных и противогрибковых препаратов и т.д.
Для профилактики инфекционных осложнений необходимо:
- избегать контактов с инфекцией
- носить хирургические маски больными, посетителями и персоналом
- использовать хирургические стерильные перчатки
- тщательно мыть руки
- не употреблять сырые овощи и фрукты, а также продукты, которые могут содержать микробы
- не контактировать с детьми, которые чаще взрослых являются носителями инфекций
Синдром лизиса (распада) опухоли возникает в результате быстрого эффекта химиотерапии у больных с крупными лимфомами. Содержимое распавшихся опухолевых клеток попадает в кровоток и нарушает функцию почек, сердца и центральной нервной системы (ЦНС). Предотвратить такое состояние можно за счет назначения большого объема жидкости и таких препаратов как сода, аллопуринол.
Содержимое распавшихся опухолевых клеток попадает в кровоток и нарушает функцию почек, сердца и центральной нервной системы (ЦНС). Предотвратить такое состояние можно за счет назначения большого объема жидкости и таких препаратов как сода, аллопуринол.
Химиотерапевтические противоопухолевые препараты способны напрямую повреждать почки, печень, яички, яичники, головной мозг, сердце и легкие. Однако применение современных средств профилактики и лечения позволяет избежать большинство таких осложнений.
Наиболее серьезным осложнением химиотерапии является возникновения второго злокачественного заболевания, в частности лейкоза. К счастью, такое осложнение у больных лимфомами встречается редко.
Для иммунотерапии используются вещества, которые в норме вырабатываются иммунной системой. Эти вещества способны уничтожить лимфомные клетки, замедлить их рост или активизировать иммунную систему больного для эффективной борьбы с лимфомой.
Интерферон является гормоноподобным веществом, который вырабатывается лейкоцитами для борьбы с инфекцией. В настоящее время имеются различные виды интерферона. Применение интерферона может вызвать приостановку роста или сокращение лимфомы. Препарат обычно используют в комбинации с химиотерапией.
Из побочных эффектов лечения интерфероном следует отметить повышенную утомляемость, повышение температуры, озноб, головную боль, боль в мышцах и суставах, изменение настроения.
Моноклональные антитела. Антитела вырабатываются иммунной системой для борьбы с инфекциями. Моноклональные антитела производятся в лабораторных условиях и применяются для борьбы с клетками лимфомы.
При неэффективности стандартной терапии у больных лимфомами в ряде случаев применяют трансплантацию костного мозга или периферических стволовых клеток. Это позволяет использовать высокие дозы химиопрепаратов для уничтожения резистентных опухолевых клеток.
Различают трансплантацию аутологичных (от самого больного) и аллогенных (от донора) клеток костного мозга или периферической крови. Поражение костного мозга или периферической крови лимфомными клетками исключает возможность использования аутологичной трансплантации.
Поражение костного мозга или периферической крови лимфомными клетками исключает возможность использования аутологичной трансплантации.
Костный мозг или периферические стволовые клетки получают от больного или донора до начала интенсивной химиотерапии или облучения, а затем вновь возвращают больному после проведенного лечения для восстановления показателей крови. Через 2-3 недели начинают повышаться показатели лейкоцитов, а затем – тромбоцитов и эритроцитов.
Побочные эффекты и осложнения трансплантации костного мозга и периферических стволовых клеток подразделяются на ранние и поздние. Ранние побочные эффекты принципиально не отличаются от таковых при назначении химиотерапии высокими дозами.
Из отдаленных осложнений следует отметить:
- Лучевое повреждение легких, вызывающее одышку
- Болезнь отторжения при аллогенной трансплантации
- Повреждение яичников у женщин, приводящее к бесплодию
- Бесплодие у мужчин
- Повреждение щитовидной железы
- Развитие катаракты
- Поражение костей, вызывающее асептический (не воспалительный) некроз
- Развитие лейкоза
причины появления, симптомы заболевания, диагностика и способы лечения
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Лимфомы: причины появления, симптомы, диагностика и способы лечения.Определение
Лимфомы представляют собой группу злокачественных опухолевых заболеваний лимфатической ткани, которая в нормальных условиях отвечает за иммунитет. Одним из первых клинических симптомов лимфом является увеличение лимфатических узлов разных локализаций.
Лимфомы, как и другие злокачественные опухоли, обладают склонностью к метастазированию, то есть миграции опухолевых клеток через кровь и лимфу, а также контактным путем в интактные (здоровые) ткани с последующим размножением в них.
Заболеваемость лимфомой Ходжкина в России составляет около 2 случаев на 100 тыс. населения в год, а неходжкинскими лимфомами – 5–7 случаев на 100 тыс.
Причины появления лимфом
Существует несколько возможных причин развития лимфом. Важно понимать, что в основе развития любого злокачественного заболевания, в том числе и лимфом, лежит нарушение функций клеток.
Способность к неконтролируемому росту опухоли возникает при нарушении естественного процесса деления клетки: в норме клетка делится ограниченное количество раз, созревает, выполняет определенную функцию, после чего заканчивает свою жизнь.
Для злокачественных клеток характерно нарушение процессов созревания и дифференцировки (процесса, в ходе которого клетка приобретает специфические особенности и способность выполнять определенные функции). У клеток появляются новые функции – они начинают продуцировать белки и токсины, возникает способность «ускользать от иммунного надзора», в результате чего меняется процесс естественной гибели клетки (апоптоза).Некоторые вирусы могут напрямую влиять на ДНК лимфоцитов и способствовать их превращению в злокачественные клетки.
Например, заражение вирусом Эпштейна–Барр (ВЭБ, EBV) является важным фактором риска развития лимфом.
Лимфоциты делятся на два подвида: Т- и В-клетки (Т- и В-лимфоциты). Заражение Т-клеточным лимфотропным вирусом человека (HTLV-1) повышает риск возникновения у пациента определенных типов Т-клеточной лимфомы. Вирус передается половым путем и через кровь, а также от матери к ребенку через грудное молоко.
Вирусы, ослабляющие иммунологический надзор, косвенно являются причиной развития некоторых типов лимфом.
Некоторые инфекции могут стать причиной развития лимфомы из-за постоянной активации иммунной системы. При хронических инфекциях вырабатывается огромное количество лимфоцитов, что повышает вероятность возникновения мутаций во время деления клеток и ведет к риску формирования лимфомы. К подобным инфекциям относят Helicobacter pylori (часто встречается при хроническом гастрите и язвенной болезни желудка и двенадцатиперстной кишки), Chlamydophila psittaci (риск развития лимфомы в тканях глаза), вирусы гепатита В и С при длительном инфицировании.
К неинфекционным факторам риска развития лимфом относят:
- Воздействие химических веществ. Многочисленные исследования доказали, что влияние гербицидов, инсектицидов, бензола связано с повышенным риском развития лимфом.
- Наличие аутоиммунных заболеваний (ревматоидного артрита, системной красной волчанки и т.д.) является значимым фактором риска развития лимфом.
- Радиационное облучение оказывает большое влияние на скорость возникновения мутаций клеток и их озлокачествление.
- Генетические факторы. Наличие близкого родственника, страдающего лимфомой, значительно увеличивает риск.
- Врожденная недостаточность иммунитета при некоторых заболеваниях.
- Возраст. Некоторые типы лимфом развиваются у детей и подростков, а другие, напротив, у лиц старше 60 лет.
- Грудные импланты в редких случаях способствуют развитию одного из типов крупноклеточной лимфомы молочных желез.
Существует два основных вида лимфом: ходжкинская лимфома, или лимфогранулематоз, и неходжкинские лимфомы.
Для лимфомы Ходжкина характерно наличие специфических клеток Рид–Березовского–Штернберга в пораженных лимфатических узлах, селезенке, печени или костном мозге.
Увеличенные шейные лимфоузлы у пациента с лимфомой Ходжкина
К группе неходжкинских лимфом относятся:
- фолликулярная лимфома;
- лимфома маргинальной зоны;
- диффузная крупноклеточная В-клеточная лимфома;
- лимфома из клеток мантии;
- лимфома Беркитта;
- первичная лимфома центральной нервной системы;
- нодальные Т-клеточные лимфомы;
- первичные кожные лимфомы;
- неходжкинские лимфомы у больных, инфицированных ВИЧ;
- неходжкинские лимфомы у больных, инфицированных вирусами гепатита В и С.
Самый ранний симптом – увеличение лимфатических узлов на фоне полного благополучия. Увеличенные лимфоузлы безболезненны.
Различные клинические проявления зависят от локализации опухоли: если происходит рост опухоли в лимфатических узлах грудной клетки, возможно сдавливание дыхательных путей и появление охриплости голоса, нарушение глотания, затруднение дыхания, навязчивый кашель.
При расположении лимфомы в средостении появляется синдром сдавления верхней полой вены: возникают головные боли, отек и расширение вен лица и шеи.
В некоторых случаях присутствуют только общие симптомы: потеря аппетита, снижение массы тела, повышение температуры тела, ночная потливость, слабость, иногда – кожный зуд и боль в увеличенных лимфоузлах.
На фоне снижения иммунитета могут присоединяться инфекционные заболевания – часто активируется вирус ветряной оспы, проявляющийся опоясывающим герпесом.Описаны случаи поражения органов брюшной полости (проявляется увеличением объема живота за счет роста опухоли и скопления жидкости, появлением болей, желтухи, тошноты и рвоты) и костного мозга (боли в костях, спине, частые переломы, бледность, повышенная кровоточивость).
Диагностика лимфом
Диагноз того или иного вида лимфомы устанавливают исключительно на основании морфологического исследования биопсийного материала (кусочка или целого лимфоузла, полученного в ходе небольшой операции), взятого из опухоли (гистологические, цитогенетические и молекулярно-генетические методы исследования). Дополнительные исследования врач назначит для диагностики стадии заболевания и его осложнений. Список исследований зависит от предположительной локализации опухоли и может быть изменен.
Дополнительные исследования врач назначит для диагностики стадии заболевания и его осложнений. Список исследований зависит от предположительной локализации опухоли и может быть изменен.
- Клинический анализ крови.
Способы лечения рака средостения | Полезные статьи
Средостение — область грудной полости между легкими, грудиной, позвоночником и ребрами. Органы и структуры этого анатомического отдела — трахея, пищевод, вилочковая и щитовидная железы, сердце, аорта. Опухоли средостения — новообразования различного гистологического происхождения, объединенные в одну группу, благодаря расположению в одной анатомической области.
Развитие опухолей среди жизненно важных органов в ограниченном пространстве приводит к сдавлению, смещению элементов средостения, создавая риск для жизни больного.
Опухоли могут исходить из самих органов, тканей между ними и эктопированными тканями. Кисты являются следствием патологических процессов и пороков развития с формированием полостей. Патоморфологические формы характеризуются чрезвычайным многообразием. Наиболее распространенные — лимфомы, тимомы, ангиосаркомы, нейробластомы.
Особенностями опухолей средостенияявляются морфологические и анатомо-физиологические характеристики средостения, трудности морфологической верификации, неопределенность лечебной тактики при ряде заболеваний.
В структуре онкологических заболеваний опухоли средостения составляют 3–7 %, из них 80 % доброкачественные, 20 % — злокачественные. Озлокачествление отмечается в 17–41 % случаев.
Причины заболеваний опухолями средостения многообразны: ионизирующее излучение, контакт с канцерогенами, вирусы ВИЧ и Эпштейна — Барр, ряд других этиологических факторов.
Клинические симптомы заболевания:
- общая и мышечная слабость, потеря веса до 15 кг;
- нарушение сердечного ритма;
- одышка, головные боли;
- повышение температуры тела до 37 °С;
- кашель, кровохарканье;
- боль в грудной клетке и суставах;
- отечность, расширенные вены лица и шеи, синюшность губ.

Осложнения патологии связны с последствиями компрессионного синдрома — сдавления опухолью соседних жизненно важных органов и нарушения их функций.
Диагностика и хирургическая тактика
В клинической картине опухолей средостениявыделяют два периода: скрытый бессимптомный — когда заболевание выявляется при случайном рентгене грудной клетки или компьютерной томографии и с выраженными клиническими явлениями — боль, затруднение дыхания, кашель, субфебрилитет, признаки компрессии органов (верхней полой вены, пищевода, трахеи, нервов и спинного мозга, сердца).
При тимомах часто возникает миастения, при лимфомах — анемия.
Диагноз ставят по результатам компьютерной томографии, лабораторных анализов. Информативны также МРТ, УЗИ и ПЭТ-КТ. Для диагностики используется эндоскопия (видеобронхоскопия, медиастиноскопия) и биопсия (забор образцов тканей) с последующим гистологическим исследованием.
Тактика лечения зависит от типа опухоли, ее локализации и распространенности. Наиболее эффективный метод лечения большинства видов опухолей средостения — радикальное хирургическое иссечение в пределах здоровых тканей с окружающей клетчаткой и лимфоузлами. Исключение — лимфомы, при них тактику лечения подбирают индивидуально, приоритет отдают химиолучевым методам.
Радикальное удаление опухолей по возможности проводят минимально инвазивным способом (видеоторакоскопия). Хирургическое лечение опухолей средостения также бывает паллиативным с целью декомпрессии внутренних органов. Сочетание хирургического лечения с лучевой и химиотерапией улучшает прогноз.
Консервативное лечение опухолей средостения, реабилитация и прогноз
Если опухоль средостения нерезектабельна, показаны лекарственная, лучевая и химиотерапия. С их помощью замедляют рост метастазов, уменьшают выраженность симптомов, улучшают общее состояние больного.
Дополнительно применяют:
- гормонотерапию — для лечения гормонозависимых опухолей;
- иммунотерапию — используются специфические антитела;
- таргетную терапию — блокирует механизмы развития опухоли.

Индивидуальную лечебную схему подбирает лечащий врач с учетом размеров опухоли и степени поражения органов средостения. В периоде реабилитации показан сбалансированный рацион, отказ от вредных привычек, посильная двигательная и социальная активность, психотерапия, диспансерное наблюдение врача-онколога.
Пятилетняя выживаемость при злокачественных опухолях средостения не превышает 50 %. При появлении метастазов прогноз резко ухудшается, но даже в самых запущенных случаях можно улучшить состояние больного и добиться клинической ремиссии. При выявлении опухоли на бессимптомном этапе вероятность полного выздоровления — до 100 %, поэтому так важны регулярные профилактические осмотры. Чем раньше начато лечение, тем лучше прогноз для пациента.
назад…
Лимфома Ходжкина | Клиника “Оберіг”
Лимфома Ходжкина относится к злокачественным опухолям лимфатической системы. Патологические лимфоидные элементы образуют опухоль, которая в большинстве случаев локализуется в лимфатическом узле. Также они могут накапливаться в других частях тела – селезенке, печени, костном мозге. Если опухоль возникла вне лимфатических узлов, лимфома называется экстранодальной.
Впервые лимфома была описана доктором Томасом Ходжкином в 19 столетии. Впоследствии ученые выяснили, что лимфомы – это группа разнородных заболеваний. В наше время они разделяются на лимфому Ходжкина, котрая составляет 30% от всех лимфом, и неходжкинские лимфомы. В случае лимфомы Ходжкина при микроскопическом исследовании поражённых лимфатических узлов обнаруживают гигантские клетки Рид-Березовского-Штернберга, а также их одноядерные предшественники, клетки Ходжкина.
Лимфома Ходжкина имеет два возрастных пика заболеваемости: 15-34 года и старше 60 лет. Следует отметить, что в большинстве случаев болезнь встречается в молодом возрасте, что имеет существенную социальную проблему, так как поражает трудоспособное население детородного возраста.
Причины заболевания остаются неизвестными. Определенную роль в развитии лимфомы отводят вирусу Эпштейна-Барр.
Определенную роль в развитии лимфомы отводят вирусу Эпштейна-Барр.
СИМПТОМЫ ЛИМФОМЫ ХОДЖКИНА
Наиболее частый симптом заболевания – это увеличение лимфатических узлов в области шеи, подмышек, паха. Часто при лимфоме Ходжкина наблюдается разрастание лимфоидной ткани в средостении, что клинически может сопровождаться появлением длительного кашля, затруднением дыхания. При возникновении опухолевого процесса в брюшной полости пациентов могут беспокоить боли в животе, нарушения опорожнения кишечника.
У многих пациентов не отмечается специфических признаков заболевания. Однако, нередко могут встречаться следующие симптомы:
- Потеря массы тела без очевидной причины более чем на 10 % за 6 месяцев;
- Профузный пот, особенно ночью;
- Устойчивая лихорадка или симптомы, напоминающие грипп;
- Сильная слабость;
- Зуд тела.
ДИАГНОСТИКА ЛИМФОМЫ ХОДЖКИНА
Диагностикой и лечением лимфомы Ходжкина занимается врач-гематолог. Для постановки диагноза необходима эксцизионная биопсия лимфатического узла – хирургическое удаление узла. Образцы отправляют в лабораторию, где врач-патогистолог определяет тип лимфомы. Также он проводит иммуногистохимические исследования, которые выявляют на поверхности раковых клеток экспрессию специфических антигенов, свойственных тому или иному виду лимфом.
Анализы крови проводят перед началом и во время лечения, важным прогностическим показателем на момент установления диагноза является СОЭ. Лечащий врач может назначить, кроме анализов крови и биопсии, другие диагностические процедуры, например проведение трепанобиопсии костного мозга подвздошной кости. Обязательным являются скрининг вирусных гепатитов В, С, ВИЧ-инфекции, оценка функции деятельности сердца и легких. План обследования для каждого пациента подбирается индивидуально, поэтому не стоит беспокоиться, если он не включает дополнительные методы.
Для определения пораженных тканей в организме применяются такие методы, как компьютерная томография (КТ). На этапе диагностики лимфомы Ходжкина и в последующем для мониторинга ответа на терапию необходимо проведение позитронно-эмиссионной томографии (ПЭТ-КТ). Перед обследованием пациенту внутривенно вводится радиоактивная форма глюкозы. Раковые клетки активно усваивают глюкозу, и с помощью ПЭТ-КТ можно обнаружить местоположение опухоли.
На этапе диагностики лимфомы Ходжкина и в последующем для мониторинга ответа на терапию необходимо проведение позитронно-эмиссионной томографии (ПЭТ-КТ). Перед обследованием пациенту внутривенно вводится радиоактивная форма глюкозы. Раковые клетки активно усваивают глюкозу, и с помощью ПЭТ-КТ можно обнаружить местоположение опухоли.
Стадия лимфомы определяется в зависимости от того, какие лимфатические узлы и другие органы поражены заболеванием. При I стадии лимфома обнаруживается в одной группе лимфатических узлов выше или ниже диафрагмы. В случае II стадии в патологический процесс вовлечены 2 и больше групп лимфатических узлов выше или ниже диафрагмы. При III стадии поражены лимфатические узлы выше и ниже диафрагмы. IV стадия характеризуется наличием опухолей в органах за пределами лимфатической системы или в костном мозге.
Стадии лимфомыВ отличие от многих других онкологических заболеваний, все стадии лимфомы, включая IV, излечимы. Точное стадирование имеет большое значение для правильного назначения плана лечения. Для оценки прогноза заболевания обязательным является определение групп риска.
ЛЕЧЕНИЕ ЛИМФОМЫ ХОДЖКИНА
Лечение назначается согласно группы риска, возраста и общего состояния здоровья. Назначается несколько циклов химиотерапии. Химиопрепараты могут вводиться в клинике в условиях дневного стационара. В целом химиотерапия занимает несколько месяцев. После ее окончания пациентам с низкой и промежуточной группами риска проводится радиотерапия – прицельное облучение пораженных лимфатических зон. Решение о назначении радиотерапии у пациентов с продвинутой стадией заболевания принимается на основании результатов ПЭТ-КТ по окончанию химиотерапии.
При редкой форме заболевания, которая называется «нодулярная лимфома Ходжкина с лимфоидным преобладанием», может применяться лучевая терапия в монорежиме при стадии IA без факторов риска, в остальных случаях терапия идентична лечению классической лимфомы Ходжкина. Иногда к лечению добавляют ритуксимаб – противоопухолевое анти-СD20 моноклональное антитело.
Цель лечения лимфомы – достижение стойкой ремиссии. К сожалению, болезнь может возвращаться, но рецидивы также поддаются терапии. После наступления ремиссии пациент находится под наблюдением врача. Вначале осмотры проходят часто – раз в 3 месяца, постепенно интервалы между ними увеличиваются до одного раза в год.
В наше время лимфома хорошо поддается лечению. Если вы или ваш близкий человек столкнулись с этим диагнозом, обращайтесь в Универсальную клинику «Оберіг». Мы обладаем всеми необходимыми ресурсами для победы над заболеванием. Запишитесь на консультацию врача-гематолога по телефону:
(044) 521 30 03
Рекомендации Международной группы радиационной онкологии лимфомы
Кровь. 2018 окт 18; 132 (16): 1635–1646.
, 1 , 2 , 3 , 4 , 5, 6 , 2 , 7 , 8 , 9 , 10 9000Бутхайна Шбиб Дабая
1 Отделение радиационной онкологии, Онкологический центр доктора медицины Андерсона Техасского университета, Хьюстон, Техас;
Брэдфорд С.Хоппе
2 Отделение радиационной онкологии, Университет Флориды, Джексонвилл, Флорида;
Джон П. Пластарас
3 Отделение радиационной онкологии Пенсильванского университета, Филадельфия, Пенсильвания;
Уэйн Ньюхаузер
4 Департамент радиационной физики, Университет Луизианы, Батон-Руж, Луизиана;
Катерина Розолова
5 Отделение протонной терапии, Центр протонной терапии Чехия, Прага, Чехия;
6 Отделение онкологии, Карлов университет в Праге и университетская больница Мотол, Прага, Чешская Республика;
Стелла Флампури
2 Отделение радиационной онкологии, Университет Флориды, Джексонвилл, Флорида;
Радхе Мохан
7 Отделение радиационной физики, Онкологический центр им. М.Д. Андерсона Техасского университета, Хьюстон, Техас;
М.Д. Андерсона Техасского университета, Хьюстон, Техас;
Н.Джордж Михаил
8 Отделение радиационной онкологии, Госпиталь Гая и Св. Томаса, Лондон, Соединенное Королевство;
Юлия Кирова
9 Отделение радиационной онкологии, Институт Кюри, Париж, Франция;
Лена Шпехт
10 Отделение онкологии, Rigshospitalet, Университетская больница Копенгагена, Копенгаген, Дания; и
Иоахим Яхалом
11 Отделение радиационной онкологии, Мемориальный онкологический центр Слоуна Кеттеринга, Нью-Йорк, Нью-Йорк
1 Отделение радиационной онкологии Техасского университета Онкологический центр Андерсона, Хьюстон, Техас;
2 Отделение радиационной онкологии, Университет Флориды, Джексонвилл, Флорида;
3 Отделение радиационной онкологии Пенсильванского университета, Филадельфия, Пенсильвания;
4 Департамент радиационной физики, Университет Луизианы, Батон-Руж, Луизиана;
5 Отделение протонной терапии, Центр протонной терапии Чехия, Прага, Чехия;
6 Отделение онкологии, Карлов университет в Праге и университетская больница Мотол, Прага, Чешская Республика;
7 Отделение радиационной физики, Онкологический центр им. М. Д. Андерсона Техасского университета, Хьюстон, Техас;
8 Отделение радиационной онкологии, Гая и Св.Thomas ‘Hospital, Лондон, Великобритания;
9 Отделение радиационной онкологии, Институт Кюри, Париж, Франция;
10 Отделение онкологии, Rigshospitalet, Университетская больница Копенгагена, Копенгаген, Дания; и
11 Отделение радиационной онкологии, Мемориальный онкологический центр им. Слоуна Кеттеринга, Нью-Йорк, Нью-Йорк
Автор, отвечающий за переписку.Поступило 08.03.2018 г .; Принято 19 июля 2018 г.
Авторские права © Американское общество гематологов, 2018 г. Эта статья цитируется в других статьях в PMC.
Эта статья цитируется в других статьях в PMC.Abstract
Среди взрослых, переживших лимфому, методы лучевой терапии, которые увеличивают избыточную дозу облучения органов риска (OAR), подвергают пациентов риску увеличения побочных эффектов, особенно поздней токсичности. Сведение к минимуму облучения ОАР у взрослых пациентов с Ходжкинскими и неходжкинскими лимфомами с поражением средостения является решающим фактором при выборе метода лечения. Протонная терапия может помочь снизить дозу облучения OAR и снизить токсичность, особенно риск сердечных заболеваний и вторичного рака.Поскольку протонная терапия может иметь некоторые недостатки, важно выявить пациентов и обстоятельства, при которых протонная терапия может принести наибольшую пользу. Мы представляем современные рекомендации по выявлению взрослых пациентов с лимфомой, которые могут получить наибольшую пользу от протонной терапии, а также анализ преимуществ и недостатков протонной терапии.
Введение
Снижение связанных с лечением токсических эффектов у выживших после Ходжкина и неходжкинских лимфом стало краеугольным камнем последних достижений в лечении гематологических злокачественных новообразований.Долгосрочные последующие исследования пациентов с гематологическими злокачественными новообразованиями предоставили убедительные и надежные доказательства того, что преимущества ионизирующего излучения могут быть смягчены увеличением смертности и заболеваемости, особенно от вторичных злокачественных новообразований и сердечных осложнений. 1 Эти результаты послужили толчком к огромным усилиям по поиску способов минимизировать побочный ущерб от радиации соседним органам грудной клетки, подверженным риску (OAR). Некоторые из этих способов включали трехмерную (3D) конформную лучевую терапию и лучевую терапию с модуляцией интенсивности (IMRT). 2-5 Протонная терапия с ее уникальными характеристиками – более низкой входной дозой, пиком высокой дозы и резким спадом около конца диапазона пучка – представляет еще одну возможность для более конформного распределения дозы и лучшего сохранения OAR.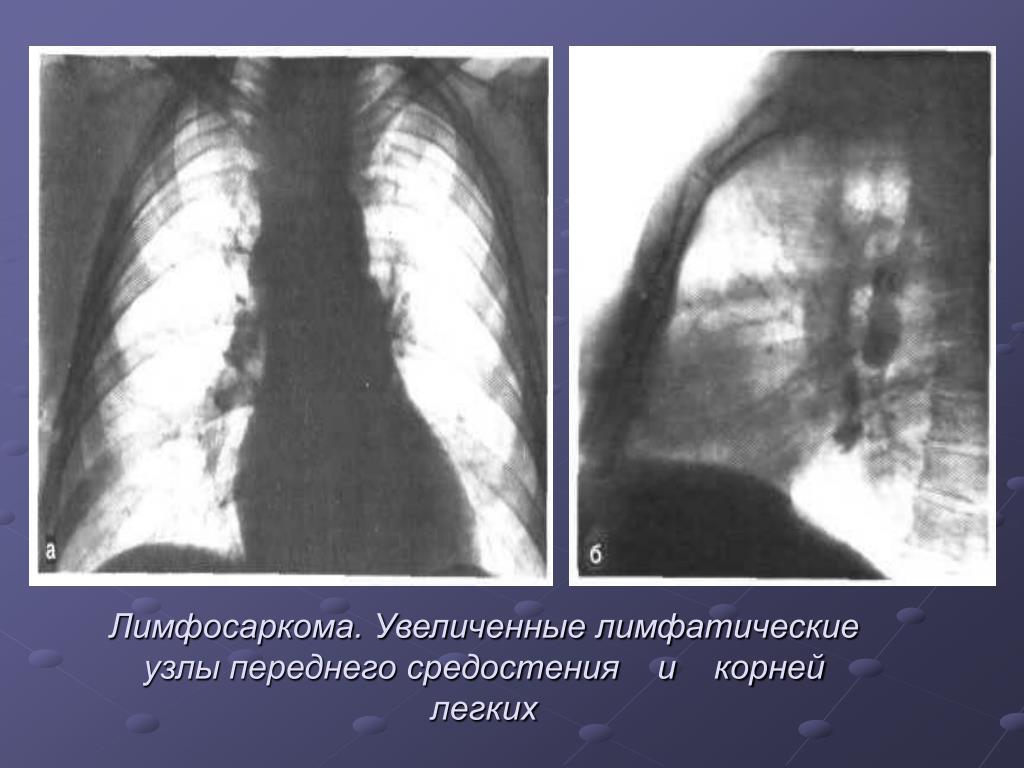 1,6,7
1,6,7
Руководство представляет собой набор согласованных рекомендаций экспертов-радиологов-онкологов и физиков из различных международных академических центров. Рекомендации передовой практики, включая потенциальные преимущества или вред, были основаны на обширном обзоре опубликованной литературы.Каждая включенная рекомендация была достигнута консенсусом более 80% авторов документа; в статье приводится обоснование рекомендаций, а также подробное объяснение рекомендаций, которые стали предметом многочисленных споров среди авторов.
Представленные здесь руководящие принципы включают обзор протонной терапии взрослых лимфом с поражением средостения, подробное обсуждение передовых практик вместе с примерами случаев, в которых протоны дают преимущество, и ссылки на области, в которых требуются дальнейшие исследования.Хотя протонная терапия полезна для лечения других анатомических участков, мы сосредотачиваемся на средостении из-за большого количества доступных данных. перечисляет полезные определения технических терминов, используемых в статье.
Таблица 1.
| Термин | Определение |
|---|---|
| Общий объем опухоли (GTV) | Объем, содержащий видимую протяженность опухоли, которую можно определить по контуру и нацелить с помощью компьютерной томографии |
| Объем клинической опухоли (CTV) | Объем, содержащий подозрение на микроскопическое заболевание; это может быть около крупной опухоли или в исходном месте после достижения полной ремиссии после химиотерапии |
| Планируемый целевой объем | Объем, содержащий GTV и CTV; кроме того, он учитывает все неопределенности, такие как движение внутренних органов и ежедневные ошибки настройки пациента |
| 3D-планирование лучевой терапии | Перспективное планирование, определение анатомии на компьютерной томографии, идентификация цели и создание схемы луча излучения для наилучшего охвата цель; генерировать дозу облучения, которую оператор считает приемлемой |
| IMRT | Оператор заранее вводит в систему планирования желаемую дозу для цели и органов, подверженных риску, и то, как должно выглядеть конечное распределение дозы, затем программное обеспечение инвертирует проблема и пусть компьютер через математическую итерацию ищет лучшее и оптимизированное решение; программное обеспечение будет продолжать попытки до тех пор, пока оператор не сочтет план приемлемым |
| Линейная передача энергии (LET) | Общее количество энергии, выделенной на единицу расстояния в биологических материалах под действием ионизирующего излучения |
| Радиобиологический эквивалент | Относительное радиационное биологическое эффективность в зависимости от ЛПЭ, типа радиационной частицы, общей дозы и фракционирования дозы |
| Активное сканирование протонов | Доставка пучка протонов с помощью стержневого пучка, который точно направляется через терапевтический объем, с использованием магнита в линии пучка; затем доза наносится слой за слоем, обеспечивая хорошую конформацию |
| Пассивное рассеяние протонов | Пространственно равномерное распределение дозы, достигаемое за счет формирования луча с помощью набора устройств на пути луча |
| Протонная терапия с модуляцией интенсивности | Дальнейшая форма активного сканирования дистального отдела опухоли для выявления опухолей неправильной формы |
Консенсусные рекомендации
Пациенты с лимфомой, которым протонная терапия может принести большую пользу, включают (1) пациентов с заболеванием средостения, которое распространяется ниже начала левого главного ствола коронарная артерия – кпереди, кзади или слева от сердца; (2) молодые пациенты женского пола, для которых протонная терапия может снизить дозу груди и риск вторичного рака груди; и (3) пациенты, прошедшие интенсивное предварительное лечение, которые подвергаются более высокому риску радиационной токсичности для костного мозга, сердца и легких.
При использовании протонной терапии лечащие врачи должны (1) продемонстрировать расчетным путем, что она обеспечивает большую пользу пациенту по сравнению с оптимально запланированной фотонной терапией; (2) задокументировать медицинскую необходимость протонной терапии, в том числе рассмотрение вопросов для выживших в течение длительного времени и рисков поздних радиогенных эффектов; (3) понимать сложность планирования протонов лимфомы, включая необходимость управления неопределенностями, и развивающийся характер технологии с развитием сканирования карандашным лучом, объемной визуализации в помещении и оптимизации надежности; и (4) использовать задержку дыхания на глубоком вдохе (DIBH), когда это дополнительно минимизирует дозы для OAR, с пониманием повышенной сложности использования DIBH с протонной терапией по сравнению с фотонной терапией.
Различные методы проведения протонной терапии
Было проведено несколько дозиметрических исследований по сравнению протонных и фотонных планов 8-21 с целью установить пользу и показания для использования протонной терапии при лимфоме, причем подавляющее большинство из них было сосредоточено на поражение средостения. Они показали, что у пациентов со снижением дозы на сердце, легкие и грудь с помощью протонной терапии есть индивидуализированная и потенциальная выгода по сравнению с 3D конформной лучевой терапией или IMRT. 1 Кроме того, отсутствие краевых рецидивов, которых опасаются при использовании высококонформной терапии, такой как протонная терапия, сделало это лечение привлекательным. 22-24
Поскольку величина дозиметрической пользы значительно варьируется в зависимости от конкретного случая, каждый случай необходимо рассматривать индивидуально, а потенциальную пользу от использования протонов следует соотносить с доступностью лечения (необходимо путешествовать), наличные расходы в случае отказа в страховом покрытии, необходимые ресурсы в виде медицинского и физического персонала, а также потенциальные неопределенности, связанные с протонной терапией.
Свойства протонного пучка
Протоны – это заряженные частицы, которые выделяют излучение за счет линейной передачи энергии (ЛПЭ), теряют мало энергии при попадании в ткань и откладывают большую часть при замедлении непосредственно перед остановкой, что приводит к эффекту пика Брэгга. 25 Поскольку положение пика сильно зависит от плотности ткани на пути луча, протонная терапия страдает от неопределенностей диапазона, которые клиницисты должны понимать, чтобы наилучшим образом использовать эту технологию.
Неопределенности протонной терапии и способы их смягчения
Некоторые из проблем, связанных с протонной терапией, – это неопределенности, связанные с диапазоном проникновения пучка в ткани и изменением величины биологических эффектов на пути пучка протонов. Неопределенности в вычислении диапазона проникновения протонов в ткань имеют два основных потенциальных источника: (1) ошибки диапазона, вызванные изменениями плотности ткани из-за ошибок в настройке (позиционировании пациента), движением органов (например, связанных с дыханием или сердцем) или анатомическими изменениями. (например, деформация ткани и сжатие опухоли), которые в совокупности вызывают изменения в пути и дальности луча, которые могут вызвать несоответствия между запланированным и проведенным лечением, и (2) входные данные, используемые для планирования диапазона луча (т. е. преобразование компьютерной томографии [CT] число в линейную тормозную способность протона).Другим важным источником неопределенностей является изменение величины биологического эффекта (описываемого в терминах относительной биологической эффективности [ОБЭ]) протонов вдоль пути луча, который влияет на мишени и нормальные ткани.
Неопределенность диапазона из-за изменений плотности
Один потенциально большой источник неопределенности диапазона связан с анатомическими изменениями пациента. В частности, текущий стандарт лечения использует объемные изображения в качестве основы для создания плана лучевой терапии на несколько дней или даже недель спустя. Во время лечения распределение доставленной дозы будет отклоняться от запланированного распределения из-за изменений положения или размера пациента и опухоли. Эти изменения не так важны для фотонной терапии, но они могут иметь сильное влияние на распределение дозы протонной терапии в осевом и латеральном направлениях пучка. Из них осевые отклонения являются синонимом погрешностей диапазона; если линейная тормозная способность (тесно связанная с массовой плотностью) любого вокселя пациента изменяется (относительно его значения, используемого для планирования лечения), то диапазон всех протонов, проходящих через этот воксель, также изменится. 26
Во время лечения распределение доставленной дозы будет отклоняться от запланированного распределения из-за изменений положения или размера пациента и опухоли. Эти изменения не так важны для фотонной терапии, но они могут иметь сильное влияние на распределение дозы протонной терапии в осевом и латеральном направлениях пучка. Из них осевые отклонения являются синонимом погрешностей диапазона; если линейная тормозная способность (тесно связанная с массовой плотностью) любого вокселя пациента изменяется (относительно его значения, используемого для планирования лечения), то диапазон всех протонов, проходящих через этот воксель, также изменится. 26
Для решения дозиметрических неопределенностей, связанных с анатомическими изменениями, было разработано множество стратегий. 27,28 Надежные инструменты оптимизации теперь позволяют пользователям включать неопределенности дальности, ошибки настройки и физиологическое движение путем включения результатов нескольких компьютерных томографий (например, 4-мерного [4D] CT) в процессы оптимизации плана и расчета дозы. Эффективность этих инструментов можно оценить с помощью анализа устойчивости, который включает расчет распределения доз для различных сценариев ошибок.Семейства гистограмм доза-объем (DVH) клинических целевых объемов (CTV) и OAR для нескольких сценариев неопределенностей (т. Е. Сдвигов по направлениям x, y и z и связанных с ними неопределенностей диапазона) проверяются перед проведением лечения, чтобы гарантировать приемлемость плана. Обычно для оценки используется DVH «наихудшего случая» диапазона (). 29,30
Анализ устойчивости на основе DVH, показывающий несколько сценариев, представляющих различные неопределенности и их результирующее влияние на распределение дозы для конкретного органа, подверженного риску, или цели.
Помимо возмущений дозы на периферии протонного поля, интерференция между динамическим карандашным лучом с движением цели и другими окружающими анатомическими элементами приводит к локальным неоднородностям дозы внутри цели. Это взаимодействие между анатомическим движением, вызванным дыханием, и сканированием точек может привести к появлению «горячих» и «холодных» областей дозы в целевом объеме. Поля не могут компенсировать эффект взаимодействия, но могут помочь другие решения, включая одно или несколько из следующих: перекраска пятна, увеличение размера пятна, стробирование или методы уменьшения движения. 8 Доступны некоторые алгоритмы робастной оптимизации 4D, которые могут учитывать изменения плотности, но информация о времени, необходимая для расчета взаимодействия, не включена в эти алгоритмы.
Это взаимодействие между анатомическим движением, вызванным дыханием, и сканированием точек может привести к появлению «горячих» и «холодных» областей дозы в целевом объеме. Поля не могут компенсировать эффект взаимодействия, но могут помочь другие решения, включая одно или несколько из следующих: перекраска пятна, увеличение размера пятна, стробирование или методы уменьшения движения. 8 Доступны некоторые алгоритмы робастной оптимизации 4D, которые могут учитывать изменения плотности, но информация о времени, необходимая для расчета взаимодействия, не включена в эти алгоритмы.
Расхождения между расчетным и фактическим пробегами протонов в ткани
Этот источник неопределенности является результатом преобразования единиц Хаунсфилда, полученных при компьютерной томографии, в относительную тормозную способность протонов ткани, воспроизводимость протонного пучка, погрешности измерения воды при вводе пучка в эксплуатацию и ошибки в диапазоне изготовление компенсатора. 31 Хотя величина этих типов неопределенностей специфична для каждой протонной системы (включая компоненты доставки, построения изображений и вычислений), отдельные учреждения могут использовать «рецепты маржи» для обеспечения целевого охвата. Такие рецепты обычно основаны на формулировке, введенной Мойерсом и др. 32 : дистальный край = α% глубины + β мм, где α связано с погрешностями в вычислении дозы, а β связано с ошибками, не зависящими от расчет дозы.
Неопределенности в ОБЭ
В современной клинической практике предполагается, что ОБЭ протонов по сравнению с фотонами высоких энергий имеет постоянное значение 1,1. В действительности ОБЭ варьируется и является сложной функцией нескольких величин, включая ЛПЭ от протонов к локальной среде, дозу на фракцию, тип ткани и клетки, оксигенацию, биологические или клинические конечные точки и другие факторы. 33 Оценки воздействия этих факторов на ОБЭ доступны в исследованиях in vitro, но данные in vivo на людях все еще отсутствуют. 26 Тем не менее, имеющиеся данные предполагают, что ОБЭ протона может увеличиваться на пике Брэгга, возможно, более быстро и нелинейно на дистальном крае. Поскольку LET увеличивается по мере уменьшения энергии протонов с глубиной, что приводит к повышенным LET и связанным значениям RBE в конце протонного диапазона, это вызывает опасения, когда дистальный конец лечебного поля направлен в сторону чувствительных OAR. Существуют разногласия по поводу протяженности области, в которой RBE отклоняется от 1,1, и она может быть> 1.1. Принято считать, что чем выше разброс по энергии и диапазону, тем большее смешение по диапазону мы видим, что объясняет изменчивость дозы в конце пика Брэгга. 34,35 С другой стороны, другие исследователи считают это отклонение небольшим (несколько миллиметров вокруг пика Брэгга). Поскольку планирование на основе RBE или даже на основе LET коммерчески недоступно, используются эмпирические методы для защиты структур от увеличения RBE, включая снижение физической дозы на OAR на дистальном краю луча, использование нескольких полей для пространственного разбавления эффект, смещение диапазона одного и того же поля, облучение мимо чувствительных структур или разрешение дыхательных / сердечных движений сглаживать дозу для движущихся OAR.
26 Тем не менее, имеющиеся данные предполагают, что ОБЭ протона может увеличиваться на пике Брэгга, возможно, более быстро и нелинейно на дистальном крае. Поскольку LET увеличивается по мере уменьшения энергии протонов с глубиной, что приводит к повышенным LET и связанным значениям RBE в конце протонного диапазона, это вызывает опасения, когда дистальный конец лечебного поля направлен в сторону чувствительных OAR. Существуют разногласия по поводу протяженности области, в которой RBE отклоняется от 1,1, и она может быть> 1.1. Принято считать, что чем выше разброс по энергии и диапазону, тем большее смешение по диапазону мы видим, что объясняет изменчивость дозы в конце пика Брэгга. 34,35 С другой стороны, другие исследователи считают это отклонение небольшим (несколько миллиметров вокруг пика Брэгга). Поскольку планирование на основе RBE или даже на основе LET коммерчески недоступно, используются эмпирические методы для защиты структур от увеличения RBE, включая снижение физической дозы на OAR на дистальном краю луча, использование нескольких полей для пространственного разбавления эффект, смещение диапазона одного и того же поля, облучение мимо чувствительных структур или разрешение дыхательных / сердечных движений сглаживать дозу для движущихся OAR.
Клинические проявления и применение протонной лучевой терапии
Пациенты с заболеванием средостения, особенно молодые женщины, сталкиваются с проблемой лечения, в которой протонная терапия может быть очень полезной. В этом разделе рассматриваются общие цели и проблемы в конкретных клинических ситуациях.
Независимо от типа излучения, которое будет использоваться, основные правила клинической оценки плана лучевой терапии заключаются в достижении следующего: (1) охват планируемого целевого объема (PTV) ≥95% дозы; (2) минимизировать дозу на субструктуры сердца, включая коронарные артерии, левый желудочек и клапаны, 36 , насколько это возможно; (3) свести к минимуму облучение груди с уделением первоочередного внимания предотвращению облучения больших объемов груди у молодых женщин (<35 лет) 37 ; и (4) минимизировать дозу для легких, включая V 5 , V 20 , V 30 и среднюю дозу. 38 суммирует эти моменты и может быть полезным в качестве руководства для выполнения этих требований. 38-41
38 суммирует эти моменты и может быть полезным в качестве руководства для выполнения этих требований. 38-41
Таблица 2.
Руководство по приемлемым дозам, объему и учету полей
| Структуры | Идеал | Техника оптимизации | Оптимизация поля (с учетом уменьшения поля) | Неприемлемо | посадка максимальной дозы в |
|---|---|---|---|---|---|
| Сердце: левый желудочек, коронарные артерии, клапаны 39-41 | Среднее <5 Гр | Среднее, 5-15 Гр | Среднее> 15 Гр | Среднее> 30 Гр | Коронарные сосуды |
| Грудь (в зависимости от возраста) * | Среднее <4 Гр | Среднее, 4-15 Гр | Среднее> 15 Гр | Среднее> 30 Гр | Железистая ткань |
| V 5 <55% | V 5 , 55-60% | – | V 5 > 60% | ||
| V 20 <30% | Среднее, 10-13. 5 Гр 5 Гр | Среднее> 13,5 Гр | |||
| Среднее <10 Гр | |||||
| Щитовидная железа 62 | V 25 <62,5% | V | 25%V 25% | 25%Вся щитовидная железа |
Следует иметь в виду, что в существующих системах планирования клинического лечения отсутствуют некоторые ключевые возможности, необходимые для создания, оптимизации или оценки возможных планов лечения. В частности, рассеянное радиационное облучение обычно недооценивается за пределами области лечения на несколько сантиметров, что исключает обычные прогнозы риска, основанные на радиационном воздействии. 42 Точно так же их возможности моделирования рисков ограничены, если они вообще присутствуют. 43,44
Учет дозы на сердце
Связь заболевания с ОАР определяет ситуации, в которых протонная терапия наиболее эффективна. В частности, что касается заболеваний сердца и его подструктур, опубликованные результаты показывают, что средние дозы на сердце> 15 Гр связаны с повышенным риском сердечных заболеваний. 39 Средняя доза на сердце – приблизительная оценка, используемая довольно часто 45 ; механистически, однако, ишемическая болезнь сердца, вероятно, зависит от средней дозы на сердце, а также от максимальной дозы на субструктуры сердца, 46,47 , особенно в отношении атеросклероза коронарных сосудов.Следовательно, следует помнить об объеме высокой дозы, особенно в отношении потенциальной неопределенности ОБЭ для пучков, которые заканчиваются в пределах нескольких миллиметров от коронарных сосудов. 21
Для целей этой статьи в протонных и фотонных планах на всех показанных иллюстрациях используется DIBH, наклонная доска для женщин, чтобы еще больше избежать груди, и, для IMRT, техника бабочки. 48-51
48-51
Сценарий 1: медиастинальная цель полностью над сердцем без вовлечения подмышек
Отрыв левой основной стволовой коронарной артерии используется для определения того, находится ли цель выше или ниже сердца ().В этом примере () экспонирование сердца вполне сопоставимо, независимо от того, какой метод используется. Различия в DVH, а также в средней дозе для других структур аналогичны планам для протонов и IMRT.
Три сценария связи между заболеванием средостения и сердцем. (A) Показывает, как использовать отрыв левой основной стволовой коронарной артерии (обведен розовым цветом) для определения расположения верхнего и нижнего средостения. (B) Сценарий 1: КТ-изображения коронарной артерии 28-летнего мужчины с первичной лимфомой средостения до (i) и после (ii) 6 курсов ритуксимаба, циклофосфамида, доксорубицина, винкристина, преднизона (RCHOP) химиотерапии, представляющей для консолидации с радиация.(Biii) Аксиальный, коронарный и сагиттальный виды плана IMRT (верхние панели) и протонного плана (нижние панели). (Biv) Соответствующие средние дозы для критических структур с использованием IMRT против протонов. (C) Сценарий 2: КТ-изображения коронковой части 25-летнего мужчины с лимфомой Ходжкина до (i) и после (ii) 4 курсов химиотерапии доксорубицином, блеомицином, винбластином и дакарбазином (ABVD) для консолидации с помощью излучения. (Ciii) Аксиальный, коронарный и сагиттальный виды плана IMRT (верхние панели) и протонного плана (нижние панели).(Civ) Соответствующие средние дозы для критических структур с использованием IMRT против протонов. (D) Сценарий 3: КТ-изображения коронарной артерии 30-летнего мужчины с рецидивирующей лимфомой Ходжкина, как показано на коронарных изображениях ПЭТ / КТ-сканирования (i-ii) для окончательного облучения. (Diii) Осевые, корональные и сагиттальные виды плана IMRT (верхние панели) и протонного плана (нижние панели). (Div) Соответствующие средние дозы для критических структур с использованием IMRT по сравнению с протонами.
Сценарий 2: цель охватывает правую часть сердца
Для целей в правой части сердца IMRT часто обеспечивает сопоставимые дозы для сердца и других структур, как протонная терапия.Примечательно, однако, что даже когда протонные планы дают дозиметрическое преимущество перед планами IMRT, величина преимущества может варьироваться в зависимости от случая, и его нужно оценивать индивидуально. Например, для пациента, показанного на, средние дозы для критических структур от протонной терапии достаточно ниже, чем от IMRT, чтобы предположить, что протонная терапия может быть предпочтительнее из-за большого объема, охватывающего правую часть сердца. Этот пример демонстрирует необходимость тщательного рассмотрения отдельных случаев перед принятием решения о лечении.
Сценарий 3: цель находится с обеих сторон сердца
Заболевание, которое распространяется значительно впереди сердца спереди, сзади или слева, представляет собой особую проблему для IMRT; поэтому протонная терапия может быть лучшим планом. Примечательно, что токсичность для сердца и легких не устраняется с помощью протонной терапии; скорее, доза для сердца может быть ниже, чем IMRT. Таким образом, в подобных случаях клиницисты должны тщательно взвесить терапевтическую пользу с долгосрочными рисками радиационно-индуцированной токсичности лечения, прежде чем принимать решение о том, какой метод следует использовать.В самом деле, в этом случае протонная терапия может значительно избежать воздействия на сердце, и ее следует искать в попытке снизить дозу на субструктуры сердца.
Учет поражения подмышечных впадин
Протонная терапия может значительно снизить дозу облучения груди за счет специального использования полей, которые входят сзади и не выходят через грудь. В качестве альтернативы, если нельзя использовать протоны, вместо них можно использовать другие методы смещения груди, такие как использование наклонной доски или физическое перемещение груди с пути луча.показывает, как протонная терапия может защитить грудь в случае поражения подмышечных впадин.
Поражение подмышечных впадин при презентации. (A) Аксиальный, коронарный и сагиттальный виды протонного плана (слева) и плана IMRT (справа) для пациента с поражением подмышек. Использование протонной терапии в этом случае щадит левую грудь. (B) Независимо от того, какой метод лечения выбран, IMRT (левая панель) и протонная (правая панель), ограничение объема, подвергаемого облучению, должны включать внимание к избеганию ванны с низкой дозой.(C) Предельная доза для легких. Если основной целью данного пациента является предотвращение поражения легких, особенно если пациент прошел легочную токсическую химиотерапию (например, любую комбинацию блеомицина, бусульфана, гемцитабина, брентуксимаба и т. Д.), Протонная терапия может лучше избавить легкие за счет уменьшения ванна с малой дозой облучения фотонами.
Рассмотрение дозы в груди
Долгосрочный риск развития рака груди связан с воздействием высоких и низких доз радиации. 37,52 Особенно при лечении молодых пациентов следует направлять усилия на поддержание максимально низкой дозы облучения тканей груди.В большинстве случаев, связанных с заболеванием средостения, подмышечная впадина не задействована, и доза облучения груди при IMRT или протонной терапии будет небольшой. Хотя IMRT приводит к тому, что большие объемы ткани молочной железы получают низкие дозы излучения, в некоторых случаях протонная терапия может привести к увеличению объемов ткани молочной железы, получающей высокие дозы излучения. Неизвестно, важнее ли минимизировать порцию с низкой дозой по сравнению с частью с высокой дозой; впоследствии средняя доза груди продолжает оставаться лучшим фактором для оценки различных планов.Однако в настоящее время высокая доза для небольшого объема обычно предпочтительнее, чем низкая доза для большого объема, основываясь на данных, предполагающих, что низкие дозы 4 Гр 37 могут быть связаны с риском долгосрочных вторичных злокачественных новообразований. особенно у пациентов моложе 24 лет. Хотя расчет дозы Travis et al. 37 относится к точечной дозе (а не к средней), мы все же рекомендуем проявлять осторожность, пытаясь сохранить среднюю дозу на грудь ≤ 4 Гр.
особенно у пациентов моложе 24 лет. Хотя расчет дозы Travis et al. 37 относится к точечной дозе (а не к средней), мы все же рекомендуем проявлять осторожность, пытаясь сохранить среднюю дозу на грудь ≤ 4 Гр.
Когда необходимо покрыть внутригрудную болезнь, доза для груди может увеличиться, и избежать попадания в грудь становится трудно при использовании любого метода (протонного или фотонного).При выборе метода лечения для таких случаев необходимо учитывать дозы, получаемые другими критическими структурами, такими как сердце и легкие, особенно у пациентов, ранее лечившихся и получавших тяжелое лечение. Однако при рассмотрении того, как наилучшим образом ограничить объемы, подвергающиеся облучению, не менее важно избегать «ванн с малыми дозами» (т.е. облучения больших объемов низкими дозами), независимо от того, какой метод используется ().
Учет дозы в легких
С появлением планирования лимфомы средостения на основе КТ доза в легкие теперь может быть коррелирована с риском пневмонита.Рекомендуется ограничивать дозу для легких: V 5 <55%, средняя доза для легких <13,5 Гр и V 30 <20%. Эти значения более достижимы при использовании DIBH. 38 Хотя средняя доза в легких 13,5 Гр была связана с более низким риском пневмонита, рекомендуется стремиться к более низкой дозе, что довольно часто достижимо при использовании строгих ограничений. Например, когда используется IMRT, важно ограничить лучи некоторыми вариациями переднезадних лучей, избегая боковых лучей.Если основной целью данного пациента является предотвращение поражения легких, особенно если этот пациент получил легочную токсическую химиотерапию (например, блеомицин, бусульфан, гемцитабин, брентуксимаб), протонная терапия может лучше избавить легкие за счет уменьшения количества наблюдаемых ванн с низкой дозой с фотонами ().
Современные методы протонно-лучевой терапии
Протонная терапия с пассивным рассеянием
Протонная терапия с пассивным рассеянием (PSPT) – наименее сложный метод доставки протонов; луч расширяется в поперечном направлении за счет размещения рассеивающего материала на пути луча. Колеса модулятора диапазона или гребневые фильтры используются для создания расширенного пика Брэгга, области плоского распределения дозы, предназначенной для покрытия цели в поперечном и продольном направлениях. Полный пик Брэгга доставляется почти мгновенно (<0,1 секунды), поэтому нет взаимодействия между пучком протонов и физиологическим движением во время доставки, что делает PSPT наиболее надежной формой доставки протонов. 53
Колеса модулятора диапазона или гребневые фильтры используются для создания расширенного пика Брэгга, области плоского распределения дозы, предназначенной для покрытия цели в поперечном и продольном направлениях. Полный пик Брэгга доставляется почти мгновенно (<0,1 секунды), поэтому нет взаимодействия между пучком протонов и физиологическим движением во время доставки, что делает PSPT наиболее надежной формой доставки протонов. 53
Проблемы при планировании PSPT
Соответствие целевой неоднородности (например, смежные подобъемы разного размера, формы и глубины) является сложной задачей; Лучи PSPT могут прилегать только к одной стороне мишени, проксимально или дистально.Кроме того, большие цели часто требуют согласования полей из-за ограниченного максимального размера рассеянных лучей. Неоднородность дозы, создаваемая согласованными лучами, смягчается за счет изменения согласованных линий, что увеличивает сложность лечения.
Управление движением в PSPT требует использования точного анализа движения, адекватного определения запаса и методов уменьшения движения. Для процедур свободного дыхания используется 4D CT для оценки смещения цели перпендикулярно лучу и для увеличения ширины луча.Вдоль луча движение оценивается по максимальной разнице в водоэквивалентной глубине от поверхности пациента до дистального края мишени для каждого луча на основе изменений плотности 4D CT и учитывается с помощью смазывания компенсатора. DIBH уменьшает движение цели и учитывает границы раздела тканей.
Плановая цель – CTV; когда на обрабатываемую область воздействует дыхательное движение, плановой целью является внутренний целевой объем (ITV), который охватывает движение CTV, отображаемое на 4D компьютерных томограммах.В качестве альтернативы, если лечение будет проводиться с помощью DIBH, ITV может быть получен из положений CTV, воспроизведенных из нескольких сканирований DIBH. Для формирования бокового луча расширение запаса для формирования PTV учитывает неопределенность настройки, а межфракционная изменчивость анатомии применяется к CTV / ITV. Коллиматоры пучка, ориентированные на пациента, согласовывают дозу латерально с PTV с запасом на полутень. В зависимости от целевой глубины и прилегающих тканей эти поля варьируются от 5 до 10 мм. Компенсаторы диапазона разработаны для каждого луча, чтобы дистально согласовать дозу с CTV / ITV.Смазка компенсатора диапазона в пределах радиуса, соответствующего допускам установки и движению ткани, применяется для учета изменений дальности действия протонов, вызванных изменениями плотности на пути луча. Кроме того, вдоль каждого луча дистальные и проксимальные границы устанавливаются на CTV / ITV для компенсации неопределенностей дальности протонов, как описано в разделе «Неопределенности дальности из-за изменений плотности». Несколько лучей (по сравнению с одним лучом) можно использовать для увеличения конформности дозы и уменьшения неопределенности дозы за счет распространения лучей в различных направлениях.Предпочтительно использовать переднее или заднее поля, а не оба, из-за необходимости избегать ненужного луча через сердце ().
Коллиматоры пучка, ориентированные на пациента, согласовывают дозу латерально с PTV с запасом на полутень. В зависимости от целевой глубины и прилегающих тканей эти поля варьируются от 5 до 10 мм. Компенсаторы диапазона разработаны для каждого луча, чтобы дистально согласовать дозу с CTV / ITV.Смазка компенсатора диапазона в пределах радиуса, соответствующего допускам установки и движению ткани, применяется для учета изменений дальности действия протонов, вызванных изменениями плотности на пути луча. Кроме того, вдоль каждого луча дистальные и проксимальные границы устанавливаются на CTV / ITV для компенсации неопределенностей дальности протонов, как описано в разделе «Неопределенности дальности из-за изменений плотности». Несколько лучей (по сравнению с одним лучом) можно использовать для увеличения конформности дозы и уменьшения неопределенности дозы за счет распространения лучей в различных направлениях.Предпочтительно использовать переднее или заднее поля, а не оба, из-за необходимости избегать ненужного луча через сердце ().
Пример подхода с использованием 2 передних полей с протонной терапией, который может лучше защитить сердце и пищевод (справа) по сравнению с передним / задним доступом (слева).
Протонная терапия со сканированием карандашным лучом
По сравнению с PSPT, протонная терапия со сканированием карандашным лучом в активном режиме (PBSPT) предлагает потенциал для лучшей конформности и экономии OAR. 54 Поскольку лечение включает доставку индивидуально контролируемых точек, неоднородные дозы могут быть созданы намеренно. PBSPT может доставлять более низкие дозы в OAR за счет своей способности согласовывать дозу в непосредственной близости от мишени, за счет улучшенной конформности, удаленной от мишени, и за счет уменьшения образования вторичных нейтронов, образующихся в аппарате для лечения. 55,56 Однако поперечная ширина полутени некоторых неколлимированных сканируемых лучей может быть больше, чем у коллимированных пучков пассивно рассеянных протонов. Когда каждое сканированное лечебное поле используется для лечения целого объекта, этот метод называется «однородной дозой для одного поля». Конформность может быть дополнительно улучшена с использованием подхода с модуляцией интенсивности (т. Е. Протонной терапии с модуляцией интенсивности), в которой каждый пучок используется для обработки только части объема мишени; эта методика аналогична IMRT по принципу «шаг-и-стреляй». По сравнению с лучами PSPT, поля PBSPT больше, поэтому большие цели можно обрабатывать без согласованных полей. Однако, когда требуются совпадения, PBSPT позволяет «согласование градиента», 57,58 , что устраняет необходимость изменения линии совпадения.Согласование градиента можно использовать для встречных лучей, нацеленных на разные области сложных целевых объемов, как описано ниже.
Когда каждое сканированное лечебное поле используется для лечения целого объекта, этот метод называется «однородной дозой для одного поля». Конформность может быть дополнительно улучшена с использованием подхода с модуляцией интенсивности (т. Е. Протонной терапии с модуляцией интенсивности), в которой каждый пучок используется для обработки только части объема мишени; эта методика аналогична IMRT по принципу «шаг-и-стреляй». По сравнению с лучами PSPT, поля PBSPT больше, поэтому большие цели можно обрабатывать без согласованных полей. Однако, когда требуются совпадения, PBSPT позволяет «согласование градиента», 57,58 , что устраняет необходимость изменения линии совпадения.Согласование градиента можно использовать для встречных лучей, нацеленных на разные области сложных целевых объемов, как описано ниже.
Проблемы PBSPT
По сравнению с PSPT, PBSPT более чувствителен к изменениям плотности на пути луча; таким образом, управление движением имеет первостепенное значение. В то время как межфракционные изменения и уменьшение опухоли могут потребовать адаптивного планирования при PSPT, повышенная чувствительность к вариациям пути луча делает это еще более важным при использовании PBSPT.
Управление движением
Использование PBSPT требует пристального внимания к оценке внутрифракционного движения, которое обычно связано с дыхательным циклом.Технику свободного дыхания можно безопасно использовать при выполнении определенных условий. 54 Использование PBSPT со свободным дыханием требует 4D компьютерной томографии для оценки движения внутренних структур во время дыхательного цикла. Надежность повышается за счет использования стратегии перекраски, которая снижает вероятность эффекта взаимодействия. Для пациентов с целевым движением, превышающим 5 мм за дыхательные циклы, могут использоваться альтернативные стратегии, такие как DIBH, респираторное стробирование, сжатие живота или изменение положения.
Что касается расположения пациента, важно обеспечить воспроизводимость между фракциями. По сравнению с PSPT, PBSPT требует еще более строгой воспроизводимости из-за его большей чувствительности к изменениям плотности на пути луча.
Что касается расположения полей, метод PBSPT для переднего верхнего средостения и нижней части шеи обычно требует 1 (перекрашенный) или 2 передних поля. Для более сложных целевых объемов цели могут быть разделены на 2 или более частей (например, CTV шеи, CTV средостения и CTV подмышек), и может использоваться многополевой план ().В случаях, когда затрагиваются нижние (задние) и верхние (передние) мишени средостения, комбинация задних и передних полей может максимально защитить сердце и легкие (). Для целей в верхней части шеи боковые или задние поля могут избегать структур полости рта / слюнной железы. Для подмышечных мишеней заднее поле может помочь сохранить ткань груди. Хотя эти различные конфигурации полей могут использоваться в PSPT, согласование градиентов в PBSPT проще, когда поля перекрываются или противоположны, что устраняет необходимость в размытии.
Планы PBSPT с однородной дозой в одном поле и согласованием градиента с использованием передних и задних лучей для лечения заболевания, которое затрагивает двустороннюю верхнюю часть шеи и средостение (заболевание перед правыми отделами сердца).
Сканирование молодой женщины, у которой мишень включала средостение, левую парастернальную и левую подмышечную области. Одно переднее поле использовалось для средостения, а отдельное заднее поле – для подмышечной области.
Проверка положения пациента и распределения дозы в PSPT или PBSPT
Системы доставки протонов оснащены системами визуализации ортогональных кВ, используемых для ежедневной настройки пациента. В более новых системах есть КТ с коническим лучом. Хотя планы PSPT и PBSPT могут быть составлены с учетом ошибок настройки и движения дыхания, рекомендуется проверка дозы. Описанные ранее границы не защищают от непредсказуемых изменений, которые происходят во время курса лечения, таких как прогрессирование лимфомы, плевральный выпот, пневмония или потеря веса.Если установка лечения под контролем изображения не основана на трехмерной визуализации, рекомендуется повторить верификационную КТ-визуализацию и пересчитать дозу для проверки точности лечения. Рекомендуется адаптивное планирование (например, при рефрактерном рецидиве), когда целевой охват не поддерживается или ограничения по дозе OAR нарушаются во время курса лечения
Планирование лечения
Определение цели и границы
Определение цели соответствует современному определению облучения пораженных участков, ранее опубликованные Международной группой радиационной онкологии лимфомы (ILROG). 3 CTV / ITV и нормальные структуры разграничиваются таким же образом для протонной терапии и для фотонной терапии. Из-за неопределенностей в диапазоне протонов обоснованность концепции PTV сомнительна. В текущей практике PSPT поля для CTV назначаются для каждого луча, а боковые поля такие же, как для фотонов; однако дистальный и проксимальный края зависят от глубины дистального и проксимального краев мишени. Это приводит к тому, что называется «зависимым от луча PTV». Эта практика не применима к протонной терапии с модуляцией интенсивности, для которой рекомендуется надежная оптимизация.
Управление движением
4D компьютерная томография может помочь установить степень анатомического движения, вызванного дыханием, и соответствующее расширение ITV. Однако это вносит дополнительную неопределенность; для смягчения последнего необходимо увеличить объем излучения. Таким образом, использование DIBH идеально подходит для уменьшения подвижности средостения и его изменения формы в зависимости от дыхания (тоньше при вдохе, шире при свободном дыхании) (). 59 Это достигается путем сбора анатомических данных в фиксированной респираторной фазе.DIBH может иметь дополнительное преимущество, заключающееся в смещении сердца вниз, а также в расширении легких от цели, потенциально снижая дозу, полученную этими OAR.
Использование DIBH может помочь справиться с некоторыми неопределенностями, связанными с использованием протонной терапии. По сравнению со свободным дыханием (правая панель), ДИБГ расширяет легкие, перемещает сердце вниз и вызывает истончение средостения (левая панель).
DIBH может выполняться несколькими способами, например, путем активного блокирования воздушного потока, произвольной задержки дыхания или синхронизации (дыхательного стробирования).Каждый из этих методов имеет преимущества и ограничения при использовании с протонной терапией, особенно PBSPT, который имеет тенденцию иметь более длительное время включения луча, чем PSPT. Следует оценить межфракционную воспроизводимость положения диафрагмы во время фракции излучения. 60,61 Независимо от используемой техники задержки дыхания, бортовая визуализация может быть полезна для проверки и проверки ежедневной воспроизводимости объема легких по сравнению с данными КТ для планирования лечения.
Резюме и направления на будущее
Использование протонной терапии при лимфомах, поражающих средостение, является многообещающим, и методы лечения продолжают развиваться.Дозиметрическое преимущество снижения дозы OAR при определенных распределениях заболеваний может быть значительным и весьма желательным. Однако ограниченная доступность протонной терапии требует выбора случая, основанного на четком понимании того, какие случаи принесут наибольшую пользу от протонной терапии по сравнению с передовыми фотонными методами.
Каждый центр протонной терапии имеет разные возможности и методы, и пока нет единого метода протонной лучевой терапии для пациентов с лимфомой.В конечном итоге должны применяться ключевые инструменты и концепции, а также должны быть приобретены минимальные требования к компетентности для тех, кто намеревается использовать протонную терапию.
Дополнительные материалы
Онлайн-версия этой статьи содержит дополнение с данными.
Авторство
Вклад: Все авторы внесли свой вклад в создание рукописи; разногласия во мнениях разрешались консенсусом большинства.
Раскрытие информации о конфликте интересов: авторы заявляют об отсутствии конкурирующих финансовых интересов.
Список членов руководящего комитета Международной группы радиационной онкологии лимфомы приведен в онлайн-приложении.
Для корреспонденции: Бутхайна Шбиб Дабая, отделение радиационной онкологии, Онкологический центр им. Доктора медицины Андерсона Техасского университета, 1515 Holcombe Blvd, Houston, TX 77030; электронная почта: gro.nosrednadm@ajabadb.
СПИСОК ЛИТЕРАТУРЫ
1. Ценг Ю.Д., Каттер Д.Д., Пластарас Дж. П. и др. . Основанный на фактах обзор использования протонной терапии при лимфоме, подготовленный Подкомитетом по лимфоме Совместной группы по терапии частиц (PTCOG).Int J Radiat Oncol Biol Phys. 2017; 99 (4): 825-842. [PubMed] [Google Scholar] 2. Яхалом Дж., Иллидж Т., Шпехт Л. и др. ; Международная группа радиационной онкологии лимфомы. Современная лучевая терапия экстранодальных лимфом: полевые и дозовые рекомендации Международной группы радиационной онкологии лимфомы. Int J Radiat Oncol Biol Phys. 2015; 92 (1): 11-31. [PubMed] [Google Scholar] 3. Шпехт Л., Яхалом Дж., Иллидж Т. и др. ; ILROG. Современная лучевая терапия лимфомы Ходжкина: полевые и дозовые рекомендации Международной группы радиационной онкологии лимфомы (ILROG).Int J Radiat Oncol Biol Phys. 2014; 89 (4): 854-862. [PubMed] [Google Scholar] 4. Иллидж Т., Шпехт Л., Яхалом Дж. И др. ; Международная группа радиационной онкологии лимфомы. Современная лучевая терапия для узловой неходжкинской лимфомы. Определение цели и рекомендации по дозировке от Международной группы радиационной онкологии лимфомы. Int J Radiat Oncol Biol Phys. 2014; 89 (1): 49-58. [PubMed] [Google Scholar] 5. Ходжсон Д.К., Дикманн К., Терезакис С., Константин Л.; Международная группа радиационной онкологии лимфомы. Внедрение современных концепций планирования лучевой терапии для детской лимфомы Ходжкина: рекомендации Международной группы радиационной онкологии лимфомы.Практик Радиат Онкол. 2015; 5 (2): 85-92. [PubMed] [Google Scholar] 6. Homann K, Howell R, Eley J, et al. . Необходимость индивидуальных исследований для сравнения риска радиогенного второго рака (РСК) при лечении пациентов с протонной и фотонной лимфомой Ходжкина. J Протонная терапия. 2015; 1 (1): 118. [Google Scholar] 7. Элей Дж., Ньюхаузер В., Хоманн К. и др. . Реализация аналитической модели эквивалентной дозы нейтронов утечки в системе планирования протонной лучевой терапии. Раки (Базель). 2015; 7 (1): 427-438. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Цзэн С., Пластарас Дж. П., Джеймс П. и др. . Сканирование протонным карандашным пучком для лимфомы средостения: планирование лечения и оценка устойчивости. Acta Oncol. 2016; 55 (9-10): 1132-1138. [PubMed] [Google Scholar] 9. Йоргенсен А.Ю., Маральдо М.В., Бродин Н.П. и др. . Воздействие на пищевод после различных методов лучевой терапии лимфомы Ходжкина на ранней стадии. Acta Oncol. 2013; 52 (7): 1559-1565. [PubMed] [Google Scholar] 10. Саксман С., Хоппе Б.С., Менденхолл Н.П. и др. . Протонная терапия поддиафрагмальной области при ведении пациентов с лимфомой Ходжкина.Лимфома лейка. 2015; 56 (7): 2019-2024. [PubMed] [Google Scholar] 11. Маральдо М.В., Бродин П., Азнар М.К. и др. . Дозы в сонные артерии после современной лучевой терапии лимфомы Ходжкина: инсульт все еще является поздним эффектом лечения? Int J Radiat Oncol Biol Phys. 2013; 87 (2): 297-303. [PubMed] [Google Scholar] 12. Тольц А., Шин Н., Митроу Э и др. . Поздняя лучевая токсичность у больных лимфомой Ходжкина: возможности протонной терапии. J Appl Clin Med Phys. 2015; 16 (5): 167-178. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13.Хольцман А.Л., Хоппе Б.С., Ли Зи и др. . Повышение терапевтического индекса при детской лимфоме Ходжкина III / IV стадии с помощью протонной терапии. Int J Part Ther. 2014; 1 (2): 343-356. [Google Scholar] 14. Knäusl B, Lütgendorf-Caucig C, Hopfgartner J, et al. . Можно ли улучшить лечение детской лимфомы Ходжкина с помощью ПЭТ-визуализации и протонной терапии? Strahlenther Onkol. 2013; 189 (1): 54-61. [PubMed] [Google Scholar] 15. Андолино Д.Л., Хоэн Т., Сяо Л., Буксбаум Дж., Чанг А.Л. Дозиметрическое сравнение трехмерной конформной фотонной радиотерапии с вовлеченным полем и протонной терапии с сохранением груди для лечения лимфомы Ходжкина у педиатрических пациентов женского пола.Int J Radiat Oncol Biol Phys. 2011; 81 (4): e667-e671. [PubMed] [Google Scholar] 16. Cella L, Conson M, Pressello MC и др. . Методы лучевой терапии новой лимфомы Ходжкина: компромисс между поздней радиоиндуцированной токсичностью и вторичными злокачественными новообразованиями. Радиат Онкол. 2013; 8 (1): 22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Чера Б.С., Родригес С., Моррис К.Г. и др. . Дозиметрическое сравнение трех различных методов локального облучения пациентов с лимфомой Ходжкина II стадии: обычная лучевая терапия, лучевая терапия с модуляцией интенсивности и трехмерная протонная лучевая терапия.Int J Radiat Oncol Biol Phys. 2009; 75 (4): 1173-1180. [PubMed] [Google Scholar] 18. Хоппе Б.С., Флампури С., Зайден Р. и др. . Протонная терапия вовлеченных узлов в комбинированную терапию лимфомы Ходжкина: результаты исследования фазы 2. Int J Radiat Oncol Biol Phys. 2014; 89 (5): 1053-1059. [PubMed] [Google Scholar] 19. Хорн С., Фурнье-Бидоз Н., Пернин В. и др. . Сравнение пассивно-лучевой протонной терапии, спиральной томотерапии и трехмерной конформной лучевой терапии у пациенток с лимфомой Ходжкина, получающих лучевую терапию вовлеченного поля или пораженного участка.Рак Радиотермой. 2016; 20 (2): 98-103. [PubMed] [Google Scholar] 20. Маральдо М.В., Бродин Н.П., Азнар М.К. и др. . Дозы для нормальных тканей головы и шеи при ранней стадии лимфомы Ходжкина после лучевой терапии пораженных узлов. Радиатор Oncol 2014; 110 (3): 441-447. [PubMed] [Google Scholar] 21. Ли Дж., Дабаджа Б., Рид В. и др. . Обоснование и предварительные результаты протонно-лучевой терапии лимфомы средостения. Int J Radiat Oncol Biol Phys 2011; 81 (1): 167-174. [PubMed] [Google Scholar] 22.Хоппе Б.С., Цай Х., Ларсон Г. и др. . Паттерны протонной терапии и ранние результаты лечения лимфомы Ходжкина: результаты из реестра Proton Collaborative Group. Acta Oncol. 2016; 55 (11): 1378-1380. [PubMed] [Google Scholar] 23. Хоппе Б.С., Хилл-Кайзер К.Э., Ценг Ю.Д. и др. . Консолидирующая протонная терапия после химиотерапии у пациентов с лимфомой Ходжкина. Энн Онкол. 2017; 28 (9): 2179-2184. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Нанда Р., Флампури С., Менденхолл Н. П. и др. . Легочная токсичность после протонной терапии лимфомы грудной клетки.Int J Radiat Oncol Biol Phys. 2017; 99 (2): 494-497. [PubMed] [Google Scholar] 26. Международная комиссия по радиационным единицам и измерениям. Назначение, запись и сообщение о протонно-лучевой терапии. Отчет ICRU 78 . [Google Scholar] 27. Eley JG, Newhauser WD, Lüchtenborg R, Graeff C, Bert C. 4D оптимизация терапии с отслеживанием движущихся опухолей со сканированным ионным пучком. Phys Med Biol 2014; 59 (13): 3431-3452. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Элей Дж. Г., Ньюхаузер В. Д., Рихтер Д., Люхтенборг Р., Сайто Н., Берт К.Устойчивость покрытия целевой дозы к неопределенностям движения для лечения движущихся опухолей со сканированным пучком ионов углерода. Phys Med Biol 2015; 60 (4): 1717-1740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Чжу З., Лю В., Гиллин М. и др. . Оценка устойчивости протонной терапии с пассивным рассеянием в отношении местного рецидива немелкоклеточного рака легкого III стадии: вторичный анализ исследования фазы II. Радиат Онкол. 2014; 9 (1): 108. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32.Мойерс М.Ф., Миллер Д.В., Буш Д.А., Слейтер Д.Д. Методологии и инструменты для проектирования пучков протонов для опухолей легких. Int J Radiat Oncol Biol Phys. 2001; 49 (5): 1429-1438. [PubMed] [Google Scholar] 33. Куарон Дж. Дж., Чанг С., Лавлок М. и др. . Экспоненциальное увеличение относительной биологической эффективности вдоль дистального края протонного пика Брэгга, измеренное по разрывам двухцепочечной дезоксирибонуклеиновой кислоты. Int J Radiat Oncol Biol Phys. 2016; 95 (1): 62-69. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Гуан Ф., Бронк Л., Титт У. и др.. Пространственное отображение биологической эффективности сканированных пучков частиц: к биологически оптимизированной терапии частицами. Научный доклад 2015; 5 (1): 9850. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Веденберг М., Линд Б.К., Хордемарк Б. Модель относительной биологической эффективности протонов: тканевый параметр α / β фотонов является предиктором чувствительности к изменениям ЛПЭ. Acta Oncol. 2013; 52 (3): 580-588. [PubMed] [Google Scholar] 36. Малруни Д.А., Йазель М.В., Кавашима Т. и др. . Сердечные исходы в когорте взрослых, переживших рак в детском и подростковом возрасте: ретроспективный анализ когорты исследования выживших после рака.BMJ. 2009; 339: b4606. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Трэвис Л. Б., Хилл Д. А., Дорес Г. М. и др. . Рак груди после лучевой терапии и химиотерапии у молодых женщин с болезнью Ходжкина. ДЖАМА. 2003; 290 (4): 465-475. [PubMed] [Google Scholar] 38. Pinnix CC, Smith GL, Milgrom S и др. . Предикторы лучевого пневмонита у пациентов, получающих лучевую терапию с модуляцией интенсивности по поводу Ходжкина и неходжкинской лимфомы. Int J Radiat Oncol Biol Phys. 2015; 92 (1): 175-182. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39.Маральдо М.В., Джусти Ф., Фогелиус И.Р. и др. . Сердечно-сосудистые заболевания после терапии лимфомы Ходжкина: подробный анализ 9 совместных исследований EORTC-LYSA. Lancet Haematol. 2015; 2: e492-e502. [PubMed] [Google Scholar] 40. ван Нимвеген Ф.А., Шаапвельд М., Каттер Д.Д. и др. . Зависимость радиационной доза-реакция для риска ишемической болезни сердца у выживших после лимфомы Ходжкина. J Clin Oncol. 2016; 34 (3): 235-243. [PubMed] [Google Scholar] 41. Каттер Д. Д., Шаапвельд М., Дарби С. К. и др. . Риск порока сердца после лечения лимфомы Ходжкина.J Natl Cancer Inst. 2015; 107 (4): djv008. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Ньюхаузер В.Д., Шнайдер С., Уилсон Л., Шреста С., Донахью В. Обзор аналитических моделей воздействия паразитного излучения при лучевой терапии фотонами и протонами. Radiat Prot Dosimetry. 2018; 180 (1-4): 245-251. [PubMed] [Google Scholar] 43. Stokkevåg CH, Schneider U, Muren LP, Newhauser W. Прогнозирование риска радиационно-индуцированного рака в протонной и тяжелой ионной радиотерапии. Phys Med. 2017; 42: 259-262. [PubMed] [Google Scholar] 44.Ньюхаузер У.Д., Беррингтон де Гонсалес А., Шульте Р., Ли К. Обзор исследований поздних эффектов, вызванных лучевой терапией, после лечения с использованием передовых технологий. Фасад Онкол. 2016; 6: 13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Дарби С.К., Эверц М., МакГейл П. и др. . Риск ишемической болезни сердца у женщин после лучевой терапии рака груди. N Engl J Med. 2013; 368 (11): 987-998. [PubMed] [Google Scholar] 46. Фэн М., Моран Дж. М., Келлинг Т. и др. . Разработка и проверка атласа сердца для изучения воздействия радиации на сердце после лечения рака груди.Int J Radiat Oncol Biol Phys. 2011; 79 (1): 10-18. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Хоппе Б.С., Флампури С., Су Зи и др. . Эффективное снижение дозы на сердечные структуры с использованием протонов по сравнению с 3DCRT и IMRT при лимфоме Ходжкина средостения. Int J Radiat Oncol Biol Phys. 2012; 84 (2): 449-455. [PubMed] [Google Scholar] 48. Азнар М.К., Маральдо М.В., Шут Д.А. и др. . Минимизация поздних эффектов у пациентов с лимфомой Ходжкина средостения: задержка дыхания на глубоком вдохе, IMRT или и то, и другое? Int J Radiat Oncol Biol Phys.2015; 92 (1): 169-174. [PubMed] [Google Scholar] 49. Voong KR, McSpadden K, Pinnix CC и др. . Дозиметрические преимущества метода «бабочка» для лучевой терапии с модуляцией интенсивности у молодых пациенток с лимфомой Ходжкина средостения. Радиат Онкол. 2014; 9 (1): 94. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Дабая Б.С., Ребуэно Н.С., Мазлум А. и др. . Облучение лимфомы Ходжкина у молодых пациенток: новый метод, позволяющий избежать попадания в грудь и снизить дозу облучения сердца. Int J Radiat Oncol Biol Phys.2011; 79 (2): 503-507. [PubMed] [Google Scholar] 51. Фиандра С., Филиппи А.Р., Катуццо П. и др. . Различные решения IMRT по сравнению с 3D-конформной лучевой терапией на ранней стадии лимфомы Ходжкина: дозиметрическое сравнение и клинические соображения. Радиат Онкол. 2012; 7 (1): 186. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Шаапвельд М., Алеман Б.М., ван Эггермонд А.М. и др. . Второй риск рака до 40 лет после лечения лимфомы Ходжкина. N Engl J Med. 2015; 373 (26): 2499-2511. [PubMed] [Google Scholar] 53.Мэтни Дж., Парк ПК, Блуетт Дж. И др. . Влияние дыхательного движения на терапию пассивно рассеянными протонами по сравнению с фотонной терапией с модуляцией интенсивности при раке легких III стадии: являются ли протонные планы более чувствительными к дыхательному движению? Int J Radiat Oncol Biol Phys. 2013; 87 (3): 576-582. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Zeng C, Plastaras JP, Tochner ZA, et al. . Сканирование протонным карандашным лучом при лимфоме средостения: влияние взаимодействия между движением цели и сканированием луча. Phys Med Biol.2015; 60 (7): 3013-3029. [PubMed] [Google Scholar] 55. Захарату Ярлског К., Ли К., Болч В.Е., Сюй XG, Паганетти Х. Оценка органо-специфических эквивалентных доз нейтронов в протонной терапии с использованием компьютерных возрастных воксельных фантомов для всего тела. Phys Med Biol. 2008; 53 (3): 693-717. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Атар Б.С., Беднарз Б., Секо Дж., Хэнкокс К., Паганетти Х. Сравнение доз фотонов вне поля при IMRT 6 МВ и доз нейтронов при протонной терапии для взрослых и детей.Phys Med Biol. 2010; 55 (10): 2879-2891. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Lomax AJ. Протонная терапия с модуляцией интенсивности и ее чувствительность к неопределенностям лечения 2: потенциальные эффекты межфракционных и межполевых движений. Phys Med Biol. 2008; 53 (4): 1043-1056. [PubMed] [Google Scholar] 58. Лин Х, Динг Х, Кирк М. и др. . Краниоспинальное облучение в положении лежа на спине с использованием метода сканирования карандашным пучком протонов без изменения линий совпадения для полевых стыков. Int J Radiat Oncol Biol Phys .2014; 90 (1): 71-78. [PubMed] [Google Scholar] 59. Хоппе Б.С., Менденхолл Н.П., Луи Д., Ли З., Флампури С. Сравнение задержки дыхания и свободного дыхания во время лучевой терапии с модуляцией интенсивности и протонной терапии у пациентов с лимфомой Ходжкина средостения. Int J Part Ther. 2017; 3 (4): 492-496. [Google Scholar] 60. О’Брайен Р.Т., Купер Б.Дж., Кипритидис Дж., Шие С.К., Килл П.Дж. Компьютерная томография с четырехмерным конусным лучом, управляемая дыхательным движением: определение нерегулярного дыхания. Phys Med Biol. 2014; 59 (3): 579-595.[PubMed] [Google Scholar] 61. Wong JW, Sharpe MB, Jaffray DA, et al. . Использование активного контроля дыхания (ABC) для уменьшения запаса дыхательных движений. Int J Radiat Oncol Biol Phys. 1999; 44 (4): 911-919. [PubMed] [Google Scholar] 62. Pinnix CC, Cella L, Andraos TY и др. . Предикторы гипотиреоза у выживших после лимфомы Ходжкина после модуляции интенсивности по сравнению с трехмерной лучевой терапией. Int J Radiat Oncol Biol Phys. 2018; 101 (3): 530-540. [Бесплатная статья PMC] [PubMed] [Google Scholar]Рекомендации Международной группы радиационной онкологии лимфомы
Кровь.2018 окт 18; 132 (16): 1635–1646.
, 1 , 2 , 3 , 4 , 5, 6 , 2 , 7 , 8 , 9 , 10 9000Бутхайна Шбиб Дабая
1 Отделение радиационной онкологии, Онкологический центр доктора медицины Андерсона Техасского университета, Хьюстон, Техас;
Брэдфорд С. Хоппе
2 Отделение радиационной онкологии, Университет Флориды, Джексонвилл, Флорида;
Джон П.Plastaras
3 Отделение радиационной онкологии Пенсильванского университета, Филадельфия, Пенсильвания;
Уэйн Ньюхаузер
4 Департамент радиационной физики, Университет Луизианы, Батон-Руж, Луизиана;
Катерина Розолова
5 Отделение протонной терапии, Центр протонной терапии Чехия, Прага, Чехия;
6 Отделение онкологии, Карлов университет в Праге и университетская больница Мотол, Прага, Чешская Республика;
Стелла Флампури
2 Отделение радиационной онкологии, Университет Флориды, Джексонвилл, Флорида;
Радхе Мохан
7 Отделение радиационной физики, Онкологический центр им. М.Д. Андерсона Техасского университета, Хьюстон, Техас;
Н.Джордж Михаил
8 Отделение радиационной онкологии, Госпиталь Гая и Св. Томаса, Лондон, Соединенное Королевство;
Юлия Кирова
9 Отделение радиационной онкологии, Институт Кюри, Париж, Франция;
Лена Шпехт
10 Отделение онкологии, Rigshospitalet, Университетская больница Копенгагена, Копенгаген, Дания; и
Иоахим Яхалом
11 Отделение радиационной онкологии, Мемориальный онкологический центр Слоуна Кеттеринга, Нью-Йорк, Нью-Йорк
1 Отделение радиационной онкологии Техасского университета Онкологический центр Андерсона, Хьюстон, Техас;
2 Отделение радиационной онкологии, Университет Флориды, Джексонвилл, Флорида;
3 Отделение радиационной онкологии Пенсильванского университета, Филадельфия, Пенсильвания;
4 Департамент радиационной физики, Университет Луизианы, Батон-Руж, Луизиана;
5 Отделение протонной терапии, Центр протонной терапии Чехия, Прага, Чехия;
6 Отделение онкологии, Карлов университет в Праге и университетская больница Мотол, Прага, Чешская Республика;
7 Отделение радиационной физики, Онкологический центр им. М. Д. Андерсона Техасского университета, Хьюстон, Техас;
8 Отделение радиационной онкологии, Гая и Св.Thomas ‘Hospital, Лондон, Великобритания;
9 Отделение радиационной онкологии, Институт Кюри, Париж, Франция;
10 Отделение онкологии, Rigshospitalet, Университетская больница Копенгагена, Копенгаген, Дания; и
11 Отделение радиационной онкологии, Мемориальный онкологический центр им. Слоуна Кеттеринга, Нью-Йорк, Нью-Йорк
Автор, отвечающий за переписку.Поступило 08.03.2018 г .; Принято 19 июля 2018 г.
Авторские права © Американское общество гематологов, 2018 г.Эта статья цитируется в других статьях в PMC.Abstract
Среди взрослых, переживших лимфому, методы лучевой терапии, которые увеличивают избыточную дозу облучения органов риска (OAR), подвергают пациентов риску увеличения побочных эффектов, особенно поздней токсичности. Сведение к минимуму облучения ОАР у взрослых пациентов с Ходжкинскими и неходжкинскими лимфомами с поражением средостения является решающим фактором при выборе метода лечения. Протонная терапия может помочь снизить дозу облучения OAR и снизить токсичность, особенно риск сердечных заболеваний и вторичного рака.Поскольку протонная терапия может иметь некоторые недостатки, важно выявить пациентов и обстоятельства, при которых протонная терапия может принести наибольшую пользу. Мы представляем современные рекомендации по выявлению взрослых пациентов с лимфомой, которые могут получить наибольшую пользу от протонной терапии, а также анализ преимуществ и недостатков протонной терапии.
Введение
Снижение связанных с лечением токсических эффектов у выживших после Ходжкина и неходжкинских лимфом стало краеугольным камнем последних достижений в лечении гематологических злокачественных новообразований.Долгосрочные последующие исследования пациентов с гематологическими злокачественными новообразованиями предоставили убедительные и надежные доказательства того, что преимущества ионизирующего излучения могут быть смягчены увеличением смертности и заболеваемости, особенно от вторичных злокачественных новообразований и сердечных осложнений. 1 Эти результаты послужили толчком к огромным усилиям по поиску способов минимизировать побочный ущерб от радиации соседним органам грудной клетки, подверженным риску (OAR). Некоторые из этих способов включали трехмерную (3D) конформную лучевую терапию и лучевую терапию с модуляцией интенсивности (IMRT). 2-5 Протонная терапия с ее уникальными характеристиками – более низкой входной дозой, пиком высокой дозы и резким спадом около конца диапазона пучка – представляет еще одну возможность для более конформного распределения дозы и лучшего сохранения OAR. 1,6,7
Руководство представляет собой набор согласованных рекомендаций экспертов-радиологов-онкологов и физиков из различных международных академических центров. Рекомендации передовой практики, включая потенциальные преимущества или вред, были основаны на обширном обзоре опубликованной литературы.Каждая включенная рекомендация была достигнута консенсусом более 80% авторов документа; в статье приводится обоснование рекомендаций, а также подробное объяснение рекомендаций, которые стали предметом многочисленных споров среди авторов.
Представленные здесь руководящие принципы включают обзор протонной терапии взрослых лимфом с поражением средостения, подробное обсуждение передовых практик вместе с примерами случаев, в которых протоны дают преимущество, и ссылки на области, в которых требуются дальнейшие исследования.Хотя протонная терапия полезна для лечения других анатомических участков, мы сосредотачиваемся на средостении из-за большого количества доступных данных. перечисляет полезные определения технических терминов, используемых в статье.
Таблица 1.
| Термин | Определение |
|---|---|
| Общий объем опухоли (GTV) | Объем, содержащий видимую протяженность опухоли, которую можно определить по контуру и нацелить с помощью компьютерной томографии |
| Объем клинической опухоли (CTV) | Объем, содержащий подозрение на микроскопическое заболевание; это может быть около крупной опухоли или в исходном месте после достижения полной ремиссии после химиотерапии |
| Планируемый целевой объем | Объем, содержащий GTV и CTV; кроме того, он учитывает все неопределенности, такие как движение внутренних органов и ежедневные ошибки настройки пациента |
| 3D-планирование лучевой терапии | Перспективное планирование, определение анатомии на компьютерной томографии, идентификация цели и создание схемы луча излучения для наилучшего охвата цель; генерировать дозу облучения, которую оператор считает приемлемой |
| IMRT | Оператор заранее вводит в систему планирования желаемую дозу для цели и органов, подверженных риску, и то, как должно выглядеть конечное распределение дозы, затем программное обеспечение инвертирует проблема и пусть компьютер через математическую итерацию ищет лучшее и оптимизированное решение; программное обеспечение будет продолжать попытки до тех пор, пока оператор не сочтет план приемлемым |
| Линейная передача энергии (LET) | Общее количество энергии, выделенной на единицу расстояния в биологических материалах под действием ионизирующего излучения |
| Радиобиологический эквивалент | Относительное радиационное биологическое эффективность в зависимости от ЛПЭ, типа радиационной частицы, общей дозы и фракционирования дозы |
| Активное сканирование протонов | Доставка пучка протонов с помощью стержневого пучка, который точно направляется через терапевтический объем, с использованием магнита в линии пучка; затем доза наносится слой за слоем, обеспечивая хорошую конформацию |
| Пассивное рассеяние протонов | Пространственно равномерное распределение дозы, достигаемое за счет формирования луча с помощью набора устройств на пути луча |
| Протонная терапия с модуляцией интенсивности | Дальнейшая форма активного сканирования дистального отдела опухоли для выявления опухолей неправильной формы |
Консенсусные рекомендации
Пациенты с лимфомой, которым протонная терапия может принести большую пользу, включают (1) пациентов с заболеванием средостения, которое распространяется ниже начала левого главного ствола коронарная артерия – кпереди, кзади или слева от сердца; (2) молодые пациенты женского пола, для которых протонная терапия может снизить дозу груди и риск вторичного рака груди; и (3) пациенты, прошедшие интенсивное предварительное лечение, которые подвергаются более высокому риску радиационной токсичности для костного мозга, сердца и легких.
При использовании протонной терапии лечащие врачи должны (1) продемонстрировать расчетным путем, что она обеспечивает большую пользу пациенту по сравнению с оптимально запланированной фотонной терапией; (2) задокументировать медицинскую необходимость протонной терапии, в том числе рассмотрение вопросов для выживших в течение длительного времени и рисков поздних радиогенных эффектов; (3) понимать сложность планирования протонов лимфомы, включая необходимость управления неопределенностями, и развивающийся характер технологии с развитием сканирования карандашным лучом, объемной визуализации в помещении и оптимизации надежности; и (4) использовать задержку дыхания на глубоком вдохе (DIBH), когда это дополнительно минимизирует дозы для OAR, с пониманием повышенной сложности использования DIBH с протонной терапией по сравнению с фотонной терапией.
Различные методы проведения протонной терапии
Было проведено несколько дозиметрических исследований по сравнению протонных и фотонных планов 8-21 с целью установить пользу и показания для использования протонной терапии при лимфоме, причем подавляющее большинство из них было сосредоточено на поражение средостения. Они показали, что у пациентов со снижением дозы на сердце, легкие и грудь с помощью протонной терапии есть индивидуализированная и потенциальная выгода по сравнению с 3D конформной лучевой терапией или IMRT. 1 Кроме того, отсутствие краевых рецидивов, которых опасаются при использовании высококонформной терапии, такой как протонная терапия, сделало это лечение привлекательным. 22-24
Поскольку величина дозиметрической пользы значительно варьируется в зависимости от конкретного случая, каждый случай необходимо рассматривать индивидуально, а потенциальную пользу от использования протонов следует соотносить с доступностью лечения (необходимо путешествовать), наличные расходы в случае отказа в страховом покрытии, необходимые ресурсы в виде медицинского и физического персонала, а также потенциальные неопределенности, связанные с протонной терапией.
Свойства протонного пучка
Протоны – это заряженные частицы, которые выделяют излучение за счет линейной передачи энергии (ЛПЭ), теряют мало энергии при попадании в ткань и откладывают большую часть при замедлении непосредственно перед остановкой, что приводит к эффекту пика Брэгга. 25 Поскольку положение пика сильно зависит от плотности ткани на пути луча, протонная терапия страдает от неопределенностей диапазона, которые клиницисты должны понимать, чтобы наилучшим образом использовать эту технологию.
Неопределенности протонной терапии и способы их смягчения
Некоторые из проблем, связанных с протонной терапией, – это неопределенности, связанные с диапазоном проникновения пучка в ткани и изменением величины биологических эффектов на пути пучка протонов. Неопределенности в вычислении диапазона проникновения протонов в ткань имеют два основных потенциальных источника: (1) ошибки диапазона, вызванные изменениями плотности ткани из-за ошибок в настройке (позиционировании пациента), движением органов (например, связанных с дыханием или сердцем) или анатомическими изменениями. (например, деформация ткани и сжатие опухоли), которые в совокупности вызывают изменения в пути и дальности луча, которые могут вызвать несоответствия между запланированным и проведенным лечением, и (2) входные данные, используемые для планирования диапазона луча (т. е. преобразование компьютерной томографии [CT] число в линейную тормозную способность протона).Другим важным источником неопределенностей является изменение величины биологического эффекта (описываемого в терминах относительной биологической эффективности [ОБЭ]) протонов вдоль пути луча, который влияет на мишени и нормальные ткани.
Неопределенность диапазона из-за изменений плотности
Один потенциально большой источник неопределенности диапазона связан с анатомическими изменениями пациента. В частности, текущий стандарт лечения использует объемные изображения в качестве основы для создания плана лучевой терапии на несколько дней или даже недель спустя.Во время лечения распределение доставленной дозы будет отклоняться от запланированного распределения из-за изменений положения или размера пациента и опухоли. Эти изменения не так важны для фотонной терапии, но они могут иметь сильное влияние на распределение дозы протонной терапии в осевом и латеральном направлениях пучка. Из них осевые отклонения являются синонимом погрешностей диапазона; если линейная тормозная способность (тесно связанная с массовой плотностью) любого вокселя пациента изменяется (относительно его значения, используемого для планирования лечения), то диапазон всех протонов, проходящих через этот воксель, также изменится. 26
Для решения дозиметрических неопределенностей, связанных с анатомическими изменениями, было разработано множество стратегий. 27,28 Надежные инструменты оптимизации теперь позволяют пользователям включать неопределенности дальности, ошибки настройки и физиологическое движение путем включения результатов нескольких компьютерных томографий (например, 4-мерного [4D] CT) в процессы оптимизации плана и расчета дозы. Эффективность этих инструментов можно оценить с помощью анализа устойчивости, который включает расчет распределения доз для различных сценариев ошибок.Семейства гистограмм доза-объем (DVH) клинических целевых объемов (CTV) и OAR для нескольких сценариев неопределенностей (т. Е. Сдвигов по направлениям x, y и z и связанных с ними неопределенностей диапазона) проверяются перед проведением лечения, чтобы гарантировать приемлемость плана. Обычно для оценки используется DVH «наихудшего случая» диапазона (). 29,30
Анализ устойчивости на основе DVH, показывающий несколько сценариев, представляющих различные неопределенности и их результирующее влияние на распределение дозы для конкретного органа, подверженного риску, или цели.
Помимо возмущений дозы на периферии протонного поля, интерференция между динамическим карандашным лучом с движением цели и другими окружающими анатомическими элементами приводит к локальным неоднородностям дозы внутри цели. Это взаимодействие между анатомическим движением, вызванным дыханием, и сканированием точек может привести к появлению «горячих» и «холодных» областей дозы в целевом объеме. Поля не могут компенсировать эффект взаимодействия, но могут помочь другие решения, включая одно или несколько из следующих: перекраска пятна, увеличение размера пятна, стробирование или методы уменьшения движения. 8 Доступны некоторые алгоритмы робастной оптимизации 4D, которые могут учитывать изменения плотности, но информация о времени, необходимая для расчета взаимодействия, не включена в эти алгоритмы.
Расхождения между расчетным и фактическим пробегами протонов в ткани
Этот источник неопределенности является результатом преобразования единиц Хаунсфилда, полученных при компьютерной томографии, в относительную тормозную способность протонов ткани, воспроизводимость протонного пучка, погрешности измерения воды при вводе пучка в эксплуатацию и ошибки в диапазоне изготовление компенсатора. 31 Хотя величина этих типов неопределенностей специфична для каждой протонной системы (включая компоненты доставки, построения изображений и вычислений), отдельные учреждения могут использовать «рецепты маржи» для обеспечения целевого охвата. Такие рецепты обычно основаны на формулировке, введенной Мойерсом и др. 32 : дистальный край = α% глубины + β мм, где α связано с погрешностями в вычислении дозы, а β связано с ошибками, не зависящими от расчет дозы.
Неопределенности в ОБЭ
В современной клинической практике предполагается, что ОБЭ протонов по сравнению с фотонами высоких энергий имеет постоянное значение 1,1. В действительности ОБЭ варьируется и является сложной функцией нескольких величин, включая ЛПЭ от протонов к локальной среде, дозу на фракцию, тип ткани и клетки, оксигенацию, биологические или клинические конечные точки и другие факторы. 33 Оценки воздействия этих факторов на ОБЭ доступны в исследованиях in vitro, но данные in vivo на людях все еще отсутствуют. 26 Тем не менее, имеющиеся данные предполагают, что ОБЭ протона может увеличиваться на пике Брэгга, возможно, более быстро и нелинейно на дистальном крае. Поскольку LET увеличивается по мере уменьшения энергии протонов с глубиной, что приводит к повышенным LET и связанным значениям RBE в конце протонного диапазона, это вызывает опасения, когда дистальный конец лечебного поля направлен в сторону чувствительных OAR. Существуют разногласия по поводу протяженности области, в которой RBE отклоняется от 1,1, и она может быть> 1.1. Принято считать, что чем выше разброс по энергии и диапазону, тем большее смешение по диапазону мы видим, что объясняет изменчивость дозы в конце пика Брэгга. 34,35 С другой стороны, другие исследователи считают это отклонение небольшим (несколько миллиметров вокруг пика Брэгга). Поскольку планирование на основе RBE или даже на основе LET коммерчески недоступно, используются эмпирические методы для защиты структур от увеличения RBE, включая снижение физической дозы на OAR на дистальном краю луча, использование нескольких полей для пространственного разбавления эффект, смещение диапазона одного и того же поля, облучение мимо чувствительных структур или разрешение дыхательных / сердечных движений сглаживать дозу для движущихся OAR.
Клинические проявления и применение протонной лучевой терапии
Пациенты с заболеванием средостения, особенно молодые женщины, сталкиваются с проблемой лечения, в которой протонная терапия может быть очень полезной. В этом разделе рассматриваются общие цели и проблемы в конкретных клинических ситуациях.
Независимо от типа излучения, которое будет использоваться, основные правила клинической оценки плана лучевой терапии заключаются в достижении следующего: (1) охват планируемого целевого объема (PTV) ≥95% дозы; (2) минимизировать дозу на субструктуры сердца, включая коронарные артерии, левый желудочек и клапаны, 36 , насколько это возможно; (3) свести к минимуму облучение груди с уделением первоочередного внимания предотвращению облучения больших объемов груди у молодых женщин (<35 лет) 37 ; и (4) минимизировать дозу для легких, включая V 5 , V 20 , V 30 и среднюю дозу. 38 суммирует эти моменты и может быть полезным в качестве руководства для выполнения этих требований. 38-41
Таблица 2.
Руководство по приемлемым дозам, объему и учету полей
| Структуры | Идеал | Техника оптимизации | Оптимизация поля (с учетом уменьшения поля) | Неприемлемо | посадка максимальной дозы в |
|---|---|---|---|---|---|
| Сердце: левый желудочек, коронарные артерии, клапаны 39-41 | Среднее <5 Гр | Среднее, 5-15 Гр | Среднее> 15 Гр | Среднее> 30 Гр | Коронарные сосуды |
| Грудь (в зависимости от возраста) * | Среднее <4 Гр | Среднее, 4-15 Гр | Среднее> 15 Гр | Среднее> 30 Гр | Железистая ткань |
| V 5 <55% | V 5 , 55-60% | – | V 5 > 60% | ||
| V 20 <30% | Среднее, 10-13.5 Гр | Среднее> 13,5 Гр | |||
| Среднее <10 Гр | |||||
| Щитовидная железа 62 | V 25 <62,5% | V | 25%V 25% | 25%Вся щитовидная железа |
Следует иметь в виду, что в существующих системах планирования клинического лечения отсутствуют некоторые ключевые возможности, необходимые для создания, оптимизации или оценки возможных планов лечения. В частности, рассеянное радиационное облучение обычно недооценивается за пределами области лечения на несколько сантиметров, что исключает обычные прогнозы риска, основанные на радиационном воздействии. 42 Точно так же их возможности моделирования рисков ограничены, если они вообще присутствуют. 43,44
Учет дозы на сердце
Связь заболевания с ОАР определяет ситуации, в которых протонная терапия наиболее эффективна. В частности, что касается заболеваний сердца и его подструктур, опубликованные результаты показывают, что средние дозы на сердце> 15 Гр связаны с повышенным риском сердечных заболеваний. 39 Средняя доза на сердце – приблизительная оценка, используемая довольно часто 45 ; механистически, однако, ишемическая болезнь сердца, вероятно, зависит от средней дозы на сердце, а также от максимальной дозы на субструктуры сердца, 46,47 , особенно в отношении атеросклероза коронарных сосудов.Следовательно, следует помнить об объеме высокой дозы, особенно в отношении потенциальной неопределенности ОБЭ для пучков, которые заканчиваются в пределах нескольких миллиметров от коронарных сосудов. 21
Для целей этой статьи в протонных и фотонных планах на всех показанных иллюстрациях используется DIBH, наклонная доска для женщин, чтобы еще больше избежать груди, и, для IMRT, техника бабочки. 48-51
Сценарий 1: медиастинальная цель полностью над сердцем без вовлечения подмышек
Отрыв левой основной стволовой коронарной артерии используется для определения того, находится ли цель выше или ниже сердца ().В этом примере () экспонирование сердца вполне сопоставимо, независимо от того, какой метод используется. Различия в DVH, а также в средней дозе для других структур аналогичны планам для протонов и IMRT.
Три сценария связи между заболеванием средостения и сердцем. (A) Показывает, как использовать отрыв левой основной стволовой коронарной артерии (обведен розовым цветом) для определения расположения верхнего и нижнего средостения. (B) Сценарий 1: КТ-изображения коронарной артерии 28-летнего мужчины с первичной лимфомой средостения до (i) и после (ii) 6 курсов ритуксимаба, циклофосфамида, доксорубицина, винкристина, преднизона (RCHOP) химиотерапии, представляющей для консолидации с радиация.(Biii) Аксиальный, коронарный и сагиттальный виды плана IMRT (верхние панели) и протонного плана (нижние панели). (Biv) Соответствующие средние дозы для критических структур с использованием IMRT против протонов. (C) Сценарий 2: КТ-изображения коронковой части 25-летнего мужчины с лимфомой Ходжкина до (i) и после (ii) 4 курсов химиотерапии доксорубицином, блеомицином, винбластином и дакарбазином (ABVD) для консолидации с помощью излучения. (Ciii) Аксиальный, коронарный и сагиттальный виды плана IMRT (верхние панели) и протонного плана (нижние панели).(Civ) Соответствующие средние дозы для критических структур с использованием IMRT против протонов. (D) Сценарий 3: КТ-изображения коронарной артерии 30-летнего мужчины с рецидивирующей лимфомой Ходжкина, как показано на коронарных изображениях ПЭТ / КТ-сканирования (i-ii) для окончательного облучения. (Diii) Осевые, корональные и сагиттальные виды плана IMRT (верхние панели) и протонного плана (нижние панели). (Div) Соответствующие средние дозы для критических структур с использованием IMRT по сравнению с протонами.
Сценарий 2: цель охватывает правую часть сердца
Для целей в правой части сердца IMRT часто обеспечивает сопоставимые дозы для сердца и других структур, как протонная терапия.Примечательно, однако, что даже когда протонные планы дают дозиметрическое преимущество перед планами IMRT, величина преимущества может варьироваться в зависимости от случая, и его нужно оценивать индивидуально. Например, для пациента, показанного на, средние дозы для критических структур от протонной терапии достаточно ниже, чем от IMRT, чтобы предположить, что протонная терапия может быть предпочтительнее из-за большого объема, охватывающего правую часть сердца. Этот пример демонстрирует необходимость тщательного рассмотрения отдельных случаев перед принятием решения о лечении.
Сценарий 3: цель находится с обеих сторон сердца
Заболевание, которое распространяется значительно впереди сердца спереди, сзади или слева, представляет собой особую проблему для IMRT; поэтому протонная терапия может быть лучшим планом. Примечательно, что токсичность для сердца и легких не устраняется с помощью протонной терапии; скорее, доза для сердца может быть ниже, чем IMRT. Таким образом, в подобных случаях клиницисты должны тщательно взвесить терапевтическую пользу с долгосрочными рисками радиационно-индуцированной токсичности лечения, прежде чем принимать решение о том, какой метод следует использовать.В самом деле, в этом случае протонная терапия может значительно избежать воздействия на сердце, и ее следует искать в попытке снизить дозу на субструктуры сердца.
Учет поражения подмышечных впадин
Протонная терапия может значительно снизить дозу облучения груди за счет специального использования полей, которые входят сзади и не выходят через грудь. В качестве альтернативы, если нельзя использовать протоны, вместо них можно использовать другие методы смещения груди, такие как использование наклонной доски или физическое перемещение груди с пути луча.показывает, как протонная терапия может защитить грудь в случае поражения подмышечных впадин.
Поражение подмышечных впадин при презентации. (A) Аксиальный, коронарный и сагиттальный виды протонного плана (слева) и плана IMRT (справа) для пациента с поражением подмышек. Использование протонной терапии в этом случае щадит левую грудь. (B) Независимо от того, какой метод лечения выбран, IMRT (левая панель) и протонная (правая панель), ограничение объема, подвергаемого облучению, должны включать внимание к избеганию ванны с низкой дозой.(C) Предельная доза для легких. Если основной целью данного пациента является предотвращение поражения легких, особенно если пациент прошел легочную токсическую химиотерапию (например, любую комбинацию блеомицина, бусульфана, гемцитабина, брентуксимаба и т. Д.), Протонная терапия может лучше избавить легкие за счет уменьшения ванна с малой дозой облучения фотонами.
Рассмотрение дозы в груди
Долгосрочный риск развития рака груди связан с воздействием высоких и низких доз радиации. 37,52 Особенно при лечении молодых пациентов следует направлять усилия на поддержание максимально низкой дозы облучения тканей груди.В большинстве случаев, связанных с заболеванием средостения, подмышечная впадина не задействована, и доза облучения груди при IMRT или протонной терапии будет небольшой. Хотя IMRT приводит к тому, что большие объемы ткани молочной железы получают низкие дозы излучения, в некоторых случаях протонная терапия может привести к увеличению объемов ткани молочной железы, получающей высокие дозы излучения. Неизвестно, важнее ли минимизировать порцию с низкой дозой по сравнению с частью с высокой дозой; впоследствии средняя доза груди продолжает оставаться лучшим фактором для оценки различных планов.Однако в настоящее время высокая доза для небольшого объема обычно предпочтительнее, чем низкая доза для большого объема, основываясь на данных, предполагающих, что низкие дозы 4 Гр 37 могут быть связаны с риском долгосрочных вторичных злокачественных новообразований. особенно у пациентов моложе 24 лет. Хотя расчет дозы Travis et al. 37 относится к точечной дозе (а не к средней), мы все же рекомендуем проявлять осторожность, пытаясь сохранить среднюю дозу на грудь ≤ 4 Гр.
Когда необходимо покрыть внутригрудную болезнь, доза для груди может увеличиться, и избежать попадания в грудь становится трудно при использовании любого метода (протонного или фотонного).При выборе метода лечения для таких случаев необходимо учитывать дозы, получаемые другими критическими структурами, такими как сердце и легкие, особенно у пациентов, ранее лечившихся и получавших тяжелое лечение. Однако при рассмотрении того, как наилучшим образом ограничить объемы, подвергающиеся облучению, не менее важно избегать «ванн с малыми дозами» (т.е. облучения больших объемов низкими дозами), независимо от того, какой метод используется ().
Учет дозы в легких
С появлением планирования лимфомы средостения на основе КТ доза в легкие теперь может быть коррелирована с риском пневмонита.Рекомендуется ограничивать дозу для легких: V 5 <55%, средняя доза для легких <13,5 Гр и V 30 <20%. Эти значения более достижимы при использовании DIBH. 38 Хотя средняя доза в легких 13,5 Гр была связана с более низким риском пневмонита, рекомендуется стремиться к более низкой дозе, что довольно часто достижимо при использовании строгих ограничений. Например, когда используется IMRT, важно ограничить лучи некоторыми вариациями переднезадних лучей, избегая боковых лучей.Если основной целью данного пациента является предотвращение поражения легких, особенно если этот пациент получил легочную токсическую химиотерапию (например, блеомицин, бусульфан, гемцитабин, брентуксимаб), протонная терапия может лучше избавить легкие за счет уменьшения количества наблюдаемых ванн с низкой дозой с фотонами ().
Современные методы протонно-лучевой терапии
Протонная терапия с пассивным рассеянием
Протонная терапия с пассивным рассеянием (PSPT) – наименее сложный метод доставки протонов; луч расширяется в поперечном направлении за счет размещения рассеивающего материала на пути луча.Колеса модулятора диапазона или гребневые фильтры используются для создания расширенного пика Брэгга, области плоского распределения дозы, предназначенной для покрытия цели в поперечном и продольном направлениях. Полный пик Брэгга доставляется почти мгновенно (<0,1 секунды), поэтому нет взаимодействия между пучком протонов и физиологическим движением во время доставки, что делает PSPT наиболее надежной формой доставки протонов. 53
Проблемы при планировании PSPT
Соответствие целевой неоднородности (например, смежные подобъемы разного размера, формы и глубины) является сложной задачей; Лучи PSPT могут прилегать только к одной стороне мишени, проксимально или дистально.Кроме того, большие цели часто требуют согласования полей из-за ограниченного максимального размера рассеянных лучей. Неоднородность дозы, создаваемая согласованными лучами, смягчается за счет изменения согласованных линий, что увеличивает сложность лечения.
Управление движением в PSPT требует использования точного анализа движения, адекватного определения запаса и методов уменьшения движения. Для процедур свободного дыхания используется 4D CT для оценки смещения цели перпендикулярно лучу и для увеличения ширины луча.Вдоль луча движение оценивается по максимальной разнице в водоэквивалентной глубине от поверхности пациента до дистального края мишени для каждого луча на основе изменений плотности 4D CT и учитывается с помощью смазывания компенсатора. DIBH уменьшает движение цели и учитывает границы раздела тканей.
Плановая цель – CTV; когда на обрабатываемую область воздействует дыхательное движение, плановой целью является внутренний целевой объем (ITV), который охватывает движение CTV, отображаемое на 4D компьютерных томограммах.В качестве альтернативы, если лечение будет проводиться с помощью DIBH, ITV может быть получен из положений CTV, воспроизведенных из нескольких сканирований DIBH. Для формирования бокового луча расширение запаса для формирования PTV учитывает неопределенность настройки, а межфракционная изменчивость анатомии применяется к CTV / ITV. Коллиматоры пучка, ориентированные на пациента, согласовывают дозу латерально с PTV с запасом на полутень. В зависимости от целевой глубины и прилегающих тканей эти поля варьируются от 5 до 10 мм. Компенсаторы диапазона разработаны для каждого луча, чтобы дистально согласовать дозу с CTV / ITV.Смазка компенсатора диапазона в пределах радиуса, соответствующего допускам установки и движению ткани, применяется для учета изменений дальности действия протонов, вызванных изменениями плотности на пути луча. Кроме того, вдоль каждого луча дистальные и проксимальные границы устанавливаются на CTV / ITV для компенсации неопределенностей дальности протонов, как описано в разделе «Неопределенности дальности из-за изменений плотности». Несколько лучей (по сравнению с одним лучом) можно использовать для увеличения конформности дозы и уменьшения неопределенности дозы за счет распространения лучей в различных направлениях.Предпочтительно использовать переднее или заднее поля, а не оба, из-за необходимости избегать ненужного луча через сердце ().
Пример подхода с использованием 2 передних полей с протонной терапией, который может лучше защитить сердце и пищевод (справа) по сравнению с передним / задним доступом (слева).
Протонная терапия со сканированием карандашным лучом
По сравнению с PSPT, протонная терапия со сканированием карандашным лучом в активном режиме (PBSPT) предлагает потенциал для лучшей конформности и экономии OAR. 54 Поскольку лечение включает доставку индивидуально контролируемых точек, неоднородные дозы могут быть созданы намеренно. PBSPT может доставлять более низкие дозы в OAR за счет своей способности согласовывать дозу в непосредственной близости от мишени, за счет улучшенной конформности, удаленной от мишени, и за счет уменьшения образования вторичных нейтронов, образующихся в аппарате для лечения. 55,56 Однако поперечная ширина полутени некоторых неколлимированных сканируемых лучей может быть больше, чем у коллимированных пучков пассивно рассеянных протонов.Когда каждое сканированное лечебное поле используется для лечения целого объекта, этот метод называется «однородной дозой для одного поля». Конформность может быть дополнительно улучшена с использованием подхода с модуляцией интенсивности (т. Е. Протонной терапии с модуляцией интенсивности), в которой каждый пучок используется для обработки только части объема мишени; эта методика аналогична IMRT по принципу «шаг-и-стреляй». По сравнению с лучами PSPT, поля PBSPT больше, поэтому большие цели можно обрабатывать без согласованных полей. Однако, когда требуются совпадения, PBSPT позволяет «согласование градиента», 57,58 , что устраняет необходимость изменения линии совпадения.Согласование градиента можно использовать для встречных лучей, нацеленных на разные области сложных целевых объемов, как описано ниже.
Проблемы PBSPT
По сравнению с PSPT, PBSPT более чувствителен к изменениям плотности на пути луча; таким образом, управление движением имеет первостепенное значение. В то время как межфракционные изменения и уменьшение опухоли могут потребовать адаптивного планирования при PSPT, повышенная чувствительность к вариациям пути луча делает это еще более важным при использовании PBSPT.
Управление движением
Использование PBSPT требует пристального внимания к оценке внутрифракционного движения, которое обычно связано с дыхательным циклом.Технику свободного дыхания можно безопасно использовать при выполнении определенных условий. 54 Использование PBSPT со свободным дыханием требует 4D компьютерной томографии для оценки движения внутренних структур во время дыхательного цикла. Надежность повышается за счет использования стратегии перекраски, которая снижает вероятность эффекта взаимодействия. Для пациентов с целевым движением, превышающим 5 мм за дыхательные циклы, могут использоваться альтернативные стратегии, такие как DIBH, респираторное стробирование, сжатие живота или изменение положения.
Что касается расположения пациента, важно обеспечить воспроизводимость между фракциями. По сравнению с PSPT, PBSPT требует еще более строгой воспроизводимости из-за его большей чувствительности к изменениям плотности на пути луча.
Что касается расположения полей, метод PBSPT для переднего верхнего средостения и нижней части шеи обычно требует 1 (перекрашенный) или 2 передних поля. Для более сложных целевых объемов цели могут быть разделены на 2 или более частей (например, CTV шеи, CTV средостения и CTV подмышек), и может использоваться многополевой план ().В случаях, когда затрагиваются нижние (задние) и верхние (передние) мишени средостения, комбинация задних и передних полей может максимально защитить сердце и легкие (). Для целей в верхней части шеи боковые или задние поля могут избегать структур полости рта / слюнной железы. Для подмышечных мишеней заднее поле может помочь сохранить ткань груди. Хотя эти различные конфигурации полей могут использоваться в PSPT, согласование градиентов в PBSPT проще, когда поля перекрываются или противоположны, что устраняет необходимость в размытии.
Планы PBSPT с однородной дозой в одном поле и согласованием градиента с использованием передних и задних лучей для лечения заболевания, которое затрагивает двустороннюю верхнюю часть шеи и средостение (заболевание перед правыми отделами сердца).
Сканирование молодой женщины, у которой мишень включала средостение, левую парастернальную и левую подмышечную области. Одно переднее поле использовалось для средостения, а отдельное заднее поле – для подмышечной области.
Проверка положения пациента и распределения дозы в PSPT или PBSPT
Системы доставки протонов оснащены системами визуализации ортогональных кВ, используемых для ежедневной настройки пациента. В более новых системах есть КТ с коническим лучом. Хотя планы PSPT и PBSPT могут быть составлены с учетом ошибок настройки и движения дыхания, рекомендуется проверка дозы. Описанные ранее границы не защищают от непредсказуемых изменений, которые происходят во время курса лечения, таких как прогрессирование лимфомы, плевральный выпот, пневмония или потеря веса.Если установка лечения под контролем изображения не основана на трехмерной визуализации, рекомендуется повторить верификационную КТ-визуализацию и пересчитать дозу для проверки точности лечения. Рекомендуется адаптивное планирование (например, при рефрактерном рецидиве), когда целевой охват не поддерживается или ограничения по дозе OAR нарушаются во время курса лечения
Планирование лечения
Определение цели и границы
Определение цели соответствует современному определению облучения пораженных участков, ранее опубликованные Международной группой радиационной онкологии лимфомы (ILROG). 3 CTV / ITV и нормальные структуры разграничиваются таким же образом для протонной терапии и для фотонной терапии. Из-за неопределенностей в диапазоне протонов обоснованность концепции PTV сомнительна. В текущей практике PSPT поля для CTV назначаются для каждого луча, а боковые поля такие же, как для фотонов; однако дистальный и проксимальный края зависят от глубины дистального и проксимального краев мишени. Это приводит к тому, что называется «зависимым от луча PTV». Эта практика не применима к протонной терапии с модуляцией интенсивности, для которой рекомендуется надежная оптимизация.
Управление движением
4D компьютерная томография может помочь установить степень анатомического движения, вызванного дыханием, и соответствующее расширение ITV. Однако это вносит дополнительную неопределенность; для смягчения последнего необходимо увеличить объем излучения. Таким образом, использование DIBH идеально подходит для уменьшения подвижности средостения и его изменения формы в зависимости от дыхания (тоньше при вдохе, шире при свободном дыхании) (). 59 Это достигается путем сбора анатомических данных в фиксированной респираторной фазе.DIBH может иметь дополнительное преимущество, заключающееся в смещении сердца вниз, а также в расширении легких от цели, потенциально снижая дозу, полученную этими OAR.
Использование DIBH может помочь справиться с некоторыми неопределенностями, связанными с использованием протонной терапии. По сравнению со свободным дыханием (правая панель), ДИБГ расширяет легкие, перемещает сердце вниз и вызывает истончение средостения (левая панель).
DIBH может выполняться несколькими способами, например, путем активного блокирования воздушного потока, произвольной задержки дыхания или синхронизации (дыхательного стробирования).Каждый из этих методов имеет преимущества и ограничения при использовании с протонной терапией, особенно PBSPT, который имеет тенденцию иметь более длительное время включения луча, чем PSPT. Следует оценить межфракционную воспроизводимость положения диафрагмы во время фракции излучения. 60,61 Независимо от используемой техники задержки дыхания, бортовая визуализация может быть полезна для проверки и проверки ежедневной воспроизводимости объема легких по сравнению с данными КТ для планирования лечения.
Резюме и направления на будущее
Использование протонной терапии при лимфомах, поражающих средостение, является многообещающим, и методы лечения продолжают развиваться.Дозиметрическое преимущество снижения дозы OAR при определенных распределениях заболеваний может быть значительным и весьма желательным. Однако ограниченная доступность протонной терапии требует выбора случая, основанного на четком понимании того, какие случаи принесут наибольшую пользу от протонной терапии по сравнению с передовыми фотонными методами.
Каждый центр протонной терапии имеет разные возможности и методы, и пока нет единого метода протонной лучевой терапии для пациентов с лимфомой.В конечном итоге должны применяться ключевые инструменты и концепции, а также должны быть приобретены минимальные требования к компетентности для тех, кто намеревается использовать протонную терапию.
Дополнительные материалы
Онлайн-версия этой статьи содержит дополнение с данными.
Авторство
Вклад: Все авторы внесли свой вклад в создание рукописи; разногласия во мнениях разрешались консенсусом большинства.
Раскрытие информации о конфликте интересов: авторы заявляют об отсутствии конкурирующих финансовых интересов.
Список членов руководящего комитета Международной группы радиационной онкологии лимфомы приведен в онлайн-приложении.
Для корреспонденции: Бутхайна Шбиб Дабая, отделение радиационной онкологии, Онкологический центр им. Доктора медицины Андерсона Техасского университета, 1515 Holcombe Blvd, Houston, TX 77030; электронная почта: gro.nosrednadm@ajabadb.
СПИСОК ЛИТЕРАТУРЫ
1. Ценг Ю.Д., Каттер Д.Д., Пластарас Дж. П. и др. . Основанный на фактах обзор использования протонной терапии при лимфоме, подготовленный Подкомитетом по лимфоме Совместной группы по терапии частиц (PTCOG).Int J Radiat Oncol Biol Phys. 2017; 99 (4): 825-842. [PubMed] [Google Scholar] 2. Яхалом Дж., Иллидж Т., Шпехт Л. и др. ; Международная группа радиационной онкологии лимфомы. Современная лучевая терапия экстранодальных лимфом: полевые и дозовые рекомендации Международной группы радиационной онкологии лимфомы. Int J Radiat Oncol Biol Phys. 2015; 92 (1): 11-31. [PubMed] [Google Scholar] 3. Шпехт Л., Яхалом Дж., Иллидж Т. и др. ; ILROG. Современная лучевая терапия лимфомы Ходжкина: полевые и дозовые рекомендации Международной группы радиационной онкологии лимфомы (ILROG).Int J Radiat Oncol Biol Phys. 2014; 89 (4): 854-862. [PubMed] [Google Scholar] 4. Иллидж Т., Шпехт Л., Яхалом Дж. И др. ; Международная группа радиационной онкологии лимфомы. Современная лучевая терапия для узловой неходжкинской лимфомы. Определение цели и рекомендации по дозировке от Международной группы радиационной онкологии лимфомы. Int J Radiat Oncol Biol Phys. 2014; 89 (1): 49-58. [PubMed] [Google Scholar] 5. Ходжсон Д.К., Дикманн К., Терезакис С., Константин Л.; Международная группа радиационной онкологии лимфомы. Внедрение современных концепций планирования лучевой терапии для детской лимфомы Ходжкина: рекомендации Международной группы радиационной онкологии лимфомы.Практик Радиат Онкол. 2015; 5 (2): 85-92. [PubMed] [Google Scholar] 6. Homann K, Howell R, Eley J, et al. . Необходимость индивидуальных исследований для сравнения риска радиогенного второго рака (РСК) при лечении пациентов с протонной и фотонной лимфомой Ходжкина. J Протонная терапия. 2015; 1 (1): 118. [Google Scholar] 7. Элей Дж., Ньюхаузер В., Хоманн К. и др. . Реализация аналитической модели эквивалентной дозы нейтронов утечки в системе планирования протонной лучевой терапии. Раки (Базель). 2015; 7 (1): 427-438. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Цзэн С., Пластарас Дж. П., Джеймс П. и др. . Сканирование протонным карандашным пучком для лимфомы средостения: планирование лечения и оценка устойчивости. Acta Oncol. 2016; 55 (9-10): 1132-1138. [PubMed] [Google Scholar] 9. Йоргенсен А.Ю., Маральдо М.В., Бродин Н.П. и др. . Воздействие на пищевод после различных методов лучевой терапии лимфомы Ходжкина на ранней стадии. Acta Oncol. 2013; 52 (7): 1559-1565. [PubMed] [Google Scholar] 10. Саксман С., Хоппе Б.С., Менденхолл Н.П. и др. . Протонная терапия поддиафрагмальной области при ведении пациентов с лимфомой Ходжкина.Лимфома лейка. 2015; 56 (7): 2019-2024. [PubMed] [Google Scholar] 11. Маральдо М.В., Бродин П., Азнар М.К. и др. . Дозы в сонные артерии после современной лучевой терапии лимфомы Ходжкина: инсульт все еще является поздним эффектом лечения? Int J Radiat Oncol Biol Phys. 2013; 87 (2): 297-303. [PubMed] [Google Scholar] 12. Тольц А., Шин Н., Митроу Э и др. . Поздняя лучевая токсичность у больных лимфомой Ходжкина: возможности протонной терапии. J Appl Clin Med Phys. 2015; 16 (5): 167-178. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13.Хольцман А.Л., Хоппе Б.С., Ли Зи и др. . Повышение терапевтического индекса при детской лимфоме Ходжкина III / IV стадии с помощью протонной терапии. Int J Part Ther. 2014; 1 (2): 343-356. [Google Scholar] 14. Knäusl B, Lütgendorf-Caucig C, Hopfgartner J, et al. . Можно ли улучшить лечение детской лимфомы Ходжкина с помощью ПЭТ-визуализации и протонной терапии? Strahlenther Onkol. 2013; 189 (1): 54-61. [PubMed] [Google Scholar] 15. Андолино Д.Л., Хоэн Т., Сяо Л., Буксбаум Дж., Чанг А.Л. Дозиметрическое сравнение трехмерной конформной фотонной радиотерапии с вовлеченным полем и протонной терапии с сохранением груди для лечения лимфомы Ходжкина у педиатрических пациентов женского пола.Int J Radiat Oncol Biol Phys. 2011; 81 (4): e667-e671. [PubMed] [Google Scholar] 16. Cella L, Conson M, Pressello MC и др. . Методы лучевой терапии новой лимфомы Ходжкина: компромисс между поздней радиоиндуцированной токсичностью и вторичными злокачественными новообразованиями. Радиат Онкол. 2013; 8 (1): 22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Чера Б.С., Родригес С., Моррис К.Г. и др. . Дозиметрическое сравнение трех различных методов локального облучения пациентов с лимфомой Ходжкина II стадии: обычная лучевая терапия, лучевая терапия с модуляцией интенсивности и трехмерная протонная лучевая терапия.Int J Radiat Oncol Biol Phys. 2009; 75 (4): 1173-1180. [PubMed] [Google Scholar] 18. Хоппе Б.С., Флампури С., Зайден Р. и др. . Протонная терапия вовлеченных узлов в комбинированную терапию лимфомы Ходжкина: результаты исследования фазы 2. Int J Radiat Oncol Biol Phys. 2014; 89 (5): 1053-1059. [PubMed] [Google Scholar] 19. Хорн С., Фурнье-Бидоз Н., Пернин В. и др. . Сравнение пассивно-лучевой протонной терапии, спиральной томотерапии и трехмерной конформной лучевой терапии у пациенток с лимфомой Ходжкина, получающих лучевую терапию вовлеченного поля или пораженного участка.Рак Радиотермой. 2016; 20 (2): 98-103. [PubMed] [Google Scholar] 20. Маральдо М.В., Бродин Н.П., Азнар М.К. и др. . Дозы для нормальных тканей головы и шеи при ранней стадии лимфомы Ходжкина после лучевой терапии пораженных узлов. Радиатор Oncol 2014; 110 (3): 441-447. [PubMed] [Google Scholar] 21. Ли Дж., Дабаджа Б., Рид В. и др. . Обоснование и предварительные результаты протонно-лучевой терапии лимфомы средостения. Int J Radiat Oncol Biol Phys 2011; 81 (1): 167-174. [PubMed] [Google Scholar] 22.Хоппе Б.С., Цай Х., Ларсон Г. и др. . Паттерны протонной терапии и ранние результаты лечения лимфомы Ходжкина: результаты из реестра Proton Collaborative Group. Acta Oncol. 2016; 55 (11): 1378-1380. [PubMed] [Google Scholar] 23. Хоппе Б.С., Хилл-Кайзер К.Э., Ценг Ю.Д. и др. . Консолидирующая протонная терапия после химиотерапии у пациентов с лимфомой Ходжкина. Энн Онкол. 2017; 28 (9): 2179-2184. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Нанда Р., Флампури С., Менденхолл Н. П. и др. . Легочная токсичность после протонной терапии лимфомы грудной клетки.Int J Radiat Oncol Biol Phys. 2017; 99 (2): 494-497. [PubMed] [Google Scholar] 26. Международная комиссия по радиационным единицам и измерениям. Назначение, запись и сообщение о протонно-лучевой терапии. Отчет ICRU 78 . [Google Scholar] 27. Eley JG, Newhauser WD, Lüchtenborg R, Graeff C, Bert C. 4D оптимизация терапии с отслеживанием движущихся опухолей со сканированным ионным пучком. Phys Med Biol 2014; 59 (13): 3431-3452. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Элей Дж. Г., Ньюхаузер В. Д., Рихтер Д., Люхтенборг Р., Сайто Н., Берт К.Устойчивость покрытия целевой дозы к неопределенностям движения для лечения движущихся опухолей со сканированным пучком ионов углерода. Phys Med Biol 2015; 60 (4): 1717-1740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Чжу З., Лю В., Гиллин М. и др. . Оценка устойчивости протонной терапии с пассивным рассеянием в отношении местного рецидива немелкоклеточного рака легкого III стадии: вторичный анализ исследования фазы II. Радиат Онкол. 2014; 9 (1): 108. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32.Мойерс М.Ф., Миллер Д.В., Буш Д.А., Слейтер Д.Д. Методологии и инструменты для проектирования пучков протонов для опухолей легких. Int J Radiat Oncol Biol Phys. 2001; 49 (5): 1429-1438. [PubMed] [Google Scholar] 33. Куарон Дж. Дж., Чанг С., Лавлок М. и др. . Экспоненциальное увеличение относительной биологической эффективности вдоль дистального края протонного пика Брэгга, измеренное по разрывам двухцепочечной дезоксирибонуклеиновой кислоты. Int J Radiat Oncol Biol Phys. 2016; 95 (1): 62-69. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Гуан Ф., Бронк Л., Титт У. и др.. Пространственное отображение биологической эффективности сканированных пучков частиц: к биологически оптимизированной терапии частицами. Научный доклад 2015; 5 (1): 9850. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Веденберг М., Линд Б.К., Хордемарк Б. Модель относительной биологической эффективности протонов: тканевый параметр α / β фотонов является предиктором чувствительности к изменениям ЛПЭ. Acta Oncol. 2013; 52 (3): 580-588. [PubMed] [Google Scholar] 36. Малруни Д.А., Йазель М.В., Кавашима Т. и др. . Сердечные исходы в когорте взрослых, переживших рак в детском и подростковом возрасте: ретроспективный анализ когорты исследования выживших после рака.BMJ. 2009; 339: b4606. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Трэвис Л. Б., Хилл Д. А., Дорес Г. М. и др. . Рак груди после лучевой терапии и химиотерапии у молодых женщин с болезнью Ходжкина. ДЖАМА. 2003; 290 (4): 465-475. [PubMed] [Google Scholar] 38. Pinnix CC, Smith GL, Milgrom S и др. . Предикторы лучевого пневмонита у пациентов, получающих лучевую терапию с модуляцией интенсивности по поводу Ходжкина и неходжкинской лимфомы. Int J Radiat Oncol Biol Phys. 2015; 92 (1): 175-182. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39.Маральдо М.В., Джусти Ф., Фогелиус И.Р. и др. . Сердечно-сосудистые заболевания после терапии лимфомы Ходжкина: подробный анализ 9 совместных исследований EORTC-LYSA. Lancet Haematol. 2015; 2: e492-e502. [PubMed] [Google Scholar] 40. ван Нимвеген Ф.А., Шаапвельд М., Каттер Д.Д. и др. . Зависимость радиационной доза-реакция для риска ишемической болезни сердца у выживших после лимфомы Ходжкина. J Clin Oncol. 2016; 34 (3): 235-243. [PubMed] [Google Scholar] 41. Каттер Д. Д., Шаапвельд М., Дарби С. К. и др. . Риск порока сердца после лечения лимфомы Ходжкина.J Natl Cancer Inst. 2015; 107 (4): djv008. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Ньюхаузер В.Д., Шнайдер С., Уилсон Л., Шреста С., Донахью В. Обзор аналитических моделей воздействия паразитного излучения при лучевой терапии фотонами и протонами. Radiat Prot Dosimetry. 2018; 180 (1-4): 245-251. [PubMed] [Google Scholar] 43. Stokkevåg CH, Schneider U, Muren LP, Newhauser W. Прогнозирование риска радиационно-индуцированного рака в протонной и тяжелой ионной радиотерапии. Phys Med. 2017; 42: 259-262. [PubMed] [Google Scholar] 44.Ньюхаузер У.Д., Беррингтон де Гонсалес А., Шульте Р., Ли К. Обзор исследований поздних эффектов, вызванных лучевой терапией, после лечения с использованием передовых технологий. Фасад Онкол. 2016; 6: 13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Дарби С.К., Эверц М., МакГейл П. и др. . Риск ишемической болезни сердца у женщин после лучевой терапии рака груди. N Engl J Med. 2013; 368 (11): 987-998. [PubMed] [Google Scholar] 46. Фэн М., Моран Дж. М., Келлинг Т. и др. . Разработка и проверка атласа сердца для изучения воздействия радиации на сердце после лечения рака груди.Int J Radiat Oncol Biol Phys. 2011; 79 (1): 10-18. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Хоппе Б.С., Флампури С., Су Зи и др. . Эффективное снижение дозы на сердечные структуры с использованием протонов по сравнению с 3DCRT и IMRT при лимфоме Ходжкина средостения. Int J Radiat Oncol Biol Phys. 2012; 84 (2): 449-455. [PubMed] [Google Scholar] 48. Азнар М.К., Маральдо М.В., Шут Д.А. и др. . Минимизация поздних эффектов у пациентов с лимфомой Ходжкина средостения: задержка дыхания на глубоком вдохе, IMRT или и то, и другое? Int J Radiat Oncol Biol Phys.2015; 92 (1): 169-174. [PubMed] [Google Scholar] 49. Voong KR, McSpadden K, Pinnix CC и др. . Дозиметрические преимущества метода «бабочка» для лучевой терапии с модуляцией интенсивности у молодых пациенток с лимфомой Ходжкина средостения. Радиат Онкол. 2014; 9 (1): 94. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Дабая Б.С., Ребуэно Н.С., Мазлум А. и др. . Облучение лимфомы Ходжкина у молодых пациенток: новый метод, позволяющий избежать попадания в грудь и снизить дозу облучения сердца. Int J Radiat Oncol Biol Phys.2011; 79 (2): 503-507. [PubMed] [Google Scholar] 51. Фиандра С., Филиппи А.Р., Катуццо П. и др. . Различные решения IMRT по сравнению с 3D-конформной лучевой терапией на ранней стадии лимфомы Ходжкина: дозиметрическое сравнение и клинические соображения. Радиат Онкол. 2012; 7 (1): 186. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Шаапвельд М., Алеман Б.М., ван Эггермонд А.М. и др. . Второй риск рака до 40 лет после лечения лимфомы Ходжкина. N Engl J Med. 2015; 373 (26): 2499-2511. [PubMed] [Google Scholar] 53.Мэтни Дж., Парк ПК, Блуетт Дж. И др. . Влияние дыхательного движения на терапию пассивно рассеянными протонами по сравнению с фотонной терапией с модуляцией интенсивности при раке легких III стадии: являются ли протонные планы более чувствительными к дыхательному движению? Int J Radiat Oncol Biol Phys. 2013; 87 (3): 576-582. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Zeng C, Plastaras JP, Tochner ZA, et al. . Сканирование протонным карандашным лучом при лимфоме средостения: влияние взаимодействия между движением цели и сканированием луча. Phys Med Biol.2015; 60 (7): 3013-3029. [PubMed] [Google Scholar] 55. Захарату Ярлског К., Ли К., Болч В.Е., Сюй XG, Паганетти Х. Оценка органо-специфических эквивалентных доз нейтронов в протонной терапии с использованием компьютерных возрастных воксельных фантомов для всего тела. Phys Med Biol. 2008; 53 (3): 693-717. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Атар Б.С., Беднарз Б., Секо Дж., Хэнкокс К., Паганетти Х. Сравнение доз фотонов вне поля при IMRT 6 МВ и доз нейтронов при протонной терапии для взрослых и детей.Phys Med Biol. 2010; 55 (10): 2879-2891. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Lomax AJ. Протонная терапия с модуляцией интенсивности и ее чувствительность к неопределенностям лечения 2: потенциальные эффекты межфракционных и межполевых движений. Phys Med Biol. 2008; 53 (4): 1043-1056. [PubMed] [Google Scholar] 58. Лин Х, Динг Х, Кирк М. и др. . Краниоспинальное облучение в положении лежа на спине с использованием метода сканирования карандашным пучком протонов без изменения линий совпадения для полевых стыков. Int J Radiat Oncol Biol Phys .2014; 90 (1): 71-78. [PubMed] [Google Scholar] 59. Хоппе Б.С., Менденхолл Н.П., Луи Д., Ли З., Флампури С. Сравнение задержки дыхания и свободного дыхания во время лучевой терапии с модуляцией интенсивности и протонной терапии у пациентов с лимфомой Ходжкина средостения. Int J Part Ther. 2017; 3 (4): 492-496. [Google Scholar] 60. О’Брайен Р.Т., Купер Б.Дж., Кипритидис Дж., Шие С.К., Килл П.Дж. Компьютерная томография с четырехмерным конусным лучом, управляемая дыхательным движением: определение нерегулярного дыхания. Phys Med Biol. 2014; 59 (3): 579-595.[PubMed] [Google Scholar] 61. Wong JW, Sharpe MB, Jaffray DA, et al. . Использование активного контроля дыхания (ABC) для уменьшения запаса дыхательных движений. Int J Radiat Oncol Biol Phys. 1999; 44 (4): 911-919. [PubMed] [Google Scholar] 62. Pinnix CC, Cella L, Andraos TY и др. . Предикторы гипотиреоза у выживших после лимфомы Ходжкина после модуляции интенсивности по сравнению с трехмерной лучевой терапией. Int J Radiat Oncol Biol Phys. 2018; 101 (3): 530-540. [Бесплатная статья PMC] [PubMed] [Google Scholar]Рекомендации Международной группы радиационной онкологии лимфомы
Кровь.2018 окт 18; 132 (16): 1635–1646.
, 1 , 2 , 3 , 4 , 5, 6 , 2 , 7 , 8 , 9 , 10 9000Бутхайна Шбиб Дабая
1 Отделение радиационной онкологии, Онкологический центр доктора медицины Андерсона Техасского университета, Хьюстон, Техас;
Брэдфорд С. Хоппе
2 Отделение радиационной онкологии, Университет Флориды, Джексонвилл, Флорида;
Джон П.Plastaras
3 Отделение радиационной онкологии Пенсильванского университета, Филадельфия, Пенсильвания;
Уэйн Ньюхаузер
4 Департамент радиационной физики, Университет Луизианы, Батон-Руж, Луизиана;
Катерина Розолова
5 Отделение протонной терапии, Центр протонной терапии Чехия, Прага, Чехия;
6 Отделение онкологии, Карлов университет в Праге и университетская больница Мотол, Прага, Чешская Республика;
Стелла Флампури
2 Отделение радиационной онкологии, Университет Флориды, Джексонвилл, Флорида;
Радхе Мохан
7 Отделение радиационной физики, Онкологический центр им. М.Д. Андерсона Техасского университета, Хьюстон, Техас;
Н.Джордж Михаил
8 Отделение радиационной онкологии, Госпиталь Гая и Св. Томаса, Лондон, Соединенное Королевство;
Юлия Кирова
9 Отделение радиационной онкологии, Институт Кюри, Париж, Франция;
Лена Шпехт
10 Отделение онкологии, Rigshospitalet, Университетская больница Копенгагена, Копенгаген, Дания; и
Иоахим Яхалом
11 Отделение радиационной онкологии, Мемориальный онкологический центр Слоуна Кеттеринга, Нью-Йорк, Нью-Йорк
1 Отделение радиационной онкологии Техасского университета Онкологический центр Андерсона, Хьюстон, Техас;
2 Отделение радиационной онкологии, Университет Флориды, Джексонвилл, Флорида;
3 Отделение радиационной онкологии Пенсильванского университета, Филадельфия, Пенсильвания;
4 Департамент радиационной физики, Университет Луизианы, Батон-Руж, Луизиана;
5 Отделение протонной терапии, Центр протонной терапии Чехия, Прага, Чехия;
6 Отделение онкологии, Карлов университет в Праге и университетская больница Мотол, Прага, Чешская Республика;
7 Отделение радиационной физики, Онкологический центр им. М. Д. Андерсона Техасского университета, Хьюстон, Техас;
8 Отделение радиационной онкологии, Гая и Св.Thomas ‘Hospital, Лондон, Великобритания;
9 Отделение радиационной онкологии, Институт Кюри, Париж, Франция;
10 Отделение онкологии, Rigshospitalet, Университетская больница Копенгагена, Копенгаген, Дания; и
11 Отделение радиационной онкологии, Мемориальный онкологический центр им. Слоуна Кеттеринга, Нью-Йорк, Нью-Йорк
Автор, отвечающий за переписку.Поступило 08.03.2018 г .; Принято 19 июля 2018 г.
Авторские права © Американское общество гематологов, 2018 г.Эта статья цитируется в других статьях в PMC.Abstract
Среди взрослых, переживших лимфому, методы лучевой терапии, которые увеличивают избыточную дозу облучения органов риска (OAR), подвергают пациентов риску увеличения побочных эффектов, особенно поздней токсичности. Сведение к минимуму облучения ОАР у взрослых пациентов с Ходжкинскими и неходжкинскими лимфомами с поражением средостения является решающим фактором при выборе метода лечения. Протонная терапия может помочь снизить дозу облучения OAR и снизить токсичность, особенно риск сердечных заболеваний и вторичного рака.Поскольку протонная терапия может иметь некоторые недостатки, важно выявить пациентов и обстоятельства, при которых протонная терапия может принести наибольшую пользу. Мы представляем современные рекомендации по выявлению взрослых пациентов с лимфомой, которые могут получить наибольшую пользу от протонной терапии, а также анализ преимуществ и недостатков протонной терапии.
Введение
Снижение связанных с лечением токсических эффектов у выживших после Ходжкина и неходжкинских лимфом стало краеугольным камнем последних достижений в лечении гематологических злокачественных новообразований.Долгосрочные последующие исследования пациентов с гематологическими злокачественными новообразованиями предоставили убедительные и надежные доказательства того, что преимущества ионизирующего излучения могут быть смягчены увеличением смертности и заболеваемости, особенно от вторичных злокачественных новообразований и сердечных осложнений. 1 Эти результаты послужили толчком к огромным усилиям по поиску способов минимизировать побочный ущерб от радиации соседним органам грудной клетки, подверженным риску (OAR). Некоторые из этих способов включали трехмерную (3D) конформную лучевую терапию и лучевую терапию с модуляцией интенсивности (IMRT). 2-5 Протонная терапия с ее уникальными характеристиками – более низкой входной дозой, пиком высокой дозы и резким спадом около конца диапазона пучка – представляет еще одну возможность для более конформного распределения дозы и лучшего сохранения OAR. 1,6,7
Руководство представляет собой набор согласованных рекомендаций экспертов-радиологов-онкологов и физиков из различных международных академических центров. Рекомендации передовой практики, включая потенциальные преимущества или вред, были основаны на обширном обзоре опубликованной литературы.Каждая включенная рекомендация была достигнута консенсусом более 80% авторов документа; в статье приводится обоснование рекомендаций, а также подробное объяснение рекомендаций, которые стали предметом многочисленных споров среди авторов.
Представленные здесь руководящие принципы включают обзор протонной терапии взрослых лимфом с поражением средостения, подробное обсуждение передовых практик вместе с примерами случаев, в которых протоны дают преимущество, и ссылки на области, в которых требуются дальнейшие исследования.Хотя протонная терапия полезна для лечения других анатомических участков, мы сосредотачиваемся на средостении из-за большого количества доступных данных. перечисляет полезные определения технических терминов, используемых в статье.
Таблица 1.
| Термин | Определение |
|---|---|
| Общий объем опухоли (GTV) | Объем, содержащий видимую протяженность опухоли, которую можно определить по контуру и нацелить с помощью компьютерной томографии |
| Объем клинической опухоли (CTV) | Объем, содержащий подозрение на микроскопическое заболевание; это может быть около крупной опухоли или в исходном месте после достижения полной ремиссии после химиотерапии |
| Планируемый целевой объем | Объем, содержащий GTV и CTV; кроме того, он учитывает все неопределенности, такие как движение внутренних органов и ежедневные ошибки настройки пациента |
| 3D-планирование лучевой терапии | Перспективное планирование, определение анатомии на компьютерной томографии, идентификация цели и создание схемы луча излучения для наилучшего охвата цель; генерировать дозу облучения, которую оператор считает приемлемой |
| IMRT | Оператор заранее вводит в систему планирования желаемую дозу для цели и органов, подверженных риску, и то, как должно выглядеть конечное распределение дозы, затем программное обеспечение инвертирует проблема и пусть компьютер через математическую итерацию ищет лучшее и оптимизированное решение; программное обеспечение будет продолжать попытки до тех пор, пока оператор не сочтет план приемлемым |
| Линейная передача энергии (LET) | Общее количество энергии, выделенной на единицу расстояния в биологических материалах под действием ионизирующего излучения |
| Радиобиологический эквивалент | Относительное радиационное биологическое эффективность в зависимости от ЛПЭ, типа радиационной частицы, общей дозы и фракционирования дозы |
| Активное сканирование протонов | Доставка пучка протонов с помощью стержневого пучка, который точно направляется через терапевтический объем, с использованием магнита в линии пучка; затем доза наносится слой за слоем, обеспечивая хорошую конформацию |
| Пассивное рассеяние протонов | Пространственно равномерное распределение дозы, достигаемое за счет формирования луча с помощью набора устройств на пути луча |
| Протонная терапия с модуляцией интенсивности | Дальнейшая форма активного сканирования дистального отдела опухоли для выявления опухолей неправильной формы |
Консенсусные рекомендации
Пациенты с лимфомой, которым протонная терапия может принести большую пользу, включают (1) пациентов с заболеванием средостения, которое распространяется ниже начала левого главного ствола коронарная артерия – кпереди, кзади или слева от сердца; (2) молодые пациенты женского пола, для которых протонная терапия может снизить дозу груди и риск вторичного рака груди; и (3) пациенты, прошедшие интенсивное предварительное лечение, которые подвергаются более высокому риску радиационной токсичности для костного мозга, сердца и легких.
При использовании протонной терапии лечащие врачи должны (1) продемонстрировать расчетным путем, что она обеспечивает большую пользу пациенту по сравнению с оптимально запланированной фотонной терапией; (2) задокументировать медицинскую необходимость протонной терапии, в том числе рассмотрение вопросов для выживших в течение длительного времени и рисков поздних радиогенных эффектов; (3) понимать сложность планирования протонов лимфомы, включая необходимость управления неопределенностями, и развивающийся характер технологии с развитием сканирования карандашным лучом, объемной визуализации в помещении и оптимизации надежности; и (4) использовать задержку дыхания на глубоком вдохе (DIBH), когда это дополнительно минимизирует дозы для OAR, с пониманием повышенной сложности использования DIBH с протонной терапией по сравнению с фотонной терапией.
Различные методы проведения протонной терапии
Было проведено несколько дозиметрических исследований по сравнению протонных и фотонных планов 8-21 с целью установить пользу и показания для использования протонной терапии при лимфоме, причем подавляющее большинство из них было сосредоточено на поражение средостения. Они показали, что у пациентов со снижением дозы на сердце, легкие и грудь с помощью протонной терапии есть индивидуализированная и потенциальная выгода по сравнению с 3D конформной лучевой терапией или IMRT. 1 Кроме того, отсутствие краевых рецидивов, которых опасаются при использовании высококонформной терапии, такой как протонная терапия, сделало это лечение привлекательным. 22-24
Поскольку величина дозиметрической пользы значительно варьируется в зависимости от конкретного случая, каждый случай необходимо рассматривать индивидуально, а потенциальную пользу от использования протонов следует соотносить с доступностью лечения (необходимо путешествовать), наличные расходы в случае отказа в страховом покрытии, необходимые ресурсы в виде медицинского и физического персонала, а также потенциальные неопределенности, связанные с протонной терапией.
Свойства протонного пучка
Протоны – это заряженные частицы, которые выделяют излучение за счет линейной передачи энергии (ЛПЭ), теряют мало энергии при попадании в ткань и откладывают большую часть при замедлении непосредственно перед остановкой, что приводит к эффекту пика Брэгга. 25 Поскольку положение пика сильно зависит от плотности ткани на пути луча, протонная терапия страдает от неопределенностей диапазона, которые клиницисты должны понимать, чтобы наилучшим образом использовать эту технологию.
Неопределенности протонной терапии и способы их смягчения
Некоторые из проблем, связанных с протонной терапией, – это неопределенности, связанные с диапазоном проникновения пучка в ткани и изменением величины биологических эффектов на пути пучка протонов. Неопределенности в вычислении диапазона проникновения протонов в ткань имеют два основных потенциальных источника: (1) ошибки диапазона, вызванные изменениями плотности ткани из-за ошибок в настройке (позиционировании пациента), движением органов (например, связанных с дыханием или сердцем) или анатомическими изменениями. (например, деформация ткани и сжатие опухоли), которые в совокупности вызывают изменения в пути и дальности луча, которые могут вызвать несоответствия между запланированным и проведенным лечением, и (2) входные данные, используемые для планирования диапазона луча (т. е. преобразование компьютерной томографии [CT] число в линейную тормозную способность протона).Другим важным источником неопределенностей является изменение величины биологического эффекта (описываемого в терминах относительной биологической эффективности [ОБЭ]) протонов вдоль пути луча, который влияет на мишени и нормальные ткани.
Неопределенность диапазона из-за изменений плотности
Один потенциально большой источник неопределенности диапазона связан с анатомическими изменениями пациента. В частности, текущий стандарт лечения использует объемные изображения в качестве основы для создания плана лучевой терапии на несколько дней или даже недель спустя.Во время лечения распределение доставленной дозы будет отклоняться от запланированного распределения из-за изменений положения или размера пациента и опухоли. Эти изменения не так важны для фотонной терапии, но они могут иметь сильное влияние на распределение дозы протонной терапии в осевом и латеральном направлениях пучка. Из них осевые отклонения являются синонимом погрешностей диапазона; если линейная тормозная способность (тесно связанная с массовой плотностью) любого вокселя пациента изменяется (относительно его значения, используемого для планирования лечения), то диапазон всех протонов, проходящих через этот воксель, также изменится. 26
Для решения дозиметрических неопределенностей, связанных с анатомическими изменениями, было разработано множество стратегий. 27,28 Надежные инструменты оптимизации теперь позволяют пользователям включать неопределенности дальности, ошибки настройки и физиологическое движение путем включения результатов нескольких компьютерных томографий (например, 4-мерного [4D] CT) в процессы оптимизации плана и расчета дозы. Эффективность этих инструментов можно оценить с помощью анализа устойчивости, который включает расчет распределения доз для различных сценариев ошибок.Семейства гистограмм доза-объем (DVH) клинических целевых объемов (CTV) и OAR для нескольких сценариев неопределенностей (т. Е. Сдвигов по направлениям x, y и z и связанных с ними неопределенностей диапазона) проверяются перед проведением лечения, чтобы гарантировать приемлемость плана. Обычно для оценки используется DVH «наихудшего случая» диапазона (). 29,30
Анализ устойчивости на основе DVH, показывающий несколько сценариев, представляющих различные неопределенности и их результирующее влияние на распределение дозы для конкретного органа, подверженного риску, или цели.
Помимо возмущений дозы на периферии протонного поля, интерференция между динамическим карандашным лучом с движением цели и другими окружающими анатомическими элементами приводит к локальным неоднородностям дозы внутри цели. Это взаимодействие между анатомическим движением, вызванным дыханием, и сканированием точек может привести к появлению «горячих» и «холодных» областей дозы в целевом объеме. Поля не могут компенсировать эффект взаимодействия, но могут помочь другие решения, включая одно или несколько из следующих: перекраска пятна, увеличение размера пятна, стробирование или методы уменьшения движения. 8 Доступны некоторые алгоритмы робастной оптимизации 4D, которые могут учитывать изменения плотности, но информация о времени, необходимая для расчета взаимодействия, не включена в эти алгоритмы.
Расхождения между расчетным и фактическим пробегами протонов в ткани
Этот источник неопределенности является результатом преобразования единиц Хаунсфилда, полученных при компьютерной томографии, в относительную тормозную способность протонов ткани, воспроизводимость протонного пучка, погрешности измерения воды при вводе пучка в эксплуатацию и ошибки в диапазоне изготовление компенсатора. 31 Хотя величина этих типов неопределенностей специфична для каждой протонной системы (включая компоненты доставки, построения изображений и вычислений), отдельные учреждения могут использовать «рецепты маржи» для обеспечения целевого охвата. Такие рецепты обычно основаны на формулировке, введенной Мойерсом и др. 32 : дистальный край = α% глубины + β мм, где α связано с погрешностями в вычислении дозы, а β связано с ошибками, не зависящими от расчет дозы.
Неопределенности в ОБЭ
В современной клинической практике предполагается, что ОБЭ протонов по сравнению с фотонами высоких энергий имеет постоянное значение 1,1. В действительности ОБЭ варьируется и является сложной функцией нескольких величин, включая ЛПЭ от протонов к локальной среде, дозу на фракцию, тип ткани и клетки, оксигенацию, биологические или клинические конечные точки и другие факторы. 33 Оценки воздействия этих факторов на ОБЭ доступны в исследованиях in vitro, но данные in vivo на людях все еще отсутствуют. 26 Тем не менее, имеющиеся данные предполагают, что ОБЭ протона может увеличиваться на пике Брэгга, возможно, более быстро и нелинейно на дистальном крае. Поскольку LET увеличивается по мере уменьшения энергии протонов с глубиной, что приводит к повышенным LET и связанным значениям RBE в конце протонного диапазона, это вызывает опасения, когда дистальный конец лечебного поля направлен в сторону чувствительных OAR. Существуют разногласия по поводу протяженности области, в которой RBE отклоняется от 1,1, и она может быть> 1.1. Принято считать, что чем выше разброс по энергии и диапазону, тем большее смешение по диапазону мы видим, что объясняет изменчивость дозы в конце пика Брэгга. 34,35 С другой стороны, другие исследователи считают это отклонение небольшим (несколько миллиметров вокруг пика Брэгга). Поскольку планирование на основе RBE или даже на основе LET коммерчески недоступно, используются эмпирические методы для защиты структур от увеличения RBE, включая снижение физической дозы на OAR на дистальном краю луча, использование нескольких полей для пространственного разбавления эффект, смещение диапазона одного и того же поля, облучение мимо чувствительных структур или разрешение дыхательных / сердечных движений сглаживать дозу для движущихся OAR.
Клинические проявления и применение протонной лучевой терапии
Пациенты с заболеванием средостения, особенно молодые женщины, сталкиваются с проблемой лечения, в которой протонная терапия может быть очень полезной. В этом разделе рассматриваются общие цели и проблемы в конкретных клинических ситуациях.
Независимо от типа излучения, которое будет использоваться, основные правила клинической оценки плана лучевой терапии заключаются в достижении следующего: (1) охват планируемого целевого объема (PTV) ≥95% дозы; (2) минимизировать дозу на субструктуры сердца, включая коронарные артерии, левый желудочек и клапаны, 36 , насколько это возможно; (3) свести к минимуму облучение груди с уделением первоочередного внимания предотвращению облучения больших объемов груди у молодых женщин (<35 лет) 37 ; и (4) минимизировать дозу для легких, включая V 5 , V 20 , V 30 и среднюю дозу. 38 суммирует эти моменты и может быть полезным в качестве руководства для выполнения этих требований. 38-41
Таблица 2.
Руководство по приемлемым дозам, объему и учету полей
| Структуры | Идеал | Техника оптимизации | Оптимизация поля (с учетом уменьшения поля) | Неприемлемо | посадка максимальной дозы в |
|---|---|---|---|---|---|
| Сердце: левый желудочек, коронарные артерии, клапаны 39-41 | Среднее <5 Гр | Среднее, 5-15 Гр | Среднее> 15 Гр | Среднее> 30 Гр | Коронарные сосуды |
| Грудь (в зависимости от возраста) * | Среднее <4 Гр | Среднее, 4-15 Гр | Среднее> 15 Гр | Среднее> 30 Гр | Железистая ткань |
| V 5 <55% | V 5 , 55-60% | – | V 5 > 60% | ||
| V 20 <30% | Среднее, 10-13.5 Гр | Среднее> 13,5 Гр | |||
| Среднее <10 Гр | |||||
| Щитовидная железа 62 | V 25 <62,5% | V | 25%V 25% | 25%Вся щитовидная железа |
Следует иметь в виду, что в существующих системах планирования клинического лечения отсутствуют некоторые ключевые возможности, необходимые для создания, оптимизации или оценки возможных планов лечения. В частности, рассеянное радиационное облучение обычно недооценивается за пределами области лечения на несколько сантиметров, что исключает обычные прогнозы риска, основанные на радиационном воздействии. 42 Точно так же их возможности моделирования рисков ограничены, если они вообще присутствуют. 43,44
Учет дозы на сердце
Связь заболевания с ОАР определяет ситуации, в которых протонная терапия наиболее эффективна. В частности, что касается заболеваний сердца и его подструктур, опубликованные результаты показывают, что средние дозы на сердце> 15 Гр связаны с повышенным риском сердечных заболеваний. 39 Средняя доза на сердце – приблизительная оценка, используемая довольно часто 45 ; механистически, однако, ишемическая болезнь сердца, вероятно, зависит от средней дозы на сердце, а также от максимальной дозы на субструктуры сердца, 46,47 , особенно в отношении атеросклероза коронарных сосудов.Следовательно, следует помнить об объеме высокой дозы, особенно в отношении потенциальной неопределенности ОБЭ для пучков, которые заканчиваются в пределах нескольких миллиметров от коронарных сосудов. 21
Для целей этой статьи в протонных и фотонных планах на всех показанных иллюстрациях используется DIBH, наклонная доска для женщин, чтобы еще больше избежать груди, и, для IMRT, техника бабочки. 48-51
Сценарий 1: медиастинальная цель полностью над сердцем без вовлечения подмышек
Отрыв левой основной стволовой коронарной артерии используется для определения того, находится ли цель выше или ниже сердца ().В этом примере () экспонирование сердца вполне сопоставимо, независимо от того, какой метод используется. Различия в DVH, а также в средней дозе для других структур аналогичны планам для протонов и IMRT.
Три сценария связи между заболеванием средостения и сердцем. (A) Показывает, как использовать отрыв левой основной стволовой коронарной артерии (обведен розовым цветом) для определения расположения верхнего и нижнего средостения. (B) Сценарий 1: КТ-изображения коронарной артерии 28-летнего мужчины с первичной лимфомой средостения до (i) и после (ii) 6 курсов ритуксимаба, циклофосфамида, доксорубицина, винкристина, преднизона (RCHOP) химиотерапии, представляющей для консолидации с радиация.(Biii) Аксиальный, коронарный и сагиттальный виды плана IMRT (верхние панели) и протонного плана (нижние панели). (Biv) Соответствующие средние дозы для критических структур с использованием IMRT против протонов. (C) Сценарий 2: КТ-изображения коронковой части 25-летнего мужчины с лимфомой Ходжкина до (i) и после (ii) 4 курсов химиотерапии доксорубицином, блеомицином, винбластином и дакарбазином (ABVD) для консолидации с помощью излучения. (Ciii) Аксиальный, коронарный и сагиттальный виды плана IMRT (верхние панели) и протонного плана (нижние панели).(Civ) Соответствующие средние дозы для критических структур с использованием IMRT против протонов. (D) Сценарий 3: КТ-изображения коронарной артерии 30-летнего мужчины с рецидивирующей лимфомой Ходжкина, как показано на коронарных изображениях ПЭТ / КТ-сканирования (i-ii) для окончательного облучения. (Diii) Осевые, корональные и сагиттальные виды плана IMRT (верхние панели) и протонного плана (нижние панели). (Div) Соответствующие средние дозы для критических структур с использованием IMRT по сравнению с протонами.
Сценарий 2: цель охватывает правую часть сердца
Для целей в правой части сердца IMRT часто обеспечивает сопоставимые дозы для сердца и других структур, как протонная терапия.Примечательно, однако, что даже когда протонные планы дают дозиметрическое преимущество перед планами IMRT, величина преимущества может варьироваться в зависимости от случая, и его нужно оценивать индивидуально. Например, для пациента, показанного на, средние дозы для критических структур от протонной терапии достаточно ниже, чем от IMRT, чтобы предположить, что протонная терапия может быть предпочтительнее из-за большого объема, охватывающего правую часть сердца. Этот пример демонстрирует необходимость тщательного рассмотрения отдельных случаев перед принятием решения о лечении.
Сценарий 3: цель находится с обеих сторон сердца
Заболевание, которое распространяется значительно впереди сердца спереди, сзади или слева, представляет собой особую проблему для IMRT; поэтому протонная терапия может быть лучшим планом. Примечательно, что токсичность для сердца и легких не устраняется с помощью протонной терапии; скорее, доза для сердца может быть ниже, чем IMRT. Таким образом, в подобных случаях клиницисты должны тщательно взвесить терапевтическую пользу с долгосрочными рисками радиационно-индуцированной токсичности лечения, прежде чем принимать решение о том, какой метод следует использовать.В самом деле, в этом случае протонная терапия может значительно избежать воздействия на сердце, и ее следует искать в попытке снизить дозу на субструктуры сердца.
Учет поражения подмышечных впадин
Протонная терапия может значительно снизить дозу облучения груди за счет специального использования полей, которые входят сзади и не выходят через грудь. В качестве альтернативы, если нельзя использовать протоны, вместо них можно использовать другие методы смещения груди, такие как использование наклонной доски или физическое перемещение груди с пути луча.показывает, как протонная терапия может защитить грудь в случае поражения подмышечных впадин.
Поражение подмышечных впадин при презентации. (A) Аксиальный, коронарный и сагиттальный виды протонного плана (слева) и плана IMRT (справа) для пациента с поражением подмышек. Использование протонной терапии в этом случае щадит левую грудь. (B) Независимо от того, какой метод лечения выбран, IMRT (левая панель) и протонная (правая панель), ограничение объема, подвергаемого облучению, должны включать внимание к избеганию ванны с низкой дозой.(C) Предельная доза для легких. Если основной целью данного пациента является предотвращение поражения легких, особенно если пациент прошел легочную токсическую химиотерапию (например, любую комбинацию блеомицина, бусульфана, гемцитабина, брентуксимаба и т. Д.), Протонная терапия может лучше избавить легкие за счет уменьшения ванна с малой дозой облучения фотонами.
Рассмотрение дозы в груди
Долгосрочный риск развития рака груди связан с воздействием высоких и низких доз радиации. 37,52 Особенно при лечении молодых пациентов следует направлять усилия на поддержание максимально низкой дозы облучения тканей груди.В большинстве случаев, связанных с заболеванием средостения, подмышечная впадина не задействована, и доза облучения груди при IMRT или протонной терапии будет небольшой. Хотя IMRT приводит к тому, что большие объемы ткани молочной железы получают низкие дозы излучения, в некоторых случаях протонная терапия может привести к увеличению объемов ткани молочной железы, получающей высокие дозы излучения. Неизвестно, важнее ли минимизировать порцию с низкой дозой по сравнению с частью с высокой дозой; впоследствии средняя доза груди продолжает оставаться лучшим фактором для оценки различных планов.Однако в настоящее время высокая доза для небольшого объема обычно предпочтительнее, чем низкая доза для большого объема, основываясь на данных, предполагающих, что низкие дозы 4 Гр 37 могут быть связаны с риском долгосрочных вторичных злокачественных новообразований. особенно у пациентов моложе 24 лет. Хотя расчет дозы Travis et al. 37 относится к точечной дозе (а не к средней), мы все же рекомендуем проявлять осторожность, пытаясь сохранить среднюю дозу на грудь ≤ 4 Гр.
Когда необходимо покрыть внутригрудную болезнь, доза для груди может увеличиться, и избежать попадания в грудь становится трудно при использовании любого метода (протонного или фотонного).При выборе метода лечения для таких случаев необходимо учитывать дозы, получаемые другими критическими структурами, такими как сердце и легкие, особенно у пациентов, ранее лечившихся и получавших тяжелое лечение. Однако при рассмотрении того, как наилучшим образом ограничить объемы, подвергающиеся облучению, не менее важно избегать «ванн с малыми дозами» (т.е. облучения больших объемов низкими дозами), независимо от того, какой метод используется ().
Учет дозы в легких
С появлением планирования лимфомы средостения на основе КТ доза в легкие теперь может быть коррелирована с риском пневмонита.Рекомендуется ограничивать дозу для легких: V 5 <55%, средняя доза для легких <13,5 Гр и V 30 <20%. Эти значения более достижимы при использовании DIBH. 38 Хотя средняя доза в легких 13,5 Гр была связана с более низким риском пневмонита, рекомендуется стремиться к более низкой дозе, что довольно часто достижимо при использовании строгих ограничений. Например, когда используется IMRT, важно ограничить лучи некоторыми вариациями переднезадних лучей, избегая боковых лучей.Если основной целью данного пациента является предотвращение поражения легких, особенно если этот пациент получил легочную токсическую химиотерапию (например, блеомицин, бусульфан, гемцитабин, брентуксимаб), протонная терапия может лучше избавить легкие за счет уменьшения количества наблюдаемых ванн с низкой дозой с фотонами ().
Современные методы протонно-лучевой терапии
Протонная терапия с пассивным рассеянием
Протонная терапия с пассивным рассеянием (PSPT) – наименее сложный метод доставки протонов; луч расширяется в поперечном направлении за счет размещения рассеивающего материала на пути луча.Колеса модулятора диапазона или гребневые фильтры используются для создания расширенного пика Брэгга, области плоского распределения дозы, предназначенной для покрытия цели в поперечном и продольном направлениях. Полный пик Брэгга доставляется почти мгновенно (<0,1 секунды), поэтому нет взаимодействия между пучком протонов и физиологическим движением во время доставки, что делает PSPT наиболее надежной формой доставки протонов. 53
Проблемы при планировании PSPT
Соответствие целевой неоднородности (например, смежные подобъемы разного размера, формы и глубины) является сложной задачей; Лучи PSPT могут прилегать только к одной стороне мишени, проксимально или дистально.Кроме того, большие цели часто требуют согласования полей из-за ограниченного максимального размера рассеянных лучей. Неоднородность дозы, создаваемая согласованными лучами, смягчается за счет изменения согласованных линий, что увеличивает сложность лечения.
Управление движением в PSPT требует использования точного анализа движения, адекватного определения запаса и методов уменьшения движения. Для процедур свободного дыхания используется 4D CT для оценки смещения цели перпендикулярно лучу и для увеличения ширины луча.Вдоль луча движение оценивается по максимальной разнице в водоэквивалентной глубине от поверхности пациента до дистального края мишени для каждого луча на основе изменений плотности 4D CT и учитывается с помощью смазывания компенсатора. DIBH уменьшает движение цели и учитывает границы раздела тканей.
Плановая цель – CTV; когда на обрабатываемую область воздействует дыхательное движение, плановой целью является внутренний целевой объем (ITV), который охватывает движение CTV, отображаемое на 4D компьютерных томограммах.В качестве альтернативы, если лечение будет проводиться с помощью DIBH, ITV может быть получен из положений CTV, воспроизведенных из нескольких сканирований DIBH. Для формирования бокового луча расширение запаса для формирования PTV учитывает неопределенность настройки, а межфракционная изменчивость анатомии применяется к CTV / ITV. Коллиматоры пучка, ориентированные на пациента, согласовывают дозу латерально с PTV с запасом на полутень. В зависимости от целевой глубины и прилегающих тканей эти поля варьируются от 5 до 10 мм. Компенсаторы диапазона разработаны для каждого луча, чтобы дистально согласовать дозу с CTV / ITV.Смазка компенсатора диапазона в пределах радиуса, соответствующего допускам установки и движению ткани, применяется для учета изменений дальности действия протонов, вызванных изменениями плотности на пути луча. Кроме того, вдоль каждого луча дистальные и проксимальные границы устанавливаются на CTV / ITV для компенсации неопределенностей дальности протонов, как описано в разделе «Неопределенности дальности из-за изменений плотности». Несколько лучей (по сравнению с одним лучом) можно использовать для увеличения конформности дозы и уменьшения неопределенности дозы за счет распространения лучей в различных направлениях.Предпочтительно использовать переднее или заднее поля, а не оба, из-за необходимости избегать ненужного луча через сердце ().
Пример подхода с использованием 2 передних полей с протонной терапией, который может лучше защитить сердце и пищевод (справа) по сравнению с передним / задним доступом (слева).
Протонная терапия со сканированием карандашным лучом
По сравнению с PSPT, протонная терапия со сканированием карандашным лучом в активном режиме (PBSPT) предлагает потенциал для лучшей конформности и экономии OAR. 54 Поскольку лечение включает доставку индивидуально контролируемых точек, неоднородные дозы могут быть созданы намеренно. PBSPT может доставлять более низкие дозы в OAR за счет своей способности согласовывать дозу в непосредственной близости от мишени, за счет улучшенной конформности, удаленной от мишени, и за счет уменьшения образования вторичных нейтронов, образующихся в аппарате для лечения. 55,56 Однако поперечная ширина полутени некоторых неколлимированных сканируемых лучей может быть больше, чем у коллимированных пучков пассивно рассеянных протонов.Когда каждое сканированное лечебное поле используется для лечения целого объекта, этот метод называется «однородной дозой для одного поля». Конформность может быть дополнительно улучшена с использованием подхода с модуляцией интенсивности (т. Е. Протонной терапии с модуляцией интенсивности), в которой каждый пучок используется для обработки только части объема мишени; эта методика аналогична IMRT по принципу «шаг-и-стреляй». По сравнению с лучами PSPT, поля PBSPT больше, поэтому большие цели можно обрабатывать без согласованных полей. Однако, когда требуются совпадения, PBSPT позволяет «согласование градиента», 57,58 , что устраняет необходимость изменения линии совпадения.Согласование градиента можно использовать для встречных лучей, нацеленных на разные области сложных целевых объемов, как описано ниже.
Проблемы PBSPT
По сравнению с PSPT, PBSPT более чувствителен к изменениям плотности на пути луча; таким образом, управление движением имеет первостепенное значение. В то время как межфракционные изменения и уменьшение опухоли могут потребовать адаптивного планирования при PSPT, повышенная чувствительность к вариациям пути луча делает это еще более важным при использовании PBSPT.
Управление движением
Использование PBSPT требует пристального внимания к оценке внутрифракционного движения, которое обычно связано с дыхательным циклом.Технику свободного дыхания можно безопасно использовать при выполнении определенных условий. 54 Использование PBSPT со свободным дыханием требует 4D компьютерной томографии для оценки движения внутренних структур во время дыхательного цикла. Надежность повышается за счет использования стратегии перекраски, которая снижает вероятность эффекта взаимодействия. Для пациентов с целевым движением, превышающим 5 мм за дыхательные циклы, могут использоваться альтернативные стратегии, такие как DIBH, респираторное стробирование, сжатие живота или изменение положения.
Что касается расположения пациента, важно обеспечить воспроизводимость между фракциями. По сравнению с PSPT, PBSPT требует еще более строгой воспроизводимости из-за его большей чувствительности к изменениям плотности на пути луча.
Что касается расположения полей, метод PBSPT для переднего верхнего средостения и нижней части шеи обычно требует 1 (перекрашенный) или 2 передних поля. Для более сложных целевых объемов цели могут быть разделены на 2 или более частей (например, CTV шеи, CTV средостения и CTV подмышек), и может использоваться многополевой план ().В случаях, когда затрагиваются нижние (задние) и верхние (передние) мишени средостения, комбинация задних и передних полей может максимально защитить сердце и легкие (). Для целей в верхней части шеи боковые или задние поля могут избегать структур полости рта / слюнной железы. Для подмышечных мишеней заднее поле может помочь сохранить ткань груди. Хотя эти различные конфигурации полей могут использоваться в PSPT, согласование градиентов в PBSPT проще, когда поля перекрываются или противоположны, что устраняет необходимость в размытии.
Планы PBSPT с однородной дозой в одном поле и согласованием градиента с использованием передних и задних лучей для лечения заболевания, которое затрагивает двустороннюю верхнюю часть шеи и средостение (заболевание перед правыми отделами сердца).
Сканирование молодой женщины, у которой мишень включала средостение, левую парастернальную и левую подмышечную области. Одно переднее поле использовалось для средостения, а отдельное заднее поле – для подмышечной области.
Проверка положения пациента и распределения дозы в PSPT или PBSPT
Системы доставки протонов оснащены системами визуализации ортогональных кВ, используемых для ежедневной настройки пациента. В более новых системах есть КТ с коническим лучом. Хотя планы PSPT и PBSPT могут быть составлены с учетом ошибок настройки и движения дыхания, рекомендуется проверка дозы. Описанные ранее границы не защищают от непредсказуемых изменений, которые происходят во время курса лечения, таких как прогрессирование лимфомы, плевральный выпот, пневмония или потеря веса.Если установка лечения под контролем изображения не основана на трехмерной визуализации, рекомендуется повторить верификационную КТ-визуализацию и пересчитать дозу для проверки точности лечения. Рекомендуется адаптивное планирование (например, при рефрактерном рецидиве), когда целевой охват не поддерживается или ограничения по дозе OAR нарушаются во время курса лечения
Планирование лечения
Определение цели и границы
Определение цели соответствует современному определению облучения пораженных участков, ранее опубликованные Международной группой радиационной онкологии лимфомы (ILROG). 3 CTV / ITV и нормальные структуры разграничиваются таким же образом для протонной терапии и для фотонной терапии. Из-за неопределенностей в диапазоне протонов обоснованность концепции PTV сомнительна. В текущей практике PSPT поля для CTV назначаются для каждого луча, а боковые поля такие же, как для фотонов; однако дистальный и проксимальный края зависят от глубины дистального и проксимального краев мишени. Это приводит к тому, что называется «зависимым от луча PTV». Эта практика не применима к протонной терапии с модуляцией интенсивности, для которой рекомендуется надежная оптимизация.
Управление движением
4D компьютерная томография может помочь установить степень анатомического движения, вызванного дыханием, и соответствующее расширение ITV. Однако это вносит дополнительную неопределенность; для смягчения последнего необходимо увеличить объем излучения. Таким образом, использование DIBH идеально подходит для уменьшения подвижности средостения и его изменения формы в зависимости от дыхания (тоньше при вдохе, шире при свободном дыхании) (). 59 Это достигается путем сбора анатомических данных в фиксированной респираторной фазе.DIBH может иметь дополнительное преимущество, заключающееся в смещении сердца вниз, а также в расширении легких от цели, потенциально снижая дозу, полученную этими OAR.
Использование DIBH может помочь справиться с некоторыми неопределенностями, связанными с использованием протонной терапии. По сравнению со свободным дыханием (правая панель), ДИБГ расширяет легкие, перемещает сердце вниз и вызывает истончение средостения (левая панель).
DIBH может выполняться несколькими способами, например, путем активного блокирования воздушного потока, произвольной задержки дыхания или синхронизации (дыхательного стробирования).Каждый из этих методов имеет преимущества и ограничения при использовании с протонной терапией, особенно PBSPT, который имеет тенденцию иметь более длительное время включения луча, чем PSPT. Следует оценить межфракционную воспроизводимость положения диафрагмы во время фракции излучения. 60,61 Независимо от используемой техники задержки дыхания, бортовая визуализация может быть полезна для проверки и проверки ежедневной воспроизводимости объема легких по сравнению с данными КТ для планирования лечения.
Резюме и направления на будущее
Использование протонной терапии при лимфомах, поражающих средостение, является многообещающим, и методы лечения продолжают развиваться.Дозиметрическое преимущество снижения дозы OAR при определенных распределениях заболеваний может быть значительным и весьма желательным. Однако ограниченная доступность протонной терапии требует выбора случая, основанного на четком понимании того, какие случаи принесут наибольшую пользу от протонной терапии по сравнению с передовыми фотонными методами.
Каждый центр протонной терапии имеет разные возможности и методы, и пока нет единого метода протонной лучевой терапии для пациентов с лимфомой.В конечном итоге должны применяться ключевые инструменты и концепции, а также должны быть приобретены минимальные требования к компетентности для тех, кто намеревается использовать протонную терапию.
Дополнительные материалы
Онлайн-версия этой статьи содержит дополнение с данными.
Авторство
Вклад: Все авторы внесли свой вклад в создание рукописи; разногласия во мнениях разрешались консенсусом большинства.
Раскрытие информации о конфликте интересов: авторы заявляют об отсутствии конкурирующих финансовых интересов.
Список членов руководящего комитета Международной группы радиационной онкологии лимфомы приведен в онлайн-приложении.
Для корреспонденции: Бутхайна Шбиб Дабая, отделение радиационной онкологии, Онкологический центр им. Доктора медицины Андерсона Техасского университета, 1515 Holcombe Blvd, Houston, TX 77030; электронная почта: gro.nosrednadm@ajabadb.
СПИСОК ЛИТЕРАТУРЫ
1. Ценг Ю.Д., Каттер Д.Д., Пластарас Дж. П. и др. . Основанный на фактах обзор использования протонной терапии при лимфоме, подготовленный Подкомитетом по лимфоме Совместной группы по терапии частиц (PTCOG).Int J Radiat Oncol Biol Phys. 2017; 99 (4): 825-842. [PubMed] [Google Scholar] 2. Яхалом Дж., Иллидж Т., Шпехт Л. и др. ; Международная группа радиационной онкологии лимфомы. Современная лучевая терапия экстранодальных лимфом: полевые и дозовые рекомендации Международной группы радиационной онкологии лимфомы. Int J Radiat Oncol Biol Phys. 2015; 92 (1): 11-31. [PubMed] [Google Scholar] 3. Шпехт Л., Яхалом Дж., Иллидж Т. и др. ; ILROG. Современная лучевая терапия лимфомы Ходжкина: полевые и дозовые рекомендации Международной группы радиационной онкологии лимфомы (ILROG).Int J Radiat Oncol Biol Phys. 2014; 89 (4): 854-862. [PubMed] [Google Scholar] 4. Иллидж Т., Шпехт Л., Яхалом Дж. И др. ; Международная группа радиационной онкологии лимфомы. Современная лучевая терапия для узловой неходжкинской лимфомы. Определение цели и рекомендации по дозировке от Международной группы радиационной онкологии лимфомы. Int J Radiat Oncol Biol Phys. 2014; 89 (1): 49-58. [PubMed] [Google Scholar] 5. Ходжсон Д.К., Дикманн К., Терезакис С., Константин Л.; Международная группа радиационной онкологии лимфомы. Внедрение современных концепций планирования лучевой терапии для детской лимфомы Ходжкина: рекомендации Международной группы радиационной онкологии лимфомы.Практик Радиат Онкол. 2015; 5 (2): 85-92. [PubMed] [Google Scholar] 6. Homann K, Howell R, Eley J, et al. . Необходимость индивидуальных исследований для сравнения риска радиогенного второго рака (РСК) при лечении пациентов с протонной и фотонной лимфомой Ходжкина. J Протонная терапия. 2015; 1 (1): 118. [Google Scholar] 7. Элей Дж., Ньюхаузер В., Хоманн К. и др. . Реализация аналитической модели эквивалентной дозы нейтронов утечки в системе планирования протонной лучевой терапии. Раки (Базель). 2015; 7 (1): 427-438. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Цзэн С., Пластарас Дж. П., Джеймс П. и др. . Сканирование протонным карандашным пучком для лимфомы средостения: планирование лечения и оценка устойчивости. Acta Oncol. 2016; 55 (9-10): 1132-1138. [PubMed] [Google Scholar] 9. Йоргенсен А.Ю., Маральдо М.В., Бродин Н.П. и др. . Воздействие на пищевод после различных методов лучевой терапии лимфомы Ходжкина на ранней стадии. Acta Oncol. 2013; 52 (7): 1559-1565. [PubMed] [Google Scholar] 10. Саксман С., Хоппе Б.С., Менденхолл Н.П. и др. . Протонная терапия поддиафрагмальной области при ведении пациентов с лимфомой Ходжкина.Лимфома лейка. 2015; 56 (7): 2019-2024. [PubMed] [Google Scholar] 11. Маральдо М.В., Бродин П., Азнар М.К. и др. . Дозы в сонные артерии после современной лучевой терапии лимфомы Ходжкина: инсульт все еще является поздним эффектом лечения? Int J Radiat Oncol Biol Phys. 2013; 87 (2): 297-303. [PubMed] [Google Scholar] 12. Тольц А., Шин Н., Митроу Э и др. . Поздняя лучевая токсичность у больных лимфомой Ходжкина: возможности протонной терапии. J Appl Clin Med Phys. 2015; 16 (5): 167-178. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13.Хольцман А.Л., Хоппе Б.С., Ли Зи и др. . Повышение терапевтического индекса при детской лимфоме Ходжкина III / IV стадии с помощью протонной терапии. Int J Part Ther. 2014; 1 (2): 343-356. [Google Scholar] 14. Knäusl B, Lütgendorf-Caucig C, Hopfgartner J, et al. . Можно ли улучшить лечение детской лимфомы Ходжкина с помощью ПЭТ-визуализации и протонной терапии? Strahlenther Onkol. 2013; 189 (1): 54-61. [PubMed] [Google Scholar] 15. Андолино Д.Л., Хоэн Т., Сяо Л., Буксбаум Дж., Чанг А.Л. Дозиметрическое сравнение трехмерной конформной фотонной радиотерапии с вовлеченным полем и протонной терапии с сохранением груди для лечения лимфомы Ходжкина у педиатрических пациентов женского пола.Int J Radiat Oncol Biol Phys. 2011; 81 (4): e667-e671. [PubMed] [Google Scholar] 16. Cella L, Conson M, Pressello MC и др. . Методы лучевой терапии новой лимфомы Ходжкина: компромисс между поздней радиоиндуцированной токсичностью и вторичными злокачественными новообразованиями. Радиат Онкол. 2013; 8 (1): 22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Чера Б.С., Родригес С., Моррис К.Г. и др. . Дозиметрическое сравнение трех различных методов локального облучения пациентов с лимфомой Ходжкина II стадии: обычная лучевая терапия, лучевая терапия с модуляцией интенсивности и трехмерная протонная лучевая терапия.Int J Radiat Oncol Biol Phys. 2009; 75 (4): 1173-1180. [PubMed] [Google Scholar] 18. Хоппе Б.С., Флампури С., Зайден Р. и др. . Протонная терапия вовлеченных узлов в комбинированную терапию лимфомы Ходжкина: результаты исследования фазы 2. Int J Radiat Oncol Biol Phys. 2014; 89 (5): 1053-1059. [PubMed] [Google Scholar] 19. Хорн С., Фурнье-Бидоз Н., Пернин В. и др. . Сравнение пассивно-лучевой протонной терапии, спиральной томотерапии и трехмерной конформной лучевой терапии у пациенток с лимфомой Ходжкина, получающих лучевую терапию вовлеченного поля или пораженного участка.Рак Радиотермой. 2016; 20 (2): 98-103. [PubMed] [Google Scholar] 20. Маральдо М.В., Бродин Н.П., Азнар М.К. и др. . Дозы для нормальных тканей головы и шеи при ранней стадии лимфомы Ходжкина после лучевой терапии пораженных узлов. Радиатор Oncol 2014; 110 (3): 441-447. [PubMed] [Google Scholar] 21. Ли Дж., Дабаджа Б., Рид В. и др. . Обоснование и предварительные результаты протонно-лучевой терапии лимфомы средостения. Int J Radiat Oncol Biol Phys 2011; 81 (1): 167-174. [PubMed] [Google Scholar] 22.Хоппе Б.С., Цай Х., Ларсон Г. и др. . Паттерны протонной терапии и ранние результаты лечения лимфомы Ходжкина: результаты из реестра Proton Collaborative Group. Acta Oncol. 2016; 55 (11): 1378-1380. [PubMed] [Google Scholar] 23. Хоппе Б.С., Хилл-Кайзер К.Э., Ценг Ю.Д. и др. . Консолидирующая протонная терапия после химиотерапии у пациентов с лимфомой Ходжкина. Энн Онкол. 2017; 28 (9): 2179-2184. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Нанда Р., Флампури С., Менденхолл Н. П. и др. . Легочная токсичность после протонной терапии лимфомы грудной клетки.Int J Radiat Oncol Biol Phys. 2017; 99 (2): 494-497. [PubMed] [Google Scholar] 26. Международная комиссия по радиационным единицам и измерениям. Назначение, запись и сообщение о протонно-лучевой терапии. Отчет ICRU 78 . [Google Scholar] 27. Eley JG, Newhauser WD, Lüchtenborg R, Graeff C, Bert C. 4D оптимизация терапии с отслеживанием движущихся опухолей со сканированным ионным пучком. Phys Med Biol 2014; 59 (13): 3431-3452. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Элей Дж. Г., Ньюхаузер В. Д., Рихтер Д., Люхтенборг Р., Сайто Н., Берт К.Устойчивость покрытия целевой дозы к неопределенностям движения для лечения движущихся опухолей со сканированным пучком ионов углерода. Phys Med Biol 2015; 60 (4): 1717-1740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Чжу З., Лю В., Гиллин М. и др. . Оценка устойчивости протонной терапии с пассивным рассеянием в отношении местного рецидива немелкоклеточного рака легкого III стадии: вторичный анализ исследования фазы II. Радиат Онкол. 2014; 9 (1): 108. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32.Мойерс М.Ф., Миллер Д.В., Буш Д.А., Слейтер Д.Д. Методологии и инструменты для проектирования пучков протонов для опухолей легких. Int J Radiat Oncol Biol Phys. 2001; 49 (5): 1429-1438. [PubMed] [Google Scholar] 33. Куарон Дж. Дж., Чанг С., Лавлок М. и др. . Экспоненциальное увеличение относительной биологической эффективности вдоль дистального края протонного пика Брэгга, измеренное по разрывам двухцепочечной дезоксирибонуклеиновой кислоты. Int J Radiat Oncol Biol Phys. 2016; 95 (1): 62-69. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Гуан Ф., Бронк Л., Титт У. и др.. Пространственное отображение биологической эффективности сканированных пучков частиц: к биологически оптимизированной терапии частицами. Научный доклад 2015; 5 (1): 9850. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Веденберг М., Линд Б.К., Хордемарк Б. Модель относительной биологической эффективности протонов: тканевый параметр α / β фотонов является предиктором чувствительности к изменениям ЛПЭ. Acta Oncol. 2013; 52 (3): 580-588. [PubMed] [Google Scholar] 36. Малруни Д.А., Йазель М.В., Кавашима Т. и др. . Сердечные исходы в когорте взрослых, переживших рак в детском и подростковом возрасте: ретроспективный анализ когорты исследования выживших после рака.BMJ. 2009; 339: b4606. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Трэвис Л. Б., Хилл Д. А., Дорес Г. М. и др. . Рак груди после лучевой терапии и химиотерапии у молодых женщин с болезнью Ходжкина. ДЖАМА. 2003; 290 (4): 465-475. [PubMed] [Google Scholar] 38. Pinnix CC, Smith GL, Milgrom S и др. . Предикторы лучевого пневмонита у пациентов, получающих лучевую терапию с модуляцией интенсивности по поводу Ходжкина и неходжкинской лимфомы. Int J Radiat Oncol Biol Phys. 2015; 92 (1): 175-182. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39.Маральдо М.В., Джусти Ф., Фогелиус И.Р. и др. . Сердечно-сосудистые заболевания после терапии лимфомы Ходжкина: подробный анализ 9 совместных исследований EORTC-LYSA. Lancet Haematol. 2015; 2: e492-e502. [PubMed] [Google Scholar] 40. ван Нимвеген Ф.А., Шаапвельд М., Каттер Д.Д. и др. . Зависимость радиационной доза-реакция для риска ишемической болезни сердца у выживших после лимфомы Ходжкина. J Clin Oncol. 2016; 34 (3): 235-243. [PubMed] [Google Scholar] 41. Каттер Д. Д., Шаапвельд М., Дарби С. К. и др. . Риск порока сердца после лечения лимфомы Ходжкина.J Natl Cancer Inst. 2015; 107 (4): djv008. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Ньюхаузер В.Д., Шнайдер С., Уилсон Л., Шреста С., Донахью В. Обзор аналитических моделей воздействия паразитного излучения при лучевой терапии фотонами и протонами. Radiat Prot Dosimetry. 2018; 180 (1-4): 245-251. [PubMed] [Google Scholar] 43. Stokkevåg CH, Schneider U, Muren LP, Newhauser W. Прогнозирование риска радиационно-индуцированного рака в протонной и тяжелой ионной радиотерапии. Phys Med. 2017; 42: 259-262. [PubMed] [Google Scholar] 44.Ньюхаузер У.Д., Беррингтон де Гонсалес А., Шульте Р., Ли К. Обзор исследований поздних эффектов, вызванных лучевой терапией, после лечения с использованием передовых технологий. Фасад Онкол. 2016; 6: 13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Дарби С.К., Эверц М., МакГейл П. и др. . Риск ишемической болезни сердца у женщин после лучевой терапии рака груди. N Engl J Med. 2013; 368 (11): 987-998. [PubMed] [Google Scholar] 46. Фэн М., Моран Дж. М., Келлинг Т. и др. . Разработка и проверка атласа сердца для изучения воздействия радиации на сердце после лечения рака груди.Int J Radiat Oncol Biol Phys. 2011; 79 (1): 10-18. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Хоппе Б.С., Флампури С., Су Зи и др. . Эффективное снижение дозы на сердечные структуры с использованием протонов по сравнению с 3DCRT и IMRT при лимфоме Ходжкина средостения. Int J Radiat Oncol Biol Phys. 2012; 84 (2): 449-455. [PubMed] [Google Scholar] 48. Азнар М.К., Маральдо М.В., Шут Д.А. и др. . Минимизация поздних эффектов у пациентов с лимфомой Ходжкина средостения: задержка дыхания на глубоком вдохе, IMRT или и то, и другое? Int J Radiat Oncol Biol Phys.2015; 92 (1): 169-174. [PubMed] [Google Scholar] 49. Voong KR, McSpadden K, Pinnix CC и др. . Дозиметрические преимущества метода «бабочка» для лучевой терапии с модуляцией интенсивности у молодых пациенток с лимфомой Ходжкина средостения. Радиат Онкол. 2014; 9 (1): 94. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Дабая Б.С., Ребуэно Н.С., Мазлум А. и др. . Облучение лимфомы Ходжкина у молодых пациенток: новый метод, позволяющий избежать попадания в грудь и снизить дозу облучения сердца. Int J Radiat Oncol Biol Phys.2011; 79 (2): 503-507. [PubMed] [Google Scholar] 51. Фиандра С., Филиппи А.Р., Катуццо П. и др. . Различные решения IMRT по сравнению с 3D-конформной лучевой терапией на ранней стадии лимфомы Ходжкина: дозиметрическое сравнение и клинические соображения. Радиат Онкол. 2012; 7 (1): 186. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Шаапвельд М., Алеман Б.М., ван Эггермонд А.М. и др. . Второй риск рака до 40 лет после лечения лимфомы Ходжкина. N Engl J Med. 2015; 373 (26): 2499-2511. [PubMed] [Google Scholar] 53.Мэтни Дж., Парк ПК, Блуетт Дж. И др. . Влияние дыхательного движения на терапию пассивно рассеянными протонами по сравнению с фотонной терапией с модуляцией интенсивности при раке легких III стадии: являются ли протонные планы более чувствительными к дыхательному движению? Int J Radiat Oncol Biol Phys. 2013; 87 (3): 576-582. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Zeng C, Plastaras JP, Tochner ZA, et al. . Сканирование протонным карандашным лучом при лимфоме средостения: влияние взаимодействия между движением цели и сканированием луча. Phys Med Biol.2015; 60 (7): 3013-3029. [PubMed] [Google Scholar] 55. Захарату Ярлског К., Ли К., Болч В.Е., Сюй XG, Паганетти Х. Оценка органо-специфических эквивалентных доз нейтронов в протонной терапии с использованием компьютерных возрастных воксельных фантомов для всего тела. Phys Med Biol. 2008; 53 (3): 693-717. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Атар Б.С., Беднарз Б., Секо Дж., Хэнкокс К., Паганетти Х. Сравнение доз фотонов вне поля при IMRT 6 МВ и доз нейтронов при протонной терапии для взрослых и детей.Phys Med Biol. 2010; 55 (10): 2879-2891. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Lomax AJ. Протонная терапия с модуляцией интенсивности и ее чувствительность к неопределенностям лечения 2: потенциальные эффекты межфракционных и межполевых движений. Phys Med Biol. 2008; 53 (4): 1043-1056. [PubMed] [Google Scholar] 58. Лин Х, Динг Х, Кирк М. и др. . Краниоспинальное облучение в положении лежа на спине с использованием метода сканирования карандашным пучком протонов без изменения линий совпадения для полевых стыков. Int J Radiat Oncol Biol Phys .2014; 90 (1): 71-78. [PubMed] [Google Scholar] 59. Хоппе Б.С., Менденхолл Н.П., Луи Д., Ли З., Флампури С. Сравнение задержки дыхания и свободного дыхания во время лучевой терапии с модуляцией интенсивности и протонной терапии у пациентов с лимфомой Ходжкина средостения. Int J Part Ther. 2017; 3 (4): 492-496. [Google Scholar] 60. О’Брайен Р.Т., Купер Б.Дж., Кипритидис Дж., Шие С.К., Килл П.Дж. Компьютерная томография с четырехмерным конусным лучом, управляемая дыхательным движением: определение нерегулярного дыхания. Phys Med Biol. 2014; 59 (3): 579-595.[PubMed] [Google Scholar] 61. Wong JW, Sharpe MB, Jaffray DA, et al. . Использование активного контроля дыхания (ABC) для уменьшения запаса дыхательных движений. Int J Radiat Oncol Biol Phys. 1999; 44 (4): 911-919. [PubMed] [Google Scholar] 62. Pinnix CC, Cella L, Andraos TY и др. . Предикторы гипотиреоза у выживших после лимфомы Ходжкина после модуляции интенсивности по сравнению с трехмерной лучевой терапией. Int J Radiat Oncol Biol Phys. 2018; 101 (3): 530-540. [Бесплатная статья PMC] [PubMed] [Google Scholar]Роль лучевой терапии в лечении первичной В-крупноклеточной лимфомы средостения
Резюме
Роль лучевой терапии (ЛТ) в лечении первичной В-крупноклеточной лимфомы средостения (PMLBCL) неясно.В настоящем исследовании был проведен ретроспективный анализ 63 пациентов с PMLBCL, получавших или не получавших лучевую терапию, для оценки роли лучевой терапии. Клинические исходы рассчитывались с использованием метода Каплана-Мейера и сравнивались между пациентами, которые получали и не получали лучевую терапию, с использованием лог-рангового теста. Многофакторный анализ был выполнен с использованием модели пропорциональных рисков Кокса. После химиотерапии 35 пациентов получили лучевую терапию, и было обнаружено, что лучевая терапия была связана со значительным улучшением 5-летней общей выживаемости (ОВ) (87 vs.58%; P = 0,001) и 5-летняя выживаемость без прогрессирования (PFS) (75 против 39%; P = 0,001) по сравнению с пациентами без лучевой терапии. Анализ подгрупп 35 пациентов, получавших ритуксимаб в сочетании с химиотерапией, показал, что ЛТ не улучшила 5-летнюю выживаемость (88 против 92%; P = 0,814) или 5-летнюю ВБП (78 против 65%; P = 0,511). показатели по сравнению с пациентами без лучевой терапии. При многофакторном анализе RT и добавление ритуксимаба предсказывали увеличение OS [RT: отношение рисков (HR) 0,157; P = 0,018; ритуксимаб: HR 0,156; Р = 0.009] и ВБП (RT: HR 0,111, P = 0,001; ритуксимаб: HR 0,231, P = 0,002). Однако роль RT в PMLBCL в эпоху ритуксимаба неясна. Требуются дальнейшие исследования роли лучевой терапии в эпоху таргетной терапии.
Ключевые слова: первичная крупноклеточная B-клеточная лимфома средостения, лучевая терапия, ритуксимаб, прогноз
Введение
Первичная крупноклеточная B-лимфома средостения (PMLBCL), происходящая из В-клеток тимуса, когда-то была признана отличительной клинической картиной. патологический подтип диффузной крупноклеточной B-клеточной лимфомы (DLBCL) по данным Всемирной организации здравоохранения (ВОЗ) в 2008 г. (1,2).ПМЛБКЛ поражает молодых людей, чаще всего у женщин. Пациенты имеют объемное новообразование средостения, которое обычно связано с инфильтрацией соседних органов и синдромом верхней полой вены (3–5).
Оптимальное лечение PMLBCL остается неопределенным. Режим циклофосфамида, доксорубицина, винкристина и преднизона (CHOP) считается менее эффективным по сравнению с другими более интенсивными режимами (6-10), такими как режимы метотрексата, цитарабина, циклофосфамида, винкристина, преднизона и блеомицина (MACOP-B), дозы -плотные режимы или даже высокодозная консолидированная терапия на переднем крае и трансплантация аутологичных стволовых клеток.Однако сейчас ожидается, что ни один из этих усиленных подходов не даст результатов, превосходящих результаты, наблюдаемые при использовании ритуксимаба плюс CHOP (RCHOP). Ритуксимаб, как моноклональное антитело, произвел революцию в лечении агрессивных В-клеточных лимфом (11,12). Ряд исследований подтвердил, что RCHOP улучшает исходы у пациентов с PMLBCL (13–15). Хотя большинство пациентов первоначально реагируют на этот терапевтический подход, у некоторых пациентов возникает рецидив и в конечном итоге болезнь умирает. Поэтому исследования в настоящее время сосредоточены на дополнительных методах лечения, таких как лучевая терапия (ЛТ).Вопрос о том, полезно ли введение лучевой терапии после химиотерапии для пациентов с PMLBCL, остается нерешенным, особенно в эпоху ритуксимаба. Таким образом, в настоящем исследовании обобщены клинические данные 63 пациентов с PMLBCL, которые лечились в дочерних больницах (больница Xiangya, вторая больница Xiangya и дочерняя онкологическая больница медицинской школы Xiangya) Центрального Южного университета (Чанша, Китай) в период с января. 2000 г. и январь 2013 г., в попытке исследовать роль лучевой терапии при PMLBCL.
Обсуждение
Роль RT в PMLBCL всегда противоречива. В эпоху пре-ритуксимаба многочисленные исследования оценивали роль лучевой терапии. Данные исследования 138 пациентов с PMLBCL, которые лечились в 13 итальянских учреждениях, показали, что IFRT в сочетании с химиотерапией улучшили результат по сравнению с одной химиотерапией (P = 0,04), в то время как объединение IF-RT в средостение еще больше улучшило исход пациентов с CR (8 ). Ретроспективное исследование 53 пациентов с PMLBCL, получавших MACOP-B (метотрексат, доксорубицин, циклофосфамид, винкристин, преднизон, блеомицин) / VACOP-B (этопозид, доксорубицин, циклофосфамид, винкристин, преднизон, блеомицин, Италия), из Италии, показало что 5-летняя безрецидивная выживаемость и ОВ составили 93.42 и 86,6% соответственно. В общей сложности 37,7% пациентов достигли полного ответа, а 56,6% пациентов достигли ОР после IFRT плюс химиотерапия, в то время как 92% пациентов, которые уже получили PR, улучшились до полного ответа после лучевой терапии (20). Другое ретроспективное исследование, проведенное группой из Рима, Италия, включало 85 пациентов с PMLBCL, все из которых получали схему MACOP-B плюс IFRT третьего поколения. После среднего периода наблюдения 81 месяц прогрессирование или рецидив наблюдался у 15 из 84 пациентов (17.9%). Показатели 5-летнего ОВ и ВБП составили 87 и 81% соответственно. Это исследование показало, что MACOP-B и IFRT вызывают высокий ответ и выживаемость без лимфомы (10). В настоящем исследовании ЛТ ассоциировалась со значительно улучшенными показателями ВБП и ОВ по сравнению с пациентами без ЛТ, и, кроме того, анализ, проведенный на пациентах, которые достигли большего, чем PD после химиотерапии, показал, что ЛТ была связана со значительным улучшением 5-летнего показателя ОВ. и продемонстрировал тенденцию к повышению уровня безболезненной выживаемости за 5 лет, что аналогично результатам вышеупомянутых исследований.
Однако есть несколько исследований, которые не поддерживают эту точку зрения. Исследование Университета Британской Колумбии, в котором участвовал 151 пациент, показало, что при сравнении периодов времени до и после рутинного проведения лучевой терапии не было существенной разницы в 5-летней выживаемости без плода (74 против 62%; P = 0,09) или Показатели ОС (78 против 69%; P = 0,14) (21). Аналогичным образом, исследование, проведенное во Франции, показало, что при сравнении СНОР с усиленной дозой и СНОР плюс ЛТ, ЛТ может не быть необходимой при ПМЛККЛ, когда CR или CR, неподтвержденные, достигаются с помощью химиотерапии с усиленной дозой (6).
Действительно, все вышеупомянутые исследования были выполнены в эпоху, предшествовавшую лечению ритуксимабом. Ритуксимаб, как кластер дифференцированных 20 антител, произвел революцию в лечении агрессивных В-клеточных лимфом. В текущих рекомендациях Национальной комплексной онкологической сети 2013 г. ритуксимаб рекомендован в качестве препарата первой линии для лечения ПМЛКК. Ритуксимаб в сочетании с химиотерапией был подтвержден как очень эффективный и безопасный для PMLBCL в нескольких исследованиях (14, 15, 22), а превосходство некоторых интенсивных схем над CHOP для лечения PMBCL исчезло после добавления ритуксимаба (23).
Тем не менее, несколько исследований показали, что RCHOP был связан с высоким уровнем первичной рефрактерной болезни. Исследование 37 пациентов с PMLBCL показало, что ~ 50% пациентов с PMBCL показали остаточную болезнь при ПЭТ-сканировании после ритуксимаба в сочетании с химиотерапией (24). Недавнее ретроспективное исследование 63 пациентов с PMLBCL, получавших RCHOP, показало, что первичная индукционная недостаточность произошла у 13 (20,6%) пациентов (25).
Кроме того, был поднят вопрос о том, требуется ли IFRT для PMLBCL в эпоху ритуксимаба.В попытке прояснить роль лучевой терапии в текущих стандартах лечения недавно было опубликовано несколько исследований. Исследование, проведенное в Пекине, Китай, с участием 79 пациентов с PMLBCL, показало, что ЛТ плюс химиотерапия RCHOP была связана с отличной выживаемостью и показателями местного контроля. Частота 5-летнего ОВ, ВБП и местного контроля для пациентов на ранней стадии составила 73,6, 69,9 и 92,6% для химиотерапии и лучевой терапии и 50,8% (P = 0,076), 36,9% (P = 0,008) и 56,4% (P < 0,001) только для химиотерапии соответственно (5).Однако другое исследование, проведенное группой из Греции, показало, что добавление ЛТ к химиотерапии RCHOP не улучшило 5-летнюю ВБП (92 против 93%; P> 0,2) и 5-летнюю выживаемость (96 против 100%; P> 0,2) по сравнению с одним RCHOP (15). Группа Национального института рака представила обнадеживающие данные в отношении 51 пациента с PMLBCL, которые получали химиотерапию этопозидом, доксорубицином, циклофосфамидом, винкристином, преднизоном и ритуксимабом (DA-EPOCH-R) без рутинного использования лучевой терапии.В течение среднего 5-летнего периода наблюдения выживаемость без событий и общая выживаемость составили 93 и 97% соответственно. Всего 96% пациентов достигли полного ответа (26). Результат показал, что DA-EPOCH-R имеет высокий уровень излечения и устраняет необходимость в лучевой терапии у пациентов с PMLBCL.
Хотя настоящие результаты показали, что ЛТ была связана с улучшением выживаемости для всех пациентов, в анализе подгрупп 35 пациентов, получавших RCHOP, было показано, что ЛТ не может улучшить 5-летнюю выживаемость (88 vs.92%; P = 0,814) и 5-летняя ВБП (78 против 65%; P = 0,511) по сравнению с одним только RCHOP. Однако эти результаты были ограниченными, поскольку исследование было ретроспективным и имело несбалансированное количество пациентов, получавших ЛТ в сочетании с химиотерапией по сравнению с одной химиотерапией.
Настоящее исследование не может адекватно определить, можно ли безопасно пропустить дозу ЛТ в эру ритуксимаба у отдельных пациентов, поскольку опубликованный опыт применения ЛТ в сочетании с RCHOP (или ритуксимабом в сочетании с другим режимом химиотерапии) у пациентов с PMLBCL остается ограниченным и в основном основывается на небольшая серия пациентов.Замена RT на ритуксимаб требует дальнейшего исследования.
Таким образом, настоящее исследование продемонстрировало, что лучевая терапия в сочетании с химиотерапией может улучшить выживаемость для всех пациентов с PMLBCL, но лучевая терапия не улучшила выживаемость пациентов, получавших ритуксимаб. Это можно рассматривать как вариант для пациентов с PMLBCL. В отношении лечения PMLBCL остается ряд безответных вопросов. Роль лучевой терапии в эпоху таргетной терапии следует оценить в будущих рандомизированных клинических исследованиях.
Протонное излучение при лимфоме с поражением средостения – Просмотр полного текста
Если человек соглашается участвовать в этом исследовании, его попросят пройти некоторые скрининговые тесты или процедуры для подтверждения права на участие. Многие из этих тестов и процедур, вероятно, будут частью регулярного лечения рака и могут быть выполнены, даже если окажется, что пациент не принимает участие в исследовании. Если пациенту недавно были сделаны некоторые из этих тестов или процедур, их можно или не нужно будет повторять.Эти тесты и процедуры включают в себя: сбор анамнеза, состояние работоспособности, физический осмотр, оценку опухоли, эхокардиограмму, электрокардиограмму, функциональные тесты легких (легких) и анализы крови. Если эти тесты покажут, что пациент имеет право участвовать в исследовательском исследовании, он приступит к исследуемому лечению. Если пациент не соответствует критериям отбора, он не сможет участвовать в исследовании.
Протонное излучение будет доставляться ежедневно в течение 2–5 недель, в зависимости от дозы, предписанной вашим врачом.Лечение проводится (понедельник-пятница) в течение 5 дней (без выходных и праздников). Для каждой процедуры вам потребуется полежать на столе от 30 до 45 минут.
Участники получат лучевую терапию амбулаторно в Массачусетской больнице общего профиля. Во время лучевой терапии они будут проходить следующие еженедельные осмотры и процедуры: физический осмотр, оценка любых побочных эффектов, анализы крови на сердечные маркеры.
Участников исследования попросят вернуться на контрольный визит через 6–12 недель после приема последней дозы лучевой терапии.Во время этого визита будут выполнены следующие тесты и процедуры: ПЭТ / КТ, физический осмотр, оценка побочных эффектов и анализы крови на сердечные маркеры.
Участников также попросят вернуться для контрольного посещения через 6 месяцев, 12 месяцев и ежегодно в течение пяти лет после облучения. Поддержание связи с участниками исследования и проверка их состояния помогает исследователям взглянуть на долгосрочные результаты исследования. Во время этих посещений будут выполнены следующие тесты и процедуры: медицинский осмотр, оценка любых побочных эффектов, ЭКГ, ЭХО, легочные тесты, ПЭТ / КТ сканирование, стандартные анализы крови и анализы крови на сердечные маркеры (в 6 месяцев и 1 год. Только).
Лечение первичной В-крупноклеточной лимфомы средостения: моноцентрический опыт двух десятилетий с 98 пациентами | BMC Cancer
Harris NL, Jaffe ES, Stein H, Banks PM, Chan JK, Cleary ML, et al. Пересмотренная европейско-американская классификация лимфоидных новообразований: предложение Международной исследовательской группы лимфомы. Кровь. 1994; 84: 1361–92.
CAS PubMed Google Scholar
Бэнкс П.М., Варнке Р.А.Большая B-клеточная лимфома средостения (тимуса). В: Jaffe ES, Harris NL, Stein H и др., Редакторы. Классификация опухолей Всемирной организации здравоохранения. Патология и генетика опухолей кроветворной и лимфоидной тканей. Лион: IARC Press; 2001. с. 175–6.
Google Scholar
Родригес Дж., Конде Э, Гутьеррес А., Гарсия Дж. К., Лахуэрта Дж. Дж., Варела М. Р. и др. Первичная крупноклеточная лимфома средостения (PMBL): лечение на переднем крае с трансплантацией аутологичных стволовых клеток (ASCT).Опыт ГЕЛ-ТАМО. Гематол Онкол. 2008; 26: 171–8.
Артикул PubMed Google Scholar
Pfreundschuh M, Trümper L, Osterborg A, Pettengell R, Trneny M, Imrie K, et al. CHOP-подобная химиотерапия плюс ритуксимаб в сравнении с одной только CHOP-подобной химиотерапией у молодых пациентов с диффузной большой B-клеточной лимфомой с хорошим прогнозом: рандомизированное контролируемое исследование, проведенное группой Mabthera International Trial (MInT). Ланцет Онкол. 2006; 7: 379–91.
CAS Статья PubMed Google Scholar
Coiffier B, Lepage E, Briere J, Herbrecht R, Tilly H, Bouabdallah R, et al. Химиотерапия CHOP плюс ритуксимаб по сравнению с только CHOP у пожилых пациентов с диффузной В-крупноклеточной лимфомой. N Engl J Med. 2002; 346: 235–42.
CAS Статья PubMed Google Scholar
Todeschini G, Secchi S, Morra E, Vitolo U, Orlandi E, Pasini F, et al.Первичная крупноклеточная B-клеточная лимфома средостения (PMLBCL): долгосрочные результаты ретроспективного многоцентрового итальянского опыта у 138 пациентов, получавших CHOP или MACOP-B / VACOP-B. Брит Дж. Рак. 2004; 90: 372–6.
CAS Статья PubMed PubMed Central Google Scholar
Климо П., Коннорс Дж. М.. Химиотерапия MACOP-B для лечения диффузной В-крупноклеточной лимфомы. Ann Intern Med. 1985. 102: 596–601.
CAS Статья PubMed Google Scholar
Бертини М., Орсуччи Л., Витоло Ю., Левис А., Тодескини Г., Менегини В. и др. Большая B-клеточная лимфома со склерозом стадии II, леченная MACOP-B. Энн Онкол. 1991; 2: 733–7.
CAS Статья PubMed Google Scholar
Zinzani PL, Bendandi M, Frezza G, Gherlinzoni F, Merla E, Salvucci M, et al. Первичная В-клеточная лимфома средостения со склерозом: клиническая и терапевтическая оценка 22 пациентов. Лимфома лейка. 1996; 21: 311–6.
CAS Статья PubMed Google Scholar
Зинзани П.Л., Мартелли М., Полетти В., Витоло Ю., Гобби П.Г., Чисеси Т. и др. Практические рекомендации по ведению экстранодальных неходжкинских лимфом у взрослых пациентов с неиммунодефицитом. Часть I: первичные лимфомы легкого и средостения. Проект Итальянского общества гематологов, Итальянского общества экспериментальной гематологии и Итальянской группы трансплантации костного мозга.Haematologica. 2008; 93: 1364–71.
CAS Статья PubMed Google Scholar
Zinzani PL, Stefoni V, Finolezzi E, Brusamolino E, Cabras MG, Chiappella A, et al. Ритуксимаб в сочетании с MACOP-B или VACOP-B и лучевой терапией при первичной крупноклеточной B-лимфоме средостения: ретроспективное исследование. Клин Лимфома Миелома. 2009; 9: 381–5.
CAS Статья PubMed Google Scholar
Vassilakopoulos TP, Pangalis GA, Katsigiannis A, Papageorgiou SG, Constantinou N, Terpos E, et al. Ритуксимаб, циклофосфамид, доксорубицин, винкристин и преднизон с лучевой терапией или без нее при первичной крупноклеточной B-лимфоме средостения: новый стандарт лечения. Онколог. 2012; 17: 239–49.
CAS Статья PubMed PubMed Central Google Scholar
Ригер М., Эстерборг А., Петтенгель Р., Уайт Д., Гилл Д., Валевски Дж. И др.Первичная В-клеточная лимфома средостения, леченная с помощью CHOP-подобной химиотерапии с ритуксимабом или без него: результаты исследования Mabthera International Trial Group. Энн Онкол. 2011; 22: 664–70.
CAS Статья PubMed Google Scholar
Зинзани П.Л., Мартелли М., Бенданди М., Де Ренцо А., Заккария А., Павоне Е. и др. Первичная крупноклеточная B-клеточная лимфома средостения со склерозом: клиническое исследование 89 пациентов, получавших химиотерапию MACOP-B и лучевую терапию.Haematologica. 2001; 86: 187–91.
CAS PubMed Google Scholar
Зинзани П.Л., Мартелли М., Маганьоли М., Пескармона Е., Скарамуччи Л., Паломби Ф. и др. Лечение и клиническое ведение первичной крупноклеточной B-клеточной лимфомы средостения со склерозом: режим MACOP-B и лучевая терапия средостения под контролем (67) Галлиевого сканирования у 50 пациентов. Кровь. 1999; 94: 3289–93.
CAS PubMed Google Scholar
Маццаротто Р., Босо С., Вианелло Ф., Аверса М.С., Кьярион-Силени В., Трентин Л. и др. Первичная крупноклеточная В-клеточная лимфома средостения: результаты интенсивных режимов химиотерапии (MACOP-B / VACOP-B) плюс полевая лучевая терапия у 53 пациентов. Единый опыт учреждения. Int J Radiat Oncol Biol Phys. 2007; 68: 823–9.
CAS Статья PubMed Google Scholar
Cheson BD, Horning SJ, Coiffier B, Shipp MA, Fisher RI, Connors JM, et al.Отчет международного семинара по стандартизированным критериям ответа на неходжкинские лимфомы. Международная рабочая группа, спонсируемая NCI. J Clin Oncol. 1999; 17: 1244–9.
CAS Статья PubMed Google Scholar
Cheson BD, Pfistner B, Juweid ME, Gascoyne RD, Specht L, Horning SJ, et al. Пересмотренные критерии ответа на злокачественную лимфому. J Clin Oncol. 2007. 25: 579–86.
Артикул PubMed Google Scholar
Каплан Е.Л., Мейер П. Непараметрическая оценка по неполным наблюдениям. J Am Stat Assoc. 1958; 53: 457–81.
Артикул Google Scholar
Zinzani PL, Piccaluga PP. Первичный медиастинальный DLBCL: эволюция биологического понимания и терапевтических стратегий. Curr Oncol Rep. 2011; 13: 407–15.
Артикул PubMed Google Scholar
Зинзани П.Л., Брокколи А.Оптимизация исходов при первичной В-клеточной лимфоме средостения. Hematol Oncol Clin North Am. 2016; 30: 1261–75.
Артикул PubMed Google Scholar
Лаццарино М., Орланди Е., Паулли М., Бовери Е., Морра Е., Брусамолино Е. и др. Первичная В-клеточная лимфома средостения со склерозом: агрессивная опухоль с отличительными клиническими и патологическими особенностями. J Clin Oncol. 1993; 11: 2306–13.
CAS Статья PubMed Google Scholar
Lazzarino M, Orlandi E, Paulli M. Результат лечения и прогностические факторы первичной средостенной (тимической) B-клеточной лимфомы: многоцентровое исследование с участием 106 пациентов. J Clin Oncol. 1997; 15: 1646–53.
CAS Статья PubMed Google Scholar
Международный проект факторов прогнозирования неходжкинской лимфомы. Прогностическая модель для агрессивной неходжкинской лимфомы. N Engl J Med. 1993; 329: 987–94.
Артикул Google Scholar
Savage KJ, Al-Rajhi N, Voss N, Paltiel C, Klasa R, Gascoyne RD и др. Благоприятный исход первичной В-крупноклеточной лимфомы средостения в одном учреждении: опыт Британской Колумбии. Энн Онкол. 2006; 17: 123–30.
CAS Статья PubMed Google Scholar
Soumerai JD, Hellmann MD, Feng Y, Sohani AR, Toomey CE, Barnes JA, et al. Лечение первичной В-клеточной лимфомы средостения ритуксимабом, циклофосфамидом, доксорубицином, винкристином и преднизоном связано с высокой частотой первичной рефрактерной болезни.Лимфома лейка. 2014; 55: 538–43.
CAS Статья PubMed Google Scholar
De Sanctis V, Finolezzi E, Osti MF, Grapulin L, Alfò M, Pescarmona E, et al. MACOP-B и лучевая терапия с вовлечением поля являются эффективным и безопасным методом лечения первичной крупноклеточной В-клеточной лимфомы средостения. Int J Radiat Oncol Biol Phys. 2008; 72: 1154–60.
Артикул PubMed Google Scholar
Зинзани П.Л., Мартелли М., Бертини М., Джанни А.М., Девицци Л., Федерико М. и др. Стратегии индукционной химиотерапии для первичной крупноклеточной В-клеточной лимфомы средостения со склерозом: ретроспективное многонациональное исследование с участием 426 ранее не леченных пациентов. Haematologica. 2002; 87: 1258–64.
CAS PubMed Google Scholar
Беррингтон де Гонсалес А., Гилберт Э., Кертис Р., Инскип П., Кляйнерман Р., Мортон Л. и др. Второй солидный рак после лучевой терапии: систематический обзор эпидемиологических исследований зависимости доза облучения от реакции.Int J Radiat Oncol Biol Phys. 2013; 86: 224–33.
Артикул PubMed Google Scholar
Адамс М.Дж., Харденберг PH, Константин Л.С., Липшульц С.Е. Сердечно-сосудистые заболевания, связанные с радиацией. Crit Rev Oncol Hematol. 2003. 45: 55–75.
Артикул PubMed Google Scholar
Ли М.С., Финч В., Махмуд Э. Сердечно-сосудистые осложнения лучевой терапии. Am J Cardiol.2013; 112: 1688–96.
Артикул PubMed Google Scholar
Данливи К., Питталуга С., Маеда Л.С., Адвани Р., Чен С.К., Хесслер Дж. И др. Терапия EPOCH-ритуксимабом с коррекцией дозы при первичной В-клеточной лимфоме средостения. N Engl J Med. 2013; 368: 1408–16.
CAS Статья PubMed PubMed Central Google Scholar
Meignan M, Barrington S, Itti E, Gallamini A, Haioun C, Polliack A.Отчет о 4-м международном семинаре по позитронно-эмиссионной томографии при лимфоме, состоявшемся в Ментоне, Франция, 3-5 октября 2012 г. Лимфома Leuk. 2014; 55: 31–7.
Артикул PubMed Google Scholar
Мартелли М., Цериани Л., Зукка Э., Зинзани П.Л., Феррери А.Дж., Витоло У. и др. [18F] позитронно-эмиссионная томография с фтордезоксиглюкозой позволяет прогнозировать выживаемость после химиоиммунотерапии первичной крупноклеточной В-клеточной лимфомы средостения: результаты исследования IELSG-26 Международной группы по изучению экстранодальной лимфомы.J Clin Oncol. 2014; 32: 1769–75.
Артикул PubMed Google Scholar
Сэвидж К., Йенсон П.Р., Шенкьер Т. и др. Исход первичной крупноклеточной B-клеточной лимфомы средостения (PMBCL) в эпоху лечения R-CHOP. Blood (выдержки из ежегодного собрания ASH) 2012; 120: Abstract 303.
Zinzani PL, Broccoli A, Casadei B, Stefoni V, Pellegrini C, Gandolfi L, et al. Роль ритуксимаба и позитронно-эмиссионной томографии в лечении первичной В-крупноклеточной лимфомы средостения: опыт на 74 пациентах.Гематол Онкол. 2015; 33 (4): 145–50.
CAS Статья PubMed Google Scholar
Цериани Л., Мартелли М., Зинзани П.Л., Феррери А.Дж., Ботто Б., Стелитано С. и др. Полезность исходных функциональных параметров 18FDG-PET / CT для определения прогноза первичной крупноклеточной В-клеточной лимфомы средостения (тимуса). Кровь. 2015; 126: 950–6.
CAS Статья PubMed Google Scholar
Мансури Л., Неренберг Д., Янг Э., Милонас Э., Абдулла М., Фрик М. и др. Частые делеции NFKBIE связаны с плохим исходом при первичной В-клеточной лимфоме средостения. Кровь. 2016; 128: 2666–70.
CAS Статья PubMed Google Scholar
Влияние лучевой терапии на легочную токсичность у пациентов с лимфомой Ходжкина средостения
Bröckelmann PJ, Goergen H, Keller U, Meissner J, Ordemann R, Halbsguth TV et al (2020) Эффективность ниволумаба и AVD на ранней стадии неблагоприятная классическая лимфома Ходжкина: рандомизированное исследование 2 фазы немецкой исследовательской группы Ходжкина NIVAHL.JAMA Oncol. https://doi.org/10.1001/jamaoncol.2020.0750
PubMed Статья Google Scholar
Herbst C, Rehan FA, Brillant C, Bohlius J, Skoetz N, Schulz H et al (2010) Комбинированное лечение улучшает контроль опухоли и общую выживаемость у пациентов с лимфомой Ходжкина на ранней стадии: систематический обзор. Haematologica 95 (3): 494–500
CAS PubMed Статья Google Scholar
Martin WG, Ristow KM, Habermann TM, Colgan JP, Witzig TE, Ansell SM (2005) Легочная токсичность блеомицина отрицательно влияет на исход пациентов с лимфомой Ходжкина. J Clin Oncol 23 (30): 7614–7620
CAS PubMed Статья Google Scholar
Böll B, Goergen H, Behringer K, Bröckelmann PJ, Hitz F, Kerkhoff A et al (2016) Блеомицин у пожилых пациентов с благоприятной лимфомой Ходжкина на ранней стадии: анализ Немецкой исследовательской группы Ходжкина (GHSG) HD10 и испытания HD13.Кровь 127 (18): 2189–2192
PubMed Статья Google Scholar
Эльсаяд К., Рейнарц Г., Эртель М. и др. (2020) Лучевая терапия экстранодальных фолликулярных лимфом низкой степени злокачественности и лимфом маргинальной зоны: долгосрочное наблюдение за 159 пациентами. Стралентер Онкол 196: 117–125. https://doi.org/10.1007/s00066-019-01538-2
PubMed Статья Google Scholar
Медури Б., Грегуччи Ф., Д’Анджело Э. и др. (2020) Деэскалация объема в лучевой терапии: современное состояние и новые перспективы.J Cancer Res Clin Oncol 146: 909–924
PubMed Статья Google Scholar
Oertel M, Elsayad K, Weishaupt C et al (2020) Деэскалационная лучевая терапия при вялотекущей первичной кожной B-клеточной лимфоме. Стралентер Онкол 196: 126–131. https://doi.org/10.1007/s00066-019-01541-7
PubMed Статья Google Scholar
Eich HT, Diehl V, Görgen H, Pabst T., Markova J, Debus J et al (2010) Интенсивная химиотерапия и лучевая терапия с пониженной дозой у пациентов с ранней неблагоприятной лимфомой Ходжкина: окончательный анализ Испытание HD11 Немецкой исследовательской группы Ходжкина.J Clin Oncol 28 (27): 4199–4206
PubMed Статья Google Scholar
Engert A, Plütschow A, Eich HT, Lohri A, Dörken B, Borchmann P et al (2010) Снижение интенсивности лечения пациентов с лимфомой Ходжкина на ранней стадии. N Engl J Med 363 (7): 640–652
CAS PubMed Статья Google Scholar
Borchmann P, Haverkamp H, Diehl V, Cerny T., Markova J, Ho AD et al (2011) Восемь циклов повышенных доз BEACOPP по сравнению с четырьмя циклами повышенных доз BEACOPP с последующими четырьмя циклами исходного уровня -доза BEACOPP с лучевой терапией или без нее у пациентов с лимфомой Ходжкина на поздней стадии: окончательный анализ исследования HD12 o.J Clin Oncol 29 (32): 4234–4242
CAS PubMed Статья Google Scholar
Койл М., Костакоглу Л., Эвенс А.М. (2016) Возрастающая роль адаптированной к ответу ПЭТ-визуализации в лимфоме Ходжкина. Ther Adv Hematol 7 (2): 108–125
CAS PubMed PubMed Central Статья Google Scholar
Энгерт А., Шиллер П., Йостинг А., Херрманн Р., Кох П., Зибер М. и др. (2003) Лучевая терапия с вовлеченным полем одинаково эффективна и менее токсична по сравнению с лучевой терапией с расширенным полем после четырех циклов химиотерапии в пациенты с неблагоприятной лимфомой Ходжкина на ранней стадии: результаты исследования лимфомы Ходжкина Германии HD8.Дж. Клин Онкол 21 (19): 3601–3608. https://doi.org/10.1200/JCO.2003.03.023
PubMed Статья Google Scholar
Specht L, Yahalom J, Illidge T., Berthelsen AK, Constine LS, Eich HT et al (2014) Современная лучевая терапия лимфомы Ходжкина: полевые и дозовые рекомендации Международной группы радиационной онкологии лимфомы (ILROG). Int J Radiat Oncol Biol Phys 89 (4): 854–862. https://doi.org/10.1016/j.ijrobp.2013.05.005
PubMed Статья Google Scholar
Yahalom J, Mauch P (2002) Возвращение к теме: проблемы определения поля излучения при болезни Ходжкина. Анн Онкол 13 (Приложение 1): 79–83. https://doi.org/10.1093/annonc/13.S1.79
PubMed Статья Google Scholar
Li AX, Alber M, Deasy JO, Jackson A, Jee KKW, Marks LB et al (2012) Использование и контроль качества биологически связанных моделей для планирования лечения: Краткий отчет о терапии TG-166 комитет по физике AAPM.Med Phys 39 (3): 1386–1409
Статья Google Scholar
Burman C, Kutcher GJ, Emami B, Goitein M (1991) Подгонка данных толерантности нормальной ткани к аналитической функции. Int J Radiat Oncol Biol Phys 21 (1): 123–135
CAS PubMed Статья Google Scholar
Marks LB, Bentzen SM, Deasy JO, Kong FM, Bradley JD, Vogelius IS и др. (2010) Эффекты объема дозы излучения в легких.Int J Radiat Oncol Biol Phys 76 (3 приложения): 70–76
Статья Google Scholar
Шнайдер У., Сумила М., Роботка Дж. (2011) Зависимые от места зависимости доза-реакция для индукции рака от комбинированных японских атомных бомб и когорт Ходжкина для доз, относящихся к лучевой терапии. Теор Биол Мед Модель 8 (1): 27
PubMed PubMed Central Статья Google Scholar
Jayalathike DM, Stevens A, Paneesha S, Chaganti S, Hassan Y, Zarkar AM (2017) Результаты лечения с использованием задействованной полевой лучевой терапии и лучевой терапии на участках для НХЛ и HL: ретроспективный анализ крупного радиотерапевтического центра Великобритании. Hematol Oncol 35 (S2): 333–333
Артикул Google Scholar
Eich HT, Müller R, Engenhart-cabillic R, Lukas P, Schmidberger H, Staar S. et al (2008) Лучевая терапия с вовлеченными узлами в определении лимфомы Ходжкина на ранней стадии и рекомендации Немецкой исследовательской группы Hodgkin ( GHSG).Strahlenther Onkol 184 (8): 406–410
PubMed Статья Google Scholar
Toltz A, Shin N, Mitrou E, Laude C, Carolyn R, Seuntjens J et al (2015) Поздняя лучевая токсичность у пациентов с лимфомой Ходжкина: потенциал протонной терапии. J Appl Clin Med Phys 16 (5): 167–178
PubMed PubMed Central Статья Google Scholar
Edvardsson A, Kügele M, Alkner S, Enmark M, Nilsson J, Kristensen I et al (2019) Сравнительное исследование планирования лечения средостенной лимфомы Ходжкина: влияние на нормальную дозу ткани с использованием протонов и фотонов задержки дыхания при глубоком вдохе терапия.Acta Oncol 58 (1): 95–104. https://doi.org/10.1080/0284186X.2018.1512153
CAS PubMed Статья Google Scholar
Fiandra C, Filippi AR, Catuzzo P, Botticella A, Ciammella P, Franco P et al (2012) Различные решения IMRT против 3D-конформной лучевой терапии на ранней стадии лимфомы Ходжкина: дозиметрическое сравнение и клинические соображения. Radiat Oncol 7 (1): 1–9
Статья Google Scholar
Horn S, Fournier-Bidoz N, Pernin V, Peurien D, Vaillant M, Dendale R et al (2016) Сравнение пассивно-лучевой протонной терапии, спиральной томотерапии и трехмерной конформной лучевой терапии у пациенток с лимфомой Ходжкина, получающих вовлеченные поля или лучевая терапия на месте. Cancer Radiothér 20 (2): 98–103
CAS PubMed Статья Google Scholar
Lewis G, Agrusa J, Teh BS, Gramatges M, Kothari V, Allen C et al (2017) Лучевой пневмонит у детей с лимфомой Ходжкина, получающих лучевую терапию грудной клетки.Int J Radiat Oncol 99 (2): E569. https://doi.org/10.1016/j.ijrobp.2017.06.1970
Статья Google Scholar
Cella L, Liuzzi R, Avino VD, Conson M, Di A, Picardi M et al (2014) Поражение легких у пациентов с лимфомой Ходжкина, получавших последовательную химиолучевую терапию: предикторы лучевого поражения легких.