Антибиотики при тонзиллите у взрослых для лечения
Избавиться от хронического тонзиллита — дело непростое. В ход идут и медикаменты, и витамины, и народная медицина, и даже домашние снадобья. Но вот чтобы действительно гарантированно и надолго избавиться от этого осложняющего жизнь заболевания порой могут помочь только антибиотики.
Как грамотно выбрать и применять антибиотики при хроническом тонзиллите — тема статьи. Также мы рассмотрим, какие именно лекарства могут помочь в случае этой болезни взрослым людям и детям.
Особенности заболевания
Хронический тонзиллит – это распространенное среди взрослого и особенно детского населения ЛОР-заболевание. Оно может возникнуть независимо от места проживания человека, его занятий, рода деятельности и прочих социально значимых признаков. Возраст и половая принадлежность тоже роли не играют.
Хронический тонзиллит протекает большую часть времени спокойно, однако, время от времени случаются обострения, когда состояние больного может резко ухудшиться.
На видео- антибиотики при хроническом тонзиллите:
Возбудитель болезни — золотистый стафилококк в горле— один из самых распространенных вирусов, вызывающий многие заболевания аллергической природы. То, что стафилококк «оккупирует» именно горло, связано с тем, что природное строение миндалин способствует тому, что микробам и вирусам очень просто укрываться в столь труднодоступном месте.
Чаще всего хронический тонзиллит появляется у взрослых и детей после перенесенной ангины с гнойными проявлениями.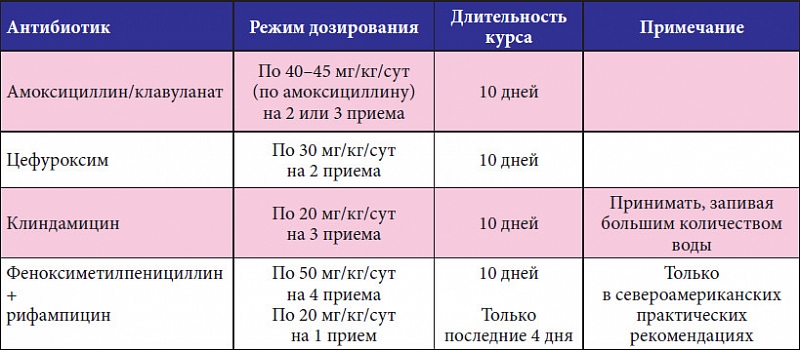
Насколько эффективен имбирь с лимоном от простуды, и как его правильно применять, очень подробно рассказывается в данной статье.
А вот как быстро восстановить голос после простуды, и какие средства самые лучшие, поможет понять данная информация.
Также будет интересно узнать о том, как заварить клюкву при простуде: https://prolor.ru/g/lechenie/klyukva-pri-prostude.html
Как проявляется заболевание
Рассмотрим — как именно тонзиллит осложняет людям жизнь.
Во время ремиссий, которые обычно занимают большую часть времени, человек не испытывает каких-то неудобств. В этот период миндалины незначительно увеличены, но сильного дискомфорта не доставляют..gif)
Во время обострений заболевания микробы начинают очень активно размножаться. Горло начинает воспаляться, отекать. Это состояние причиняет сильный дискомфорт человеку. Кроме перечисленных признаков зачастую горло сильно болит, появляется температура, сильный жар. Состояние в этот период очень просто перепутать по ощущениям с сильной ангиной.
Миндалины в период обострения покрыты гнойным налетом, который и вызывает сильнейшие дискомфортные ощущения и боль. Кроме неприятных воспалений горла также может ощущаться боль в мышцах, суставах. Головная боль — тоже частый спутник неприятного заболевания. Но ее испытывают чаще взрослые, нежели дети.
На видео- какой антибиотик пить при хроническом тонзиллите:
youtube.com/embed/POeZ7N3rYd0?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>
Лимфатические узлы, расположенные непосредственно под челюстью, увеличиваются в размерах и при нажатии становятся болезненными. Связано это с тем, что они являются последним барьером, который сдерживает микробов на их пути к кровеносной системе и всему организму в целом.
Если все-таки инфекция прорвется через этот барьер, то возможно инфицирование вирусом внутренних органов: стафилококком могут быть поражены и печень, и почки, и даже сердце.
Если у человека серьезные заболевания вроде СПИДа, рака, прочие угрожающие жизни недомогания, то последствием тонзиллита может стать даже заражение крови. Особенно часто это происходит, когда иммунитет находится на своем нижнем пределе, истощен и ослаблен.
Как выбрать лекарство
Стафилококк в горле: лечение. Необходимо, чтобы выбранное средство имело способность легко проникать в мягкие ткани организма — нужно обеспечить гарантированную доставку активных веществ к миндалинам и тем органам, которые еще захватил стафилококк.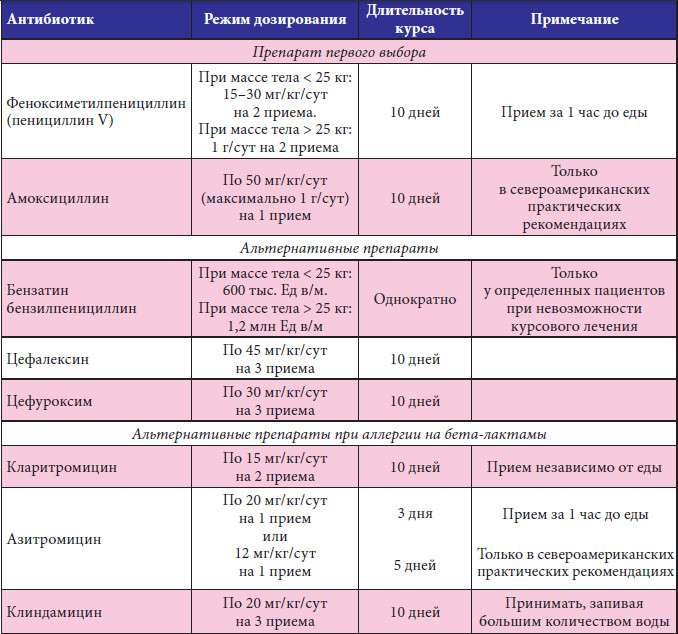 Кроме этого, средство должно иметь возможность концентрироваться именно в тех участках внутри тела, где помощь особенно необходима. И концентрация эта должна сохраняться длительное время, чтобы прием лекарств можно было свести к необходимому минимуму.
Кроме этого, средство должно иметь возможность концентрироваться именно в тех участках внутри тела, где помощь особенно необходима. И концентрация эта должна сохраняться длительное время, чтобы прием лекарств можно было свести к необходимому минимуму.
На сегодня этим требованиям отвечают только современные антибиотики. Многие из них способны быстро и надежно справиться с проявлениями тонзиллита и убрать все неприятные симптомы.
Необходимо дополнительно отметить, что в период ремиссий хронический тонзиллит лечения антибиотиками не требует. В это время прием сильнодействующих препаратов необоснован. Даже больше, если принимать антибиотики в «спокойные» периоды, можно лишь навредить организму, ослабив его. Дело в том, что если организм привыкнет к определенному лекарству, то перестанет должным образом на него реагировать в те моменты, когда помощь будет необходима.
На видео – лечение антибиотиками обострение хронического тонзиллита:
Антибиотики при хроническом тонзиллите должен назначить врач. Это обязательное условие – только в этом случае есть гарантия, что лечение пройдет должным образом, без побочных эффектов и неприятных последствий.
Выбор препарата
Антибиотики при тонзиллите назначают обычно только тогда, когда уже не удается более щадящими методами снять воспалительный процесс. Если повышается температура и нарастает уровень интоксикации организма, то чаще всего другого выхода, кроме как прием антибиотиков, не остается.
Пенициллиновая группа – те антибиотики, которые наиболее часто используются, чтоб лечить гнойную ангину у взрослых.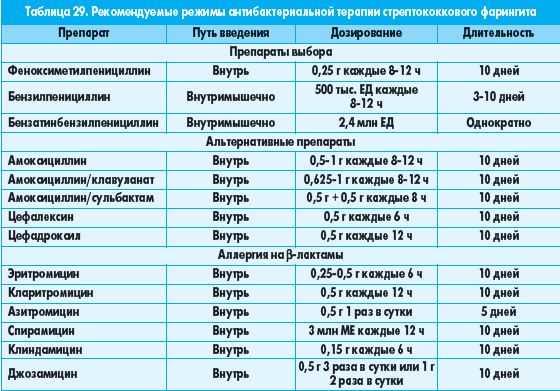 Такие препараты, как Амоксициллин (а вот как пить Амоксициллин при ангине, поможет понять данная статья) Флемоксин (а вот помогает ли при ангине Флемоксин солютаб, поможет понять данная статья) Тикарциллин и другие одинаково хорошо помогают и детям, и взрослым — различается лишь их дозировка. Эти средства отличаются недорогой стоимостью и отличным качеством при этом.
Такие препараты, как Амоксициллин (а вот как пить Амоксициллин при ангине, поможет понять данная статья) Флемоксин (а вот помогает ли при ангине Флемоксин солютаб, поможет понять данная статья) Тикарциллин и другие одинаково хорошо помогают и детям, и взрослым — различается лишь их дозировка. Эти средства отличаются недорогой стоимостью и отличным качеством при этом.
На фото- амоксициллин
Однако, если хотите избавиться от проявлений тонзиллита наиболее быстро и гарантированно, то врачи советуют выбирать препараты, в основе которых стойкий пенициллин, который отлично справляется с воздействием ферментов микробов.
К таким препаратам относятся Флемоклав, Сультамициллин, Амоксиклав при гриппе (а вот какова дозировка такого средства необходима при при ангине, указано в данной статье) и другие.
На фото- флемоклав
Амоксициллин недорого стоит и отличается быстрой всасываемостью в кишечнике, а, соответственно – полнотой усвояемости. Дозу препарата подбирает врач, учитывая все необходимые критерии. Обычно взрослым и детям после 10 лет назначают принимать амоксициллин 10 дней по 0,5 гр трижды в сутки. А вот как происходит лечение гайморита Амоксициллином, очень подробно рассказывается в статье.
Обычно взрослым и детям после 10 лет назначают принимать амоксициллин 10 дней по 0,5 гр трижды в сутки. А вот как происходит лечение гайморита Амоксициллином, очень подробно рассказывается в статье.
Ко второму ряду препаратов относятся такие препараты, как Кларитромицин (лечит ли антибиотик Кларитромицин тева от бронхита, поможет понять содержание данной статьи) Сумамед (а вот какова дозировка Сумамеда при ангине, рассказывается в данной статье)
На фото- кларитромицин
С золотистым стафилококком и его проявлениями отлично справляются и препараты-аминогликозиды. Например, Амикацин — препарат, который не вызывает побочных эффектов, связанных с работой почек, Заноацин, Локсон, Ломацин и прочие лекарственные средства.
На фото- амикацин
Обычно после начала приема антибиотиков облегчение состояния можно наблюдать уже на 2-3-й день. Поэтому крайне важно, если вы заметили, что антибиотик в течение этого времени не оказал нужного воздействия, сообщите об этом врачу. Скорее всего, необходимо использовать препарат другой группы.
Внимание: при сильном жаре и температуре принимать антибиотики можно, но только после того, как это лечение назначит врач. Если пока консультация у с доктором не проведена, принимать лучше всего обычные жаропонижающие. Особенно важно соблюдать это правило, если хроническим тонзиллитом страдает ребенок.
Кроме этого, целесообразно принимать какие-либо жаропонижающие, только если температура перевалила уже за 38 градусов. До этой отметки организм самостоятельно борется с инфекцией, и не стоит ему мешать.
Советы
Все приведенные выше препараты необходимо принимать только после того, как их порекомендует вам или вашему ребенку врач. Категорически не рекомендуется самостоятельно начинать лечение антибиотиками, особенно, если это касается ребенка.
Наряду с антибиотикам неплохо принимать и другие способствующие выздоровлению средства. Это могут быть антисептические препараты, в том числе специальные леденцы с содержанием лечебных компонентов, жаропонижающие.
Народная медицина тоже вполне может облегчить состояние больного. Так, пригодятся холодные компрессы, травяные лечебные настои, свекольный сок. Можно усилить воздействие антибиотиков, применяя средства местной терапии.
К таким средствам относятся:
- полоскание горла;
- ингаляции;
- смазывание миндалин различными лечебными составами.
Промывание горла – тоже одна из эффективнейших процедур, которые хорошо помогают при хроническом тонзиллите. Чаще всего используется специальный препарат для процедуры Тонзиллор.
На фото- промывание горла препаратом тонзиллор
Во время обострения хронического тонзиллита очень важно обеспечить больному полный покой. Взрослому необходимо взять больничные и не ходить на работу, а ребенок не должен в этот период посещать сад или школу. В этот период времени организм нуждается в отдыхе, иммунитет ослаблен, поэтому рисковать здоровьем, совершая трудовые подвиги, не стоит.
Необходимо различными доступными способами укреплять и поднимать уровень иммунитета. Важно принимать витамины и специальные препараты для этого, не стоит забывать и о пользе естественных витаминов, которые находятся в свежих фруктах, овощах и зелени. Здоровый и крепкий иммунитет способен быстрее и эффективнее справиться с болезнью на ранних стадиях, не допуская периодов обострения.
При приеме антибиотиков необходимо следовать приложенной инструкции, досконально выполнять все предписания и рекомендации лечащего врача.
Не стоит запивать лекарства чаем, кофе и другими напитками. Для этой цели подходит исключительно чистая вода.
Принимая антибиотики, не забывайте, что вместе с уничтожением вредоносных микроорганизмов, они негативно воздействуют и на полезную миклофлору кишечника. Поэтому обязательно принимайте препараты-пробиотики, которые эту самую флору восстановят. Особенно важно соблюдать данную рекомендацию, когда вы лечите антибиотиками детей. Также рекомендуем ознакомится со списком детских антибиотиков при кашле.
Как мы убедились, принимать антибиотики при хроническом тонзиллите необходимо, но только в периоды обострений. Это надежный способ избавиться от неприятных симптомов хронического тонзиллита у взрослых и облегчить жизнь человеку. Выбирайте антибиотики, исходя из предписаний врача и строго соблюдайте дозировку — в этом случае проявления тонзиллита быстро сойдут на нет.
Антибиотики при тонзиллите : инструкция по применению
Какие антибиотики применять при тонзиллите?
Антибиотики при тонзиллите назначает врач с учетом чувствительности микроорганизмов к конкретному препарату, а не всем назначает один и тот же, как это часто у нас практикуется. Важно: если возбудителем тонзиллита является вирусная инфекция, антибиотики неэффективны!
Наиболее часто при лечении тонзиллита назначают Амоксициллин.
Амоксициллин – бактерицидный пенициллиновый антибиотик. Амоксициллин быстро и полностью всасывается в кишечнике. Доза подбирается с учетом тяжести протекания тонзиллита, предварительно берется мазок для определения типа возбудителя. Взрослым и детям старше 10 лет, как правило, назначается дозировка 0.5 г три раза в день.
С осторожностью назначают при беременности.
Антибиотики при остром тонзиллите
Предостерегаем вас от необоснованного, без консультации врача, самолечения тонзиллита антибиотиками. Это может закончиться для вас тяжелыми реакциями организма на эти препараты. Антибиотики при тонзиллите должен вам назначить только доктор!
Рассмотрим действие препарата Цефадроксил на организм больного острым тонзиллитом.
Цефадроксил – цефалоспориновый антибиотик в форме таблеток. Максимальная его концентрация в крови достигается через полтора часа после приема. Цефадроксил медленно выводится, его достаточно принимать 1 раз в сутки. Суточная доза Цефадроксила – 1-2 г. Длительность лечения – 10-12 дней. Возможны такие неприятные побочные эффекты, как сыпь, головокружение, бессонница, вагинальный кандидоз.
[5], [6], [7]
Антибиотики при хроническом тонзиллите
Антибиотики при тонзиллите в хронической форме зависят от микрофлоры, которая вызвала болезнь. Антибиотики назначают во время обострения.
Для примера рассмотрим антибиотик Цефалексин.
Взрослым Цефалексин назначают в дозировке 1-4 г каждые 6 часов в течение недели. Побочное действие проявляется в диспепсии, явлениях колита, треморе, судорогах, аллергии. Возможен аллергический шок. Во время беременности врач перед назначением препарата тщательно оценивает риски. Препарат проникает в грудное молоко, на время лечения стоит прекратить ГВ.
[8], [9], [10], [11]
Антибиотики при тонзиллите у детей
Тонзиллит – это воспаление миндалин. Они расположены в ротоглотке и пронизаны маленькими порами – лакунами. В лакунах скапливаются вирусы и бактерии, и они начинают воспаляться и гноиться. Малыш становится раздражительным и плаксивым, не может заснуть, он вял. Начинается болезнь остро – еще утром ребенок был бодрым, играл, а к вечеру поднялась очень высокая температура, воспалились регионарные лимфатические узлы. Хронический тонзиллит часто дает осложнения на гайморовы пазухи, дети болеют синуситами, длительными изнуряющими ринитами и отитами. Чаще всего возбудителем ангины у детей является бета-гемолитический стрептококк.
Какие антибиотики при тонзиллите чаще всего назначают детям? Пенициллиновые, макролидные и цефалоспориновые.
Оксациллин – антибактериальный препарат пенициллинового ряда, вызывающий лизис клеток бактерий. Максимальная концентрация препарата в крови наблюдается через полчаса после инъекции. Время полувыведения – также полчаса. Препарат принимают через 4-6 часов равными дозами. Возможен кожный зуд и развитие анафилактического шока, тошнота, диарея, кандидоз полости рта, пожелтение склер и кожи, нейтропения. Оксициллин назначают по 0.25 г-0.5 г за час до еды. Суточная доза при инфекциях средней тяжести – 3г, при тяжелых – 6 г. Новорожденным — по 90–150 мг/кг/сут, в возрасте до 3 мес — 200 мг/кг/сут, до 2 лет — 1 г/кг/сут, от 2 до 6 лет — 2 г/кг/сут; суточную дозу делят на 4–6 приемов. Продолжительность лечения препаратом – 7-10 дней.
К макролидам относят препарат Эритромицин – эффективный антибиотик против стафилококковой и стрептококковой ангины. Не действует на вирусы и грибки, поэтому важно уточнить возбудителя. Эритромицин подходит ребенку с аллергией на пенициллины. При комбинировании препарата с сульфаниламидами наблюдается усиление действия. Разовая доза для ребенка – 0.25 г. Прием – через 4 ч, за час до приема пищи. Для детей до 7 лет дозу рассчитывают, исходя из формулы 20мг/кг. Возможное побочное действие проявляется тошнотой, поносом, желтухой.
Тантум Верде – нестероидный противовоспалительный препарат. Оказывает выраженный обезболивающий эффект. Тантум Верде в форме таблеток рассасывают в полости рта по одной штуке трижды в день. Тантум Верде спрей впрыскивают 4 раза (4 нажатия) каждые 2 часа.
Очень важно правильно лечить острый тонзиллит – если врач прописал «вредный» антибиотик, значит это оправдано! Большую роль в профилактике играют витамины и закаливание – обтирайте ребенка холодной водой, пусть летом он спит на свежем воздухе.
[12], [13]
Названия антибиотиков при тонзиллите
Для лечения тонзиллита чаще всего используются антибиотики пенициллиновой группы: Бензилпенициллин, Феноксиметилпенициллин.
Бензилпенициллин – оказывает бактерицидное действие на размножающиеся микроорганизмы. Препарат вводят внутримышечно или внутривенно. При инфекции верхних дыхательных путей вводят по 4-6 млн ЕД в сутки за 4 введения. Возможна реакция в виде крапивницы и сыпи на слизистых, ангионевротического отека, бронхоспазма, аритмии, гиперкалимии, рвоты, судорог.
Феноксиметилпенициллин – антибактериальный препарат для лечения острого и хронического тонзиллита группы пенициллинов. При состоянии средней тяжести детям старше 10 лет и взрослым назначается в дозировке 3 млн ЕД. Дозу разбивают на три раза. Детям до 10 лет назначают 0.5 – 1.5 млн ЕД в три приема. Возможен стоматит, фарингит.
Антибиотики при тонзиллите нужно назначать осторожно, сначала выяснив, каким возбудителем он вызван.
Когда назначают антибиотики при тонзиллите и как правильно их принимать?
Воспалительные и инфекционные заболевания верхних дыхательных путей относятся к самым распространенным сезонным недугам. Если воспаление затрагивает миндалины и другие лимфатические структуры глотки, возникает тонзиллит. Методы лечения этой патологии зависят от типа возбудителя инфекции. Антибиотики при тонзиллите применяются для устранения бактериальной инфекции.
Что такое тонзиллит?
Тонзиллит – это инфекционное воспаление небных миндалин
Тонзиллит – это инфекционно-воспалительное поражение небных миндалин и других лимфатических структур. В зависимости от типа возбудителя заболевание может иметь бактериальную, вирусную или грибковую природу. К первым признакам и симптомам тонзиллита относят разбухание миндалин, боль в горле и затрудненное дыхание. Кроме того, болезнь может принимать острую или хроническую форму.
Лимфатические структуры глотки образуют глоточное лимфатическое кольцо, включающее парные миндалины и другие образования. Эти ткани выполняют функции местного иммунитета и защищают верхние дыхательные пути от инвазии патогенных микроорганизмов. Так, иммунные клетки, входящие в состав миндалин, уничтожают любые вирусы и бактерии, попавшие в глотку из окружающей среды. Тем не менее некоторые микроорганизмы способны обходить эту защиту и поражать миндалины.
Тонзиллит часто возникает на фоне гриппа и других простудных заболеваний вирусной природы. Бактериальный тонзиллит обычно имеет более выраженные клинические проявления и возникает из-за инвазии стрептококка. К другим возбудителям болезни относят:
- Аденовирусы.
- Вирус Эпштейна-Барра.
- Вирусы парагриппа.
- Энтеровирусы.
- Вирус простого герпеса.
Поскольку эффективное лечение тонзиллита напрямую зависит от типа возбудителя, первичная лабораторная диагностика очень важна. У пациентов, не получивших соответствующего лечения, возникают тяжелые осложнения.
Методы диагностики
Подтвердить диагноз может врач после осмотра
Диагностикой и лечением тонзиллита занимаются отоларингологи. Во время консультации врач спросит пациента о жалобах, изучит анамнез и проведет осмотр горла для выявления признаков воспаления.
При подозрении на тонзиллит врач также назначит другие исследования, включающие лабораторную диагностику. Чем раньше будет установлен возбудитель болезни, тем быстрее и эффективнее можно устранить патологию.
Первичные методы диагностики:
- Пальпация шеи для выявления измененных лимфатических узлов.
- Исследование легких и дыхательных путей с помощью фонендоскопа.
Лабораторные методы диагностики:
- Мазок из горла с помощью стерильного инструмента. Полученный материал отправляют в лабораторию для идентификации возбудителя.
- Анализ крови. Врача в первую очередь интересует количество и соотношение форменных элементов крови. Некоторые аномалии могут указать на наличие инфекционного процесса в организме. Кроме того, определенные изменения в соотношении клеток крови могут указать на тип возбудителя до получения результатов по мазку.
Положительный результат большинства тестов говорит о наличии стрептококковой инфекции. Если же бактерии не выявлены, предполагается вирусная этиология болезни.
Антибиотики при тонзиллите и правила их приема
Курс приема антибиотиков нельзя прекращать, даже если почувствовали улучшение
Антибиотики является основным способом медикаментозного лечения бактериального тонзиллита. Эти препараты уничтожают возбудителей болезни, бактерии рода стрептококк. Грамотное назначение антибиотиков позволяет устранить очаг инфекции за несколько суток. При этом противомикробная терапия должна осуществляться под контролем врача, поскольку неправильный прием лекарств может стать причиной перехода тонзиллита в хроническую форму.
Антибиотики избирательно воздействуют на различные типы бактерии. Терапевтический эффект таких препаратов связан с подавлением цикла размножения бактерий и уничтожения их клеточной стенки. Антибиотики могут иметь разный химический состав и механизм воздействия. Нужный антибиотик может назначить только лечащий врач после получения результатов анализов. Для лечения бактериального тонзиллита обычно назначают противомикробные средства группы пенициллина.
Антибактериальная терапия является сложным методом лечения, подразумевающим большое количество важных нюансов.
Именно поэтому принимать такие препараты необходимо строго под контролем врача. Пациенту необходимо учитывать, что неправильный прием противомикробных средств приводит к формированию резистентности у бактерий, что в конечном итоге становится причиной перехода тонзиллита в хроническую форму.
Большинство антибиотиков предназначено для приема внутрь (перорально). Иногда эти препараты также вводят с помощью внутривенных инъекций. При тонзиллите антибиотики группы пенициллина обычно назначают на 10 дней приема. Крайне важно принимать препараты в течение назначенного срока без перерыва. Также необходимо принимать таблетки в одно и то же время.
Подробнее о лечении ангины (тонзиллита) можно узнать из видео:
Важные рекомендации:
- Если после приема противомикробного средства появляется сыпь, покраснение лица и другие симптомы аллергии, необходимо обратиться к врачу. Специалист может назначить другой антибиотик.
- Если антибиотики назначены на 10 дней, но уже через несколько дней приема пропали все симптомы болезни, необходимо продолжать курс лечения. Положительный эффект обычно связан с уменьшением числа бактерий, но сохранение даже небольшого количества микроорганизмов может привести к рецидиву.
- Дозировка антибиотиков рассчитывается исходя из возраста, массы тела пациента и типа болезни.
- Во время приема антибиотиков необходимо соблюдать диету. Не рекомендуется употреблять спиртные напитки, поскольку алкоголь может не только повлиять на терапевтический эффект медикаментов, но и вызвать осложнения. Также в зависимости от типа препарата необходимо есть до или после приема антибиотика.
Безопасные антибиотики для детей и взрослых
Наиболее часто назначаются препараты на основе пенициллина
Антибиотики не являются абсолютно безопасными препаратами. Большинство медикаментов этой группы вызывают неприятные побочные эффекты, связанные с влиянием средств на нервную и пищеварительную систему. Кроме того, некоторые препараты могут быть вредны для детей.
Группы антибиотиков:
- Пенициллиновая группа противомикробных препаратов является основной при лечении острых респираторных инфекции. Большинство этих лекарственных средств активно используется в педиатрии для лечения острого и хронического тонзиллита. Амоксициллин и другие препараты можно назначать детям старше 2 лет.
- Цефалоспориновая группа может быть назначена при аллергии на другие средства или устойчивости бактерий. Большинство этих лекарственных средств назначают с двухлетнего возраста и даже ранее.
- Макролиды отличаются высокой эффективностью при респираторных инфекциях. Многие препараты этой группы могут быть назначены как детям, так и взрослым.
Таким образом, антибиотики могут быть назначены для пациентов любого возраста. Многие препараты можно назначать в первые месяцы жизни. При этом врач должен учитывать возможные риски, связанные с побочными эффектами лекарственных средств.
Антибиотики при беременности
Беременным женщинам при лечении необходимо учитывать не только влияние лекарств на собственное здоровье, но и возможное влияние на ребенка. Активные компоненты препаратов зачастую преодолевают плацентарный барьер и воздействуют на клетки плода. Именно поэтому при назначении антибиотиков беременным женщинам врачи учитывают целесообразность терапии и возможные риски.
Беременным женщинам назначают антибактериальные средства в крайних случаях, когда существует риск тяжелых осложнений.
Тяжелый бактериальный тонзиллит обычно входит в список таких показаний, однако окончательное решение остается за врачом. Будущей маме могут быть назначены следующие средства:
- Амоксициллин
- Цефтриаксон
При этом целесообразность приема антибиотиков также зависит от срока беременности. Если в первом триместре противомикробная терапия крайне нежелательна, то на поздних сроках такое лечение может быть более безопасным.
Опасные симптомы и осложнения недуга
Запущенный тонзиллит может стать причиной болезней бронхов и легких
Тонзиллит относится к тяжелым респираторным инфекциям. Риск развития осложнений зависит от возраста пациента, особенностей иммунитета, возбудителя болезни и других факторов. Это заболевание особенно опасно в детском возрасте, когда иммунитет развит недостаточно.
При появлении следующих симптомов и признаков необходимо обратиться к врачу:
- Выраженное нарушение глотания или дыхания.
- Отек шеи и сильное увеличение лимфатических узлов.
- Симптомы сильной усталости и головокружения не исчезают в течение 48 часов.
- Высокая температура тела сохраняется на протяжении нескольких суток.
Перечисленные признаки могут указывать на тяжелое течение инфекции и риск развития осложнений. К распространенным осложнениям тонзиллита относят:
- Распространение инфекционного процесса на другие ткани.
- Инфекция среднего уха.
- Абсцесс тканей горла с выделением гноя.
- Обструктивное апноэ во сне – расслабление стенок горла во время сна, приводящее остановке дыхания.
- Скарлатина.
- Ревматическая лихорадка, вызывающая воспаление по всему телу.
- Гломерулонефрит.
- Тяжелые осложнения тонзиллита могут привести к смерти пациента.
Профилактические меры помогают предотвратить развитие тонзиллита и других острых респираторных заболеваний у взрослых и детей. Наиболее эффективны следующие меры:
- Тщательное мытье рук перед едой и после похода в туалет.
- Соблюдение мер изоляции в случае, если тонзиллит диагностирован у члена семьи. Необходимо раздельное питание и соблюдение гигиенических процедур.
- Смена зубной щетки, полотенца и других гигиенических средств после лечения тонзиллита.
- Восстановление иммунитета у детей, переболевших другие инфекционным заболеваниями.
- Обработка горла специальные средствами при простудных заболеваниях.
Грамотные меры профилактики тонзиллита при простуде и других респираторных болезнях могут избежать осложнений.
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
Поделись с друзьями! Будьте здоровы!
симптомы и лечение у взрослых, антибиотики при тонзиллите
Бактериальный гнойный вирусный, герпетический, аллергический, острый тонзиллит МКБ-10 – лечение антибиотиками, препаратами, лекарствами, таблетками, спреями у взрослых и детей
В зависимости от тяжести течения заболевания, острый тонзиллит лечится дома или в условиях стационара. Младенцев и детей раннего возраста с острым воспалением миндалин, чаще всего, госпитализируют.
Лечение предусматривает меры, направленные на:
- Устранение причины заболевания. При бактериальном, вирусном, грибковом и аллергическом остром тонзиллите врачи назначают соответственно антибиотики местного и общего воздействия, противовирусные, противогрибковые и антигистаминные препараты.
- Устранение симптомов заболевания. Антипиретики – от температуры, местные антисептики и анальгетики — от боли в горле, головной боли, прочее.
- Повышение иммунитета. Это витамины группы В, витамины С, различные витаминно-минеральные комплексы.
- Улучшение дренажа лимфы. Очень хорошо при ангине и других болезнях миндалин помогает Лимфомиозот.
При остром тонзиллите назначение делает врач.
Помимо лечения фармакологическими препаратами при ангине используют:
- физиопроцедуры
- гомеопатию
- народные методы лечения: травами, продуктами пчеловодства, прочее
- диетотерапию
Причины возникновения тонзиллита
Данное заболевание может протекать по-разному, поэтому современная медицина выделяет два основных типа протекания тонзиллита.
Классификация заболевания
Основополагающим фактором для классификации тонзиллита являются причины развития недуга. Существует две основные группы:
- Острый тонзиллит (бытовое название – ангина). Данный вид заболевания имеет местные проявлениями и проявляется в виде острого воспаления компонентов лимфойдной ткани глотки, чаще всего этому недугу подвержены нёбные миндалины. Вызвано недомогание стрептококками или стафилококками, реже встречаются иные возбудители. В большинстве случаев бактериальным возбудителем острого тонзиллита становится гемолитический стрептококк группы А, в редких – вирусы и прочие стрептококки, в исключительно редких — хламидии и микоплазмы.
- Хронический. Когда воспалительный процесс в полости глотки и миндалевидных желез протекает длительный период времени, развивается данный тип тонзиллита. Также он образуется после перенесённой ангины и других инфекционных болезней, которые характеризуются воспалением слизистой оболочки зева (скарлатина, корь, дифтерия). Бывают редкие случаи образования хронического тонзиллита без предшествующего острого заболевания.
Хроническая форма тонзиллита в свою очередь подразделяется на компенсированную и декомпенсированную стадии:
- Компенсированная стадия является своего рода дремлющим очагом инфекции. При ней нет никаких видимых реакций со стороны организма, и рецидивов ангины также не наблюдается. Защитная функция миндалевидных желез и реактивность организма не нарушены.
- Декомпенсационная стадия характеризуется частыми рецидивами ангины, нередко отмечаются осложнения тонзиллита в виде абсцессов, процессов воспаления уха и пазух носа, а также поражения других жизненно важных органов (сердца, почек).
Антибактериальная терапия
К процессу подбора лекарственного средства необходимо подходить со всей серьёзностью. Врач, назначая определённые медикаменты, учитывает несколько важных факторов, от которых будет зависеть эффективность терапии.
Критерии выбора препаратов для лечения заболевания
- Медикаменты для устранения инфекции должны без труда проникать в мягкие ткани, накапливаться там, в необходимой для подавления микробов, или остановки их роста концентрации и поддерживать эту концентрацию длительное время, чтобы препарат можно было принимать разумное количество раз в сутки. На сегодня из известных средств, удовлетворяющих этим условиям, можно говорить только об антибиотиках.
- Учитывать необходимо индивидуальную переносимость составляющих антибиотика.
Применяемые препараты
Среди многочисленного ассортимента фармацевтических препаратов необходимо выбрать тот, что подойдет каждому отдельно взятому человеку. Антибиотики бывают разные, поэтому специалист сделает это с учётом особенностей организма и личной переносимости. Часто назначают следующие препараты:
- Самыми популярные антибиотики – пенициллины. В настоящее время на смену старым инъекционным способам введения данных антибиотиков приходят полусинтетические таблетированные препараты (“Амоксициллин”, “Флемоксин”, “Оксациллин”, “Ампициллин”, “Тикарциллин”, “Карбенициллин”). Но, признанными лидерами на сегодняшний момент остаются ингибиторозащищенные пенициллины, стойкие к ферментам микробов (Амоксициллина клавулонат: “Флемоклав”, “Панклав”, “Амоксиклав”, “Аугментин”. Ампициллина сульбактам: “Ампиксид”, “Сультамициллин”, “Уназин”,) и комбинированные препараты (“Ампиокс”).
- Препаратами второго ряда являются макролиды (“Кларитромицин”, “Джозамицин”), наибольшая популярность из которых у азитромицина (“Азитрал”, “Сумамед”, “Хемомицин”). К ним же относятся цефалоспорины второго (“Цефуроквсим”) третьего (“Цефтриаксон”, “Цефоперазон”, “Цефтибутен”, “Цефиксим”, “Цефазидим”) и четвертого (“Цефепим”) поколений.
- Антибиотики при хроническом тонзиллите – это аминогликозиды с меньшими побочными эффектами со стороны почек (“Амикацин”) или фторхинолоны; офлоксацин (“Заноцин”, “Глауфос”, “Киролл”), норфлоксацин (“Квинолокс”, “Локсон”, “Негафлокс”), ломефлоксацин (“Ксенаквин”, “Ломацин”), “Лефлоксацин”, “Ципрофлоксацин” (“Ифиципро”, “Квинтор”), “Моксифлоксацин”, “Спарфлоксацин” (“Спарфло”), “Левофлоксацин”, “Гатифлоксацин”.
Как правильно принимать таблетки во время обострения ангины – дозировка
Дозировка антибиотиков, применяемых при тонзиллите, часто обусловлена формой выпуска. Ниже приведены наиболее часто назначаемые антибиотики и рекомендованная дозировка:
Стоимость от 60 р.
- Амоксициллин принимается дважды в день по 500 мг. Курс приема – 5-7 дней.
- Цефалоспорин принимают по 1,0-2,0 гр. через 8-12 часов.
- Амоксиклав принимают через каждые 6-8 часов по 1,2 грамма.
- Бензилпенициллин принимают 1,8-3,6 грамм в сутки. Длительность приема – неделя.
- Эритромицин. Допустимая суточная доза – около 2 гр., разовая – 0,5 гр. Курс лечения длится 10 дней.
- Клацид принимают 2 раза в день по 250 гр. Курс приема – от 6 до 14 дней.
- Таблетки Амоксил принимают 250 – 50 мг через 8 часов.
- Кларитромицин принимают два раза в сутки по 250 – 500 мг. Курс лечения – от 6 до 14 дней.
- Сифлокс. Допустимая разовая норма – 250 – 50 мг через 8 часов.
Противопоказания к применению антибиотиков
Как и у любого препарата у антибиотиков, применяемых для лечения тонзиллита, есть ряд противопоказаний, характерных для каждого отдельного типа лекарств. Для цефалоспоринов и пенициллинов противопоказаниями являются:
- Аллергические реакции.
- Выраженный кандидоз ротовой полости.
- Заболевания печени и ее недостаточность.
- Заболевания почек.
- Нельзя одновременно применять с аминогликозидами.
У макролидов свои противопоказания:
- Аллергия.
- Беременность.
- Грудное вскармливание.
- Поражение слуха.
- Детский возраст.
Фторхинолоны также имеют существенные ограничения в использовании:
- Аллергическая непереносимость.
- Ферментная недостаточность (дефицит глюкозо-6-дегидрогеназы).
- Беременность.
- Выраженный атеросклероз сосудов мозга.
- Грудное вскармливание.
- Недостаточность почек и/или печени.
Рекомендации по применению
- При тонзиллите антибиотики необходимо применять курсом длительностью не менее пяти дней.
- Ни в коем случае нельзя прерывать курс лечения, чтобы не было осложнений со стороны сердечно-сосудистой системы.
- Следует строго придерживаться назначений врача.
- Вкупе с антибиотиками рекомендуют применять антигистаминные препараты.
- Рекомендовано одновременное употребление пробиотиков.
Лечение
Медикаментозная терапия тонзиллита – это комплекс лекарств и процедур. В период острой формы болезни рекомендуется соблюдать строгий постельный режим. Еда должна быть неострой и негрубой, чтобы не раздражала уже и так раздраженную слизистую миндалин. Обильное питье – теплым, но не горячим. Для укрепления иммунитета прописывается курс витаминов.
Антибиотики при тонзиллите: инструкция по применению
Какие антибиотики применять при тонзиллите?
Антибиотики при тонзиллите назначает врач с учетом чувствительности микроорганизмов к тому или иному препарату, и не все прописывают одно и то же, как это часто бывает у нас. Важно: если возбудителем тонзиллита является вирусная инфекция, антибиотики неэффективны!
Чаще всего при лечении тонзиллита назначают Амоксициллин.
Амоксициллин – бактерицидный антибиотик пенициллина. Амоксициллин быстро и полностью всасывается в кишечнике. Доза подбирается с учетом тяжести течения тонзиллита, сначала берется мазок для определения типа возбудителя. Взрослым и детям старше 10 лет обычно назначают дозировку 0,5 г трижды в сутки.
С осторожностью назначают при беременности.
Антибиотики при остром тонзиллите
Предупреждаем от необоснованного, без консультации врача, самолечения тонзиллита антибиотиками.Это может закончиться тяжелой реакцией организма на эти препараты. Антибиотики при тонзиллите следует назначать только врачу!
Рассмотрим действие препарата Цефадроксил на пациента с острым тонзиллитом.
Цефадроксил – цефалоспориновый антибиотик в форме таблеток. Максимальная концентрация в крови достигается через полтора часа после приема. Цефадроксил выводится медленно, достаточно принимать его 1 раз в сутки. Суточная доза Цефадроксила составляет 1-2 г.Продолжительность лечения 10-12 дней. Возможны неприятные побочные эффекты, такие как сыпь, головокружение, бессонница, вагинальный кандидоз.
[5], [6], [7]
Антибиотики при хроническом тонзиллите
Антибиотики при тонзиллите в хронической форме зависят от микрофлоры, вызвавшей заболевание. Антибиотики назначают при обострении.
Например, рассмотрим антибиотик цефалексин.
Взрослым Цефалексин назначают в дозировке 1-4 г каждые 6 часов в течение недели.Побочное действие проявляется диспепсией, явлениями колита, тремора, судорог, аллергии. Возможен аллергический шок. Во время беременности врач перед назначением препарата тщательно оценивает риски. Препарат проникает в грудное молоко, на время лечения стоит прекратить прием ГВ.
[8], [9], [10], [11]
Антибиотики при тонзиллите у детей
Тонзиллит – воспаление миндалин. Они расположены в ротоглотке и пронизаны мелкими порами – лакунами.В лакунах накапливаются вирусы и бактерии, и они начинают воспаляться и гноиться. Малыш становится раздражительным и плаксивым, не может заснуть, вялый. Заболевание начинается остро – утром ребенок был бодрым, играл, а к вечеру поднялась очень высокая температура, воспалились регионарные лимфоузлы. Хронический тонзиллит часто дает осложнения гайморовым пазухам, дети страдают синуситом, затяжным истощающим ринитом и отитом. Чаще возбудителем ангины у детей является бета-гемолитический стрептококк.
Какие антибиотики обычно назначают детям при тонзиллите? Пенициллин, макролид и цефалоспорин.
Оксациллин – антибактериальный препарат пенициллинового ряда, вызывающий лизис бактериальных клеток. Максимальная концентрация препарата в крови наблюдается через полчаса после инъекции. Время полураспада также составляет полчаса. Препарат принимают через 4-6 часов в равных дозах. Возможен кожный зуд и развитие анафилактического шока, тошноты, диареи, кандидоза ротовой полости, пожелтения склеры и кожи, нейтропении.Оксициллин назначают по 0,25-0,5 г за час до еды. Суточная доза при инфекциях средней степени тяжести – 3 г, при тяжелых инфекциях – 6 г. Новорожденным – 90-150 мг / кг / сут, в возрасте 3 месяцев – 200 мг / кг / сут, до 2 лет – 1 г / кг / сут, от 2 до 6 лет – 2 г / кг / сут; Суточная доза делится на 4-6 приемов. Продолжительность лечения препаратом 7-10 дней.
Макролиды включают препарат Эритромицин – эффективный антибиотик против стафилококковой и стрептококковой ангины.На вирусы и грибки не действует, поэтому важно выяснить возбудителя. Эритромицин подходит ребенку с аллергией на пенициллины. При сочетании препарата с сульфаниламидами эффект усиливается. Разовая доза для ребенка – 0,25 г. Прием – 4 часа, за час до еды. Для детей до 7 лет доза рассчитывается по формуле 20 мг / кг. Возможное побочное действие проявляется тошнотой, диареей, желтухой.
Тантум Верде – нестероидный противовоспалительный препарат.Обладает выраженным обезболивающим действием. Тантум Верде в форме таблеток растворяют в полости рта по одной штуке трижды в сутки. Спрей Тантум Верде вводится 4 раза (4 удара) каждые 2 часа.
Очень важно правильно лечить острый тонзиллит – если врач прописал «вредный» антибиотик, то это оправдано! В профилактике большую роль играют витамины и закаливание – вытирайте ребенка холодной водой, дайте ему поспать на свежем воздухе летом.
[12], [13]
Названия антибиотиков при тонзиллите
Для лечения тонзиллита чаще всего используются антибиотики группы пенициллинов: Бензилпенициллин, Феноксиметилпенициллин.
Бензилпенициллин – оказывает бактерицидное действие на размножающиеся микроорганизмы. Препарат вводят внутримышечно или внутривенно. При инфекции верхних дыхательных путей вводят по 4-6 млн ЕД в сутки за 4 инъекции. Возможна реакция в виде крапивницы и высыпаний на слизистых оболочках, ангионевротического отека, бронхоспазма, аритмии, гиперкалиемии, рвоты, судорог.
Феноксиметилпенициллин – антибактериальный препарат для лечения острого и хронического тонзиллита группы пенициллина.При состоянии средней степени тяжести детям старше 10 лет и взрослым назначают в дозировке 3 млн ЕД. Доза разбита на три приема. Детям до 10 лет назначают по 0,5 – 1,5 млн ЕД в три приема. Возможен стоматит, фарингит.
Антибиотики при тонзиллите следует вводить осторожно, предварительно выяснив, какой возбудитель он вызван.
Антибиотики при кишечных инфекциях у взрослых и детей
Особенности применения антибиотиков при кишечной инфекции
Инфекционные заболевания кишечника возникают под влиянием проникших в организм различных возбудителей болезней: патогенных микроорганизмов, простейших и других энтеровирусов.От инфекции никто не застрахован: даже соблюдая чистоту, можно заразить бактерии воздушно-капельным путем или в быту. После постановки диагноза применение антибиотиков при кишечной инфекции у взрослых поможет устранить воспалительный процесс и предотвратить репликацию вируса.
Что такое кишечная инфекция
Более того, в желудочно-кишечном тракте бактерии начинают размножаться, выделяя токсичные вещества и яды, отравляя внутреннюю систему.Некоторые виды микроорганизмов, проникая в кровь, вызывают небольшой дискомфорт, проявления которого характерны для пищевых отравлений. В этих случаях назначают стандартные препараты. Другие патогены могут вызывать тяжелые заболевания, которые лечат только антибиотиками, которые уничтожают средства к существованию патогенных микробов.
Общие симптомы патологии:
- резкое повышение температуры, сопровождающееся фебрильным синдромом;
- частые позывы к рвоте, после которых больной становится легче;
- стул жидкий со слизью и прожилками крови;
- боль внизу живота, усиливающаяся после еды;
- внешний вид налетов на языке;
- снижение работоспособности, вялость, склонность к депрессиям;
- нарушение координации.
Кроме того, у некоторых пациентов может наблюдаться повышенное слюноотделение, конъюнктивит, заболевания ЛОР-органов.
Показания к применению антибиотиков
Желудочные антибиотики имеют как естественное, так и синтетическое происхождение, они способны подавлять размножение микроорганизмов и простейших. В настоящее время существует множество лекарств, некоторые из которых эффективны в случае установленного диагноза. Эти инструменты включают в себя широкий спектр приложений.
При каких заболеваниях назначают антибиотики:
- Staph.Часто источником заражения становятся люди, страдающие ангиной и тонзиллитом. Кроме того, заражение может произойти во время употребления в пищу мясных продуктов, молока, рыбы при их неправильном приготовлении или хранении. Основные симптомы – диарея, болезненность живота, лихорадка, тошнота.
- Дизентерия. Возбудитель передается через грязные руки, пищу и воду. Вы можете заразиться также, если купаетесь в грязной воде.
- Сальмонелла. Основным источником заражения является употребление яиц, молока, мясных продуктов и взаимодействие человека со СМИ.
- Холера – заболевание, сопровождающееся интенсивными приступами тошноты, водянистой диареей и быстрой потерей жидкости.
- E. coli характеризуется лихорадочным синдромом, обезвоживанием и другими симптомами интоксикации и воспаления в кишечнике. Бактерии попадают в организм с калом других людей, дома и через воду.
Антибиотики кишечные назначают при следующих патологических состояниях:
- на тяжелое течение инфекционных болезней;
- , если у вас диарея более 10 раз в день; №
- при синдроме интенсивной интоксикации, не способном устранить сорбентными средствами другими способами, например, лаважем, клизмой и приемом обезвоживающих растворов;
- появление крови и выделений слизистых оболочек в фекалиях;
- при диагнозе: сальмонеллез, дизентерия, холера, E.coli и другие.
Антибиотики для желудка и кишечника всегда назначаются взрослым и детям при наличии:
- анемия;
- иммунодефицит;
- раковые опухоли.
Самостоятельно прибегать к помощи антибиотиков не следует. Действие этих препаратов направлено на уничтожение определенного возбудителя. Чтобы выявить причину заражения и определить заболевание, можно использовать методы лабораторной диагностики.Лечение назначается по индивидуальной схеме, курс терапии зависит от степени тяжести патологии, возраста и других особенностей пациента.
Противопоказания и побочные эффекты
Кишечные антибиотики фторхинолоны нельзя применять детям младше 2 лет, но в тяжелых случаях выбор делается в пользу щадящих препаратов современного поколения.
С осторожностью назначают антибактериальные препараты подросткам, так как они могут негативно повлиять на мышечную и костную системы.
Лекарства эритромицин покупной группы не применяют при беременности и в период лактации, а также пациентам с заболеваниями печени и патологией мочевыделительной системы.
Нет антимикробных средств, не вызывающих побочных эффектов. Наиболее частые побочные эффекты – аллергические реакции. Также лекарства могут оказывать негативное воздействие на печень и состояние крови. Именно поэтому тот или иной антибиотик против кишечных инфекций должен назначить специалист.
Общие побочные эффекты антибактериальной терапии:
- расстройство крови, тромбы, анемия, лейкопения;
- нарушение работы мозга, онемение, мышечные спазмы, дезориентация, сонливость, слабость мышечной системы, эпилепсия;
- нарушение работы пищеварительного тракта, отсутствие аппетита, рвота, диарея, болевые симптомы в печени;
- затруднение дыхания, снижение слуховых и зрительных способностей, головокружение, нарушение координации;
- затрудненное мочеиспускание, наличие крови в венах мочи и белка.
- появление артериальной гипотензии, аллергических реакций в виде кожной сыпи и зуда, появление жара.
Несмотря на большой перечень противопоказаний и побочных эффектов, противомикробное лечение целесообразно при серьезных инфекционных патологиях, однако самостоятельное их назначение не имеет силы.
Популярные антибактериальные препараты
Обычно антибиотики при кишечных инфекциях пьют позже, спустя некоторое время после обнаружения патологии, а также при отсутствии благоприятной динамики заболевания.Однако при наличии некоторых заболеваний, например дизентерии, холеры и других, лекарство нужно принимать сразу после первых признаков.
Чаще всего врачи назначают следующие группы препаратов:
- цефалоспорины;
- тетрациклины;
- фторхинолоны;
- аминопенициллин;
- аминогликозиды.
Схему терапии и необходимую дозу подбирает лечащий врач.
Следующие наиболее часто используемые антибактериальные препараты против кишечных инфекций:
- Хлорамфеникол.Препарат широкого спектра применения, эффективен при различных возбудителях холерного вибриона года. Часто рекомендуется, если другие лекарства не дали результатов, противопоказаны детям.
- Тетрациклин при кишечной инфекции применяют, если причиной диареи являются амебы, сальмонелла, холерный вибрион, а также серьезные заболевания: чума, орнитоз, сибирская язва и другие. Таблетки эффективно устраняют диарею, однако могут нарушить кишечную флору и вызвать дисбактериоз.
- Рифаксимин малотоксичен, применяется взрослыми и детьми.Губительно влияет на патогенную микрофлору, предотвращает появление осложнений при инфекциях кишечника.
- Ампициллин – полусинтетическое вещество, относящееся к группе пенициллинов, применяемое детьми и при беременности. Успешно устраняет многие болезнетворные микроорганизмы.
- Ципрофлоксацин относится к фторхинолонам, эффективен против многих патогенных бактерий, не вызывает дисбактериоза.
- Азитромицин при кишечной инфекции способен подавлять рост микроорганизмов в среднем за 3 дня.В настоящее время макролиды считаются самой безопасной группой препаратов, в редких случаях вызывают тяжелые побочные эффекты.
- Амоксициллин назначают при инфекционных заболеваниях различных органов, в том числе пищеварительного тракта. Разрешено при беременности. Амоксициллин применяют также при отравлениях.
Антисептические препараты
Эти препараты, являющиеся вредными вредными бактериями, назначаются в качестве дополнительного лечения. Такие лекарства не уничтожают здоровую микрофлору, не влияют на полезные бактерии.Особенно эффективны лекарства против бактерий, локализованных в толстой кишке. Лекарства могут остановить рост стафилококков, дрожжей, дизентерии, протея, брюшного тифа.
В перечень эффективных антибиотиков для кишечника входят:
- Фуразолидон – препарат, устраняющий трихомонады, лямблии, успешно лечит симптомы дизентерии, брюшного тифа, не вызывая привыкания. Имеет меньше противопоказаний, чем другие средства.
- Одним из самых популярных современных препаратов является эрцефурил, относящийся к нитрофуранам.Способен подавить сальмонеллу, холеру. Активен только в кишечнике, не растворяется в кровотоке и имеет минимум побочных эффектов. Однако лекарство не может устранить серьезную бактериальную инфекцию.
- Intetrix, убивает многие бактерии и лямблии. Невозможность уничтожить микрофлору особых негативных последствий не имеет. Часто используется для профилактики инфекционных заболеваний в путешествиях и путешествиях.
- Фталазол – безопасное лекарство, устраняющее различные желудочно-кишечные расстройства, не способное растворяться в крови.
- Бисептол – комбинированный препарат бактерицидного действия. Используется при лечении дизентерии, сальмонеллеза и других инфекционных заболеваний.
Антибиотики детские
Основным проявлением кишечных инфекций у детей является диарея, которую могут вызвать около 40 возбудителей. Некоторые заболевания носят вирусный характер и устойчивы к антибактериальным препаратам.
Самолечение у детей опасно негативными последствиями. Назначить лекарство нужен специалист.
Если состояние ребенка умеренное, рекомендуются антибиотики при кишечной инфекции у детей в твердой лекарственной форме. Самые популярные:
- Зефикс – антибактериальный препарат, входит в состав тригидрата цефиксима. Устраняет различные патогенные бактерии и часто используется педиатрами.
- Азитромицин таблетки макролиды. Другие названия – Сумамед, хемомицин.
- Амоксициллин – препарат пенициллина. Выпускается в порошке для изготовления суспензии.
- Аугментин – инструмент широкого спектра применения. Присыпка противопоказана детям до 3 месяцев.
- Цефтриаксон – цефалоспорин 3-го поколения, применяемый в форме инъекций. Противопоказан новорожденным с малым весом и желтухой.
- Энтерофурил – средство от инфекционных заболеваний, назначаемое с 1 месяца жизни.
Чаще всего препараты выпускают в виде суспензии, которую применяют 5 дней. Помимо базовой терапии, малышу необходимо пить много воды, чтобы предотвратить обезвоживание.В некоторых случаях необходима госпитализация ребенка, например, при судорогах или сильной потере жидкости. В стационаре применяют капельное и внутривенное вливание.
Детский кишечный антибиотик назначают в крайнем случае и по возможности заменяют более щадящим средством.
Условия использования
При появлении первых признаков заболевания некоторые пациенты сразу начинают применять противомикробные препараты, не обращаясь к врачу и не проходя необходимых обследований. Чаще всего такие действия губительно влияют на микрофлору кишечника, усугубляют течение болезни, а также наносят вред здоровью, особенно у детей и пожилых людей.
Антибиотики при кишечной инфекции не следует назначать самостоятельно. Если правильно подобрать средство, возбудитель сможет адаптироваться к нему, что приведет к снижению терапевтического эффекта.
Дозу и продолжительность терапии определяет специалист. Не следует прекращать лечение даже при улучшении состояния.
Также рекомендуется соблюдать следующие правила:
- не проводить антибактериальную терапию для предотвращения;
- придерживаться необходимых доз и временных интервалов между применением таблеток;
- для нормализации микрофлоры совместно с лекарствами для приема пробиотиков: Хилак Форте, лактулоза, Линекс и другие;
- при наличии каких-либо хронических заболеваний и противопоказаний необходимо сообщить об этом лечащему врачу;
- При лечении детей курс таблеток следует пропить до конца, не уменьшая и не увеличивая дозу и продолжительность терапии.Предпочтительнее сиропы или суспензии, а не инъекции;
- Нельзя прибегать к дополнительному применению жаропонижающих препаратов: лекарства могут снижать терапевтический эффект друг друга и клиническую картину.
Кишечные антибиотики часто оказывают отрицательное действие на печень, почки и систему кровообращения. Поэтому бесконтрольное употребление антибактериальных препаратов недопустимо.
Частое употребление противомикробных препаратов приводит к приобретению резистентных бактерий.В этих случаях терапия может стать не только бесполезной, но и представлять угрозу для здоровья.
Усиленная диарея – это часто обезвоживание, поэтому дополнительной мерой является рекомендация пить много жидкости – не менее 2,5 литров в день. При легком обезвоживании нужно выпить специальный раствор регидрона, гумана. В случае значительной потери жидкости лечение проводится в амбулаторных условиях с использованием внутривенных растворов.
После завершения терапии необходимо использовать ферменты для нормализации работы желудочно-кишечного тракта.
Острое инфекционное заболевание, обычно переносимое человеком. Чтобы не повредить организм, антибактериальную терапию необходимо проводить под наблюдением врача, следуя его рекомендациям.
Официальное руководство по клинической практике ATS / ERS / ESCMID / IDSA
Опубликовано CID,
Чарльз Л.Дейли, Джонатан М. Иаккарино-младший, Кристоф Ланге, Эммануэль Камбау, Ричард Дж. Уоллес, Клэр Анджеак, Эрик К. Бёттгер, Ян Брозек, Дэвид Э. Гриффит, Лоренцо Гульельметти, Гвен А. Хайтт, Шандра Л. Найт, Филип Лейтман, Теодор К. Маррас, Кеннет Н. Оливье, Мигель Сантин, Джейсон Э. Стаут, Энрико Тортоли, Якко ван Инген, Дирк Вагнер и Кевин Л. Винтроп
Полный текст документа, включая таблицы и ссылки, можно найти на сайте Oxford University Press.
Нетуберкулезные микобактерии (NTM) представляют более 190 видов и подвидов, некоторые из которых могут вызывать заболевания у людей любого возраста и могут поражать как легочные, так и внелегочные органы.В этом руководстве основное внимание уделяется легочным заболеваниям у взрослых (без муковисцидоза или вируса иммунодефицита человека), вызываемым наиболее распространенными патогенами NTM, такими как комплекс Mycobacterium avium , Mycobacterium kansasii , и Mycobacterium xenopi среди медленно растущих NTM и Mycobacterium abscessus среди быстрорастущих НТМ. Группа экспертов была тщательно отобрана ведущими международными обществами респираторной медицины и инфекционных заболеваний (ATS, ERS, ESCMID, IDSA) и включала специалистов в области легочной медицины, инфекционных заболеваний и клинической микробиологии, лабораторной медицины и защиты интересов пациентов.Систематические обзоры проводились по каждому из 22 вопросов PICO (популяция, вмешательство, компаратор, результат), а рекомендации были сформулированы, написаны и классифицированы с использованием подхода GRADE (классификация оценок, разработки и оценки рекомендаций). Предлагается 31 рекомендация по лечению легочной болезни, основанная на фактических данных. Это руководство предназначено для использования медицинскими работниками, которые ухаживают за пациентами с легочной болезнью NTM, включая специалистов по инфекционным заболеваниям и легочным заболеваниям.
Ключевые слова: нетуберкулезные, Mycobacterium avium комплекс, Mycobacterium kansasii , Mycobacterium abscessus , Mycobacterium xenopi
Американское торакальное общество (ATS), Европейское респираторное общество (ERS), Европейское общество клинической микробиологии и инфекционных заболеваний (ESCMID) и Общество инфекционных болезней Америки (IDSA) совместно спонсировали разработку этого Руководства для обновления рекомендаций по лечению Нетуберкулезная микобактериальная (НТМ) болезнь легких у взрослых.NTM представляют более 190 видов и подвидов (http://www.bacterio.net/mycobacterium.html), многие из которых могут вызывать заболевание у людей любого возраста и могут поражать как легочные, так и внелегочные органы. Попытка охватить такой широкий спектр видов и болезней в руководстве с использованием современных методов разработки рекомендаций невозможна. Поэтому в данном руководстве основное внимание уделяется легочным заболеваниям у взрослых (без муковисцидоза или инфекции вируса иммунодефицита человека [ВИЧ]), вызываемым наиболее распространенными патогенами НТМ, включающими Mycobacterium avium complex (MAC), Mycobacterium kansasii, и Mycobacterium xenopi среди медленно растущих НТМ и Mycobacterium abscessus среди быстрорастущих НТМ.Двадцать два вопроса PICO (популяция, вмешательство, сопоставители, результаты) и связанные с ними рекомендации включены в Руководство. Группа экспертов была тщательно отобрана и проверена на предмет конфликта интересов, в нее вошли специалисты в области легочной медицины, инфекционных заболеваний и клинической микробиологии, лабораторной медицины и защиты интересов пациентов. Рекомендации были разработаны на основе доказательств, которые были оценены с помощью GRADE (Градация оценки, разработки и оценки рекомендаций) и кратко изложены ниже [1, 2].Рекомендации были либо «сильными», либо «условными» (таблица 1), и, как было предложено GRADE, фраза «мы рекомендуем» использовалась для сильных рекомендаций и «мы предлагаем» для условных рекомендаций [3].
Это резюме представляет собой сокращенную версию рекомендаций комиссии по 22 вопросам PICO. Подробное описание предыстории, методов, сводных данных и обоснований, поддерживающих каждую рекомендацию, можно найти в Интернете в полном тексте и сопроводительных дополнительных материалах.
Диагностические критерии легочной болезни NTM
Руководство 2007 г. включало клинические, рентгенологические и микробиологические критерии для диагностики болезни легких NTM [4]. В текущих рекомендациях также рекомендуется использовать эти критерии для классификации пациентов с легочными заболеваниями NTM (Таблица 2). Значение НТМ, выделенного из мокроты людей, которые соответствуют клиническим и рентгенологическим критериям, приведенным в таблице 2, следует интерпретировать в контексте количества положительных культур и конкретных выделенных видов.Поскольку НТМ может быть выделен из респираторных образцов из-за загрязнения окружающей среды, и поскольку у некоторых пациентов, у которых есть НТМ, выделенный из дыхательных путей, не обнаруживаются признаки прогрессирующего заболевания, для диагностических целей рекомендуется> 1 положительный посев мокроты и те же виды НТМ или подвиды в случае M. abscessus ) должны быть выделены в ≥2 культурах мокроты. Клинически значимое заболевание легких при МАК маловероятно у пациентов с единичным положительным посевом мокроты во время первоначальной оценки [5–7], но может достигать 98% у пациентов с ≥2 положительными посевами [5].
Патогенность NTM значительно варьируется от таких организмов, как M. gordonae , которые редко вызывают заболевания у людей, до M. kansasii, , которые обычно следует рассматривать как патогенные [8]. Для видов с низкой патогенностью, таких как M. gordonae , потребуется несколько повторных положительных культур в течение нескольких месяцев, наряду с убедительными клиническими и радиологическими доказательствами заболевания, чтобы определить, вызывает ли оно заболевание, тогда как одна положительная культура для M.kansasii в надлежащем контексте может быть достаточным доказательством для начала лечения [9]. Патогенность видов НТМ может различаться в зависимости от географического региона [9, 10].
Важно отметить, что тот факт, что пациент соответствует диагностическим критериям легочного заболевания NTM, не обязательно означает необходимость лечения антибиотиками. Тщательная оценка патогенности организма, рисков и преимуществ терапии, желания и возможности пациента получать лечение, а также цели терапии следует обсудить с пациентами до начала лечения.В некоторых случаях «бдительное ожидание» может быть предпочтительным курсом действий.
Двадцать два вопроса PICO рассмотрены в данном Руководстве, что дает 31 рекомендацию. Для каждой покрываемой НТМ рекомендации сгруппированы по препаратам, которые необходимо включить в схему, частоте приема и продолжительности терапии.
Лечение легочной болезни NTM (вопросы I – II)
I: Следует ли лечить пациентов с легочной болезнью NTM с помощью антимикробной терапии или наблюдать за признаками прогрессирования («бдительное ожидание»)?
- Пациентам, которые соответствуют диагностическим критериям легочной болезни НТМ (таблица 2), мы предлагаем начать лечение, а не настороженное ожидание, особенно в контексте положительных мазков мокроты на кислотоустойчивые бациллы и / или полостной болезни легких (условная рекомендация , очень низкая уверенность в оценке эффекта) .
Примечания : Решение о начале антимикробной терапии при НТМ-болезни легких должно приниматься индивидуально на основе комбинации клинических факторов, вида инфицирования и индивидуальных приоритетов пациента. Любое решение о лечении должно включать обсуждение с пациентом возможных побочных эффектов антимикробной терапии, неопределенности, связанные с преимуществами антимикробной терапии, и возможность рецидива, включая повторное инфицирование (особенно при узловой / бронхоэктатической болезни) [11– 13].
II: Следует ли лечить пациентов с легочной болезнью NTM эмпирически или на основании результатов теста на лекарственную чувствительность in vitro ?
- У пациентов с легочной болезнью МАК мы предлагаем лечение на основе чувствительности к макролидам и амикацину по сравнению с эмпирической терапией (условная рекомендация, очень низкая уверенность в оценке эффекта) .
- У пациентов с легочной болезнью M. kansasii мы предлагаем лечение на основе чувствительности к рифампицину, а не эмпирическую терапию
(условная рекомендация, очень низкая уверенность в оценке эффекта) . - Члены комиссии сочли, что у пациентов с легочной болезнью M. xenopi недостаточно доказательств, чтобы дать рекомендацию
за или против лечения, основанного на чувствительности. - У пациентов с легочной болезнью M. abscessus мы предлагаем лечение на основе чувствительности к макролидам и амикацину
по сравнению с эмпирической терапией (условная рекомендация, очень низкая уверенность в оценке эффекта) . Для макролидов требуется 14-дневная инкубация и / или секвенирование гена erm (41) для оценки потенциальной индуцибельной устойчивости к макролидам.
Примечание : Хотя корреляция in vitro-in vivo для всех основных антимикобактериальных препаратов еще не доказана, в соответствии с руководящими принципами Института клинических и лабораторных стандартов
(CLSI) рекомендуется тестирование базовой чувствительности к конкретным лекарствам [14, 15] для изолятов NTM от пациентов с определенным заболеванием. Может оказаться полезным тестирование других препаратов, но данных для конкретных рекомендаций недостаточно.
Mycobacterium avium Комплекс (вопросы III-IX)
III: Следует ли пациентам с чувствительным к макролидам МАК легочным заболеванием назначать схему из трех препаратов с макролидом или без макролида?
- У пациентов с легочной болезнью, чувствительной к макролидам, мы рекомендуем схему из трех препаратов, которая включает макролид по схеме из трех препаратов без макролида (сильная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: Хотя хорошо спланированных рандомизированных исследований макролидной терапии не проводилось, чувствительность к макролидам была последовательным предиктором успеха лечения легочного МАК [16–18]. Потеря макролида из схемы лечения связана с заметно сниженной скоростью превращения посевов мокроты в отрицательную и более высокой смертностью [16–18]. Таким образом, члены комиссии твердо придерживались мнения, что в схему лечения следует включить макролид.
IV: Следует ли использовать схему на основе азитромицина или схему на основе кларитромицина у пациентов с впервые диагностированным заболеванием легких, чувствительным к макролидам?
- Для пациентов с легочной болезнью, чувствительной к макролидам, мы предлагаем схемы лечения на основе азитромицина, а не схемы на основе кларитромицина (условная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: Экспертная группа пришла к выводу, что азитромицин предпочтительнее кларитромицина из-за лучшей переносимости, меньшего количества лекарственных взаимодействий, меньшего количества таблеток, однократного ежедневного приема и равной эффективности. Однако, когда азитромицин недоступен или не переносится, приемлемой альтернативой является кларитромицин.
V: Следует ли лечить пациентов с МАК легочной болезнью парентеральным режимом, содержащим амикацин или стрептомицин, или без парентерального режима, содержащего амикацин или стрептомицин?
Для пациентов с полостным или прогрессирующим / тяжелым бронхоэктатическим или макролидорезистентным МАК легочным заболеванием мы предлагаем включить парентеральное введение амикацина или стрептомицина в начальную схему лечения (условная рекомендация, умеренная уверенность в оценке эффекта) .
Примечания: В связи с отсутствием сравнительно эффективных пероральных препаратов существует несколько вариантов, кроме парентеральных аминогликозидов, для «усиления» стандартной пероральной терапии МАК. Комитет посчитал, что польза перевешивает риски у пациентов с полостным или тяжелым бронхоэктатическим заболеванием или резистентным к макролидам МАК легочным заболеванием, и что назначение аминогликозидов в течение как минимум 2–3 месяцев является наилучшим балансом между рисками и пользой.
VI: Следует ли для лечения пациентов с чувствительным к макролидам МАК легочным заболеванием использовать режим с ингаляционным амикацином или режим без ингаляционного амикацина?
У пациентов с впервые выявленным заболеванием легких, вызванным МАК, мы не предлагаем ни ингаляционный амикацин (парентеральная форма), ни ингаляционная суспензия липосом амикацина (ALIS) как часть начальной схемы лечения (условная рекомендация, очень низкая степень уверенности в оценке эффекта) .
Пациентам с легочной болезнью МАК, у которых лечение на основе рекомендаций не прошло не менее 6 месяцев, мы рекомендуем добавить к схеме лечения ALIS, а не стандартный пероральный режим, только (сильная рекомендация, умеренная уверенность в оценке эффекта ) .
Примечания: Рандомизированные контролируемые испытания продемонстрировали эффективность и безопасность ALIS при добавлении к терапии, основанной на рекомендациях, для лечения рефрактерной МАК легочной болезни [19, 20].ALIS в настоящее время одобрен Федеральным управлением лекарственных средств США для лечения рефрактерной болезни легких, вызванной МАК. Как отмечалось в вопросе 5, мы предлагаем, чтобы парентеральное введение амикацина или стрептомицина было включено в начальную схему лечения пациентов с полостным или прогрессирующим / тяжелым бронхоэктатическим или макролидорезистентным МАК легочным заболеванием.
VII: Следует ли у пациентов с макролидно-чувствительной болезнью легких использовать схему из трех или двух препаратов, содержащих макролиды?
Пациентам с легочной болезнью, чувствительной к макролидам, мы предлагаем схему лечения, включающую не менее трех препаратов (включая макролид и этамбутол), а не схему с двумя препаратами (только макролид и этамбутол) (условная рекомендация, очень низкая уверенность в оценки эффекта) .
Примечания: Приоритетом в терапии легочных заболеваний МАК является предотвращение развития устойчивости к макролидам. Члены комиссии были обеспокоены тем, что имеющихся в настоящее время данных [21] было недостаточно для определения риска приобретенной резистентности к макролидам при схеме из двух препаратов, и поэтому предлагали схему из трех препаратов, содержащих макролиды.
VIII: Должен ли для лечения использоваться режим на основе макролидов у пациентов с чувствительным к макролидам МАК легочным заболеванием: ежедневно или три раза в неделю?
Пациентам с легочной болезнью легких, не связанной с полостными узлами / бронхоэктатическими макролидами, мы предлагаем схему на основе макролидов три раза в неделю, а не ежедневную схему на основе макролидов (условная рекомендация, очень низкая степень уверенности в оценке эффекта) .
Пациентам с полостным или тяжелым / прогрессирующим бронхоэктатическим легочным заболеванием, чувствительным к макролидам, мы предлагаем ежедневный режим на основе макролидов, а не три раза в неделю на основе макролидов (условная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: Прерывистая терапия имеет те же показатели конверсии мокроты, что и ежедневная терапия узловой / бронхоэктатической МАК легочной болезни, а также лучше переносится, чем ежедневная терапия [22, 23].Критически важным выводом имеющихся исследований является отсутствие развития устойчивости к макролидам при прерывистой терапии. Нет подобных доказательств, оправдывающих или поддерживающих прерывистую терапию полостной МАК-легочной болезни, и она не рекомендуется.
IX: Следует ли лечить пациентов с легочной болезнью, чувствительной к макролидам, MAC: <12 месяцев лечения после отрицательного посева или ≥12 месяцев лечения после отрицательного посева?
Мы предлагаем, чтобы пациенты с легочной болезнью, чувствительной к макролидам, получали лечение в течение не менее 12 месяцев после конверсии культуры (условная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: Оптимальная продолжительность терапии легочной МАК в настоящее время не известна. Группа сочла, что в отсутствие доказательств, определяющих оптимальную продолжительность лечения, следует следовать рекомендациям Руководства 2007 года [4].
Mycobacterium kansasii (Вопросы X-XIV)
X: у пациентов с чувствительным к рифампцину M. kansasii легочным заболеванием, следует ли использовать для лечения режим, содержащий изониазид, или режим, содержащий макролиды?
У пациентов с чувствительностью к рифампицину M.kansasii болезнь легких, мы предлагаем схему лечения рифампицином, этамбутолом и либо изониазидом, либо макролидом (условная рекомендация, очень низкая уверенность в оценке эффекта).
Примечания : Изониазид в настоящее время широко используется для лечения M. kansasii легочной болезни, и, по опыту членов комиссии, были хорошие результаты при использовании схемы, состоящей из рифампицина, этамбутола и изониазида независимо от результата минимальных ингибирующих концентраций (МПК) для изониазида и этамбутола [24].На основании активности макролидов in vitro против M. kansasii и двух исследований, которые продемонстрировали хорошие результаты лечения, когда кларитромицин был заменен изониазидом [25, 26], группа предполагает, что для лечения можно использовать либо изониазид, либо макролид. комбинация с рифампицином и этамбутолом.
XI: Следует ли включать в схему лечения пациентов с чувствительным к рифампицину M. kansasii легочным заболеванием парентерально амикацин или стрептомицин?
Мы предлагаем, чтобы ни парентеральный амикацин, ни стрептомицин не использовались в рутинной практике для лечения пациентов с M.kansasii болезнь легких (сильная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: Схемы трех пероральных препаратов, рифампицина и этамбутола, а также изониазида или макролида, позволяют достичь высоких показателей устойчивой конверсии посевов и успеха лечения при лечении легочной болезни M. kansasii . Таким образом, с учетом хороших результатов, наблюдаемых при пероральных схемах приема, и высокого риска побочных эффектов, связанных с парентеральным введением амикацина или стрептомицина, комитет твердо убежден в том, что использование этих парентеральных средств не является оправданным, если только невозможно использовать схему на основе рифампицина. или присутствует тяжелое заболевание.
XII: Следует ли использовать схему лечения, включающую фторхинолон, или схему без фторхинолона, у пациентов с чувствительным к рифампицину M. kansasii легочным заболеванием?
У пациентов с легочным заболеванием, чувствительным к рифампицину M. kansasii , мы предлагаем использовать режим рифампицина, этамбутола и либо изониазида, либо макролида вместо фторхинолона (условная рекомендация, очень низкая уверенность в оценке эффекта) .
У пациентов с устойчивостью к рифампицину M. kansasii или непереносимостью одного из антибиотиков первого ряда мы предлагаем использовать фторхинолон (например, моксифлоксацин) как часть схемы второго ряда (условная рекомендация, очень низкая уверенность в отношении оценки эффекта) .
Примечания: Успешное лечение M. kansasii легочного заболевания схемой приема препаратов на основе рифамицина обычно превосходно, но оптимальный выбор сопутствующих препаратов не ясен.В то время как этамбутол обычно является предпочтительным сопутствующим препаратом, в качестве дополнительного сопутствующего лекарственного средства можно выбрать изониазид, макролид или фторхинолон. Поскольку имеется больше опыта и достоверных данных в отношении схем лечения, включающих изониазид или макролид в качестве сопутствующего препарата, эти препараты являются предпочтительными [25–28]. При резистентном к рифампицину заболевании такая схема, как этамбутол, азитромицин и фторхинолон, вероятно, приведет к успешному лечению.
XIII: У пациентов с чувствительностью к рифампицину M.kansasii болезнь легких, следует использовать схему лечения три раза в неделю или ежедневно?
Пациентам с неполостным узловым / бронхоэктатическим заболеванием легких M. kansasii , получавшим схему лечения рифампицином, этамбутолом и макролидами, мы предлагаем лечение ежедневно или три раза в неделю (условная рекомендация, очень низкая уверенность в оценке эффекта) .
У больных с полостью M.kansasii легочное заболевание, которое лечат схемой на основе рифампицина, этамбутола и макролидов, мы предлагаем ежедневное лечение вместо трехкратного еженедельного лечения (условная рекомендация, очень низкая уверенность в оценке эффекта) .
У всех пациентов с заболеванием легких M. kansasii , получавших режим изониазида, этамбутола и рифампицина, мы предлагаем лечение ежедневно вместо трех раз в неделю (условная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: Поскольку отсутствуют рандомизированные исследования и небольшой размер единственного исследования, в котором оценивалась трехкратная еженедельная терапия [26], комитет не считал, что они могут рекомендовать прерывистую терапию при полостной болезни до тех пор, пока больше доказательства были доступны. Точно так же нет данных, подтверждающих использование изониазида три раза в неделю у пациентов с легочной болезнью M. kansasii .
XIV: У пациентов с чувствительностью к рифампицину M.kansasii болезнь легких, следует ли продолжать лечение <12 месяцев или ≥12 месяцев?
Мы предлагаем лечить пациентов с легочными заболеваниями, чувствительными к рифампицину M. kansasii , по крайней мере, в течение 12 месяцев (условная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: Текущие схемы лечения на основе рифампицина связаны с высокой степенью успеха при использовании в течение как минимум 12 месяцев [27, 29].Рандомизированные контролируемые исследования, сравнивающие более короткие схемы лечения, в настоящее время отсутствуют. Хотя некоторые эксперты отдают предпочтение 12-месячному лечению после конверсии культуры, нет никаких доказательств того, что рецидивы можно предотвратить с помощью курсов лечения более 12 месяцев. Таким образом, члены комиссии сочли, что M. kansasii можно лечить в течение фиксированной продолжительности 12 месяцев вместо 12 месяцев после конверсии культуры. Поскольку конверсия мокроты обычно наблюдается через четыре месяца лечения на основе рифампицина [29–31], следует проконсультироваться с экспертом, если посевы к этому времени не превратятся в отрицательные.
Mycobacterium xenopi (вопросы XV – XVIII)
XV: Следует ли у пациентов с легочной болезнью M. xenopi использовать схему лечения, включающую фторхинолон, или схему без фторхинолона?
У пациентов с заболеванием легких, вызванным M. xenopi , мы предлагаем использовать комплексную схему лечения, включающую моксифлоксацин или макролид (условная рекомендация, низкая уверенность в оценке эффекта) .
Примечания: Имеются доказательства in vitro, что макролиды и фторхинолоны активны в отношении M. xenopi , тогда как рифампицин и этамбутол неактивны in vitro по отдельности и в комбинациях [32]. Предварительные данные исследования, проведенного во Франции, в котором пациенты рандомизировались для получения либо моксифлоксацина, либо кларитромицина в сочетании с этамбутолом и рифампицином, не показали различий в эффективности лечения между группами исследования [33].
XVI: У пациентов с M.xenopi болезнь легких, следует ли использовать схему из двух, трех или четырех препаратов для лечения?
У пациентов с легочной болезнью M. xenopi мы предлагаем ежедневный режим, включающий как минимум три препарата: рифампицин, этамбутол и либо макролид, либо фторхинолон (например, моксифлоксацин) (условная рекомендация, очень низкая степень уверенности в оценке эффекта) .
Примечания: Учитывая высокую смертность, связанную с M.xenopi , члены комиссии посчитали, что большой риск неэффективности лечения при схеме с двумя препаратами оправдывает, по крайней мере, схему лечения с тремя препаратами. Однако при выборе схемы лечения следует учитывать отсутствие универсального доступа к моксифлоксацину и небольшой объем данных по другим фторхинолонам.
XVII: Следует ли включать в схему лечения пациентов с легочной болезнью M. xenopi парентерально амикацин или стрептомицин?
У пациентов с полостным или прогрессирующим / тяжелым бронхоэктатическим поражением M.xenopi болезнь легких, мы предлагаем добавить парентеральный амикацин в схему лечения и получить консультацию специалиста (условная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: Если не считать убедительных доказательств обратного, пациентов с M. xenopi должны получать агрессивное лечение, учитывая высокую смертность от этого заболевания [34–36]. Помимо высокой смертности, комитет рассмотрел общую приемлемость и осуществимость парентеральной терапии, а также возможные затраты и токсичность, основываясь на клиническом опыте.
XVIII: Следует ли продолжать лечение у пациентов с легочной болезнью M. xenopi <12 месяцев или ≥12 месяцев после конверсии посева?
У пациентов с легочной болезнью M. xenopi мы предлагаем продолжать лечение в течение как минимум 12 месяцев после конверсии культуры (условная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: Данные показывают, что результаты лечения улучшаются при увеличении продолжительности лечения [35, 37].Группа считает, что это перевешивает риск побочных эффектов, связанных с более длительным лечением, и согласуется с предыдущими рекомендациями [4].
Mycobacterium abscessus (Вопросы XIX – XXI)
XIX: Следует ли у пациентов с легочной болезнью M. abscessus использовать схему на основе макролидов или схему без макролидов?
У пациентов с M. abscessus легочной болезнью, вызванной штаммами без индуцибельной или мутационной устойчивости , мы рекомендуем схему лечения несколькими лекарствами, содержащую макролиды (сильная рекомендация, очень низкая уверенность в оценке эффекта) .
У пациентов с M. abscessus заболеванием легких, вызванным штаммами с индуцибельной или мутационной устойчивостью к макролидам , мы предлагаем схему, содержащую макролиды, если лекарство используется из-за его иммуномодулирующих свойств, хотя макролид не считается активным лекарственным средством. в схеме с несколькими лекарствами (условная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: M.abscessus могут быть опасными для жизни, и использование макролидов потенциально может принести большую пользу. Макролиды очень активны in vitro против штаммов M. abscessus без функционального гена erm (41), и данные подтверждают использование макролидов у пациентов с заболеванием, вызванным чувствительным к макролидам M. abscessus [38, 39]. Важно выполнить тестирование in vitro на чувствительность к макролидам , включая определение функционального или нефункционального гена erm (41) [40–42].
XX: У пациентов с M. abscessus сложным заболеванием легких, сколько антибиотиков следует включить в комбинированные схемы лечения?
Пациентам с легочной болезнью M. abscessus мы предлагаем схему с несколькими лекарственными препаратами, которая включает не менее трех активных препаратов (с учетом чувствительности in vitro) на начальной фазе лечения (условная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: Учитывая обычную тяжесть заболевания, равную M. abscessus , легочную болезнь, изменчивую и ограниченную in vitro лекарственную чувствительность этих организмов, возможность возникновения лекарственной устойчивости и возможность более быстрого прогрессирования M. abscessus , заболевание легких, члены комиссии предлагают использовать схему, состоящую из трех или более активных препаратов. Члены комиссии твердо убеждены в том, что схемы лечения следует разрабатывать в сотрудничестве с экспертами по ведению этих сложных инфекций.
XXI: Следует ли у пациентов с легочной болезнью M. abscessus использовать более короткую или более длительную терапию?
У пациентов с легочной болезнью M. abscessus мы предлагаем использовать более короткий или более длительный режим лечения и получить консультацию специалиста (условная рекомендация либо вмешательства, либо сравнения, очень низкая уверенность в оценке эффекта) .
Примечания: Отсутствие исследований, различия в доступности лекарств, ресурсах и условиях практики затрудняли достижение консенсуса по оптимальной продолжительности терапии. Кроме того, члены комиссии сочли, что некоторые подгруппы пациентов следует рассматривать отдельно при определении продолжительности терапии, например: пациенты с узловой / бронхоэктатической болезнью в сравнении с полостным заболеванием, пациенты с заболеванием легких, вызванным различными подвидами M. abscessus и, что важно, в зависимости от чувствительности к макролидам и амикацину.Члены комиссии предлагают проконсультироваться со специалистом по ведению пациентов с легочной болезнью M. abscessus .
Хирургическая резекция (Вопрос XXII)
XXII: Следует ли использовать хирургическое вмешательство в сочетании с медикаментозной терапией или только медикаментозное лечение для лечения болезни легких NTM?
У отобранных пациентов с болезнью легких NTM мы предлагаем хирургическую резекцию в качестве дополнения к медикаментозной терапии после консультации со специалистом (условная рекомендация, очень низкая уверенность в оценке эффекта) .
Примечания: Отобранные пациенты с неэффективным лечением, полостными заболеваниями, лекарственно-устойчивыми изолятами или такими осложнениями, как кровохарканье или тяжелые бронхоэктазы, могут подвергнуться хирургической резекции пораженного легкого. Решение о продолжении хирургической резекции необходимо сопоставить с рисками и преимуществами операции. Панель предлагает, чтобы операция проводилась хирургом, имеющим опыт в хирургии микобактерий [43].
Род Mycobacterium состоит из разнообразной группы видов и подвидов (http: // www.bacterio.net/mycobacterium.html). За исключением комплекса Mycobacterium tuberculosis, , комплекса Mycobacterium leprae , и Mycobacterium ulcerans , остальные виды называются NTM, и их можно найти повсюду в нашей среде. Наиболее частым клиническим проявлением является болезнь легких, часто возникающая на фоне основного структурного заболевания дыхательных путей, такого как бронхоэктазы или хроническая обструктивная болезнь легких [4]. Заболеваемость и распространенность легочной болезни НТМ возрастают во многих регионах мира, особенно у пожилых людей и пациентов с бронхоэктазами [44–48].Причины увеличения распространенности полностью не изучены, но, вероятно, имеют многофакторный характер, включая факторы окружающей среды, хозяина и микробиологические факторы. Независимо от причин увеличения, очевидно, что медицинские работники будут все чаще встречаться с этими пациентами в ближайшие годы.
Доступность секвенирования генов улучшила таксономию микобактерий с необычайным увеличением числа официально опубликованных видов NTM. Из многих известных видов NTM лишь небольшое число вызывает легочные заболевания у человека.Наиболее распространенными для этого медленно растущими НТМ являются члены комплекса Mycobacterium avium , который в настоящее время состоит из 12 отдельных видов [49]. Чаще всего вызывают легочные заболевания M. avium, M. intracellulare, и M. chimaera . Другими важными НТМ, вызывающими легочные заболевания, являются M. kansasii и M. xenopi . M. abscessus и его подвиды abscessus, bolletii и massiliense на сегодняшний день являются наиболее частыми возбудителями легочных заболеваний из-за быстрорастущих микобактерий.
Диагностика болезни легких NTM требует обобщения клинических, рентгенографических и микробиологических данных. ATS и IDSA разработали набор критериев, которые помогут врачам определить, у каких пациентов наиболее вероятно прогрессирование заболевания [4]. К сожалению, прогностическая ценность этих критериев недостаточно изучена, и поэтому они служат в первую очередь в качестве руководства для клиницистов. Лаборатория остается критическим компонентом в диагностике легочного заболевания NTM, учитывая множество видов и различную патогенность.Идентификация НТМ до уровня вида, а в случае M. abscessus до уровня подвида может предоставить важную клиническую и эпидемиологическую информацию.
Лечение легочной болезни NTM варьируется в зависимости от вида (в некоторых случаях подвидов), степени заболевания, результатов лекарственной чувствительности (с ограничениями) и сопутствующих заболеваний. Режимы требуют использования нескольких противомикробных агентов, которые часто связаны с клинически значимыми побочными реакциями и должны применяться в течение длительных периодов времени.Даже в этом случае результаты лечения часто неоптимальны, и повторное заражение другим штаммом или видом является обычным явлением. Во многих случаях полезна консультация специалиста.
Состав комитета
Это руководство было разработано мультидисциплинарным комитетом, состоящим из врачей и исследователей с признанным опытом в области NTM (CA, EB, EC, CD, DG, LG, GH, JI, CL, TM, KO, JS, MS, ET, DW, KW. , RW), методологов (JLB и JMI) и представителя некоммерческой организации NTM, целью которой является поддержка пациентов, обучение и исследования в области NTM (P.Л.). Представитель пациента был полноправным участником каждого этапа процесса разработки, но не голосовал по конкретным рекомендациям. Комитет возглавил C.D. (ATS) и сопредседателем C.L. (ERS), E.C. (ESCMID) и R.W. (IDSA), представляющие свои соответствующие общества. Комитет работал с медицинским библиотекарем (S.K.), который имел опыт обобщения доказательств и процесса разработки рекомендаций. Все члены, у которых были потенциальные финансовые и / или интеллектуальные конфликты, отказались от участия или были освобождены председателями от обсуждений, связанных с формулировкой и оценкой рекомендаций, а также с голосованием по рекомендациям, связанным с потенциальным конфликтом.Команда методологов провела систематические обзоры и подготовила резюме доказательств в соответствии с подходом GRADE [1, 2].
Формулировка клинических вопросов
Комитет разработал потенциальные вопросы, которые должны быть рассмотрены в руководстве, используя руководство 2007 г. [4] и свой собственный клинический опыт и знания. Членов комитета попросили расположить вопросы в порядке важности и приоритетности, при этом все вопросы, которые считаются важными и имеют высокий приоритет, включены в руководство.Двадцать два вопроса были выбраны на основе рейтинга комитета, относящегося к лечению легочной болезни NTM. Некоторые из этих вопросов ранее рассматривались в 2007 году, но требовали обновления на основе новых данных, тогда как другие были новыми вопросами, которые, по мнению комитета, были критическими темами для управления НТМ. Представляющие интерес исходы были отобраны комиссией априори на основе их опыта и клинической экспертизы с использованием подхода, предложенного рабочей группой GRADE [1, 2, 50].
Литературный поиск и обзор доказательств
Медицинский библиотекарь (С.К.) разработал стратегию поиска с использованием ключевых слов в медицинских заголовках и текстовых слов (см. Онлайн-приложение), ограничиваясь исследованиями людей и статьями с аннотациями на английском языке. Базы данных, в которых проводился поиск, включали MEDLINE, EMBASE, Кокрановский реестр контролируемых исследований, оценку технологий здравоохранения и базу данных резюме обзоров эффектов с 1946 по июль 2015 года. Обновление было выполнено в мае 2016 года перед заключительной встречей на Международной конференции ATS и окончательное обновление было выполнено в июне 2018 г. перед подачей рукописи.
Разработка клинических рекомендаций
Комитет разработал рекомендации, которые учитывали достоверность доказательств из профилей доказательств GRADE, а также других областей, которые используются при принятии решений. Система доказательств и принятия решений GRADE использовалась для организации и документирования обсуждения каждой рекомендации [2, 50]. При разработке рекомендаций комитет рассматривал каждый из следующих факторов: качество доказательств, баланс желательных и нежелательных последствий сравниваемых вариантов управления, ценности и предпочтения, связанные с решением, последствия для использования ресурсов и справедливости в отношении здоровья, приемлемость вмешательство заинтересованных сторон и возможность реализации (см. онлайн-приложение).Комитет разработал рекомендации, основанные на профилях доказательств GRADE по каждому вопросу, с рекомендациями и их силой, определяемыми консенсусом комитета во время личных встреч.
Рекомендации были либо «сильными», либо «условными» в соответствии с подходом GRADE (таблица 1) [3]. Сила рекомендаций основывалась на уверенности в оценке эффекта, изученных исходах и связанной с этим важности для пациентов, желаемых и нежелательных последствиях лечения, стоимости лечения, влиянии лечения на справедливость в отношении здоровья, осуществимости лечения, и приемлемость лечения для важных заинтересованных сторон.В случаях, когда достоверность оценок эффекта была низкой, комитет определял, была ли обоснована сильная рекомендация, на основе парадигматических ситуаций, описанных Эндрюсом и др. [3]. Как было предложено GRADE, фраза «мы рекомендуем» использовалась для сильных рекомендаций и «мы предлагаем» для условных рекомендаций [3]. Руководство, которое финансировалось ATS, ERS, ESCMID и IDSA, будет переоценено через четыре года для определения необходимости обновления.
Руководство 2007 г. включало клинические, рентгенографические и микробиологические критерии для диагностики болезни легких NTM [4].В текущих рекомендациях также рекомендуется использовать эти критерии для классификации пациентов с легочными заболеваниями NTM (Таблица 2). Значение НТМ, выделенного из мокроты людей, которые соответствуют клиническим и рентгенологическим критериям, приведенным в таблице 2, следует интерпретировать в контексте количества положительных культур и конкретных выделенных видов. Поскольку НТМ может быть выделен из респираторных образцов из-за загрязнения окружающей среды, и поскольку у некоторых пациентов, у которых есть НТМ, выделенный из дыхательных путей, не проявляются признаки прогрессирующего заболевания, для диагностических целей рекомендуется> 1 положительный посев мокроты и тот же вид НТМ (или подвид в случае M.abscessus ) следует изолировать в ≥2 культурах мокроты, собранных с интервалом в неделю или более. Клинически значимое заболевание легких при МАК маловероятно у пациентов с единичным положительным посевом мокроты во время первоначальной оценки [5–7], но может достигать 98% у пациентов с ≥2 положительными посевами [5].
Патогенность NTM значительно варьируется от таких организмов, как M. gordonae , которые редко вызывают заболевания у людей, до M. kansasii, , которые обычно следует рассматривать как патогенные [8].Для видов с низкой патогенностью, таких как M. gordonae , потребуется несколько повторных положительных культур в течение нескольких месяцев, наряду с убедительными клиническими и радиологическими доказательствами заболевания, чтобы определить, вызывает ли он болезнь, тогда как одна положительная культура на M. kansasii в надлежащем контексте может быть достаточным доказательством для начала лечения [9]. Патогенность видов НТМ может различаться в зависимости от географического региона [9, 10].
Важно отметить, что тот факт, что пациент соответствует диагностическим критериям легочного заболевания NTM, не обязательно означает необходимость лечения антибиотиками.Тщательная оценка патогенности организма, симптомов пациента, рисков и преимуществ терапии, желания и возможности пациента получать лечение, а также цели терапии должны быть обсуждены с пациентами до начала лечения. В некоторых случаях «бдительное ожидание» может быть предпочтительным курсом действий.
Клиническая лаборатория играет решающую роль в диагностике болезни легких NTM. Подробный обзор предмета выходит за рамки Руководства, но краткий обзор клинически значимых лабораторных вопросов приводится ниже.
Получение проб дыхательных путей
Учитывая медленное течение болезни легких NTM, увеличенный интервал гарантирует, что повторные положительные посевы вряд ли будут отражать временное загрязнение трахеобронхиальной системы после однократного воздействия окружающей среды. Чтобы отличить НТМ легочное заболевание от случайного присутствия НТМ в трахеобронхиальном тракте, исследуют не менее 3 респираторных проб с интервалом не менее недели. При полостной НТМ легочной болезни для диагностики часто бывает достаточно образцов мокроты [4].В нескольких небольших исследованиях сообщалось, что жидкость из бронхоальвеолярного лаважа и посевы для промывания бронхов более чувствительны, чем спонтанно отхаркиваемый посев мокроты для диагностики узловой / бронхоэктатической болезни НТМ [51–54]. Однако в самом крупном исследовании результаты посева мокроты и культуры для промывания бронхов были эквивалентны [55]. Бронхоскопия проводится только пациентам с подозрением на легочную болезнь НТМ, у которых невозможно получить образцы мокроты спонтанно или индукционным путем.
Обработка образцов и культивирование
Обеззараживание 0,25% N-ацетил-L-цистеином и 1% NaOH (NALC-NaOH) является предпочтительным методом. Повышение концентрации NaOH снижает уровень загрязнения, но снижает чувствительность культуры [56].
Культивирование респираторных образцов выполняется как на жидких, так и на твердых средах для повышения чувствительности. Мета-анализ [57] 9 исследований [58–65] показал увеличение чувствительности культуры к NTM на 15%, если твердая среда инкубировалась вместе с жидкой системой культивирования.В нескольких исследованиях, в которых применялось несколько твердых сред и приводились результаты для каждой среды, среда Левенштейна-Йенсена оказалась наиболее чувствительной для обнаружения НТМ [59, 64]. Тем не менее, Институт клинических и лабораторных стандартов (CLSI) в настоящее время рекомендует использовать твердые среды 7h20 и 7h21 [66]. CLSI предлагает температуру инкубации 36 ± 1 ° C для медленных производителей и 28 ± 2 ° C для тех, кто выращивает быстро [66]: более высокие температуры (например, 42 ° C) могут ускорить рост M. xenopi , но более низкие температуры инкубации имеют не доказано, что его полезность в диагностике легочных заболеваний NTM не доказана [67].
У пациентов с высоким подозрением на легочную болезнь NTM, но с отрицательными результатами посева, могут быть полезны пересмотр процедур дезактивации и использование среды с добавками и молекулярное обнаружение, хотя дополнительные среды редко необходимы для диагностики болезни легких NTM. Для молекулярного обнаружения большинство используют анализ, специфичный для рода микобактерий, который используется в сочетании с секвенированием нуклеиновых кислот, чтобы отличить комплекс M. tuberculosis от NTM [68, 69].
Идентификация видов
Правильная идентификация НТМ важна, так как она может предсказать клиническую значимость изолята [8], а также помочь в выборе схемы лечения.Могут применяться как методы молекулярной, так и масс-спектрометрии. Молекулярная идентификация является предпочтительным методом и может быть достигнута с помощью зондов или секвенирования генов. Анализы на основе зондов легче выполнять и внедрять, но они не обладают дискриминирующей способностью, что приводит к ошибочной идентификации и упрощенному представлению о филогении и эпидемиологии НТМ [70, 71]. Секвенирование генов допускает более высокий уровень дискриминации, часто вплоть до уровня подвидов, но выполнимо только для лабораторий, имеющих доступ к средствам секвенирования.Было описано несколько генов-мишеней, например, 16S рРНК, hsp65, rpoB, и внутренний транскрибируемый спейсер (ITS) 16S – 23S [72–75]. Одно только секвенирование гена 16S рРНК обеспечивает ограниченную дискриминационную способность, особенно для группы M. abscessus – M. chelonae [70]. Гены hsp65 и rpoB и ITS более различимы [76]. Дополнение секвенирования 16S рРНК дополнительными мишенями там, где это необходимо, дает лучшую дискриминационную способность, позволяя идентифицировать до уровня подвидов (например, для M.abscessus ) [77, 78].
Различительная способность метода масс-спектрометрии с использованием метода лазерной десорбции-ионизации-времени пролета с использованием матрицы (MALDI-TOF) для НТМ увеличилась с недавними улучшениями протоколов экстракции белков и баз данных, но не все виды и подвиды могут быть дифференцированы с помощью этого подхода [ 79, 80]. Эти процедуры хорошо работают для чистых культур [80, 81]; однако при применении к новым положительным жидким культурам сразу можно идентифицировать только 50% изолятов [82].В остальных случаях для получения хороших результатов MALDI-TOF необходимо провести пересев на твердую среду до появления видимого роста [79].
Все клинически значимые изоляты НТМ должны быть идентифицированы молекулярными методами, включая последующие изоляты пациентов, проходящих лечение НТМ легких. По возможности, изоляты от пациентов, проходящих лечение от болезни легких NTM, замораживаются и сохраняются, чтобы отличить повторное инфицирование от рецидива в случае рецидива.
Тестирование лекарственной чувствительности
В целом, тестирование лекарственной чувствительности проводится для препаратов, используемых в схемах лечения и для которых существует четкая корреляция между активностью in vitro и результатами лечения in vivo.Такая корреляция становится все более очевидной для НТМ, особенно для макролидов и амикацина. CLSI предоставляет рекомендации по процедурам тестирования [14, 15].
Для комплекса M. avium существует четкая корреляция между исходной чувствительностью к макролидам штамма-возбудителя и исходом лечения схемами макролид-этамбутол-рифампицин [83, 84]. Приобретенная устойчивость к макролидам в комплексе M. avium обусловлена точечными мутациями в гене 23S рРНК ( rrl ) [85, 86].Приобретенная устойчивость к амикацину обусловлена мутациями, придающими устойчивость в гене 16S рРНК ( rrs ), и в основном выделяется у пациентов, подвергшихся обширному воздействию амикацина и / или родственных аминогликозидов [55, 87].
