Диагностика рака предстательной железы | Университетская клиника г. Фрайбурга
Важным преимуществом использования этой системы является выбор пути доступа к простате. Вследствие устойчивости кишечных бактерий к антибиотикам иногда возникают осложнения после трансректального способа (через прямую кишку) биопсии простаты. Новый метод позволяет проводить процедуру биопсии перинеально (через промежность) и тем самым предотвращать возможность проникновения кишечных бактерий в кровь. Для этого в области промежности делаются всего два маленьких прокола, через которые берутся образцы тканей опухоли.
Специально разработанная программа роботизированной системы «iSR`obotTM Mona-Lisa-Systems» демонстрирует на экране трехмерное изображение места забора проб для биопсии, и образцы тканей с различной степенью агрессивности врач может тут же на месте идентифицировать. Таким образом, с помощью роботизированного метода диагностики можно получить пространственное изображение опухоли и определить её размер.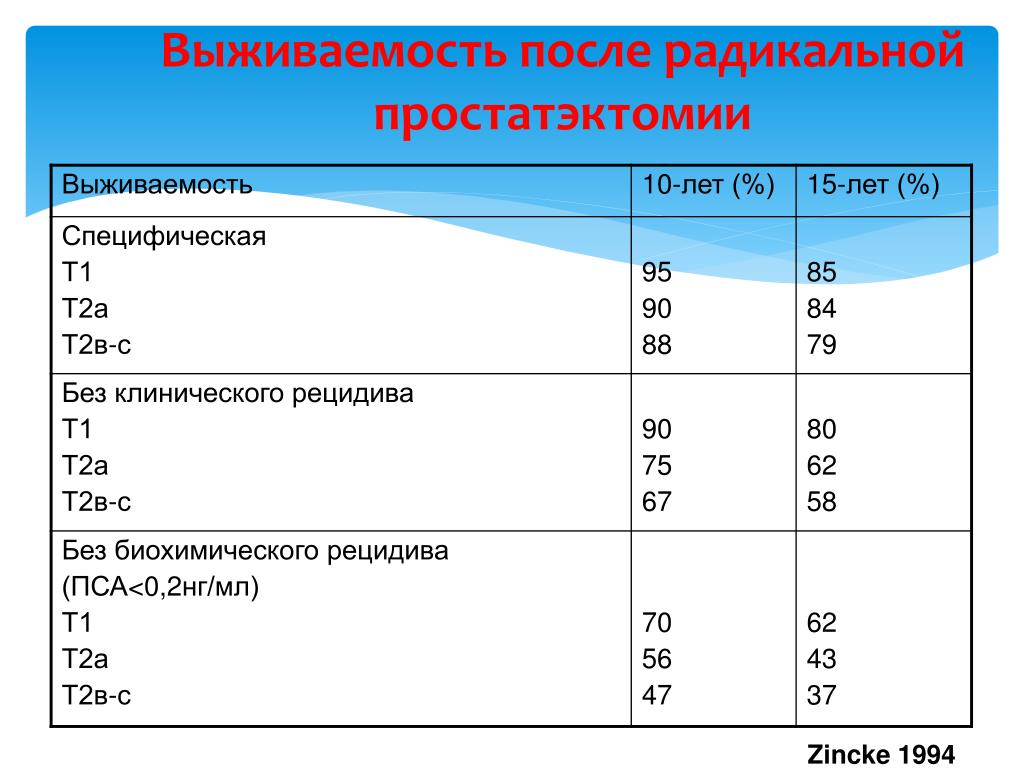
Роль онкомаркера ПСА
ПСА (PSA – prostate-specific antigen) – аббревиатура от «простатспецифический антиген». В 80-е годы прошлого века, вскоре после его первого обнаружения в сперме в 1979 г., ПСА получил статус онкомаркера рака предстательной железы.
ПСА – органоспецифический (простата), а не онкоспецифический маркер
Это значит, что повышение ПСА может наблюдаться даже при доброкачественном увеличении простаты (доброкачественная гиперплазия предстательной железы – ДГПЖ) или при ее воспалении (простатит).
Нормы для ПСА не существует. Более 10 лет предельным значением, при превышении которого рекомендовали проведение биопсии простаты, считали 4 нг/мл. Положительная предсказывающая ценность такой величины, то есть вероятность наличия рака простаты, составляет около 25%.
Более 90% рака предстательной железы обнаруживают благодаря определению уровня ПСА
Между тем пальпаторное исследование простаты через прямую кишку утратило свое значение, так как опухоль, которую можно прощупать, должна быть не менее 0.7 см в диаметре.
Поскольку по уровню ПСА часто невозможно четко отграничить доброкачественное увеличение простаты от рака, в последние годы предложены многочисленные вспомогательные параметры, которые в порядке убывающей сверху вниз клинической значимости коротко представлены в таблице:
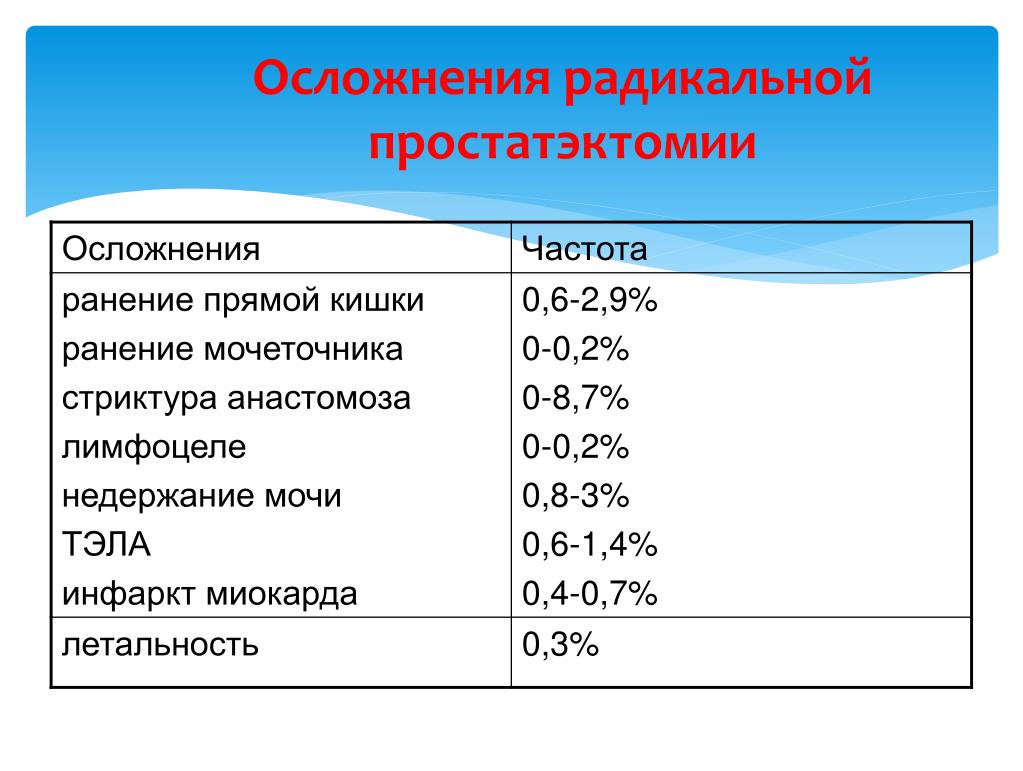
Рецидив рака предстательной железы после радикальной простатэктомии
Радикальная простатэктомия (РПЭ) — самый эффективный метод лечения локализированных форм рака, который позволяет полностью удалить опухоль. Однако даже удаление первичного очага заболевания не исключает появления отдаленных метастазов в послеоперационный период.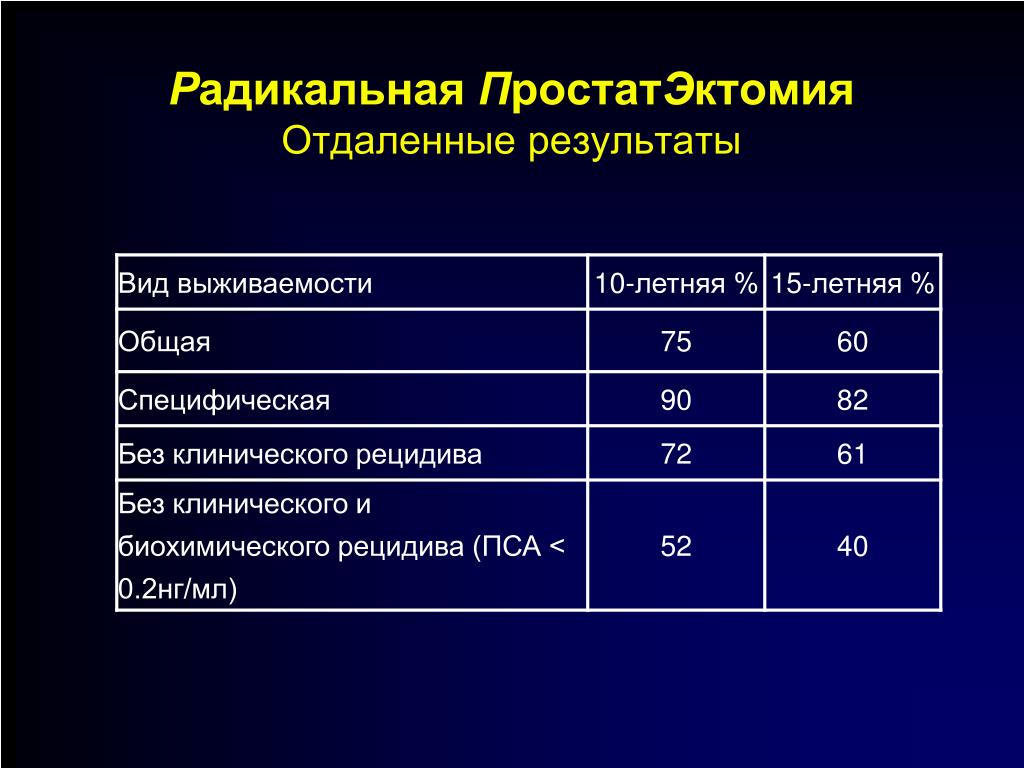
Причины рецидива рака простаты
Основная причина рецидива рака простаты после радикальной простатэктомии — оставшиеся в организме пораженные клетки, которые в активном состоянии способны к неконтролируемому размножению.
Как в организме остаются злокачественные клетки? В первую очередь, это отдалённые вторичные очаги — метастазы, которые в момент проведения оперативного вмешательства присутствуют в организме. Они распространяются как в ткани ближайших органов (семенные пузырьки, тазовые лимфоузлы, шейку мочевого пузыря, кишечник), так и в печень, легкие, кости осевого скелета, органы центральной нервной системы. Рецидив такого вида называют метастатическим.
 Позитивный хирургический край может образоваться, когда рак распространяется за капсулу предстательной железы или при низком качестве оперативного вмешательства.
Позитивный хирургический край может образоваться, когда рак распространяется за капсулу предстательной железы или при низком качестве оперативного вмешательства.Факторы прогноза местного рецидива рака простаты после РПЭ
Прогрессирование рака простаты после радикальной простатэктомии происходит крайне медленно и практически бессимптомно. Риск развития рецидива определяют по совокупности биомаркеров: уровню сывороточного ПСА, плотности ПСА патологоанатомической стадии рака, сумме Глисона, характеру хирургического края, объему удаленной опухоли, лимфоваскулярной и периневральной инвазии. Общепризнанным фактором прогноза рецидива также является предоперационный уровень ПСА в сочетании со степенью распространенности рака.
Уровень простатспецифического антигена
Исследования C.R. Pound в 1999 году показали, что все без исключения случаи рецидива рака простаты сопровождаются повышением уровня простатического специфического антигена (ПСА) — протеина, вырабатываемого клетками предстательной железы.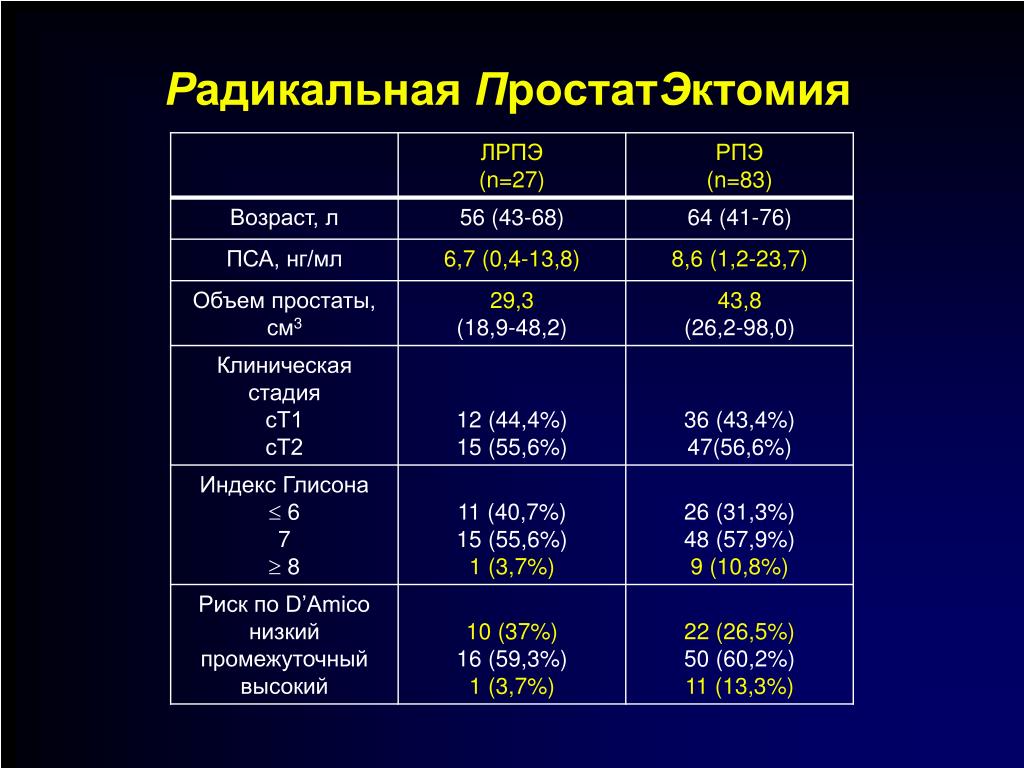 В течение 2-3 недель сразу после успешного проведения радикальной простатэктомии у подавляющего большинства пациентов уровень ПСА снижается до пороговых значений.
В течение 2-3 недель сразу после успешного проведения радикальной простатэктомии у подавляющего большинства пациентов уровень ПСА снижается до пороговых значений.
Любой рост уровня антигена и его отличная от нуля величина могут быть индикатором локального или отдаленного рецидива рака. Поэтому оценку уровня рекомендуется проводить через 3 и 6 месяцев после операции, затем в течение первых трех лет после РПЭ — через каждые полгода, в дальнейшем — 1 раз год.
Однако если после удаления опухоли остался позитивный хирургический край, уровень ПСА также может незначительно повышаться, при этом другие клинические признаки опухолевого процесса отсутствуют.
 При этом также принимают во внимание плотность ПСА — отношение дооперационного уровня антигена к объему удаленной простаты.
При этом также принимают во внимание плотность ПСА — отношение дооперационного уровня антигена к объему удаленной простаты.Сумма Глисона
Злокачественные опухоли простаты неоднородны. Для оценки структурной дифференцировки злокачественного образования используется сумма Глисона. Она определяется в результате сложения приведенных к пятибалльной шкале результатов гистологического исследования двух участков пораженной железы и позволяет оценить степень прогрессирования опухоли. Минимальный риск развития рецидива у пациентов с локализованной формой рака при показателе Глисона 6, максимальный — при значении от 8 до 10.
Характер хирургического края
При «чистых» краях резекции прогноз развития рецидива минимален, он составляет не более 16%. В то время как при позитивном хирургическом крае — 26%. Уменьшить риск образования позитивного хирургического края позволяет радикальная робот-ассистированная простатэктомия Да Винчи. Система роботической хирургии предоставляет хирургу 3D-изображение и 20-кратное увеличение оперируемой области, что позволяет полностью удалить пораженные ткани.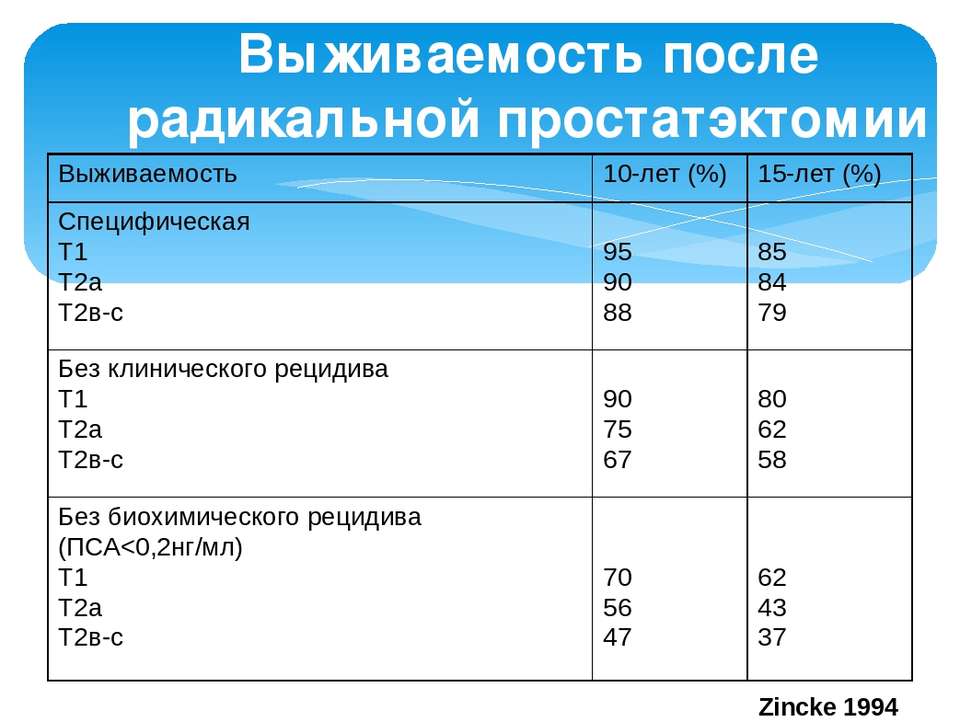
Совокупность вышеперечисленных факторов, а также объем удаленной опухоли более 4 куб. см, лимфоваскулярная и периневральная инвазия и стадия рака от Т2а и выше увеличивают риск возникновения местного рецидива рака простаты после радикальной простатэктомии.
Диагностические исследования
При возрастании уровня ПСА после РПЭ для уточнения диагноза на ранних стадиях развития рецидива используют современные методы визуализации.
- Трансректальное УЗИ (при подозрении на локальный рецидив и как метод контроля при проведении биопсии).
- Эндоректальная МРТ малого таза с контрастным усилением (идентифицирует рецидивирующие опухоли при относительно низких значениях ПСА).
- Мультиспиральная компьютерная томография (выявление висцеральных и костных метастазов, оценка состояния лимфоузлов).
Проведение компьютерной и магнитно-резонансной томографии рекомендуется пациентам с повышенным уровнем сывороточного ПСА, а также при жалобах на боли в костях (независимо от уровня ПСА).
Методы лечения рецидива
Локализованная форма
Пациентам с высоким риском рецидива может быть рекомендовано проведение адъювантной лучевой терапии сразу после операции. Облучению подвергают ложе удаленной предстательной железы и регионарные лимфатические узлы. Полный курс лечения длится около 7 недель, сессии облучения — ежедневно.
Метастатический рецидив
На стадии рака T3a-bN0/1M0 после РПЭ при низкой распространенности процесса для предотвращения рецидива рекомендовано применение лучевой терапии в комбинации с курсом андрогенной депривации. Пациентам с тяжелыми сопутствующими заболеваниями может быть назначена гормональная терапия или комбинация гормональной и химиотерапии.
Выбор метода лечения для каждого пациента определяется индивидуально в зависимости от стадии заболевания, группы риска, размера опухоли, значений биомаркеров.
Локально прогрессирующий рак предстательной железы
Локально-прогрессирующий рак предстательной железы относится к опухоли, которая распространяется за пределы предстательной железы.
Рис.1 Т3 опухоль простаты распространяется на семенные пузырьки Рис.2 Т4 Опухоль простаты распространяется в шейку мочевого пузыря, сфинктер уретры и прямую кишку
Варианты лечения
Наиболее распространенными вариантами лечения локально-прогрессирующего рака предстательной железы являются: радикальная простатэктомия в сочетании с лучевой и гормональной терапией. Вариант лечения подходящий вам зависит от:
- характеристик опухоли;
- вашей истории болезни;
- вашего возраста;
- возможностей вашего стационара;
- ваших личных предпочтений и ценностей;
Радикальная простатэктомия – это хирургическое лечение, при котором удаляется вся простата и семенные пузырьки. Может быть выполнена как открытым, так и лапароскопическим способом. Если у вас локально-прогрессирующий рак предстательной железы, вам потребуется дополнительное лечение после операции. Это может быть лучевая терапия, гормональная терапия или их комбинация.
Может быть выполнена как открытым, так и лапароскопическим способом. Если у вас локально-прогрессирующий рак предстательной железы, вам потребуется дополнительное лечение после операции. Это может быть лучевая терапия, гормональная терапия или их комбинация.
В качестве альтернативы хирургической операции, может быть рекомендована лучевая терапия направленная на повреждение и уничтожение раковых клеток. Это распространенный вариант лечения локально-прогрессирующих опухолей. При локально-прогрессирующем раке предстательной железы лучевая терапия всегда сочетается с гормональной.
Гормональная терапия влияет на выработку тестостерона в организме. Цель состоит в том, чтобы остановить рост опухоли. Другое название для гормональной терапии – андрогенная депривационная терапия (ADT).
Радикальная простатэктомия
Радикальная простатэктомия является хирургическим вариантом лечения локально-прогрессирующего рака предстательной железы. Цель состоит в том, чтобы удалить как можно больше опухоли. Это делается путем удаления всей предстательной железы и всех семенных пузырьков, а также окружающих тканей пораженных опухолью. Операция также включает удаление лимфатических узлов в области таза. Для проведения радикальной простатэктомии используется общий наркоз. Не всегда возможно удалить всю опухоль, поэтому врач может рекомендовать дополнительное лечение лучевой или гормональной терапией.
Это делается путем удаления всей предстательной железы и всех семенных пузырьков, а также окружающих тканей пораженных опухолью. Операция также включает удаление лимфатических узлов в области таза. Для проведения радикальной простатэктомии используется общий наркоз. Не всегда возможно удалить всю опухоль, поэтому врач может рекомендовать дополнительное лечение лучевой или гормональной терапией.
Радикальная простатэктомия может быть выполнена как открытым, так и лапароскопическим способом. При открытой хирургической операции доступ к предстательой железе осуществляется через брюшную стенку или промежность. Простата, семенные пузырьки а также ткани пораженные опухолью удаляются, а мочевой пузырь и мочеиспускательный канал соединяются вместе (рис.3). Вводится уретральный катетер, для адекватного опорожнения мочевого пузыря и заживления места соединения уретры и мочевого пузыря. Обычно катетер удаляется через 7 дней.
Рис. 3а – место радикальной простатэктомии с семенными пузырьками. Рис. 3б – положение мочевого пузыря после радикальной простатэктомии.
Рис. 3б – положение мочевого пузыря после радикальной простатэктомии.
При лапароскопической операции через брюшную стенку вставляются специальный порты (трубки). Через эти порты заводятся специальные инструменты, необходимые для удаления простаты. Один порт используется для вставки камеры, которая позволяет хирургу видеть высококачественное изображение вашей простаты на мониторе. Лапароскопическая операция также может быть выполнена с помощью хирургической робототехнической системы. Для удаления локализованной опухоли предстательной железы с радикальной простатэктомией открытая и лапароскопическая операции одинаково эффективны.
Врач объяснит, как именно в вашей ситуации необходимо готовиться к данной операции.
Нельзя кушать, пить, курить за 6-8 часов до операции. Если вы принимаете какие-либо лекарственные препараты, сообщите об этом своему врачу. Возможно, потребуется отмена некоторых препаратов за несколько дней до операции.
Обычно вы можете быть выписаны из стационара на 3 – 7 сутки после операции. Продолжительность вашего пребывания в стационаре зависит от конкретной сложившейся ситуации. Вы можете испытывать незначительные боли в нижней части живота в течение нескольких недель после открытой радикальной простатэктомии. После операции может быть недержания мочи или эректильная дисфункция. Может потребоваться лечение при таких осложнениях.
Продолжительность вашего пребывания в стационаре зависит от конкретной сложившейся ситуации. Вы можете испытывать незначительные боли в нижней части живота в течение нескольких недель после открытой радикальной простатэктомии. После операции может быть недержания мочи или эректильная дисфункция. Может потребоваться лечение при таких осложнениях.
Вам необходимо вернуться в больницу, если есть:
- высокая лихорадкa
- большая кровопотеря
- сильная боль
- проблемы с мочеиспусканием
Радикальная простатэктомия может стать причиной стрессового недержания мочи (СНМ). Это происходит потому, что простата окружает мочеиспускательный канал, помогая ему противостоять давлению при полном мочевого пузыря. Если предстательная железа удалена, это может отразиться на способности уретры удерживать мочу при полном мочевом пузыре. Есть несколько вариантов лечения СНМ.
Еще один распространенный риск радикальной простатэктомии является эректильная дисфункция. Во время операции хирург должен манипулировать вблизи нервов и сосуды пениса стараясь оставить их неповрежденными. Сохранность нервов и сосудов зависит от агрессивности рака, и его распространения.
Во время операции хирург должен манипулировать вблизи нервов и сосуды пениса стараясь оставить их неповрежденными. Сохранность нервов и сосудов зависит от агрессивности рака, и его распространения.
При необходимости, врач порекомендует лечение СНМ или эректильной дисфункция. Не стесняйтесь сообщать врачу о своих проблемах.
Имейте в виду, что основной целью радикальной простатэктомии является удаление опухоли.
Радикальная простатэктомия – распространенная операция при локально-прогрессирующем раке предстательной железы. В большинстве случаев для полного удаления опухоли необходимы другие методы лечения. Наиболее распространенными видами лечения после радикальной простатэктомии являются лучевая и гормональная терапия. Эти методы лечения могут вызывать побочные эффекты и влиять на качество жизни.
После радикальной простатэктомии при раке предстательной железы необходимо регулярное посещение лечащего врача. Регулярное наблюдение длится не менее 5 лет. Во время каждого визита проводится исследование уровня простатспецифического антигена (ПСА) в крови.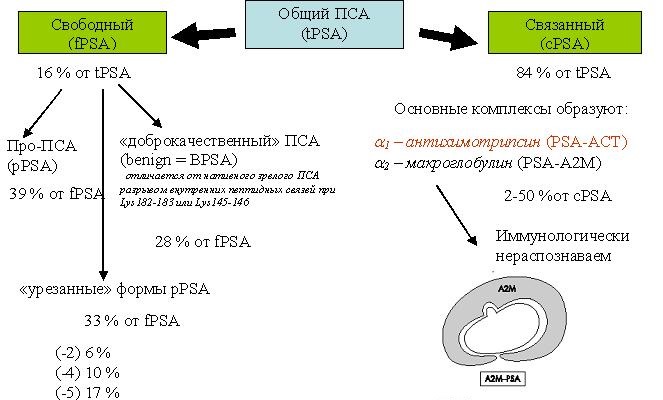 В некоторых случаях может потребоваться пальцевое ректальное исследование. Последующее наблюдение важно для контроля вашего состояния после операции, чтобы обратить внимание на общее состояние здоровья и выявить возможные рецидивы рака.
В некоторых случаях может потребоваться пальцевое ректальное исследование. Последующее наблюдение важно для контроля вашего состояния после операции, чтобы обратить внимание на общее состояние здоровья и выявить возможные рецидивы рака.
Лучевая терапия повреждает и убивает раковые клетки. Раковые клетки предстательной железы обычно чувствительны к лучевой терапии. Благодаря новейшим технологиям, этот метод стал эффективным при лечения локализованного рака предстательной железы. Обсудите с вашим врачом преимущества и недостатки лучевой терапии, если этот метод вам подходит.
Цель лучевой терапии в том, чтобы убить раковые клетки в простате. Поскольку излучение может затронуть клетки других органы, такиех как мочевой пузырь, важно, чтобы пучок излучения был нацелен на раковые клетки. В настоящее время лучевая терапия имеют повышенную точность луча, и позволяет использовать более высокие дозы радиации с меньшим количеством побочных эффектов. Стандартный курс лучевой терапии (Рис.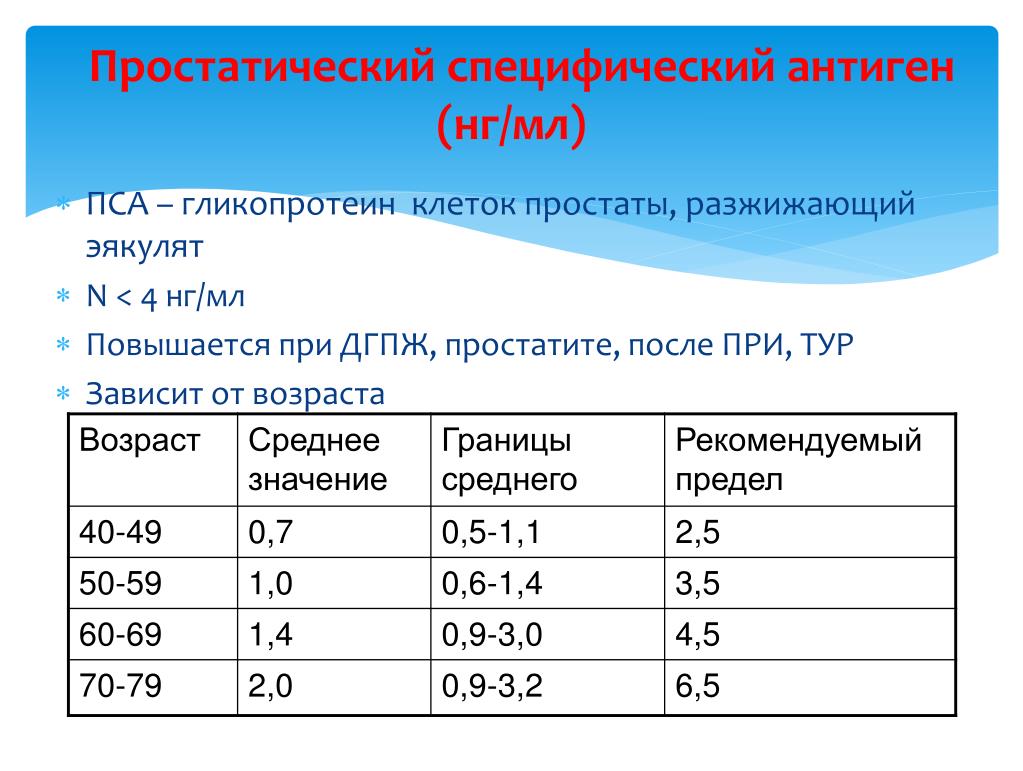 4) длится около 8 недель, 5 дней в неделю. Вы получаете одну дозу радиации в день. Процедура занимает около 20 минут каждый день.
4) длится около 8 недель, 5 дней в неделю. Вы получаете одну дозу радиации в день. Процедура занимает около 20 минут каждый день.
Рис. 4 Внешняя лучевая терапия
Перед началом курса лучевой терапии необходимо выполнение КТ. Это делается для более точного определения области, которая будет подвергаться излучению, а также окружающей ткани, которую не следует затрагивать. В последние годы лучевая терапия с использованием визуализации стала более доступной. Для данной терапии онколог очень точно определяет место опухоли с помощью рентгеновского или компьютерного исследования, чтобы убедиться, что доза облучения доставляется точно. Другой формой лучевой терапии является внутренняя лучевая терапия (брахитерапия). Для этого типа лечения источник излучения подводится непосредственно к простате (рис.5). Ваш врач может предложить такой вариант лечения, если у вас низкий балл по Глисону и нет никакой симптоматики.
5 Брахитерапия.
Врач объяснит, как именно в вашей ситуации необходимо готовиться к данной процедуре.
Будет составлено расписание приемов пищи и жидкости перед каждой процедурой, чтобы убедиться, что ваш мочевой пузырь адекватно наполнен, а прямая кишка пуста. Если вы принимаете какие-либо лекарственные препараты, сообщите об этом своему врачу.
Как правило, вам не нужно прекращать прием препарата во время лучевой терапии.
Общие побочные эффекты – жжение при мочеиспускании, учащенное мочеиспускание и раздражение анального отверстия. Это связано с тем, что окружающие органы, особенно мочевой пузырь и прямая кишка, также получают небольшую дозу облучения. Обычно эти симптомы появляются на середине курса лечения и исчезают через несколько месяцев после его окончания.
Общим побочным эффектом лучевой терапии является кровотечение в мочевом пузыре и прямой кишке, даже через несколько лет после лечения. Вы также можете испытать симптомы нижних мочевых путей (СНМП) или эректильную дисфункцию. Побочные эффекты лучевой терапии варьируются связаны с состоянием вашего здоровья и типом лучевой терапии, которую вы получаете.
Если после операции наблюдения повышение уровня ПСА, это значит, что рак предстательной железы не был полностью удален, может потребоваться дополнительное лечение для удаления всех опухолевых клеток. Обсудите с вашим врачом, какой вариант лечения для вас наиболее подходит.
Какими будут последующие мероприятия?
После лучевой терапии рака предстательной железы необходимо регулярное посещение лечащего врача. Регулярное наблюдение длится не менее 5 лет. Во время каждого визита проводится исследование уровня простатспецифического антигена (ПСА) в крови. В некоторых случаях может потребоваться пальцевое ректальное исследование. Последующее наблюдение важно для контроля вашего состояния после операции, чтобы обратить внимание на общее состояние здоровья и выявить возможные рецидивы рака.
Гормональная терапия является вариантом лечения локально-прогрессирующего рака предстательной железы. Она направлена остановку роста опухоли. Рост клеток рака предстательной железы зависит от мужских половых гормонов, называемых андрогенами. Тестостерон является наиболее важным андрогеном. Андрогены вырабатываются в основном в яичках. Гормональная терапия либо влияет на выработку, либо блокирует действие андрогенов. Это называется кастрацией. Другое название для гормональной терапии андрогенная депривационная терапия (ADT). Кастрацию можно выполнить хирургическим путем или с помощью лекарственных препаратов. Хирургическим путем удаляются оба яичка, это называется двусторонней орхиэктомией. Операция обычно проводится под местной анестезией. Медикаментозная терапия для прекращения производства андрогенов включает агонисты агонисты гонадотропин-рилизинг-гормона и антагонисты гонадотропин-рилизинг-гормона. Эти препараты доступны для подкожного тик и внутримышечного введения. Антиандрогены – это препараты, которые блокируют действие андрогенов. Выпускаются в таблетированой форме. Все эти методы лечения приводят к кастрации. Кастрация имеет физические и эмоциональные последствия. Наиболее распространенными симптомами после кастрации являются: снижение сексуального влечения и эректильная дисфункция.
Тестостерон является наиболее важным андрогеном. Андрогены вырабатываются в основном в яичках. Гормональная терапия либо влияет на выработку, либо блокирует действие андрогенов. Это называется кастрацией. Другое название для гормональной терапии андрогенная депривационная терапия (ADT). Кастрацию можно выполнить хирургическим путем или с помощью лекарственных препаратов. Хирургическим путем удаляются оба яичка, это называется двусторонней орхиэктомией. Операция обычно проводится под местной анестезией. Медикаментозная терапия для прекращения производства андрогенов включает агонисты агонисты гонадотропин-рилизинг-гормона и антагонисты гонадотропин-рилизинг-гормона. Эти препараты доступны для подкожного тик и внутримышечного введения. Антиандрогены – это препараты, которые блокируют действие андрогенов. Выпускаются в таблетированой форме. Все эти методы лечения приводят к кастрации. Кастрация имеет физические и эмоциональные последствия. Наиболее распространенными симптомами после кастрации являются: снижение сексуального влечения и эректильная дисфункция. Последствия хирургической кастрации симптомы являются постоянными. При химической кастрации некоторые симптомы могут исчезнуть после лечения. При локально-прогрессирующем раке предстательной железы стандартным методом лечения является гормональная терапия в сочетании с лучевой.
Последствия хирургической кастрации симптомы являются постоянными. При химической кастрации некоторые симптомы могут исчезнуть после лечения. При локально-прогрессирующем раке предстательной железы стандартным методом лечения является гормональная терапия в сочетании с лучевой.
Двусторонняя орхиэктомия.
Двусторонняя орхиэктомия или хирургическая кастрация – операция по удалению обоих яичек. Это вариант лечения локально-прогрессирующего рака предстательной железы и направлен на прекращение выработки андрогенов. Операция может проводиться под местной анестезией. Если у вас есть заболевания сердечно-сосудистой системы необходима консультация кардиолога перед началом приема гормональной терапии.
Во время операции вы укладываетесь на спину. Может быть использована местная или спинномозговая анестезия. В некоторых случаях будет рекомендован общий наркоз. Хирург выполняет разрез в мошонке, и удаляет оба яичка. Поскольку ткань, которая окружает яички, не удаляется, мошонка не будет выглядеть абсолютно пустой после операции.
Врач объяснит, как именно в вашей ситуации необходимо готовиться к данной операции.
Нельзя кушать, пить, курить за 6-8 часов до операции. Если вы принимаете какие-либо лекарственные препараты, сообщите об этом своему врачу. Возможно, потребуется отмена некоторых препаратов за несколько дней до операции.
Осложнения после выполнения двухсторонней орхиэктомии встречаются редко, но может быть боль в области мошонки, кровотечение, присоединение инфекции или медленное заживление раны.
Рекомендации в течение 2-3 недель после операции:
- Ограничение физической нагрузки
- Нельзя принимать ванну с горячей водой
- Нельзя посещать баню, сауну
Вам необходимо вернуться в больницу, если есть:
- высокая лихорадки
- сильная боль
- рана начинает кровить
Если вас не устраивает хирургическая кастрация, есть препараты, которые могут остановить производство андрогенов. Наиболее распространенными препаратами являются агонисты гонадотропин-рилизинг-гормона и антагонисты гонадотропин-рилизинг-гормона .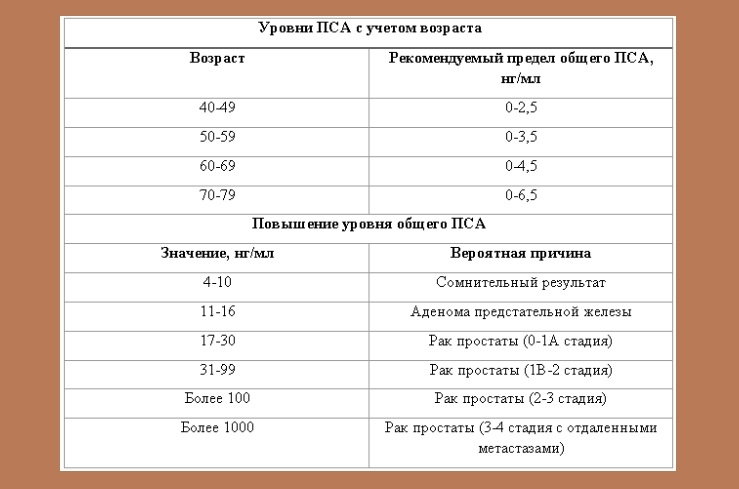 Цель этих препаратов – остановить рост опухоли с помощью химической кастрации.
Цель этих препаратов – остановить рост опухоли с помощью химической кастрации.
Гонадотропин-рилизинг-гормон (ЛГРГ)
Выработка тестостерона регулируется головным мозгом. Мозг производит несколько гормонов, которые помогают регулировать другие гормоны. При лечении рака простаты препараты, влияющие на Гонадотропин-рилизинг-гормон, используются для прекращения выработки андрогенов.
Агонисты ЛГРГ
Агонисты ЛГРГ останавливают выработку тестостерона в яичках. Они вводятся подкожно или внутримышечно. Введения могут длиться 1, 3, 6 или 12 месяцев. Обсудите с врачом, какой вариант лучше для вас. В первые дни после первой инъекции агонисты ЛГРГ повышают уровень тестостерона, это называется всплеском. Увеличение уровня тестостерона может вызвать увеличение опухоли. В редких случаях это может быть опасно и может вызвать затрудненное мочеиспускание. Врач может скомбинировать терапию с антиандрогенами.
Антагонисты ЛГРГ
Антагонисты ЛГРГ являются новой формой гормональной лекарственной терапии. Их не нужно комбинировать с антиандрогенами в течение первых недель, потому что они не вызывают всплеска. Дегареликс является наиболее часто используемым антагонистом ЛГРГ. Его нужно вводить каждый месяц под кожу.
Их не нужно комбинировать с антиандрогенами в течение первых недель, потому что они не вызывают всплеска. Дегареликс является наиболее часто используемым антагонистом ЛГРГ. Его нужно вводить каждый месяц под кожу.
Антиандрогены
Антиандрогены блокируют действие тестостерона. В результате опухоль будет расти медленнее или перестанет расти полностью. Наиболее часто применяемыми антиандрогенами являются ацетат ципротерона, флутамид и бикалютамид. Все они выпускаются в виде таблеток и принимаются каждый день.
Ацетат ципротерона обычно принимается в двух-трех ежедневных дозах. Флутамид принимают три раза в день. Бикалютамид является наиболее распространенным антиандрогеном, и его принимают один раз в день.
Каковы побочные эффекты гормональной терапии?
Гормональная терапия останавливает выработку или блокирует действие мужских гормонов и вызывает кастрацию. Каждый может реагировать на кастрацию по-разному. Наиболее частыми побочными эффектами кастрации являются:
- приливы жара
- снижение сексуального влечения
- эректильная дисфункция
- остеопороз
- повышенный риск сердечных заболеваний
- диабет
У вас также может появиться боль в суставах, спине, костях или мышцах. Изменение уровня гормонов может вызвать повышение артериального давления, головокружение высокий риск присоединения инфекции, особенно в носоглотке или мочевых путях.
Изменение уровня гормонов может вызвать повышение артериального давления, головокружение высокий риск присоединения инфекции, особенно в носоглотке или мочевых путях.
Потеря аппетита и потеря веса также могут быть результатом кастрации. Это может быть связано с диареей, запором или рвотой, вызванной гормональными изменениями. Другие побочные эффекты могут включать кашель, одышку, головные боли и периферические отеки. Антагонисты LHRH могут вызывать аллергическую реакцию. Антиандрогены могут вызвать увеличение вашей груди. Это называется гинекомастией и может протекать болезненно в некоторых случаях. Чтобы предотвратить гинекомастию, врач может рекомендовать лучевую терапию грудной клетки до начала гормональной терапии. В редких случаях вам может понадобиться хирургическое вмешательство. Антиандрогеновые осложнения можно лечить с помощью малых доз эстрогенов. Эстрогены могут увеличить риск сердечных заболеваний. Флутамид может вызвать диарею. Как часто появляются побочные эффекты после гормональной терапии зависит индивидуально от каждого человека. Это связано с общим состоянием здоровья и типом лечения, которое вы получаете. Со временем раковые клетки предстательной железы становятся устойчивыми к гормональной терапии, и опухоль снова начнет расти. Это назвается рак простаты устойчивый к кастрации.
Это связано с общим состоянием здоровья и типом лечения, которое вы получаете. Со временем раковые клетки предстательной железы становятся устойчивыми к гормональной терапии, и опухоль снова начнет расти. Это назвается рак простаты устойчивый к кастрации.
Если после операции наблюдения повышение уровня ПСА, это значит, что рак предстательной железы не был полностью удален, может потребоваться дополнительное лечение для удаления всех опухолевых клеток. Общие варианты лечения:
- Новые гормональные препараты
- Химиотерапия
- Иммунотерапия
Возможно, что рак предстательной железы возникает после лечения. Это называется рецидивом. Рак может возникнуть в простате, в ткани вокруг простаты или тазовых лимфатических узлах или в других органах. Дальнейший путь лечения зависит от месторасположения опухоли. Врач будет порекомендовать проведение дополнительных методов исследования, таких как компьютерная томография, МРТ, или остеосцинтиграфия, чтобы определить местонахождение опухоли, определить ее характеристики и решить тактику лечения.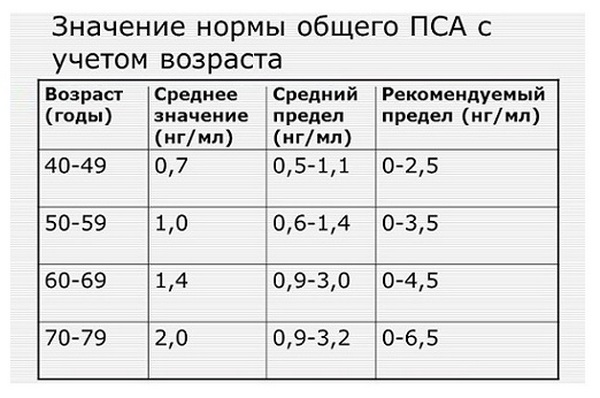 Если у вас была радикальная простатэктомия и уровень ПСА в крови повысился, это может быть признаком рецидива. Врач может порекомендовать лучевую терапию. Данная процедура будет направлена на область, где была расположена простата, чтобы убить раковые клетки. Если лучевая терапия не самый лучший вариант для вас, моет быть порекомендована гормональная терапия. Если у вас была лучевая терапия, то может быть рекомендована радикальная простатэктомией. При быстром повышении уровня ПСА и появлении симптомом рекомендуется начать гормональную терапию. В некоторых странах брахитерапия доступна для лечения рецидивов в качестве альтернативы гормональной терапии.
Если у вас была радикальная простатэктомия и уровень ПСА в крови повысился, это может быть признаком рецидива. Врач может порекомендовать лучевую терапию. Данная процедура будет направлена на область, где была расположена простата, чтобы убить раковые клетки. Если лучевая терапия не самый лучший вариант для вас, моет быть порекомендована гормональная терапия. Если у вас была лучевая терапия, то может быть рекомендована радикальная простатэктомией. При быстром повышении уровня ПСА и появлении симптомом рекомендуется начать гормональную терапию. В некоторых странах брахитерапия доступна для лечения рецидивов в качестве альтернативы гормональной терапии.
Подготовка к консультации может быть очень полезной. Это поможет вам и вашему врачу лучше понять проблему и подобрать правильный вариант лечения. Это также поможет вам подготовиться к лечению и возможным побочным эффектам.
Вот несколько вещей, которые вы можете сделать:
- Запишите вопросы, которые вы хотели бы задать врачу.
 Это поможет вам вспомнить то, что вы хотите спросить.
Это поможет вам вспомнить то, что вы хотите спросить. - Узнайте информацию о вашем конкретном типе рака простаты.
- Если доктор использует термины, которые вы не понимаете, попросите объяснить их.
- Если вы принимаете какие-либо лекарственные препараты, сообщите об этом своему врачу. Некоторые из этих лекарств могут влиять на лечение
Радикальная простатэктомия может вызывать стрессовое недержание мочи (СНМ). Это означает, что моча может произвольно подтекать во время кашляя, смеха, бега, подъема по лестнице и т.д. Вот несколько советов, которые помогут вам справиться с этими симптомами:
- Старайтесь всегда знать, где находится ближайший туалет. Никогда не бойтесь и не стесняйтесь спрашивать, где туалет, когда вы находитесь вдали от дома
- Если у вас есть проблемы с подтеканием мочи, вы можете использовать пенильные зажимы или прокладку. Пенильные зажимы надеваются поверх пениса и удерживают мочу.
- Используйте средства борьбы с неприятным запахом.
 Спросите о таких в аптеке.
Спросите о таких в аптеке. - Носите одежду темного цвета. На светлой одежда могут появляться пятна.
- Носите свободную и комфортную одежду
- Имейте дополнительный комплект одежды под рукой
Другой распространенный риск операции – эректильная дисфункция. Существуют различные варианты лечения этого состояния. Наиболее распространенными из них являются: таблетки, инъекции или протезирование. Обсудите с врачом какой вариант больше вам подходит.
СНМ или эректильная дисфункцией после радикальной простатэктомии могут трудно поддаваться лечению. Что оказывает пагубное психологическое воздействие.
Во время лучевой терапии вы можете заниматься своей повседневной деятельностью. Лечение может повлиять на нижние мочевые пути, кишечник, и может вызывать усталость. Усталость может быть результатом ежедневных поездок в больницу. Обычно эти симптомы исчезают через несколько месяцев после лечения.
Из-за излучения может быть повреждена кожа.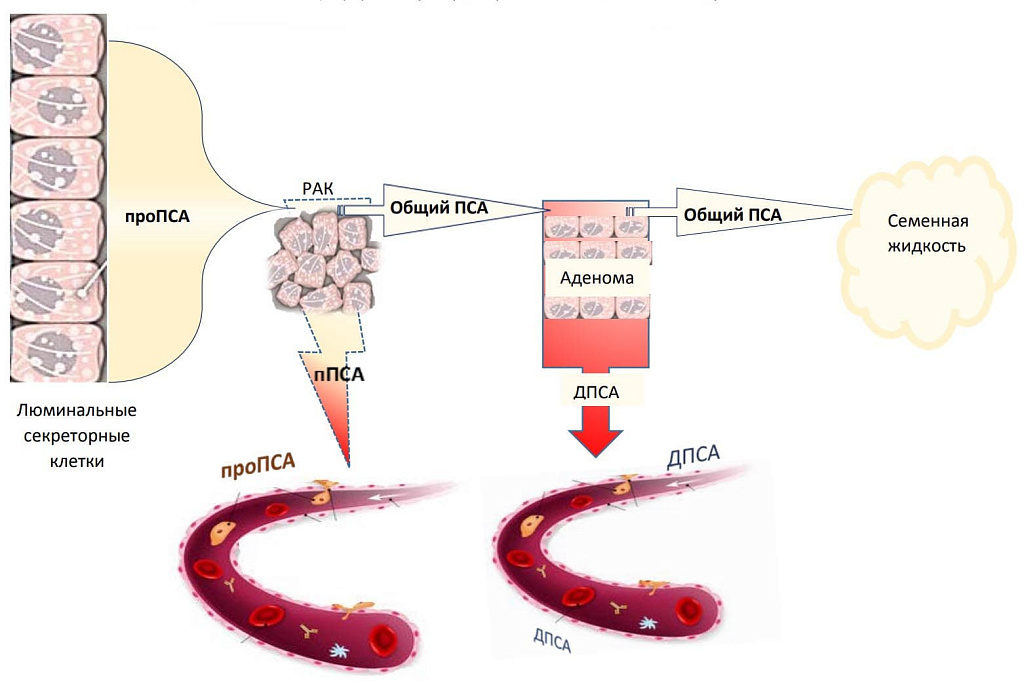 Чтобы ухаживать за кожей, вы можете:
Чтобы ухаживать за кожей, вы можете:
- Избегать повреждения облучаемой области.
- Используйте лосьон для кожи для борьбы с раздражением.
- Избегайте воздействия прямых солнечных лучей.
- Используйте солнцезащитный крем с высоким фактором. Носите одежду из хлопчатобумажной или льняной ткани;
- Ежедневно соблюдайте правила личной гигиены;
- Осторожно вытерайте кожу после мытья;
- Не посещайте баню, сауну
Все виды гормональной терапии вызывают кастрацию, на которую все реагируют по разному. Наиболее частым побочным эффектом кастрации является приступообразное ощущение жара. Чтобы справиться с этим, необходимо контролировать свой вес и не употреблять алкогольных напитков.
Если вы испытываете приливы жара, вы можете:
- одеваться прохладнее
- носить одежду из хлопчатобумажной или льняной ткани, которая позволят телу дышать
- спите под тонким одеялом
- избегать горячих ванн, саун, бани
- не употребляйте горячую или острую пищу
- Пейте больше воды
После лечения будет составлен график посещений для наблюдения за вашим состоянием. Частота посещений и дополнительные исследования зависят от вашего заболевания.
Частота посещений и дополнительные исследования зависят от вашего заболевания.
Важно придерживаться графика. Во время этих наблюдений врач следит за вашим состоянием и может своевременно обнаружить рецидив опухоли. Необходимо сообщить врачу, если у вас появились новые симптомы, которые могут быть связаны с раком предстательной железы.
Важно поддерживать здорового образа жизни во время и после лечения. Старайтесь регулярно выполнять физические упражнения. Либо обратитесь к физиотерапевту. Попытайтесь сбалансировать диету с содержанием овощей, фруктов и молочных продуктов. Также включите продукты содержащие крахмал, такие как хлеб, картофель, рис, макароны, а также богатые белками продукты, такие как мясо, рыба, яйца или бобовые. Попытайтесь меньше есть сахара, соли и жирной пищи. Можете обратиться к диетологу. Попробуйте бросить курить. Это может помочь вам быстрее восстановиться после лечения.
После лечения вас может беспокоить дальнейший прогноз, влияние рака на вашу социальную, бытовую, финансовую ситуацию. Обычно беспокоит мысль о рецидиве рака. Если вас это беспокоит, обратитесь к своему врачу и узнайте о риске рецидива. Во время лечения вы будете не работоспособны, поэтому обсудите со своим начальствам все аспекты и время возвращения к рабочей деятельности. Обсудите со своей страховой компанией финансовую поддержку вашего лечения
Обычно беспокоит мысль о рецидиве рака. Если вас это беспокоит, обратитесь к своему врачу и узнайте о риске рецидива. Во время лечения вы будете не работоспособны, поэтому обсудите со своим начальствам все аспекты и время возвращения к рабочей деятельности. Обсудите со своей страховой компанией финансовую поддержку вашего лечения
Кастрат резистентный рак предстательной железы является одним из видов рака предстательной железы, который обычно развивается во время лечения метастатической болезни. Рак простаты может распространиться на другие органы или лимфатические узлы за пределами таза. Это называется метастатическим раком предстательной железы. Опухоли в других органах или лимфатических узлах называются метастазами. Врач может рекомендовать лечение метастатической болезни с помощью гормональной терапии. Гормональная терапия либо останавливает выработку, либо блокирует действие андрогенов. Это называется кастрацией. Когда этот метод эффективен, гормональная терапия останавливает рост опухоли. Этот эффект не будет длительным и приведет к кастрат резистентному раку предстательной железы. Обычно это происходит через 2-3 года после начала гормональной терапии. Кастрат резистентный рак предстательной железы не может быть излечен. Для резистентных к кастрации опухолей предстательной железы требуется значительно более низкий уровень андрогенов для прогрессирования. Это означает, что если в организме практически не вырабатываетютя андрогены, опухоль и метастазы продолжают расти. Эти раковые образования называют устойчивыми к кастрации, потому что они больше не реагируют на гормональную терапию. При этом типе рака уровень простатспецифического антигена (ПСА) в крови снова повышается. Врач поставит диагноз кастрат резистентный рак предстательной железы, если 3 анализа в течение 3 недель показывают повышенный уровень ПСА в крови. Он также может быть диагностирован, при появлении симптоматики вызванной ростом опухоли или метастазов. Исследования кастрат резистентного рака предстательной железы продолжаются, и варианты лечения быстро меняются.
Этот эффект не будет длительным и приведет к кастрат резистентному раку предстательной железы. Обычно это происходит через 2-3 года после начала гормональной терапии. Кастрат резистентный рак предстательной железы не может быть излечен. Для резистентных к кастрации опухолей предстательной железы требуется значительно более низкий уровень андрогенов для прогрессирования. Это означает, что если в организме практически не вырабатываетютя андрогены, опухоль и метастазы продолжают расти. Эти раковые образования называют устойчивыми к кастрации, потому что они больше не реагируют на гормональную терапию. При этом типе рака уровень простатспецифического антигена (ПСА) в крови снова повышается. Врач поставит диагноз кастрат резистентный рак предстательной железы, если 3 анализа в течение 3 недель показывают повышенный уровень ПСА в крови. Он также может быть диагностирован, при появлении симптоматики вызванной ростом опухоли или метастазов. Исследования кастрат резистентного рака предстательной железы продолжаются, и варианты лечения быстро меняются.
Если у вас был диагностирован рак предстательной железы, устойчивый к кастрации, врач порекомендует вам терапию, оказывающую влияние на симптомы, чтобы улучшить качество вашей жизни. Важно помнить, что кастрат резистентный рак предстательной железы не может быть излечен.
Кастрат резистентный рак предстательной железы может контролироваться:
- антиандрогенной терапией
- терапией эстрогена
- адренолитиками
- новыми гормональными препаратами
- иммунотерапией
- химиотерапией
- лучевой терапией
Поскольку кастрат резистентный рак предстательной железы по-прежнему реагирует на андрогены, врач будет рекомендовать продолжить гормональную терапию, чтобы поддерживать низкий уровень тестостерона.
После хирургической или химической кастрации врач может порекомендовать дополнительное лечение антиандрогенами. Наиболее распространенным анти-андрогенным препаратом для лечения кастрат резистентного рака предстательной железы является бикалютамид. Лечение этим препаратом направлено на замедление роста опухоли. Это не избавит вас от симптомов. Побочные эффекты могут включать увеличение груди и проблемы с печенью.
Лечение этим препаратом направлено на замедление роста опухоли. Это не избавит вас от симптомов. Побочные эффекты могут включать увеличение груди и проблемы с печенью.
Если вы лечились агонистами или антагонистами ЛГРГ в сочетании с антиандрогенной терапией, врач может рекомендовать прекратить прием антиандрогенов. Этот подход может снизить уровень ПСА в крови на несколько месяцев. Эффект проявится через 4-6 недель после прекращения приема препаратов.
Лекарственная терапия гормоном эстрогена может замедлить рост опухоли и снизить уровень ПСА в крови, не влияя на ваши кости. Это лечение может вызвать сердечно-сосудистые заболевания, включая тромбозы и сердечные приступы. Из-за этих побочных эффектов эстроген-терапия редко используется.
После кастрации надпочечники продолжают вырабатывать небольшое количество андрогенов. Адренолитические средства останавливают выработку гормонов надпочечниками. Побочные эффекты этих препаратов – диарея, зуд, сыпь на коже, усталость, эректильная дисфункция и повреждение печени. Данная терапия используется редко.
Данная терапия используется редко.
Для производства тестостерона организму необходим фермент CYP17 (17α-гидроксилаза). CYP17 обнаружен в яичках, надпочечниках и клетках рака предстательной железы. Новый гормональный препарат абиратерон блокирует CYP17, так что тестостерон не продуцируется. Лечение абиратероном направлено на замедление роста опухоли и метастазов. Это может увеличить продолжительность жизни и уменьшить симптоматику. Наиболее распространенными побочными эффектами абиратерона являются: усталость, снижение уровня калия в крови, высокое кровяное давление,
воспаление и боль в суставах, отеки вызванные задержкой жидкости в организме. Принимая абиратерон может появляться чувство усталость из-за пониженного содержания эритроцитов в крови. Другие изменения в крови могут вызвать учащенное сердцебиение, повышенную жажду, потерю аппетита, тошноту, рвоту или быстрое увеличение массы тела. Абиратерон принимается два раза в день в таблетированной форме и всегда используется в сочетании с преднизоном.
Раковые опухоли простаты нуждаются в рецепторах андрогенов. Энзалутамид – новый гормональный препарат, блокирующий андрогенные рецепторы. Он направлен на снижение уровня ПСА в крови и замедляет рост опухоли. Вам не нужно принимать дополнительные стероидные гормоны при приеме энзалутамида. Наиболее частыми побочными эффектами энзалутамида являются: чувство слабости, боли в спине и усталость.
Иммунотерапия – это тип лечения, который использует вашу собственную иммунную систему для борьбы с опухолевыми клетками. При раке предстательной железы препарат Sipuleucel-T используется в качестве иммунотерапии. Ваша собственная кровь используется для приготовления препарата. Вам нужно ходить в больницу 3 раза в 2 недели, чтобы получать терапию. Если данный метод эффективен, это позволит вам жить дольше и замедлит рост опухолей. Уровень ПСА в крови при данной терапии не уменьшается. Общие побочные эффекты могут включать: лихорадку, усталость, тошноту и головную боль.
Химиотерапия – это метод лечения рака, в котором используются химические вещества для уничтожения раковых клеток.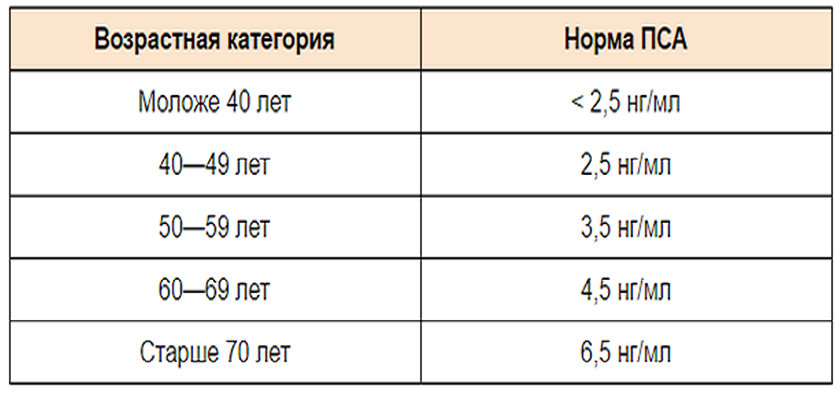 Химиотерапевтические препараты могут вводиться в кровоток, чтобы действовать на опухолевые клетки по всему организму. Они могут также применяться местно, непосредственно на опухоль. Врач может порекомендовать химиотерапию доцетакселтом для лечения кастрат резистентного рака предстательной железы. Препарат снимает боль, вызванную опухолью или метастазами. Если данный метод эффективен, это позволит вам жить с меньшим количеством симптомов и побочных эффектов. Терапия длится 1 час и обычно повторяется 10 раз, один раз каждые 3 недели. Во время курса терапии вы будете принимать преднизон в таблетированной форме. Вам необходимо принимать преднизон дважды в день в течение 5-10 курсов. Доцетаксел может вызвать побочные эффекты. Они могут включать:
Химиотерапевтические препараты могут вводиться в кровоток, чтобы действовать на опухолевые клетки по всему организму. Они могут также применяться местно, непосредственно на опухоль. Врач может порекомендовать химиотерапию доцетакселтом для лечения кастрат резистентного рака предстательной железы. Препарат снимает боль, вызванную опухолью или метастазами. Если данный метод эффективен, это позволит вам жить с меньшим количеством симптомов и побочных эффектов. Терапия длится 1 час и обычно повторяется 10 раз, один раз каждые 3 недели. Во время курса терапии вы будете принимать преднизон в таблетированной форме. Вам необходимо принимать преднизон дважды в день в течение 5-10 курсов. Доцетаксел может вызвать побочные эффекты. Они могут включать:
- Снижение уровня лейкоцитов
- Анемия
- Потеря волос
- Отеки
- Рвота
- Аллергические реакции
- Усталость
- Диарея
- Изменения ногтей
- Потеря аппетита
После того, как вы лечились доцетакселом, врач может порекомендовать гормональную терапию или другие препараты для химиотерапии. Основными гормональными препаратами являются абиратерон и энзалутамид. Кабазитаксел – препарат химиотерапии, наиболее часто используемый в этих случаях. Вы также можете получить второй курс доцетаксела. Врач обсудит различные варианты лечения, чтобы найти для вас наилучший.
Основными гормональными препаратами являются абиратерон и энзалутамид. Кабазитаксел – препарат химиотерапии, наиболее часто используемый в этих случаях. Вы также можете получить второй курс доцетаксела. Врач обсудит различные варианты лечения, чтобы найти для вас наилучший.
Абиратерон
Если ваше лечение доцетакселом было неэффективным, врач может рекомендовать гормональное лечение абиратероном. Если этот метод будет эффективен, может уменьшиться боль, снизится уровень ПСА в крови, замедлится рост опухоли и метастазов, что позволить вам жить дольше.
Наиболее распространенными побочными эффектами абиратерона являются: усталость, снижение уровня калия в крови, высокое кровяное давление, воспаление и боль в суставах, отеки вызванные задержкой жидкости в организме. Абиратерон всегда назначается в сочетании со стероидным препаратом преднизоном.
Энзалутамид
Врач может рекомендовать гормональное лечение энзалутамидом. Если этот метод будет эффективен, может уменьшиться боль, снизится уровень ПСА в крови, замедлится рост опухоли и метастазов, что позволить вам жить дольше.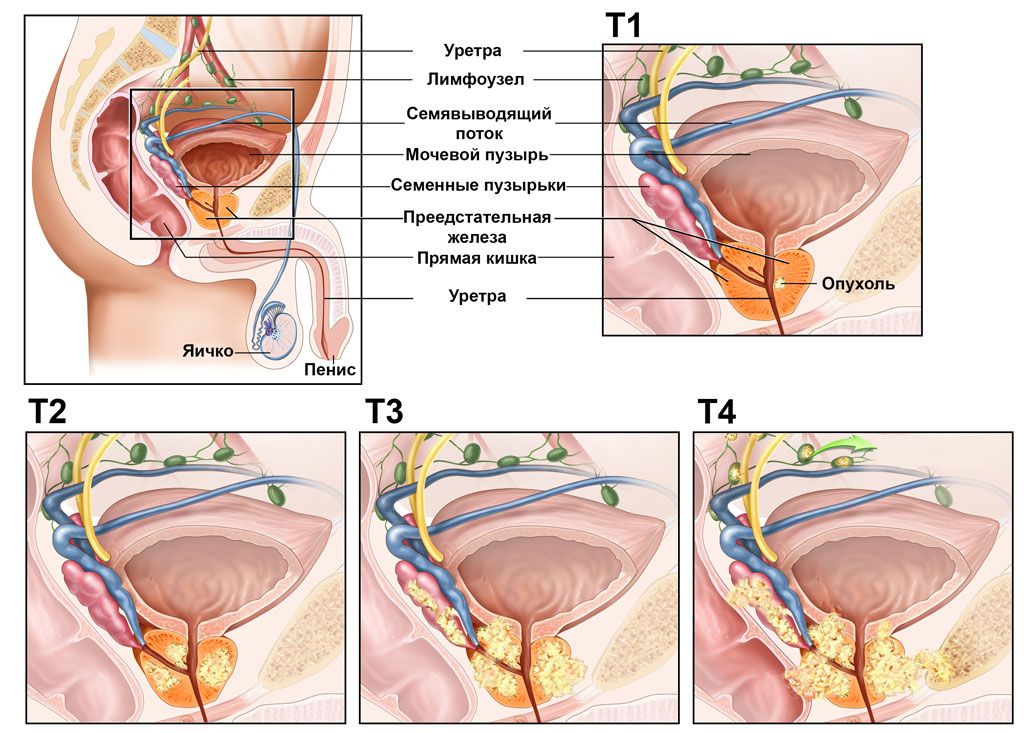 Возможные побочные эффекты: чувство слабости, боли в спине, диарея и усталость.
Возможные побочные эффекты: чувство слабости, боли в спине, диарея и усталость.
Кабазитаксел
Если доцетаксел не был эффективен, врач может рекомендовать лечение с помощью химиотерапевтического препарата кабазитаксела. Если этот метод будет эффективен, может уменьшиться боль, снизится уровень ПСА в крови, замедлится рост опухоли и метастазов, что позволить вам жить дольше. Побочные эффекты кабазитаксела включают: серьезное падение белых кровяных клеток и диарею.
Кастрат резистентный рак предстательной железы может контролироваться лучевой терапией. Радиация повреждает и убивает раковые клетки. Лечение поможет облегчить боль и может позволить вам жить дольше. Общие побочные эффекты: жжение при мочеиспускании, учащенное мочеиспускание и раздражение анального отверстия
Кости, пораженные опухолями, легче ломаются. При наличии риска переломов костей, врач может рекомендовать препараты для укрепления ваших костей. Наиболее распространенными препаратами являются бисфосфонаты и деносумаб. Эти препараты помогут отсрочить осложнения, вызванные метастазами в кости. Метастазы в кости можно также лечить лучевой терапией. Бисфосфонаты вводят каждые 4 недели. Они увеличивают костную массу и могут отсрочить осложнения, вызванные метастазами в кости. Наиболее эффективным бисфосфонатом при раке предстательной железы является золедроновая кислота. Этот препарат может вызвать повреждение почек. Деносумаб вводится под кожу каждые 4 недели. Он также увеличивает костную массу, но обычно вызывает меньше побочных эффектов, чем бисфосфонаты. Деносумаб может снижать уровень кальция в крови.
Эти препараты помогут отсрочить осложнения, вызванные метастазами в кости. Метастазы в кости можно также лечить лучевой терапией. Бисфосфонаты вводят каждые 4 недели. Они увеличивают костную массу и могут отсрочить осложнения, вызванные метастазами в кости. Наиболее эффективным бисфосфонатом при раке предстательной железы является золедроновая кислота. Этот препарат может вызвать повреждение почек. Деносумаб вводится под кожу каждые 4 недели. Он также увеличивает костную массу, но обычно вызывает меньше побочных эффектов, чем бисфосфонаты. Деносумаб может снижать уровень кальция в крови.
Метастазы в кости рака предстательной железы могут контролироваться лучевой терапией. Лечение поможет облегчить боль и может позволить вам жить дольше.
Все виды гормональной терапии вызывают кастрацию, на которую все реагируют по разному. Наиболее частым побочным эффектом кастрации является приступообразное ощущение жара. Чтобы справиться с этим, необходимо контролировать свой вес и не употреблять алкогольных напитков.
Если вы испытываете приливы жара, вы можете:
- одеваться прохладнее
- носить одежду из хлопчатобумажной или льняной ткани, которая позволят телу дышать
- спите под тонким одеялом
- избегать горячих ванн, саун, бани
- не употребляйте горячую или острую пищу
- Пейте больше воды
Во время лечения у вас может возникнуть тошнота, вызванная терапией, ростом опухоли или эмоциональным состоянием.
Врач может назначить лекарство для уменьшения тошноты. Это может также помочь:
- Кушайте меньшими порциями но чаще
- Пейте меньше но чаще пьете, чтобы не было обезвоживания
- Кушайте холодные блюда, если горячие блюда вызывают тошноту
Другим распространенным побочным эффектом лечения является диарея. Диарея может привести к обезвоживанию, и важно:
- Пить больше, чем обычно.
- Избегать пищи, которая, по вашему мнению, ухудшает диарею.

- Соблюдать правила личной гигиены.
- Используйте увлажняющий крем, при наличии раздражения анальной области.
Также может быть повышение артериального давления, особенно на ранней стадии лечения. Это нормальное явление, которым можно управлять медикаментозной терапией. Химиотерапия может вызвать изменение вкусовых ощущений. Возможно, появится отвращение для привычных вам продуктов. Лучший способ выяснить, какая еда вам нравится, это попробовать разные вещи:
- Пейте воду перед едой, чтобы нейтрализовать рецепторы вкуса.
- Если красное мясо кажется странным, попробуйте белое мясо или рыбу или наоборот.
- Если горячая пища кажется странной, попробуйте употреблять ее холодной или наоборот.
- Попробуйте использовать больше или меньше специй
- Используйте пластмассовую вилку и нож, при появлении привкуса металла
Во время лучевой терапии вы можете заниматься своей повседневной деятельностью.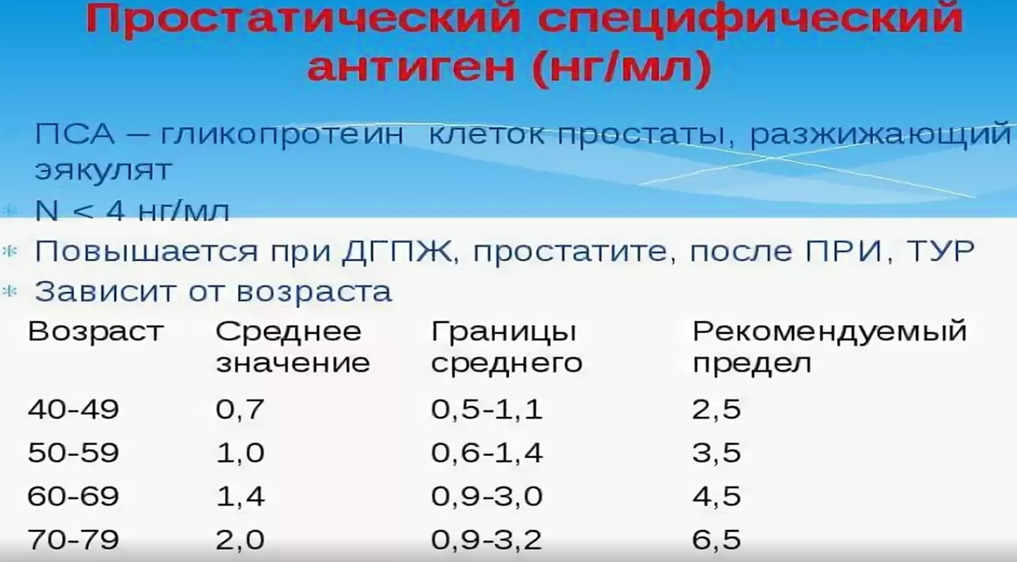 Лечение может повлиять на нижние мочевые пути, кишечник, и может вызывать усталость. Усталость может быть результатом ежедневных поездок в больницу. Обычно эти симптомы исчезают через несколько месяцев после лечения.
Лечение может повлиять на нижние мочевые пути, кишечник, и может вызывать усталость. Усталость может быть результатом ежедневных поездок в больницу. Обычно эти симптомы исчезают через несколько месяцев после лечения.
Из-за излучения может быть повреждена кожа. Чтобы ухаживать за кожей, вы можете:
- Избегать повреждения облучаемой области.
- Используйте лосьон для кожи для борьбы с раздражением.
- Избегайте воздействия прямых солнечных лучей.
- Используйте солнцезащитный крем с высоким фактором. Носите одежду из хлопчатобумажной или льняной ткани;
- Ежедневно соблюдайте правила личной гигиены;
- Осторожно вытерайте кожу после мытья;
- Не посещайте баню, сауну
После лечения вас может беспокоить дальнейший прогноз, влияние рака на вашу социальную, бытовую, финансовую ситуацию. Обычно беспокоит мысль о рецидиве рака. Если вас это беспокоит, обратитесь к своему врачу и узнайте о риске рецидива. Во время лечения вы будете не работоспособны, поэтому обсудите со своим начальствам все аспекты и время возвращения к рабочей деятельности. Обсудите со своей страховой компанией финансовую поддержку вашего лечения.
Во время лечения вы будете не работоспособны, поэтому обсудите со своим начальствам все аспекты и время возвращения к рабочей деятельности. Обсудите со своей страховой компанией финансовую поддержку вашего лечения.
Стадии рака предстательной железы после радикальной простатэктомии
Злокачественные новообразования предстательной железы – актуальная проблема современной онкологии. Регистрируемый во всем мире рост числа больных переводит данную проблему в число социально значимых, требующих, наряду с разработкой профилактических мероприятий, применения современных методов диагностики и лечения. Радикальная хирургия рака предстательной железы (РПЖ) остается сегодня наиболее эффективным методом лечения, позволяющим добиться высоких показателей качества и продолжительности жизни пациентов [1]. Кроме того, радикальная простатэктомия (РПЭ) – оперативное вмешательство, позволяющее точно установить стадию заболевания, что имеет прямое отношение к прогнозу и выбору метода дальнейшего лечения пациента [2].
Цель работы – изучить роль РПЭ в уточнении стадии заболевания, определить возможные факторы, повлиявшие на изменение предоперационной стадии распространенности опухоли, а так же адекватность объема предоперационного обследования применяемого в практике онкоурологического отделения ККОД № 1 г. Краснодара.
МАТЕРИАЛЫ И МЕТОДЫ
Для оценки онкоэпидемиологии рака простаты в Краснодарском крае использованы статистические медицинские данные по Краснодарскому краю, материалы Краевого популяционного канцер-регистра. Результаты радикального лечения и изменения стадии заболевания изучены у больных, оперированных в урологическом – онкологическом отделении ГУЗ КОД № 1 ДЗКК с 1999 по 2010 гг. Результаты дальнейшего наблюдения прослежены по данным амбулаторного наблюдения в условиях ДПО ККОД № 1 г. Краснодара.
РЕЗУЛЬТАТЫ
За 10 лет число больных раком предстательной железы, регистрируемых ежегодно в Краснодарском крае, увеличилось на 121,5% (более чем в 2 раза) и составило 1028 человек в 2009 г. Прирост заболеваемости с 1999 г. составил 126,7%, показатель заболеваемости при этом в 2009 г. составил 44,9%. Количество больных, состоящих на учете по данному заболеванию, с 1757 человек в 1999 г. увеличилось до 4818 в 2009 г. (прирост контингентов – 174,2%). В структуре заболеваемости доля рака предстательной железы увеличилась с 5,7% в 1999 г. до 10,9% – в 2009 г. РПЖ в регионе в 2009 г. занял третье место, уступая раку легкого (16,5%) и кожи (15,5%). Рак предстательной железы в стадиях 1 и 2 выявлен в 1999 г. у 42%, а в 2009 – у 37,3% пациентов (по России – 37,3%). Смертность при данном заболевании в 2009 г. составила 16,3%, что почти в 2 раза выше аналогичного показателя 1999 г. (9,8%). В структуре смертности РПЖ (2,4%) вырос с 2,4 до 4,4%.
Прирост заболеваемости с 1999 г. составил 126,7%, показатель заболеваемости при этом в 2009 г. составил 44,9%. Количество больных, состоящих на учете по данному заболеванию, с 1757 человек в 1999 г. увеличилось до 4818 в 2009 г. (прирост контингентов – 174,2%). В структуре заболеваемости доля рака предстательной железы увеличилась с 5,7% в 1999 г. до 10,9% – в 2009 г. РПЖ в регионе в 2009 г. занял третье место, уступая раку легкого (16,5%) и кожи (15,5%). Рак предстательной железы в стадиях 1 и 2 выявлен в 1999 г. у 42%, а в 2009 – у 37,3% пациентов (по России – 37,3%). Смертность при данном заболевании в 2009 г. составила 16,3%, что почти в 2 раза выше аналогичного показателя 1999 г. (9,8%). В структуре смертности РПЖ (2,4%) вырос с 2,4 до 4,4%.
Одногодичная летальность снизилась с 15,3 до 10,6 [3]. Динамика эпидемиологических показателей рака предстательной железы по Краснодарскому краю во многом соответствует Российским показателям (таблица 1) [4, 5].
Таблица 1. Эпидемиологические аспекты рака предстательной железы в Краснодарском крае
Эпидемиологические аспекты рака предстательной железы в Краснодарском крае
| Показатель | Количество заболевших | Заболеваемость (%) | Доля в структуре (%) | Смертность (%) | 1-2 стадии (%) | На учете более 5 лет (%) |
| Краснодарский край, 1999 г. | 464 | 19,8 | 5,7 | 9,8 | 42 | 35,1 |
| Краснодарский край, 2009 г. | 1028 | 44,9 | 10,9 | 16,3 | 37,3 | 33,4 |
| Россия 2009 г. | 23 845 | 33,8 | 8,9 | 15,2 | 36,4 | 30,0 |
Таблица 2. Этапы отбора больных для РПЭ
Этапы отбора больных для РПЭ
| 1 этап (общеклинический) | 2 этап (морфологическая оценка) | 3 этап (уточнение распространенности) |
| Анамнез, определение уровня ПСА, ректальное пальцевое исследование | Выполнение полифокальной биопсии при ТРУЗИ-контроле, морфологическая оценка биоптатов | Выполнение КТ исследований, МРТ исследований, радиоизотопных исследований |
Таблица 3. Прогнозируемые и полученные результаты распространенности опухолей
| Показатель | Общее количество больных с более распространенной стадией | Экстракапсулярная инвазия | Вовлечение семенных пузырьков | Вовлечение лимфоузлов |
| Полученный | 15,2% | 13,2% | 0,9% | 0,9% |
| Прогнозируемый по Partin Tables | 27% | 22% | 3% | 1% |
Количество больных, получивших различное лечение по поводу РПЖ в урологическом отделении Краевого онкологического диспансера, увеличилось с 26 пациентов в 1999 г. до 361 – в 2009 г. Радикальная простатэктомия, как метод лечения, внедрена в отделении онкоурологии с 2004 г. В 2004-2009 гг. выполнено 316 оперативных вмешательств в указанном объеме. Из них нами отобраны 302 наблюдения, по которым имеются достоверные данные для анализа.
до 361 – в 2009 г. Радикальная простатэктомия, как метод лечения, внедрена в отделении онкоурологии с 2004 г. В 2004-2009 гг. выполнено 316 оперативных вмешательств в указанном объеме. Из них нами отобраны 302 наблюдения, по которым имеются достоверные данные для анализа.
Критерии отбора пациентов для выполнения радикальной простат- эктомии не отличались от обще-принятых, рекомендованных Ев-ропейской ассоциацией урологов, Национальной всеобщей онкологи-ческой сетью США, Национальным институтом рака США и Российским обществом урологов [6-9]. По-казаниями к оперативному лечению явились локализованные формы рака предстательной железы без вовлечения капсулы и окружающих тканей, отсутствие поражения регионарного лимфоколлектора, отсутствие отдаленных метастатических очагов, морфологическая верификация диагноза на предоперационном этапе. Ожидаемая продолжительность жизни более 10 лет, информированное согласие на оперативное вмешательство, допу-стимые сопутствующие заболевания, осознание возможных осложнений – эти сведения учитывались при определении показаний к операции.
Все 302 пациента по данным предоперационного обследования имели локализованную форму заболевания (стадии не более T2N0M0) и ожидаемую продолжительность жизни более 10 лет. С целью реализации предъявляемых требований к отбору пациентов для радикальной простатэктомии был использован алгоритм обследования, который включал следующие этапы:
- анамнез, определение уровня ПСА, пальцевое ректальное иссле-дование на этапе общеклинического обследования;
- выполнение мультифокальной биопсии предстательной железы в сочетании с ТРУЗИ (не менее 12биоптатов) на этапе морфологи-ческой оценки характера опухоли;
- после получения морфологи-ческой оценки выполнялась ком-пьютерная томография органов таза для оценки регионарного лимфоколлектора и местной распространенности опухоли.
Сканирование костей скелета проводилось у пациентов, имеющих ПСА более 20 нг/мл (таблица 2).
Выбранные больные в дальнейшем получили оперативное лечение в объеме радикальной позадилонной простатэктомии. По итогам патоги-стологического исследования после-операционного материала, полученного у 302 пациентов, у 256 (I группа) стадия опухоли не изменилась, т.е. соответствовала дооперационному определению. У 46 пациентов (15,2%) (II группа) после выполнения ра-дикальной простатэктомии стадии опухоли были расценены как более распространенные.
По итогам патоги-стологического исследования после-операционного материала, полученного у 302 пациентов, у 256 (I группа) стадия опухоли не изменилась, т.е. соответствовала дооперационному определению. У 46 пациентов (15,2%) (II группа) после выполнения ра-дикальной простатэктомии стадии опухоли были расценены как более распространенные.
Литературные данные также свидетельствуют о частоте утяжеления стадии распространенности опухоли предстательной железы, определяемой после радикальной простатэктомии до 33% [10, 11]. В таблице 3 приведены данные об изменении стадии заболевания у наших больных после операции и по номограмме (Partin Tables) [12]. Согласно прогностической таблице Партина, 27% пациентов в нашем случае могли бы иметь более распространенную стадию опухоли, при этом стадия ТЗа прогнозировалась у 22% больных, ТЗЬ – у 3%, N1 – у 1% V5 15,2%, 13,2%, 0,9% и 0,9%, определенных у больных после операции.
Следовательно, примененный нами алгоритм отбора пациентов позволил получить более низкий, чем ожидался, процент ошибок ста- дирования опухолей предстательной железы на дооперационном этапе.
Был проведен анализ различий показателей, наиболее часто учиты-ваемых как факторов прогноза ошибок выставления стадии опухоли на предоперационном этапе и прогноза заболевания, такие как: уровень ПСА в крови и степень дифференцировки опухоли – показатель Глисона (ПГ).
Таблица 4. Показатель уровня ПСА (нг/мл) у пациентов
| Показатель | Минимум | Максимум | Средний | Доверительный интервал | Ошибка средней | t | Р |
| I группа | 0,1 | 63,4 | 11,7 | 6,5 | 0,44 | 3,274 | 0,002 |
| II группа | 4,5 | 65 | 16,6 | 9,6 | 1,43 |
Таблица 5. Дифференцировка новообразований (показатель Глисона)
Дифференцировка новообразований (показатель Глисона)
| Показатель | Минимум | Максимум | Средний | Доверительный интервал | Ошибка средней | t | Р |
| I группа | 2 | 9 | 3,8 | 1,6 | 0,26 | 81 | 0,001 |
| II группа | 3 | 9 | 6,4 | 1,3 | 0,19 |
Таблица 6. Риск изменения стадии РПЖ при ПСА от 15 нг/мл и выше
| Показатель | ПСА>15 | ПСА | всего |
| 1 группа | 72 | 184 | 256 |
| 2 группа | 21 | 25 | 46 |
| Всего | 93 | 209 | 302 |
| Показатель | Результат | Нижняя граница | Верхняя граница |
| Относительный шанс | 2,14 | 1,07 | 4,27 |
| Относительный риск | 1,6 | 1,05 | 2,32 |
| Специфичность | 0,88 | 0,85 | 0,91 |
| Прогноз положительного результата | 0,45 | 0,32 | 0,59 |
| Прогноз отрицательного результата | 0,72 | 0,69 | 0,74 |
| Х2 = 4,82 | Степень свободы = 1 | Р = 0,0283 | Риск недостоверен! |
Таблица 7. Риск изменения стадии РПЖ при ПГ от 5 и выше
Риск изменения стадии РПЖ при ПГ от 5 и выше
| Показатель | ПСА>15 | ПСА | всего |
| 1 группа | 134 | 122 | 256 |
| 2 группа | 41 | 5 | 46 |
| Всего | 175 | 127 | 302 |
| Показатель | Результат | Нижняя граница | Верхняя граница |
| Относительный шанс | 7,43 | 2,7 | 22,4 |
| Относительный риск | 1,78 | 1,4 | 1,87 |
| Специфичность | 0,96 | 0,92 | 0,98 |
| Прогноз положительного результата | 0,89 | 0,76 | 0,96 |
| Прогноз отрицательного результата | 0,47 | 0,45 | 0,48 |
| Х2 = 20,17 | Степень свободы = 1 | Р = 0,0005 | Риск недостоверен! |
Уровень ПСА в крови пациентов в общей группе колебался от 0,1 до 65 нг/мл. При этом в группе больных, стадия опухоли которых после опе-ративного лечения осталась прежней (I группа), показатель ПСА колебался от 0,1 до 63,4 (нг/мл), и в среднем составил 11,7 ± 6,5 нг/мл. У пациентов, стадия заболевания которых была изменена в большую сторону (II группа), уровень ПСА оказался в целом достоверно выше и составил в среднем 16,6 ± 9,6 нг/мл (таблица 4).
При этом в группе больных, стадия опухоли которых после опе-ративного лечения осталась прежней (I группа), показатель ПСА колебался от 0,1 до 63,4 (нг/мл), и в среднем составил 11,7 ± 6,5 нг/мл. У пациентов, стадия заболевания которых была изменена в большую сторону (II группа), уровень ПСА оказался в целом достоверно выше и составил в среднем 16,6 ± 9,6 нг/мл (таблица 4).
Показатель степени дифференцировки опухоли также имел различия в группах. У пациентов I группы ПГ колебался от 2 до 9 и в среднем составил 3,8 ± 1,6, что указывает на высокую степень дифференцировки опухоли. Пациенты группы II имели критерий Глисона от 3 до 9 (в среднем 6,4 ± 1,3), что указывает на умеренную дифференцировку новообразований. При этом различия средних показателей в группах имеют достоверную разницу (таблица 5).
Полученные данные позволяют сделать предположения о возможности выделения групп риска получения более распространенной опухоли по учитываемым признакам. С этой целью были определены показатели рисков в группах, выделенных для анализа с учетом выявленных особенностей распределения уровня ПСА и дифференцировки новообразований согласно критерию Глисона. В нашем исследовании критерием риска принята величина моды показателей для обеих групп, а именно уровень ПСА > 15 и по дифференцировки опухоли ПГ > 5 (т.е. обязательное присутствие ПГ = 3 как фактора ошибки в нашем исследовании в сумме). Расчет показателей произво-дился по стандартным методикам с учетом поправки Йэйтса.
В нашем исследовании критерием риска принята величина моды показателей для обеих групп, а именно уровень ПСА > 15 и по дифференцировки опухоли ПГ > 5 (т.е. обязательное присутствие ПГ = 3 как фактора ошибки в нашем исследовании в сумме). Расчет показателей произво-дился по стандартным методикам с учетом поправки Йэйтса.
| Показатель | Прогрессирование | Осложнения |
| I группа | 12 (4,7%) | 27 (10,5%) |
| II группа | 15 (32,6%) | 3 (6,5%) |
Таблица 9. Показатели ПСА и ПГ у больных с прогрессированием локального рака предстательной железы
| Больные | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | среднее |
| ПСА | 6,9 | 14,4 | 1,4 | 1,2 | 1,7 | 17,6 | 0,8 | 19,8 | 16,5 | 7,2 | 21,4 | 6,4 | 12,9 |
| ПГ | 6 | 7 | 2 | 5 | 7 | 4 | 8 | 6 | 9 | 6 | 7 | 5 | 6 |
Показатели риска получения более распространенной стадии опухоли по результатам оперативного лечения при уровне ПСА от 15 и выше приведены в таблице 6.
Согласно полученным данным, у пациентов, имеющих на этапе об-следования уровень ПСА > 15 в крови, повышен относительный риск получения после операции более распространенной стадии опухоли, также у больных РПЖ при уровне ПСА > 15 повышен и относительный шанс выявления более распространенной опухоли. Тем не менее, данный показатель не имеет достоверной значимости, что отражает наличие более значимых условий или требует коррекции уровня учи-тываемого показателя.
Показатели риска получения более распространенной стадии опухоли по результатам хирургического лечения пациентов с учетом критерия ПГ > 5 приведены в таблице 7.
По результатам вычислений установлено, что у пациентов, имеющих в сумме показатель Глисона 5и выше, имеется риск установить более распространенную опухоль, чем предполагается на стадии пре-доперационного обследования и подготовки пациента к операции. При этом риск достоверно повышен почти в 2 раза (1,78 раза).
Обобщая, отметим, что если сум-марный показатель Глисона > 3, то достоверно повышается риск получить в итоге более распространенную стадию опухоли. В свою очередь, показатель уровня ПСА > 15 не может быть достоверным критерием, хотя и оказывает влияние на повышение риска рестадирования опухоли в более распространенную. В литературных источниках указывается на большую значимость низкой дифференциров- ки опухоли как фактора неблагоприятного прогноза [13].
В свою очередь, показатель уровня ПСА > 15 не может быть достоверным критерием, хотя и оказывает влияние на повышение риска рестадирования опухоли в более распространенную. В литературных источниках указывается на большую значимость низкой дифференциров- ки опухоли как фактора неблагоприятного прогноза [13].
Учитывая разнородность групп и недостаточную репрезентативность для анализа достоверности различий, мы приводим результаты диспансерного наблюдения без их детального анализа (таблица 8). При этом у 33% пациентов II группы отмечено прогрессирование заболевания. Этим пациентам потребовалось системное лечение. У пациентов I группы лишь в 4,7% случаев отмечено прогрессирование. Процент осложнений оказался практически одинаков в обеих группах.
Особый интерес вызывает группа пациентов, имевших локальные формы рака предстательной железы, у которых в дальнейшем констатировано прогрессирование опухоли. В таблице 9 приведены показатели уровня ПСА этих пациентов и морфологические варианты опухолей.
Можно отметить, что в среднем у пациентов данной группы уровень ПСА не имел критического для риска прогрессирования значения. Показатель морфологической оценки опухоли характеризовался как умеренно-дифференцированная опухоль и соответствовал выявленным нами особенностям для пациентов II группы.
ВЫВОДЫ
За период с 1999 по 2009 гг. в Крас-нодарском крае отмечен рост заболе-ваемости раком предстательной железы и поздняя его диагностика.
При тщательном отборе пациентов для радикальной простатэк- томии имеется риск получения более распространенной опухоли по результатам гистопатологического анализа операционного материала.
Применяемый алгоритм обсле-дования позволяет получить меньший процент ошибок стадирования опухоли на предоперационном этапе по сравнению с послеоперационным диагнозом.
Риск рестадирования опухоли в более распространенную достоверно выше при показателе Глисона > 5. Так же отмечается отрицательное влияние уровня ПСА более 15 нг/мл на течение РПЖ.
Изменение стадии в более рас-пространенную сопровождается худшим прогнозом, и чаще требует в последующем проведения системного лечения.
Ключевые слова: рак предстательной железы, эпидемиология, стадирование, алгоритм обследования, ПСА, показатель Глисона.
Keywords: prostate cancer, epidemiology, staging, diagnostic algorithm, PSA, Gleason score.
ЛИТЕРАТУРА
- Радикальная простатэктомия / Под ред. Кирби Р., Монторси Ф., Гонтеро П., Смитт Дж.А., Пушкарь Д.Ю. М. ГЭОТАР-Медиа. 2011. С. 5.
- Радикальная хирургия рака предстательной железы / Коган М.И., Лоран С.Б., Петров С.Б. М. ГЭОТАР-Медиа. 2006. С. 251-261.
- Казацева М.В., Тесленко Л.Г., Цокур И.В., Бондарева И.С. Распространенность злокачественных новообразований в Краснодарском крае 2006-2010 годы // Информационно-аналитические материалы. Краснодар. 2011. Издание № 11. С. 147-161.
- Чисов В.И., Старинский В.В., Петрова Г.
 В. Злокачественные новообразования в России в 2009 году. М. 2011. С. 50-74.
В. Злокачественные новообразования в России в 2009 году. М. 2011. С. 50-74. - Состояние онкологической помощи населению России в 2009 году. М. 2010. С. 112-116.
- Лопаткин Н.А. Клинические рекомендации. Урология. М. ГОЭТАР-Медиа. 2007. С. 243-269.
- Клинические рекомендации европейской ассоциации урологов. ООО «АБВ-пресс». 2010. С. 47-57.
- AUA Prostate cancer clinical guidelines panel. Report on the management of clinically localized prostate cancer. 1995.
- NCCN. Clinical practice guidelines in oncology: prostate cancer version 2. 2005.
- Медведев В.Л., Дмитриенко Г.Д., Медведев А.В., Косенко В.А. Анализ зависимости стадии рака предстательной железы и суммы баллов Глисона по результатам радикальной простатэктомии // Материалы 5 конгресса российского общества онкоурологов. Москва. 2010. С. 82-83.
- Велиев Е.И., Охриц В.Е., Обейд А.Х. Прогностические факторы рака предстательной железы до и после радикальной простатэктомии // Онкоурология.
 2011.№ 2. С. 52-55.
2011.№ 2. С. 52-55. - Partin A.W., Mangold L.A., Lamm D.M., Walsh P.C., Epstein J.I., Pearson J.D. Contemporary update of prostate cancer staging nomograms (Partin Tables) for the new millennium // Urology. 2001. Vol. 58. № 6. P. 843-848.
- Freedland S.J., Csathy G.S., Dorey F., Aronson W.J. Persent prostate needle biopsy tissue with cancer is more predictive of biochemical failure or adverse pathology after radical prostatectomy then prostate specific antigen or Gleason score // J Urol. 2002. Vol. 167. № 2, Pt.1. P. 516-520.
| Прикрепленный файл | Размер |
|---|---|
| Скачать статью | 160.32 кб |
Ключевые слова:
Другие статьи выпуска
Отправить статью
5-летний импакт-фактор РИНЦот 15.
 01.2020 – 0,723
01.2020 – 0,72310-летний индекс Хирша 20
Включен в Russian Science Citation Index (RSCI)
ISSN print 2222-8543
ISSN online 2712-8571
Журнал входит в Перечень российских рецензируемых научных журналов, в которых должны быть опубликованы основные научные результаты диссертаций на соискание учёных степеней доктора и кандидата наук
Международный классификатор
Сайт журнала “Экспериментальная и клиническая урология” содержит материалы
медицинского характера, предназначенные исключительно для работников
здравоохранения.
Подтвердите, пожалуйста, что Вы являетесь медицинским работником с соответствующим дипломом или студентом медицинского образовательного учреждения.
ПодтверждаюБиохимический рецидив после радикальной простатэктомии: немедленная или отсроченная гормональная терапия
| Всеволод Борисович Матвеев Д.м.н., проф., заведующий отделением урологии РОНЦ им. Н.Н. Блохина РАМН [email protected] | |
| Виталий Александрович Черняев Врач-онколог отделения урологии ГУ РОНЦ им. Н.Н. Блохина РАМН [email protected] |
Как известно, заболеваемость злокачественными новообразованиями предстательной железы увеличивается как во всем мире, так и в России.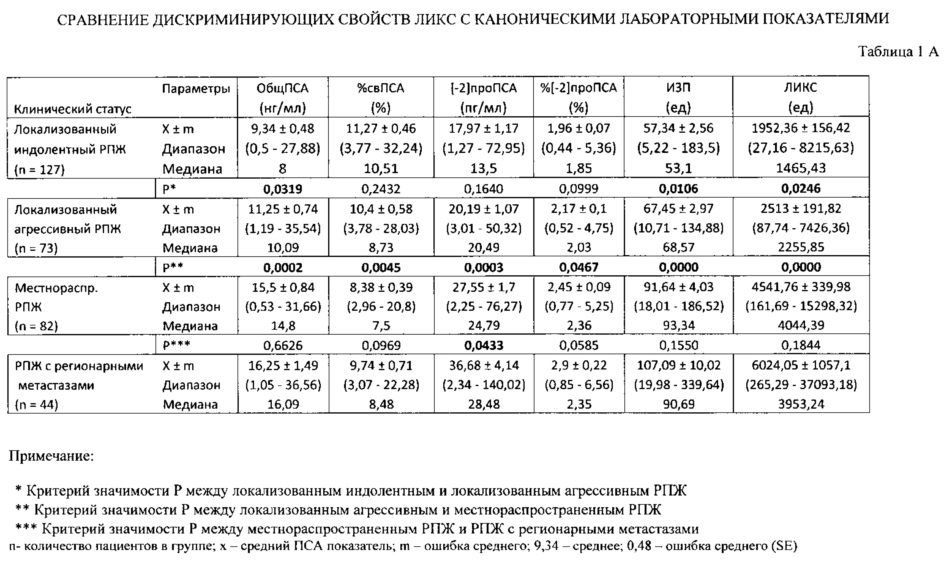 При этом благодаря широкому внедрению в клиническую практику определения сывороточного содержания простатического специфического антигена (ПСА) все в большем проценте случаев удается диагностировать заболевание на ранних стадиях, что делает возможным выполнение радикального хирургического лечения.
При этом благодаря широкому внедрению в клиническую практику определения сывороточного содержания простатического специфического антигена (ПСА) все в большем проценте случаев удается диагностировать заболевание на ранних стадиях, что делает возможным выполнение радикального хирургического лечения.
Однако особенности течения заболевания таковы, что у некоторых пациентов развивается рецидив заболевания отмечается постепенное увеличение показателей ПСА биохимический рецидив (БР). При этом по времени развития БР и скорости прироста ПСА можно предположить характер рецидива. Если БР наступает более чем через 2 года после радикального хирургического лечения и характеризуется временем удвоения ПСА (PSADT) > 12 месяцев, можно думать о местном рецидиве заболевания. В таком случае основным методом лечения является проведение дистанционной лучевой терапии. При быстром развитии БР (менее 2 лет после радикального лечения) и быстром PSADT (менее 12 месяцев), вероятно, речь идет о системном рецидиве. В таком случае показано проведение гормональной терапии. При этом до сих пор продолжается дискуссия о сроках назначения гормональной терапии (немедленная или при появлении клинических симптомов). На сегодняшний день, согласно рекомендациям Европейской ассоциации урологов, под БР после радикального хирургического лечения понимают увеличение ПСА более 0,2 нг/мл.
В таком случае показано проведение гормональной терапии. При этом до сих пор продолжается дискуссия о сроках назначения гормональной терапии (немедленная или при появлении клинических симптомов). На сегодняшний день, согласно рекомендациям Европейской ассоциации урологов, под БР после радикального хирургического лечения понимают увеличение ПСА более 0,2 нг/мл.
Частота развития БР составляет от 19 до 75%. Приведенные данные основываются на результатах ретроспективного исследования Karakiewicz et al. (Urology, 2005), объединившего опыт 8 клиник (5831 пациент). В исследовании было показано, что риск развития БР зависит от нескольких факторов: местной распространенности опухолевого процесса, степени дифференцировки (показатель Глисона), наличия метастатического поражения лимфатических узлов, присутствия положительного хирургического края.
Следует отчетливо понимать, что увеличение ПСА после радикального хирургического лечения не означает скорую неотвратимую смерть, а только лишь неудачу хирургического лечения. В 1999 г. Pound опубликовал данные исследования, в котором анализировалась судьба пациентов, которым не проводилось лечения при развитии БР. Из 1997 пациентов, подвергнутых радикальной простатэктомии (РПЭ), у 315 (15%) развился БР. Без дальнейшего лечения наблюдались 304 пациента, и лишь у 103 (34%) из них в среднем через 8 лет развились отдаленные метастазы. От прогрессирования рака предстательной железы (РПЖ) умерли только 44 мужчины. Несколько позже, в 2004 г., D’Amico исследовал результаты лечения 8669 пациентов после РПЭ и дистанционной лучевой терапии, из них у 16,7% развился БР и только 7,6% погибли от РПЖ. Но не все случаи БР одинаковы. Да, действительно, есть группа пациентов, для которых риск умереть от РПЖ в случае развития БР не превышает 10%, но есть и те, для которых риск смерти составляет более 90%. В 2005 г. Freedland определил факторы риска смерти от РПЖ в течение 10 лет после РПЭ (см. таблицу).
В 1999 г. Pound опубликовал данные исследования, в котором анализировалась судьба пациентов, которым не проводилось лечения при развитии БР. Из 1997 пациентов, подвергнутых радикальной простатэктомии (РПЭ), у 315 (15%) развился БР. Без дальнейшего лечения наблюдались 304 пациента, и лишь у 103 (34%) из них в среднем через 8 лет развились отдаленные метастазы. От прогрессирования рака предстательной железы (РПЖ) умерли только 44 мужчины. Несколько позже, в 2004 г., D’Amico исследовал результаты лечения 8669 пациентов после РПЭ и дистанционной лучевой терапии, из них у 16,7% развился БР и только 7,6% погибли от РПЖ. Но не все случаи БР одинаковы. Да, действительно, есть группа пациентов, для которых риск умереть от РПЖ в случае развития БР не превышает 10%, но есть и те, для которых риск смерти составляет более 90%. В 2005 г. Freedland определил факторы риска смерти от РПЖ в течение 10 лет после РПЭ (см. таблицу).
На сегодняшний день не было проведено крупных рандомизированных исследований, напрямую сравнивающих результаты лечения при применении немедленной и отсроченной гормональной терапии при развитии БР после радикального хирургического лечения. Поэтому для выяснения преимуществ того или иного подхода приходится экстраполировать данные, полученные при сравнении немедленной или отсроченной гормональной андрогендепривационной терапии (АДТ) при лечении пациентов, которым не было проведено радикального хирургического лечения.
Поэтому для выяснения преимуществ того или иного подхода приходится экстраполировать данные, полученные при сравнении немедленной или отсроченной гормональной андрогендепривационной терапии (АДТ) при лечении пациентов, которым не было проведено радикального хирургического лечения.
/049/049_2.jpg) Однако при более детальном рассмотрении оказалось, что в результате немедленной гормональной терапии достоверное преимущество в общей выживаемости имели пациенты, ПСА которых был более 20 нг/мл в возрастной группе 70 лет.
Однако при более детальном рассмотрении оказалось, что в результате немедленной гормональной терапии достоверное преимущество в общей выживаемости имели пациенты, ПСА которых был более 20 нг/мл в возрастной группе 70 лет.Влияет ли немедленная АДТ на развитие отдаленных метастазов? Данной проблеме было посвящено исследование Moul et al. (2004). Были изучены результаты лечения около 5000 пациентов, которым была выполнена РПЭ по поводу РПЖ. У 27,2% пациентов развился БР. Пациенты были разделены на 2 группы: немедленной и отсроченной АДТ. В общей когорте пациентов не было показано преимущества немедленной АДТ. Однако, в группе пациентов, у которых балл Глисона > 7 и PSADT < 12 месяцев, немедленная АДТ достоверно увеличивала время до развития отдаленных метастазов (HR 2,12; p=0,01).
Преимущество раннего назначения гормональной терапии подтверждено недавним исследованием японских ученых Hiroki et al. (Jpn J Clin Oncol 2010), в ходе которого было показано, что в случае развития БР после РПЭ достоверно лучшую беспрогрессивную выживаемость (p=0,012) имели те пациенты, у которых гормональная терапия началась при уровне ПСА < 2нг/мл.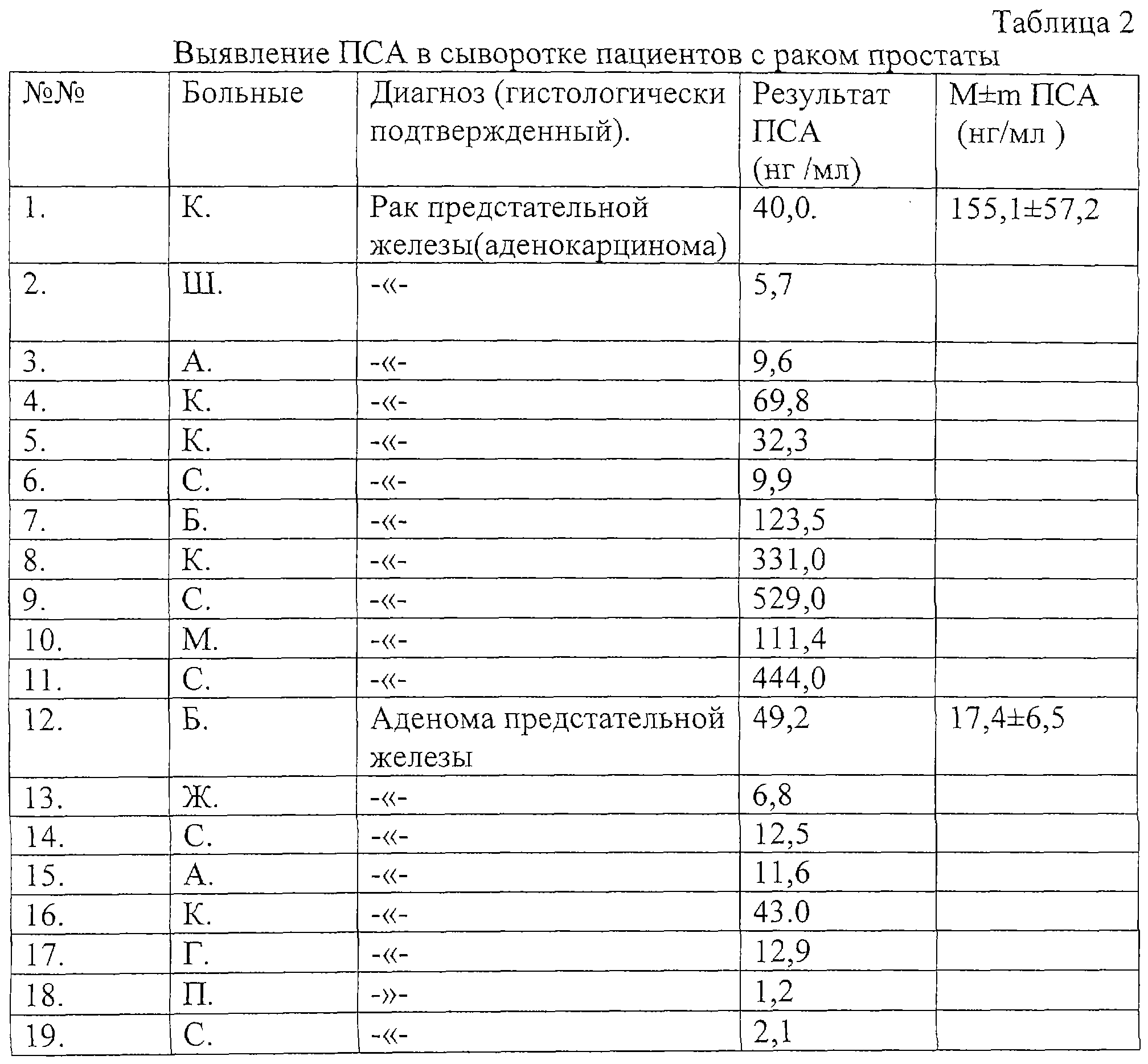
Особую группу представляют пациенты, у которых выявлены метастазы в лимфатические узлы после радикального хирургического лечения. Показано ли им немедленное назначение АДТ? Согласно данным исследования, проведенного Messing et al. (Lancet Oncol 2006), включившего больных после РПЭ N+, пациенты, начавшие немедленное гормональное лечение, имели достоверное преимущество как в общей выживаемости (p=0,02), так и в опухолевоспецифичной (p=0,001) и беспрогрессивной (p < 0,001) выживаемости.
Интересное исследование предприняли Wirth et al., предложившие пациентам с местно-распространенным РПЖ после РПЭ (рТ3-4ШМ0) в качестве немедленной гормональной терапии антиандрогены (Бикалута мид 150 мг). При медиане наблюдения 6,1 года не было показано преимущества в общей выживаемости, однако риск прогрессирования в группе немедленной гормональной терапии был достоверно ниже (p=0,0041).
Результаты 2 последних исследований были подтверждены мета-анализом Kumar et al. (Cochrane Database), в результате которого доказано преимущество немедленной адъювантной гормональной терапии после радикального хирургического лечения в отношении увеличения 5-летней (p < 0,00001) и 10-летней (p=0,0009) беспрогрессивной выживаемости.
Группа пациентов, у которых развился БР, неоднородна. Если при повышении ПСА после радикального хирургического лечения в ходе обследования диагностируется местный рецидив заболевания, то для этой группы пациентов методом лечения является проведение дистанционной лучевой терапии, согласно рекомендациям как Европейской, так и Американской ассоциаций урологов. Если же перед вами пациент, у которого высокий уровень ПСА (> 20 нг/мл), местно-распространенный РПЖ рТ3-4, подтверждено наличие метастатического поражения лимфатических узлов, быстро увеличивается показатель ПСА после радикального хирургического лечения (PSADT < 9-12 месяцев), отсутствуют данные за наличие местного рецидива заболевания, то этот мужчина имеет значительный риск системного прогрессирования заболевания. Именно для этой группы больных методом выбора может стать АДТ.
Таблица. Риск смерти от РПЖ в течение 10 лет после РПЭ (Freedland et al., JAMA 2005)
Время удвоения ПСА | Биохимический рецидив > 3 лет после простатэктомии | Биохимический рецидив < 3 лет после простатэктомии | ||
Глисон < 8 | Глисон > 8 | Глисон < 8 | Глисон > 8 | |
> 15 мес | 2% | 4% | 7% | 14% |
9,0 – 14,9 мес | 5% | 10% | 15% | 31% |
3,0 – 8,9 мес | 16% | 32% | 45% | 74% |
< 3 мес | 41% | 70% | 85% | 99% |
Ваша оценка: Нет Средняя оценка: 5 (1 vote)
Уровень ПСА после операции простатэктомии: что означают результаты?
Простатэктомия – специфическая урологическая операция, при которой хирург удаляет предстательную железу, чаще всего по причине патологического увеличения ее тела или ракового перерождения.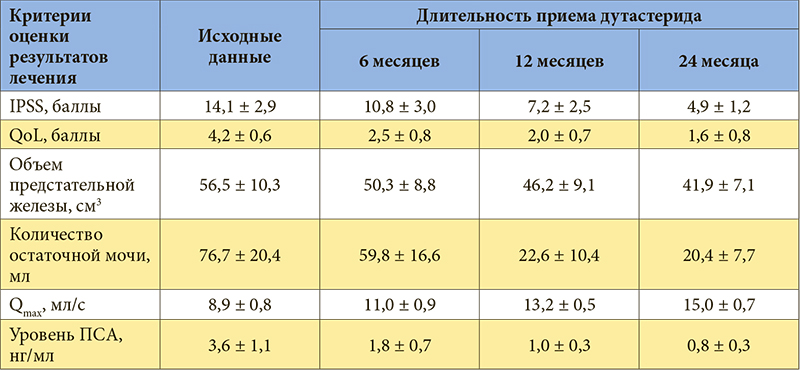 После операции врачи используют лабораторный тест на специфический антиген простаты (ПСА), чтобы проверять наличие рецидива рака.
После операции врачи используют лабораторный тест на специфический антиген простаты (ПСА), чтобы проверять наличие рецидива рака.
Предстательная железа вырабатывает небольшое количество белка, который называется простат-специфическим антигеном (ПСА, PSA). И, соответственно, раковые клетки, источником которых являются нормальные клетки из этой мужской железы, также продуцируют этот антиген. Врачи, в свою очередь, используют анализ по определению уровня ПСА в крови. Высокие уровни этого антигена указывают на проблемы со здоровьем предстательной железы, в том числе и развитие рака простаты.
Одним из действенных методов лечения рака предстательной железы является простатэктомия. Во время этой операции хирург полностью удаляет простату и также ткани, которые окружают ее.
После простатэктомии мужчины в большинстве продолжают проходить тесты на ПСА. Это помогает врачам проверить и убедиться, что рак и другая онкологическая патология простаты окончательно побеждена.
В этой статье мы обсудим почему анализ на простат-специфический антиген настолько важен после простатэктомии и что показывают его результаты. Также в тексте будет поднят вопрос лечения и профилактики повышения уровня ПСА.
Почему лабораторный анализ на ПСА так важен после простатэктомии?
Ответ прост – чтобы вовремя отследить возможный рецидив рака простаты. «Сухие» факты: согласно данным исследования 2013 года, в 20-40 процентов мужчин (а это четверть/почти половина (!)), Которые были прооперированы в течение 10 лет после даты исследования, происходит возврат этой страшной болезни.
Хотя хирурги и удаляют предстательную железу во время простатэктомии, некоторые раковые клетки могут проникнуть в окружающие ткани. Это процесс похож на локальное метастазирование. И, в случае если эти клетки продолжат размножаться, возникает рецидив рака вырастает новая опухоль.
Врач-уролог может порекомендовать пройти тест на ПСА, чтобы удостоверится в наличии или отсутствии онкопатологии в виде рака простаты после операции (Фото – www. freepik.com)
freepik.com)Что означают результаты исследования?
Общепринятой единицей измерения ПСА является нанограмм на миллилитр (нг/мл) крови. Уровни ПСА меняются со временем и проявляется устойчивая тенденция повышения их с возрастом. Они также могут отличаться между различными индивидуумами.
В соответствии с рекомендациями Фонда по лечению рака простаты, вот уровни вариантов нормы в кореляции с возрастом:
| Возраст | Нормальный диапазон ПСА |
| 40–49 лет | 0–2,5 нг/мл |
| 50–59 лет | 0–4 нг/мл |
| 60–69 лет | 0–4,5 нг/мл |
| 70–79 лет | 0–6,5 нг/мл |
Есть одна важная деталь. Урологи рекомендуют проведение первого анализа после радикальной простатэктомии через 6-8 недель после операции. Это связано с тем, что уровень ПСА снижается постепенно и проведенные до указанного периода тесты все еще могут показывать высокие показатели наличия антигена.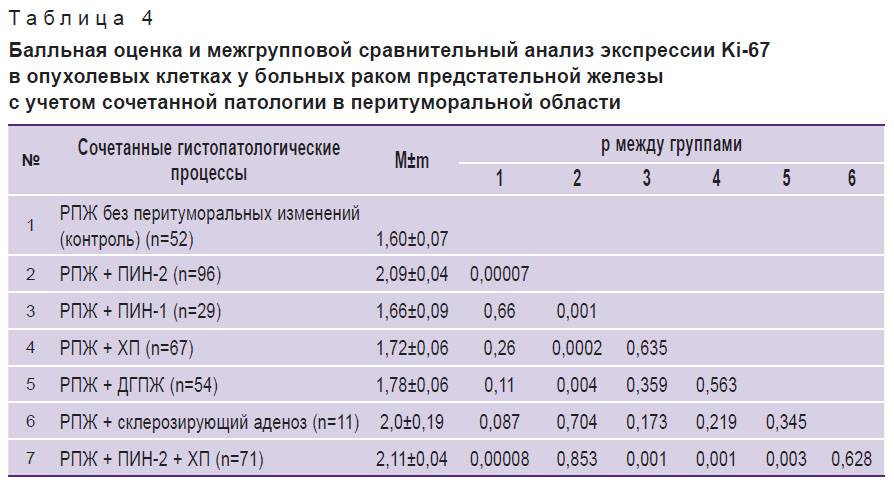
После проведенного лечения как пациенты так и врачи ждут низкого уровня ПСА в крови. Во многих случаях он вообще не идентифицируется. Это является важным критерием успешного лечения.
Однако, если проведен лабораторный анализ все еще фиксирует наличие ПСА после простатэктомии, это вовсе не означает, что рак вернулся. Клетки, которые совершенно невозможно отнести в категорию «опухолевых», могут также производить ПСА. Только врач может правильно интерпретировать результаты анализа и дать заключение, нуждается ли пациент в дальнейшем обследовании или лечении.
Насколько серьёзный высокий или растущий уровень ПСА?
Наблюдение за повышением уровня ПСА не всегда означает рецидив рака простаты или метастазирования. Этот анализ очень чувствителен и может проявлять совсем незначительные изменения уровня простат-специфического антигена.
Для врачей более важно в анализе то, как быстро повышается уровень ПСА в крови. Чтобы это обнаружить, мужчине придется сдавать кровь на ПСА регулярно. Если уровни стабильные или растут очень медленно, лечение может и не понадобиться.
Чтобы это обнаружить, мужчине придется сдавать кровь на ПСА регулярно. Если уровни стабильные или растут очень медленно, лечение может и не понадобиться.
Есть исключения. В некоторых случаях высокие уровни простат-специфического антигена не связаны с клетками рака. Факторы, которые могут повлиять на уровень, следующие:
При рассмотрении результатов анализов уролог обязательно учитывает эти факторы и это позволяет понять насколько высоки эти уровни ПСА для того, чтобы начать беспокоиться.
Нужны ли другие анализы?
Врачи обычно не назначают лечения на основании однократного теста ПСА. Если возникнут какие-то подозрения, они будут следить за уровнем в течение определенного времени, чтобы понять растет ли он.
Анализ на ПСА – это только один из методов диагностики здоровья пациента после простатэктомии. К примеру врач может использовать визуализационный тест для поиска опухоли или определения наличия раковых клеток.
Также урологи проводят опрос пациента по поводу любых других симптомов, которые могут указать на рецидив рака простаты.
Лечение повышенного уровня ПСА
В случае медленного или незначительного роста уровня ПСА у пациента лечение в большинстве случаев не требуется. Врач, принимая решение по поводу лечения, учитывает общее состояние здоровья, детальное изучение истории болезни, возраст и прочее.
Однако в случае более быстрого роста показателей, врачи выбирают тактику активного наблюдения. Это серия сдачи анализов и проверок состояния здоровья на регулярной основе в течение определенного времени. Лечение назначается только в случае необходимости. Рак простаты часто прогрессирует очень медленно, поэтому могут пройти годы до дня необходимости назначения лечения пациенту.
В случае, если человек ранее проходил простатэктомию, врач может назначить лучевую терапию. Это вид лечения, при которой раковые клетки уничтожаются с помощью высокоэнергетических частиц.
Но надо учитывать, что лучевая терапия подходит не для всех пациентов. Если человек уже принимал курс лучевой терапии до операции, он в подавляющем большинстве случаев не сможет пройти это лечение снова.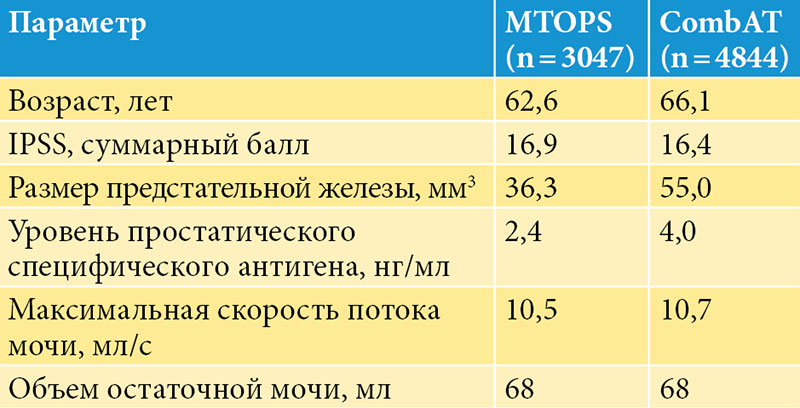 Повторный курс лучевой терапии может вызвать нежелательные побочные эффекты.
Повторный курс лучевой терапии может вызвать нежелательные побочные эффекты.
Также, чтобы уменьшить или инактивировать опухоль, врачи могут назначить гормональную терапию. Ее назначают в качестве монотерапии или в комплексе с лучевой и/или хирургическим вмешательством для большей эффективности.
Профилактика повышения уровня ПСА
Отказ от курения и ограничение употребления алкоголя поможет предотвратить повышение уровня ПСА (Фото Pexels)К сожалению, не всегда уровень ПСА в крови остается таким как хочется врачу или пациенту. Лучший способ предупредить возвращение болезни и сохранить здоровье – это регулярное посещение врача для медицинского осмотра.
Чтобы не провоцировать повышение уровня антигена, Американская ассоциация рака приводит рекомендации для таких пациентов:
Отказаться от привычки курения любых табачных изделий
Регулярно заниматься спортом
Следить и поддерживать вес тела в возрастной норме
Здоровое питание с большим количеством овощей и фруктов
Ограничение употребления алкоголя до умеренного количества
Прогноз
Ученые работают над повышением точности анализа крови на ПСА. Они стремятся усовершенствовать его настолько, чтобы он точно указывал на излечение, ремиссию или прогрессирования рака.
Они стремятся усовершенствовать его настолько, чтобы он точно указывал на излечение, ремиссию или прогрессирования рака.
Но пока можно лишь констатировать, что повышение уровня ПСА после простатэктомии не означает, что рак вернулся. Часто раковой опухоли необходимы годы роста, чтобы достичь уровня, который необходимо будет лечить. А некоторые люди с диагнозом вообще не будут нуждаться лечения.
Однако в случае рецидива рака простаты, дальнейшее эффективное лечение возможно. Лучевая терапия, лечение гормонами вместе с активным наблюдением – это все варианты для пациента с «повторным» возвращением рака после простатэктомии.
Итог
Простатэктомия – это один из эффективных методов лечения рака предстательной железы, основанный на хирургическом вмешательстве с удалением простаты.
Дальнейшие медосмотры и анализы на ПСА необходимые для проверки и наблюдения случаев рецидива болезни после простатэктомии. После этой операции человек, как правило, будет сдавать кровь на простат-специфический антиген каждые 6 месяцев.
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ПРЕДЕЛЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ: ЕСТЬ ЛИ ОНИ?
С. Петров, Е. Велиев
ВМА, Санкт-Петербург
Рак предстательной железы (РП) является одним из распространенных онкологических заболеваний у мужчин. По предварительным оценкам в США частота заболеваемости РП колеблется от 182 до 249 случаев на 100000 населения.
Риск развития клинически проявляющегося РП в течение жизни у американских мужчин составляет приблизительно 10%, у 3% он является причиной смерти. Эти факты заставляют урологов и онкологов стремиться к выработке рационального подхода в ранней диагностике и эффективной лечебной тактике всех стадий заболевания. Несмотря на имеющиеся успехи в лечении данного заболевания, многие вопросы остаются нерешенными, а предлагаемые пути решения остаются спорными.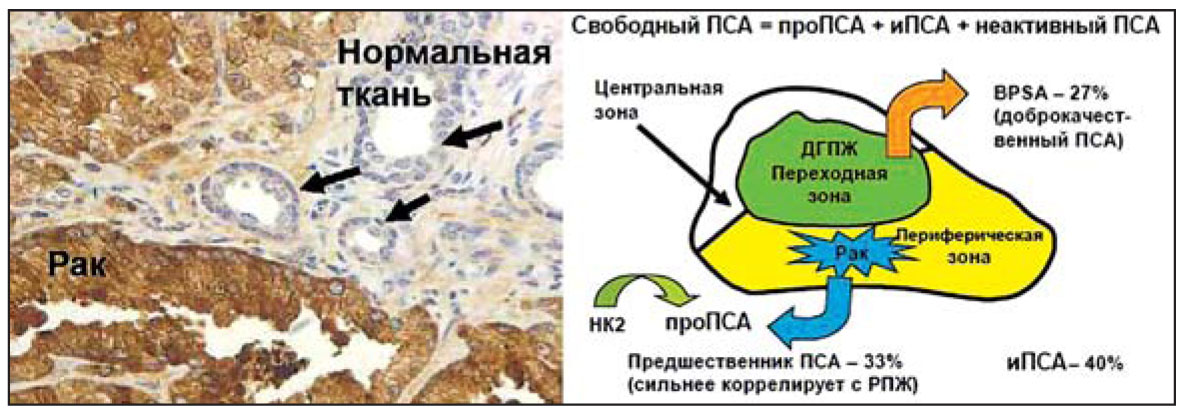 Кого лечить? Как лечить? Когда лечить? Различные показания – социальные, биохимические, патоморфологические, терапевтические и многие другие учитываются перед выбором той или иной лечебной тактики.
Кого лечить? Как лечить? Когда лечить? Различные показания – социальные, биохимические, патоморфологические, терапевтические и многие другие учитываются перед выбором той или иной лечебной тактики.
Радикальная простатэктомия (РПЭ) является одним из старейших и наиболее эффективных методов лечения локализованных форм РП. Немецкий хирург Billroth первый выполнил перинеальную простатэктомию в 1860 году. В начале этого века Young H.H. усовершенствовал технику операции при лечении больных РП.
Позадилонный подход для удаления предстательной железы был предложен Т. Мillin в 1947 году, однако операция сопровождалась большим количеством осложнений, таких как массивная кровопотеря, недержание мочи, импотенция. До внедрения анатомического подхода в технику операции почти 100 % больных после операции оставались импотентами.
В последние два десятилетия интерес специалистов к оперативному лечению рака предстательной железы значительно вырос.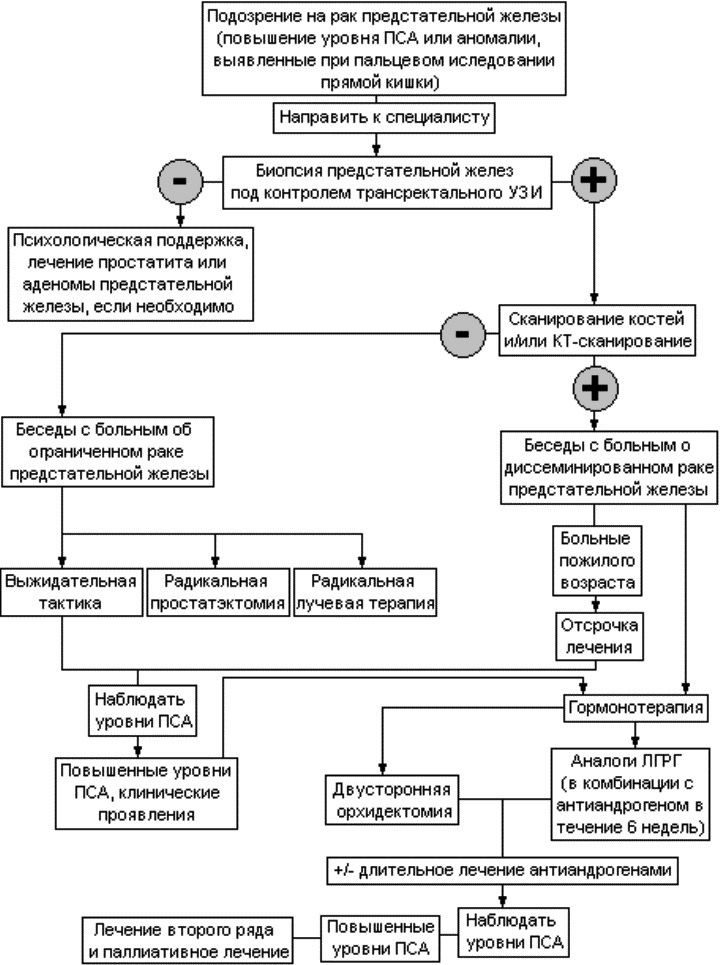
Целесообразность применения агрессивной тактики в лечении больных РП основывается на следующих положениях.
- Клинически выявленный рак предстательной железы прогрессирует медленно, но неизбежно.
- Оперативное лечение может быть эффективным, а подчас и радикальным, если РП выявляется на ранних стадиях.
- Пациент, страдающий РП, который распространяется в перипростатические ткани, семенные пузырьки, или лимфоузлы не может быть радикально излечен, однако оперативное лечение способствует увеличению продолжительности жизни.
- Данный вид терапии в настоящее время является относительно безопасным.
- Только хирургическая тактика позволяет точно установить патоморфологический диагноз и более точно прогнозировать исход заболевания.
Выжидательная тактика в лечении определенных категорий больных РП применяется давно. Основными аргументами, которые приводятся специалистами в защиту этой лечебной тактики, являются: а) отсутствие каких-либо осложнений, снижающих качество жизни; б) низкая стоимость лечения; в) отсутствие потерь рабочего времени; г) достаточно высокие показатели выживаемости больных с клинически незначимыми, а также локализованными формами РП. Последний довод в пользу выжидательной тактики спорен, так как эти данные, представленные шведскими специалистами, не подтверждаются сообщениями из Англии и Дании. Так, по данным M. Borre с соавт. (1997), 5- летняя выживаемость у больных РП в стадии Т
1-2N
ХМ
0 составила 71%, а 10-летняя – 42%. Согласно данным W.V. Catalona с соавт. (1994), длительное наблюдение за больными с локализованными формами рака предстательной железы показало, что более 50% больных умирает от этого заболевания. Эти и другие наблюдения свидетельствуют о том, что рак предстательной железы даже в ранних стадиях не является “беззубым львом”, т.е. он растет и становится инкурабельным, особенно у мужчин с ожидаемой продолжительностью жизни более 10 лет. Кроме того, постоянный стресс для мужчины жить с прогрессирующим РП снижает качество его жизни.
Последний довод в пользу выжидательной тактики спорен, так как эти данные, представленные шведскими специалистами, не подтверждаются сообщениями из Англии и Дании. Так, по данным M. Borre с соавт. (1997), 5- летняя выживаемость у больных РП в стадии Т
1-2N
ХМ
0 составила 71%, а 10-летняя – 42%. Согласно данным W.V. Catalona с соавт. (1994), длительное наблюдение за больными с локализованными формами рака предстательной железы показало, что более 50% больных умирает от этого заболевания. Эти и другие наблюдения свидетельствуют о том, что рак предстательной железы даже в ранних стадиях не является “беззубым львом”, т.е. он растет и становится инкурабельным, особенно у мужчин с ожидаемой продолжительностью жизни более 10 лет. Кроме того, постоянный стресс для мужчины жить с прогрессирующим РП снижает качество его жизни.
Интерес к хирургическому лечению рака предстательной железы в последние десятилетия значительно вырос. Это обусловлено лучшим знанием анатомии таза и совершенствованием техники оперативного вмешательства.
Это обусловлено лучшим знанием анатомии таза и совершенствованием техники оперативного вмешательства.
В 1979 году W. Reiner и P. Walsh описали технику позадилонной радикальной простатэктомии с учетом анатомии дорсального венозного комплекса и венозного сплетения Санторини. В 1982 году P. Walsh и P. Donher высказали положение о том, что импотенция, которая возникала после операции, была обусловлена повреждением боковых сосудисто-нервных пучков, обеспечивающих иннервацию кавернозных тел. На основании этих наблюдений они модифицировали технику позадилонной РПЭ, что позволило значительно облегчить ее выполнение, уменьшить объем кровопотери, увеличить число континентных больных, а также сохранить потенцию у большинства пациентов. Кроме этого, преимуществом анатомического подхода при выполнении РПЭ стала возможность тщательного гемостаза, что обеспечивало хорошую визуализацию места операции.
Применение анатомического подхода к выполнению позадилонной РПЭ в условиях хорошей видимости позволяет хирургу принимать решения об объеме удаляемых тканей в зависимости от интраоперационных находок, т. е. сохранить или же широко иссечь сосудисто-нервный пучок. Сохранение одного пучка позволяет сохранить потенцию в послеоперационном периоде у большинства больных (P.Walsh – 1988). Билатеральное сохранение пучков увеличивает шансы пациента сохранить потенцию (71% против 48%), если он моложе 70 лет, и 48% против 40%, если он старше 70 лет. (Catalona W.J.с соавт., 1999). Таким образом, РПЭ стала более радикальной и сопровождается значительно меньшей частотой послеоперационных осложнений.
е. сохранить или же широко иссечь сосудисто-нервный пучок. Сохранение одного пучка позволяет сохранить потенцию в послеоперационном периоде у большинства больных (P.Walsh – 1988). Билатеральное сохранение пучков увеличивает шансы пациента сохранить потенцию (71% против 48%), если он моложе 70 лет, и 48% против 40%, если он старше 70 лет. (Catalona W.J.с соавт., 1999). Таким образом, РПЭ стала более радикальной и сопровождается значительно меньшей частотой послеоперационных осложнений.
Данные различных авторов говорят о том, что смертность в результате РПЭ колеблется от 0,2 до 0,5 %. Частота послеоперационных осложнений по данным различных источников весьма варьирует, однако их процент существенно ниже в тех клиниках, где эта операция выполняется часто и одними и теми же специалистами. Так стрессовое недержание мочи после РПЭ составляет, по различным сообщениям, 10% и менее, а 92% больных полностью удерживают мочу. (Catalona W.J. с соавт., 1999). Сексуальная активность у мужчин с локализованными формами рака предстательной железы после операции составляет в возрасте менее 50 лет – 92%; от 50 – 60 лет – 75%, а свыше 60 лет – 58% и широко варьирует не только в зависимости от возраста, но и от вида оперативной техники, используемой при сохранении сосудисто-нервных пучков (Catalona W. J. с соавт., 1999; Igel T. с соавт., 1987). Частота других послеоперационных осложнений по данным B. Andriol с соавт. (1994 ) составляет 7,2%.
J. с соавт., 1999; Igel T. с соавт., 1987). Частота других послеоперационных осложнений по данным B. Andriol с соавт. (1994 ) составляет 7,2%.
Выбор больных раком предстательной железы для операции, к сожалению, как шутят специалисты, считается скорее хирургическим искусством, чем хирургической наукой. Тем не менее, подавляющее большинство специалистов едины во мнении, что кандидатами на РПЭ, являются пациенты с ожидаемым сроком жизни не менее 10 лет. Не самыми удачными кандидатами являются больные, имеющие риск анестезии. Кроме того, пациенты, для которых риск потери сексуальной потенции крайне важен, иногда воздерживаются от выбора агрессивной лечебной тактики в пользу других видов терапии.
Одним из наиболее спорных критериев выбора больных для хирургического лечения РП является стадия заболевания. Рассмотрим результаты лечения больных с различными стадиями.
Клиническая стадия Т 1а – Т 1с
Стадия Т
1аN
0M
0 встречается крайне редко, и как правило, это хорошо дифференцированные опухоли. Ранее считалось, что лечить пациентов в этой стадии нет необходимости, так как появление метастазов в течение 4 лет наблюдения отмечалось только у 2% больных (Cantrell B. с соавт., 1981). В то же время данные V. Epstain с соавт. (1986) свидетельствуют о прогрессии опухоли у 16 % больных в стадии Т
1а. Кроме того, клиническая практика говорит о том, что несовершенство методов диагностики часто приводит нас в этих случаях к занижению стадии заболевания. Так по данным D. Paulson с соавт. (1988), из 18 больных в стадии Т
1а 11 (61%) имели окончательный диагноз после выполненной РПЭ стадии Т
1b – Т
3.
Ранее считалось, что лечить пациентов в этой стадии нет необходимости, так как появление метастазов в течение 4 лет наблюдения отмечалось только у 2% больных (Cantrell B. с соавт., 1981). В то же время данные V. Epstain с соавт. (1986) свидетельствуют о прогрессии опухоли у 16 % больных в стадии Т
1а. Кроме того, клиническая практика говорит о том, что несовершенство методов диагностики часто приводит нас в этих случаях к занижению стадии заболевания. Так по данным D. Paulson с соавт. (1988), из 18 больных в стадии Т
1а 11 (61%) имели окончательный диагноз после выполненной РПЭ стадии Т
1b – Т
3.
Наиболее часто стадия Т
1аN
0M
0 заболевания выявляется после выполнения трансуретральной электрорезекции (ТУР) предстательной железы по поводу доброкачественной гиперплазии простаты. Однако вероятность полного удаления опухоли в ходе ТУР определить крайне тяжело.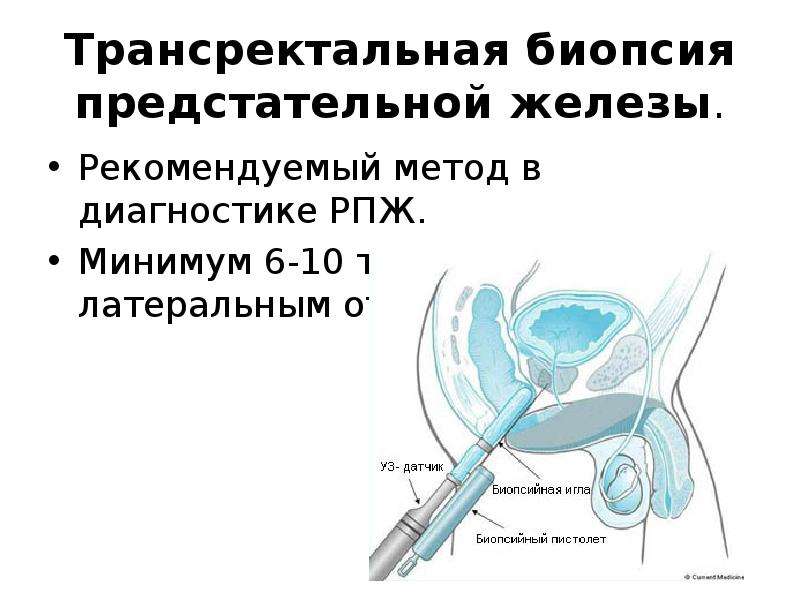 Об этом можно судить косвенно по уровню простатического специфического антигена (PSA) в сыворотке крови, либо по результатам шести точечной трансректальной биопсии под ультразвуковым наведением, выполненной позже. В то же время наличие высокой дифференциации опухоли в полученном материале (G3), отсутствие специфических маркеров наличия рака предстательной железы (20 % РП проходит на фоне PSA < 4 нг/мл) свидетельствует о целесообразности выполнения РПЭ как единственного радикального метода лечения этой локализованной стадии.
Об этом можно судить косвенно по уровню простатического специфического антигена (PSA) в сыворотке крови, либо по результатам шести точечной трансректальной биопсии под ультразвуковым наведением, выполненной позже. В то же время наличие высокой дифференциации опухоли в полученном материале (G3), отсутствие специфических маркеров наличия рака предстательной железы (20 % РП проходит на фоне PSA < 4 нг/мл) свидетельствует о целесообразности выполнения РПЭ как единственного радикального метода лечения этой локализованной стадии.
Клиническая стадия Т
1bN
0М
0. Данная стадия опухоли безусловно должна рассматриваться как новообразование с высоким риском прогрессии, т.к. у 20% больных после РПЭ выявляется Т
3 (Altwein V., 1999). Поэтому у данной группы пациентов предпочтителен выбор оперативного метода лечения – РПЭ. Ряд специалистов высказывают мнение о нецелесообразности РПЭ, если стадия Т
1b сочетается с низким показателем по шкале Глиссона, однако невозможность точного определения стадии процесса, а также высокий процент расхождений при определении степени дифференцировки опухолевых клеток в биопсийных столбиках и препарате заставляет большинство специалистов склоняться в пользу агрессивной лечебной тактики.
Клиническая стадия Т
1cN
0M
0. Это группа опухолей предстательной железы очень неоднородна. Epstain J. с соавт. (1994) предложили для более точного определения объема опухоли выделить три категории: ограниченный рак, очень ограниченный и незначимый рак. Он полагает, что на основании трактовки результатов секстантной биопсии, а также уровня PSA можно в 95% случаев определить локализованную форму рака предстательной железы с объемом <0,2 мл и суммой по шкале Глиссона <7. Однако выделение этих категорий в стадии Т
1c не дает возможности говорить о вероятной прогрессии этой опухоли при выборе выжидательной тактики или лучевой терапии. Клиническая практика свидетельствует о том, что стадия опухоли Т
1с часто является заниженной. Так, по данным Т. Donglas с соавт. (1995), у 44% больных в стадии Т
1с после выполненной РПЭ выявлено распространение образования в перипростатическую жировую клетчатку, у 8% – в семенные пузырьки и только у 5% имел место незначимый рак в стадии Т
1сN
0М
0. Из 72 больных, прооперированных в период между 1987-1995 годами, средний балл по шкале Глиссона составлял 5,6, а у 25% больных он превышал 7, свидетельствуя о высоком риске рецидива. Данные, приведенные J. Epstein с соавт. (1994) показывают, что позитивный хирургический край имел место у 17%, а инвазия в семенные пузырьки у 6% прооперированных больных в стадии Т
1с.
Из 72 больных, прооперированных в период между 1987-1995 годами, средний балл по шкале Глиссона составлял 5,6, а у 25% больных он превышал 7, свидетельствуя о высоком риске рецидива. Данные, приведенные J. Epstein с соавт. (1994) показывают, что позитивный хирургический край имел место у 17%, а инвазия в семенные пузырьки у 6% прооперированных больных в стадии Т
1с.
Таким образом, отсутствие диагностических возможностей точно определить стадию опухоли и прогноз на будущее у пациентов с предполагаемой стадией Т 1N 0М 0 и высокая надежность радикального удаления локализованной формы рака предстательной железы позволяет говорить о целесообразности выполнения именно РПЭ.
Клиническая стадия Т
2а-bN
0М
0. Показания для выполнения РПЭ у больных в стадии Т
2 сходны с приведенными выше для стадии Т
1, однако не все специалисты согласны с этой точкой зрения, ссылаясь на тот факт, что у большого количества больных с ограниченной формой РП до операции окончательным диагнозом является стадия Т
3. Так по данным E. Mukamel с соавт. (1987), 66% больных, прооперированных в его институте с предполагаемой стадией Т
2, имели прорастание в капсулу предстательной железы или за ее пределы и инвазию в семенные пузырьки, либо экстракапсулярную экстензию. Сходные результаты сообщает V. Epstein с соавт. (1994).
Так по данным E. Mukamel с соавт. (1987), 66% больных, прооперированных в его институте с предполагаемой стадией Т
2, имели прорастание в капсулу предстательной железы или за ее пределы и инвазию в семенные пузырьки, либо экстракапсулярную экстензию. Сходные результаты сообщает V. Epstein с соавт. (1994).
Тем не менее, большинство институтов и клиник придерживаются мнения, что пациенты, имеющие стадию Т
2а, являются идеальными кандидатами для выполнения РПЭ, т.к. у них еще нет пенетрации капсулы и инвазии в семенные пузырьки. Если больных в стадии Т
2а не лечить, то у 35-55% из них через 5 лет будут выявлены метастазы и 20% умрут от основного заболевания, что еще раз свидетельствует о неумолимом росте опухоли. Некоторые специалисты склоняются в пользу лучевой терапии при стадии Т
2а, апеллируя к хорошим результатам лечения, однако рост уровня PSA отмечается у многих больных, а частота положительных биопсий через 1 год после облучения колеблется от 39% до 62% по разным источникам. (Dudan, Kabalin).
(Dudan, Kabalin).
Клиническая стадия Т 2b рака предстательной железы оценивается как более агрессивная. В течение 5 лет у 77% больных в стадии Т 2b отмечается дальнейший рост опухоли. Эффект от лучевой терапии не дает высоких показателей выживаемости. Общая выживаемость для пациентов, имеющих стадию Т 2 РП составляет: 81% – 5 лет; 60% – 10 лет и 34% – 15 лет.
Применение РПЭ в лечении больных в стадии Т
2 обеспечивает радикальность лечения в тех случаях, когда опухоль ограничена железой. Это является основной причиной хороших результатов лечения. Так по данным D. Paulson с соавт. (1994) 92% больных с локализованной формой рака предстательной железы были свободны от болезни в течение 5 лет наблюдений, 89% – в течение 10 лет. Пациенты с капсулярной инвазией без экстракапсулярного прорастания в 81% в течение 5 лет были свободны от заболевания и в 70% – к 10 годам. В тех случаях, когда была выявлена экстракапсулярная инвазия или инвазия в семенные пузырьки, эти показатели составили соответственно 57% и 40%.
В тех случаях, когда была выявлена экстракапсулярная инвазия или инвазия в семенные пузырьки, эти показатели составили соответственно 57% и 40%.
Эффективность любого агрессивного метода лечения в онкологии оценивается по его радикальному удалению тканей опухоли, а также по предотвращению рецидива заболевания. Следовательно, успех того или иного метода лечения необходимо рассматривать с точки зрения продолжительности жизни без клинических и биохимических признаков заболевания.
Именно у больных раком предстательной железы в стадии Т
2 при локализованной форме частота локального рецидива очень мала. Так по данным E. Mukamel с соавт. (1987) из 103 больных с локализованной формой опухоли, либо имевших капсулярную инвазию, частота локального рецидива составила 1% в течение 48 месяцев наблюдения. Таким образом, правильно выполненная РПЭ является наиболее эффективным методом радикального удаления локализованных форм рака предстательной железы.
Клиническая стадия Т 3N 0М 0.
Частота выявления стадии Т
3 по данным различных источников колеблется от 12 до 18% (Schmidt V. с соавт., 1986). На сегодняшний день выбор лечебной тактики у больных с этой стадией заболевания остается спорным. Многие используют лучевую терапию, однако результаты свидетельствуют о невысокой ее эффективности при Т
3. Основной проблемой при выборе хирургического лечения является наличие экстракапсулярного прорастания, а также инвазии в семенные пузырьки, что, по мнению противников агрессивной терапии, не позволяет говорить о радикальности операции и лишает целесообразности ее применения. В то же время, данные многочисленных исследований говорят о том, что среди больных с предполагаемой стадией Т
3 от 9 до 22% пациентов имели окончательный патоморфологический диагноз Т
2 (Van den Ouden с соавт. , 1998; M.Wolf с соавт., 1994). Кроме того, радикальность операции может быть достигнута широким иссечением окружающих тканей, включая боковые сосудисто-нервные пучки, что бесспорно увеличивает число отрицательных хирургических краев и улучшает результаты лечения.
, 1998; M.Wolf с соавт., 1994). Кроме того, радикальность операции может быть достигнута широким иссечением окружающих тканей, включая боковые сосудисто-нервные пучки, что бесспорно увеличивает число отрицательных хирургических краев и улучшает результаты лечения.
В целях снижения частоты положительных краев при выполнении РПЭ у больных в стадии Т
3 (она достигает 66% – van den Ouden с соавт.,1998) была предложена неоадъювантная гормональная терапия. Ее применение позволило в несколько раз снизить частоту положительных краев после РПЭ (с 45% до 24% – Aus O. с соавт., 1998; с 33,8% до 7,8% – Labrie F. с соавт., 1994). Однако ряд последних исследований (включая и рандомизированные) показал, что в течение 3-4 лет наблюдения нет значительных различий в частоте биохимической прогрессии (PSA) между двумя группами (Witjes W. с соавт., 1998). В настоящее время установлено, что применение неоадъювантной терапии не увеличивает продолжительность жизни больных, однако никто не отрицает целесообразности проведения дальнейших рандомизированных исследований.
Помимо попыток снизить частоту положительных краев применением неоадъювантной терапии были предприняты усилия по улучшению технического выполнения операции по полному удалению опухолевой ткани. Применение панорамных увеличительных линз позволяет избежать повреждений капсулы, улучшить за счет хорошего гемостаза визуализацию операционного поля. Кроме того, широкое иссечение периуретральной и перипростатической фасций в области верхушки, включая несколько миллиметров проксимальной части мембранозной уретры, позволяет повысить радикальность оперативного вмешательства (Stamey T. с соавт., 1990).
Применение экспресс биопсии (frozen section) проксимального отдела уретры, а также краев резекции не получили широкого применения вследствие имевших место ложноположительных или ложноотрицательных ответов.
Некоторые авторы рекомендуют широкое иссечение сосудисто-нервных пучков, что, безусловно, снижает вероятность положительных краев. Ряд авторов предлагает выделять до выполнения РПЭ группу риска, у которой должны быть предприняты все меры по снижению прогнозируемой высокой вероятности положительных краев. Так высокий уровень PSA, большой объем, а также высокая степень дифференциации опухоли (G3) свидетельствуют о значительной вероятности положительных краев. (V. Epstein 1996 ; van den Ouden с соавт., 1994). Кроме этого показаниями для широкого иссечения краев могут служить более чем два положительных биопсийных столбика, либо один, но содержащий 100 % опухолевой ткани; локализация опухоли в верхушке железы (Watson R. с соавт., 1996). По данным R. Smith с соавт. (1996), широкое иссечение сосудисто-нервных пучков на стороне пальпируемой опухоли позволило получить отрицательный хирургический край у 58% больных по сравнению с 45%, у которых он сохранялся.
Ряд авторов предлагает выделять до выполнения РПЭ группу риска, у которой должны быть предприняты все меры по снижению прогнозируемой высокой вероятности положительных краев. Так высокий уровень PSA, большой объем, а также высокая степень дифференциации опухоли (G3) свидетельствуют о значительной вероятности положительных краев. (V. Epstein 1996 ; van den Ouden с соавт., 1994). Кроме этого показаниями для широкого иссечения краев могут служить более чем два положительных биопсийных столбика, либо один, но содержащий 100 % опухолевой ткани; локализация опухоли в верхушке железы (Watson R. с соавт., 1996). По данным R. Smith с соавт. (1996), широкое иссечение сосудисто-нервных пучков на стороне пальпируемой опухоли позволило получить отрицательный хирургический край у 58% больных по сравнению с 45%, у которых он сохранялся.
Таким образом, широкое иссечение тканей способствует повышению степени радикальности операции и за счет явного циторедуктивного эффекта, который не может быть достигнут ни одним из других видов терапии, позволяет начать адъювантную терапию в более поздние сроки, что улучшает качество жизни больного и способствует увеличению продолжительности жизни. Примером этого могут быть данные, представленные van den Ouden с соавт. (1998), которые проследили 5-10 – летнюю выживаемость у 64 больных в стадии Т
3N
0М
0 после РПЭ как монотерапии. Так пациенты с низко дифференцированным раком предстательной железы в стадии Т
3N
0М
0 имели высокие показатели прогрессии (локальный рецидив на 5 и 10 год наблюдения составили 28% и 100%, а отдаленные метастазы – 64% и 100% соответственно), что говорит о необходимости немедленной адъювантной терапии. В то же время, пациенты, у которых опухоль была G
1-2 степени дифференциации имели результаты, сходные с показателями у больных со стадией Т
2 (локальный рецидив на 5 и 10 год наблюдений составили 13% и 30%, а отдаленные метастазы 16% и 31% соответственно). Эти данные убедительно свидетельствуют о том, что РПЭ должна рассматриваться как эффективный метод лечения у пациентов с высокой или средней степенью дифференцировки тканей опухоли в стадии Т
3N
0М
0.
Примером этого могут быть данные, представленные van den Ouden с соавт. (1998), которые проследили 5-10 – летнюю выживаемость у 64 больных в стадии Т
3N
0М
0 после РПЭ как монотерапии. Так пациенты с низко дифференцированным раком предстательной железы в стадии Т
3N
0М
0 имели высокие показатели прогрессии (локальный рецидив на 5 и 10 год наблюдения составили 28% и 100%, а отдаленные метастазы – 64% и 100% соответственно), что говорит о необходимости немедленной адъювантной терапии. В то же время, пациенты, у которых опухоль была G
1-2 степени дифференциации имели результаты, сходные с показателями у больных со стадией Т
2 (локальный рецидив на 5 и 10 год наблюдений составили 13% и 30%, а отдаленные метастазы 16% и 31% соответственно). Эти данные убедительно свидетельствуют о том, что РПЭ должна рассматриваться как эффективный метод лечения у пациентов с высокой или средней степенью дифференцировки тканей опухоли в стадии Т
3N
0М
0.
Клинические стадии Т 1-3N 1М 0.
Вопрос о выборе оптимальной лечебной тактики у больных раком предстательной железы с положительными лимфоузлами вызывает большие споры. Дело в том, что наличие метастазов в лимфатических узлах расценивается как системное заболевание, и на этом основании многие специалисты считают бесполезной оперативную тактику. Выявление метастазов в лимфоузлах у пациентов, с прежде считавшимся локальным заболеванием понизилось с 20-40% в 1970 гг. до менее 10% в начале 1980 гг. В настоящее время в клинике Мейо это число составляет 5%. Однако оптимальные пути лечения для пациента с узловым метастазированием неясны. Не леченный л/у-позитивный рак предстательной железы ассоциируется с плохим прогнозом. У большинства пациентов симптоматическая локальная прогрессия происходит в сроки от 18 до 24 месяцев. Монотерапия в виде хирургии, гормональной терапии демонстрирует дальнейшую прогрессию заболевания. В то же время применение лучевой терапии, как на предстательную железу, так и лимфатические узлы не является методом лечения системного заболевания, о чем говорят и неудовлетворительные результаты ее применения в качестве монотерапии.
В то же время применение лучевой терапии, как на предстательную железу, так и лимфатические узлы не является методом лечения системного заболевания, о чем говорят и неудовлетворительные результаты ее применения в качестве монотерапии.
Другой проблемой является трудность выявления положительных лимфоузлов. Дело в том, что микрометастазы в лимфоузлы не выявляются ни КТ (компьютерной томографией), ни MЯТ (магнитно-ядерной томографией). В тех случаях, где увеличенный лимфоузел определяется с помощью КТ, в 90% случаев имеют место и отдаленные метастазы. На сегодняшний день мы можем лишь предполагать наличие опухолевых клеток в лимфоузлах на основании уровня PSA и степени дифференцировки. Наиболее часто специалисты прибегают к помощи экспресс биопсии лимфатических узлов у больных группы риска, и при получении положительного ответа решают вопрос о дальнейшей тактике – применении лучевой терапии в сочетании с андрогенной блокадой (Paulson D.F. с соавт., 1982; Seay T.M., Blute M. L. с соавт., 1998, Zincke N., 1989), либо РПЭ с последующей адъювантной терапией.
L. с соавт., 1998, Zincke N., 1989), либо РПЭ с последующей адъювантной терапией.
Данные, представленные в последние годы из клиники Mayo (Zincke H. 1997; Seay T. с соавт., 1998) и посвященные лечению больных с положительными лимфоузлами посредством РПЭ и адъювантной терапии, приобретают сторонников. Отмечено, что пациенты в стадии Т
3N
1-3М
0 и диплоидным типом опухоли, перенесшие РПЭ в сочетании с адъювантной гормональной терапией, имеют результаты лечения, сходные с результатами у пациентов со стадией Т
2 – 88% больных в течение 10 лет наблюдения не имели рецидива заболевания. Заслуживают внимания результаты R. Kalies с соавт., (1997): время до прогрессии заболевания у больных после РПЭ в сочетании с адъювантной эндокринной терапией было значительно больше, чем в группе после выполнения лимфаденэктомии в сочетании с эндокринной терапией. Все эти данные свидетельствуют о целесообразности применения комбинации РПЭ в сочетании с адъювантной терапией в лечении больных в стадиях Т
3N
1-3М
0. Результаты последнего исследования в клинике Мейо, опубликованных в 1999 г. в J. Urology, являются самым большим контролируемым ретроспективным анализом роли РПЭ в рТ
хN+ РП. У пациентов с рТ
хN+ была выполнена РПЭ с ранней орхэктомией (в течение 3-х месяцев после простатэктомии). Общая выживаемость в течение 10 лет в группе РПЭ + орхэктомия составила 66% в сравнении с 28%, если выполнялась только орхэктомия. Это наблюдение подтверждает тот факт, что РПЭ в сочетании с орхэктомией обеспечивает существенное улучшение общей и раково-специфической выживаемости (Ghavamian R. с соавт., 1999).
Результаты последнего исследования в клинике Мейо, опубликованных в 1999 г. в J. Urology, являются самым большим контролируемым ретроспективным анализом роли РПЭ в рТ
хN+ РП. У пациентов с рТ
хN+ была выполнена РПЭ с ранней орхэктомией (в течение 3-х месяцев после простатэктомии). Общая выживаемость в течение 10 лет в группе РПЭ + орхэктомия составила 66% в сравнении с 28%, если выполнялась только орхэктомия. Это наблюдение подтверждает тот факт, что РПЭ в сочетании с орхэктомией обеспечивает существенное улучшение общей и раково-специфической выживаемости (Ghavamian R. с соавт., 1999).
Радикальная простатэктомия для большинства больных раком предстательной железы, имеющих ожидаемую продолжительность жизни не менее 10 лет и локализованную форму
Т
1-2N
0М
0 – идеальный метод лечения, так как позволяет радикально удалить опухоль. Выживаемость больных после РПЭ зависит от многих факторов, но летальные исходы отмечаются крайне редко, а частота серьезных осложнений составляет не более 2%. Кроме того, частота послеоперационных осложнений уменьшается со временем, то есть в приводимых группах пациентов первые имели больше осложнений, чем оперированные в последние годы. Это обстоятельство может быть связано с улучшением хирургической техники, тщательным отбором больных и более совершенной диагностикой. Важность этих факторов и их позитивные изменения часто недооцениваются, однако, именно они являются направлением по улучшению результатов РПЭ (Catalona W.J. с соавт., 1999). Современная хирургическая техника операции дает возможность полностью удалять экстракапсулярные формы РП у пациентов в стадии Т
3N
0М
0, а также выделять пациентов группы риска (положительные хиpургические края, G>7), т.е. тех, которым при необходимости может назначаться адъювантная терапия.
Выживаемость больных после РПЭ зависит от многих факторов, но летальные исходы отмечаются крайне редко, а частота серьезных осложнений составляет не более 2%. Кроме того, частота послеоперационных осложнений уменьшается со временем, то есть в приводимых группах пациентов первые имели больше осложнений, чем оперированные в последние годы. Это обстоятельство может быть связано с улучшением хирургической техники, тщательным отбором больных и более совершенной диагностикой. Важность этих факторов и их позитивные изменения часто недооцениваются, однако, именно они являются направлением по улучшению результатов РПЭ (Catalona W.J. с соавт., 1999). Современная хирургическая техника операции дает возможность полностью удалять экстракапсулярные формы РП у пациентов в стадии Т
3N
0М
0, а также выделять пациентов группы риска (положительные хиpургические края, G>7), т.е. тех, которым при необходимости может назначаться адъювантная терапия. Пациенты с положительными лимфоузлами Т
1-3N
1М
0 могут рассчитывать на хороший эффект системной терапии после циторедуктивного эффекта РПЭ. Изучение рака груди подтверждает, что локо-региональная опухоль может быть потенциальным источником для будущей опухолевой диссеминации и присоединение локо-региональной терапии может предупредить вторичную диссеминацию из опухоли (Cadedu J.A. с соавт., 1997).
Пациенты с положительными лимфоузлами Т
1-3N
1М
0 могут рассчитывать на хороший эффект системной терапии после циторедуктивного эффекта РПЭ. Изучение рака груди подтверждает, что локо-региональная опухоль может быть потенциальным источником для будущей опухолевой диссеминации и присоединение локо-региональной терапии может предупредить вторичную диссеминацию из опухоли (Cadedu J.A. с соавт., 1997).
Хирургическая тактика, исповедуемая клиникой урологии ВМА, является активной как в отношении так называемых “традиционных” для оперативного лечения стадий РП – Т
1-Т
2, так и в отношении местно-распространенных процессов без вовлечения лимфоузлов (Т
3N
0M
0). В ситуациях с микрометастазированием в лимфоузлы, выявляемых после выполнения РПЭ, нам импонирует опыт клиники Мейо с использованием циторедуктивного эффекта в сочетании с антиандрогенной терапией или энуклеацией. Этот опыт особенно ценен и убедителен у молодых пациентов.
Этот опыт особенно ценен и убедителен у молодых пациентов.
Кроме того, текущие исследования, возможно, позволят нам рационально использовать новые методы лечения, усиливающие циторедуктивный эффект, такие как использование аутовакцины и дендритных клеток.
Наши результаты подтверждают, что РПЭ является безопасной операцией у тщательно отобранных пациентов и в руках опытной хирургической команды.
Предотвращает ли стерилизация собак заболевание простаты?
Говоря о стерилизации, ветеринары часто перечисляют ряд заболеваний, которые стерилизация может помочь предотвратить. Заболевания простаты часто занимают первое место в этом списке – но так ли это? Как кастрация влияет на заболевание простаты у собак? Наш ветеринарный блоггер Сиан копается в науке в этом, первом из наших постов о «Неделе стерилизации».
Что такое предстательная железа у собак? Простата – это железа в брюшной полости кобеля. Это дополнительная половая железа, поскольку она производит семенную жидкость. Эта жидкость смешивается со спермой, вырабатываемой яичками, с образованием спермы. Жидкость проходит в уретру, трубку, соединяющую мочевой пузырь с пенисом. Простата окружает уретру и находится выше мочевого пузыря и ниже прямой кишки.
Это дополнительная половая железа, поскольку она производит семенную жидкость. Эта жидкость смешивается со спермой, вырабатываемой яичками, с образованием спермы. Жидкость проходит в уретру, трубку, соединяющую мочевой пузырь с пенисом. Простата окружает уретру и находится выше мочевого пузыря и ниже прямой кишки.
Стерилизация кобеля обычно подразумевает хирургическую кастрацию. При этой процедуре удаляются оба яичка. Гормональные препараты можно использовать для химической кастрации собаки, но эти процедуры необходимо повторять, чтобы предотвратить выработку тестостерона, поскольку яички не удаляются.
Что говорится в исследовании? Собаки, которые не были кастрированы, называются целыми или неповрежденными. В статье 2018 года о заболевании предстательной железы у собак объясняется, что у всех интактных собак старше 6 лет развивается состояние, называемое доброкачественной гипертрофией простаты (ДГПЖ) (1) . ДГПЖ вызывает увеличение предстательной железы. Как следует из названия, это доброкачественное заболевание, поскольку оно не вызывает опасного для жизни заболевания. Однако это может вызвать у собаки сильный дискомфорт и повлиять на мочеиспускание и дефекацию.
Как следует из названия, это доброкачественное заболевание, поскольку оно не вызывает опасного для жизни заболевания. Однако это может вызвать у собаки сильный дискомфорт и повлиять на мочеиспускание и дефекацию.
По мере увеличения предстательной железы она сдавливает уретру. Это затрудняет нормальное мочеиспускание собаки. Они напрягаются, чтобы помочиться, часто с большим усилием выделяя небольшое количество мочи. Моча может содержать кровь или капли крови могут быть видны вокруг мочеиспускания из-за натуживания. К счастью, полная непроходимость мочевого пузыря встречается редко.
Значительное увеличение предстательной железы в размерах также вызывает сдавление прямой кишки.Это вызывает затруднения при отхождении фекалий, у собаки начнутся запоры, и у нее будет выделяться небольшое количество сплющенных фекалий.
Почему возникает аденома простаты? ДГПЖ возникает из-за выработки тестостерона яичками, поэтому кастрация препятствует этому. Кастрация используется для лечения аденомы простаты, поскольку уровень тестостерона падает, простата сокращается. Симптомы дискомфорта и трудности с туалетом полностью исчезают в течение одного месяца после кастрации.
Кастрация используется для лечения аденомы простаты, поскольку уровень тестостерона падает, простата сокращается. Симптомы дискомфорта и трудности с туалетом полностью исчезают в течение одного месяца после кастрации.
ДГПЖ увеличивает риск других заболеваний предстательной железы, которые вызывают дальнейшее увеличение предстательной железы и более тяжелое заболевание. (2) .Таким образом, стерилизация предотвратит заболевания простаты, обсуждаемые ниже. И кисты простаты, и абсцессы могут потребовать дополнительного хирургического вмешательства, но кастрация предотвратит рецидив.
Простатит Это воспаление предстательной железы. Обычно это вызвано бактериальной инфекцией, возникающей в самой простате, почках или мочевом пузыре. ДГПЖ делает предстательную железу более восприимчивой к инфекции, поскольку структурные изменения блокируют протоки внутри железы и вызывают скопление жидкости.
Бактериальный простатит может вызвать абсцесс предстательной железы, при котором закупорка протоков приводит к образованию больших карманов жидкости. Эти абсцессы отгораживаются от тела, препятствуя проникновению антибиотиков и успешному лечению. Абсцессы предстательной железы требуют длительных курсов антибиотиков продолжительностью не менее 4 недель и могут потребовать хирургического вмешательства.
Кисты простатыЭти заполненные жидкостью карманы могут развиваться независимо или чаще из-за аденомы простаты, рака или воспаления.Это стерильные скопления жидкости, возникающие в предстательной железе. Они вызывают симптомы, похожие на ДГПЖ: затрудненное пользование туалетом, боль в животе и кровь в моче. Кисты простаты могут рассосаться кастрацией, если они маленькие, но требуют хирургического вмешательства, если они большие.
Парапростатические кисты немного отличаются тем, что они образуются из-за аномальной ткани, прикрепленной к простате. Эта ткань прикрепляется к простате и выделяет жидкость, вызывая скопление жидкости рядом с простатой.Эти кисты стерильны, но сдавливают уретру, вызывая дискомфорт и затруднения при мочеиспускании. Для разрешения необходимо хирургическое удаление кисты, но кастрация обычно предотвращает рецидив. Кастрация до 4-летнего возраста обычно останавливает рост этих кист, поскольку ткань реагирует на тестостерон.
Эта ткань прикрепляется к простате и выделяет жидкость, вызывая скопление жидкости рядом с простатой.Эти кисты стерильны, но сдавливают уретру, вызывая дискомфорт и затруднения при мочеиспускании. Для разрешения необходимо хирургическое удаление кисты, но кастрация обычно предотвращает рецидив. Кастрация до 4-летнего возраста обычно останавливает рост этих кист, поскольку ткань реагирует на тестостерон.
Плоская метаплазия вызывает увеличение простаты из-за повышения уровня эстрогена. Этот гормон в избытке секретируется опухолью яичек из клеток Сертоли.Поскольку кастрация включает удаление обоих яичек, стерилизация предотвращает все типы рака яичек. Распространенная опухоль, называемая перианальной аденомой, также встречается у целых собак, но не у кастрированных собак, поскольку образование зависит от тестостерона.
А как насчет рака простаты? Есть одно заболевание предстательной железы, которое не удается предотвратить с помощью стерилизации. Рак простаты встречается у собак редко – считается, что он встречается менее чем у 1% собак (3) . Исследование, проведенное в 2002 г. (4) , показало, что кастрация не вызывает рака простаты, но может способствовать прогрессированию опухоли.Таким образом, рак простаты на больше, чем у некастрированных собак, обычно на . Однако заболеваемость все еще очень низка.
Рак простаты встречается у собак редко – считается, что он встречается менее чем у 1% собак (3) . Исследование, проведенное в 2002 г. (4) , показало, что кастрация не вызывает рака простаты, но может способствовать прогрессированию опухоли.Таким образом, рак простаты на больше, чем у некастрированных собак, обычно на . Однако заболеваемость все еще очень низка.
Заболевание предстательной железы возникает у собак среднего и старшего возраста. Выработка тестостерона вызывает большинство заболеваний, поэтому стерилизация (кастрация) предотвратит большинство заболеваний простаты. Когда ваша собака моложе, важно учитывать это внимательно, поскольку у пожилой собаки может быть сопутствующее заболевание, которое может усложнить хирургическую процедуру.
Ссылки и дополнительная литература:
1. Christensen BW. Заболевание предстательной железы собак. Vet Clin North Am Small Anim Practices, июль 2018 г .; 48 (4): 701-719.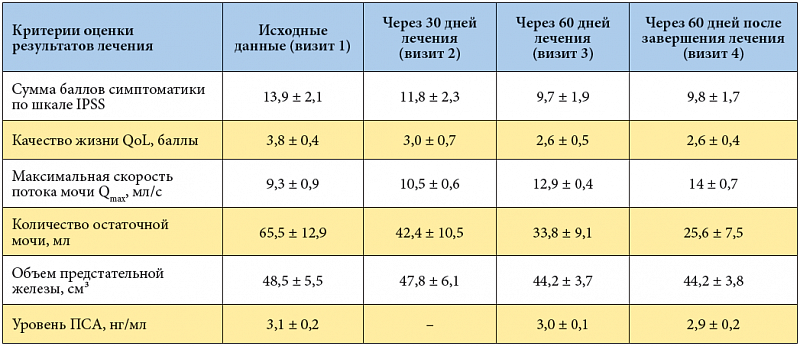
2. Нижански В., Леви X, Охота М., Пасиковска Ю. Фармакологическое лечение распространенных заболеваний предстательной железы у собак – доброкачественной гиперплазии предстательной железы и простатита: обновленная информация. Reprod Domest Anim. 2014; 49Поддержка 2: 8-15.
3. Брайан Дж. Н., Киллер М. Р., Генри Си Джей, Брайан М. Е., Хан А. В., Колдуэлл К. В.. Популяционное исследование статуса стерилизации как фактора риска рака простаты у собак.Предстательная железа. 2007; 67 (11): 1174-1181.
4. Теске Э., Наан Э.С., ван Дейк Э.М., Ван Гардерен Э., Шалькен Я. Карцинома простаты у собак: эпидемиологические доказательства повышенного риска у кастрированных собак. Mol Cell Endocrinol. 2002; 197 (1-2): 251-255.
Что нужно знать о простате собаки
Простата – это железа, которая является частью репродуктивной системы у многих млекопитающих, включая людей и собак, но знаете ли вы, что почти у всех интактных кобелей с возрастом увеличивается простата? Многие кастрированные собаки тоже могут.
К счастью, увеличение простаты у собак не обязательно представляет собой проблему само по себе, но это проблема, на которую вы должны обращать внимание, когда ваша собака становится старше. Вот еще несколько условий, о которых следует знать.
Доброкачественная гиперплазия предстательной железы (ДГПЖ)
Это простое увеличение простаты вашей собаки. Как правило, обе доли имеют одинаковый уровень увеличения. Он не вызывает злокачественных новообразований и обычно не доставляет собаке дискомфорта. Однако при значительном увеличении простата может закупоривать прямую кишку или оказывать давление на уретру.
В этих случаях вы можете заметить, что ваша собака напрягается во время дефекации или мочеиспускания, страдает запорами или калом, имеет кровь в моче или у нее кровянистые или желтые выделения из полового члена.
Лечение Если у собаки нет симптомов, лечение не требуется. Однако для тех, кто испытывает дискомфорт, наиболее эффективным лечением является стерилизация неповрежденной собаки. Другие возможные методы лечения включают терапию эстрогенами и противогрибковый препарат кетоконазол, который доступен под несколькими торговыми марками.Хотя использование противогрибковых средств в этом случае может показаться странным, это связано с тем, что они блокируют секрецию определенных гормонов, которые могут ухудшить состояние.
Другие возможные методы лечения включают терапию эстрогенами и противогрибковый препарат кетоконазол, который доступен под несколькими торговыми марками.Хотя использование противогрибковых средств в этом случае может показаться странным, это связано с тем, что они блокируют секрецию определенных гормонов, которые могут ухудшить состояние.
Это происходит, когда бактерии попадают в простату собаки через мочевыводящие пути или кровь. Состояние может быть острым с внезапным началом или хроническим, если не заметить начальные симптомы.
Симптомы острой инфекции включают затруднение дефекации или мочеиспускания, вялость, депрессию, потерю аппетита, лихорадку, боли в животе, жесткую ходьбу и кровянистые выделения из полового члена.Хронические бактериальные инфекции могут не иметь заметных симптомов и их сложнее лечить. В некоторых случаях бактерии могут застрять в простате и образовывать абсцесс.
Лечение Ваша собака обычно получает антибиотики через капельницу и требует госпитализации.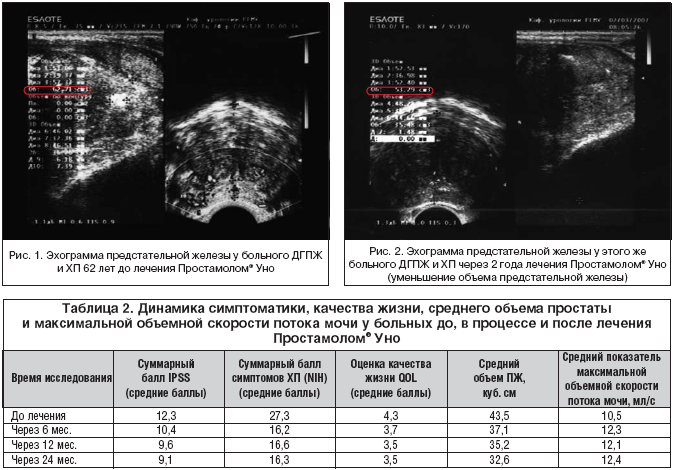 В тех случаях, когда ваша собака также страдает от разрыва предстательной железы абсцессом в результате воспаления, необходимо хирургическое вмешательство.
В тех случаях, когда ваша собака также страдает от разрыва предстательной железы абсцессом в результате воспаления, необходимо хирургическое вмешательство.
Эти заполненные жидкостью карманы начинают развиваться рядом с простатой у некоторых собак средних и крупных пород вскоре после рождения, но обычно они не представляют проблемы, пока собаке не исполнится несколько лет.
Когда кисты становятся большими, они могут оказывать давление на уретру или смещать прямую и толстую кишку. В результате у вашей собаки могут проявляться такие симптомы, как вялость, потеря аппетита, запор, болезненное мочеиспускание, кровь в моче, боль в животе или его увеличение, жесткая ходьба и боль в прямой кишке.
Лечение Кастрация может помочь решить проблему, а также предотвратить ее появление в будущем. В зависимости от размера кисты, возможно, потребуется дренировать или удалить ее хирургическим путем.
В отличие от людей, рак простаты у собак встречается редко. К сожалению, когда это действительно происходит, это обычно потенциально опасно для жизни, поскольку рак может распространяться по всему телу.
Симптомы включают ленточный стул, потерю аппетита и / или веса, затрудненное мочеиспускание, боль в животе, лихорадку и затрудненное дыхание.
ЛечениеК сожалению, от рака простаты у собак нет лекарства, но вы можете достичь краткосрочной ремиссии и облегчения с помощью лучевой и медикаментозной терапии.
По каким признакам вы впервые заметили, что с вашей собакой что-то не так? Какой путь лечения вы выбрали?
Часто задаваемые вопросы по кастрации собак – Ветеринарная больница Winter Park Статьи о здоровье домашних животных
Почему я должен кастрировать своего кобеля?
Помимо помощи в контроле над перенаселенностью собак, стерилизация собаки обычно делает собаку более здоровой и лучшим домашним животным. Стерилизованные собаки, как правило, живут дольше и имеют меньше проблем с поведением (см. Ниже).Они с меньшей вероятностью будут оставлены в приюте и не способствуют перенаселенности в общественных приютах для животных своими потомками. Местные власти больше заинтересованы в том, чтобы меньше бродячих собак, которые могли бы быть опасными, и чтобы они не обременяли бюджет службы поддержки животных. Владельцы домашних животных больше заинтересованы в том, чтобы иметь хорошо воспитанных и долгоживущих домашних питомцев.
Стерилизованные собаки, как правило, живут дольше и имеют меньше проблем с поведением (см. Ниже).Они с меньшей вероятностью будут оставлены в приюте и не способствуют перенаселенности в общественных приютах для животных своими потомками. Местные власти больше заинтересованы в том, чтобы меньше бродячих собак, которые могли бы быть опасными, и чтобы они не обременяли бюджет службы поддержки животных. Владельцы домашних животных больше заинтересованы в том, чтобы иметь хорошо воспитанных и долгоживущих домашних питомцев.
Какая польза для здоровья собаки?
Стерилизация дает несколько преимуществ для здоровья. Одна из самых важных проблем – предстательная железа, которая под действием тестостерона будет постепенно увеличиваться в размерах в течение жизни собаки.К пяти годам он обычно значительно увеличивается у кобелей, не подвергнутых лечению. По мере того, как собака продолжает стареть, его простата, вероятно, станет неудобной, возможно, достаточно большой, чтобы препятствовать дефекации. Простата под влиянием тестостерона также предрасположена к инфекции, вылечить которую без стерилизации практически невозможно. Стерилизация приводит к уменьшению предстательной железы до незначительной степени, что предотвращает как простатит, так и неприятную доброкачественную гиперплазию (увеличение), которая возникает с возрастом.Часто ошибочно полагают, что стерилизация предотвращает рак простаты, но это неверно; Преимущества кастрации для простаты заключаются в предотвращении увеличения и инфекции. Другие преимущества стерилизации для здоровья включают предотвращение некоторых типов грыж и опухолей яичек и заднего прохода. Избыточные выделения из препуциального отдела также уменьшаются за счет стерилизации.
Простата под влиянием тестостерона также предрасположена к инфекции, вылечить которую без стерилизации практически невозможно. Стерилизация приводит к уменьшению предстательной железы до незначительной степени, что предотвращает как простатит, так и неприятную доброкачественную гиперплазию (увеличение), которая возникает с возрастом.Часто ошибочно полагают, что стерилизация предотвращает рак простаты, но это неверно; Преимущества кастрации для простаты заключаются в предотвращении увеличения и инфекции. Другие преимущества стерилизации для здоровья включают предотвращение некоторых типов грыж и опухолей яичек и заднего прохода. Избыточные выделения из препуциального отдела также уменьшаются за счет стерилизации.
Какие изменения в поведении можно ожидать после стерилизации?
Было проведено множество исследований поведенческих эффектов стерилизации, в которых оценивались игривость, страх перед незнакомцами, территориальная агрессия, верховая езда, моча, блуждание и другие формы поведения. Поведение, которое наиболее последовательно изменяется после стерилизации, – это неправильная посадка, маркировка мочи и драки. Это поведение было значительно уменьшено или полностью устранено у 50-60 процентов кобелей после стерилизации. Большинство владельцев домашних животных стремятся сократить эти действия и тем самым улучшить свои отношения с собакой.
Поведение, которое наиболее последовательно изменяется после стерилизации, – это неправильная посадка, маркировка мочи и драки. Это поведение было значительно уменьшено или полностью устранено у 50-60 процентов кобелей после стерилизации. Большинство владельцев домашних животных стремятся сократить эти действия и тем самым улучшить свои отношения с собакой.
Что именно делается хирургическим путем?
Разрез делается, как правило, впереди мошонки. Через этот разрез удаляются яички.Стебли обрезают и обрезают. Кастрация достигнута. Если яички не удалить, перечисленные выше желаемые преимущества не могут быть реализованы. Разрез кожи может иметь швы, а могут и не иметь.
В каком возрасте можно проводить стерилизацию?
Кобелей можно кастрировать практически в любом возрасте, хотя традиционный возраст кастрации составляет от шести до девяти месяцев, то есть еще до полового созревания. Существуют некоторые разногласия относительно того, когда лучше всего проводить стерилизацию: после полового созревания, традиционный возраст или «ранний», что может означать любой возраст от восьми недель до шести месяцев. Старшие собаки также могут получить пользу от стерилизации. Больная увеличенная простата все равно уменьшится до комфортного размера даже у пожилой собаки. Стерилизация – это относительно простая операция с низким уровнем риска, а это значит, что даже пожилой собаке она может помочь.
Старшие собаки также могут получить пользу от стерилизации. Больная увеличенная простата все равно уменьшится до комфортного размера даже у пожилой собаки. Стерилизация – это относительно простая операция с низким уровнем риска, а это значит, что даже пожилой собаке она может помочь.
Чем моложе щенок стерилизуется, тем длиннее его длинные кости будут продолжать расти, что изменяет его телосложение на более высокий рост. Это, как представляется, имеют некоторые последствия опорно-двигательного аппарата, хотя хирургическое восстановление в более молодом возрасте быстрее, и есть меньше осложнений с самого стерилизуют.
Будет ли он полнеть или станет вялым? Метаболизм изменяется при стерилизации таким образом, что существует умеренный риск ожирения после стерилизации. Владелец собаки должен быть готов внести коррективы в диету или упражнения, если кажется, что собака набирает слишком много веса.
Будут ли его по-прежнему интересовать женщины?
Его интерес будет уменьшен, но если он будет рядом с сукой во время течки, он будет возбужден ею. Наступательное поведение часто имеет корни в выражении доминирования и может быть выражено кастрированным мужчиной в различных обстоятельствах, не мотивированных сексуальностью.
Наступательное поведение часто имеет корни в выражении доминирования и может быть выражено кастрированным мужчиной в различных обстоятельствах, не мотивированных сексуальностью.
Что делать, если у собаки неопустившееся яичко?
Неопущенные яички имеют повышенную тенденцию к росту опухолей. Они также могут скручиваться на стеблях и вызывать опасное для жизни воспаление. По этим причинам рекомендуется стерилизация собак с неопущенными яичками. Если есть одно опущенное яичко, собака сможет размножаться, но, поскольку сохранение яичка является наследственной чертой, важно, чтобы кобель не разводился до того, как он будет кастрирован. Передавать сохраненный признак яичка – не лучшая идея.
Требуется ли стерилизация по закону?
В некоторых районах может потребоваться стерилизация, поскольку муниципалитеты пытаются предотвратить перенаселение домашних животных. Проконсультируйтесь с властями вашего города или округа.
Как обращаться с ними у кобелей без стерилизации
Давайте поговорим о заболевании простаты у кобелей. Существует четыре типа проблем с простатой:
Существует четыре типа проблем с простатой:
- Доброкачественная гипертрофия или гиперплазия предстательной железы, также известная как ДГПЖ: Это наиболее частая проблема простаты, которую мы наблюдаем у неопытных или интактных кобелей.Это часто наблюдается в возрасте старше 5 лет, а иногда и раньше у бернских зенненхундов и больших швейцарских зенненхундов. Симптомы: капание крови из полового члена, не связанное с мочеиспусканием, боль при размножении; плоские ленточные табуреты; и кровь в эякуляте. От антибиотиков не поправляется. Он действительно растет и ослабевает, часто, если поблизости находятся охваченные течкой самки. Доброкачественная гипертрофия или гиперплазия предстательной железы очень хорошо поддается гормональной терапии. Однако, если его не лечить, это может привести к бесплодию, плохому качеству спермы и, в конечном итоге, к простатиту, поскольку бактерии могут перемещаться в кистозные структуры простаты.Лучше всего диагностировать это с помощью УЗИ, хотя можно провести ректальное исследование.
 На УЗИ простата увеличена и могут образовываться кисты, похожие на швейцарский сыр.
На УЗИ простата увеличена и могут образовываться кисты, похожие на швейцарский сыр. - Простатит: Это также довольно часто встречается у необработанных кобелей. Однако эти собаки больны – так же больны, как и самки пиометрой. У них жар, они вялые, не едят и могут умереть, если инфекция распространяется в брюшную полость, вызывая перитонит. Этим собакам нужна как антибиотик, так и гормональная терапия при аденоме простаты (см. Выше), так как это приведет к уменьшению предстательной железы и исчезновению кист, и бактериям некуда будет приживаться.
- Рак простаты: Обычно возникает у кастрированных, а не интактных самцов собак. Это может быть аденокарцинома или переходный рак, распространяющийся из мочевого пузыря. Оба плохие и не поддаются хирургическому вмешательству. Медицинский менеджмент помогает лишь на короткое время. Единственный способ подтвердить рак простаты – это биопсия простаты, которую можно сделать с помощью биопсии под ультразвуковым контролем – гораздо менее инвазивно, чем вскрытие собаки.

- Парапростатические кисты: Редкие, но серьезные.Это кисты, которые образуются вне простаты, и их можно увидеть на УЗИ или рентгене. Парапростатические кисты лучше всего лечить хирургическим путем и при стерилизации собаки.
Стерилизация вылечит аденомы простаты и простатит. Однако очень трудно разводить стерилизованных кобелей, если у них не заморожена сперма. Лучшее время для замораживания спермы – это возраст собаки от 2 до 5 лет. Собака должна быть здоровой и производить сперму отличного качества. Замораживание семени собаки в молодом возрасте будет стоить намного меньше денег.Если позже у него окажется заболевание, которое вы не хотите использовать в своей программе разведения, вы можете либо подождать, пока будет проведен анализ ДНК, чтобы определить, как вы можете использовать его в своей программе разведения, либо выбросить сперму.
Если вы решите не хранить замороженную сперму своей собаки, узнайте в своем клубе породы, есть ли другие люди, которые оценят этот ресурс. Слишком много пород становятся «исчезающими видами», поэтому помните об этом, прежде чем выбрасывать сперму. Если у вашей собаки заболевание простаты, и она представляет ценность для вас или других людей для разведения, обратитесь за помощью к ветеринару, который разбирается в диагностике и вариантах лечения для ценных племенных собак.Не стерилизируйте его – это не экстренная процедура.
Слишком много пород становятся «исчезающими видами», поэтому помните об этом, прежде чем выбрасывать сперму. Если у вашей собаки заболевание простаты, и она представляет ценность для вас или других людей для разведения, обратитесь за помощью к ветеринару, который разбирается в диагностике и вариантах лечения для ценных племенных собак.Не стерилизируйте его – это не экстренная процедура.
И помните: замораживать рано и замораживать часто!
Доктор Марти Грир руководит ветеринарной клиникой для мелких животных в Ломире, штат Висконсин, с 1982 года. Она является экспертом по репродукции собак и часто читает лекции по этой теме. Доктор Грир также изучал право в университете Маркетт и является партнером компании Animal Legal Resources LLC.
Рак предстательной железы – направления по Фитцпатрику
Рак предстательной железы может поражать как людей, так и животных.У собак он имеет тенденцию проявляться как особенно агрессивная форма заболевания с высоким потенциалом метастазирования. Новообразование предстательной железы может быть уротелиально-клеточной карциномой предстательной железы или аденокарциномой предстательной железы. Традиционно собак с раком простаты лечили внутривенной химиотерапией, но, к сожалению, ответ на это может быть ограниченным.
Новообразование предстательной железы может быть уротелиально-клеточной карциномой предстательной железы или аденокарциномой предстательной железы. Традиционно собак с раком простаты лечили внутривенной химиотерапией, но, к сожалению, ответ на это может быть ограниченным.
В компании Fitzpatrick Referrals мы твердо верим в поиск лучших способов лечения рака. Одна из областей, в которой мы особенно стремимся разработать лечение, – это опухоли нижних мочевых путей, включая рак мочевого пузыря и простаты.Мы надеемся, что благодаря внедрению новых методов лечения мы сможем предложить пациентам улучшенное качество жизни и увеличенное время выживания.
Каковы признаки и симптомы рака простаты у собак?
- Затруднения и частые попытки мочеиспускания
- Напряжение для отхождения фекалий / ленточных фекалий
- Гематурия
- Хромота задних ног / аномалии походки
- Усталость
- Потеря веса
- Диагностика рака простаты
Рак простаты диагностируется с помощью комбинации клинических признаков, расширенных диагностических изображений, таких как УЗИ / КТ, и получения клеток из предстательной железы для цитологического исследования.

Какие методы лечения доступны при раке простаты?
Медицинское обслуживание
Традиционно для лечения рака простаты используется комбинация внутривенной химиотерапии и нестероидных противовоспалительных препаратов (НПВП). Недавнее исследование показало пользу внутривенной химиотерапии и лечения НПВП у этих пациентов с увеличением среднего времени выживания собак, которые получали это, по сравнению с теми, кто этого не делал (106 дней против 51 дня).
Хирургическое управление
Наш старший врач-терапевт по интервенционной радиологии Джерард Маклаучлан (европейский специалист и специалист RCVS по внутренней медицине мелких животных) работал с коллегами в Королевской больнице Суррея, ветеринарной школе Калифорнийского университета в Дэвисе в Калифорнии, а также над нашими командами медицинских и хирургических онкологов. предоставить новые методы лечения неоплазии предстательной железы и других видов рака.
Перед лечением мы обычно рекомендуем пациентам пройти стадию с помощью компьютерной томографии, чтобы оценить степень имеющегося заболевания и определить, какие варианты лечения наиболее подходят для конкретного пациента и его семьи.

Хирургическое лечение простатэктомии, к сожалению, часто невозможно из-за распространения рака на момент постановки диагноза и осложнений, которые могут возникнуть после удаления простаты.
Минимально инвазивная интервенционная медицина
Внутриартериальная (IA) химиотерапия
Внутриартериальная химиотерапия включает доставку химиотерапии непосредственно в артериальный кровоток опухоли под рентгеноскопическим контролем.Не наблюдается увеличения побочных эффектов по сравнению с внутривенным введением (некоторые исследования показывают, что побочные эффекты могут быть меньше после внутривенного введения).
Исследования показали, что это может увеличить концентрацию химиотерапевтических препаратов, воздействующих на мочевой пузырь, простату и местные лимфатические узлы, более чем в восемь раз. В клинической публикации документировано, что у собак более высокая вероятность ремиссии опухоли после химиотерапии IA, чем после стандартной химиотерапии IV.

За последние 18 месяцев Служба интервенционной радиологии вылечила 10 случаев рака простаты с помощью химиотерапии IA.Результаты были очень многообещающими: некоторые из них клинически благополучно прошли через 12 месяцев после постановки диагноза. Результаты этого лечения были представлены Джерардом на международной ветеринарной конференции в 2018 году и, как ожидается, вскоре будут опубликованы. Подробнее о химиотерапии IA.
Изображение рентгеноскопического исследования, показывающее кровоснабжение мочевого пузыря и простаты. Это используется для выбора наилучшего места для проведения химиотерапии или эмболизации.
Эмболизация предстательной железы
Это включает введение эмболического агента (микросфер) в артерию предстательной железы под рентгеноскопическим контролем.Таким образом, цель процедуры – устранить кровоснабжение опухоли, что приводит к гибели клеток. Недавняя экспериментальная работа в Калифорнийском университете в Дэвисе показала очень многообещающие результаты: опухоли предстательной железы уменьшились в среднем на 40% после лечения.
 Этот метод очень похож на подход для внутриартериальной химиотерапии и доступен в онкологической больнице Fitzpatrick Referrals и Soft Tissue в Гилфорде, графство Суррей, где мы являемся первым центром в Европе, предлагающим это новое лечение рака простаты.
Этот метод очень похож на подход для внутриартериальной химиотерапии и доступен в онкологической больнице Fitzpatrick Referrals и Soft Tissue в Гилфорде, графство Суррей, где мы являемся первым центром в Европе, предлагающим это новое лечение рака простаты.Каковы возможные осложнения эмболизации простаты?
В серии случаев, когда собак лечили эмболизацией простаты, побочных эффектов не было.
Консультации для ваших пациентов
Мы знаем, что время от времени беседа с одним из наших специалистов очень важна и позволяет вам предложить наилучшие варианты для вашего клиента. Мы доступны каждый день, чтобы дать ветеринарам рекомендаций. Наша цель – поговорить с вами, когда вы звоните, но если это невозможно, один из наших врачей перезвонит вам в течение нескольких часов после того, как вы сделаете клинический запрос.* Пожалуйста, позвоните в больницу онкологии и мягких тканей Fitzpatrick по телефону 01483 688100.
* Консультации в течение нескольких часов относятся к обычным рабочим часам (с 8:00 до 20:00) с понедельника по пятницу – в нерабочее время мы можем дать совет в экстренных случаях.
В блоге
Лечение рака – не поздно ли?
Майкл Макфарлейн
Отвечая на ваши вопросы о раке у животных ко Всемирному дню борьбы против рака
Истории пациентов
Неоплазия предстательной железы: помогает ли тотальная простатэктомия?
Хотя неоплазия предстательной железы у собак встречается относительно редко, она обычно связана с плохим прогнозом из-за высокого риска местной инвазии или метастазирования.Кроме того, современные варианты лечения обычно связаны с плохим ответом и высоким риском осложнений.
СВЯЗАННЫЕ:
- Репродуктивный статус и частота неоплазий у золотистых ретриверов
- Диагностика и лечение рака
Исследователи недавно выполнили мультиинституциональное исследование ретроспективного лечения простаты после . пациенты.
Дизайн исследованияДанные были получены из медицинских карт собак, перенесших тотальную простатэктомию по поводу неоплазии предстательной железы с октября 2004 г. по август 2016 г.Послеоперационные осложнения классифицировались как незначительные (самоограничивающиеся или купированные с медицинской точки зрения) или серьезные (опасные для жизни или купированные хирургическим путем). Первоначальный диагноз, метастазирование и рецидив опухоли были подтверждены цитологически или гистологически.
РезультатыВ исследование были включены записи 25 кастрированных кобелей, представляющих 20 пород. Средний возраст и вес составляли 9,3 года и 25,0 кг соответственно. Наиболее частыми клиническими признаками были дизурия (48%), дисхезия (32%), гематурия (24%) и поллакиурия (24%).Увеличенная простата была пальпирована при ректальном исследовании у 16 собак, а у 2 собак были пальпированы образования в брюшной полости. Гематурия присутствовала в 87% проб мочи, и в 3 из 6 культур мочи был бактериальный рост.
Предоперационная визуализация выявила простатомегалию у 24 из 25 собак. Предоперационная цитология, проведенная у 20 собак, классифицировала опухоли как карциному (85%), эпителиальную дисплазию (10%) или плоскоклеточную метаплазию (5%). Предоперационная гистопатология опухолей у 3 собак классифицировала опухоли как переходно-клеточную карциному (66%) или аденокарциному предстательной железы (34%).
Тотальная простатэктомия была выполнена всем собакам посредством каудально-вентральной срединной целиотомии. Уретроуретральный или цистоуретральный анастомоз был возможен для всех собак, кроме 2. Все собаки получали послеоперационную анальгезию, а у 20 собак поддерживали мочевые катетеры в среднем в течение 4 дней после операции.
Несмотря на то, что все собаки дожили до выписки, послеоперационные осложнения включали инфекцию мочевыводящих путей (24%), рассечение швов (8%), инфекцию области хирургического вмешательства (8%), уроабдомен из-за разрыва мочевого пузыря (4%) и грыжу препубика ( 4%).Временное (60%) или постоянное (32%) недержание мочи было обычным явлением после операции.
Послеоперационная гистология охарактеризовала опухоли простаты как:
- Переходно-клеточная карцинома (60%)
- Аденокарцинома (32%)
- Недифференцированная карцинома (4%)
- Папиллярная цистаденокарцинома (4%) Возможно полное удаление опухоли 20
Лечебная химиотерапия была проведена 15 собакам, но была прекращена в 5 случаях из-за побочных эффектов или развития метастазов. Восемьдесят четыре процента всех пациентов в конечном итоге испытали местный рецидив опухоли и / или метастазы. Медиана безрецидивного интервала между хирургическим вмешательством и рецидивом новообразования, измеренная у 14 собак, составила 81,5 дня.
Среднее время выживания (MST) для всех собак составляло 231 день (диапазон 24-1255 дней). Экстракапсулярное расширение было значительно связано с более коротким MST.Дополнительное лечение, включая химиотерапию, существенно не улучшило MST. Во время исследования умерли 22 собаки, 19 из которых были связаны с опухолями.
Сообщение на домОсложнения возникали реже, и выживаемость была дольше, чем в предыдущих отчетах о собаках, перенесших тотальную простатэктомию. Недержание мочи оставалось наиболее частым послеоперационным побочным эффектом.
Доктор Стилвелл получила степень доктора медицины в Обернском университете, затем магистра наук в области рыболовства и водных наук и доктора ветеринарных наук в Университете Флориды.Она предоставляет внештатные медицинские письменные и консультационные услуги по водной ветеринарии через свой бизнес Seastar Communications and Consulting.
ТУРПЖ и другие операции по поводу увеличенной простаты и аденомы простаты
Лекарства могут помочь большинству мужчин с увеличенной простатой, но для некоторых их не всегда бывает достаточно для облегчения таких симптомов, как слабый отток мочи и подтекание.
Когда вы один из таких мужчин, у вас есть возможность хирургического лечения доброкачественной гиперплазии простаты, или ДГПЖ.
5 вопросов, которые следует задать перед операцией
Обдумывая варианты операции, задайте своему врачу следующие вопросы:
- Есть ли большая вероятность, что мое состояние улучшится?
- Насколько это улучшится?
- Каковы шансы побочных эффектов от лечения?
- Как долго продлится эффект?
- Нужно ли мне повторять эту процедуру?
С новыми технологиями врачи могут выполнять некоторые малоинвазивные процедуры с крошечными надрезами (надрезами) или использовать инструменты в виде трубок, которые они вставляют в вас.Эти процедуры могут не лечить симптомы в той же степени или долговечности, что и более инвазивные хирургические варианты, они имеют более быстрое выздоровление, меньшую боль и меньшие риски.
В других случаях может потребоваться традиционная и более инвазивная хирургия. Все зависит от вашего случая и того, что вы и ваш врач решите, что лучше для вас.
Врачи могут выбирать из этих малоинвазивных процедур, эндоскопических или открытых операций для лечения умеренных и тяжелых симптомов. Эти процедуры также используются, если тесты показывают, что ваша способность мочиться серьезно нарушена.
Минимально инвазивные процедуры
С помощью новейших технологий врачи могут использовать минимально инвазивные процедуры с крошечными разрезами (надрезами) или использовать инструменты трубчатого типа, которые они вводят в уретру. Они облегчают симптомы аденомы простаты лучше, чем лекарства. Другие преимущества включают более быстрое восстановление и меньшую боль, чем при традиционной открытой хирургии, и меньший риск. Эти процедуры не включают удаление или разрезание простаты. Ваш врач рассмотрит размер вашей простаты и общее состояние вашего здоровья, чтобы определить, подходит ли вам минимально инвазивная операция.
Несколько видов малоинвазивной хирургии:
- Терапия водяным паром Rezūm. Устройство вводится в уретру, трубку для мочи, и небольшая игла вводит водяной пар или пар для обработки избыточной ткани предстательной железы. Обычно это делается в кабинете вашего врача.
- Трансуретральная микроволновая терапия (ТУМТ). В этой неинвазивной процедуре используется микроволновая антенна, прикрепленная к гибкой трубке, которую врач вставляет в мочевой пузырь.Микроволны убивают лишнюю ткань простаты.
- Система УроЛифт. UroLift – это стационарное устройство, используемое для подъема и удержания увеличенной ткани простаты, чтобы оно больше не блокировало уретру. Процедура не влияет на половую функцию. Обычно это выполняется под местной или общей анестезией в кабинете врача, амбулаторном хирургическом центре или операционной. Пациенты обычно возвращаются домой в тот же день без катетера.
- Трансуретральная игольная абляция (TUNA). Эта процедура больше не рекомендуется для лечения аденомы простаты. Это офисная процедура, при которой ваш врач вводит нагретую иглу в простату через уретру, трубку, по которой моча и сперма проходят через половой член . Нагретая игла использует радиочастотные волны для нагрева и разрушения лишних клеток в предстательной железе.
Мини-инвазивные операции, выполняемые под общей анестезией, включают:
- Трансуретральная резекция простаты (ТУРП). Это наиболее распространенная операция по лечению аденомы простаты. Ваш врач удаляет части простаты, которые влияют на отток мочи. Порезов и внешних шрамов не видно, так как через уретру вводится зонд для удаления излишков ткани. При ТУРП у некоторых мужчин может наблюдаться так называемая «ретроградная эякуляция» (эякуляция спермы в мочевой пузырь, а не через уретру).
- Трансуретральный разрез простаты (TUIP). Эта операция не включает удаление ткани простаты.В простате делают несколько небольших разрезов, чтобы уменьшить давление железы на уретру и облегчить мочеиспускание. Эта процедура подходит для некоторых мужчин, например, для людей с меньшей простатой. При ТУИП риск ретроградной эякуляции намного меньше, чем при ТУРП. Тем не менее, он обычно дает облегчение симптомов, равное ТУРП. Один из возможных недостатков: некоторым мужчинам нужен повторный TUIP. Врачи решают, что использовать, в основном, исходя из размера простаты.
- Лазерная хирургия. Врач использует энергию лазера, чтобы убить ткань простаты и уменьшить ее.Это может быть не так эффективно при больших размерах простаты. Лазерные процедуры обычно облегчают симптомы и улучшают отток мочи, как при ТУРП. Однако некоторые виды лазерной терапии вызывают меньше побочных эффектов, чем другие, а также снижают риск кровотечения. Необходимы долгосрочные исследования, чтобы выяснить, столь же эффективны лазерные процедуры, как ТУРП.
Инвазивная хирургия
Может потребоваться более инвазивная хирургия. Вы и ваш врач решите, что для вас лучше. Врачи часто считают инвазивную хирургию лучшим долгосрочным решением для облегчения надоедливых мочевых симптомов.Большинство из них связано с удалением увеличенной части простаты. Хирургическое вмешательство обычно рекомендуется при лечении симптомов ДГПЖ от средней до тяжелой в следующих условиях:
- Вы вообще не можете мочиться.
- Изменение образа жизни, лекарства или малоинвазивные методы лечения вам не помогли.
- Вы обнаружили кровь в моче, которая не становится лучше.
- Вы получаете камни в мочевом пузыре.
- Вы часто получаете инфекции мочевыводящих путей.
- У вас повреждение почек.
Типы хирургии
Виды операций, о которых вы могли бы обсудить со своим врачом, могут включать:
- Открытая простатэктомия (открытая операция). Врач часто делает это, когда простата сильно увеличена, когда есть осложнения или когда мочевой пузырь поврежден и требует ремонта. При открытой операции хирург делает разрез и удаляет увеличенную ткань простаты.
- Лапароскопическая и роботизированная простатэктомия. Лапароскопическая операция или роботизированная хирургия отличается от традиционной открытой хирургии тем, что для операции по удалению увеличенной ткани простаты делают четыре небольших разреза вместо одного большого.
Другие вещи, на которые следует обратить внимание
Перед тем, как пройти одну из этих процедур, поговорите со своим врачом о том, дадут ли вам что-нибудь для обезболивания области («местная анестезия») или вам дадут что-нибудь, чтобы вы выиграли не бодрствовать («общая анестезия») во время процедуры. Что вы получите и где это у вас, зависит от процедуры.
Ваш врач даст вам инструкции, как подготовиться к любому из них.
Операция может облегчить многие симптомы аденомы простаты, но не всех.Если есть определенные осложнения, такие как слабый мочевой пузырь, проблемы с мочеиспусканием могут сохраняться после операции, хотя это бывает редко.

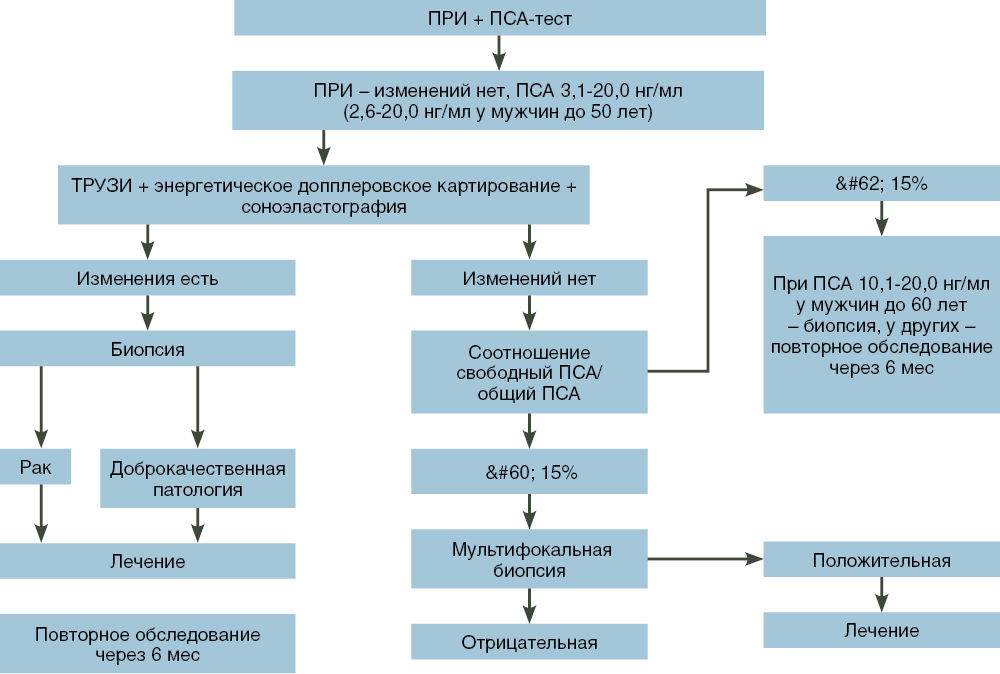 Это поможет вам вспомнить то, что вы хотите спросить.
Это поможет вам вспомнить то, что вы хотите спросить. Спросите о таких в аптеке.
Спросите о таких в аптеке.
 В. Злокачественные новообразования в России в 2009 году. М. 2011. С. 50-74.
В. Злокачественные новообразования в России в 2009 году. М. 2011. С. 50-74. 2011.№ 2. С. 52-55.
2011.№ 2. С. 52-55.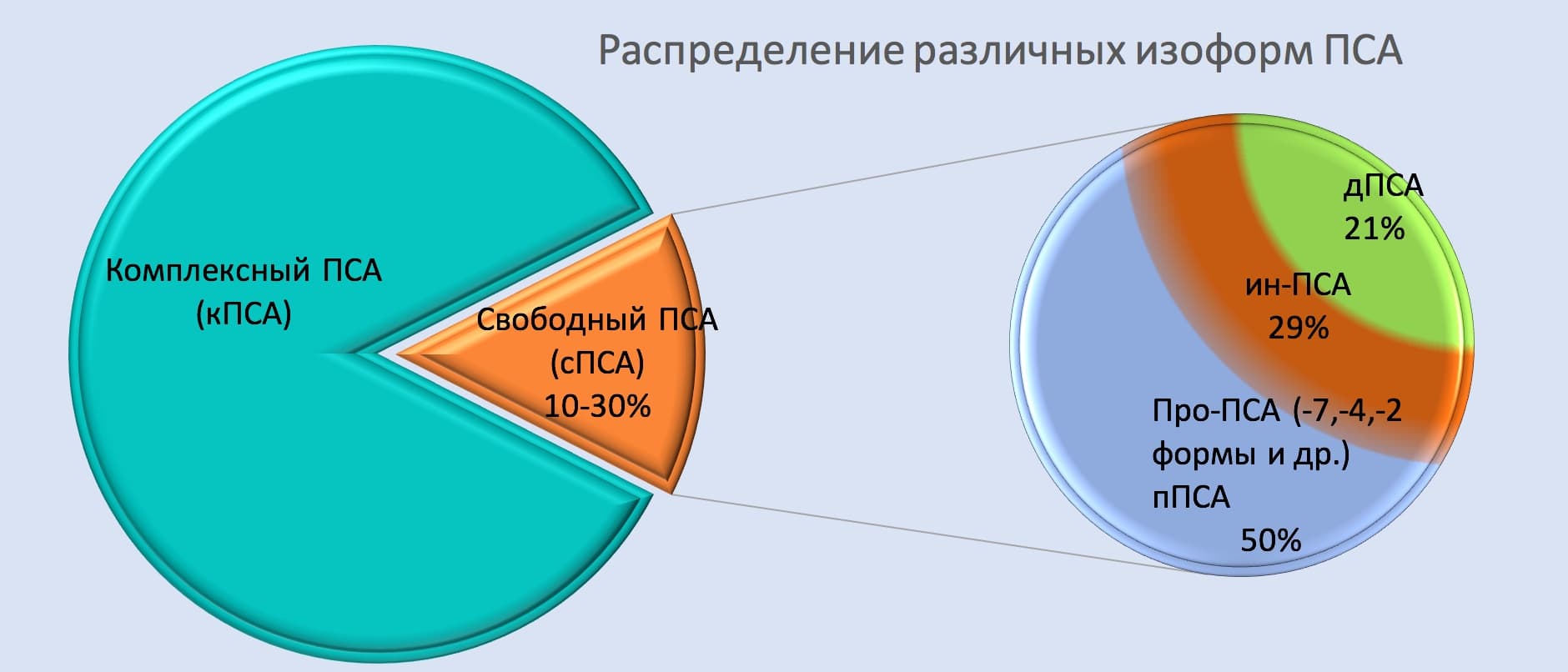 На УЗИ простата увеличена и могут образовываться кисты, похожие на швейцарский сыр.
На УЗИ простата увеличена и могут образовываться кисты, похожие на швейцарский сыр.



 Этот метод очень похож на подход для внутриартериальной химиотерапии и доступен в онкологической больнице Fitzpatrick Referrals и Soft Tissue в Гилфорде, графство Суррей, где мы являемся первым центром в Европе, предлагающим это новое лечение рака простаты.
Этот метод очень похож на подход для внутриартериальной химиотерапии и доступен в онкологической больнице Fitzpatrick Referrals и Soft Tissue в Гилфорде, графство Суррей, где мы являемся первым центром в Европе, предлагающим это новое лечение рака простаты.